胆碱转运蛋白Slc44a2通过调节线粒体功能来控制血小板活化和血栓形成
摘要
遗传因素有助于形成血栓性疾病。最近的全基因组关联研究已经确定了包括SLC44A2在内的可能调控血栓形成的基因位点。在这里,我们显示Slc44a2通过调节线粒体能量来控制血小板活化和血栓形成。我们发现,与野生型(Slc44a2(WT))对照相比,Slc44a2无效小鼠(Slc44a2(KO))的出血时间增加且血栓形成延迟。血小板从Slc44a2(KO)小鼠对凝血酶的激活受损。我们发现Slc44a2介导胆碱运输到线粒体,在那里胆碱代谢导致线粒体耗氧量和ATP产生增加。缺少Slc44a2的血小板在静止时包含的ATP较少,被激活时释放的ATP较少,并且具有可以被外源ADP挽救的激活缺陷。综上所述,我们的数据表明线粒体需要胆碱才能发挥最大功能,证明线粒体代谢对血小板活化的重要性,并揭示Slc44a2影响血栓形成的机制。
介绍
静脉血栓栓塞症(VTE)是一种以静脉血栓形成(深静脉血栓形成(DVT))或肺部血栓形成(肺栓塞)为特征的疾病1。VTE有很强的遗传基础,如果有兄弟姐妹受到感染,患病的风险会增加2.5倍2。但是,大多数血栓形成的遗传危险因素尚不完全清楚。所述INVENT财团用于GWAS来识别与VTE在超过60,000人受试者的群组关联的遗传变异体,其中包括位于所述基因内的遗传变异体SLC44A2,将其用一〜20%相关联的复制和发现队列增加血栓形成的风险3,4。
蛋白SLC44A2的生物和生理作用没有被很好地理解5,6。SLC44A2的功能是未知的,但它股与胆碱转运如SLC5A7同源7,8。GWAS研究相关的SLC44A2听力丧失,美尼尔氏病,和静脉血栓形成:与人类表型,包括座位3,9。最近的研究探讨了SLC44A2血栓形成的作用,10,11,12,13。两项研究发现,SLC44A2促进血栓形成的激光损伤或静脉狭窄的小鼠模型,但没有确定潜在的这一现象的机制11,13。对Slc44a2影响血栓形成的机制的研究发现,Slc44a2不影响小鼠的VWF水平13。另一项研究探讨了Slc44a2对血浆蛋白的影响,并且发现野生型和Slc44a2缺失小鼠之间血浆蛋白没有差异,得出的结论是Slc44a2必须通过基于细胞的机制影响血栓形成12。
我们现在显示Slc44a2是调节ATP的线粒体合成,血小板活化和血栓形成的线粒体胆碱转运蛋白。
结果
Slc44a2促进止血和血栓形成
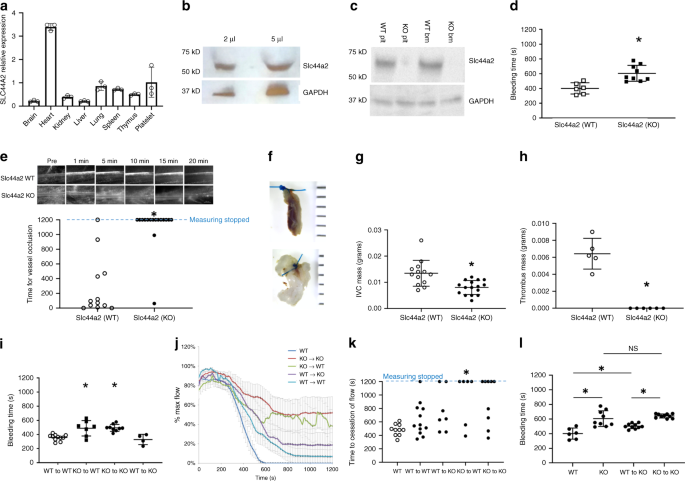
我们首先使用qPCR和免疫印迹法在鼠和人组织中确定了Slc44a2的表达。Slc44a2 RNA在所有检查过的组织中均有表达(图 1a)。在人和鼠血小板中检测到Slc44a2蛋白(图 1b,c)。由于未知原因,Slc44a2在心脏中的相对表达高于大多数其他组织。缺乏Slc44a2的小鼠称为Slc44a2(KO)小鼠,是全球性的Slc44a2无效小鼠,在包括血小板和骨髓在内的所有器官中均缺乏Slc44a2表达(图 1c)8。
通过qPCR测量鼠器官中相对于β-肌动蛋白的Slc44a2 的 RNA水平(n = 3±生物学独立的样本±SD)。b通过免疫印迹法测定正常人血小板中SLC44A2的蛋白水平。c通过免疫印迹测量小鼠血小板和小鼠骨髓中Slc44a2的蛋白水平。d在尾部横断后测量Slc44a2(WT)和Slc44a2(KO)小鼠的出血时间( 在两尾学生t检验中,n = 6 WT和8 KO小鼠的±SD和* P <0.01 )。e FeCl 3后肠系膜动脉血栓形成的时间通过活体显微镜测量治疗。*对于WT与KO,Fisher的精确检验统计量为0.0001,结果在P <0.05时显着。f IVC收缩后6 h下腔静脉的代表性图像,WT上方,KO下方。g在IVC收缩后6 h量化包含IVC节段和血栓的IVC质量( 在两尾学生t检验中,n = 13 WT和15 KO小鼠±SD,* P <0.01 )。h IVC收缩后6 h从IVC分离出的血栓块的定量( 在两尾学生t检验中,n = 5 WT和6 KO小鼠±SD和* P <0.01 )。i在Slc44a2(WT)和Slc44a2(KO)小鼠之间进行骨髓移植后重复出血时间(n = 10、7、9和4只小鼠,如图±SD所示, WT–WT vs. * P <0.01)。 KO–WT和* P <0.01(在Tukey范围测试中KO–KO与WT–KO的比较)。Slc44a2(KO)供体小鼠的骨髓延长了受体小鼠的出血时间。j超声测量FeCl 3处理后颈动脉最大血流百分比。k j的定量。对于WT–WT与KO–WT,Fisher的精确检验统计量为0.02,结果在P处显着 <0.05。对于WT–KO与KO–KO,Fisher的精确检验统计量为0.3,并且在P <0.05时结果不显着。样本大小包括:10、12、7、6和8,如图所示。l测量尾部横切(WT和KO)后Slc44a2(WT)和Slc44a2(KO)小鼠的出血时间。(n = 6、9、9和8只小鼠,如图±SD所示, WT vs. KO * P <0.01)。在尾部横切(WT至KO以及KO至KO)后,测量从Slc44a2(WT)或Slc44a2(KO)小鼠的血小板输注后Slc44a2(KO)小鼠的出血时间。(n = 10小鼠±SD和* P 在Tukey的距离测试中,WT到KO与KO到KO <0.01。源数据作为源数据文件提供。
SLC44A2已与人类血栓形成遗传相关,因此我们接下来描述了Slc44a2对小鼠止血和血栓形成的作用。我们测量了Slc44a2(WT)和Slc44a2(KO)小鼠尾部横断后止血的时间。Slc44a2(KO)小鼠的出血时间大大延长,比野生型小鼠最多延长50%,这表明止血方面存在缺陷(图 1d)。然后,我们使用活体显微镜检查了FeCl 3处理后肠系膜动脉中形成闭塞性血栓的时间。Slc44a2(KO)小鼠的肠系膜动脉血栓形成时间增加(图 1e))。接下来,我们探讨了Slc44a2在DVT鼠模型中的作用,并发现Slc44a2(KO)小鼠在下腔静脉(IVC)结扎后具有降低的DVT形成(图 1f–h)。
血小板中的Slc44a2增加止血
然后,我们探讨了Slc44a2在骨髓腔和血小板中的作用。Slc44a2的出血效果取决于骨髓来源细胞中的Slc44a2,因为从Slc44a2(KO)小鼠移植骨髓后,出血缺陷会转移至Slc44a2(WT)小鼠(图 1i)。我们用超声波测量了FeCl 3处理后在颈动脉中形成闭塞性血栓的时间。在Slc44a2(WT)小鼠的颈动脉血栓形成时间被延迟,该小鼠的骨髓腔室缺少Slc44a2(图 1j,k)。两者合计,我们的数据表明造血细胞中的Slc44a2促进血栓形成的发展并有助于正常止血。
骨髓移植实验表明但没有证明Slc44a2通过来自骨髓的细胞对血栓形成发挥作用。为了确定这种Slc44a2效应是否特定于血小板,我们将来自WT和KO供体的洗涤过的血小板输注到KO受体中。当从Slc44a2(WT)小鼠而不是从Slc44a2(KO)小鼠接受血小板时,Slc44a2(KO)小鼠的出血时间更短(图 1l)。(WT血小板可以改善Slc44a2(KO)小鼠的出血时间,但不能完全将出血时间恢复为正常的野生型出血时间,这可能是因为在输注的Slc44a2(KO)中仍然存在残留的KO血小板 这表明Slc44a2至少部分的血栓形成作用是由于其在血小板中的作用。
Slc44a2增加血小板活化
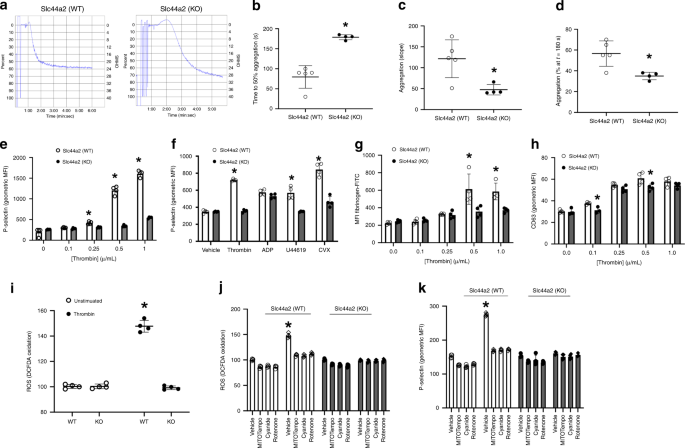
我们假设Slc44a2直接调节血小板活化,因为出血表型取决于骨髓衍生细胞中Slc44a2的存在。我们发现Slc44a2在人和鼠血小板中表达(图 1b,c)。我们从Slc44a2(WT)和Slc44a2(KO)小鼠中收获血小板,将它们暴露于媒介物或凝血酶,然后使用光透射聚集法测量血小板聚集物的形成。凝血酶处理后,Slc44a2(KO)血小板聚集少于Slc44a2(WT)血小板(图 2a–d)。尤其是,延长了达到50%最大聚集的时间,聚集速率较慢,并且在3分钟内聚集百分比较低。Slc44a2(KO)血小板(图 2b–d)。
a – d凝血酶0.5 µ / mL处理后的血小板聚集通过光透射聚集法测定。 在两尾学生t检验中,n = 4个生物学独立的样本±SD * P <0.05 。e通过流式细胞仪测量凝血酶刺激后P-选择素的血小板外在化。 在两尾学生t检验中,n = 3个生物学独立的样本±SD * P <0.05 。f用各种激动剂(0.5 µ / mL凝血酶,5 µM ADP或U46619或0.5 ng / mL惊厥毒素)治疗后P-选择蛋白的血小板外化作用。ñ 在两尾学生t检验中, = 3个生物学独立的样本±SD * P <0.05 。g通过FITC-纤维蛋白原结合的流式细胞术测量0.5μ/ mL凝血酶处理后GPIIbIIIA的血小板活化。 在两尾学生t检验中,n = 3个生物学独立的样本±SD * P <0.05 。h通过流式细胞仪测量0.5 µ / mL凝血酶处理后CD63的血小板外在化。 在两尾学生t检验中,n = 4个生物学独立的样本±SD * P <0.05 。一世用DCF-DA通过流式细胞术测量了在用0.5 µ / mL凝血酶刺激期间血小板ROS的产生。j用线粒体抑制剂处理后,再用0.5 µ / mL凝血酶处理,测量血小板ROS的产生。 在两尾学生t检验中,n = 3个生物学独立的样本±SD * P <0.05 。k线粒体抑制剂处理后再进行0.5 µ / mL凝血酶处理后,测定P选择素的血小板外在化。 在两尾学生t检验中,n = 3个生物学独立的样本±SD * P <0.05 。对于j和k,所有化合物均以0.5 µ / mL的凝血酶在5 µM下测试。源数据作为源数据文件提供。
我们比较了Slc44a2(WT)和Slc44a2(KO)血小板对各种激动剂的反应,例如凝血酶通过G蛋白偶联受体发出信号,以及惊厥蛋白与糖蛋白VI相互作用并通过基于(hem)免疫受体酪氨酸的激活基序发出信号依赖性通路14,15。凝血酶刺激后,Slc44a2(KO)血小板暴露的P-选择素较少(图 2e)。当用各种激动剂治疗时,Slc44a2(KO)血小板暴露的P-选择素少于Slc44a2(WT)血小板(图 2f)。Slc44a2(KO)血小板也比GPIIbIIIA具有更少的激活用凝血酶治疗时,Slc44a2(WT)血小板(图 2g)。然而,通过CD63易位测量,Slc44a2(KO)和Slc44a2(WT)血小板具有相似水平的致密颗粒释放(图 2h)。这些数据表明Slc44a2调节血小板α-颗粒释放和血小板GPIIbIIIa活化。
接下来,我们探讨了Slc44a2调节血小板活化的机制。我们假设Slc44a2调节线粒体活性和ATP合成。我们的假设是基于其他人的观察结果,显示出SLC44A2是胆碱转运蛋白,和线粒体可以使用胆碱生成甜菜碱,在这个过程中产生活性氧和ATP 16,17,18。为了探讨Slc44a2对ROS血小板生成的影响,我们比较了凝血酶刺激后从Slc44a2(WT)和Slc44a2(KO)血小板产生ROS的情况。凝血酶激活后,Slc44a2(KO)血小板比Slc44a2(WT)血小板产生更少的ROS (图。 2i)。我们发现线粒体是凝血酶刺激后氧化爆发的源头,因为线粒体酶的抑制剂废除了凝血酶刺激的ROS(图 2j)。接下来,我们确认血小板衍生的线粒体ROS介导血小板活化。产生ROS的线粒体复合物抑制剂可降低血小板活化(图 2k)。这些研究表明线粒体是伴随血小板活化的ROS的来源。两者合计,我们的数据表明Slc44a2控制血小板激活过程中线粒体ROS的产生。
Slc44a2调节线粒体功能
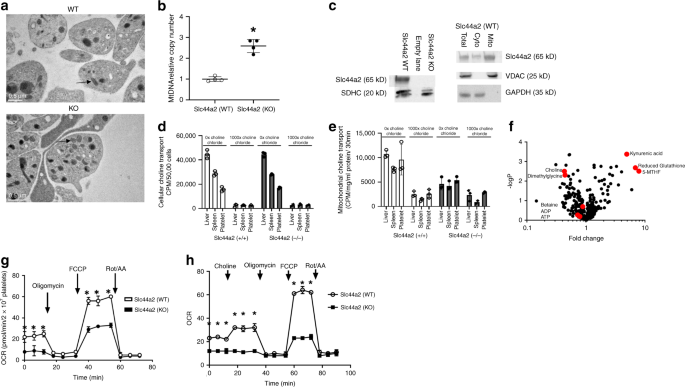
由于我们的数据表明Slc44a2(KO)血小板的线粒体ROS产生异常,因此我们接下来检查了Slc44a2(KO)小鼠的线粒体数量和功能。我们观察到,通过测量mtDNA ,来自Slc44a2(KO)小鼠的血小板含有更多的线粒体(图 3a,b)。但是,来自Slc44a2(WT)和Slc44a2(KO)的血小板具有相似数量的α颗粒和致密颗粒(补充图 1)。我们使用了部分免疫印迹方法来显示Slc44a2在线粒体中表达(图 3c)。)。由于Slc44a2与胆碱转运蛋白具有功能同源性,因此我们将胆碱转运到整个血小板和从血小板分离的线粒体中进行了表征。我们将血小板或纯化的线粒体与放射性标记的胆碱一起孵育,或在未标记的胆碱存在下与放射性标记的胆碱一起孵育,洗涤细胞或线粒体,并测量残留放射性。Slc44a2介导胆碱转运进入线粒体,但不转运入整个血小板(图 3d,e)。我们对来自Slc44a2(KO)和Slc44a2(WT)小鼠的血小板进行了质谱分析,以测量胆碱代谢产物(图 3f)。缺少Slc44a2的小鼠胆碱含量下降,并且其代谢物之一二甲基甘氨酸降低(图 3f)。)。这表明Slc44a2将胆碱转运到线粒体中,并且胆碱在线粒体内活跃地代谢。
Slc44a2(WT)和Slc44a2(KO)小鼠的血小板的代表性透射电镜图像。箭头表示单个线粒体。b通过qPCR测定的血小板线粒体DNA拷贝数。n =4。* 在两尾学生t检验中P <0.05 (c)Slc44a2存在于从血小板纯化的线粒体的裂解物中(左免疫印迹),并且Slc44a2富集于血小板的线粒体部分,但不富集于细胞的线粒体部分。血小板(右免疫印迹)。dSlc44a2不能调节胆碱向全细胞的转运,这是通过放射性标记胆碱与未标记胆碱竞争的细胞摄取来衡量的。(n = 3个生物学上独立的样品,±SD,* WT与KO的* P <0.05)。È SLC44A2调节胆碱转运到线粒体中分离,如通过与非标记的胆碱竞争放射标记的胆碱的摄取线粒体测量。(n = 3个生物学上独立的样品,±SD,* WT与KO的* P <0.05)。f通过质谱法测量的相对于Slc44a2(WT)小鼠的Slc44a2(KO)小鼠血小板中的代谢产物谱。(n = 2–3)。G来自Slc44a2(KO)和Slc44a2(WT)小鼠的血小板的线粒体耗氧率(OCR):Slc44a2(KO)血小板的基础和未偶联的OCR降低(n = 4个生物学独立的样品±SD; * P <0.05 WT vs. KO在两尾学生t检验中)。h胆碱治疗期间的线粒体OCR(n = 4个生物学上独立的样品±SD; * 在两尾学生t检验中P<0.05 WT vs. KO )。对于压力测试,抗霉素A = 1.0 µM,FCCP = 1.0 µM,鱼藤酮= 0.5 µM。所有实验均以20 µM加入胆碱。(对于所有面板,* P 在两尾学生t检验中,<0.05 WT vs. KO )。源数据作为源数据文件提供。
接下来,我们测量了Slc44a2对线粒体功能的影响。线粒体的主要功能是氧化磷酸化和ATP产生,这些过程消耗氧气。通过Seahorse分析仪测量,Slc44a2(KO)小鼠的血小板的耗氧率基线低于Slc44a2(WT)小鼠的血小板(图 3g,寡聚霉素前)。在Slc44a2(KO)和Slc44a2(WT)血小板之间,用ATP合酶抑制剂寡霉素处理后的耗氧率相似,这表明它们具有相似的非线粒体耗氧率(图3g,经过寡聚 霉素处理后)。ATP的最大产生速率在与膜解偶联剂FCCP(羰基氰化物-4-(三氟甲氧基)苯基hydr)处理后的Slc44a2(WT)血小板相比,Slc44a2(KO)血小板有所不同( FCCP 后的图 3g)。当加入鱼藤酮和抗霉素 A抑制电子传输时,Slc44a2(WT)和Slc44a2(KO)血小板的耗氧率均降至较低水平( Rot / AA后的图 3g)。因此,缺乏Slc44a2的静息血小板消耗较少的氧气,并且在FCCP处理后显示最大的氧气消耗减少(图 3g)。最后,我们观察到添加胆碱会使Slc44a2(WT)的耗氧量适度增加血小板,但不是在Slc44a2(KO)血小板中(图 3h)。这些数据表明胆碱在线粒体呼吸中起主要作用。
Slc44a2增加线粒体ATP的产生
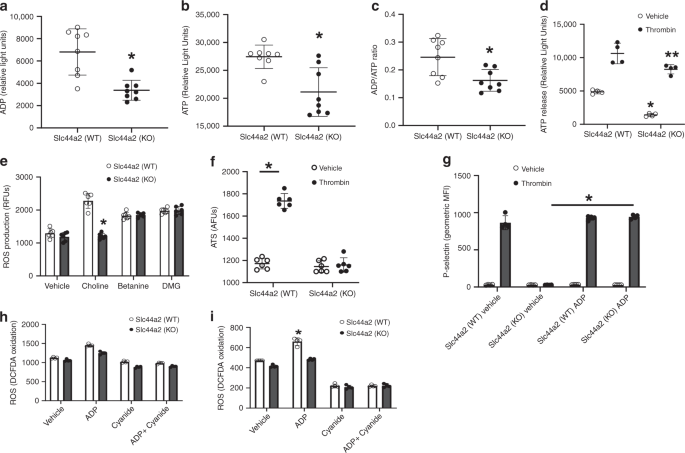
血小板通过多种细胞外激动剂如凝血酶19刺激后分泌ADP 。在释放之后,ADP然后通过血小板P2Y12受体20以自分泌和旁分泌的方式放大血小板活化。由于我们观察到了Slc44a2(KO)血小板中线粒体功能的降低,因此我们接下来比较了分离的血小板中ATP和ADP的水平。与来自Slc44a2(WT)小鼠的血小板相比,来自Slc44a2(KO)小鼠的血小板含有更少的ADP和更少的ATP (图 4a,b)。Slc44a2(KO)血小板中ADP / ATP的比例小于Slc44a2(WT)血小板中的ADP / ATP的比例(图 4c)。我们发现血小板来自Slc44a2(KO)与Slc44a2(WT)血小板相比,小鼠在凝血酶刺激后释放的ATP更少(图 4d)。我们测试了胆碱影响线粒体ROS和ATP产生的能力:Slc44a2(WT)血小板的线粒体对胆碱的反应产生额外的ROS和ATP,但是Slc44a2(KO)血小板的线粒体不能对胆碱的反应产生额外的ROS或额外的ATP胆碱(图 4e,f)。
与来自Slc44a2(WT)小鼠的血小板相比,来自Slc44a2(KO)小鼠的血小板包含的ADP更少。 在两尾学生t检验中,n = 7个生物学上独立的样本±SD * P <0.05 。b来自Slc44a2(KO)小鼠的血小板比来自Slc44a2(WT)小鼠的血小板含有更少的ATP 。 在两尾学生t检验中,n = 7个生物学上独立的样本±SD * P <0.05 。c与来自Slc44a2(WT)小鼠的血小板相比,来自Slc44a2(KO)小鼠的血小板具有改变的ADP / ATP比。 在两尾学生t检验中,n = 7个生物学独立的样本±SD * P<0.05 。d Slc44a2(KO)小鼠的血小板响应0.5 µ / mL凝血酶释放的ATP较少。 在两尾学生t检验中,n = 4个生物学独立的样本±SD * P <0.05 。e胆碱以依赖于纯化线粒体中Slc44a2的方式增加ROS的产生。 在两尾学生t检验中,n = 3个生物学独立的样本±SD * P <0.05 。F胆碱依赖于分离的线粒体中Slc44a2的方式增加ATP的产生。加入20 µM胆碱。 在两尾学生t检验中,n = 6个生物学独立的样本±SD * P <0.05 。g外源性ADP可以挽救Slc44a2(KO)血小板中的血小板活化缺陷。用0.5 µ / mL凝血酶和5 µM 2-MeSADP处理血小板。 在两尾学生t检验中,n = 3个生物学独立的样本±SD * P <0.05 。h ADP可增加血小板ROS的产生。i ADP可增加线粒体ROS的产生。ñ 在两尾学生t检验中, = 3个生物学独立的样本±SD * P <0.05 。源数据作为源数据文件提供。
ATP产生和释放的减少可以解释Slc44a2(KO)血小板活化为何降低,因为从血小板释放的ATP和ADP可以促进血小板活化。如果是这样,那么添加外源ADP应该可以挽救缺乏Slc44a2的血小板的活化缺陷。为了检验这一假设,我们向血小板中添加了外源性不可水解的ADP。如前所述,凝血酶未能激活Slc44a2(KO)小鼠的血小板,但是2-me-ADP 响应凝血酶而恢复了Slc44a2(KO)血小板的激活(图 4g)。我们还测试了不可水解的ATP类似物,并且该激动剂如预期的那样会稍微增加血小板活化,并且WT和KO血小板之间没有差异(补充图 2)。)。综上所述,我们的数据表明Slc44a2控制细胞内ATP和ADP的水平,而异常低的ADP和ATP血小板水平则导致Slc44a2(KO)小鼠的血小板活化受损。
讨论区
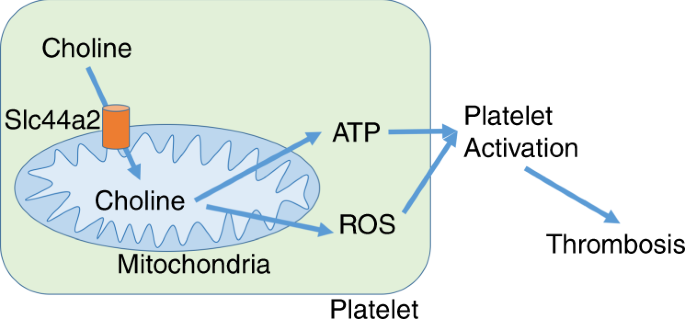
我们研究的主要发现是胆碱是线粒体的底物,Slc44a2调节胆碱向线粒体的转运,胆碱在最大血小板活化所必需的ATP产生中起关键作用(图 5)。
我们在Slc44a2(KO)中发现线粒体血小板功能不全:与野生型对照组相比,它们的静止时的耗氧率低,而未偶合时的最大呼吸率也低。线粒体功能障碍导致血小板中ATP含量降低,血小板中ATP释放降低以及细胞外ADP降低。ADP降低反过来会导致较少的旁分泌和自分泌血小板活化。血小板活化中这一缺陷的一种可能解释是Slc44a2介导胆碱转运到线粒体中,在那里它被代谢为氧化代谢的底物,从而产生ATP。16,17,21。SLC44A2也可以通过控制线粒体ROS产生,这是用于介导的血小板活化重要的调节血小板活化 18,22,23,24,25,26,27,28,29,30。
人类受试者的GWAS已经表明,在遗传变异体SLC44A2基因座链接到异常VTE的风险3,4。我们的数据通过证明Slc44a2调节小鼠的血小板活化和血栓形成来支持这些发现(图 1和2)。人类GWAS数据还显示,在该遗传变异体SLC44A2基因座不与已知的生物标记物止血相关的3,4。
我们对Slc44a2的研究得到先前工作的支持。其他人也表明,SLC44A2增加血栓形成的各种小鼠模型11,13。为寻找Slc44a2影响血栓形成的机制途径,一项研究排除了Slc44a2对血浆蛋白(包括凝血因子)的影响,并提出Slc44a2通过细胞途径影响血栓形成12。我们证实了这一预测并扩展了先前的工作,现在证明Slc44a2通过调节血小板代谢促进血栓形成。
我们的研究有一些局限性。我们显示Slc44a2直接影响血小板功能,因为从Slc44a2(KO)小鼠分离的血小板具有激活缺陷(图 2),并且由于血小板输注部分恢复了Slc44a2(KO)小鼠的出血时间(图 1)。但是,其他缺少Slc44a2的细胞也可能导致Slc44a2(KO)小鼠的止血和血栓异常。例如,敲除与野生型小鼠(补充表小鼠具有较低的淋巴细胞计数 1)和淋巴细胞能调节血栓形成体内31,32,33。淋巴细胞数量的变化可以改变DVT形成的动力学和组成,形成“红色血栓”,血栓中有相当一部分的红细胞。作为另一示例,即使SLC44A2(KO)的小鼠具有类似于WT小鼠(补充表中性粒细胞计数 1),其他人已经表明嗜中性粒细胞能够影响血栓形成34,35,36,37,38。中性粒细胞数量的变化会改变动脉血栓,表现为富含血小板的“白色血栓”。在白细胞中表达的Slc44a2可能部分影响静脉和动脉床中的血栓形成。我们的数据显示Slc44a2(KO)小鼠止血和血栓形成减少,并且我们显示Slc44a2(KO)血小板的活化降低,并且从Slc44a2(KO)小鼠输注血小板未能改善出血时间。这些数据表明血小板中的Slc44a2是Slc44a2(KO)小鼠止血缺陷的主要原因。
总之,我们的数据表明Slc44a2是一种血栓形成调节剂,它不在经过充分研究的血栓形成途径之内,并且Slc44a2可能是重要的治疗靶点。
方法
老鼠
Slc44a2(KO)小鼠获自Thomas Carey博士(密歇根大学),并在罗切斯特大学8建立了一个殖民地。这些小鼠是缺少Slc44a2 8外显子的全局Slc44a2空小鼠8。按照罗彻斯特大学建立的方案对所有小鼠进行治疗,该方案已得到大学动物研究委员会(UCAR)的批准。这些经过批准的方案以及对小鼠的所有研究均符合罗彻斯特大学动物试验和研究的所有道德规范。这项研究获得了罗切斯特大学(University of Rochester)的UCAR的道德认可。所有实验均使用8-12周龄的雄性小鼠,但肠系膜血栓形成除外,因为选择6周龄的小鼠以促进肠系膜动脉或小静脉的可视化。尽一切努力使用于繁殖或实验的小鼠的疼痛和不适最小化。
抗体和试剂
抗Slc44a2的一抗购自Aviva Systems Biology(ARP44009_P050),稀释比例为1:500。从Abcam(ab 8245)购买了抗GAPDH的一抗,并以1:2000的稀释度使用。针对兔一抗的HRP偶联二抗购自GE(NA931),稀释比例为1:5000。用于流式细胞术的抗CD62-PE和抗CD63-PE抗体购自BioLegend(目录号304905和#143903)。FITC-纤维蛋白原购自赛默飞世尔(Thermo Fisher)(目录号RB-1924-R2)。DCF-DA购自Invitrogen。所有ROS酶抑制剂均直接从Sigma-Aldrich购买。
蛋白质印迹
如先前所述进行蛋白质印迹39。简而言之,用Laemmli样品缓冲液(Bio-Rad)裂解内皮细胞或血小板,在95°C下煮沸5分钟,在4–20%的Mini-PROTEAN TGX预制凝胶(Bio-Rad)上分离,并使用湿电泳转移单元(Bio-Rad)移至硝酸纤维素膜上。在室温下用5%脱脂牛奶在含有0.05%Tween 20的PBS中封闭1小时后,将膜与一抗杂交,然后与HRP偶联的二抗杂交,并使用Bio-Rad Chemidoc Imager和ImageLab软件增强化学发光检测( Bio-Rad)(请参见补充图 3)。
实时定量PCR
处死后立即收获小鼠组织,并在干冰上速冻。按照制造商的规程(Qiagen),使用RNEasy试剂盒分离总RNA。通过分光光度法(NanoDrop; Thermo Scientific)测量的所有样品的A260 / A280比率在1.9至2.1之间。使用iScript™cDNA合成试剂盒(Bio-Rad)合成cDNA。通过PrimePCR Sybr Green基因表达分析(Bio-Rad)在CFX Connect热循环仪(Bio-Rad)上进行40个循环的实时定量PCR。qPCR引物形成试剂盒(Bio-Rad qMmuCID0026393和qMmuCED0027497)。每个样品一式三份进行定量,并从至少n = 3只小鼠中收获组织。通过ΔΔCT方法计算表达结果,并相对于参考基因Gapdh标准化。
血小板分离和激活
由麻醉的动物到肝素化的鼠蒂罗德缓冲液(134毫摩尔氯化钠,2.9mM的氯化钾的眶后出血得到鼠血,12mM的碳酸氢钠3,0.34毫摩尔的Na 2 HPO 4,20mM的HEPES,pH值7.0,5mM葡萄糖,和在Eppendorf管中加入0.35%的牛血清白蛋白)。然后将血液离心以产生富含血小板的血浆,然后将其在含有Tyrode缓冲液和1%PGE 2的新试管中洗涤,以防止血小板活化。然后将血小板沉淀5分钟600× g在室温下离心,弃去上清液。将沉淀的血小板轻轻重悬于Tyrode's缓冲液中,并在室温下放置2小时以进行进一步实验。为了活化血小板,将稀释的血小板悬浮液分成100μL等分试样,在适当的情况下用指定的药物(10 µM MitoTEMPO,1 mM NAC,100 µM氰化钠或10 µM鱼藤酮)处理,然后用PBS或指定浓度的凝血酶刺激持续15分钟,然后用1μLCD62P-PE / CD63-PE(BioLegend)或1μL纤维蛋白原-俄勒冈绿(Thermo Fisher)染色30分钟,然后立即用100μL2%福尔马林固定。对于DCFDA实验,在37°C的血小板中加载10 µM DCFDA 1 h,然后按上述方法进行处理/刺激。荧光强度在Accuri C6流式细胞仪(BD Biosciences)上测量。用FlowJo软件(Tree Star Inc.)分析数据。使用ATP生物发光分析试剂盒(Sigma-Aldrich)在刺激后上清液中测量ATP释放。根据制造商的说明(Abcam),使用ADP / ATP比率试剂盒测定整个血小板的ADP / ATP含量。如所述使用流式细胞术进行凝集测定40。使用商业试剂盒(Abcam)通过qPCR测量50,000血小板中的线粒体DNA拷贝数,并标准化为WT拷贝数。
小鼠尾巴出血分析
如41所述测量小鼠尾巴出血时间。用氯胺酮和甲苯噻嗪(80/12 mg / kg)进行IP麻醉后,将小鼠尾巴的远端3 mm截肢并立即浸入37°C的盐水中,目视止血的时间为30 s或连续记录最大持续时间为20分钟的出血时间,以先到者为准。
小鼠肠系膜血栓形成模型和颈动脉血栓形成模型
血栓形成如先前所述测定42,43。对于肠系膜血栓形成模型,麻醉小鼠,并用针对GPIb beta的DyLight488抗体标记血小板。将包含肠系膜小动脉(直径为120–150 µm)的目标区域外部化以进行成像。在静止状态下记录小动脉血流3分钟。然后将1 mm 2的Whatman纸用7.5%FeCl 3饱和将溶液施加到小动脉上3分钟,并连续记录小动脉流量总计20分钟。记录形成小血栓(直径为50像素)和完全闭塞血管的时间。如果未观察到阻塞,则在20分钟结束时终止记录。对于颈动脉血栓形成模型,将小鼠用2.5%异氟烷镇静,并用2%异氟烷麻醉。使用MA1PRB血管周围血流探头和TS420流量计(Transonic Systems),暴露颈总动脉以进行基线血流记录。然后,将浸有1.5 µL 7.5%FeCl 3溶液的1×2 mm Whatman纸在流动探针上游的颈动脉腹侧表面上涂3分钟,然后在FeCl 3上恢复流量测量总共20分钟。洗去。我们将闭塞定义为3分钟内没有血流(0 mL / min)
小鼠深静脉血栓形成模型
对于DVT模型,将小鼠麻醉,进行中线切口。在肾静脉和the静脉分叉之间的IVC周围固定绑扎带,并在绑扎带和IVC之间放置一个28号钝针。缝合线被打结,暂时导致IVC完全闭塞,并从缝合线下方拔出针头,恢复腔内部分血流,并伴有严重的IVC狭窄。伤口用缝线缝合。结扎后六小时,麻醉小鼠并分离IVC,包括已形成的任何血栓。记录总质量,分离出的IVC在4%PFA中沉积24–48 h,然后切除血栓并记录血栓质量。
骨髓移植
对Slc44a2(WT)和Slc44a2(KO)供体小鼠实施安乐死,并在无菌条件下分离股骨。收获骨髓,然后反复抽吸以产生单细胞悬液。手动进行细胞计数,10 7在接受致死性辐射的同一天,通过眼眶后静脉将细胞注射到每只接受小鼠中。将八周大的小鼠用作受体,并用X射线RS 2000(放射源)辐射器进行致命照射,该辐射器的分剂量为1100 rad,早晨为550 rad,下午为550 rad。移植当天。骨髓移植后,向小鼠提供补充有硫磺草胺的水2周,并在进行尾巴出血分析或采血之前使其复溶6周。
血小板输注
如上所述分离血小板。通过眼眶后注射44将洗过的血小板输注到受体小鼠体内。
线粒体分离和ATP产生
使用市售试剂盒(Thermo Fisher#89801)进行线粒体分离。简而言之,如上所述分离血小板,将其裂解,然后进行一系列的蔗糖梯度离心步骤,以产生线粒体的纯层,然后将其悬浮以用于进一步的实验。为了产生ATP,将线粒体悬浮在线粒体呼吸缓冲液KCl(120 mM),蔗糖(25 mM),HEPES(10 mM),EGTA(1 mM),KH 2 PO 4(1 mM),MgCl 2(5 mM)中,谷氨酸(15 mM)和苹果酸(7.5 mM)pH 7.3,辅以载体或胆碱,ATP的定量方法如上。
胆碱运输
胆碱摄取速率通过测量3H氯化胆碱(Perkin Elmer)随时间的吸收来确定。将血小板或线粒体加入1.5mL管中。摄取前一小时,除去培养基,用PBS洗涤细胞,然后在Tyrode缓冲液中孵育直至使用。在摄取之前,立即再次洗涤细胞,然后加入含1μCi/ mL 3H胆碱的Tyrode缓冲液,并在37°C孵育所需时间(1–30分钟)。孵育后,将细胞用Tyrode's缓冲液洗涤两次,并在150μL的0.1 M NaOH中溶解,然后使用等分试样通过液体闪烁计数确定放射性。根据制造商的说明,使用BCA蛋白测定法(Thermo Fisher Scientific)确定细胞总蛋白。
血小板线粒体功能测量
将96孔格式海马细胞外通量分析仪(海马Bioscience公司,MA,USA)被用来测量生物能量学45,46。在XF DMEM分析缓冲液(含1 mM丙酮酸,5.5 mM D-葡萄糖,4 mM 1-谷氨酰胺,pH 7.4的DMEM)中将血小板稀释至2×10 7的浓度,然后接种到Cell-Tak包被的XF96微孔板和线粒体上应力试验如所描述的进行45,46。对于某些Seahorse实验,在压力测试之前以10 µM的剂量注射胆碱。
质谱
我们使用基于LC-MS / MS的方法对147种分析物进行了分析,包括氨基酸,有机酸,胆汁酸,吲哚,核苷酸和糖。我们在以前使用这些平台来表征代谢有牵连的生化途径47,48。简而言之,使用含有稳定同位素标记的内标物的萃取溶剂对样品进行脱蛋白处理。将样品涡旋并离心,然后将等分试样转移至带有玻璃插入物的2 mL自动进样瓶中,以进行LC-MS分析。在正模式下,将使用2.1×150 mm 3μmAtlantis色谱柱(Waters)的正相亲水相互作用色谱(HILIC)与配备有用于目标检测的电喷雾电离源的4000 QTrap三重四极杆质谱仪(Applied Biosystems / Sciex)耦合。动态多反应监测(dMRM)机制分析78种代谢产物。在阴性模式下,使用2.1×100 mm的HILIC色谱3。将5μmXbridge Amide色谱柱(Waters)连接到配备有电喷雾电离源的Agilent 6490三重四极杆质谱仪,使用dMRM靶向检测69种代谢物。使用Sciex MultiQuant软件(正模式)或Agilent Masshunter定量软件(负模式)对代谢物峰面积进行积分。手动检查所有代谢物峰的峰质量,以盲法方式进行。(见附表) 2和 3用于代谢物和代谢组学数据。)
人血小板收集
如先前所述,使用由罗切斯特大学医学中心的机构审查委员会批准的方案(IRB方案RSRB00028659)49进行了人类血液采集。招募正常的健康献血者。如果受试者在抽血前10天内使用了阿司匹林或任何非甾体类抗炎药,则将其排除在外。通过静脉穿刺将血液收集到柠檬酸钠抗凝管中。全血以180× g离心 分离15分钟以分离出富血小板血浆的顶层,将其在室温下以Tyrode的缓冲液(134 mM NaCl,2.9 mM KCl,12 mM NaHCO3、0.34 mM Na2HPO4、20 mM HEPES,pH 7.0、5:1:20稀释)稀释mM葡萄糖和0.35%的牛血清白蛋白),并以100 µL的体积分配,用于各种药物的治疗。如先前所述进行蛋白质印迹49。
统计
通过二尾学生t检验对正态分布的数据进行分析以比较两组,并通过方差分析比较三组或更多组的均值。统计学显着性定义为P <0.05。为了比较两组的尾巴出血时间(图1e中Slc44a2(WT)和Slc44a2(KO)小鼠的 出血时间),使用了二分法测量20分钟内出血的停止时间(是或否),并在2×2列联表。由于某些单元格中的样本量较小,因此使用了Fisher精确概率测试来比较两组。为了比较两组的血栓形成时间(图2中的WT到KO小鼠和KO到KO小鼠的颈动脉血流停止时间)。 1k),使用二分法测量20分钟内的血栓形成(是或否),并在2×2列联表中进行比较。由于某些单元格中的样本量较小,因此使用了Fisher精确概率测试来比较两组。使用Tukey检验进行多次比较(例如,图1l中输血宿主之间出血时间的差异 )。
|
|