造血干细胞基因工程中的抗病毒免疫和核酸传感
摘要
人类造血干细胞和祖细胞(HSPC)的低基因操纵效率仍然是创新疗法对各种疾病的可持续和广泛临床应用的主要障碍。鉴于所有当前和新兴的基因转移和编辑技术都必须将HSPC暴露于外源核酸,最常见的是暴露于病毒载体,因此我们认为宿主抗病毒因子和核酸传感器在HSPC基因操作的功效中起着关键作用。在这里,我们回顾了我们在基因工程后对HSPC中的宿主与宿主相互作用和先天免疫的理解方面的最新进展,并讨论了如何剖析这种串扰如何在将来指导更多隐身和有效的基因治疗方法的发展。
介绍
造血干细胞(HSC)基因疗法可以通过离体基因工程在所有子代细胞中提供终生治疗益处,使其成为许多先天性疾病,传染病和癌症的细胞和基因疗法的有吸引力的靶标[ 1]。单个HSC的大后代要求使用稳定的基因传递系统来确保血液和免疫细胞的长期遗传变化。因此,迄今为止,整合重组病毒系统(如γ-逆转录病毒(ɣRV)和慢病毒(LV))的使用已主导了这一领域。基于可编程核酸酶的基因组编辑技术的最新进展,例如锌指核酸酶(ZFN)和规则间隔的短回文重复序列(CRISPR)相关的核酸酶Cas9,也为基因治疗打开了另一条途径[ 2 ]。在这种情况下,非整合腺相关载体(AAV)已成为HSC中同源直接修复(HDR)所需的供体DNA的广泛开发载体[ 3]。单链和双链寡聚脱氧核苷酸(ODN)也正在成为在包括HSC在内的几种临床相关环境中提供HDR供体模板的有效手段[ 4 ]。
当前的HSC基因治疗方案基于对骨髓(BM)或动员的外周血(mPB)衍生的CD34 +细胞的修饰,这些细胞富含HSC,但也包含大部分分化程度更高的祖细胞,统称为造血干和祖细胞(HSPC)。尽管最近针对患有原发性免疫缺陷(PID),血红蛋白病或先天性代谢错误的患者进行的基于LV的临床试验取得了明显的成功,但提高HSPC转导效率仍是该领域的首要目标,因为这些细胞对基因转移和转基因尤为难治。在患者中治疗结果显著变异性已被观察到[ 5,6,7]。实际上,仍需要高载体剂量,多轮转导和长时间的离体培养才能达到临床相关的基因标记和编辑水平。这增加了昂贵的大规模载体生产,并有可能损害HSPC在培养物中的保存,因为越来越多的证据表明,培养的HSPC通过细胞周期进程和粘附分子的丧失逐渐丧失了植入潜能,从而损害了其归巢并驱动谱系的定型和分化[ 8,9,10,11 ]。值得注意的是,在基因编辑方案的背景下,离体培养通常会更长,因为HDR仅在细胞活跃循环时才会发生[ 12 ]。
HSPC响应于先天免疫线索,例如TLR配体[ 13 ],外源核酸[ 14,15 ],和IFN诱导病毒[ 16]具有潜在的有害生物后果。由于所有当前和新兴的基因转移和编辑技术都必须将其暴露于外源核酸,最常见的是暴露于病毒载体,因此我们认为宿主抗病毒因子和核酸传感器在HSPC基因操作的功效中起着关键作用。一致地,许多实验证据表明,旨在调节先天性免疫激活的策略可能会提高基因工程效率。在这篇综述中,我们将重点介绍我们对HSPC中的宿主与宿主相互作用和先天免疫的理解的最新进展,并讨论如何剖析这种串扰如何在将来指导更多隐身和有效基因治疗方法的发展。
HSPC基因治疗中的核酸传感
作为抵抗病原体的宿主的第一道防线,先天免疫系统采用有限的称为模式识别受体(PRR)的种系编码受体来检测病原体并对其做出反应。PRR识别称为病原体相关分子模式(PAMP)的保守分子结构,这对于病原体的生命周期至关重要。在微生物中发现了许多PAMP,例如LPS,肽聚糖和鞭毛蛋白,但在宿主中却没有,这使宿主可以通过PRR区分非自身和自身。一个明显的例外是检测病原体衍生的核酸。由于宿主在进化军备竞赛中不断暴露于入侵的病原体中,因此许多先天感测机制可能会承受选择性压力,这通常被称为“红皇后冲突” [ 17]。]。结果,随着时间的流逝,哺乳动物细胞已经发展了许多潜在的冗余免疫传感途径。相反,病毒继续发展逃避这些宿主反应的新方法,导致宿主和病原体之间的遗传拉锯战趋于达到相互适应的动态平衡。
Toll样受体
在PRR中,Toll样受体(TLR)家族已得到最广泛的研究。TLR位于细胞膜和内体膜上,并监测内体和溶酶体的内腔。它们从细菌和病毒中检测出各种形式的核酸,并且大多数在巨噬细胞和树突状细胞上表达。在人类中鉴定出十种不同的TLR。TLR1、2、4、5、6和10在细胞表面表达,主要识别微生物所独有的,不是宿主产生的疏水分子。相反,TLR3、7、8和9几乎完全位于内体区室中,并且专门用于核酸识别。TLR9识别内体中未甲基化的富含CpG的DNA,从而检测通过内体或自噬途径进入的DNA [ 18]。TLR7 / 8是高度同源物,可识别单链RNA,而TLR3被dsRNA激活,并可以在体外与合成dsRNA poly(I:C)结合。人类CD34 +细胞表达TLR3,TLR4,TLR7,TLR8和TLR9 [ 13 ]。体外TLR7和TLR8的激活会引起髓样祖细胞的倾斜[ 19],而聚(I:C)对TLR3的刺激导致HSPC中强烈的IFN刺激基因(ISG)诱导和凋亡[ 20 ]。TLR在HSPC上的表达表明它们有能力直接检测感染并通过偏向分化立即产生免疫效应细胞作出反应。作为协议,LPS是TLR4的主要配体,可诱导HSPC增殖并从BM中动员[ 21 ]。
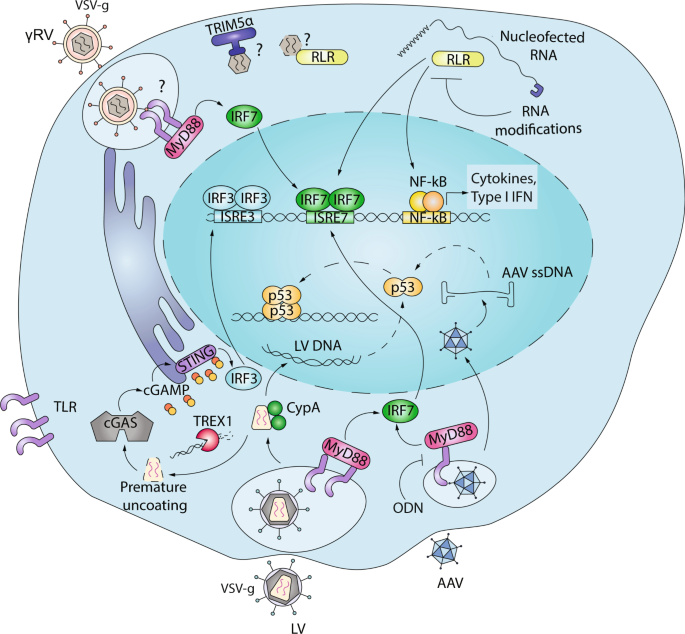
由于慢病毒和逆转录病毒载体在转导细胞的细胞质中将其RNA基因组逆转录为双链DNA,因此先天核酸传感器可能会对这些载体造成特殊问题。此外,当HIV-1通过膜融合进入细胞时,VSV-g假型载体将经历内吞作用,可能将它们暴露于包括TLR在内的几种内吞免疫传感器中(图 1)。然而,在人类B细胞系中进行的初步研究表明,LV转导对细胞基因表达的影响极低[ 22 ]。同样,我们观察到LV转导仍显着隐身,不会触发人类HSPC中TLR介导的转录程序[ 23]。取而代之的是,TLR7,TLR3和TLR9可以识别鼠浆细胞样树突状细胞(pDC)中的LV,从而导致其成熟[ 24 ]。在体内对目标肝细胞进行LV血友病基因治疗的体内给药诱导了肝脏中的先天免疫应答,这取决于TLR和非TLR信号传导[ 25 ]。重要的是,阻断这种先天免疫反应可提高肝脏的转导效率[ 25 ](图 1)。
据报道,LV和AAV可在内体水平激活TLR信号传导(TLR9和7),从而导致Myd88介导的IRF激活。富含G的ODN可以抑制TLR9介导的先天免疫激活。进入后,LV和γRV可以被胞质RIG-I样受体(RLR)或cGAS识别。LV通常通过利用细胞因子(例如CypA或TREX1)来防止这种过早的脱膜或RT中间体的过量生成来逃避这种反应,RT中间体可能会通过cGAS和STING激活继之以IRF3和NF-kB介导的I型IFN产生而导致cGAMP的产生。基因编辑过程中经核检测的RNA可以激活RLR并诱导ISG。用5-甲基胞嘧啶和假尿苷修饰RNA可防止这种活化。核进入后,LV和AAV基因组会触发人HSPC中p53介导的DDR(见图 2)。 有关详细信息)。
与对腺病毒载体的免疫反应相比,对AAV的先天免疫反应通常据报道较低[ 26 ]。然而,在AAV转导后,TLR9的激活与引发CD8 + T细胞对转基因产物的反应有关[ 27 ]。TLR9的激活不依赖于血清型或转基因[ 28 ],随后在体外pDC中诱导I型干扰素,从而促进了对转基因或AAV衣壳的适应性免疫应答的发展[ 27]。]。已经报道了单链(ssAAV)和自互补AAV(scAAV)的先天感知中的有趣差异。尽管ssAAV诱导了轻度和短暂的IFN反应,并在体内转导后约6 h减弱,但scAAV激活了更高水平的IFN,从而导致系统性炎性细胞因子的产生[ 28 ](图 1)。这些观察结果表明,取决于载体基因组结构和复制,存在两种不同的核酸识别机制。
RNA传感器
检测RNA的先天免疫受体称为RIG-I样受体(RLR)。在大多数细胞类型的细胞质中都发现了哺乳动物RLR家族的三个主要成员:维甲酸诱导基因I(RIG-1),黑素瘤分化因子5(MDA5)和遗传与生理学实验室2(LGP2)。并且在病毒检测后可以在正反馈回路中被IFN强烈诱导[ 29 ]。RIG-I用三磷酸(PPP)和5'末端约20个核苷酸的平末端碱基配对区域检测RNA,从而可将病毒与自身区分开[ 30 ]。MDA5可检测到未感染细胞中通常不存在的dsRNA [ 31]。一旦被激活,RIG-1和MDA5均会诱导线粒体表面的MAVS聚合,从而通过磷酸化和I型IFN基因的诱导而导致强烈的IRF3激活[ 32 ]。可能与LGP2(第三个RLR家族成员)结合的RNA的性质知之甚少,但一些体外研究表明LGP2可以与MDA5协同作用以进行适当的RNA识别和信号传导[ 33 ]。LV和γRV利用宿主细胞机制将它们的ssRNA基因组5'-cap,从而避免了RIG-I介导的识别[ 34 ]。然而,我们已经观察到γRV转导仍在人HSPC中诱导ISG反应[ 23]。有趣的是,这种诱导不受RT抑制的影响,表明涉及RNA传感。或者,可能通过宿主因子(例如人TRIM5α)检测到结构成分(例如病毒衣壳),该宿主因子显示与N-MLV衣壳蛋白p30结合[ 35 ],并介导先天性免疫信号转导,后者通过逆转录病毒感染和与衣壳点阵相互作用而进一步放大[ 35 ]。36 ]。不同的核输入动力学也可能解释了HSPC中LV和γRV传感的差异[ 37]。由于γRV需要细胞循环进入细胞核,因此与具有活跃核输入的LV相比,病毒复制中间体可能长时间暴露在HPSC中的胞质传感器中。当锌指核酸酶作为mRNA进行核转染时,已经证明在人类HSPC基因编辑的背景下会发生RNA感应。重要的是,通过在细胞RNA中常见的5-甲基胞嘧啶和伪尿苷核苷酸修饰修饰体外转录的RNA,显着降低了这种感觉[ 38 ](图 1)。
DNA传感器
除了与病原体相关的RNA外,外源DNA的存在也是细胞内的主要危险信号。由于核心DNA分子的化学组成与哺乳动物细胞和微生物相同,因此在这种情况下,识别原理主要基于DNA传感器的亚细胞定位。哺乳动物基因组DNA位于细胞核中。因此,大多数DNA传感器都存在于其他细胞区室中,例如TLR9的内体[ 39 ]。DNA传感器如环状GMP-AMP(cGAMP)合酶(CGA)的和不存在于黑色素瘤2(AIM2)主要作用在细胞质中,并在序列无关的方式[检测DNA 40,41,42]。通过cGAS与DNA结合后,开始合成环状二核苷酸2',3'-cGAMP。cGAMP与IFN基因的刺激物(STING)高亲和力结合,后者是I型IFN诱导的关键信号转导子(图 1)。一旦被胞质DNA信号激活,STING就会从内质网重新定位到高尔基体,并组装成点状结构,从而导致IRF3磷酸化并激活下游通路[ 43 ]。最近,一些报告识别CGAS作为核蛋白,但其在DNA检测和先天免疫激活作用遗体被完全阐明[ 44,45,46,47 ]。
已显示胞质cGAS可以在THP-1细胞系,单核细胞衍生的巨噬细胞(MDM)和单核细胞衍生的树突状细胞(MDDC)中去除复制的其他障碍时识别VSV-G假型HIV-1和其他逆转录病毒DNA [ 48,49 ]。病毒衣壳的稳定性也会影响先天免疫感应,因为改变有利的宿主-衣壳相互作用会导致过早的脱壳[ 50 ]以及病毒中间体在胞浆中的暴露,在那里它们可以被识别并触发MDM中的I型干扰素[ 51 ](图 1)。)。值得注意的是,当某些重要的宿主相互作用被阻止时,LV仍无法在人HSPC中引发I型IFN反应[ 52]。HSPC中可能存在一些预防先天性免疫激活的其他机制。γ-干扰素诱导蛋白(IFI16)也已显示出可感知和控制人类巨噬细胞中的HIV [ 53 ]。IFI16包含可与DNA结合和蛋白质相互作用的结构域[ 54 ]。它被发现是巨细胞病毒的核DNA传感器[ 55 ],但可以识别胞浆中的HIV DNA中间体,并有助于MDM中的病毒控制[ 53 ]。艾滋病的认识不完全由IFI16逆转录还与艾滋病的发病机制,导致CD4 +通过pyroptosis [T细胞死亡56,57]。IFI16是否在HSPC中的DNA传感中发挥作用仍有待解决(图 2)。考虑到它们的人工来源,在此背景下对ssODN和裸核酸的研究很少。但是,由于它们正在成为用于基因编辑的有用工具,因此了解靶细胞如何与这些外源核酸发生反应将变得越来越重要。
DNA损伤反应
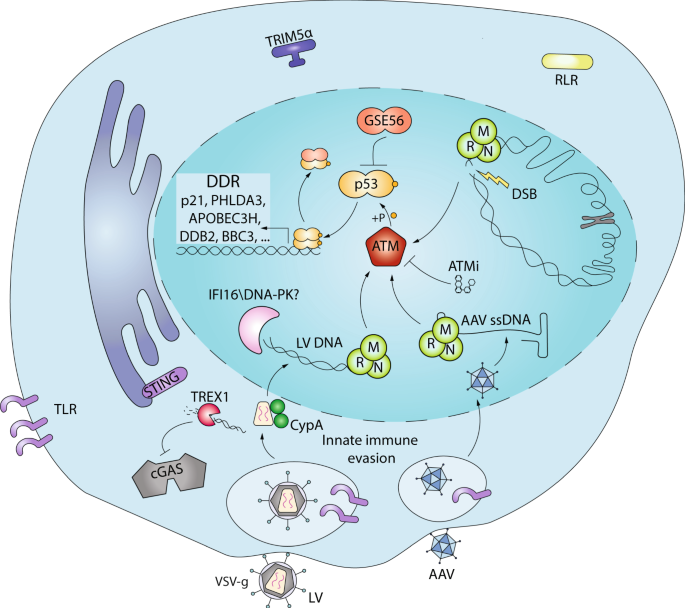
先天免疫感应与DNA损伤之间正在形成复杂的相互作用。经历DNA损伤的细胞可以激活通过涉及IFI16和STING [非规范的途径先天免疫信号58,59 ]和核C气体已被报道在DNA修复和肿瘤发生[作用44 ]。相反,病毒感染或转导能够在HeLa细胞中[所述病毒整合过程导致DNA损伤响应(DDR)由于双链断裂(DSB)60,61 ]或ssAAV基因组的在U2OS细胞中存在[ 62,63,64]。HIV和AAV已经进化出辅助蛋白,可以利用DNA损伤感测和修复中涉及的宿主因子进行有效的病毒复制,尽管存在一些争议,因为阻断DDR不能抑制HIV整合[ 65 ],但仍然可以改变病毒的复制和转导[ 66]。 ]。有趣的是,最近已证明规范的DDR蛋白DNA依赖性蛋白激酶(DNA-PK)介导人细胞中STING依赖性DNA感应和I型IFN激活[ 67 ]。DNA损伤的传感器因此可以被视为主要通过p53激活起作用但也可以触发I型IFN反应的替代性先天免疫雷达。
DNA损伤传感器对各种DNA损伤的反应都非常出色,因为双螺旋中的单个DSB都能诱导DDR,如果不解决,也会导致细胞死亡[ 68 ]。受损DNA的初始识别通常依赖于DSB的Mre11-Rad50-Nbs1(MRN)[ 69 ],而其他传感器(如XPC-RAD23-CETN2)可以识别紫外线引起的损伤[ 70 ]。一旦识别出DNA损伤,共济失调毛细血管扩张突变(ATM),共济失调毛细血管扩张和Rad3相关(ATR)的三种激酶中的至少一种,或将DNA-PK转换并放大为适当的DDR信号,在其他地方进行了广泛综述[ 71]。ATM和ATR已显示出潜在的磷酸化700个多的目标,包括充当转录因子来诱导DDR效应蛋白导致细胞周期阻滞,DNA修复或细胞凋亡[表达的DDR主调节的p53 71,72,73 ] (图 2)。对于AAV,DDR信号传导似乎有助于病毒复制,尽管目前尚不清楚DDR在多大程度上由复制压力产生并影响病毒非结构蛋白的细胞周期和核酸酶活性[ 74 ]。在以腺病毒为辅助的有效AAV复制过程中,DDR通过DNA-PK激活[ 75 ],而以HSV-1为辅助,主要涉及ATM [ 76]。]。MRN可以直接结合反向末端重复序列(ITR)上的AAV基因组,并损害HeLa细胞中的复制[ 77 ](图 2)。作为一种潜在的拮抗策略,腺病毒癌蛋白可以重组和降解MRN复合物的成员以增强病毒复制[ 78 ]。有趣的是,腺病毒和HSV-1蛋白也可以阻止DNA-PK作为替代的DNA传感器和先天性免疫激活剂[ 67 ]。这些数据中有许多是在细胞系中收集的,这些细胞系通常包含受损的免疫感应和DDR途径。因此,仍然需要进一步的研究来证实相关原代人类细胞中的这些发现,以促进基因工程的临床翻译。
我们已经显示,AAV和LV转导均激活人HSPC中的DDR [ 23 ](图 2)。这种激活是由p53介导的,并且在没有依赖整合的DSB的情况下发生。这种反应的强度与到达转导细胞核的源自载体的DNA量有关[ 23 ]。我们的结果指向了一种剂量依赖性机制,可检测细胞核内染色体外DNA的存在,该DNA易于转化为人类HSPC中更宽的DDR。p53激活的高峰通常发生在转导后48小时,并倾向于在转导后5天恢复正常。这种信号传导是由顶端的ATM激酶介导的,并且似乎对人类HSPC非常特异性[ 23 ]。确实,鼠林-HSPC在LV或γRV转导时未显示出DDR的迹象,而是激活了强大的I型IFN反应。相同的传感器可能激活小鼠和人类细胞中的不同途径。重要的是,载体介导的DDR激活会导致培养物中人HSPC的轻度但显着的凋亡增加和细胞增殖减少[ 23 ]。这些体外功能性后果在体内以较低的转导HSPC植入率转化,特别是在造血重建的早期阶段。与我们的观察结果一致,在人类HSPC [ 79 ]和其他干细胞类型[ 80 ] 的基因编辑中证实了p53依赖的DDR。]。尽管诱导DSB的基因编辑成分(例如ZFN或CRISPR)在HSPC中触发了DDR,特别是在使用低特异性试剂时,但在这种情况下,大多数p53反应可能归因于AAV的存在[ 79 ]。在这项研究中观察到的功能性结果类似于仅在LV和AAV转导时观察到的功能性结果,包括细胞周期延迟和体内编辑过的细胞低两倍的移入。但是,在这种情况下,仍需研究载体信号转导和编辑机对DSB的诱导对体内表型的单一贡献。值得注意的是,Cromer等。报道AAV6转导本身对人类CD34 +转录组的影响很小细胞,Cas9 mRNA和sgRNA的电穿孔是抗病毒和低DDR反应的主要驱动力[ 81 ]。这项研究与我们之间的差异可能在于转录组分析的不同技术平台,而微阵列技术对大量RNAseq或对不同时间点的敏感性较低。
尽管基因编辑介导的DDR诱导似乎是由基因组内的位点特异性核酸酶产生的DSB的逻辑结果,但人们对这种途径的激活缺乏针对人类HSPC的基因组DNA的物理断裂的缺乏却不那么令人期待。与外源DNA的DSB独立识别有关的尚未确定的因素可能会与已知的DSB传感器融合,或代表HSPC中核酸传感与DDR之间的新型联系。值得注意的是,LV和AAV都可以规避HSPC中规范的抗病毒先天免疫感应[ 23 ]。在这方面,艾滋病毒已经发展了几种逃避免疫的机制,包括利用在核导入之前稳定病毒衣壳的宿主因子,将其遗传物质隐藏在许多胞质传感器中[ 51]。],并利用宿主内切核酸酶清除过量的RT产物[ 82 ]。对于直接在细胞核中脱壳的AAV,可能存在类似的机制[ 83 ](图 2)。评估某些能够拮抗先天和DDR传感器的病毒蛋白是否可以利用来使HSPC基因工程更隐蔽也将是令人感兴趣的。
限制因素
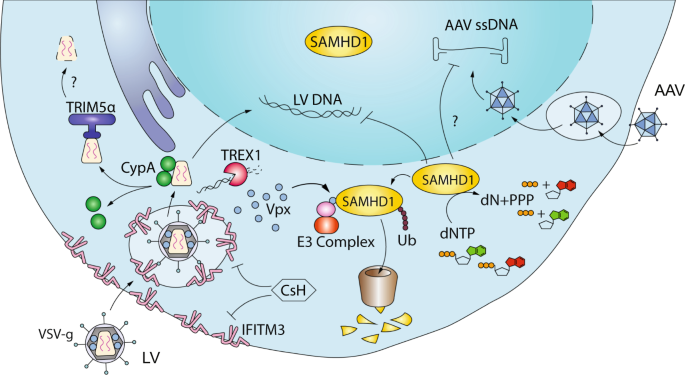
由于LV依赖于与HIV-1相同的细胞机制才能到达靶细胞的核区室并整合到宿主基因组中,因此在这种情况下,LV可能仍然容易受到针对病毒生命周期早期阶段的宿主抗病毒反应的攻击[ 84]。 ]。这在HSPC中可能特别重要,因为它们具有抗病毒ISG的高内在表达[ 85],这可能潜在地有助于其对基于病毒载体的基因治疗方法的耐药性。此外,假型包膜糖蛋白以及所有辅助和调节病毒蛋白(Vpr / Vpx,Vpu,Vif,Nef,Tat和Rev)的缺失可能会影响载体遇到的宿主因子,以及必须逃避它们的手段。由于抑制感染性HIV-1的限制因子已在其他地方进行了广泛的综述[ 86 ],我们将在这里讨论据报道抑制LV的那些因子,这些因子也可能与AAV和基因组编辑有关,特别是HSPC(图8)。 3)。
干扰素诱导的跨膜蛋白3(IFITM3)抑制宽范围的病毒,包括埃博拉病毒,登革热,SARS,HIV,流感病毒A,西尼罗河病毒,和VSV [ 87,88,89,90 ]。IFITM3的确切作用机理仍然难以捉摸,但这取决于其亚细胞定位和病毒包膜[ 91 ]。最近的证据表明,IFITM3通过改变脂质组成和细胞膜的物理特性来抑制感染[ 92 ]。我们最近报道说,IFITM3阻断人和鼠HSPC中的LV转导[ 93 ](图 3)。)。IFITM3施加的限制发生在VSV-g介导的进入水平,因为MLV衍生的两性包膜糖蛋白或狒狒包膜糖蛋白(BaEV-TR)假型LV的胞质尾突变体仍对IFITM3介导的限制具有抗性。与我们的观察一致,IFITM蛋白可以限制LV基因向气道上皮的转移[ 94 ]。有趣的是,与BaEV-TR假型LV已经建议显著改善在人CD34转导效率+相比VSV-G假型载体,包括在未刺激的细胞HSPC [ 95]。根据我们的发现,这种优势可能至少部分地是由于其绕过了IFITM3限制的能力而得到了解释。由于AAV不具有包膜,因此它对IFITM3限制不敏感[ 93 ],与基于LV的供体DNA递送策略相比,可能有助于其在HSPC基因编辑中的更高效率[ 3 ]。
SAMHD1是在骨髓和静息T细胞[用于HIV的公知限制因子96,97 ]。此外,已经显示出抑制病毒感染和转导LV在人类和小鼠骨髓细胞[ 98,99 ]。SAMHD1充当四聚体,通过不断将dNTP降解为dN [ 100 ] 来调节细胞中dNTP的量(图 3)。)。因此,在存在SAMHD1的情况下,有限的dNTP库会损害逆转录,并且转导或感染的总体效率较低。重要的是,由于限制是基于dNTP浓度的控制,因此大多数SAMHD1限制都限于非增殖细胞,例如巨噬细胞和树突状细胞。在协议中,HPSC SAMHD1介导的限制的相关性是最小的,当这些细胞与促生长因子刺激,使细胞存活和增殖[ 101]。但是,SAMHD1可能在限制静态,未刺激的HSPC的转导中发挥某些作用。在RT之前起作用的限制因子(如IFITM3)也可能会掩盖其对HSPC中LV转导的某些影响。值得注意的是,由于AAV还需要dNTP来合成dsDNA [ 102 ],因此SAMHD1限制的作用可能比以前认为的要多效(图 3)。
TRIM5α是一个原型约束因子即目标通过泛素化传入慢病毒衣壳和可能的话,蛋白酶体降解[ 103,104 ]。这会导致逆转录受阻,并破坏病毒。尽管人TRIM5α在人细胞中几乎没有抗HIV-1或没有抗病毒活性[ 103 ],但最近的证据表明,如果与宿主因子CypA的保护性相互作用被破坏,人TRIM5α可以抑制HIV [ 105 ](图 3)。这些作用可能是细胞类型特异性的,因为我们没有观察到带有衣壳突变体的LV不再与HSPC中的CypA相互作用而导致LV的转导效率受到特定损害[ 52]。]。常用γRV通常是从NB向性莫洛尼小鼠白血病病毒(MO-MLV)衍生的,并因此留在很大程度上不敏感的人类TRIM5α介导的限制[ 106,107 ]。另一方面,在旧大陆和一些新大陆猴中表达的TRIM5α(TRIM-Cyp)有效地限制了HIV-1的感染,但没有限制SIV的感染[ 108 ]。当为临床前基因疗法研究选择非人类灵长类动物模型时,细胞固有免疫力的这些物种特异性方面变得尤为重要。
由于针对野生型病毒对人类没有致病性,并且针对AAV与宿主的相互作用的研究十分有限,因此针对AAV生命周期的限制性因子的了解较少。然而,已显示蛋白酶体抑制剂可增加AAV2转导人类细胞系(Hela,HepG2)[ 109]。此外,AAV2和AAV5衣壳是泛素缀合的衬底,潜在地标记它们对蛋白酶体依赖性降解[ 110,111 ]。由于各种限制因素通过针对传入病毒的降解部分起作用,因此很容易推测类似的机制可能抵消并潜在地限制HSPC中的AAV。有趣的是,蛋白酶体抑制剂可增强HSPC中的LV转导[ 112],增加了一些尚未确定的抗病毒因子可能限制跨载体类型的转导的可能性。
如何克服HSPC基因工程中的细胞内在障碍
更好地了解常用病毒载体及其靶细胞之间的关系可以指导优化基因治疗策略的发展。特别地,限制因素和核酸传感器如上所述可以药理学上或通过修饰病毒载体,以适应拮抗辅助蛋白以增加的几个基因治疗应用的效率和安全性来抵消(图 1 - 3)。
可以通过拮抗ODN暂时抑制TLR9来提高体内AAV的转导,而ODN可能会整合到AAV基因组中以防止先天免疫信号传导[ 28 ](图 1)。在整合载体和离体基因操作的背景下,已经开发了许多转导增强剂,并且化合物(例如16,16-二甲基前列腺素E 2(PGE 2)和LentiBOOST™)已包括在临床试验中[ 113 ]。对于大多数这些增强子而言,导致它们对转导效率产生生物学影响的分子机制仍不清楚,并且可能代表着长期安全性的潜在问题。PGE 2已经显示出通过双重大致减轻早期,仍然未识别,转导块和增加基因转移效率[ 11,114 ]。然而,由于暴露于PGE 2而导致原始HSPC丧失的报道引起人们对患者长期获益的关注[ 115 ],并强调了更好地表征增强剂机制以及这些化合物可能对HSPC生物学产生潜在副作用的重要性。转导促进剂如泊洛沙姆[ 116 ]或聚阳离子硫酸鱼精蛋白[ 117 ]通过支持载体-细胞接触,潜在地通过载体的fluidifcation和细胞脂质膜[动作116,118]。据报道,LentiBOOST™与硫酸鱼精蛋白的组合可产生高出六倍的LV转导效率,并且对体外HSPC生物学的影响极小[ 116 ]。这种作用是否会在体内长期补充HSPC中持续存在尚待确定,因为在大多数进行的基因治疗试验中,在体外药物产品和长期补充细胞之间已观察到载体标记显着下降迄今,包括那些其中转导增强剂已采用[ 5,6,60,113,119,120 ]。
我们最近发现了一种在体外转导阶段通过添加环孢菌素H(CsH)克服HSPC中IFITM3介导的限制的方法[ 93 ](图 3)。CsH瞬时下调HSPC中的IFITM3,从而导致LV输入效率的提高。的CsH产生在长期中的转导效率5-10倍的增加体内再植HSPC,使其描述HSPC的基因转移的最有效的增强剂迄今[ 11,93 ]。重要的是,CsH不会影响人类HSPC的生存力或移植能力,相反,其他增强剂如雷帕霉素(Rapa)或环孢菌素A(CsA)已显示出一定程度的毒性,特别是在临床相关的mPB衍生的HSPC中[ 121]]。确实,应该仔细评估增强剂的细胞来源依赖性作用,因为与mPB来源的CD34 +细胞相比,脐血和BM来源的HSPC通常不那么敏感[ 121 ]。值得注意的是,CsH还显着增强了非整合的基于LV的基因编辑,因为它增加了HPSC中供体DNA模板的可用性[ 121 ]。在需要AAV无法容纳的较大供体DNA盒的环境中,这尤其有意义。
有趣的是,最近也有人建议Rapa通过从人HSPC瞬时清除IFITM3来增加转导[ 122 ]。然而,Rapa赋予的倍数增强效果仍不及CsH,而且它们的组合具有加成性[ 93 ],表明这两种化合物的作用机理不同。由于AAV对IFITM3限制不敏感,因此CsH不能提高HSPC中AAV的转导效率[ 93 ]。最近,据报道,环状白藜芦醇三聚体咔酚A改变了晚期核内体上IFITM2和IFITM3的量,从而提高了HSPC的转导效率[ 123]]。在临床相关的HSPC来源和载体的背景下,这些化合物如何与CsH进行比较或添加尚有待研究。原则上,也可以通过抵抗IFITM3的信封(如Baev-TR [ 93 ])来克服IFITM3的限制。然而,通常表征非VSV-g假型LV的总体载体效价差使它们难以翻译,因为总体基因标记将不太可能达到足以获得临床益处的水平。就基因标记水平而言,不同增强子的组合通常会产生进一步的好处。在这种情况下,仔细评估毒性和长期疗效变得至关重要,因为同时会影响多个通常表征较差的途径。
可以利用病毒辅助蛋白抵抗限制因子的天然能力来克服基因治疗中的宿主限制。例如,HIV-2和SIV辅助蛋白靶向VPX为SAMHD1蛋白酶体降解的[ 97,98,99 ]。当VPX存在于病毒颗粒SAMHD1是容易降解,并在细胞产生水平的dNTP即反转录和转导的增加效率[ 97,98,99 ]。HIV-1通常不会编码Vpx或将Vpx包装到病毒粒子中,但是LV包装构建物中Gag多蛋白的p6部分可以被SIV衍生的蛋白取代,从而允许Vpx整合[ 99 ]。 3)。Vpx的掺入不会影响载体的效价,但可使LV高效转导原代人骨髓细胞[ 99 ]。这种策略已经用于提高MDM和DC的转导相关临床前设置[ 124,125 ],但只有有限的益处在HSPC被报道迄今[ 101 ]。将Vpx与早期作用的转导增强子结合可能是有益的。
供体变性仍然是该领域的显著问题作为基因标记最近为β地中海贫血基因治疗的患者[观察强调也由高可变性5,6 ]。在这种情况下,控制HSPC对基因操纵的允许性的先天免疫因子的个体差异可能是造成这种情况的原因。有趣的是,我们观察到可变的IFITM3蛋白水平与HSPC跨供体的转导率负相关[ 93]。在我们的研究中,最不被允许的捐助者表现出最高的IFITM3水平,并从CsH中受益最大。这些数据表明,CsH除了增强转导作用外,还可能具有减轻离体基因治疗过程中供体变异的独特潜力,这对于设计更好控制的临床试验以及最终标准化药物具有重大益处。还已经表明,抗逆转录病毒宿主因子TRIM5α表达水平的变化与HSPC对慢病毒转导的允许性相关[ 126 ],尽管人类TRIM5α对HIV-1的抑制作用很弱[ 127]]。TRIM5α水平和其他ISG的差异可能反映了可变的IFITM3水平,而不是直接TRIM5α对转导的影响。备选地,保护LV免受TRIM5α侵害的辅因子在人细胞中的表达也可能因个体而异。
随着我们增强转导的工具变得越来越有效,在设计优化的基因工程方案时将需要考虑与剂量依赖性载体信号传导有关的方面。确实,在高载体剂量下用转导增强子已经观察到基因标记的丢失[ 128 ],这可能是由于载体介导的DDR激活增加[ 23 ]。在可通过LV和AAV转导抑制p53活化的药物中,ATM抑制剂(ATMi)KU55933可显着减少载体信号传导,离体细胞凋亡并在基因添加和编辑的背景下挽救了体内HSPC植入的延迟动力学。 [ 23,79 ](图 2)。办法直接靶向p53的诸如GSE56,P53 [的显性失活形式的瞬时过表达129 ],还可以防止载体信令和已经整合在基因编辑协议来实现编辑HSPC的高效植入与基因毒性[没有可检测的效果23,79 ](图 2)。在接受基因治疗的大量细胞中对p53的短暂抑制也可能降低选择在转导或基因编辑过程中对载体信号传导不太敏感的现有p53突变体克隆的可能性。
结论与观点
综上,我们在这里总结了一些最重要的例子,这些例子说明了解剖HSPC与不同基因操作平台之间发生的串扰如何为将来开发更多隐身和有效基因治疗方法提供信息。尽管我们的综述主要集中在人类HSPC中的核酸传感机制上,但这些原理可能在离体操作以及在一定程度上对体内的情况下,也适用于其他原代细胞,例如T细胞和单核细胞基因工程方法。随着基因操作工具箱和患者群体的扩大,仍有很大的改进空间。特别是,对组合方法的评估包括提高基因转移或编辑效率的策略,同时抑制HSPC中的载体或核酸介导的信号传导将使基因工程的潜力最大化。另外,了解患者细胞背景下的载体和增强子信号传导将至关重要。特定的基因缺陷或改变的BM微环境可能会影响HSPC对基因工程机器组件的响应,因此可能需要针对特定疾病设置的定制方案。旨在剖析基因治疗功效中个体变异性决定因素的更大患者队列的研究将有助于统一并保证所有患者的临床获益。最后,目前对于涉及ssODN的新型递送方法的了解甚少,dsDNA,mRNA和修饰的mRNA与宿主先天传感器相互作用,并可能影响细胞适应性,因此有必要在未来进行广泛研究。总体而言,更好地了解HSPC中载体与宿主相互作用的基本机制以及基因治疗的其他主要目标将有助于阐明先天免疫的分子机制,揭示可能阻碍基因转移和校正的新型免疫障碍,并提供对临床相关靶标中改良载体的开发和基因工程策略。
|
|