通过幽门螺杆菌 共培养系统的全球RNA-seq数据集的表达模式分析鉴定新的调控基因
摘要
幽门螺杆菌是一种革兰氏阴性细菌,通过诱导免疫调节反应而持久地定居在人的胃中。我们已经使用了一种新颖的平台,该平台将骨髓来源的巨噬细胞和活幽门螺杆菌共培养物与全球时程转录组学分析相结合,以基于类似于具有已知调控功能的基因的表达模式来鉴定新的调控基因。我们使用了基于细胞位置和新颖性参数的过滤标准来选择5个潜在的潜在候选目标。其中,包含2(Plxdc2)的Plexin域被选为最主要的免疫调节靶标。幽门螺杆菌体内模型的功能丧失研究感染以及化学诱导的结肠炎模型,证实了其预期的调节功能以及对宿主免疫反应调节的重大影响。我们集成的生物信息学分析和实验验证平台使发现新的免疫调节基因成为可能。该管道可用于鉴定具有治疗传染性,炎性和自身免疫性疾病的治疗应用的基因。
介绍
慢性细菌感染通过在细胞和分子水平上复杂而动态的宿主细菌相互作用来维持,这些相互作用决定了宿主免疫应答的结果,有利于持久性。这些相互作用的表型表现是由具有重叠功能的基因组的协同表达共同作用的,这些功能在调节宿主反应中协同作用。除了发出感染信号并与先天的抗菌和炎性反应相关的病原体相关分子模式(PAMP)外,其他鲜为人知的细菌成分也会引发代偿性免疫调节反应,当病原体利用其时,会促进适应性组织微环境的发展,从而有利于长期期细菌定植。例如,结核分枝杆菌诱导IL-10驱动的监管响应该抑制效应机制导致感染的慢性化1,2,3,4。因此,某些细菌物种对宿主免疫调节机制的激活会抑制效应免疫反应并阻止细菌清除。
幽门螺旋杆菌是高度专业化的殖民人体肠胃利基5,6。这种感染是慢性的,影响着世界50%以上的人口7。幽门螺杆菌感染大多无症状;然而,载体的大约10%开发消化性溃疡8,9,和1-3%的胃癌9。有趣的是,幽门螺杆菌感染可以是无症状个体的全身耐受性的与该细菌的存在和自身免疫疾病,哮喘,食管腺癌和发展之间的逆相关的重要驱动因素是2型糖尿病10,11,12,13,14。在疾病这些相互矛盾的影响可能从相对于效应以下感染的免疫应答的调节部件的相对显性茎15,16,17,18。总之,长期定植表明强的幽门螺杆菌诱导的免疫调节反应可以促进免疫耐受并转移炎症反应和效应反应。因此,幽门螺杆菌与免疫细胞的相互作用作为一种理想且独特的系统出现,以探索控制免疫应答的两个边缘并发现新的免疫调节机制的潜在分子途径。
巨噬细胞已被描述为幽门螺杆菌诱导的调控机制中的关键细胞贡献者19。特别地,幽门螺杆菌与单核吞噬细胞的子集相互作用,促进IL-10驱动的调节反应,从而促进免疫耐受并实现胃黏膜的最佳定殖20。我们证明,巨噬细胞过氧化物酶体增殖物激活受体γ(PPARγ),一种抗炎转录因子,是诱导全范围的调控反应所需要的20。额外的巨噬细胞表达基因(Par1,HO-1)起到类似的作用,PPARγ,并有助于保持高水平的定植,同时降低病理和疾病21,22。免疫反应开始后的早期,巨噬细胞和树突状细胞(DC)均能承受强烈的代谢和转录重编程,以应对感染。基因表达的细胞程序在时间上高度协调,具有重叠作用的基因组通过同时上调和下调而共享相似的表达模式。免疫和代谢界面上单个枢纽基因的缺失会影响整个系统的平衡,从而对响应的结果产生重大影响。实际上,仅PPARγ的抑制或失活会导致更强的炎症反应,而激活或增强的表达则会导致更均衡的反应,20,23,24,25。
在这项研究中,我们利用幽门螺杆菌已知的诱导调控反应的能力,寻求具有调控功能的基因的鉴定。我们的方法涉及对野生型(WT)或PPARγ缺陷型骨髓源巨噬细胞(BMDM)与活幽门螺杆菌的共培养物进行高分辨率时程转录组分析,从而提供了详细的表达方式具有有效的促炎或调节作用的基因。我们使用生物信息学分析系统对具有类似于已知调节基因的动力学行为的转录本进行排序,并使用了筛选标准,该标准提供了潜在的新免疫调节候选物的简短列表。其中之一,包含2(Plxdc2的 Plexin域),被选择并进一步证实具有免疫调节作用,并有潜力用作开发炎症和自身免疫性疾病治疗的分子靶标。
结果
BMDM- 幽门螺杆菌共培养体外系统的校准
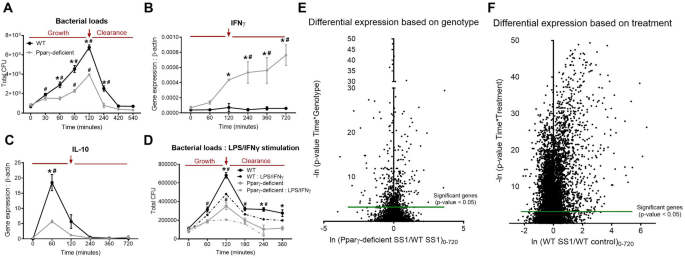
我们试图用庆大霉素保护共培养系统探索幽门螺杆菌与BMDM的相互作用,比较从WT和PPARγ缺陷型(PPARγfl / fl; LysCre +)小鼠获得的细胞。将BMDM培养物暴露于活幽门螺杆菌(SS1菌株)15分钟,然后用庆大霉素处理。值得注意的是,幽门螺杆菌是由巨噬细胞内化,它可以在细胞内的隔间复制26,27,28,29。因此,庆大霉素在最初暴露后用于杀死活的细胞外细菌并同步细胞反应。另外,我们使用庆大霉素处理后的细胞内复制作为抗菌反应的作用和状态的标志。在PPARγ缺陷小鼠,缺乏基因的调节功能和促炎和抗细菌反应基因表达的表达缺陷此转录因子的结果的30,31,32。因此,WT和PPARγ缺陷细胞之间的比较被用来评估促炎和调节程序的表达变化。庆大霉素后0至12小时的几个时间点收获细胞。我们进行了初步分析,以校准细菌生长的时机,峰和清除以及促炎性基因和调节基因的表达。庆大霉素处理后30分钟首次检测到初始复制,两种基因型均在120分钟达到峰值,细菌在420分钟时被有效清除(图 1)。一个)。两种基因型的动力学都相似,尽管在整个时间过程中,从攻击后60分钟到最多240分钟,PPARγ缺陷型巨噬细胞共培养物中的细菌计数均显着降低。该表型与由于PPARγ的损失引起的炎症转变相容。
幽门螺杆菌共培养物改变巨噬细胞转录组谱,导致早期调节反应的激活并增加WT细胞中细菌的持久性。WT和PPARγ缺陷型BMDM与幽门螺杆菌离体共培养,庆大霉素处理后的0至720分钟的几个时间点收获细胞。评估细菌负担(A)和基因表达,包括IFNγ(B)和IL-10(C)。为了经典地激活幽门螺杆菌共培养之前的巨噬细胞,用LPS和IFNγ刺激细胞,然后用幽门螺杆菌攻击并测量细菌负荷(D)。还评估了基于基因型(E)和幽门螺杆菌感染(F)的差异基因表达,该差异来自对收获的细胞进行的整个转录组分析。红色箭头突出显示与细菌生长峰值相对应的120分钟时间点。* P <基因型之间0.05, #P <0.05每种基因型内相比时间0。
为了用基因表达覆盖细菌复制的发现,我们测量了典型的促炎和调控基因。与WT相比,在PPARγ缺陷的BMDM中幽门螺杆菌攻击后的IFNγ表达显着增加(图 1B)。相比之下,WT巨噬细胞在60分钟时上调了抗炎细胞因子IL-10,在PPARγ缺陷型BMDM中明显降低(图 1)。C)。另外,IL-10应答与细菌生长阶段重叠,而IFNγ表达与细菌清除阶段在时间上重合。这些数据符合细菌复制过程中初始调节反应的协调表达模型,随后是细菌清除所需的显性炎症反应。为了验证该评估,在感染前24小时通过LPS /IFNγ刺激经典激活了WT和PPARγ缺失的巨噬细胞。促炎性WT巨噬细胞的产生在120分钟的时间点抑制了幽门螺杆菌的负载(图 1)。D)。此外,在LPS /IFNγ处理的PPARγ缺陷细胞中,细菌负荷峰被完全消除。为了阐明幽门螺杆菌共培养时激活的潜在调控和抗菌机制,我们对庆大霉素保护性检测时间过程(0、60、120、240、360和720分钟)进行了全局转录组分析。初始RNA测序分析表明在这两种基因型(图中的基因表达谱显著差异 1 E)和处理(图 1F)。根据处理,几乎有50%的基因表现出显着的差异表达,幽门螺杆菌攻击后总体上调。因此,幽门螺杆菌 影响巨噬细胞的转录谱,这些变化转化为巨噬细胞功能的改变,有利于调节表型的产生。
验证实验性共培养系统并鉴定特征性抗菌素基因中的差异表达模式
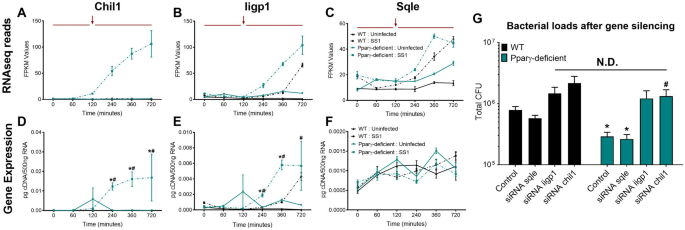
随着时间的流逝,调节基因和促炎基因的表达受到严格调节和协调。实际上,正如我们的共培养系统所表明的,促炎基因和调节基因在相同条件下经常呈现相反的表达动力学。我们所用的转录数据集来评估的9建立规范促炎基因(表达MCP1,MCP5,IL6,IFN γ ,IL12A,IL12B,CXCL1,CXCL10和MIP-1 α)最初探索并识别相关的表达的独特的模式具有促炎和抗菌功能。与调节基因相比,与炎症相关的基因的表达被延迟,并且在暴露于活幽门螺杆菌的 120分钟后在复制的峰值附近被诱导。(补充图S1)。如所预期的,缺乏PPARγ导致促炎基因表达增加。我们通过对整个转录组数据集的基因型,治疗和时间影响进行三项方差分析来遵循此初始评估。8个基因,Chil1,ETV5,Iigp1,PTGER4,SQLE,OSM,Rptoros和HSPA2,鉴定与P <0.05。这些效应之间的相互作用在基因之间有所不同,但许多是迟反应基因,在PPARγ缺陷型巨噬细胞中显着上调(补充图S2)。)。这与许多这些基因的确定的促炎功能一致。我们关注我们的验证分析Chil1,Iigp1和SQLE(图 2 A-C) ,由于类似于标识的炎症基因模式和宿主-病原体的反应其众所周知的作用其表达动力学。验证通过qRT-PCR证实了RNA测序表达模式Chil1和Iigp1(图 2 d,E)。相反,在感染组中,Sqle的晚期上调是不可检测的(图 2 F)。Chil1和Iigp1基因沉默(补充图S3)导致两种基因型的细菌负荷增加(图 2 G)。不出所料,由于Sqle的沉默,没有差异。因此,基于与促炎功能相关的表达模式对该全球转录组学数据集进行的初步分析突出显示了两个基因Chil1和Iigp1,它们在巨噬细胞抗微生物反应中具有相关的,先前确立的作用。初步分析验证了该系统根据表达的动力学模式鉴定功能连接的转录本的潜在用途,以及使用PPARγ缺陷型BMDM从系统中减去调节基因的潜力。
基于表达的分析模式确定了五种候选基因为具有推测调控功能的新基因
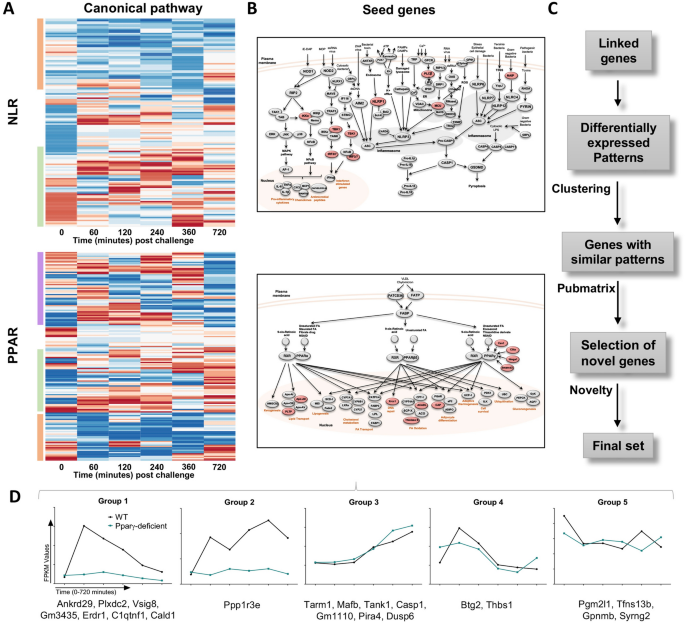
为了鉴定具有调节功能的参考表达模式的初始集合,选择了包含200多个基因的调节Nod样受体(NLR)和PPAR典型免疫途径。NLR是模式识别受体的一个亚家族,与PPAR相似,它调节巨噬细胞的先天免疫应答和代谢。当在开始时的NLRX1途径结果的配体结合,下游激活和有效的炎症机制调节33,34。这两个经典途径共同包含具有主要促炎或抗炎作用的基因的混合物,与炎性基因的转录本相比,这有助于鉴定调控模式。
最初,我们分析了在整个时间过程中两种途径中WT基因表达倍数变化(与PPARγ缺陷相比),并以热图形式呈现(图 3)。A),其中蓝色代表与PPARγ缺陷相比,WT中基因表达下调,红色代表与PPARγ缺陷相关,WT中基因表达上调。根据我们的假设,炎性基因将落入WT下调(蓝色)簇中,而调节基因将由于基因型之间的调节性和促炎性基因表达模式倒置而在WT上调(红色)组中发现。确实,生物信息学分析揭示了在两个信号通路中成群聚集的特定表达模式。NLR途径包括两个基于基因型的明确定义的簇(图 3)。一个)。顶部的橙色框包含在缺乏PPARγ的BMDM中上调的基因,底部的绿色框包含在WT组中表达更高的第二类基因。有趣的是,PPARγ缺失的上调基因具有延迟的表达模式,而WT上调的基因则出现了较早的峰值。这两种模式也以PPAR路径表示,以橙色和绿色框表示(图 3)。一个)。对与PPAR相关的基因的分析揭示了另一个第三簇,用紫色突出显示,包括一组在整个时间过程中具有随机模式特征的基因。一个合理的解释是与这些基因存在强烈的PPARγ相互作用。因此,由于直接激活,抑制或上调补偿机制,导致PPARγ缺陷型BMDM中转录因子的缺失会改变这些基因的表达,从而导致波动模式。
生物信息学流水线用于分析RNAseq数据集并建立差异表达模式,从而识别潜在的调控候选物。热图代表来自NLR和PPAR途径中每个基因的整个时间过程(攻击后0-720分钟)的基因型倍数变化表达(A)。蓝色表示与PPARγ缺陷的上调相比,WT巨噬细胞中表达受到抑制,而红色表示与PPARγ缺陷的巨噬细胞中表达受抑制相比,WT上调。热图是使用R软件(版本3.2.3)生成的。NLR和PPAR途径在这些图中表示的(乙)。这些图像是使用Microsoft PowerPoint(版本15.40)生成的。根据热图中表示的差异表达分析,排名靠前的基因以红色突出显示并被选作种子基因。种子基因选择(C)之后,在生物信息学分析过程中执行的步骤的示意图。最终集合中包含的21个基因根据其表达方式(D)分为五个组。
基因选择范围缩小到绿色框簇(即WT中上调的基因),以包括在WT BMDM中对幽门螺杆菌有阳性反应的转录本,而该基因型在120分钟时报告的细菌负荷达到峰值(图 1A)。 )。选择包括用红色突出显示的7个NLR和10个PPAR途径基因(图 3)。B),其被定义为种子基因。基于种子基因的表达模式,我们建立了一个初始数据集,其中包括这些基因以及从全局转录组数据集获得的一组称为模式关联基因的基因。连锁基因的特征在于与种子基因具有相似的动力学。在这个较大的初始数据集中选择了差异表达模式的一个子集,并通过整个全局转录数据集中的2个聚类循环,我们获得了一组包含潜在候选基因的特定基因。为了进一步缩小搜索范围,我们使用Pubmatrix 35工具根据以下标准选择最新颖的基因:出版物数量,细胞位置和已知功能(图 3)。C)。对于最终选择,根据最终表达中的21个基因的表达模式将其分为5组(补充图S4)。第1和第2组在基因型内表现出明显的独特模式,而在第3、4和5组中未观察到基因型差异(图 3 D)。此外,第1和第2组中的基因在WT BMDM中幽门螺杆菌攻击后被上调,而在PPARγ缺陷中被抑制,我们以此作为潜在调节功能的指标。
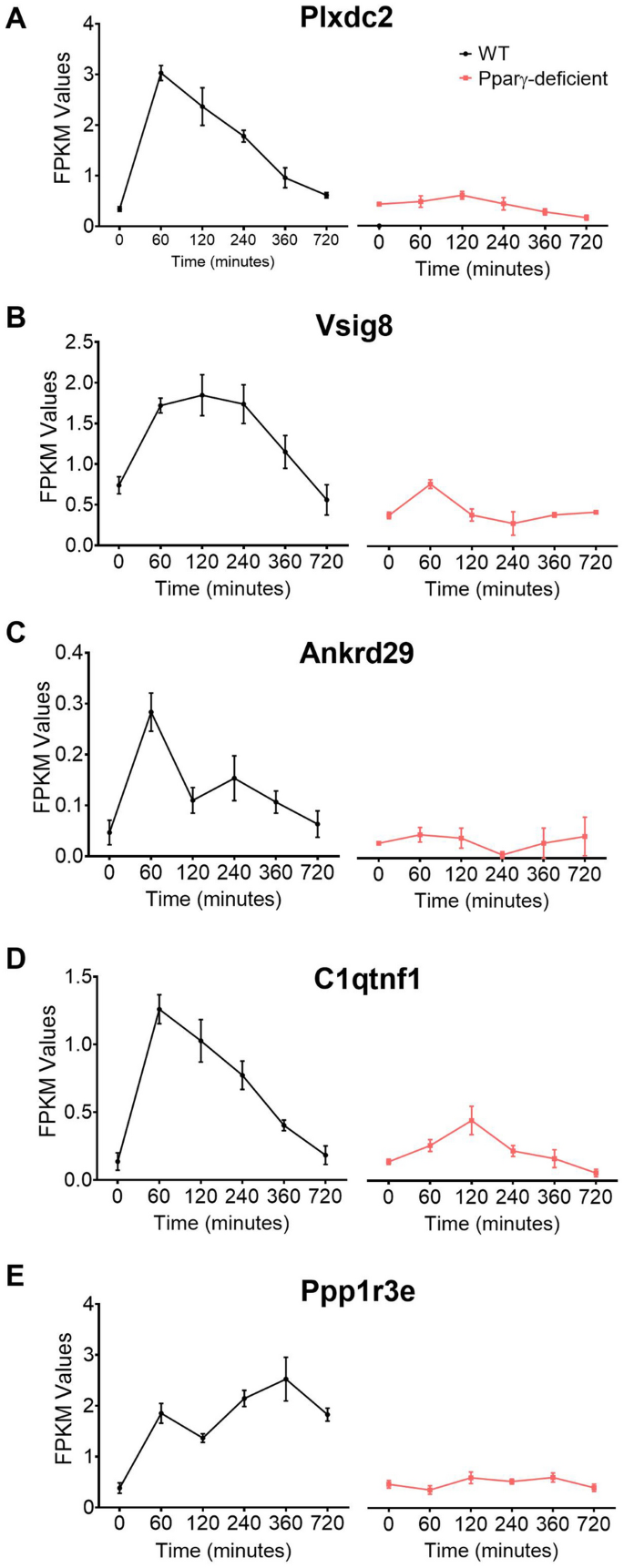
基于模式加Pubmatrix分析,最终数据集的第1组和第2组的5个基因被确定为潜在的新监管线索,需要进一步验证。包含2(Plxdc2,图 4A),V-set的免疫球蛋白域和包含8(Vsig8,图 4 B),锚蛋白重复域29(Ankrd29,图 4 C)和C11的免疫球蛋白域以及肿瘤坏死因子相关蛋白1(C1qtnf1,图 4D)在WT巨噬细胞中共有一个早期表达峰,该峰在PPARγ缺陷型细胞中被废除,并与庆大霉素保护试验中的细菌负荷峰值一致。动力学的蛋白磷酸酶1调节亚基3E(Ppp1r3e,图 4 E)具有双相表达,在60分钟时出现一个初始峰,一个与最大细菌生长相吻合的树丛,在360分钟时出现一个第二个峰。在缺乏PPARγ的BMDM中,所有5个候选物均被下调并显示为一条平线。这五个基因的已知特性在补充表S1中进行了描述。与每个基因相关的出版物揭示了已建立功能的多样性。然而,大多数基因均未报道与免疫反应相关。因此,有限数量的出版物以及每个基因当前确定的功能支持了它们与宿主免疫调节机制潜在相互作用的新颖性。
在巨噬细胞特异性PPARγnull小鼠中,废除了野生型小鼠体内和体外幽门螺杆菌诱导的所有五个主要靶标候选基因的上调
为了对五个选定基因进行验证,我们首先通过qRT-PCR在庆大霉素组学分析中使用的庆大霉素保护分析的每个时间点对样品进行了qRT-PCR测定(图 5A,C,E,G,I) 。所有5个基因均表现出与RNAseq数据集相似的模式,其特征在于WT BMDM中的早期上调,由于PPARγ的丢失,在具有促炎表型的细胞中被抑制。
为了探索体内选定基因的动态,将幽门螺杆菌感染了WT和PPARγ缺陷的小鼠。在第28天收集的受感染和未感染小鼠的胃中测量了5个候选基因的表达。在先前的研究中,我们证明了幽门螺杆菌在体内的感染诱导了由表达IL-10的髓样细胞驱动的强大调控机制,开始于感染后第14天,并在感染后第28天达到最高水平20。与体外发现一致,幽门螺杆菌感染上调了Plxdc2(图 5B),Vsig8(图 5 D),Ankrd29的表达。(图 5 F),C1qtnf1(图 5 H)和Ppp1r3e(图 5 J)在WT胃组织中。相反,在巨噬细胞特异性PPARγ缺陷型小鼠感染幽门螺杆菌后,报道的差异很小或没有差异。因此,在WT小鼠中幽门螺杆菌攻击后调节应答的激活与五个选定基因的转录增加相关。但是,髓样细胞中PPARγ的缺乏消除了对所选先导调节基因的这种作用。
Plxdc2缺乏症会诱发幽门螺杆菌感染过程中促炎性巨噬细胞的产生并减少细菌负担
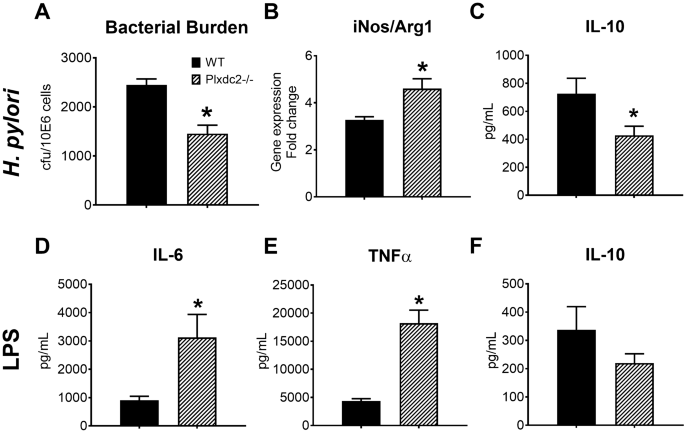
一旦完成了对五个潜在候选基因的初步筛选和验证,便选择了Plxdc2进一步探索其调控活性。该选择基于报告的表达动力学以及Plxdc2是膜受体和潜在可药物靶向的事实。缺乏Plxdc2的小鼠用于这些研究(补充图S5)。对从WT和Plxdc2 -/-小鼠获得的BMDM进行庆大霉素保护分析,并在共培养后2、6或21小时收获。与WT BMDM的共培养相比,Plxdc2缺乏导致幽门螺杆菌负担减少了两倍(图 6一个)。为了评估Plxdc2-/- BMDM中报告的细菌复制减少是否是由于巨噬细胞功能的调节所致,我们评估了诱导型一氧化氮合酶(iNOS)和精氨酸酶1(Arg1)之间的基因表达比例。Plxdc2缺陷细胞具有增加的iNOS / ARG1比率(图 6 B),促炎性表型的标记物。此外,IL-10分泌(图 6 C)是显著下降Plxdc2 - / -细胞。通过WT和PPARγ缺陷BMDM的siRNA研究,通过Plxdc2基因沉默获得了相似的结果(补充图S6)。Plxdc2沉默(WT BMDM中效率的70%,补充图S6 A)阻止了幽门螺杆菌攻击后在WT对照组中检测到的早期Arg1上调(补充图S6 B)。与共培养后2小时的基因表达结果相关,Plxdc2沉默导致WT BMDM中的幽门螺杆菌负担减少了三倍(补充图S6 C)。在PPARγ缺陷组中未观察到差异。为了进一步验证Plxdc2在不同体外系统中的调节功能,用大肠杆菌刺激了WT和Plxdc2-/- BMDM 。LPS(100 ng / mL),以评估细胞因子谱。的损失Plxdc2导致IL-6(图的>增加三倍 6 d)和TNFα(图 6 E),和降低的IL-10分泌(图 6 F)。因此,Plxdc2缺乏症导致巨噬细胞表型的促炎性转变,从而消除了幽门螺杆菌诱导的调节反应,从而限制了细菌的持久性和复制。
在幽门螺杆菌感染的体内模型中,Plxdc2缺乏症与炎症增加和细菌定植降低有关
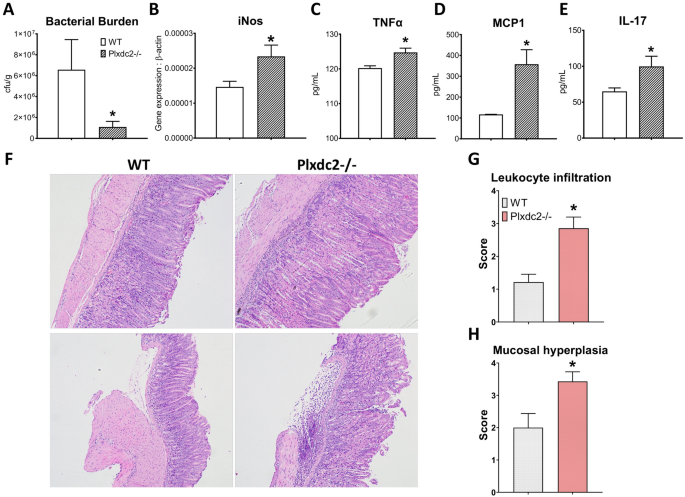
为了评估Plxdc2在幽门螺杆菌诱导的体内调节反应中的作用,将 WT和Plxdc2-/-小鼠感染了5×10 7 cfu的H. pylori SS1。与体外结果相似,Plxdc2缺乏症在感染后第28天显着减少了细菌定植(图 7A)。此外,在细菌负荷的降低与iNOS的的增加胃表达(图相关 7 B)。为了评估Plxdc2缺陷是否影响下游抗原特异性应答,将胃淋巴结的单细胞悬液与灭活的幽门螺杆菌进行离体共培养SS1。分泌的TNFα(图 7 C),MCP1(图 7 d)和IL-17(图 7E),测定72小时后的刺激及观察到的要增加Plxdc2缺陷型基团。因此,我们的数据表明Plxdc2表达有助于细菌定殖过程中幽门螺杆菌驱动的调节反应的产生。为了评估PLXDC2的丢失是否在诱导胃炎中起作用,WT和Plxdc2-/-小鼠感染了5×10 7 cfu的幽门螺杆菌 PMSS1。我们之所以选择PMSS1,是因为该菌株比SS1更有效地在胃中定植并诱导更强的免疫反应。感染后第28天与WT组相比,Plxdc2-/-小鼠浸润到胃粘膜和粘膜下层的炎性细胞显着增加(图 7 F,G),并伴有更严重的粘膜增生(图 7 H)。值得注意的是,许多未感染的Plxdc2缺陷小鼠表现出轻度自发性胃炎(数据未显示),这表明Plxdc2在维持组织稳态方面的作用。
幽门螺杆菌感染小鼠模型中Plxdc2调节作用的体内验证。WT和Plxdc2-/-小鼠感染了幽门螺杆菌 SS1。在感染后第28天收集胃和GLN。测量胃组织中的细菌负荷(A)和iNOS(B)表达。用灭活的幽门螺杆菌 SS1 离体刺激GLN分离的细胞72小时。培养72小时后,通过细胞因子珠阵列对分泌的TNFα(C),MCP1(D)和IL-17(E)进行定量。WT和Plxdc2-/-小鼠感染了幽门螺杆菌PMSS1。苏木精和曙红染色的胃切片WT和Plxdc2-/-小鼠在感染后第二天感染PMSS1的代表性图像28(F)。这些图像是使用Olympus CellSens Entry成像软件获得的。白细胞浸润(G)和粘膜增生(H)的平均组织病理学评分* P <0.05。
在DSS诱导的结肠炎模型中,Plxdc2的缺失加剧了疾病的严重程度和结肠炎症
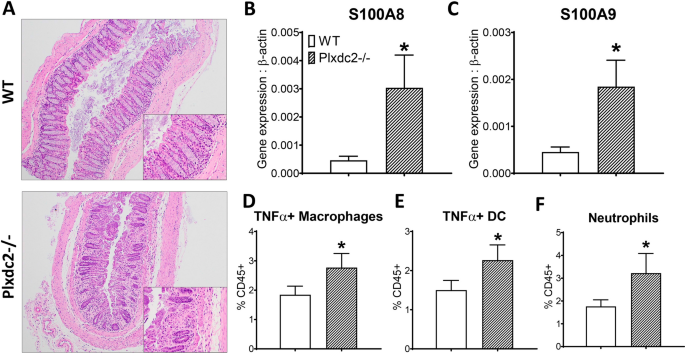
为了进一步验证Plxdc2在体内的调节作用,将WT和Plxdc2-/-小鼠置于DSS化学诱导的结肠炎模型中。DSS攻击后7天,在炎症高峰时进行结肠组织的组织病理学分析。与WT组相比,Plxdc2缺乏导致白细胞浸润,粘膜增厚和上皮侵蚀增加(图 8A)。(图S100A8的表达 8 B)(图和S100A9 8 C)的基因,其编码对嗜中性粒细胞蛋白复合物钙防卫蛋白,炎症和对治疗的反应在IBD行之有效的标记物,也被上调在Plxdc2 - / -冒号。(图此外,促炎性巨噬细胞结肠固有层浸润 8 d),树突状细胞(图 8 E)和嗜中性粒细胞(图 8 F)还增强在Plxdc2 - / -小鼠。因此,该数据表明在Plxdc2缺陷型小鼠中对DSS攻击的易感性升高,这是通过结肠炎的增加和与Plxdc2的丧失有关的总体疾病严重性检测到的。
讨论区
我们提出了一种新颖的系统,该系统利用幽门螺杆菌在离体共培养物中诱导的调控反应,结合生物信息学分析,以基于WT和PPARγ缺陷型BMDM的表达模式动力学发现具有潜在免疫调节特性的基因。使用这个新平台,我们确定了5个候选免疫调节基因:Plxdc2,Ppp3e1r,Vsig8,Ankrd29和C1qtnf1。幽门螺杆菌进一步验证了所选基因的预测调控作用在体内以及通过体外测定挑战。在功能上,幽门螺杆菌感染期间5种候选物的表达与调节机制的诱导之间的相关性支持了它们潜在的免疫调节作用。此外,共培养系统的验证为生物信息学筛查方法的应用提供了新的见识,从而发现了用于治疗炎症和自身免疫性疾病的新型分子靶标。
幽门螺杆菌发挥在胃癌病理,即消化性溃疡和胃癌的病因中起重要作用36,37。长期以来,这种革兰氏阴性细菌就具有诱导混合的促炎和免疫调节反应的能力。研究后者曾透露已追踪到特定细菌组分几种机制,如以激活在与树突状细胞接触诱导的致耐受性反应等等TLR4或毒素的效果LPS的能力低38,39,40。这些机制的同时激活被认为有助于免疫逃避或偏离的状态,其允许人胃粘膜的慢性定植。在这里,我们利用幽门螺杆菌的能力来诱导调节反应,以鉴定参与该反应的新基因。我们已将简化的体外系统与BMDM结合使用,以避免涉及多种细胞类型的体内反应的复杂性。在与BMDM进行离体共培养的严格控制环境中,幽门螺杆菌显着影响基因表达谱。因为我们描述的方法取决于对基因表达动力学模式的分析,所以BMDM文化的使用提供了响应同步的其他优势。我们证明了这种同步的离体系统与下一代测序(NGS)策略和生物信息学分析的利用,是捕获幽门螺杆菌诱导的全范围调控反应并发现具有有意义意义的新型调控机制的合适方法。影响体内免疫反应的调节。
除了结合NGS和生物信息学分析方法外,在当前研究中,基因选择还基于候选基因与已知宿主基因(具有经过验证的调节功能)的表达动力学之间的相似性,以鉴定具有相似特征的新基因。在我们的系统中,利用具有独特免疫稳态(WT与PPARγ缺陷)的巨噬细胞进行比较,以确认已建立基因集的调制并验证新调控基因候选物的功能重要性。
为了确定预测的调控模式,我们利用了NLRs和PPARs的经典免疫途径。PPAR是调节葡萄糖和脂质代谢并发挥有效免疫调节功能的核受体。实际上,PPAR途径中成员的激活导致脂质代谢的β-氧化增加,并抑制炎症反应41。23种模式识别受体的NLR家族与巨噬细胞先天免疫应答的启动有关。正如预期的那样,NLR途径包括炎症驱动的基因的重要数34,42,43与免疫调节功能,包括NLRP10和NLRX1,而且基因44,45,46,47。还考虑了激活和维持巨噬细胞免疫应答必不可少的其他途径,包括Toll样受体(TLR),核因子kB(NF-kB)以及与活性氧产生相关的途径(ROS) 。然而,这样的途径,分别启动和与巨噬细胞的限制促监管职能炎症机制放大的强关联48,49,限制了它们在我们的调控基因的发现管道的潜在价值。
体内外的分子证据表明,Plxdc2和Ppp1r3e是具有最大免疫调节潜力的两个基因。Plxdc2编码已知的神经系统的发育过程中参与细胞增殖和分化的控制一个350氨基酸的细胞膜蛋白质50,51。我们的结果表明,Plxdc2的丧失在体外改变了巨噬细胞表型,导致其向更炎性的状态转变,从而导致细菌负担的显着减少以及组织愈合和抗炎相关基因的表达下调。Plxdc2及其同源基因Plxdc1,已被确定为色素上皮衍生因子(PEDF)52,内源性抗血管生成因子53的膜受体之一。有趣的是,PEDF治疗264.6细胞通过IL-10产生的与PPARγ激活潜在的关联增加调制在原始巨噬细胞活化54,55。Cheng等人报道,PEDF诱导的Raw 264.7巨噬细胞中IL-10的产生依赖于Plxdc1和Plxdc2 52。我们的数据不仅表明Plxdc2可以独立于PEDF的外部刺激而诱导免疫学改变,而且还表明Plxdc2表达是有效产生Plxdc2所必需的。幽门螺杆菌驱动的体内调节反应。实际上,Plxdc2的丧失与细菌定植的减少,以及幽门螺杆菌感染期间促炎性标志物的整体上调和更严重的胃炎性病理有关。在体内感染过程中随时间变化的Plxdc2动态变化和胃微环境的变化,提示了影响抗菌和整体免疫反应的其他信号传导机制。而且,Plxdc2的损失基于加剧的疾病严重性,炎性细胞因子表达和Plxdc2-/-小鼠更严重的结肠病变,由结肠炎的DSS模型引起的实验性炎症性肠病(IBD)显着恶化。
PEDF在巨噬细胞中已建立的调节作用,以及PLXDC2的细胞位置和靶标可药性的潜力,为选择Plxdc2提供了理论基础,以便进一步使用敲除小鼠进行验证。但是,观察到的动力学Ppp1r3e也支持该基因的调节作用,并鼓励其进一步研究。Ppp1r3e基因编码的蛋白丝氨酸胰岛素调节糖原靶向亚基/苏氨酸磷酸酶1(PP1),参与的几个重要的细胞功能,包括基因表达,代谢和细胞死亡的调节中的蛋白56,57。糖原驱动亚基增加糖原生成,促进糖原合酶活性56。糖原在免疫细胞的代谢相互作用中发挥作用 58。树突状细胞在免疫反应启动过程中以糖原为燃料 58。糖原代谢的缺乏改变了树突状细胞的适当活化58。活化的巨噬细胞,与葡萄糖转运蛋白GLUT1的过表达和葡萄糖消耗的增加,上调了糖原合成 59。因此,通过调节糖原代谢, Ppp1r3e可能会调节免疫细胞的激活。
总之,本研究描述了一种新的方法,该方法可鉴定具有理想的调节和免疫代谢作用的候选治疗靶标。用于候选人选择的主要标准是(1)与幽门螺杆菌生长阶段一致的早期上调;(2)在PPARγ缺陷型BMDM中表达减弱。尽管我们不能排除时程数据集中存在表达动力学不同的调节基因,但我们的管道设计用于对具有这些属性的基因进行排序。虽然确定了5个新靶标,但初步的验证研究支持Plxdc2和Ppp1r3e这两个基因具有调节免疫和宿主反应的巨大潜力。进一步的体内功能丧失研究证实了Plxdc2幽门螺杆菌感染和IBD小鼠模型中,其调节功能及其塑造宿主免疫应答的能力。因此,我们的筛选平台可以为鉴定新型治疗靶标提供新的见解,从而调节免疫应答。作为新药开发计划的一部分,这些新颖的靶标可推动下一波针对自身免疫性疾病的一流疗法的发展。
材料和方法
动物住房和伦理声明
使用6至10周大的C57Bl / 6J野生型(WT),PPARγfl / fl,LysCre +(PPARγ缺陷)和Plxdc2-/-小鼠进行了这些研究。通过将PPARγfl / fl繁殖到Lys-Cre小鼠中来产生PPARγ缺陷小鼠,以产生在髓样细胞中缺乏PPARγ的小鼠。Plxdc2-/-是全身敲除。饲养所有小鼠,并在通风条件下并在12小时光照周期下饲养在同一菌落中。用CO 2对小鼠实施安乐死继发颈椎脱位是继发性麻醉的辅助方法。所进行的所有实验程序均得到机构动物护理和使用委员会(IACUC)的批准,达到或超过《公共卫生服务/国家健康与动物福利协会法》的要求,并根据批准的指南和规定进行。
骨髓巨噬细胞(BMDM)的分离和培养
如先前所述[ 60]分离出骨髓源性巨噬细胞(BMDM)。简而言之,从安乐死小鼠的无菌股骨和胫骨中冲洗出骨髓(BM)。渗透裂解用于去除红细胞。在补充了25 ng / mL重组蛋白的cRPMI(RPMI 1640、10%胎牛血清,2.5%Hepes,1%丙酮酸钠,1%1-谷氨酰胺,1%青霉素/链霉素和50 uMβ-巯基乙醇)中对样品进行区分。小鼠巨噬细胞集落刺激因子(M-CSF)在37°C,5%CO 2和95%湿度下。在第3天,加入补充了M-CSF的新鲜培养基。在第6天,收获BMDM。将细胞重悬于cRPMI中,并在37℃,5%CO 2和95%湿度下粘附过夜。
幽门螺杆菌的培养和接种物的制备
这项研究是使用幽门螺杆菌 SS1和PMSS1菌株进行的。幽门螺杆菌在微需氧条件下于37°C的Difco Columbia血琼脂平板中培养,该平板中添加了7%的Horse Laked血液和幽门螺杆菌选择性补充剂(5 mg万古霉素,2.5 mg甲氧苄啶,2.5 mg头孢磺啶和2.5 mg两性霉素B)。对于体内接种物制备,将幽门螺杆菌收获于1×PBS中,并调节至2.5×10 8个菌落形成单位(cfu)/ mL,这对应于600 nm波长下的最佳密度(OD)为1.2。为了进行体外接种,将幽门螺杆菌收获在无抗生素的cRPMI中,并调整为1×10 8 如上所述的cfu / mL。
庆大霉素保护测定
洗涤BMDM细胞,并将新鲜的无抗生素的cRPMI加入板中。在MOI 10时用幽门螺杆菌 SS1 感染细胞,并通过快速旋转使其同步以确保立即接触。孵育15分钟后,通过用含有100 ng / mL庆大霉素的PBS / 5%FBS彻底洗涤细胞,杀死未内在化的细菌。洗涤时间为0的细胞并立即收集用于下游测定。在剩余时间点(30分钟至12小时)分配的细胞被培养基覆盖,直至收集用于下游分析。
从BMDM和胃中分离细菌
BMDM用无菌1×PBS洗涤3次。使用细胞刮刀在200μLBrucella肉汤中分离细胞。将细胞悬浮液超声处理5秒钟以释放细胞内细菌。将胃收集在200μLBrucella Broth中,并使用研磨机匀浆。
将原始匀浆的连续十倍稀释液(来自胃或BMDM)铺在上述幽门螺杆菌平板上。培养4天后计数菌落。
基因表达
在冰冷的RLT(补充有β-巯基乙醇)中收集BMDM细胞。纵向切开胃,在1×PBS中冲洗两次,并保存在RNAlater中。按照制造商的说明,使用RNeasy mini试剂盒(Qiagen)从BMDM和胃中提取总RNA。在Nanodrop上定量RNA浓度。使用iScript cDNA合成试剂盒(Bio-Rad)从RNA样品生成cDNA。通过使用Taq聚合酶通过PCR产生的已知浓度的纯化引物特异性扩增子进行一系列稀释,生成标准曲线。使用CFX96热循环仪和SYBR Green Supermix(Bio-Rad)通过定量实时PCR(qRT-PCR)评估总基因表达水平。β-肌动蛋白表达被用来归一化靶基因的表达水平。
全局转录组测序
在感染后0、30、60、120、240、360和720分钟的时间点从WT和PPARγ缺陷型BMDM中分离出的RNA提交用于使用Illumina Hiseq进行全转录组基因表达分析。一旦收到包含100 bp长对末端读段的fastq文件,质量差的读段(PHRED得分<10的碱基> 40%; N大于5%的N的百分比; polyA读段)被排除。通过使用参数设置为'-l 25 -I 1 -X 1,000 -a -m 200' 的Bowtie 61(版本:1.0.0),将其余读数映射到RefSeq(来自https:// genome的mm10)。 ucsc.edu/)。为了计算基因表达水平,我们使用了基于期望最大化算法的程序RSEM 62。FPKM 63(每千个测序读段的每千碱基片段数)用作表达水平的量度。数据已提交到NCBI的GEO数据库(登录号GSE67270)。
生物信息学分析
如图3C中所述, 生成了与所选的NLR和PPAR候选物连锁的基因的初始数据集。组织中基因网络的基因组规模综合分析(GIANT)和基因表达综合(GEO)数据库被使用并整合到Ingenuity Pathway Analysis(IPA)软件中,以建立最初的基因组。使用基于层次的聚类来获得组合的初始NLR和PPAR基因内的差异表达模式,并生成链接的数据集。该hclust使用Ward最小方差法和R中的Manhattan距离度量法对数据进行聚类。为了获得更多具有相似目的模式的基因,进行了另一个聚类循环。使用Pubmatrix工具增强了生成的数据集的新颖性,并获得了最终的基因数据集。
基因沉默和BMDM刺激
WT和PPARγ缺陷的BMDM用Lipofectamine RNAiMax转染试剂(Thermo Fisher Scientific)转染20 nM siRNA(27mer Dicer-底物siRNA,DsiRNA)作为靶基因或加扰序列作为阴性对照(Integrated Device Technology)。感染。转染后6小时更换培养基。基因敲低通过qRT-PCR验证。
为了诱导促炎环境,将BMDM用大肠杆菌 LPS(100 ng / mL)和rIFNγ(100 ng / mL)预处理过夜。对于LPS刺激,将BMDM用大肠杆菌LPS(100ng / mL)处理6小时。
体内幽门螺杆菌感染
在第0天和第2天,通过经口胃管向8至10周大的WT,PPARγ缺陷型和Plxdc2-/-小鼠施用200μL新鲜制备的5×10 7 cfu H. pylori SS1或PMSS1在1×PBS中的溶液。 。还包括一个未感染的组,该组接种了200μL不含细菌的1×PBS。每周监测小鼠的疾病迹象,并在感染后第28天收集胃样品。
胃淋巴结(GLN)分离和离体培养
切下GLN,并在补充胶原酶和DNAse的RPMI培养基中于37°C进行酶消化1小时。将2×10 5个细胞铺在96孔板中,并用5 ng / mL灭活的SS1抗原刺激。将样品在37°C 5%CO 2 95%湿度下孵育72小时。收集上清液,并按照制造商的说明使用细胞因子微珠阵列(BD Biosciences)分析分泌的细胞因子谱。
葡聚糖硫酸钠(DSS)结肠炎诱发的模型
对8至10周大的WT和Plxdc2-/-小鼠在饮用水中用8%DSS(Fisher)攻击7天,以诱发结肠炎。每天通过体重变化和评估疾病的临床体征来监测小鼠。在DSS攻击后第7天对小鼠实施安乐死。
细胞分离和流式细胞仪分析
打开切除的结肠和胃,用1×PBS冲洗。将组织在补充胶原酶和DNAse的RPMI培养基中于37°C搅拌孵育1小时。通过Percoll梯度纯化样品。收集对应于白细胞的中间层并将其铺在96孔板中用于免疫表型分析。如上所述获得了来自GLN的单细胞悬液。然后将样品首先与Fc阻断物一起孵育,然后与针对细胞外标记物的荧光染料偶联的抗体混合物进行孵育,这些抗体包括CD45,CD3,CD4,CD8,NK1.1,CD11b,CD64,F4 / 80,CD103,CD11c,MHC II,Ly6G ,Ly6C。然后将样品与链霉亲和素-得克萨斯红一起温育以进行二次染色。固定样品并使其通透(eBioscience),并与胞内荧光染料偶联的抗TNFα抗体孵育。
组织学分析
切除并清洁的结肠和胃固定在10%福尔马林中。结肠和胃切片用石蜡包埋,并用苏木精和曙红(H&E)染色。使用奥林巴斯显微镜检查载玻片。图像是通过Olympus CellSens Entry成像软件获得的。
统计
数据表示为平均值,平均值的标准误以误差线表示。为了计算RNAseq数据集的显着性,将所有样本中中位表达水平大于0的所有基因都包括在3向(基因型,治疗和时间)ANOVA分析中。使用正常分位数转换(来自R 64的qqnorm )对FPKM进行归一化,以适应ANOVA的正态性假设(使用Kolmogorov–Smirnov检验进行了测试)。R 64中进行了三向方差分析,FDR 65和Bonferroni用于计算调整后的P值。为了确定标准数据的重要性,使用SAS(SAS Institute)中的常规线性模型程序进行了方差分析(ANOVA)。重要性在P ≤0.05和显著差异鉴定有星号(基因型)或井号(感染或治疗)。
|
|