败血症早期检查肠道超微结构,肠壁细胞凋亡和紧密连接
摘要
肠道通透性过高可能由肠道上皮细胞凋亡或紧密连接的状态,通透性或孔隙度改变引起。该项目旨在阐明败血症早期的这些机制。将十八只雄性野生型小鼠随机分为两组。干预前30分钟,所有小鼠均接受一次单管饲的异硫氰酸荧光素(FITC)葡聚糖。一组(n = 10)进行盲肠结扎和穿刺以引起败血症。另一组(n = 8)是假手术。败血症动物术后8 h FITC的通透性显着增加。血清白细胞介素-6,肿瘤坏死因子-α和白细胞介素-1-β的确诊证实为败血症。化脓动物显示出回肠和结肠样本的肠壁明显发炎。PCR显示,claudin-2的表达显着增加,而claudin-4,紧密连接蛋白-1和occludin-1的表达降低,类似于紧密连接的通透性增加。但是,这些改变不能在蛋白质水平上得到证实。光镜检查显示败血动物肠上皮细胞(IEC)基底部分的细胞间空间明显扩张,这在电子显微镜(TEM)中紧密连接和粘附连接水平的细胞间空间增加证实了这一点。在小角度X射线散射中,肠壁中未显示出纳米孔的数量或大小增加。回肠样品的HOECHST染色和PCR检测细胞凋亡标记物证明两组之间肠上皮细胞凋亡无相关差异。
介绍
尽管最近在重症监护医学方面取得了进展,脓毒症仍然代表着全球范围内的重大医疗保健问题。在美国,每年有80万以上的患者患有败血症,并且每年有23万至370,000的患者死于这种疾病1。
肠壁代表了人体最重要的功能屏障之一。肠上皮细胞(IEC)形成其最内层,并在肠屏障功能2中起主要作用。该屏障可以作为一个选择滤波器允许同时阻止细菌和进入循环及其毒素的营养物质,电解质和液体反式和旁转运3,4。脓毒症中屏障功能的破坏已有报道,但也有多种其他疾病,例如慢性炎症性肠病,2型糖尿病和肿瘤相关恶病质5。在这些情况下,通透性增加可能是由于紧密连接组件的结构改变或IEC的凋亡引起的6。另外,可以设想IEC体系结构的超微结构更改。过去,许多研究项目都致力于采用各种方法来研究肠壁屏障。除其他外,为异硫氰酸荧光素葡聚糖(FITC-葡聚糖),电子显微镜,常规组织学,免疫组织化学和紧密连接部件的定量分析的渗透性进行了说明 7,8。但是,这些技术都无法提供有关IEC超微结构的详细信息。
小角度X射线散射(SAXS)是一种用于材料科学9中超微结构分析的无损实验方法。样品被X射线束击中,而该束的主要部分不受干扰地通过样品,但一小部分散布在不同密度的区域,例如脂质双层和细胞质10之间的边界。SAXS已被用于研究各种生物材料11,12,13,14包括软组织9,14,15,16。但是,到目前为止,SAXS尚未用于评估败血症期间肠壁的纳米结构改变。
因此,本实验研究的目的是结合使用多种材料表征技术(例如SAXS,光和电子显微镜)来研究败血症早期肠壁的超微结构。此外,我们试图研究导致肠道通透性过高的机制(紧密连接的状态和组成,上皮细胞凋亡或细胞结构改变)。
材料与方法
从Harlan实验室以7周龄获得了18只雄性C57Bl / 6小鼠。分娩后,小鼠习惯于新的环境1周。这些动物在任何时候都可以自由进食和饮水,并经历了12小时的明暗循环。1周后,将动物按重量分成两组。所有动物都在相同的居住条件和相同的架子上饲养。给两组小鼠管饲饲喂溶于50mg / ml PBS河豚的500mg / kg FITC-葡聚糖(Sigma Aldrich Handels GmbH,维也纳,奥地利)。灌胃后三十分钟(n = 10),用0.05 mg / kg芬太尼,5 mg / kg咪达唑仑和0.5 mg / kg meditomedine麻醉败血症组的动物(n = 10)。在温度控制下,将小鼠剃毛并消毒皮肤。小鼠接受正中剖腹术并盲肠结扎并穿刺(CLP)。17。在双层闭合伤口后,用2.5mg / kg阿替哌唑和0.5mg / kg氟马西尼拮抗麻醉。对照组(n = 8)的动物进行了假手术,包括全身麻醉,正中剖腹手术,盲肠外在化和盲肠和腹部闭合的减少。术后两组动物均接受0.1 mg / kg皮下丁丙诺啡镇痛治疗。根据政府兽医委员会的要求,使用标准化的评分系统对动物的行为进行持续的剧烈疼痛或不良事件监测(补编 1)。
灌胃FITC-葡聚糖后八个半小时,将小鼠重新麻醉。用23 G针刺穿心脏,并收集血液。然后通过颅颈错位处死小鼠。打开腹部以解剖4 cm末端回肠(从回盲肠瓣口开始1 cm)和4 cm结肠(从回盲瓣尾管开始1 cm)。
炎性细胞因子
用Millipore MerckLuminex®试剂盒(MMHMAG-70 K,Merck Chemicals and Life Science GmbH,维也纳,奥地利)测定血清中的促炎细胞因子,该试剂盒专门针对白介素(IL)-1α,IL-1β,IL-6 ,肿瘤坏死因子(TNF)-α和干扰素(INF)-γ。根据制造商的说明进行测量。
FITC-葡聚糖测定肠通透性
凝结30分钟后,将血液以10,000 rpm离心10分钟。将150μl上清液血清在4°C的绝对黑暗中保存,直到测量。如制造商的说明书中所述,在485nm和535nm的波长下通过荧光法测定血清FITC-葡聚糖含量。
回肠和结肠样本的光学显微镜
回肠和结肠样品经过固定,脱水,包埋,切割,补液后再进行苏木精-伊红染色,然后进行标准的组织学检查。从三个回肠(100×,200×和400×)以每个回肠和结肠样本的三个切片进行肠壁炎症的组织学检查。测量包括根据改良的Marsh Oberhuber分类法19确定绒毛高度,隐窝深度和肠壁炎症。另外,使用ImageJ.Ink1.52®在每只小鼠的三个回肠样品的苏木精-伊红染色中,用100×油浸物镜(补充2)确定细胞间间隙的宽度。
常规扫描电子显微镜(CSEM)
在每只动物的反肠系膜侧打开一个回肠和一个结肠。通过用生理盐水仔细冲洗来除去肠内容物。然后将样品在5%的戊二醛缓冲液中于4°C固定2 h。用1%的四氧化固定后,将样品按递增的酒精系列进行脱水。将脱水后的样品浸入1,1,1,3,3,3-六甲基二硅氮烷中,并用Edwards ScancodeSix®(Hind High Vacuum Company Private Limited,印度班加罗尔,印度)涂覆的金涂覆2分钟。SEM使用Quanta FEG 250(Thermo Fisher Scientific)电子显微镜进行,使用20 kV束进行。用xTm4.1.7.2095®(Thermo Fisher Scientific)拍摄图像。以1,000×的放大倍率从-5°,0°和5°的倾斜角获得了三张图像,并用于用MeX 5进行3D重建。1®(Alicona Imaging GmbH,奥地利Raaba)。这些3D重建的125×200μm区域的表面粗糙度(R使用30μm的截止波长计算a)。
透射电子显微镜(TEM)
与SEM相似,准备1 cm的回肠和1 cm的结肠用于TEM分析。将样品在pH 7.4的0.1 M磷酸盐缓冲液中的2.5%(wt / vol)戊二醛和2%(wt / vol)多聚甲醛中固定2小时,然后在室温下在2%(wt / vol)四氧化中固定2小时。温度。脱水后(在梯度乙醇系列中脱水),将组织浸润(乙醇和琼脂100环氧树脂,纯琼脂100环氧树脂)并置于琼脂100环氧树脂中(8小时),转移到包埋模具中并聚合(48小时)。在60°C时)。用UC 7超薄切片机(Leica Microsystems,Vienna,Austria)切割超薄切片(70 nm厚),并用柠檬酸铅染色5分钟,用铂蓝染色15分钟。使用配备有Ultrascan 1,000 ccd相机(Gatan)的Tecnai G 2 FEI显微镜在120 kV下拍摄图像。检查图像在TJ,粘附连接和桥粒水平的细胞间接触的增宽。使用ImageJ.Ink版本1.52®在每个动物的最宽点进行测量,每只动物至少有10个细胞间接触(补充2)。
小角X射线散射(SAXS)
对于SAXS测量,如上所述,打开并冲洗回肠和结肠的肠样品。将肠样品在KalleBrat®箔(Ed。Haas Austria GmbH,奥地利特劳恩,奥地利)中真空密封,并保存在− 80°C下。SAXS测量是使用Rigaku S-MAX3000 SAXS系统(Rigaku Europe SE,新伊森堡,德国)和Cu-α目标Micro Focus X射线管MM-002 +获得的(电压为45 keV,电流强度为0.88 mA)能量为8.05 keV)。X射线束通过两个无衍射的锗针孔聚焦,从而使样品处的束直径为420 µm。为了保持肠壁的结构完整性,将标本安装在温度可控台上(HFS350X-CAP; Linkam Scientific Instruments,塔德沃思,英国),并在测量过程中保持在− 21°C的温度下。-1。散射矢量q与波长λ(λ= 1.54 A)和散射角2θ有关。
每次测量耗时1,500 s,并且是在真空条件下,最大压力为10-2 mbar的条件下进行的,以最大程度地减少空气的吸收和衍射。为了进行测量,直接光束被3.8 mm的光阑挡住了,并使用TRITON 200 2D多线气体填充X射线检测器(Rigaku Europe SE,新伊森堡,德国)记录了散射轮廓,有效直径为200 mm。
由于肠样品显示出各向同性的散射图案,表明样品中没有优选的结构取向,因此仅散射强度I被确定为q的函数。
为此,使用SaxsGui2.15.01®软件包通过减去背景信号来对2D散射轮廓进行径向积分和校正。然后以双对数标度将散射曲线绘制为I(q)。
在0.1 A -1和0.15 A -1处观察到的明显峰归因于样品中有血液残留而形成的冰晶,因此不在评估之列。SAXS数据的解释主要集中在0.01至0.05 A -1的低q范围内,这归因于12.5-62.8 nm尺寸范围内的结构,对应于紧密连接纳米孔的潜在变化。由于所有图线均在所考虑的q范围内显示直线,因此评估仅限于拟合具有指数描述的分形维数的指数衰减(如Porod定律所述)(其中D表示比例因子,α表示porod指数)。
该方程式是在Python 2.7脚本中实现的,目的是评估所有样本的分形维数。
双对数Porod图的斜率α产生有关散射图的分形维数的信息。因此,通过刚性杆的散射可以得到Porod指数α= 1,而α= 2则表示来自扁平(几乎二维)结构(例如薄片或薄片)的散射,α= 4表示光滑,斜率在3和4之间粗糙的表面。
荧光免疫组化用于IEC凋亡
进行HOECHST染色以确定回肠切片的凋亡小肠上皮细胞的比例。根据标准组织学程序进行固定和石蜡包埋。将2.5μm厚的石蜡切片浸入Roticlear溶液(Carl Roth GmbH + Co. KG,卡尔斯鲁厄,德国)中,然后浸入2×100%乙醇,70%乙醇,50%乙醇,蒸馏水和PBS缓冲液中,每次5分钟。通过用蒸馏水将25 mg原始培养基(HOECHST B2261-25MG,Lot 017K4122,Sigma Aldrich Handels GmbH,维也纳,奥地利)稀释至5μg/ ml的浓度来制备HOECHST工作溶液(HOECHST溶液的吸收频率为350 nm和消光频率461 nm)。将样品转移到Hoechst工作溶液中(在绝对黑暗中浓度为5μg/ ml,持续10分钟)。然后将切片在PBS河豚中清洗3次,转移至载玻片(Thermo Scientific)上,并用Vectashield®封固剂(Vector Laboratories LTD,Peterborough,UK)和Menzel盖玻片(Gerhard Menzel GmbH,不伦瑞克,德国)覆盖。显微镜是使用Olympus BX51荧光显微镜和Olympus DP71相机使用Cell sens标准程序进行的。拍摄了一张灰度照片并将直方图调整为10–125。获得了绿色和红色的假彩色图像,以供进一步检查。每个标本选择两个代表性区域,每只小鼠评估两个标本,放大倍数为200×(每视野约150个肠上皮细胞)。确定凋亡细胞比率为凋亡核相对于肠上皮细胞总数的百分比。
紧密连接和凋亡蛋白RNA基因表达
在回肠切片中进行实时定量PCR,以检测肠的通透性。根据文献先前的报道18选择标记(紧密连接蛋白1,occludin-1,claudin 2和claudin 4)。使用Qiagen miRNeasy Micro试剂盒(Qiagen,德国希尔登,德国),经DNAse处理(Qiagen,德国希尔登,德国),根据制造商的说明,从冷冻的小鼠回肠片段中分离出总RNA。在NanoDrop 2000c分光光度计上定量RNA产量。对于逆转录,根据制造商的说明,在High Capacity cDNA逆转录试剂盒(ThermoFisher Scientific)中使用1 µg总RNA。
cDNA用作BioRad CFX 384实时PCR检测系统中定量RT-PCR反应的模板,其检测方法包括β-肌动蛋白(Actb; Mm00607939_s1),羟甲基胆烷(Hmbs; Mm01143545_m1)作为管家基因。选择紧密连接蛋白1(TJP-1; Mm00493699_m1),occludin-1(OCLDN-1; Mm00500912_m1),claudin 4(CLDN-4; Mm00515514_s1)和claudin 2(CLDN-2; Mm00516703_s1)作为紧密连接蛋白评价。此外,选择了Bax(Bax; Mm00432051_m1),Bad(坏; Mm00432042_m1),Caspase 3(Casp3; Mm0195085_m1),Lamin B1(Lmnb1; Mm0521949_m1),Bak1(Bak1; Mm00432045_m1)和Bcl2(Bcl2)字符(选择Bcl2);细胞凋亡(ThermoFisher Scientific)。
简而言之,在10 µl反应中,将4 µl cDNA一式三份,与5 µl TaqMan Genexpression MasterMix(ThermoFisher Scientific),0.5 µl测定法和0.5 µl dH 2 O 进行PCR反应。 2分钟,酶在95°C激活10 s,然后在95°C变性40个循环15 s,并在60°C退火和延伸1分钟。β-肌动蛋白和Hmbs基因用作管家基因进行标准化。
紧密连接蛋白ELISA
除PCR外,还对回肠样品的claudin 2(ABIN1745307;antikörperonline.com),claudin 4(ABIN1745294;antikörperonline.com)和occludin-1(ABIN773507;antikörperonline.com)进行了ELISA。所有测量均根据制造商的说明从组织匀浆中进行。
统计
数据是在Microsoft Excel2016®电子表格中收集的。为了进行统计分析,将数据传输到SPSS22.0®。图形成像使用GraphPad Prism7®进行。标称和有序数据以数字和百分比形式显示,度量数据以中位数和四分位间距(IQR)显示。使用Mann–Whitney-U-Tests对独立组进行比较。进行了Pearson测试以搜索不同参数之间的相关性。P值<0.05被认为是统计学上的显着差异。
道德认证
所有描述的方法均根据相关指南和法规进行,并获得兽医委员会的批准(奥地利联邦教育,科学与研究部,BMWFW 66.010 / 0028-WF / V / 3B / 2017)。
结果
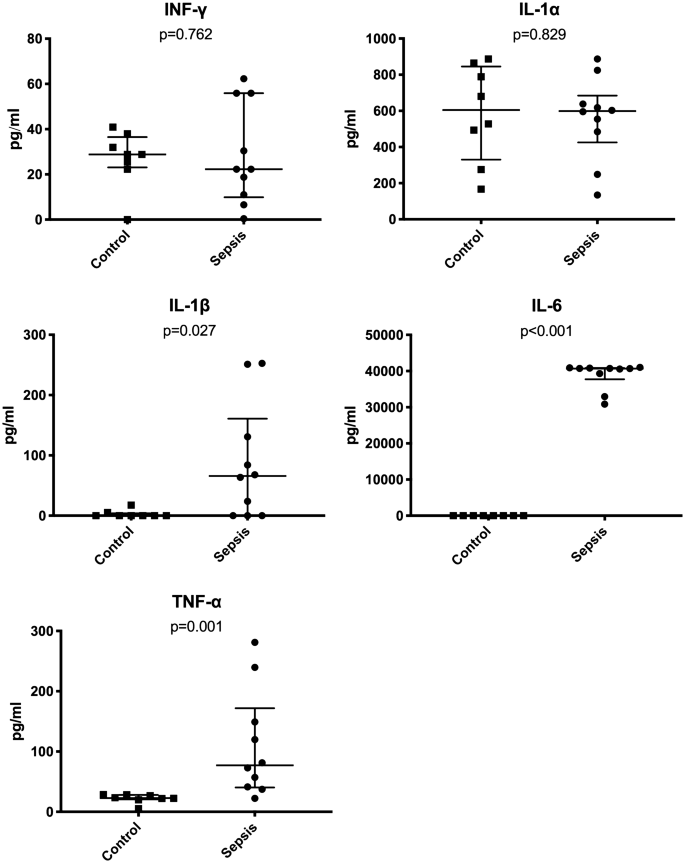
所有动物的临床败血症评分均显示在附录1中。脓毒症导致血清中IL-1β水平显着升高(对照中位数2.9,IQR 4.0与败血症中位数65.8,IQR 161.0; p = 0.027),IL-6(对照中位数12.4,IQR 9.6与败血症中位数40,704.8,IQR 3,130.3; p <0.001)和TNF-α(对照中位数23.0,IQR 7.5,败血症中位数77.1,IQR 131.5; p = 0.001)(图 1)。INF-γ和IL-1α不变。然而,败血症动物的FITC-葡聚糖的肠道通透性显着增加(对照中位数为1.2,IQR 0.7,败血症中位数为18.1,IQR 78.0; p <0.001)。
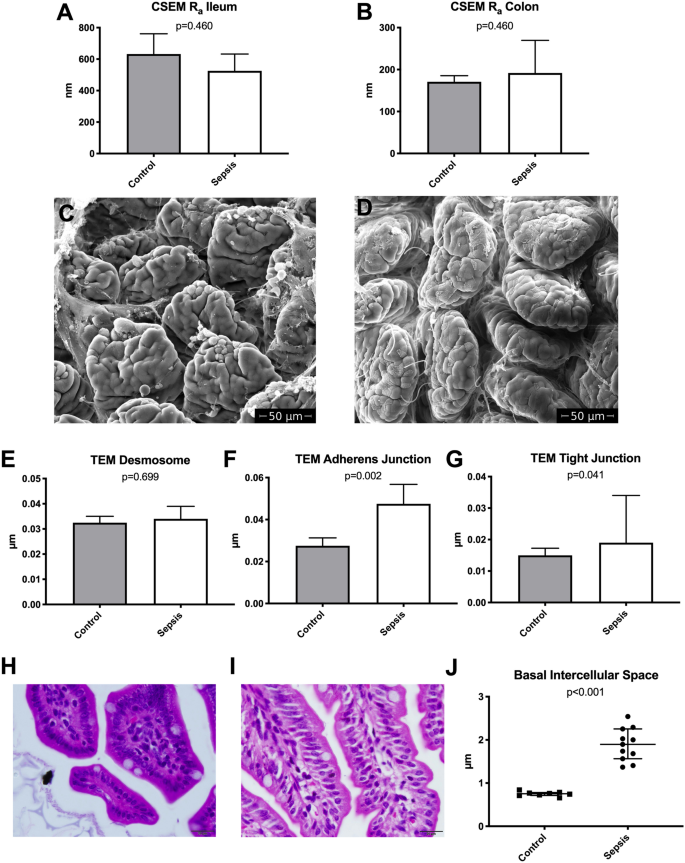
光学显微镜显示脓毒症动物在IECs的基础水平上细胞间隙显着增加(图 2)。
传统的扫描电子显微镜在回肠和结肠样品中均未显示两组之间的任何明显差异(图 2)。与两组相比,表面粗糙度(R a)值没有统计学上的显着差异(图 2)。有关紧密连接,粘附连接和桥粒的TEM图像的详细分析显示,紧密连接和粘附连接水平的细胞间距离显着增加,但在桥粒区域却没有(图 2)。对照组中的微绒毛长度中位数为1.21 µm(IQR 24),败血症组中位数为1.21 µm(IQR 20)(p = 0.583)。
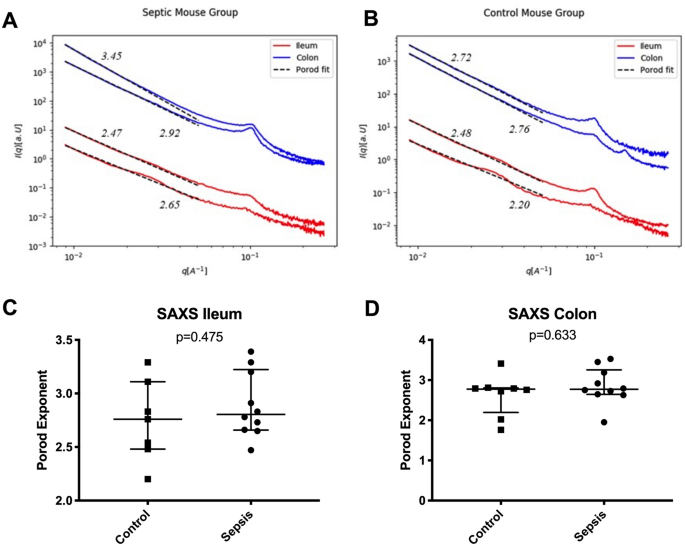
图 3描绘了SAXS测量的结果,两组的Porod指数没有统计学上的显着差异。
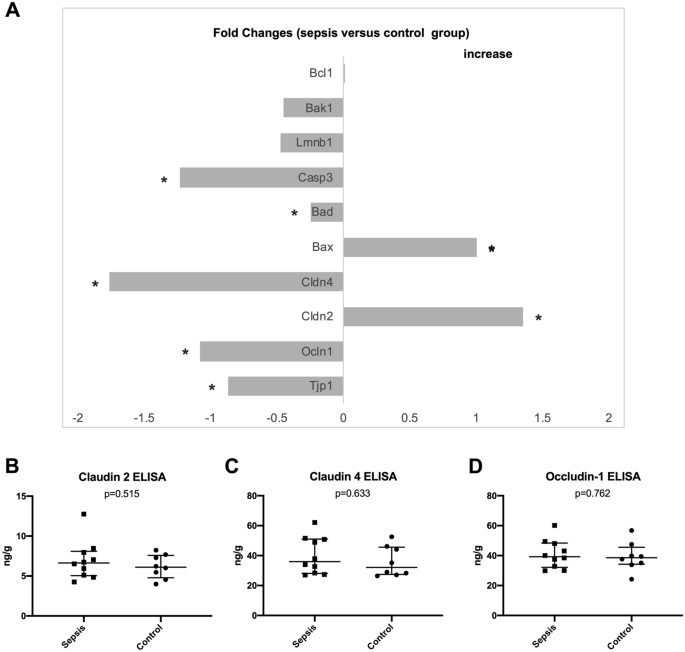
回肠样品的紧密连接蛋白基因表达分析表明,CLP导致CLDN-2,CLD-4,TJP-1和OCLN-1的表达显着增加(即,较低的校正Ct值)和减少的表达(较高的校正Ct值)(图 4和补编3)。但是,回肠样品的ELISA测量不能在蛋白质水平上证实这些发现(claudin 2,claudin 4和occludin-1的差异无显着性)。
两组之间通过HOECHST染色评估的凋亡率无显着差异(对照组中位数2.8,IQR 3.1,脓毒症组中位数1.8,IQR 3.2; p = 0.573)。在脓毒症动物中,凋亡基因表达显示Bad和Caspase 3表达显着降低,而Bax表达显着升高(图 4)。
传统的H&E染色光学显微镜显示,回肠(对照中位数0.1,IQR 0.4 vs败血症中位数1.3,IQR 0.8; p = 0.003)和结肠(对照中位数0.1,IQR 0.4 vs.败血症中位数1.9,IQR 0.6; p <0.001)样本。在回肠和结肠样品中,绒毛高度(VH),隐窝深度(CD)或VH:CD比没有统计学上的显着差异。回肠样品的H&E染色还显示,在IECs的基础水平上,细胞间距离显着增加(图 2)。
相关分析
相关性分析显示FITC-葡聚糖水平与细胞因子IL-6(系数0.520; p = 0.027)和TNF-α(系数0.635; p = 0.005)以及OCLN-1(系数0.649; p = 0.004),在TJ水平的细胞间距离(系数0.679; p = 0.015),但对于R a或Porod指数则不是。
讨论区
本研究调查了CLP引起的败血症对表征回肠和结肠肠壁完整性的不同参数的影响。如本研究应用盲肠结扎和穿刺是诱导多种微生物腹部败血症行之有效的方法17,20,21,其是由促炎性细胞因子IL-1β的血清水平显著增加证实,IL-6和TNF-α中电后八小时。
败血症与肠屏障功能的破坏导致增加的肠渗透性有关5,21。我们能够通过化脓性动物血清FITC-右旋糖酐水平的增加来证明这种破坏。FITC-右旋糖酐管饲,CLP和安乐死之间的时间点是根据旨在调查败血症21早期阶段的文献中的其他报道选择的。
各种不同的机制可被假设为败血症期间底层原因肠屏障功能障碍包括上皮细胞凋亡,紧密连接组成的变化6,21和肠壁的纳米结构上的改变。在以前的报道中,发现肠道小肠上皮细胞凋亡增加和绒毛萎缩是导致败血症小鼠在24、48和72 h 20后FITC-右旋糖酐通透性增加的原因。相反,在我们的实验中,HOECHST染色显示回肠样品中肠上皮细胞凋亡没有明显增加。凋亡基因表达结果不同。在脓毒症动物中促凋亡Bax的表达显着增加。同时,这些动物中促凋亡的Bad和Caspase 3的表达显着降低。但是,校正后的Ct值显示所有研究基因的折叠变化低于1.5。因此,PCR结果对于某些基因是重要的,但是生物学相关性值得怀疑。与其他报道相比,我们实验中CLP和安乐死之间的时间间隔相对较短,这似乎是导致细胞凋亡率低的最可能原因。同样,
肠道通透性增高的另一可能的机制与增加孔隙度紧密连接的变化在脓毒症动物20,21。在这方面,我们可以证明claudin-2(CLDN-2)的表达显着增加,而紧密连接蛋白1(TJP-1),occludin-1(OCLN-1)和claudin-4(CLDN)的表达降低-4)在败血性小鼠的回肠样品中。关于倍数变化,只有claudin-4的水平高于1.5(比较图 4))。这些发现与肠壁炎症显着增加同时存在,其特征是CLP后回肠和结肠样品中改良的Marsh Oberhuber评分提高,败血症动物中回肠样品的TJ和AJ宽度与对照动物相比有所增加(比较图 2)。
细胞超微结构的改变可能代表与败血症相关的肠通透性过高的另一个原因。然而,文献中缺乏有关败血症中肠样品超微结构分析的数据。仅有少数研究将小角度X射线散射(SAXS)应用于有机组织的超微结构分析。在软组织上进行过去的实验主要集中乳腺组织15,16,22。但是,SAXS尚未用于实验性评估脓毒症时肠壁的超微结构。在本研究中,我们无法发现对照动物和败血症动物之间细胞超微结构的变化(如SAXS所评估)。与描述局部和独特特征的显微镜技术不同,SAXS产生由光束照射的样品体积的平均纳米结构参数。因此,由于光束中的每个纳米级物体都有助于产生整体可检测的散射信号,因此对于研究大量出现在辐照体积中的纳米结构特征特别有用。此外,该方法的优点在于无损性质和在水合的软组织上使用它的可能性。如果败血症伴有肠通透性过高,-1。但是,这在我们的结果中不可见。另外,孔径的大范围分布可能会使肩膀消失(信号涂抹),但根据幂定律拟合确定的分形尺寸变化仍应可见。因此,我们建议败血症早期的肠通透性与大量纳米孔的形成和高密度无关。
同样,我们用来检查败血病小鼠肠样本的CSEM也无法揭示结构变化。用CSEM分析肠表面,选择表面粗糙度作为组比较的参数。败血症诱导后8 h,我们无法确定各组之间的表面粗糙度变化。细胞间接触的分析显示,在H&E染色中,在败血症动物的IECs基础水平上,细胞间空间增加。在第一种观点上,似乎细胞间的接触没有改变(特别是在TJ级别),更详细的细胞间接触的测量显示,在TEM图像中,败血症动物的细胞间空间显着扩张,处于粘附和紧密连接的水平。
本研究的局限性包括我们仅评估了CLP后8 h败血症的早期阶段。然而,先前的研究表明,尽管脓毒症发作后6至48小时肠道通透性升高,但在脓毒症21诱导后6至12小时之间达到峰值。此外,我们不能排除在显微镜下评估的参数方面不同肠段的区域异质性。
总之,本研究强调在实验性微生物败血症的早期肠壁通透性最高可能是由细胞间接触(AJ和TJ)的改变引起的,而不是由细胞凋亡或肠上皮细胞的纳米孔的大小或数量增加引起的。
|
|