使用CRISPR / dCas9表观遗传编辑技术抑制神经细胞中PTEN的转录
使用CRISPR/dCas9表观遗传编辑技术抑制神经细胞中PTEN的转录
损坏成年哺乳动物的中枢神经系统(CNS)后,存活的神经元再生和恢复功能连接的能力有限。PTEN的有条件遗传删除会导致CNS轴突再生强劲,而短发夹RNA(shRNA)抑制PTEN则可提高再生能力,但程度较轻,这可能是由于使用此方法的PTEN mRNA敲除效果欠佳。在这里,我们采用了CRISPR / dCas9系统来抑制神经细胞中的PTEN转录。我们针对PTENdCas9的近端启动子和5'非翻译区与阻遏蛋白Krüppel-associatedbox(KRAB)融合。在带有一种CRISPR指导RNA(gRNA)的慢病毒载体中递送的dCas9-KRAB 在人细胞系模型和源自人iPSC的神经细胞中实现了有效的和特异性的PTEN抑制,并在PTEN启动子处诱导组蛋白(H)3甲基化和脱乙酰化。dCas9-KRAB系统优于四个靶向PTEN转录本的shRNA的组合,PTEN转录本是先前用于CNS损伤模型的构建体。CRISPR系统在抑制大鼠神经c来源的PC-12细胞中的Pten方面也比shRNA更加有效,并在神经生长因子刺激后增强了神经突向外生长。PTEN CRISPR / dCas9表观遗传编辑沉默可能为中枢神经系统创伤后促进轴突再生和功能恢复提供新的选择。
介绍
身体创伤,中风或慢性神经退行性疾病对中枢神经系统(CNS)功能的毁灭性后果很大程度上是由于缺乏有效的修复机制以及损伤后无法再生神经回路所致。炎症改变,CNS髓磷脂,神经胶质瘢痕组织和胞外指导线索的损失的击穿都有助于抑制性环境,对轴突再生不利地影响1,2,3。这些胞外抑制因子扰动,具有支持性神经营养因子的外源给药一起可以提高轴突再生损伤后在一定程度上4,5。然而,成熟CNS神经元也有在其适应的环境营养因子和目标无关的存活和轴突扩展相关的能力固有局限性6,7,8。
各种转录因子和细胞内信号传导蛋白已经牵连在CNS神经元这一损失的固有生长的能力8,9,10,11。特别地,雷帕霉素(mTOR的)途径的磷酸肌醇3-激酶(PI3K)/哺乳动物靶标起着损伤后影响细胞存活,蛋白质合成和必要的轴突延长细胞骨架的形成至关重要的作用(图 1 A)12,13,14,15,16。Cre驱动的PI3K / mTOR途径主要拮抗剂PTEN(磷酸酶和张力蛋白同源物)的缺失生产)中的轴突再生显着改善CNS损伤后小鼠两侧装接loxP 17,18,19,20,21,22。有条件的遗传缺失PTEN在CNS神经元提高在两个视网膜神经节细胞神经元存活和长途再生17,18和皮质神经元19。重要的是,当轴突再生是显著改善PTEN是脊髓损伤后不久进行删除,也达1年后20,21。PTEN 因此,抑制是改善受损中枢神经系统中轴突再生的有前途的策略。
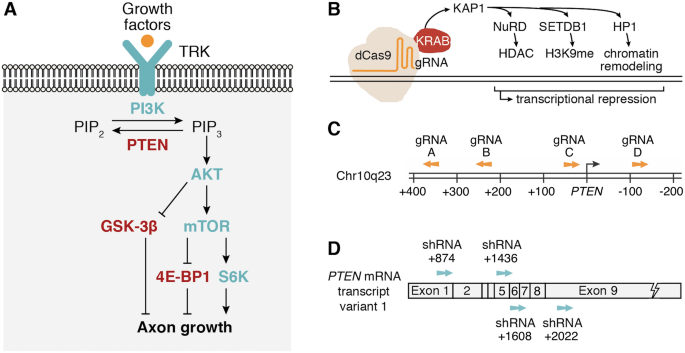
用于PTEN抑制的CRISPR和shRNA系统的设计。(A)调节CNS损伤后轴突再生的细胞内信号传导途径。生长因子激活酪氨酸受体激酶(TRK),导致PI3K将PIP 2转换为第二信使PIP 3。PIP 3的积累导致AKT / mTOR途径的激活和下游信号蛋白GSK-β,4E-BP1和S6K的调节,以促进轴突的生长。PTEN通过将PIP 3转化为PIP 2来抑制该途径,从而抵消了PI3K活性,减少了轴突的生长。(B)化脓性链球菌具有KRAB阻遏物结构域C端融合的dCas9被gRNA导向DNA靶位点。KRAB招募了KAP1,后者与核酸酶重塑和脱乙酰基酶(NuRD)复合体结合用于组蛋白去乙酰化(HDAC),组蛋白-赖氨酸N-甲基转移酶SETDB1用于组蛋白甲基化(H3K9me)和异染色质蛋白1(HP1)用于染色质重塑。这些效应子共同促进异染色质形成和转录沉默。(C)PTEN近端启动子和5'非翻译区(UTR)中gRNA靶位点的位置。编号是指PTEN上游或下游DNA碱基对中的距离转录起始位点(TSS)(NM_000314.8)。箭头指示gRNA是靶向正向还是反向DNA链。(D)shRNA靶位点在PTEN转录物中的位置。外显子编号是指PTEN mRNA转录变体1(NM_000314.8)中TSS下游的核苷酸数,但是这些shRNA靶向所有注释的PTEN转录变体。
作为条件基因缺失PTEN利用Cre-LOX重组是不适用的临床,几个小组设计了RNA干扰策略来击倒PTEN成绩单,这可能更适合于临床翻译23,24,25,26。的shRNA靶向PTEN已经由腺相关病毒(AAV)递送至损伤脊髓或视神经,导致其中形成在目标区域的突触远离损伤部位受损轴突的再生一些25,26。然而,在这些研究中,PTEN shRNA仅显示了中等水平的PTEN敲低和轴突再生的程度不如显著与遗传PTEN缺失,可能是由于残余的PTEN表达25,26。可以将PTEN抑制到与基因缺失相似的程度的方法可以为改善对CNS损伤的反应提供有希望的翻译选择。
我们对是否在转录水平上抑制PTEN的表观遗传编辑是否可以提供shRNA PTEN抑制的更有效替代方法感兴趣。最近,群集定期间隔开短回文重复序列(CRISPR)/ CRISPR相关蛋白9(Cas9)的系统的基础的机制的化脓性链球菌中阐明,并随后适于作为基因的新颖可编程工具在哺乳动物细胞中编辑27,28,29。Cas9核酸内切酶通过互补的指导RNA(gRNA)分子定向到靶标基因组位置,在该处切割DNA链。Cas9诱导的DNA双链断裂可用于基因敲除。然而,我们赞成的可逆镇压策略PTEN,这将规避长期永久征收副作用PTEN基因敲除30,31。通过将Cas9的催化结构域突变形成``死''Cas9(dCas9)蛋白,CRISPR系统已经适应转录激活,阻遏和表观遗传编辑,从而与gRNA指定的DNA靶标结合而无需启动双链打破。dCas9已与多种蛋白质融合,这些蛋白质被称为效应子域,当被gRNA 32引导至调控区时,它们会影响转录或编辑表观遗传标记。
我们使用dCas9将转录阻遏物Krüppel相关框(KRAB)定向到PTEN转录起始位点。从天然存在的真核转录因子,并且先前已被稠合至dCas9并靶向调节区,以实现有效的转录抑制KRAB发源33,34,35。KRAB募集KRAB相关蛋白1(KAP1),从而卡合组蛋白脱乙酰酶(HDAC)和组蛋白甲基转移酶(HMTS),以促进异染色质形成(图 1个 B)36,37,38,39,40,41。dCas9-KRAB融合蛋白减少H3K9和H3K27乙酰化,增加H3K9和H3K27三甲基化,和减少在目标区域染色质无障碍42,43,44,并引导到近端启动子和增强时诱导靶基因的转录沉默44,45,46。
我们试图研究是否可以通过使用CRISPR / dCas9-KRAB的表观遗传编辑在CNS神经元中有效沉默PTEN表达。的压制PTEN而无永久基因敲除是这种方法的一个重要优点,因为持续的PTEN损失可能导致神经元肥大等异常30,31,47。这种方法还避免了Cas9核酸酶48触发脱靶诱变和外源DNA整合的风险。我们设计了一个使用dCas9-KRAB抑制PTEN表达的系统,并将CRISPR系统诱导的抑制程度与靶向该基因的四个shRNA进行了比较。PTEN成绩单,以前显示出部分增强视神经再生(图 1 C,D)26。
结果
我们使用CRISPR表观遗传编辑系统研究了人类细胞系模型,神经干细胞和诱导多能干细胞(iPSC)衍生的CNS神经元中的PTEN抑制。我们选择了带有C末端KRAB融合的化脓性链球菌 dCas9,该融合先前已用于内源基因抑制44。我们设计了四个针对人的PTEN近端启动子和5'非翻译区(UTR)的gRNA ,其中两个我们以前用于PTEN 49的转录激活(图 1 C,补充表S1)。根据既定算法50选择gRNA靶位点,以实现最小的预测脱靶活性和最大的脱靶活性。我们将dCas9-KRAB的抑制程度与递送四个靶向PTEN转录物的shRNA所实现的抑制程度进行了比较(图 1 D)。最初,在两种模型细胞类型(人类胚胎肾(HEK)293T细胞系和人类间充质前体细胞(hMPC))中测试了dCas9-KRAB系统和PTEN shRNA,以建立最有效的gRNA,然后在神经系统中实施该系统。细胞。
dCas9-KRAB抑制HEK 293T细胞系和hMPC中PTEN的表达
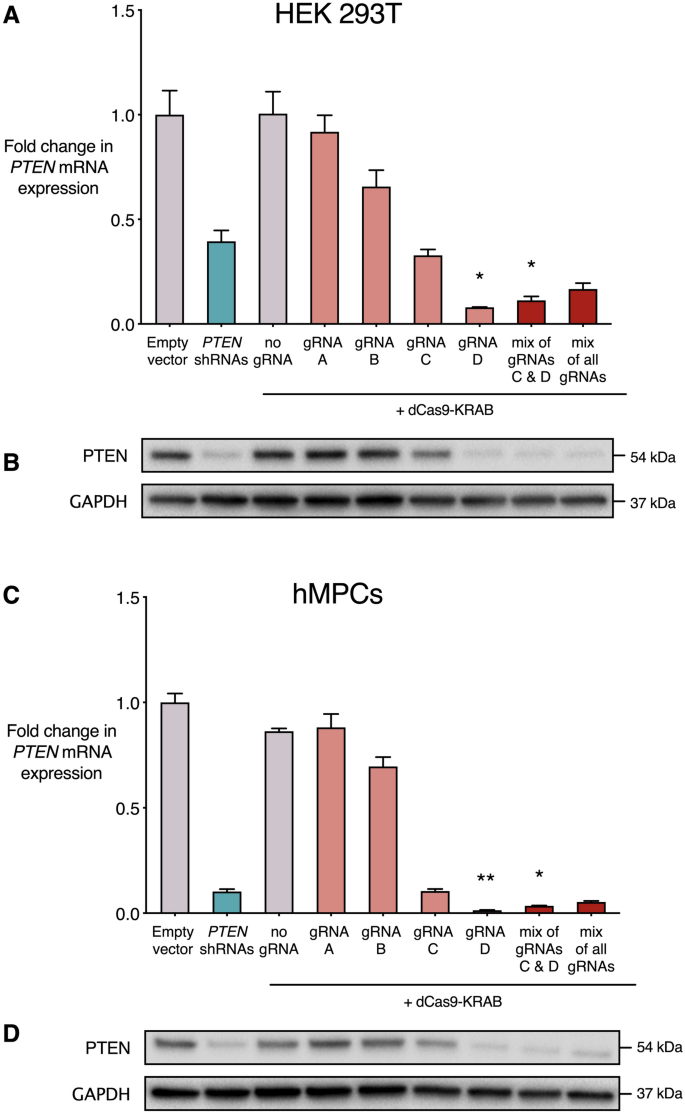
dCas9-KRAB系统和PTEN shRNA通过慢病毒转导进行递送,无需选择转导细胞即可收集和处理细胞群体。dCas9-KRAB不含gRNA或单独的靶向PTEN的 gRNA 。我们还测试了最接近PTEN转录起始位点(TSS)或所有四种gRNA混合的gRNA C和D的联合递送,因为先前的研究表明有时每个靶基因使用多个gRNA可以实现更有效的抑制45,51,52,53,54。进行了qRT-PCR和Western blot评估PTEN mRNA和蛋白表达(图。 2 A,B)。在HEK 293T细胞系中,相对于空载体对照,gRNA D(0.08倍,p <0.05)和gRNA C和D的组合(0.11倍,p <0.05)显着抑制PTEN表达。有趣的是,与四个PTEN shRNA 的组合相比,dCas9-KRAB抑制PTEN的程度更大(0.39倍,p = 0.70)。相对于空载体条件,不含gRNA或任何其他单个gRNA的dCas9-KRAB的递送不会导致PTEN表达的显着变化。Western印迹的结果与mRNA水平上明显的抑制强度相关(图 2)。B)。在hMPC中观察到了这些抑制系统的类似作用。相对于空载体对照,gRNA D(0.01倍,p <0.001)以及gRNA C和D的组合(0.04倍,p <0.001)均显示出显着的PTEN抑制(图 2 C)。qRT-PCR结果中PTEN表达的相对水平反映在Western blot中(图 2 D)。
所述dCas9-KRAB系统阻抑PTEN在HEK 293T细胞系和人类间质前体细胞(hMPCs)。dCas9-KRAB在没有gRNA的情况下稳定表达,单个gRNA靶向PTEN近端启动子和5'非翻译区(UTR),带有gRNA C和D的混合物,或所有四个gRNA的混合物。空载体和靶向PTEN转录本的四个shRNA的组合也通过慢病毒转导稳定表达。(A,C)相对于HEK 293T细胞系(A)和hMPC(C)中的空载体,qRT-PCR 中PTEN mRNA表达的倍数变化。)。* p <0.05,** p <0.01(Kruskall–Wallis检验,使用Dunn的多重比较检验将每个条件与空载体对照进行比较),n = 3,误差线显示平均值的标准误差(SEM)。(B,D)HEK 293T(B)和hMPC(D)中PTEN和GAPDH的蛋白质印迹。条件对应于上面标记的qRT-PCR数据。
dCas9-KRAB不会在预期的脱靶位点诱导转录调控
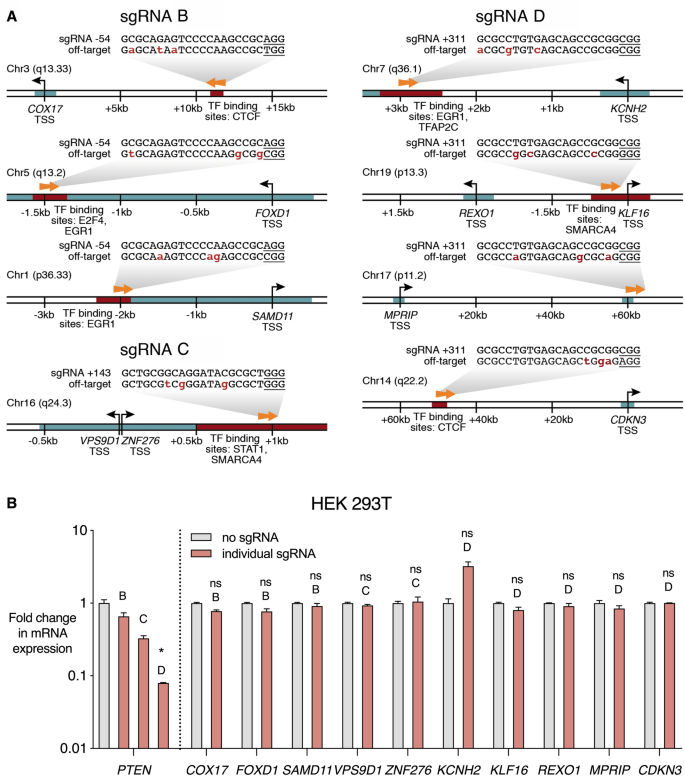
建立了dCas9-KRAB 对PTEN的显着抑制后,我们研究了dCas9-KRAB系统是否也诱导了脱靶转录调控。我们分析了PTEN gRNA序列,并编译了潜在的全基因组脱靶gRNA结合位点55。然后,我们确定了位于调控区域的脱靶位点,这些位点具有调节基因表达的潜力。鉴定出八个潜在的脱靶结合位点,总共接近十个基因的调节元件(图 3A,补充表S2)。进行了qRT-PCR,以评估dCas9-KRAB对这些基因的调控,将相关的靶向PTEN的 gRNA与没有gRNA 的dCas9-KRAB进行了比较(图。 3 B)。对PTEN阻抑组分转导的HEK 293T细胞中任何潜在的脱靶基因的表达均无明显影响。先前的研究也表明在非靶位点的CRISPR人工转录因子和基因表达表观遗传编辑或表观遗传修饰的影响可以忽略45,53,56,57,58,59,60,61,62,63,64,65,66。
dCas9-KRAB抑制PTEN不会影响预测的脱靶基因的表达。(一)潜在的化脓性链球菌 Cas9结合位点与4个靶向PTEN的 gRNA中的任何一个的同源序列具有3个错配或更少,如先前所述49。在所有已鉴定的脱靶位点中,有8个位于调控元件的附近,因此具有改变相关基因表达的潜力。与这些脱靶位点相关的十个基因是COX17,FOXD1,SAMD11,VPS9D1,ZNF276,KCNH2,KLF16,REXO1,MPRIP和CDKN3。PAM序列带有下划线,并且关联序列和脱靶序列之间的不匹配以红色突出显示。箭头指示gRNA是靶向正向还是反向DNA链。编号是指距相关基因转录起始位点(TSS)的距离。CpG岛由DNA的绿色阴影区域表示,转录因子(TF)结合位点由DNA的红色阴影区域表示。(B)dCas9-KRAB在没有gRNA或单个靶向PTEN的 gRNA的HEK 293T细胞系中稳定表达。数据显示为相对于无gRNA的dCas9-KRAB,对于PTEN,在qRT-PCR中mRNA表达的变化倍数10个潜在的脱靶基因中的每一个(图2中的 PTEN表达数据均从图2中复制)。条形上方指示了相关的靶向PTEN的gRNA(B,C或D)。没有发现任何预测的脱靶基因对mRNA表达的显着影响。* p <0.05(Mann–Whitney检验),n = 3,误差线显示SEM。
dCas9-KRAB系统在PTEN转录调控区域引发组蛋白甲基化和去乙酰化
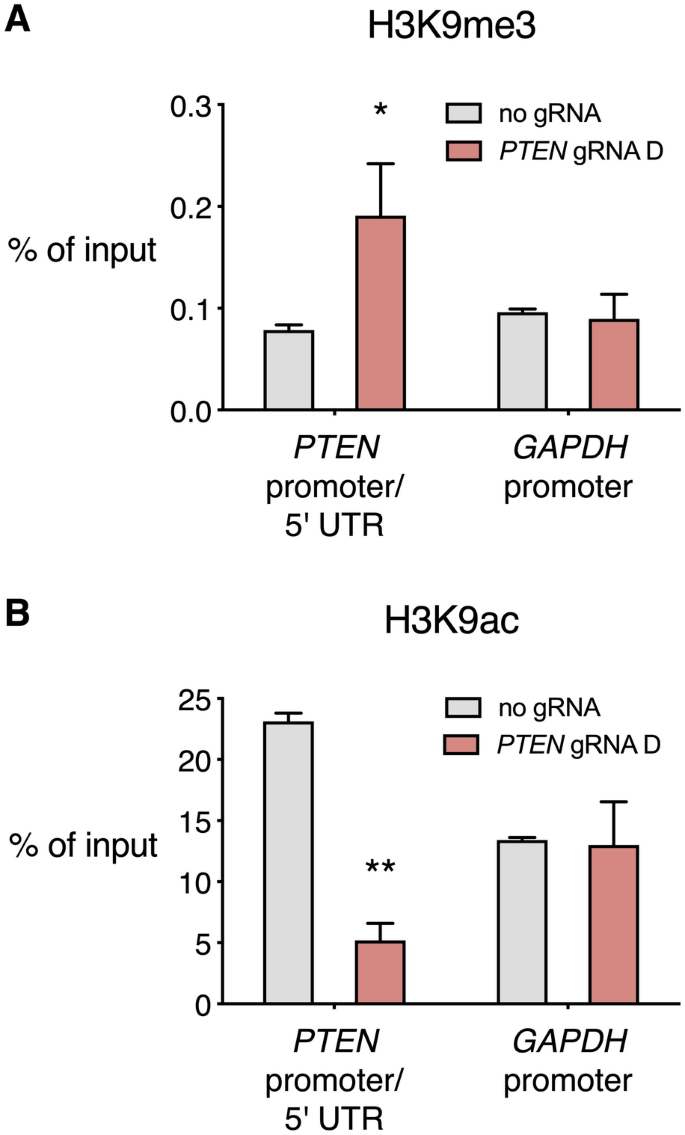
dCas9-KRAB先前已经显示招募的HDACs并HMTS导致在目标区域的变化为组蛋白的翻译后修饰42,43。我们针对三甲基化的H3K9(H3K9me3)(通常与异染色质和转录抑制相关的组蛋白修饰)和乙酰化的H3K9(H3K9ac)进行了染色质免疫沉淀(ChIP)(与活性启动子高度相关)(图 4)。我们在跨越PTEN近端启动子和5'UTR 交界处的区域评估了H3K9me3,在PTEN gRNA D 靶位点的上游有70个碱基对。H3K9me3在稳定表达dCas9-KRAB和PTEN的 HEK 293T细胞中显着富集gRNA D(0.19%的输入染色质与不带gRNA的dCas9-KRAB的输入染色质的0.08%比较,p <0.05)。H3K9ac在带有gRNA D 的PTEN转录调节区也显着降低(输入染色质为5.20%,而没有gRNA的dCas9-KRAB则为输入染色质的23.13%,p <0.01)。gRNA D和无gRNA对照条件之间,GAPDH启动子处的H3K9me3和H3K9ac频率没有显着差异,表明dCas9-KRAB和gRNA D诱导的表观遗传修饰是靶基因特异性的。
dCas9-KRAB系统在人iPSC衍生的神经细胞中诱导PTEN抑制
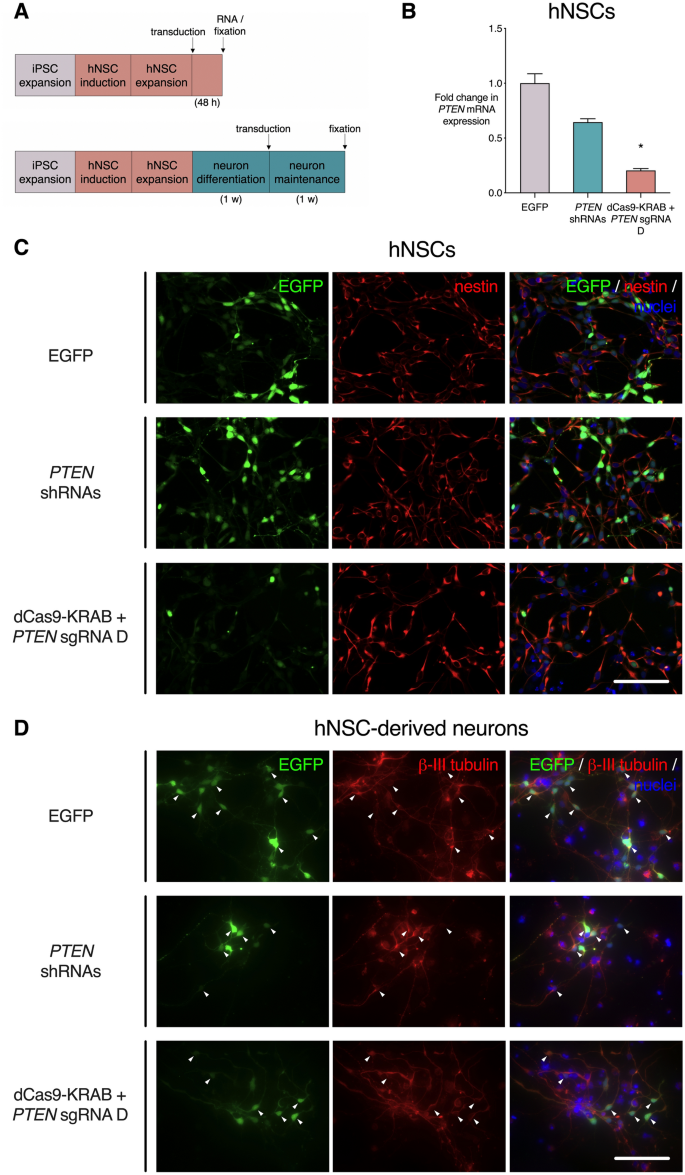
确定了最有效的PTEN抑制gRNA后,我们接下来在神经细胞模型中交付了慢病毒系统。人神经干细胞(hNSC)源自健康供体的iPSC,然后用等价的表达PTEN shRNA,dCas9-KRAB和PTEN gRNA D或EGFP对照的慢病毒颗粒进行转导(图 5 A)。从大细胞群体中收集RNA,无需选择转导细胞,然后进行qRT-PCR评估PTEN mRNA表达水平(图 5 B)。在hNSC中,四个PTEN shRNA 的传递降低了PTEN相对于空载体对照的mRNA水平,但不显着(0.65倍,p = 0.34)。但是,相对于空载体对照,具有PTEN gRNA D的dCas9-KRAB 显着降低PTEN表达(0.20倍,p <0.05)。免疫荧光分析表明,转导未改变NSC群体中NSC标记Nestin的表达(图 5 C)。在递送编码shRNA,dCas9-KRAB系统或EGFP对照的慢病毒之前,hNSCs还可以在1周内分化为神经元表型(图 5A)。对神经元特异性标志物ßIII-微管蛋白的染色显示,大多数情况下,大多数被转导的(EGFP +)细胞都保持神经元表型(图 5)。D)。
dCas9-KRAB抑制人iPSC衍生的神经细胞中的PTEN,而不会改变细胞身份。用含有dCas9-KRAB和PTEN gRNA D,四个靶向PTEN的 shRNA 或EGFP对照的慢病毒转导人神经干细胞(hNSC)或hNSC衍生的神经元。(A)iPSC与hNSC和神经元分化方案的示意图。首先扩大iPSC,然后进行神经诱导以产生hNSC。慢病毒用于转导hNSC,随后48小时后进行RNA提取和固定(A,上图)。hNSCs也分化为神经元1周,然后在1周后固定(A,底部)。(B)PTEN转导后48小时,未分类的hNSC群体中的mRNA表达,相对于EGFP对照的倍数变化显示。* p <0.05(使用Dunn的多重比较测试进行的Kruskall–Wallis检验,将每种条件与EGFP对照进行比较),n = 3,误差线显示SEM。(C,D)转导的hNSC(C)和神经元(D)的代表性图像。对细胞进行GFP和核Hoechst 33,342染色,以及hNSC标志物Nestin(A)和神经元标志物ßIII-tubulin(C)染色。比例尺= 200 µm。
dCas9-KRAB系统在大鼠PC-12细胞中诱导PTEN抑制
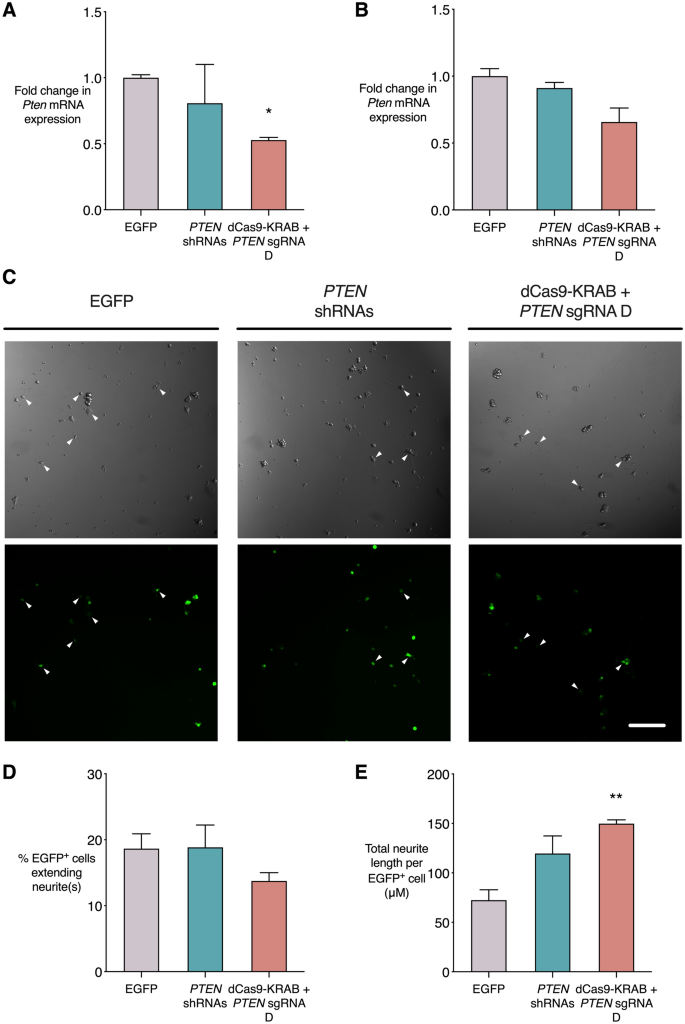
由于CRISPR / dCas9系统理想地在中枢神经系统损伤的临床前啮齿动物模型中进行测试,因此我们希望确定它是否还能成功抑制大鼠细胞中的Pten。gRNA D靶向人类的PTEN 5'UTR,并且该结合位点在人,大鼠和小鼠之间完全保守,在大鼠基因组中没有明显的脱靶位点。在大鼠中,gRNA D与ATG起始密码子上游的679个碱基对结合。我们在大鼠PC-12细胞系中体外测试了Pten抑制,该PC-12细胞系源自神经rest起源的肾上腺髓质细胞。用神经生长因子(NGF)刺激的PC-12细胞分化为神经表型并延伸神经突。未分化的PC-12细胞(图 6)A)或已用NGF播种并分化48小时的PC-12细胞(图 6 B)用PTEN shRNA,dCas9-KRAB和PTEN gRNA D或EGFP对照转导。提取来自未选择的细胞群的RNA,并进行qRT-PCR以评估Pten mRNA表达的水平(图 6A,B)。在未分化的PC-12细胞中,具有PTEN gRNA D的dCas9-KRAB 相对于空载体显着降低了Pten表达(0.53倍,p <0.05),而PTEN shRNA并没有显着影响Pten mRNA水平(0.81倍)(图。 6一个)。在转导前用NGF刺激48h的PC-12细胞中,CRISPR抑制条件显示的Pten mRNA表达低于EGFP对照(0.66倍),但这并不显着(p = 0.05)(图6)。 B)。
dCas9-KRAB抑制分化为神经表型的大鼠PC-12细胞系中的PTEN并增强神经突生长。用dCas9-KRAB和PTEN gRNA D,四个靶向PTEN或EGFP对照的shRNA 转导褐家鼠 PC-12细胞,然后(A)或之后(B – E)分化为具有神经生长因子(NGF)的神经表型)。(A,B)当病毒被输送到未分化的PC-12细胞(A)或已经被NGF刺激48h的PC-12细胞时,qRT-PCR中Pten mRNA的表达(B),显示为相对于EGFP对照的倍数变化,* p <0.05(使用Dunn的多重比较检验进行Kruskall-Wallis检验以将每种条件与EGFP对照进行比较),n =3。(C)分化的PC-12细胞表达EGFP,相位对比说明神经突长度。比例尺= 500 µm。(D)延伸1个或多个神经突的转导细胞的百分比等于或大于细胞体的直径。(E)每个分化的转导细胞的总神经突长度。** p <0.01(使用Dunnett的多重比较测试进行单向ANOVA,以比较每个条件与EGFP对照),n = 3,误差线显示SEM。
我们还评估了NGF刺激的PC-12细胞中Pten抑制对神经突增生程度的影响。在诱导神经突生长后6小时,我们转导了PC-12细胞系,然后继续用NGF刺激,直到4天后评估神经突生长的程度(图 6 C–E)。在不同条件下,延伸神经突的转导细胞百分比没有显着差异(图 6 D)。然而,与EGFP对照相比,随着dCas9-KRAB和PTEN gRNA D的递送,每个分化细胞的平均神经突长度显着增加(149.8 µm,对照中的72.3 µm,p <0.01)(图 6 E)。dCas9-KRAB抑制的卓越性能在进行将这种方法应用于临床前中枢神经系统损伤模型的研究时,大鼠神经样细胞中的Pten shRNA是一个令人鼓舞的发现。
讨论区
我们已经显示,dCas9-KRAB 通过单个gRNA 靶向PTEN 5'UTR,在mRNA和蛋白质水平上有效且特异性地抑制了PTEN表达,并导致在PTEN转录调控区域增加了H3K9me3并减少了H3K9ac 。所述dCas9-KRAB系统压抑PTEN比四点的组合在更大程度上PTEN靶向的shRNA在几个实验人类细胞类型。将CRISPR系统递送至hNSC或hNSC衍生的神经元可成功抑制PTEN表达,而不会改变NSC特异性或神经元特异性标记的表达。先前的研究表明,尽管PTENshRNA的可部分提高受损的神经元的存活和轴突再生长体内23,25,它们不是有效,因为PTEN基因缺失,可能是由于不完全的PTEN敲低。此处的CRISPR / dCas9系统在人类细胞中实现了极强的阻遏作用,并可以提供PTEN抑制策略,该策略几乎与PTEN基因删除一样有效,但由于其可逆性和降低的外源DNA风险而具有更大的翻译潜力整合到Cas9诱导的双链断裂中48。另外,对于由RNA干扰策略产生的显着水平的脱靶活性也存在一些担忧。此处使用的gRNAs不影响预测的脱靶基因的表达,以及许多其他研究支持权利要求,与dCas9转录调控是高度特异性的45,53,56,57,58,59,60,61,62,63,64,65。
培养的神经元未提供有关dCas9-KRAB是否能在体内促进受损CNS神经元的轴突再生的确切信息,因此CRISPR系统必须最终在临床前,最可能是啮齿动物的CNS损伤模型中进行测试。我们使用的gRNA序列在大鼠和小鼠中都是保守的,并且在人细胞中有效工作的同一CRISPR系统也显着下调了大鼠PC-12神经c衍生细胞中的Pten并增加了神经突向外生长。CRISPR Pten的功效对PC-12细胞的抑制表明该系统将来可能会有效地应用于大鼠CNS损伤模型。我们将dCas9-KRAB和gRNA包装在慢病毒中;但是,重组AAV(rAAV)载体通常被认为是临床基因治疗应用的更安全替代品,因为它们从病毒DNA整合中获得插入诱变的风险较低67。rAAV DNA分子在体内主要作为附加体存在,很少有整合入宿主基因组的情况,并已被批准用于临床试验68。除治疗基因的大小外,AAV的包装限制使化脓性链球菌的适应性复杂化dCas9,在添加了转录抑制所需的启动子,效应子域和gRNA之前为4.1碱基对。为了解决这个问题,双AAV系统已经用于CRISPR基因编辑和转录调控在小鼠和灵长类动物69,70,71,72,73。在神经系统修复的背景下,PTEN抑制的一种有前途的方法是在单链AAV中提供dCas9-KRAB,以及在自我互补AAV中提供CRISPR gRNA,如最近所证实的74。此外,其他物种(例如金黄色葡萄球菌)的 Cas蛋白dCas9,将被容纳在AAV对于转录激活和抑制小就够了,这些可能被证明是一种有效的替代化脓性链球菌 dCas9用于体内递送75,76。
在两种测试的初步细胞类型中,结合多个靶向PTEN的 gRNA的HEK 293T和hMPC 没有比单个最有效的gRNA达到更高的抑制水平。这种单一的gRNA 在hNSC和PC-12细胞中也实现了显着的PTEN抑制。这是一个令人鼓舞的发现,因为它更容易在体内应用移动到时,提供一个单一的gRNA,并且还促进多重转录调控通过提供几个gRNAs,每个针对不同的基因的可能性77,78,79,80。考虑到PTEN, gRNA复用特别重要先前已经证明,缺失可与其他抑制生长的基因缺失协同作用,以在CNS中实现更高水平的轴突再生。例如,共缺失PTEN和细胞因子信号3(的抑制器SOCS3) ,信号转导和转录(STAT)途径的活化剂的关键负调节物,改进的轴突再生到甚至大于程度PTEN单独缺失18,81。
Bisperoxovanadium(BPV)的化合物,蛋白酪氨酸磷酸酶(PTP)的抑制剂,也被用于治疗脊髓损伤和缺血的上下文中PTEN的药理学调节82,83,84。尽管bpV化合物对PTEN表现出一定程度的选择性,但它们在较高浓度下也会阻断其他PTP,因此可能会产生意料之外的非特异性作用的风险。bpV PTEN抑制剂的全身给药也可能在非神经元细胞类型中产生意想不到的作用,而AAV向性性和细胞类型特异性启动子提供了一种将CRISPR系统表达限制于神经元的方法85。
尽管在中枢神经系统修复策略中潜在强大的工具,但在轴突再生和与靶神经元连接的重建之外,PTEN抑制可能不是安全或不理想的。还有的是,组成和永久的可能性PTEN敲除可能导致癌症发展,PTEN已成熟的肿瘤抑制功能49,86。重要的是,有证据表明,有条件的PTEN缺失成熟的神经元会导致轴突和树突的进行性生长和细胞体肥大30,31,47。这些考虑表明,时间调控PTEN抑制将是一种更安全,更临床相关的方法。因为通过后生CRISPR / dCas9-KRAB编辑诱导转录抑制不缺席续效应表达的持续存在64,87,该方法在本研究中所描述代表一个有前途的替代策略,以沉默PTEN没有永久基因敲除。此外,表观遗传学编辑避免了脱靶诱变和与基因编辑相关的外源DNA整合的风险48。一种有希望的方法可以是获得CRISPR压制部件的瞬时表达,通过使用可化学在转录或者控制的系统85,88,89,90或翻译后水平90。
重要的是要注意,轴突的再生只是恢复CNS功能的第一步。虽然后轴突再生PTEN缺失导致功能上的改进23,25,84,也有通过再生靶向错误的证据PTEN -deleted轴突91,92,另一个原因的时间调制PTEN压制。目标神经支配是一个复杂的过程,由成年人通常不存在的发展指导线索精心策划93。建立突触地图,提供功能恢复是另一个克服的障碍一旦轴突扩展实现的,并且可能需要的支化促进因子,以及其它神经营养因子和指导线索的外源性递送4,94,95。轴突再生后,恢复训练对促进突触形成也可能是必需的。总而言之,尽管在克服成人中枢神经系统再生失败的过程中仍然存在许多障碍,但使用CRISPR / dCas9技术抑制PTEN可能被证明是对抗其衰弱作用的有效且可调节的方法。
方法
细胞培养
人类胚胎肾(HEK)293T细胞系获自美国典型培养物保藏中心(ATCC,Manassas,VA),并在DMEM中培养(由澳大利亚珀斯的哈里·珀金斯医学研究所生产;按ATCC规范配制)含10%热灭活的HyClone胎牛血清(FBS; Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州)和1%抗生素-抗真菌药(Gibco,Fisher Scientific,汉普顿,新罕布什尔州)。hMPC是皇家珀斯医院细胞与组织疗法WA(CTTWA)的Marian Sturm博士提供的礼物。hMPCs是由CTTWA使用Ficoll-Paque密度离心法和培养物中的塑料粘附力从澳大利亚珀斯皇家珀斯医院的健康供体中分离得到的,并表达了MPC表面标记。hMPCs在ATCC配制的MEM alpha(哈里·珀金斯医学研究所)中培养,辅以10%热灭活的HyClone FBS和1%抗生素-抗真菌药。PC-12细胞系获自ATCC,并在ATCC配制的RPMI-1640培养基(哈里·珀金斯医学研究所)中培养,该培养基中补充了10%的马血清,5%的热灭活的HyClone FBS和1%的抗生素-抗真菌药。
将人类游离iPSC品系(Gibco)在Essential 8培养基(Gibco)中扩增,并分化为神经干细胞(hNSC),并根据制造商的方案扩增。扩增后,将hNSC在含有2%神经诱导补充剂(Gibco)和1:1神经基础培养基混合物的培养基中,在涂有Geltrex hESC合格,即用型,生长因子降低的基底膜基质(Gibco)的板上培养。 (Gibco)和Advanced DMEM / F-12(Gibco)。为了分化为神经元,将hNSCs接种到涂有0.05%聚乙烯亚胺溶液(Merck)和3.3μg/ mL层粘连蛋白的板上,在以下培养基中:2%B-27补充剂,无血清(Gibco),1%N -2补充剂(Thermo Fisher),1%GlutaMAX(Gibco),1%胰岛素-转铁蛋白-硒-丙酮酸钠(ITS-A)(Gibco),10 ng / mL重组人β-NGF(伦敦Peprotech,英国),10 ng / mL重组人NT-3(Peprotech),10 ng / mL重组人/鼠/大鼠BDNF(Peprotech),神经基础培养基(Gibco)和Advanced DMEM / F-12的1:1混合物(Gibco)。开始分化后,将细胞在慢病毒转导之前在分化培养基中保持1周。
gRNA和shRNA设计
gRNA靶标设计和脱靶鉴定
候选gRNA序列PTEN压制用的Benchling CRISPR设计工具(benchling.com),它提供一个得分指示所预测的靶向特异性和脱靶根据已建立的算法结合各gRNA的站点标识50,96。仅当gRNA的特异性得分大于60且效率得分大于40时,才考虑使用gRNA。在转录起始位点(TSS)上游400 bp处向下游延伸400 bp的区域中有44个推定的gRNA。PTEN的5'UTRmRNA转录变体1.从中选择4个gRNA,它们的特异性和效率得分均高于指定的阈值,并且在目标区域内相对均匀地分布。在补充表S1中列出了选择用于PTEN抑制的四种gRNA靶序列,以及它们的特异性和效率得分。
为了鉴定潜在的脱靶gRNA结合位点并具有调节基因表达的潜力,使用软件程序Cas-OFFinder 55搜索与4个PTEN gRNA中的任何一个高度相似的化脓链球菌上游的基因组序列。NGG PAM。搜索仅限于与相应同源gRNA序列具有三个或三个以下错配的脱靶位点。将每个潜在的脱靶位点的位置与UCSC基因组浏览器和ENCODE数据进行比较,以识别与带注释的NCBI RefSeq基因,启动子,增强子,CpG岛,DNase I超敏区和转录因子结合位点的接近性,这表明潜力更大dCas9-KRAB复合物可调节基因表达。发现八个脱靶序列非常接近总共十个基因的潜在调控元件(补充表S2),并通过如下所述的qRT-PCR进行评估。
shRNA设计
PTEN shRNA基于SIBR载体,其中shRNA位于内含子中,侧翼是源自内源性内含子shRNA miRNA-155的序列。四个单独的shRNA序列(分别靶向PTEN的不同区域)串联在单个质粒中26。补充表S3中列出了四个shRNA序列。shRNA + 2022包含一个与人球菌PTEN转录物不匹配的核苷酸,因为该shRNA载体最初设计为靶向大鼠和小鼠Pten。但是,在人类转录组中鉴定的这些shRNA没有明显的脱靶序列。
质粒
为了验证单个gRNA的阻遏作用,将每个gRNA克隆到pLV hU6-sgRNA hUbC-dCas9-KRAB-T2A-Puro第三代慢病毒转移质粒44(Addgene质粒#71236,查尔斯·格斯巴赫(Charles Gersbach)的礼物;下文称为pLV) -KRAB)。退火的寡核苷酸gRNA克隆到BsmBI位点如先前所述进行97。确定gRNA D实现了最佳的基因阻遏后,将gRNA D靶序列克隆到pLV hU6-sgRNA hUbC-dCas9-KRAB-T2a-GFP第三代慢病毒转移质粒44(Addgene质粒#71237,这是查尔斯·格斯巴赫(Charles Gersbach)的礼物) ;以下称为pLV-KRAB-EGFP)。pLV-KRAB和pLV-KRAB-EGFP编码人源化脓链球菌 在hUbC启动子控制下的dCas9蛋白(在D10A和H840A中具有突变),以及在hU6启动子控制下的gRNA支架。
克隆了pLenti-shPTEN-EGFP以表达四个靶向PTEN转录本的shRNA 。shRNA来源于pAAV-shPTEN质粒,pAAV-shPTEN质粒是Murray Blackmore博士(Marquette大学)和Kevin Park的礼物。使用NEBuilder HiFi DNA Assembly Master Mix(New England),将包含泛素启动子,内含子序列,敲除盒和EGFP开放阅读框的pAAV-shPTEN区域克隆到pLenti骨架(pLenti-dCAS-VP64_Blast,Addgene质粒#61425)中。生物实验室,伊普斯维奇,MA)。通过从pLenti-shPTEN-EGFP 去除PTEN shRNA盒克隆出pLenti-EGFP。
将没有插入gRNA序列的pLenti-CMV_Blast_empty 98(Addgene质粒#17486)和pLV-KRAB用作HEK 293T和hMPC中的实验对照。将第三代慢病毒包装质粒pMDLg / pRRE(Addgene质粒#12251)和pRSV-Rev(Addgene质粒#12253)和包膜质粒pMD2.G(Addgene质粒#12259;所有礼物由Didier Trono提供)用于慢病毒。生产。
慢病毒生产和转导
实验已获得澳大利亚基因技术监管局(OGTR)的批准,公告号为低风险交易(NLRD)批准号004/2017。如先前所描述的慢病毒是由HEK 293T细胞用慢病毒转移,包装和包膜质粒转染产生99。简而言之,将HEK 293T细胞接种到10 cm平板中(4×10 6转染前一天的每板细胞数)。根据制造商的方案,使用Lipofectamine 3000 Transfection Reagent(Thermo Fisher),使用包装,包膜和转移质粒(如上所述)转染细胞,每板使用8.4μg包装质粒,5.5μg包膜质粒和10.9μg转移质粒DNA。将细胞在转染混合物中孵育过夜,第二天早晨更换培养基。在转染后48和72 h去除含有上清液的上清颗粒,并在浓缩前将两次收集的上清液合并。
通过将1体积的40%聚乙二醇8,000(Sigma-Aldrich,圣路易斯,密苏里州),1.2 M NaCl,pH 7.0溶液添加到3体积的上清液中,浓缩上清液中的病毒颗粒,在4°C下以60 rpm振荡过夜,然后在4°C下以1,600 RCF离心1小时。然后除去上清液,并将含有慢病毒颗粒的沉淀重悬于对目的细胞类型特异的新鲜培养基中。根据流式细胞术评估的EGFP表达,对慢病毒进行滴定。为了进行转导,将慢病毒与Polybrene感染/转染试剂(Merck Millipore,Burlington,MA)一起添加到培养基中过夜(对于hNSC和神经元为5μg/ mL,对于所有其他细胞类型为8μg/ mL),并进行新鲜培养第二天早上中等。
RNA提取,反转录和qRT-PCR
使用QIAzol裂解试剂(QIAGEN,德国希尔登,德国)使用苯酚-氯仿提取从转导细胞中提取RNA 49。使用高容量cDNA逆转录试剂盒(Applied Biosystems,Foster City,CA),将纯化的总RNA(对于HEK 293T,hMPC和PC-12为2μg,对于hNSC为250 ng)产生cDNA,并在25°C下孵育室温下10分钟,然后在37°C下120分钟,在85°C下灭活5分钟。
如先前所述49进行实时定量逆转录PCR(qRT-PCR)。基因PTEN,GAPDH,KLF16和SAMD11的 qRT-PCR 用TaqMan基因表达测定法(Applied Biosystems)进行,列于补充表S4中。基因COX17,FOXD1,SAMD11,VPS9D1,ZNF276,KCNH2,MPRIP,CDKN3和Pten的 qRT-PCR(大鼠)是使用QuantiFast SYBR Green PCR Master Mix(QIAGEN)和定制设计的引物(Integrated DNA Technologies,Coralville,IA)进行的,其列在补充表S5中。使用ViiA 7实时PCR系统(Applied Biosystems)进行qRT-PCR反应。TaqMan分析的热循环设置为:95°C持续20 s,然后进行40个循环(95°C持续1 s)和60°C持续20 s。SYBR Green分析的热循环设置为:95°C持续5分钟,然后是95°C持续10 s和60°C持续30 s的40个循环。接下来是熔体曲线程序:95°C持续15 s,60°C持续1分钟,并且以每秒0.05°C的速度升至95°C。QuantStudio实时PCR软件(v1.1,Applied Biosystems)用于自动确定每个孔的循环阈值(Ct)。使用比较(ΔΔ)Ct法分析基因表达的相对定量100,101 与GAPDH或PPIA作为管家基因。
蛋白质提取和定量
使用细胞裂解缓冲液(Cell Signaling Technology,Danvers,MA)49从转导的细胞中提取蛋白质。将样品在10 mA下超声处理15 s,然后在4°C下以16,000 RCF离心10分钟,然后将上清液转移至新试管中。使用推荐的方案,通过DC蛋白测定(Bio-Rad,Hercules,CA)对样品进行定量。使用PowerWave XS2微孔板分光光度计(BioTek,Winooski,VT)对750 nm处的样品吸光度进行定量。
蛋白质印迹
如先前所述进行蛋白质印迹49。用Mini-PROTEAN TGX无污染蛋白质凝胶(Bio-Rad)分离蛋白质,每个泳道上样20μg蛋白质。TransBlot Turbo(Bio-Rad)用于将蛋白质转移至0.2μMPVDF膜(Trans-Blot Turbo Transfer Pack,Bio-Rad)。在室温下轻轻摇动,用含Tween-20(Sigma-Aldrich)(TBS-T)的Tris缓冲盐水中的5%脱脂奶粉封闭膜1小时。封闭后,将膜与第一抗体在TBS-T中于4°C孵育过夜(抗体列于补充表S6中))。第二天,将膜洗涤并与第二抗体在TBS-T中于室温孵育1小时。使用ChemiDoc MP系统(Bio-Rad)和ImageLab软件(Bio-Rad),使用Luminata Crescendo Western HRP底物(Merck-Millipore)可视化印迹。来自图2的未裁剪的蛋白质印迹的图像 显示在补充图S1中。
染色质免疫沉淀(ChIP)-qPCR
如先前所述102进行ChIP 。简而言之,将样品在室温下于1%甲醛中缓慢摇动10分钟。通过每毫升培养物添加100μL1.375 M甘氨酸来淬灭交联。洗涤样品并收集在冰冷的PBS中,然后根据冷泉港(CSH)ChIP规程102进行细胞裂解和细胞核收集。将核沉淀物在1 mL Covaris milliTUBEs(Thermo Fisher Scientific)中的Covaris M220聚焦超声仪(Thermo Fisher Scientific)中以75 W峰值入射功率,10%占空比和200次/脉冲的频率在7°C下超声处理9分钟。根据CSH协议102进行下拉使用Dynabeads Protein G(Invitrogen,Carlsbad,CA)和Tri-Methyl-Histone H3(Lys9)和Acetyl-Histone H3(Lys9)兔单克隆抗体(Cell Signaling Technology,#13969和#9649),没有抗体作为对照。1%的输入染色质保留作为输入对照。通过苯酚-氯仿-异戊醇DNA提取从免疫沉淀的样品中纯化DNA。
使用PTEN调节区和GAPDH启动子的引物,以及SYBR Green Quantifast PCR Master Mix 对纯化的DNA样品进行实时定量PCR(qPCR)。PTEN引物如先前所述103。引物在补充表S7中列出。该反应在ViiA 7 Real-Time PCR系统(Applied Biosystems)中以以下热循环设置进行:95°C持续5分钟,然后40个循环(95°C持续10 s和60°C持续30 s)。然后执行熔体曲线程序:95°C持续15 s,60°C持续1分钟,然后以每秒0.05°C的速度升至95°C。使用QuantStudio实时PCR软件(v1.1,Applied Biosystems)自动确定每个孔的循环阈值(Ct)。根据百分比输入法进行定量,其中从ChIP获得的信号除以从输入样品获得的信号。根据以下公式计算每种条件的输入值百分比:
其中,“调整后的输入Ct”是从1%输入染色质样品中获得的Ct(针对稀释因子进行调整),而IP Ct是从该条件下的IP获得的Ct。该方法校正了每种条件下ChIP中染色质用量的变化。
免疫荧光
室温下,将铺在Geltrex或PEI-laminin包被板上的细胞在DPBS中用4%甲醛固定20分钟。为了进行免疫染色,在室温下用DPBS中的5%正常山羊血清(Invitrogen)和0.3%Triton X-100(Sigma-Aldrich)封闭样品1小时。然后将样品与一抗(GFP:Roche#11814460001; nestin:Biolegend#841901;ßIII-tubulin:Biolegend#802001)在稀释缓冲液(含1%BSA和0.3%Triton X-100的DPBS)中于4°C孵育过夜。补充表S8中列出了用于免疫荧光的抗体和稀释因子的完整细节。。过夜孵育后,将样品洗涤,并与二抗在稀释缓冲液中于室温避光孵育2小时。使用SlowFade Diamond Antifade固定剂(Molecular Probes,Eugene,OR)固定载玻片和盖玻片。使用Olympus DP71荧光显微镜以及DP Controller和DP Manager软件(日本新宿的Olympus)获取图像。
神经突增生
为了进行神经突向外生长测定,将PC-12细胞以2.6×10 4个细胞/孔的密度接种在PC-12分化培养基中,并涂上聚-1-赖氨酸(Sigma-Aldrich)。PC-12分化培养基由RPMI-1640培养基(哈里·珀金斯医学研究所)中的1%马血清和1 ng / mLβ-NGF(Peprotech)组成。接种后六小时,如上所述用慢病毒转导细胞。将细胞与慢病毒一起孵育过夜,第二天,将转导培养基替换为PC-12分化培养基。最初接种细胞后四天获取图像。从每口井分析了四个视野,每种条件分析了三口井。使用ImageJ软件(NIH)对图像进行定量。
统计分析
用Prism 8(GraphPad Software Incorporated,La Jolla,CA)进行统计分析。qRT-PCR数据的统计显着性通过非参数Kruskall-Wallis和Mann-Whitney检验确定。使用单向方差分析或Student's t检验确定所有其他数据的统计显着性。对于Kruskall–Wallis试验和单向方差分析,进行了事后多重比较试验,以比较每个实验条件与对照条件的平均值。在p <0.05(*)和p <0.01(**)时,差异被认为是显着的。误差线显示平均值的标准误差(SEM)。
|
|