AhR缺乏宿主中的肺副球虫病严重且与Treg和Th22反应不良有关
摘要
AhR是一种配体激活的转录因子,在先天和适应性免疫反应中起着重要的作用。在感染模型中,它与促进或抑制疾病进展的宿主反应有关。在拉丁美洲流行的原发性真菌感染肺副球虫病中,免疫保护作用由Th1 / Th17细胞和疾病严重程度介导,主要是Th2 / Th9 / Treg反应。由于其在上皮屏障中的重要作用,我们评估了AhR在副球孢子菌病肺模型的预后中的作用。AhR -/-小鼠显示出增加的真菌负担,增强的组织病理学和死亡率。感染期间,AhR -/-小鼠具有更多的具有激活表型的肺髓样细胞,并且表达吲哚胺2,3双加氧酶1的数量减少。AhR缺陷型肺改变了细胞因子的产生,并减少了先天淋巴样细胞(NK,ILC3和NCR IL-22)的数量。AhR -/-小鼠的肺显示出存在的Th17细胞增加,同时Th1,Th22和Foxp3 + Treg细胞数量减少。此外,用AhR特异性拮抗剂(CH223191)处理受感染的WT小鼠重现了在AhR -/-小鼠中获得的主要发现。总体而言,我们的数据表明,在肺副球孢子菌病中,AhR可控制真菌负荷和过度的组织炎症,并且是抗真菌治疗的可能目标。
介绍
AhR是一种配体激活的胞质转录因子,已知参与异源化合物的代谢。它介导了包括2、3、7、8-四氯二苯甲酰对二恶英(也称为TCDD或Dioxin)1的人造芳烃的毒性作用,但也可以被多种内源性和外源性配体2激活。在稳定状态下,AhR作为几种伴侣蛋白3组成的无活性复合物的一部分保留在细胞质中。配体结合后,AhR被释放,易位至细胞核,并与其伴侣AhR核转运蛋白(ARNT)异源二聚。异二聚体可以结合含有其结合基序的基因组区域,从而诱导靶基因的转录,包括细胞色素P的解毒酶。450家族4和AhR阻遏物,可破坏AhR / ARNT复合物并减弱AhR信号传导。在细胞核中,AhR可以与几个调节其活性的转录因子相互作用3。AhR激活的程度可能取决于配体的结构和受体亲和力。几种色氨酸(Trp)降解产物,例如Kynurenine(Kyn),是由吲哚胺2,3双加氧酶(IDO-1)和6-甲酰基吲哚并[3,2-b]咔唑(FICZ)的酶促作用产生的,色氨酸缩合产物是公知的AhR的配体5,6。
的AhR通过与参与先天免疫和适应性免疫系统的细胞在细胞增殖,分化和细胞因子分泌的控制下表达6,7,8,9,10。在2008年,不同的实验室发现的AhR有助于Th17细胞和调节性T细胞(Treg)的分化8,9,10。有趣的是,两种不同的AhR的配体(TCDD和FICZ)中显示出调节在相对的方向的实验性自身免疫性脑脊髓炎的严重程度9,10。这些发现促使数名研究人员研究了AhR在各种自身免疫,肿瘤和感染性疾病中的作用。然而,活化的AhR的影响不使用的多样的AhR的配体,由于均匀,病理类型的研究,和治疗方案中使用3,11,12,13,14。
许多研究已经测试了AhR活性及其配体在感染过程中的影响12。若干报告已经证明的AhR的调节活性对病毒15,细菌14,16,原生动物17,寄生18和真菌19,20,21,22感染。例如,在白色念珠菌和烟曲霉感染中,由于经由Kyn诱导的AhR激活Treg细胞扩增,IDO酶可同时减少Trp饥饿和炎症反应介导的真菌负荷20,21,22。除了Th17细胞/ Treg细胞分化 9,10,激动剂活化的AhR显示出与IL-22的产量被链接 8,23,24。确实,在感染白色念珠菌的粘膜部位,AhR被证明可控制IL-22转录/产生,从而在肠上皮细胞中提供保护性表型22。芳香烃受体还参与了先天淋巴样细胞(国际劳工公约)的增殖和分化,一个家庭,不表达重排的抗原受体,但可以用类似的Th亚群的表型组织的免疫细胞的 25,26,27,28,29。
副球菌样真菌病(PCM)是拉丁美洲最普遍的全身性肉芽肿性真菌病,可影响具有免疫能力的个体30。它是由 Paracoccidioides 属(P. brasiliensis 和P. lutzii)31引起的。吸入真菌分生孢子后可通过呼吸途径获得感染。在肺中,真菌的繁殖体可以通过固有的先天免疫细胞控制,可以促进局部病变或可以通过血源性或淋巴系统扩散。
30。巴西利亚疟原虫 感染可导致三种明确的结果:亚临床感染,无症状出现,但可能发展为进行性,临床表现的疾病;急性形式通常影响两性的年轻个体,是一个明显且严重的过程,其表现为多个器官的参与;慢性形式是在老年人(主要是男性)中观察到的最常见(90%)临床表现,表现出不同的临床表现,范围从孤立的肺部或上皮病变(单灶性形式)到全身受累(多灶性形式) 32。与其他系统性霉菌病相似,PCM中的免疫保护作用由Th1 / Th17反应介导,Th1 / Th17反应受Treg细胞的抗炎活性控制。严重形式与Th2 / Th9反应和Treg细胞33过度扩增有关。
我们的实验室开发了一种PCM小鼠模型,该模型模仿了人类疾病的主要发现。通过遗传抗性小鼠发展了轻微的疾病涉及的Th1 / Th17细胞淋巴细胞的优先激活,同时与流行Treg细胞活化导致相关联的严重的疾病IFN-克生产不足34,35。我们最近的研究表明,巴西体育杆菌感染可诱导介导Trp分解代谢的显着IDO-1表达,从而导致Kyn产生增加和AhR激活36。巴西假单胞菌使用两种不同的机制来触发IDO-1表达,该表达取决于宿主的遗传模式。在易感小鼠(B10.A)中,IDO-1被IFN-γ诱导,主要表现出酶活性。在抗性(A / J)小鼠,通过TGF-β导致IDO-1磷酸化介导的树突状细胞的活化,其赋予的信令特性的分子和浆细胞样树突细胞致耐受性简档36,37。我们的研究还表明,IDO-1和AHR相互调节和影响的Th17 / Treg细胞平衡38,39。确实,在肺部PCM中,IDO-1表达的缺失会导致AhR表达的强烈降低,从而导致与不受控制的Th17 / Treg细胞免疫功能介导的严重组织病理学相关的真菌生长失控39。然而,AhR在肺PCM免疫调节中的确切作用仍未确定。使用AhR -/-小鼠,我们可以证明AhR表达对于控制真菌生长以及ILC和T细胞的分化很重要。AhR中的肺PCM -/-尽管Th17细胞的免疫力增强了,但小鼠的特征还是在于进行性真菌的生长和传播,而不是免疫保护,它似乎参与了组织损伤和疾病的严重程度。还证明了AhR对产生IL-22的细胞的强大影响:在肺AhR -/-小鼠中观察到CD4 + IL-22 + T淋巴细胞,ILC3和NCR + IL-22 + ILC的迁移减少。重要的是,AhR -/-小鼠的主要发现已通过AhR特异性拮抗剂药物CH223191进行了验证,这表明AhR的免疫调节可用于未来的免疫治疗程序。
结果
缺乏AhR会增加真菌负荷和组织病理学,从而降低感染巴西假单胞菌的小鼠的存活
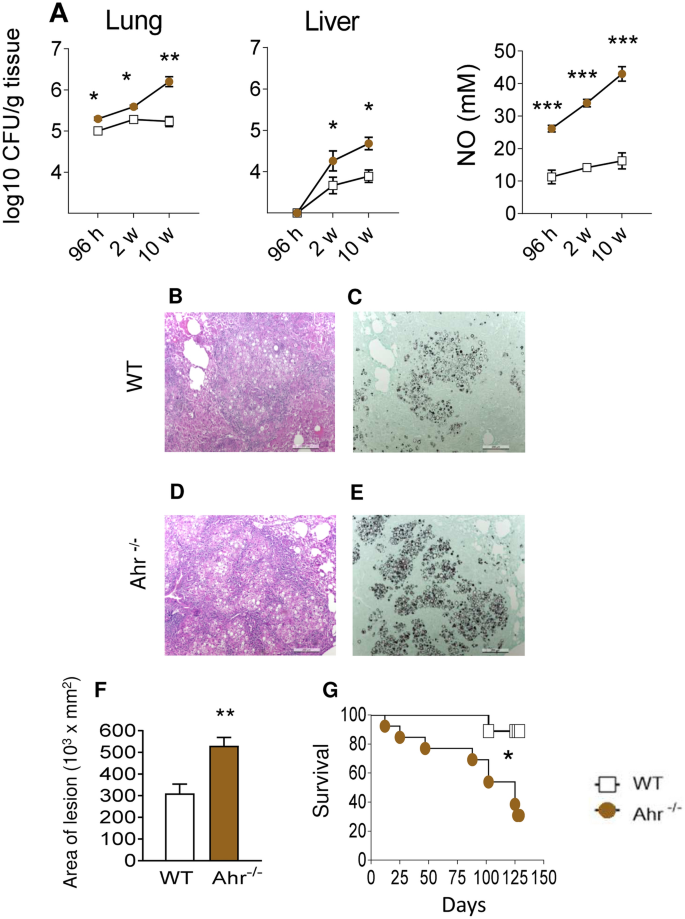
通过CFU分析评估了AhR对1×10 6的 巴西毕赤酵母酵母感染后96小时,2和10周恢复的真菌负荷的影响。这些时间点用于更好地评估先天性(96小时),早期(2周)和晚期(10周)适应性免疫的某些特征。与野生型对照相比,AhR -/-小鼠显示出较高的肺和肝真菌负荷(图 1 A)。在AhR -/-小鼠中,感染96 h,2和10周后的肺NO水平也较高(图 1 A),这表明尽管存在以下一氧化氮水平升高,但没有AhR的情况下杀菌能力却降低了被认为是主要的巴西乳杆菌吞噬细胞的杀真菌介质40。
缺乏AhR会增加真菌负荷,肺部损伤和巴西假单胞菌感染小鼠的死亡率。5只AhR -/-和WT C57BL6 / J小鼠组感染了1×10 6的 巴西假单胞菌酵母,并在感染后96 h,2和10周评估了疾病的严重程度。(A)通过集落形成单位(CFU)测定法测定小鼠的肺和肝中的真菌负荷,并表示为log 10 CFU / g组织。通过标准的Griess反应定量肺上清液中的一氧化氮(NO)水平。(B – E)WT(B,C)和AhR -/-(D,E)小鼠在感染后第10周。肺切片用苏木精-曙红染色(左图)以分析炎症的存在,或用Grocott染色的银(右图)分析真菌细胞的存在。(F)在感染后第10周对肺部病变进行形态分析。在每组5只小鼠中,每张幻灯片的10个显微镜视野中的病变区域以mm 2进行测量,并表示为平均值±SEM。(G)在140天的时间内测定AhR -/-和WT小鼠的存活曲线。实验重复了三遍。星号(*)表示具有统计学意义的差异(* P <0.05; ** P <0.01和***P <0.001)。
感染10周后,对对照组和AhR -/-小鼠的肺组织病理学进行了评估,并且在缺乏AhR的小鼠的肺中观察到了更多的酵母细胞(图 1 B–E)。这些增加的真菌负荷与肺中较大的病变区域相关(图 1 F),这可能是导致AhR -/-小鼠存活率降低的原因(图 1 G)。
AhR缺乏会增加具有激活表型的肺CD11c +白细胞的数量
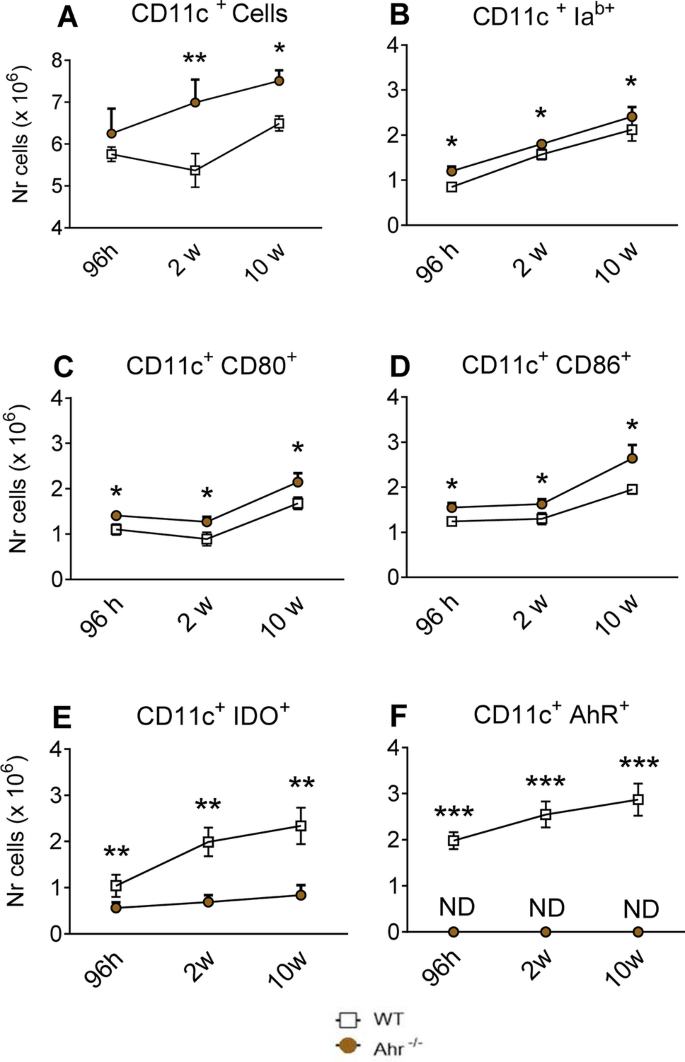
如先前所述感染C57BL6 / J WT和AhR -/-小鼠,在感染96小时,2周和10周后获得其肺细胞,并通过流式细胞术分析表面分子的表达。的CD11c +被选择的骨髓细胞,因为这种细胞标记物在树突细胞中高度表达,我们先前的研究已显示在他们的AhR高参与/ IDO表达36,38,39。因此,评估了肺CD11c +细胞中IA b,CD86和CD80作为激活标记的表达41。如图 2 A所示,AhR -/-小鼠的CD11c +内流增加表达MHC II类分子(IA b)和共刺激分子(CD80和CD86)的肺髓样细胞(图 2 B–D)表明其活化表型高于对照组WT小鼠。
缺少AhR会增加巴西腊肠杆菌感染后激活标记(IA b,CD86,CD80)的表达,但会减少表达吲哚胺2,3双加氧酶(IDO-1)的骨髓CD11c +细胞的数量。总的CD11c的数量+髓样细胞(甲)表达活化标记IA b,CD80,CD86(乙 - d),酶IDO-1(Ë)和转录因子的AhR(˚F)在肺的白细胞,其特征在于通过流式细胞术来自AhR -/-和WT小鼠感染1×10 6个活酵母后96 h,2和10周巴西假单胞菌。通过FSC / SSC分析门控肺部浸润的白细胞。然后对细胞进行CD11c表达门控,然后评估表达激活标记物和蛋白质的细胞数量。数据代表每组使用5只小鼠的3个实验的平均值±SEM。星号(*)代表统计上的显着差异(* P <0.05和** P <0.01)。
缺少AhR可减少表达IDO-1的骨髓细胞的数量
以前的报道表明免疫调节通过IDO-1上先天和适应性免疫施加取决于对的AhR的活化3,11,导致我们检查的CD11c的数量+细胞中表达IDO-1和AHR中的AhR - / -和野生型感染的老鼠。感染后96小时,2周和10周获得肺白细胞,并通过流式细胞术确定IDO-1 +和AhR +细胞的数目。与WT对照相比,在AhR -/-小鼠中检测到IDO-1 + CD11c +细胞显着减少。如预期的那样,仅WT小鼠表达在感染过程中增加的AhR +细胞(图。 2 E,F)。
感染的AhR -/-和对照小鼠的CD11c +肺白细胞中细胞因子的表征
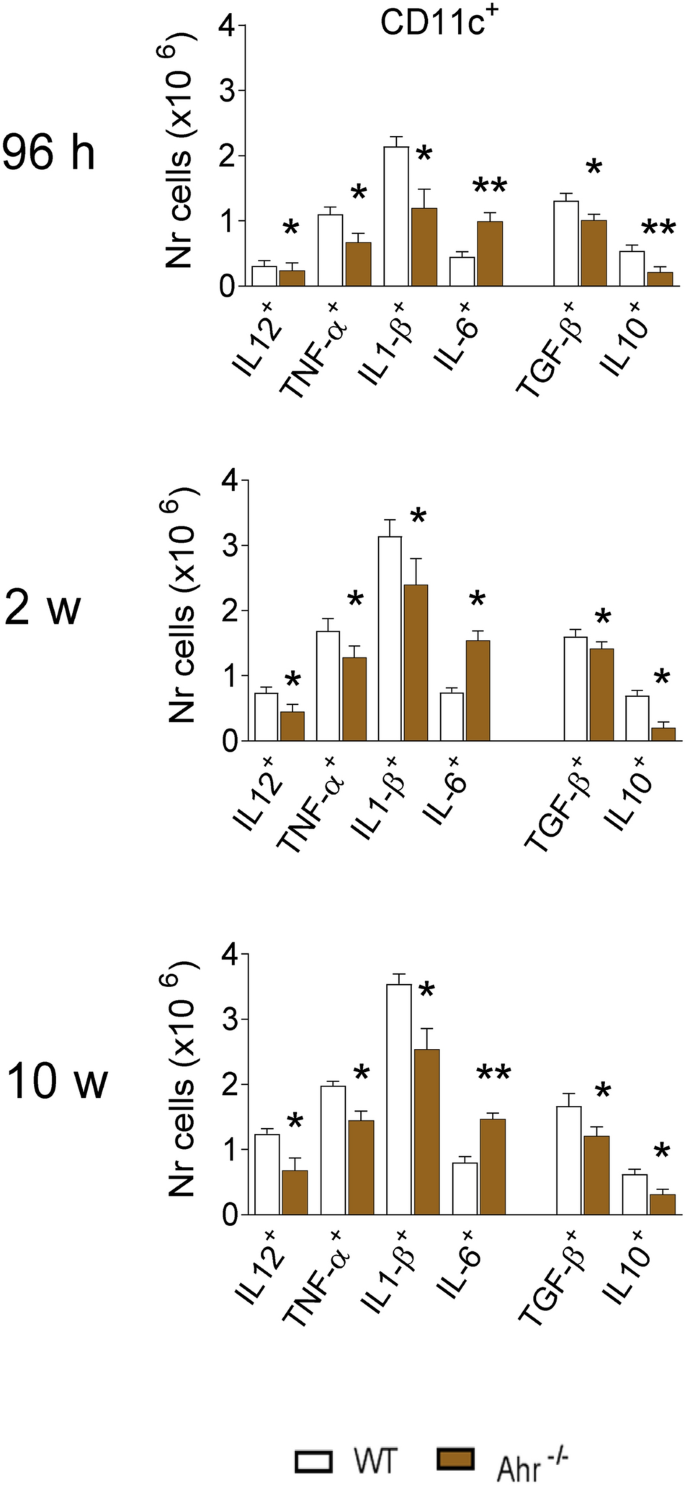
在感染后96 h,2和10周,从受感染的AhR -/-和WT小鼠中获得了肺白细胞,并通过流式细胞仪分析了细胞内细胞因子(IL-12,TNF-α,IL-1β,IL-6 CD11c +门控细胞中的TGF-β和IL-10)。观察到非常均匀的模式:在AhR -/-小鼠中,表达促炎(IL-12,TNF-a和IL-1b)和抗炎(TGF-b和IL-10)的CD11c +细胞数量减少。在所有时间点都观察到细胞因子。相反,在AhR -/-小鼠的肺中发现的CD11c + IL-6 +细胞数量比野生型对照更高(图 3)。
除IL-6 +细胞外,AhR的缺失会减少表达细胞因子的肺CD11c +细胞的数量。AhR -/-和WT小鼠的CD11c +肺白细胞表达的细胞因子(IL-12,TNF-α,IL-1β,IL-6,TGF-β和IL-10)的表达感染了1×10 6P 。巴西利亚酵母。使用荧光染料标记的特异性单克隆抗体通过流式细胞术在CD1c +细胞门处评估细胞因子的存在(见图S1)。数据代表每组使用5只动物的3个实验的平均值±SEM。星号表示统计学上的显着差异(* P <0.05和** P <0.01)。
缺乏AhR可以减少感染巴西假单胞菌的小鼠肺中NK,ILC3和NCR IL-22先天淋巴样细胞(ILC)的存在
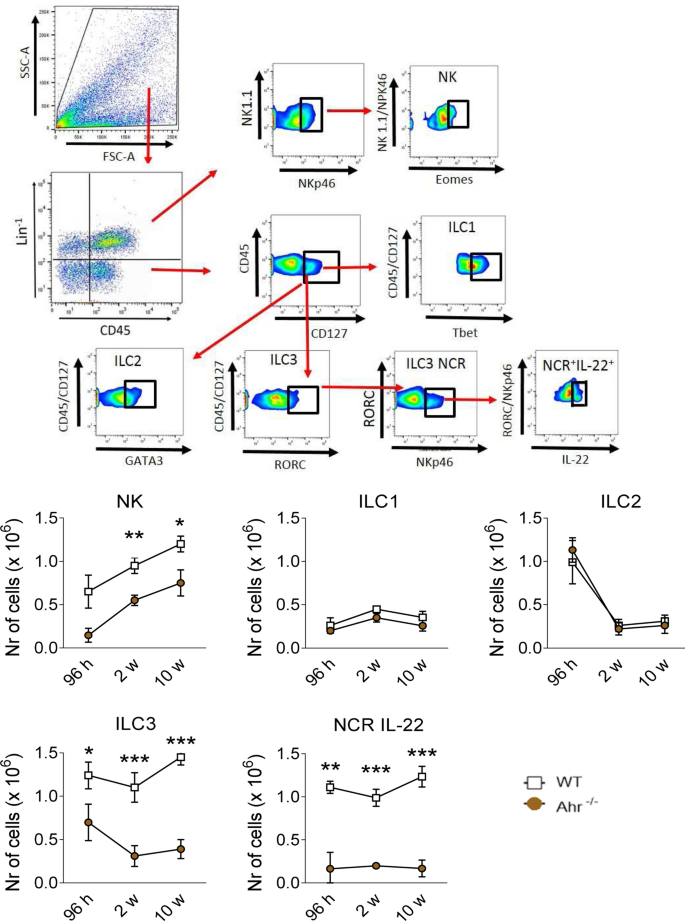
AhR的表达对于ILC3的维持,存活和功能很重要。此外,RORγt的AhR配合以诱导IL-22转录25,28,42,这一事实导致我们的表型表征这些细胞在P.巴西感染WT和AHR - / -小鼠。因此,如材料和方法中所述,ILC亚群通过其特定表面分子和转录因子的表达进行分类。NK细胞分类为Lin + CD45 + NK1.1 +NKp46 + Eomes +,ILC1分类为CD45 + Lin - CD127 +Tbet +,ILC2如CD45 +林- CD127 + GATA3 +,ILC3如CD45 +林- CD127 + RORC +和NCR + IL-22 +作为CD45 +林- CD127 + RORC + NKp46的+ IL-22 +。如图4所示 ,在整个感染过程中,在AhR -/-肺中观察到NK,ILC3和NCR IL-22淋巴细胞的数量明显减少。在AhR之间没有观察到ILC1和ILC2的差异-/-和它们的WT对应物(图 4)。
缺少AhR会降低感染巴西假单胞菌的小鼠肺中NK,ILC3和NCR IL-22先天淋巴样细胞(ILC)的存在。在巴西布鲁氏菌感染96小时,2周和10周后,对WT和AhR -/-小鼠肺中的ILC进行了表型分析。首先用抗小鼠谱系混合物(Biolegend)处理肺白细胞,该抗小鼠谱系混合物含有与T细胞,B细胞,单核细胞,巨噬细胞,NK细胞反应的CD3,Ly6G / Ly6C,CD11b,CD45R / B220,TER 119 /红细胞抗体和红细胞。然后将NK细胞分类为Lin + CD45 + NK1.1 + NKp46 + Eomes +,ILC1分类为CD45 + Lin− CD127 + Tbet +,ILC2为CD45 + Lin − CD127 + Gata3 +,ILC3为CD45 + Lin - CD127 + RORC +和NCR + IL-22 +为CD45 + Lin − CD127 + RORC +NKp46 + IL-22 +。通过流式细胞术测量细胞表面和细胞内标志物。计数了50.000个细胞,数据以阳性细胞数表示。数据以M±SEM表示,并且代表使用每组每只小鼠品系的5只小鼠的三个独立实验(* P <0.05; ** P <0.01和*** P <0.001)。
AhR对巴西假单胞菌感染小鼠肺脏基因表达的影响
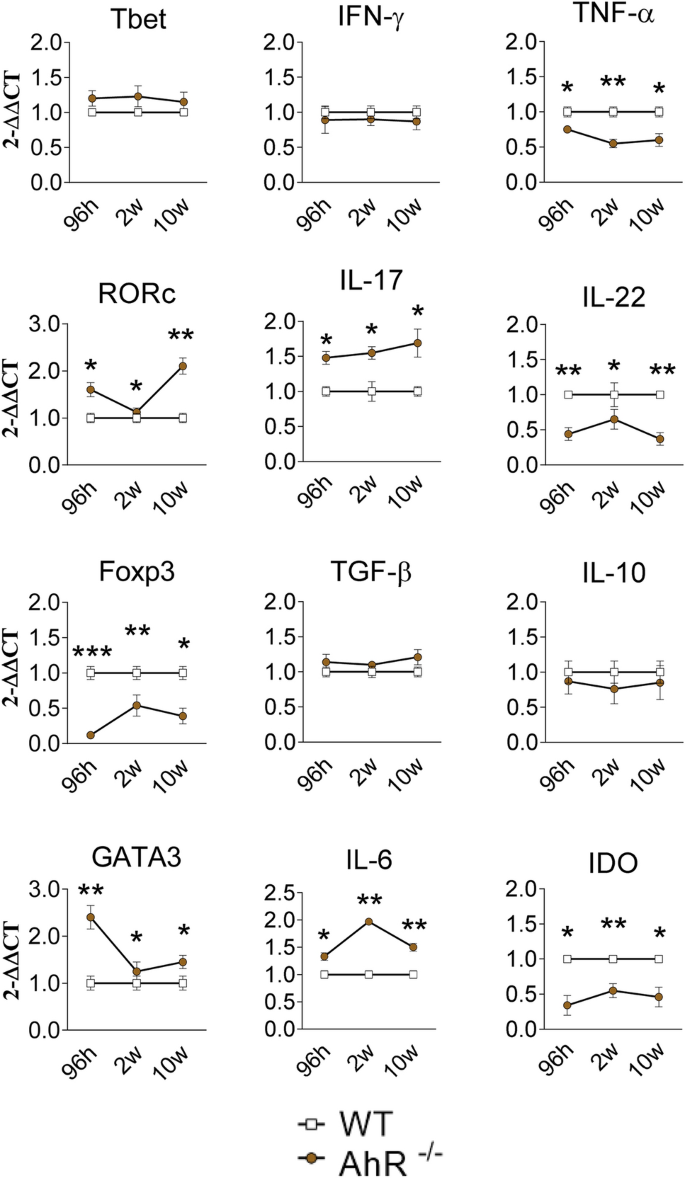
涉及一些细胞因子(ifn-γ,tnf-α,il-6,il-17和il-22),IDO-1酶(ido)和转录因子(tbet,gata3,rorc和foxp3)的mRNA表达在感染巴西假单胞菌96小时,2周和10周后,在感染的AhR -/-和野生型小鼠中确定了淋巴细胞免疫力和表型分化的差异43。如图5所示 ,在评估的所有时间点,Tbet和IFN-g mRNA表达均无差异,观察到Th1免疫标记,但是AhR缺陷小鼠以降低的水平产生TNF-αmRNA。RORc和IL-17(Th17标记)的mRNA表达在AhR -/-中较高水平老鼠; 然而,在AhR缺陷型小鼠的肺中,以降低的水平检测到高度依赖于AhR活性的IL-22。与野生型对照相比,AhR -/-小鼠显示Foxp3 mRNA的表达减少,但与Treg细胞分化和活性相关的TGF-b或IL-10,转录因子和细胞因子却没有。GATA3(Th2转录因子)和IL-6(多效细胞因子)mRNA的产生水平较高,而AhR -/-小鼠中IDO mRNA的表达则低于野生型对照(图 5)。
AhR对肺细胞因子产生的影响
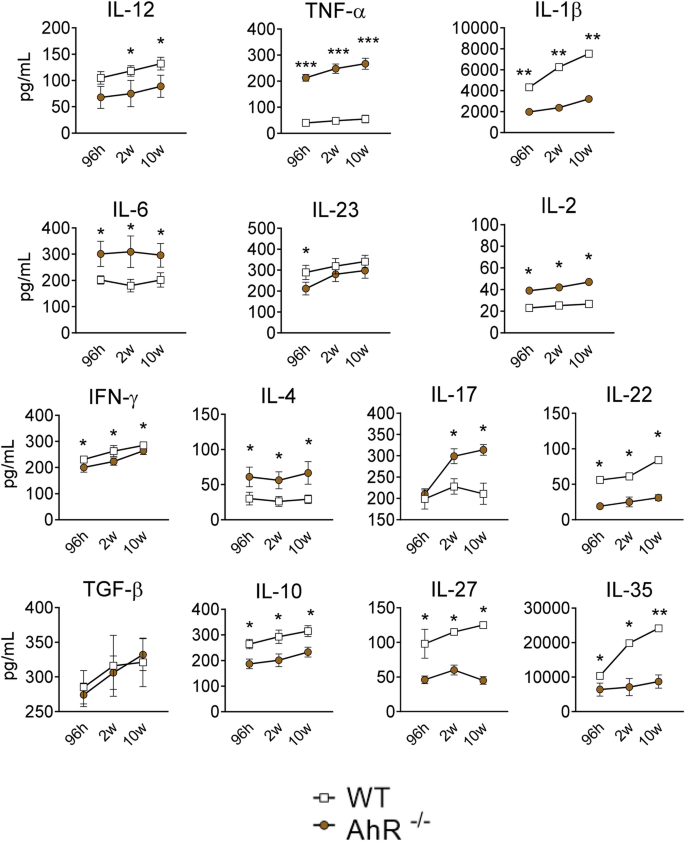
感染96 h,2和10周后收集WT和AhR -/-小鼠的肺匀浆,并用于评估细胞因子(IL-12,TNF-α,IL-1β,IL-6,IL- 23,IL-2,IFN-γ,IL-4,IL-17,IL-22,TGF-β,IL-10,IL-27和IL-35)。如图 6所示,在评估的所有时间点,在AhR缺陷型小鼠的肺中检测到TNF-α,IL-6,IL-2和IL-4的水平升高。感染后第2周和第10周,IL-17的含量较高。相反,在所有评估的感染后时期,这些小鼠的肺中IL-1β,IFN-γ,IL-22,IL-10,IL-27和IL-35的含量较低。有趣的是,在AhR缺陷小鼠的肺中,IL-1β是促炎性细胞因子最明显的降低。TGF-β是抑制或抑制性细胞因子组中不受不受AhR表达影响的唯一细胞因子。在AhR缺陷小鼠的肺中,以降低的浓度检测到与Tr1和Treg细胞的发育或活性有关的所有其他抑制性细胞因子(IL-27,IL-10和IL-35)。
缺少AhR会增加感染巴西假单胞菌小鼠的肺中Th17细胞,但减少Th1,Th22和Treg细胞
在感染后第2周和第10周,通过流式细胞术评估存在于AhR -/-小鼠和WT对照肺中的T细胞的数量和表型。
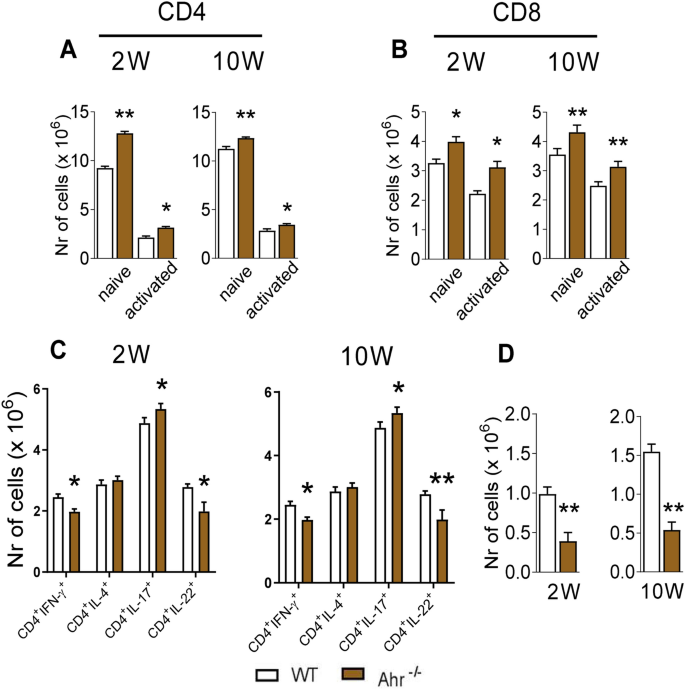
在研究的两个感染后时期,AhR缺陷小鼠的肺部均观察到较高数量的幼稚和活化CD4 +(分别为CD4 + CD44 低 CD62L 高和CD4 + CD44 高 CD62L 低)(图 7A) 。对于幼稚的和活化的CD8 +(分别为CD8 + CD44 低 CD62L 高和CD8 + CD44 高 CD62L 低),观察到了相同的结果(图 7 B)。
缺少AhR会增加肺中Th17细胞的存在,但会减少Th1,Th22和Treg细胞。如材料和方法中所述获得肺细胞,并用与不同荧光染料偶联的抗体标记。对于T细胞表型,通过FSC / SSC分析对肺浸润白细胞进行门控,然后对CD4 +或CD8 +表达进行门控。然后在CD4 +和CD8 + T细胞中评估CD44和CD62L的表达(关于门策略,请参见图S2和S3)。(A)CD4 + CD44 低 CD62L 高和CD4 + CD44 高低的CD62L 被分别认为是幼稚的和活化的CD4细胞。(B)CD8 + CD44lowCD62L 高,CD8 + CD44 高 CD62L 低分别被认为是原始的和活化的CD8细胞。(C)对于Th细胞亚群,对细胞进行CD4 +表达门控,然后对IFN-γ,IL-4,IL-17和IL-22的细胞内表达进行门控(门控策略如图S4B所示)。(D)对于Treg细胞,然后分析CD4门控细胞的CD25和Foxp3表达(图S4中的门策略)一个)。在FACS CANTO II上采集了100.000个细胞,随后通过FlowJo软件进行了分析。数据表示为每组使用5只小鼠的三个独立实验的M±SEM。星号表示统计学上的显着差异(* P <0.05和** P <0.01,*** P <0.001。
当TH1,TH2,Th17细胞和TH22亚群进行了表征(图 7 C),Th1细胞的数量减少(CD4 + IFN-γ +)和TH22(CD4 + IL-22 +在肺中发现的)的细胞与WT对照相比,AhR -/-小鼠。相反,在AhR缺陷型小鼠中观察到Th17(CD4 + IL-17 +)淋巴细胞数量增加。当评估调节性CD4 + CD25 + FoxP3 + T淋巴细胞(Tregs)的数量时,在所分析的两个时间点,AhR缺陷型小鼠的肺部均检测到明显减少(图 7)。D)。没有差异在Th2细胞中(图中发现 7C)。
用AhR特异性拮抗剂(CH223101)处理巴西假单胞菌感染的小鼠重现了AhR -/-小鼠的主要发现
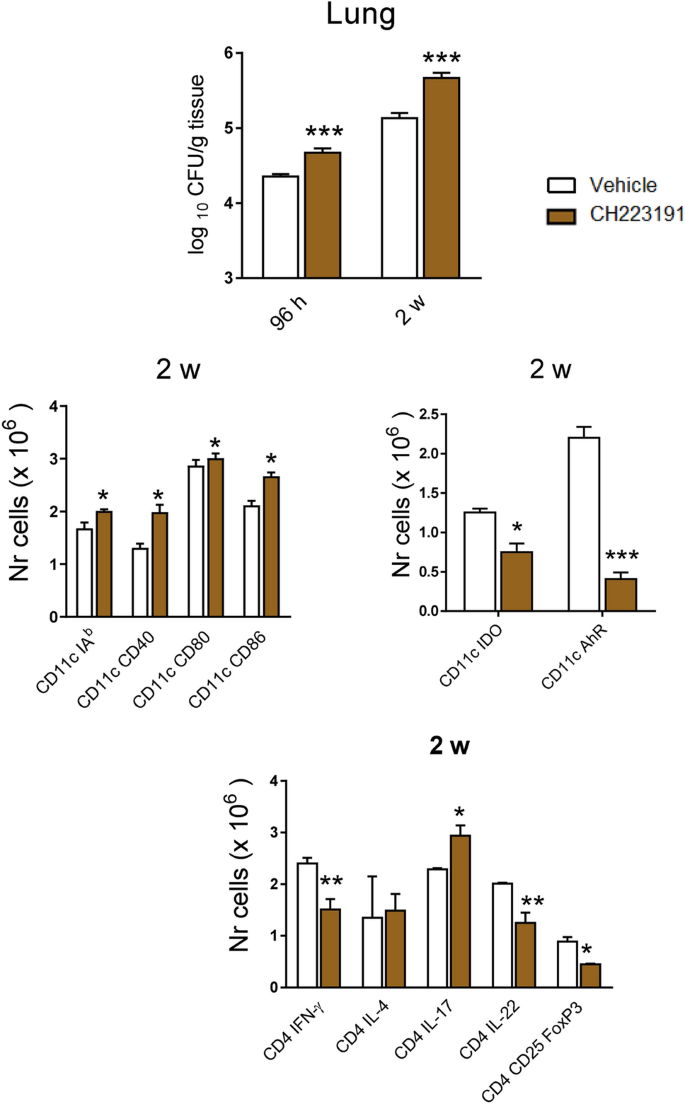
最后,我们通过评估CH223191对肺PCM的拮抗作用,扩展了用AhR -/-小鼠获得的结果。按照材料和方法中的描述处理小鼠,用1×10 6真菌细胞感染,并在感染后96小时和2周进行研究。在研究的两个感染后阶段,用CH223191进行处理均增加了真菌负荷(图 8)。在第2周,CD11c的+白细胞显示出增加的MHC II类分子(IA数b),CD40,CD80和CD86。但是,CD11c +的数量表达IDO-1或AhR的细胞明显减少。表征存在于CH223191处理的小鼠肺中的主要T细胞表型,Th17细胞数量增加,同时Th1,Th22和Foxp3 + Treg细胞减少(图 8)。这些发现再现了在AhR -/-小鼠中观察到的主要表型,进一步证明了AhR在肺PCM中的免疫调节活性。
肺副球虫病可以通过AhR特异性拮抗剂(CH223191)进行免疫调节,该拮抗剂可再现在AhR缺陷型小鼠中获得的主要发现。C57BL6 / J WT小鼠从媒介感染1×10 6的 巴西假单胞菌开始,每周一次以20 mg / kg的剂量经媒介物(玉米油)或CH223191 ip处理,共2周,共2周。感染后96小时和2周测量CFU计数。表达膜(IA b,CD80,CD86)和细胞内(IDO-1和AhR)标记的CD11c +细胞的数量以及CD4 +的表型通过流式细胞术测量感染第2周时获得的肺白细胞中的T细胞亚群。数据显示为每组使用4-5只小鼠的三个独立实验的M±SEM。星号表示统计学上的显着差异(* P <0.05和** P <0.01,*** P <0.001)。
讨论区
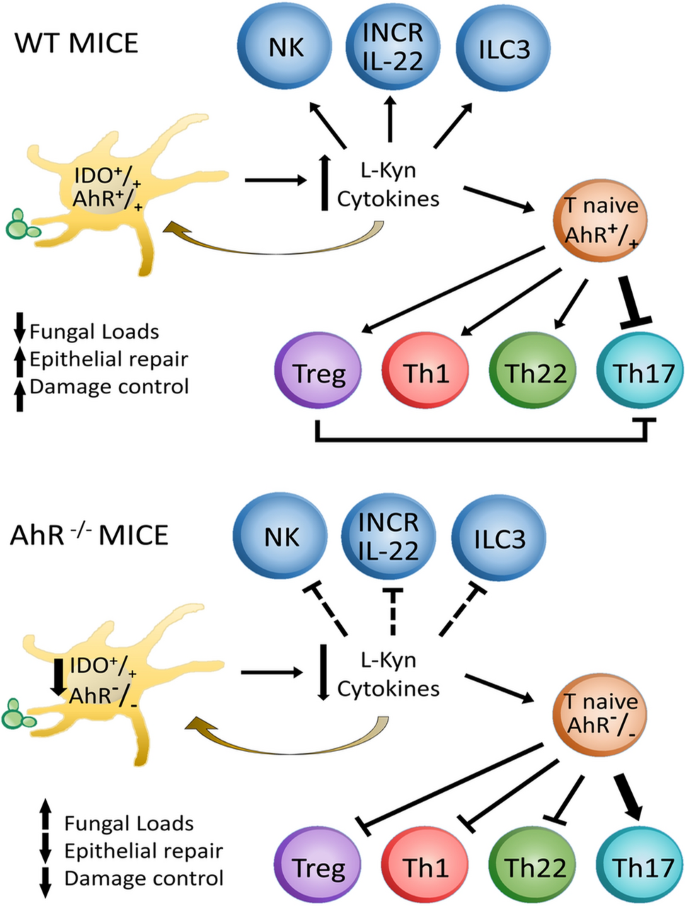
一旦被认为是对二恶英毒性反应的介体,AhR随后被描述为免疫反应的重要调节剂,包括针对传染病的免疫12。除了解毒酶的诱导,在AhR调节分化和先天和适应性免疫细胞的活性9,10,显着地影响感染过程的结果。确实,在这里我们可以证明AhR在肺PCM中具有重要的调节作用。图 9总结了巴西假单胞菌在免疫的固有阶段和适应阶段的AhR缺乏的主要发现。被感染的小鼠。AhR表达的缺乏会降低肺DC的细胞因子,IDO-1表达和Kyn合成。这种改变的肺微环境导致先天免疫机制缺陷,NK,ILC-3和NCR-IL-22细胞的参与减少。在随后发展的免疫适应性阶段,AhR的缺乏会导致Th1,Th22和Treg细胞的扩张减少,而Th17的发育却与此有关,后者的促炎活性仅受Treg细胞数量减少的部分控制。IDO活性的降低也促进了Trp利用率的提高,从而促进了真菌的生长。总体而言,真菌负荷增加和免疫效果机制低效可能会导致AhR引起的肺部病理改变和死亡率升高-/-小鼠。重要的是要评论说,包括显示WT和AhR缺陷小鼠之间基线差异的其他对照将改善数据分析。但是,由于大多数胎儿由于与这种缺陷相关的严重遗传错误而无法发育,因此难以获得足够数量的AhR -/-小鼠而造成了限制,并且限制了使用大量动物动物使用伦理委员会证明此处采用的实验设计是合理的。但是,这里观察到的差异可能是由于与AhR缺乏相关的遗传差异,因为两个AhR -/-WT小鼠和WT小鼠属于相同的C57BL / 6株。此外,用AhR拮抗剂进行的实验重现了在AhR缺陷小鼠中观察到的主要发现,表明观察到的不同反应与AhR表达有关。
在抗巴西假单胞菌感染的免疫的固有阶段和适应阶段中,AhR缺陷的示意图。与对照组WT小鼠(A)相比,AhR -/-小鼠具有缺陷的先天和适应性免疫(B)。缺少AhR表达会改变DC的行为,从而降低IDO-1表达并产生低水平的Kynurenines(Kyn)。AhR缺乏也会损害在免疫的自然阶段参与IFN-γ,IL-17和IL-22合成的NK,ILC3和NCR-IL-22先天淋巴样细胞的发育。在免疫的适应性阶段,降低的AhR活性导致Treg / Th1 / Th22细胞的分化和扩增减少,但Th17细胞的增殖增加。在AhR中-/- 在小鼠中,降低的IDO-1活性可实现较高的色氨酸利用率,从而增强真菌生长,而真菌促生长并未受到促炎性Th17细胞的充分控制,促炎性Th17细胞可能与组织病理学有关,并增加了缺陷小鼠的死亡率。
在的AhR生物学的一个重要发现是通过的AhR和IDO-1的表达所施加的相互控制44,45,46,这一发现在肺PCM这里证实。这种酶已经研究了主要介导由色氨酸饥饿其抗菌能力47并且还通过犬尿氨酸的免疫调节活性48,49,50。在真菌感染中,IDO-1的重要性/的Kyn /的AhR轴的Treg细胞和DC的致耐受性的活动被证明产生37,51,52。在肺PCM,我们小组已显示IDO-1和AHR表达之间有深刻互连,其中这些介质的一个平衡的活化用真菌免疫疾病和公差的控制连接36,37,38,39。
基本的研究表明,在AhR控制免疫力的若干机制,由于其在先天免疫细胞(ILC3,路斯特,NCR IL-22,巨噬细胞,树突状)和(调节性T细胞,Th17细胞,TH22)适应性免疫的细胞影响8,9,10。在这里,我们可以证明,在肺部PCM中,AhR表达的缺乏改变了免疫的固有阶段和适应性阶段,从而导致真菌负荷增加,组织病理学改变以及巴西假单胞菌感染小鼠的死亡率增加。在单核细胞增生性李斯特菌中观察到类似结果,但在克鲁氏锥虫感染的AhR -/-小鼠中未观察到类似结果。有趣的是,在T. cruzi感染后,AhR缺陷型小鼠NO产生增加,病原体负荷减少53,我们的研究未复制这一观察结果。尽管在AhR -/-小鼠中检测到的NO水平升高,但观察到真菌负荷增加,这表明在肺PCM中,由IDO-1的酶活性介导的Trp耗竭比由NO介导的杀菌机理更有效。
缺乏AhR导致除IL-6外,表达促炎性(IL-12,TNF-α和IL-1β)和抗炎性(TGB-b和IL-10)的肺CD11c +细胞数量减少产生数量增加的细胞。尽管表达激活标记(IA b,CD80,CD86)的CD11c +细胞数量增加,这种细胞因子的产生仍会减少。但是,这种多样化的激活模式可能与某些T细胞亚群(Th1,Th22,Treg)的扩增减少以及其他T细胞亚群的增殖(Th17)有关。一致时,IL-6可经由STAT3活化Th17细胞的正调节8,9,10可能促进了在AhR -/-小鼠中检测到的Th17细胞扩增的增加。此外,AhR缺陷型小鼠的CD11c + IL-1β +细胞数量以及肺匀浆中存在的IL-1β水平也显着降低。在肺PCM NLRP3炎性和IL-1β合成的激活起到免疫的先天和适应性阶段中起重要作用54,55,56,57,因此在IL-1β减少巨噬细胞的减少杀真菌能力可能有助于和DC,但此处未描述增强的Th17激活。休斯等。58已经优雅地证明了IL-1b缺乏与IL-22 + NKp46 +(NCR IL-22)细胞的扩增减少有关。他们发现,现有的DC-衍生IL-1β蜜饯和膨胀IL-1R1 喜 IL-22 +的AhR +未成熟的NK细胞,潜在地影响感染过程中的粘膜先天性免疫。NCR IL-22的减少的存在+这里检测到的可与缺乏IL-1β生产但不存在的AhR的相关联的细胞,即,以IL-22产生细胞的扩展基本59,60,是可能负责的主要机制观察到的NCR IL-22 +细胞数量减少。AhR的肺与WT小鼠相比,-/-小鼠的CD11c + TGF-β +细胞数量更少。TGF-β在Th17和Treg细胞61的分化中起重要作用,AhR -/-小鼠TGF-β和IL-1β合成的减少意外地伴随着IL-17分泌增加,Th17数量增加细胞和RORγtmRNA表达增加。这些发现表明,增加的Th17相关的标志物可能已被积极地由增加的IL-6产生和STAT3信号如以前证明调制8,9,10。此外,Th17扩增的增加可能归因于在AhR -/-中检测到的真菌负荷增加 老鼠。
在AhR -/-小鼠的肺上清液中检测到的表达细胞内IL-10和TGF-β的髓样细胞的减少以及IL-10和IL-35的水平降低伴随着CD4 + CD25 数量的有效降低+Foxp3 + Treg细胞,这可能解释了Th17细胞升高引起的肺部炎症增加。此外,IL-10和IL-27的水平低也可以被链接到的IL-10产生细胞TR1数量减少(这里未表征的)可能影响的Treg和Th17细胞62,63,64。
在巴西假单胞菌感染的第2周和第10周,在受感染的AhR肺中发现了数量减少的常规NK,ILC3和NCR IL-22 ILC。这些发现与在AhR缺陷动物中观察到的CD4 + T细胞亚群和细胞因子和转录因子的mRNA 部分一致。实际上,在AhR -/-小鼠中检测到的减少的NCR IL-22,Th22和IL-22 mRNA 清楚地表明,在肺PCM中,IL-22的产生依赖于AhR表达。另一方面,此处特征化的Th17和RORC mRNA 的升高表明Th17表型高度依赖于RORC转录因子9。相比之下,ILC3的芳香烃受体感染的网站数量减少- / - ,表明这些细胞是远远超过Th17细胞更依赖于芳香烃受体活性25,26。
关于适应性免疫,AhR -/-小鼠显示Th17细胞分化增加,而Foxp3 + Treg细胞扩增减少。这一发现可能与降低的IDO-1的表达,在PCM的肺模型被看见控制致耐受性相关联DC和Treg细胞增殖36,37,38,39。另一方面,将数据与IDO-1 -/-小鼠对比,在AhR -/-小鼠中检测到CD4 + IL-22 +细胞数量减少。该结果也与AhR -/-的肺匀浆中IL-22的较低含量相符。小鼠,IL-22 mRNA表达降低,IL-22分泌ILC3细胞(NCR IL22 +细胞)显着降低。总之,这些数据表明,在肺PCM IL-22的合成是高度依赖于的AhR转录因子,并且类似地与其他真菌感染65,66,IL-22可能施加在肺部PCM保护作用。
我们先前的研究已经表明Treg细胞可以是保护性的或有害的P.巴西感染小鼠34,35,67,68。在检测的所有感染后时间,均观察到Treg细胞的存在减少,这与检测到的Foxp3 mRNA 减少以及低水平的IL-10,TGF-β和IL-35(参与该T抑制活性的细胞因子)一致细胞亚群。有趣的是,髓样细胞减少的TGF-β表达,而不是总肺细胞的TGF-βmRNA水平与减少的Treg细胞扩张有关,不足以控制肺部炎症。
总而言之,我们的数据使我们认为NK,ILC3和NRC IL-22 ILC的存在减少,以及Th1和Th22细胞增殖的减少可能影响了IFN-γ介导的吞噬细胞和IL-22的杀真菌机制介导产生抗微生物肽由真菌感染在宿主发挥防御中起重要作用的上皮细胞的21,22,39,65,66。此外,这些低效的效应器机制似乎已通过减少Treg细胞的存在及其对TH17介导的组织病理学的抑制作用而得到加强。
我们使用特定AhR拮抗剂(CH223191)的数据证实了AhR信号在控制肺PCM中的重要免疫调节作用。与AhA缺陷小鼠相似,CH22319处理的WT小鼠表现出增加的真菌负荷,表达共刺激分子的髓样细胞数量增加,但包含IDO-1或AhR蛋白的数量减少。此外,在治疗小鼠的肺中,Th17细胞数量的增加与Th1,Th22和Foxp3 + Treg细胞的存在减少有关。这些数据表明,肺PCM可以被AhR配体调节,并且与实验性外阴念珠菌病中获得的相符,在后者中抗真菌免疫力和疾病严重性可以由AhR激动剂通过IL-22-IL-18串扰65来调节。
总之,这里的数据报告和原先由我们集团公布的36,37,38,39,68使我们能够确定IDO1 / AhR轴在对照Treg / Th17 / Th22发育和肺部PCM严重程度中的重要性。AhR表达的缺乏使免疫应答的固有阶段和适应性阶段失衡,从而导致对宿主的有害作用,其中不受限制的真菌生长与导致组织病理学的不受控制的炎症过程相关。但是,此处提供的数据开辟了有趣的免疫治疗视角,因为AhR的强力免疫调节活性可单独或暂时用作抗真菌药的辅助疗法,以调节针对巴西假单胞菌的免疫反应。感染和疾病严重程度。我们相信免疫调节程序具有实际重要性,因为用抗真菌剂治疗PCM可以长期持续并且具有重要的副作用,导致患者不依从和疾病复发。
方法
伦理声明
严格按照巴西联邦法律11,794建立了科学使用动物的程序,并根据建立圣保罗州动物保护法的州法律进行了实验。尽一切努力使动物的痛苦最小化。该程序已由圣保罗大学生物医学科学研究所动物实验伦理委员会(Proc.180 / 11 / CEEA)批准。
老鼠
八至12周大的雄性C57BL6 / J WT和B6.129- Ahr tm1Bra / J(AhR -/-小鼠)69,来自Jackson实验室,最初由Marc Veldhoen博士提供,并作为无特定病原体的小鼠繁殖。在整个研究过程中,使用了圣保罗大学生物医学科学研究所免疫学系的同基因育种单位。
真菌和感染
通过在Fava Netto培养基中于36°C每周培养,保持了来自巴西假单胞菌 18分离株(Pb18)的酵母细胞,并在培养的第6-8天使用。由Janus Green B活性染料(Merck)确定的真菌细胞的活力始终高于95%。如先前所述将小鼠麻醉并进行气管内感染(70)。简而言之,在腹膜内(ip)注射氯胺酮和甲苯噻嗪后, 通过外科手术接种动物,感染了1×10 6酵母细胞,该酵母细胞包含在50 µL PBS中,可以将真菌细胞直接分配到肺中。
CFU分析,死亡率和组织学分析
在肺和肝脏活酵母的数量通过的菌落形成单位(CFU)的数目先前所描述的计数测定71。死亡率研究是对10-12只小鼠进行的。每天记录死亡人数。为了进行组织学检查,用苏木精-伊红对5微米的组织切片进行染色以表征病变,并对它们进行银染(格罗科特染色)以进行真菌评估。使用Nikon DXM 1200c相机和Nikon NIS AR 2.30软件进行形态分析。如先前所述72,在每组5只小鼠的每张玻片的10个显微镜视野中测量损伤面积(以平方微米计)。结果表示为每只小鼠的病变总面积的平均值±SEM。
流式细胞仪评估白细胞亚群和细胞内细胞因子
在感染96小时,2周和10周后,收集来自巴西布鲁氏杆菌感染的WT和AhR -/-小鼠的肺,进行酶消化并按照前述方法制备肺白细胞39。对于细胞表面染色,将肺细胞以1×10 6 细胞/ mL的浓度悬浮在染色缓冲液中。Fc受体用未标记的抗CD16 / 32(eBioscience)封闭,然后在冰上用荧光团偶联的抗体染色30分钟。对于骨髓细胞,使用了以下抗体:抗CD11c,CD40,CD80,CD86和MHC-II(IAb +)。对于淋巴细胞:抗CD4,CD25,CD8,CD44和CD62L。为了进行ILC表征,首先用抗小鼠谱系混合物(Biolegend)处理肺白细胞,该抗小鼠谱系含有抗CD3,Ly6G / Ly6C,CD11b,CD45R / B220,TER 119 /红细胞的抗体,这些抗体会与T细胞,B细胞,单核细胞,巨噬细胞,NK细胞和红细胞。使用eBioscience转录因子染色试剂盒和针对IL-17,IL-4,IFN-γ,IL,22,IL-1β,IL-12,TNF-α,IL-6,TGF-β的特异性抗体进行细胞内染色,IL-10,FoxP3,IDO-1和AhR。细胞在FACSCantoII(BD Biosciences)上运行,并且使用FACSDiva软件(BD Biosciences)至少采集了50,000个事件。使用FlowJo软件(Tree Star)分析细胞。
RNA分离,cDNA合成和实时定量聚合酶链反应(RT–PCR)
如先前所述39从AhR -/-和对照小鼠的肺中分离RNA 。在NanoDrop ND-1000分光光度计上评估RNA纯度和浓度。使用高容量RNA转cDNA试剂盒(Applied Biosystems)按照制造商的指示,在20μL反应混合物中反转录1μg总RNA。将cDNA使用TaqMan通用PCR主混合物(Applied Biosystems)和预先开发TaqMan测定引物和探针(扩增IFNG,Mm001168134_m1,TNF, Mm99999068_m1,IL6,Mm00446190_m1,IL10, Mm00439614_m1,TGFB1,Mm00117882_m1,IL17, Mm00439618_m1,IL22,Mm01226722_m1,Tbet,Mm00450960_m1;Gata3,Mm00484683_m1;Rorc,Mm01261022_m1;Foxp3,Mm00475162_m1;Gapdh,Mm99999915_g1a,II,来自Applied Biosystems)。在MxP3000P QPCR系统上进行PCR测定,并使用MxPro qPCR软件(Stratagene)开发数据。将样品的平均阈值循环(CT)值标准化为Gapdh基因的CT值。相对表达通过2- ΔΔCT法确定。
细胞因子和一氧化氮检测
感染96小时,2周和10周后,无菌收集来自巴西疟原虫感染的WT和AhR -/-小鼠的肺,进行破碎,并将获得的上清液保存在-80°C。如先前所述39测量细胞因子和NO水平。捕获ELISA(酶联免疫吸附测定)用于测量IL-12,TNF-α,IL-1β,IL-6,IL-23,IL-27,IL-2,IFN-γ,IL -4,IL-17,IL-22,TGF-β,IL-10和IL-35,带有来自eBioscience或PBL的抗体对。使用分光光度计读板器(VersaMax,Molecular Devices)通过标准的Griess反应对一氧化氮的产生进行定量。所有测定均一式两份进行,结果表示为NO的微摩尔浓度。
用Ah223特异性拮抗剂CH223291治疗小鼠
如Kim等人所述,用AhR拮抗剂CH223191(InvivoGen)治疗小鼠。73,稍作修改。简而言之,雄性C57BL6 / J WT小鼠每周三次接受媒介物(玉米油)或CH223191(InvivoGen,2-甲基-4-o-甲苯基苯基酰胺)的剂量为20 mg / kg玉米油从感染当天开始持续2周。在感染96小时和2周后对小鼠进行分析。
统计分析
如先前所述68分析数据,并表示为M±SEM。通过非配对的学生t检验或方差分析(ANOVA),然后进行Tukey检验来分析组之间的差异。使用LogRank检验表征生存时间差异。使用GraphPad Prism 7.03软件(GraphPad Prism Software,Inc.)分析数据。p值≤0.05被认为是显着的。
|
|