COVID-19肺炎患者T细胞活化、衰老、衰竭和向TH17倾斜
摘要
受SARS-CoV-2感染的患者的免疫系统受到严重损害。迫切需要详细研究受COVID-19肺炎影响的患者的T细胞和细胞因子产生。在这里,我们表明,与健康对照相比,COVID-19患者的T细胞区室表现出几种改变,包括幼稚,中枢记忆,效应记忆和终末分化细胞,以及调节性T细胞和PD1 + CD57 +精疲力竭的T细胞。几个谱系特异性转录因子和趋化因子受体也存在重大改变。来自患者的终末分化T细胞的增殖少于健康对照组的T细胞,而其线粒体功能在CD4 +中相似两组的T细胞。患者显示出明显增加的促炎或抗炎细胞因子,包括1型和2型T辅助细胞因子,趋化因子和半乳糖凝集素。它们的淋巴细胞产生更多的肿瘤坏死因子(TNF),干扰素-γ,白介素(IL)-2和IL-17,最后的观察结果表明,阻断IL-17可以为COVID-19提供新的治疗策略。
介绍
严重急性呼吸系统综合症冠状病毒(SARS-CoV-2)引起的大流行病,导致2019年冠状病毒疾病(COVID-19)1,对我们的物种构成了巨大威胁,正在改变整个地区的日常习惯和社会行为。世界。在意大利,伦巴第地区发现了首例来源不明的严重肺炎患者,首次确诊病例始于2020年2月21日2。从那一刻起,我们发现大量肺炎患者无法预测,他们的治疗常常需要进入重症监护病房。不幸的是,许多患者在抵抗病毒方面失败了,截至6月18日,意大利在超过240,000例感染中已计有35,000例死亡。
这种病毒的病理生理尚未完全了解3,4。上引起的其他冠状严重疾病以前的研究表明,肺部炎症与促炎细胞因子的增加的血浆水平相关5,6。在患有COVID-19的患者中已经描述了类似的现象,他们可能会经历所谓的“细胞因子风暴7 ”。但是,对于这些介导物的产生所涉及的细胞或COVID-19患者的特异性免疫反应知之甚少。
目前,我们和其他人都观察到COVID-19是在老年患者中更为严重,尤其是在那些具有不同的合并症,糖尿病和肥胖,而它出现在儿童和孕妇更严重的8,9,10。免疫老化与慢性亚临床炎症状态有关,被定义为“发炎”,其中1型T辅助(TH)淋巴细胞起关键作用,而儿童和孕妇则倾向于产生TH2反应,因此产生的促炎分子较少11,12。为了更好地了解如何协调免疫应答和细胞因子的产生,我们对T细胞进行了深入研究,并研究了T细胞向TH1,TH2或TH17的功能分化。为此目的,我们采用了一系列流式细胞术方法,结合复杂的技术对复杂的T细胞表型进行无监督分析,并且我们研究了不同CD4 +和CD8 +T细胞亚群的增殖能力,以及CD4中的线粒体功能+ T细胞。我们终于测量了31种细胞因子的血浆水平和T细胞的多功能性。
我们小组进行的一项回顾性研究证明,能够阻断IL-6生物学活性的药物(例如tocilizumab)可以显着减少严重COVID-19肺炎(定义为伴随呼吸频率的发生)中的有创机械通气或死亡。每分钟≥30次呼吸,血氧饱和度≤93%,室内空气中的PaO 2 / FiO 2比<300 mmHg,并且肺浸润> 50%的肺,在24–48 h内发生[ 13]。即使需要通过随机试验确认我们的结果,也要注意的是,与对照组相比,接受托珠单抗治疗的COVID-19患者的严重感染发生率有所增加。
在这里,我们显示COVID-19患者的CD4 +和CD8 + T淋巴细胞绝对数量减少,这些数量显示与激活或衰竭/衰老相关的标记,以及主调节因子和几种趋化因子受体的表达改变。同时,他们的CD4 +以线粒体耗氧量和细胞外酸化率(ECAR)衡量,T细胞的细胞增殖发生改变,但线粒体功能没有改变。在这些患者中,血浆中可检测到的大量细胞因子风暴伴随着肿瘤坏死因子(TNF),干扰素(IFN)-γ,白介素(IL)-2的体外产生增加,以及偏向TH17或Tc17表型。这不仅强调了与细胞因子风暴相反的药物的功效,而且还提出了基于IL-17途径抑制作用的新策略的临床评估。
结果
患者特征
我们已经研究了39位患者,其中前21位在2020年3月12日至3月30日期间被摩德纳大学医院的传染病诊所连续收治,而其余患者则在4月15日至2007年3月之间进行了研究。 5月10日。所有患者的症状包括喉咙痛,发烧,咳嗽,呼吸困难和胸痛。入院时,通过实时逆转录酶PCR在鼻咽拭子样本中检测到SARS-CoV-2,随后通过X射线确认所有肺炎。补充表 1 - 4详细显示患者的个体临床和生物体液特征。请注意,通常它们是淋巴细胞减少的(平均:1150个细胞/μL,范围:360–2334),在某些情况下,淋巴细胞计数非常低。对于下文所述的免疫学分析,将它们与总共25个年龄和性别匹配的健康对照进行了比较。对于那些研究了T细胞表型的对照,我们可以测量淋巴细胞的绝对数量,其平均值为2320个细胞/μL,范围:1580–3130(对照组与患者:p <0.0001)。
CD4 + T细胞亚群的表征和计数
我们 使用18参数流式细胞术研究了患者和对照中的CD4 +和CD8 + T细胞。然后使用两种互补的方法对数据进行分析。首先,我们使用经典方法,即对给定细胞类型进行二维识别,然后是确定目标群体(即CD4 +或CD8 +淋巴细胞)所需的第一个门,然后依次进行门以识别激活,分化,衰老,衰竭,调节性CD4 + T细胞和记忆干T细胞(T SCM)。然后,通过适当的非参数统计检验对使用此门控策略获得的数据进行分析,并在图中以散点图的形式表示均值和均值的标准误。在第二部分中,我们进行了无监督分析,该分析考虑了CD4 +或CD8 + T细胞呈现的整个复杂情况。此分析技术使用通过FlowSOM元聚类获得的多维信息,再结合降维方法(如统一流形近似和投影(UMAP))获得多维信息。热图最终报告统计分析(有关详细信息,请参见方法)。使用相同的方法研究CD8 + T淋巴细胞。
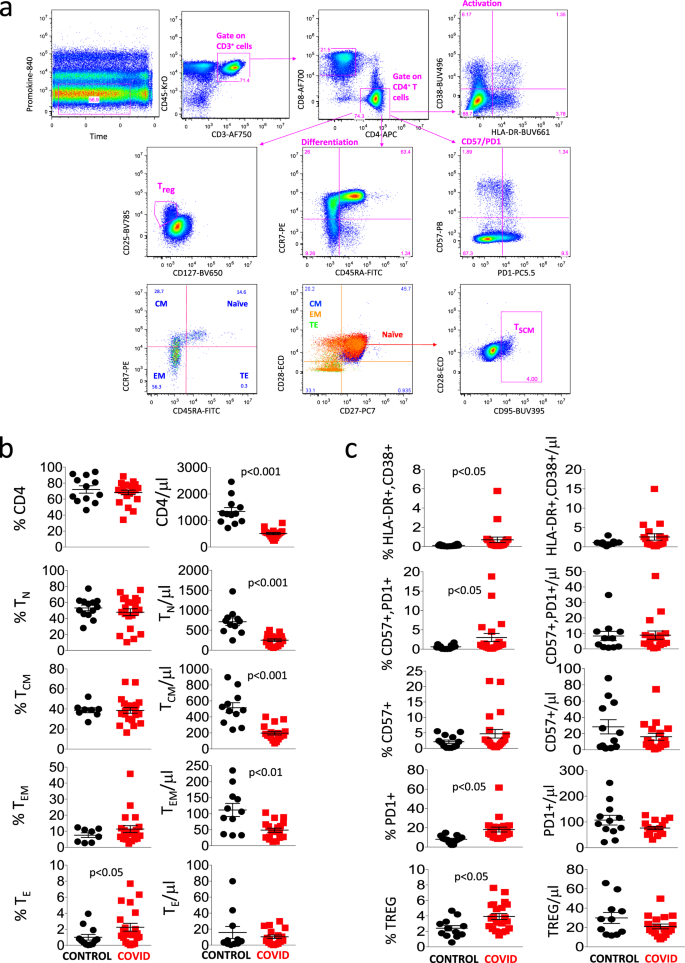
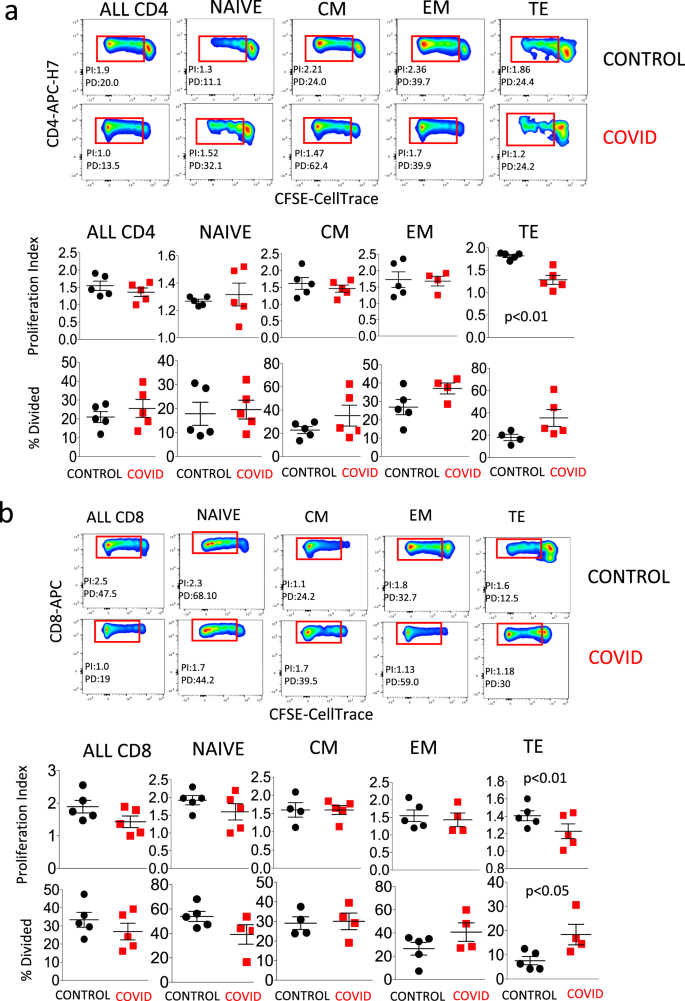
图 1a显示了上述门控策略,我们将其用于比较健康供体和COVID-19患者的CD4 + T细胞。在参数“时间”和“生存力”上设置第一个门,然后在CD3 +CD45 +细胞(即T淋巴细胞)上设置第二个门,其中我们鉴定出CD4 +或CD8 +淋巴细胞。在CD4 +人群中,我们分析了通常与T细胞活化(HLA-DR和CD38),衰老和衰竭(CD57和PD1),分化(CD45RA,CCR7,CD28和CD27),调节性T细胞(Treg,被认为是CD25 高和CD127 低),其中我们可以确定不同的分化阶段,最后是T SCM(即CD45RA中的CD95 +细胞+CCR7 + CD27 + CD28 +幼稚淋巴细胞)。
一种门控策略,用于分析与分化,激活状态,衰老和衰竭相关的标记,并鉴定CD4 + T细胞中的Treg和TSCM 。原始T细胞被鉴定为CCR7 + CD45RA + CD28 +CD27 +细胞;TSCM是CCR7 + CD45RA + CD28 + CD27 + CD95 + ; 中央存储器(CM)是CCR7 - CD45RA + CD28 + CD27 +/- ; 效应记忆(EM)是CCR7 −CD45RA − CD28 +/− CD27+/− ; 末端效应器(TE)是CCR7 - CD45RA + CD28 -CD27 +/-。活化的细胞是CD38 + HLA-DR + ; Treg是CD127 - CD25 + ; 精疲力竭/衰老的是PD1 + CD57 +。b,c对照(n = 13)和患者(n = 13)中不同CD4 + T细胞亚群的百分比和绝对数 = 21),通过手动选通获得。数据代表单个值,均值(中心条)±SEM(上下条)。通过双面曼-惠特尼非参数检验进行统计分析;如果未指示,则p值不显着。源数据作为源数据文件提供。
图 1b显示患者的CD4 + T细胞百分率与对照组相似,但这些细胞的绝对数量显着降低。就幼稚,中枢记忆和效应记忆CD4 + T细胞而言,观察到类似现象,而患者中终末分化(TE)细胞的百分比而非绝对数更高。图 1c报告说,患者的活化细胞(共表达HLA-DR和CD38),衰老/衰竭细胞(PD1 +CD57 +)和调节性T细胞(Treg)的百分比也更高,但不是绝对数。
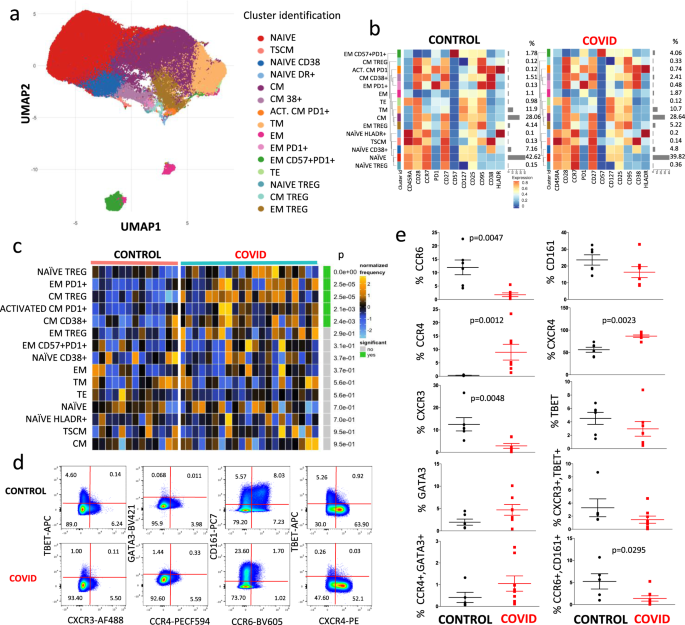
然后,我们使用了更复杂的方法来检测CD4 + T细胞的不同亚群中发生的精细变化。对于每位患者和对照组,将5000个CD45 + CD3 + CD4 + T细胞的数据输出并连接在一个唯一的矩阵中。我们使用FlowSOM 14通过无监督分析探索了T辅助细胞面板; 它基于自组织图(定义为“ SOM”)算法执行细胞的多元聚类,根据细胞的表面标记将细胞分类为相关的元簇。我们首先基于表面表达标记蛋白将所有单个细胞聚集成25个不同的簇。然后,为了降低复杂性,我们将彼此非常靠近的簇合并在一起,并根据激活,分化和耗竭作用,将细胞重新聚类为15个代表不同T细胞类型的元簇。这样做,我们使用降维方法“ UMAP”来区分几个CD4 + T细胞群体(图 2a),其百分比在图2b所示的热图中报告。 。可以立即识别出大量的幼稚T细胞(红色点),它们是CD45RA + CD28 + CCR7 + CD27 + CD127 + CD25 + CD95 - CD38 - HLA-DR - 15,并且在两组之间相似; 然后,我们鉴定了最近激活的表达CD38的幼稚T细胞和表达HLA-DR的T细胞。我们还发现一小部分代表CD4 +记忆干细胞的T细胞,其特征在于CD95和CD38 16的表达,在两组中相似。
CD4 + T细胞景观的统一流形近似和投影(UMAP)表示。b代表不同CD4 +的热图通过FlowSOM鉴定的T细胞簇,在健康对照和COVID-19患者中具有相对身份和百分比。热图上的颜色代表在所有样品的细胞上计算出来的arcsinh的中值(0-1转换标记表达),从蓝色(较低的表达)到红色(较高的表达)变化。左侧的树状图表示元簇之间的层次相似性(度量:欧几里得距离;链接:平均值)。每个群集均分配有唯一的颜色(左侧的栏)。沿着行(簇)的条形图和右边的值指示簇的相对大小。c对照品(条形:鲑鱼;n = 13)和COVID-19(翡翠;n)之间的差异分析 = 21)。热量代表反正弦平方根变换的细胞频率,随后将其按簇(行)归一化为均值零和标准偏差一。热量的颜色从蓝色(表示相对不足)到橙色(表示相对过度)变化。右边的条形和数字表示明显不同的丰富簇(绿色)和调整后的p值。聚类根据调整后的p值进行排序,因此顶部的聚类显示出两个条件之间最显着的丰度变化。d与门控CD4 +中不同趋化因子受体和谱系特异性转录因子的表达有关的代表性点图来自控件(上部)和患者(下部面板)的T。数字表示每个象限中的百分比。显示了13个实验中的两个实验(对照组一个,患者一个)。数字表示每个象限中的百分比。补充图1报告了用于鉴定CD4 + T细胞 的门控策略。e 通过手动门控获得的对照组(n = 6)和患者(n = 7)中不同CD4 + T细胞亚群的百分比。数据代表单个值(点),平均值(中心条)±SEM(上下条)。统计分析通过双面曼-惠特尼非参数检验进行;如果未指示,则p价值不重要。源数据作为源数据文件提供。
中央记忆T细胞的特征在于CD45RA,CD28,CD27,CD127和CD95分子的表达。在这些细胞中,已经鉴定出仅表达CD38的群体,以及被激活的细胞群体(HLA-DR + CD38 +),并且还表达PD1。在患者中,这两个人群的频率明显高于对照组。
关于效应子记忆区室,过渡效应子记忆T细胞的部分特征在于缺乏CD45RA和CCR7的表达,但是表达CD28。效应记忆细胞的特征在于缺乏CD45RA,CCR7,CD27,CD28,CD38和HLA-DR的表达,以及PD1,CD127和CD25的中等表达。此外,患者组中与疲劳相关的表达效应记忆的标志物(如PD1)明显更高。表达CD45RA,CD25,CD127和CD95的末端效应记忆T细胞在两组以及TSCM之间没有差异。
最后,我们很清楚,Foxp3的表达可以更好地鉴定T调节细胞(Treg),该表达在我们的面板中不存在。但是,由于CD127(低)和CD25(高)的表达,我们得以鉴定出三种不同的T调节细胞群:幼稚的(表达CD45RA +CCR7 +),中枢记忆(CD45RA - CCR7 +)和效应记忆的最有代表性的子集(CD45RA - CCR7 - )。健康供体和COVID-19的患者之间不同簇的比较示于图2 ℃。值得注意的是,患者的特征是原始Treg细胞的百分比更高(p该值低于通过软件提供的统计分析的下限(即<10 -9),更多的中央记忆Treg细胞,以及增加的表达PD1的活化中央记忆细胞。
我们能够更详细地分析来自7位患者和6位对照的细胞,测量几种趋化因子受体的表达以及被认为是主要调控因子的分子(即谱系特异性转录因子)的表达。图 2d显示了对照供体(上图)和COVID-19患者的CD3 + CD4 +细胞内细胞计数分析的代表性比较。补充图1报告了用于鉴定CD4 + T细胞 的门控策略。
如图2e所示 ,患者表现出较低百分比的表达CCR6或CXCR3的细胞,以及共表达CCR6和CD161的那些细胞,但较高百分比的CXCR4 +或CCR4 +细胞。T-bet或GATA3的表达没有差异。
CD8 + T细胞亚群的表征和计数
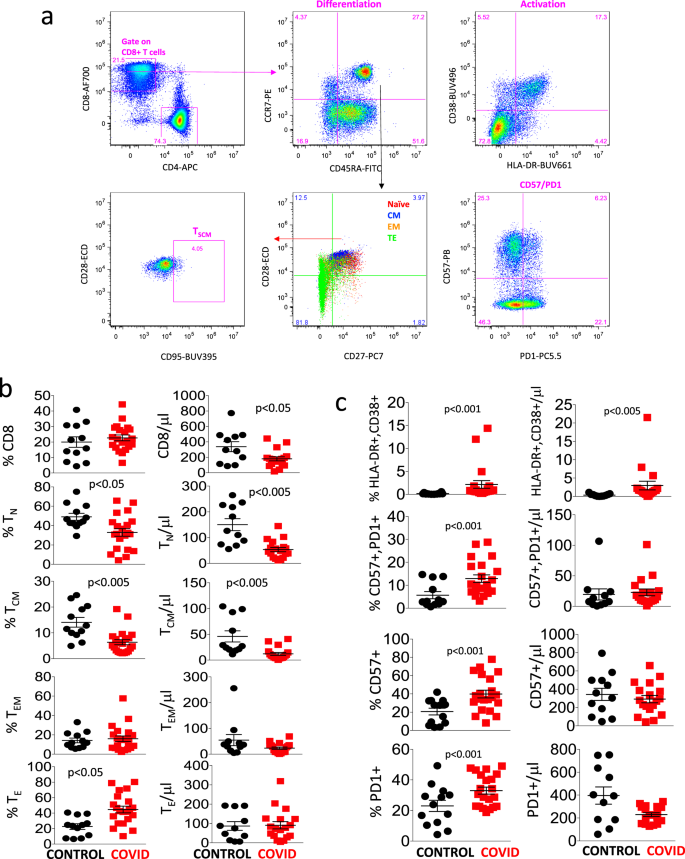
图 3a显示了我们用于鉴定不同类型的CD8 + T细胞的手动门控策略,与用于CD4 + T细胞的策略相似。如图3b所示 ,健康捐献者和COVID-19患者在总CD8 + T细胞中所占的百分比相当,即使患者中的绝对数目较低。幼稚和中央记忆细胞的百分比和绝对数均较低,而TE细胞的百分比而非绝对数则较高。
一种门控策略,用于分析分化,激活状态,衰老和衰竭的标志物,以及CD8 + T细胞内TSCM的鉴定。幼稚T细胞被鉴定为CCR7 + CD45RA + CD28 + CD27 + ; TSCM是CCR7 + CD45RA + CD28 + CD27 + CD95 + ; 中央存储器(CM)是CCR7 −CD45RA + CD28 + CD27 +/−,效应子存储器(EM)CCR7 − CD45RA − CD28 +/-CD27 +/−; 末端效应器(TE)是CCR7 - CD45RA + CD28 - CD27 +/-。活化的细胞是CD38 + HLA-DR + ; 精疲力竭/衰老的是PD1 + CD57 +。b,c 通过手动门控获得的对照组(n = 13)和患者(n = 21)中不同CD8 + T细胞亚群的百分比和绝对数。数据代表单个值,均值(中心条)±SEM(上下条)。通过双面曼-惠特尼非参数检验进行统计分析;如果未指示,则p价值不重要。源数据作为源数据文件提供。
图 3c报告了患者具有更高百分比和绝对数量的活化细胞(表达HLA-DR和CD38),以及更高百分比的表达PD1和/或CD57(与细胞衰老/疲惫相关的标志物)的细胞。就干细胞记忆细胞而言,没有差异,与CD4 + T淋巴细胞之间的差异相似(未显示)。
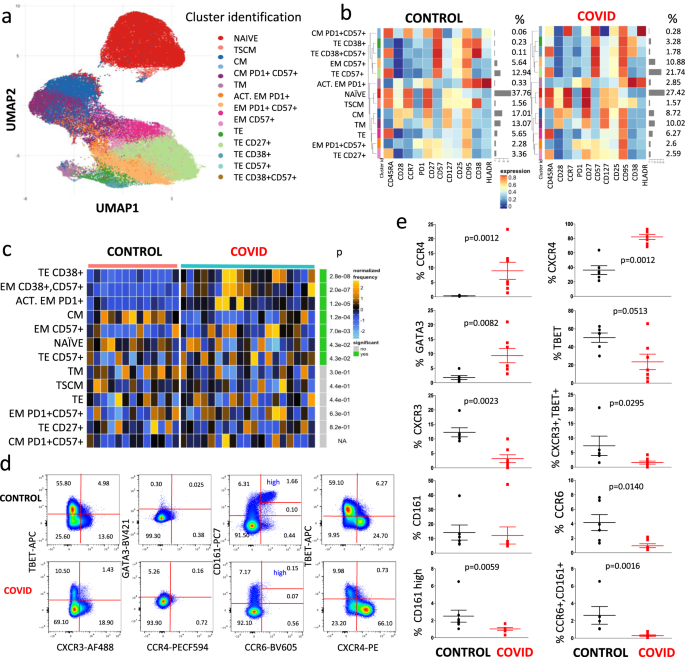
然后,我们通过使用FlowSOM元聚类来研究CD8的表型进行同样的无监督分析+ T细胞,通过在图中表示的UMAP 4A和由图热图4湾 在这种情况下,确定并分析了13个群集。
CD8 + T细胞景观的统一流形近似和投影(UMAP)UMAP表示。b代表由FlowSOM识别的不同簇的热图,以及对照和患者中的相对身份和百分比。热图中的颜色表示在所有样本的细胞上计算出来的arcsinh的中值(0-1转换标记表达),从蓝色(表示较低的表达)到红色(表示较高的表达)变化。左侧的树状图表示元簇之间的层次相似性(度量:欧几里得距离;链接:平均值)。每个群集均分配有唯一的颜色(左侧的栏)。沿行(簇)的条形图和右侧的值指示簇的相对大小。CCTR(条形:鲑鱼;n = 13)和COVID-19(翡翠;n = 19)之间的差异分析。热量代表反正弦平方根变换的细胞频率,随后将其按簇(行)归一化为均值零和标准偏差一。热量的颜色从蓝色(表示相对不足)到橙色(表示相对过度)变化。右边的条形和数字表示明显不同的丰富簇(绿色)和调整后的p值。聚类根据调整后的p值进行排序,因此顶部的聚类显示出两个条件之间最显着的丰度变化。d代表性的点图与来自对照供体(上部)和患者(下部)的门控CD8 + T 中不同趋化因子受体的表达和谱系特异性转录因子的表达有关。显示了13个实验中的两个实验(对照组一个,患者一个)。数字表示每个象限中的百分比。补充图1报告了用于鉴定CD8 + T细胞 的门控策略。e对照(n = 6)和患者(n的不同CD8 + T细胞亚群的百分比 = 7),通过手动选通获得。数据代表单个值(点),平均值(中心条)±SEM(上下条)。统计分析通过双面曼-惠特尼非参数检验进行;如果未指示,则p值不显着。源数据作为源数据文件提供。
如图4c所示,该图 显示了患者与对照中趋化因子受体和主调节因子的统计分析,COVID-19患者的特征是末端效应细胞单独或与CD57结合表达CD38的终末效应细胞百分比更高,并且激活的效应子记忆表达PD1或CD57的细胞。他们还显示出幼稚和中枢记忆T细胞的百分比明显降低,这可能表明患者表现出了疲惫的CD8 + T细胞区室。
图 4d显示了对照供体(上图)和COVID-19患者(下图)中CD3 + CD8 +细胞的细胞计数分析的代表性比较。补充图1报告了用于鉴定CD8 + T细胞 的门控策略。我们还可以确定CD8 + T淋巴细胞表达高水平的CD161,以及CCR6,存在于大多数以Vα7.2T细胞受体17为特征的粘膜相关不变T(MAIT)细胞中。关于趋化因子受体和转录因子在CD8 + T细胞中的表达,我们发现患者表达的CCR6 +百分比较低CXCR3 +,T-bet +或CD161 高细胞,以及CXCR3 + T-bet +或CCR6 + CD161 +淋巴细胞(图 4e);他们也有较高百分比的细胞表达CCR4,CXCR4或GATA3。
T细胞增殖和线粒体生物能
与CD4 +细胞相关的图5a在上图中 显示了门控策略,用于鉴定经历了两种细胞增生的细胞(将起源归因于所谓的“增殖指数” PI,由红色的那些事件表示)矩形)或复制不同的时间(“百分比划分”,PD,与不同的荧光峰有关)。显示了健康对照和COVID患者的代表性实例。下图比较了五位患者和五个对照,并显示来自患者的TE CD4 + T细胞的增殖指数较低。图 5b显示了应用于CD8 +的相同分析T细胞。在这种情况下,患者显示出明显较低的增殖指数和较高的分裂细胞百分比。补充图2报告了用于研究CD4 +和CD8 + T细胞中 细胞增殖的门控策略。
a上两行:与 来自对照供体(上图)和患者(COVID,下图)的不同类型的CD4 +T细胞中细胞增殖相关的代表性点图。下两行表示所有CD4 + T细胞或幼稚,中央记忆(CM),效应记忆(EM)或终末分化(TE)细胞中的增殖指数和分裂细胞的百分比。数据代表五位患者和五位对照的个体值(点),均值(中心条)±SEM(上下条)。统计分析通过双面曼-惠特尼非参数检验进行;如果未指示,则p值不显着。补充图2报告了用于鉴定CD4 + T细胞的门控策略。 2。b上两行:与来自对照供体(CTR,上图)和患者(COVID,下图)的不同类型CD8 + T细胞中细胞增殖相关的代表性点图。下两行表示所有CD8 + T细胞或幼稚,中央记忆(CM),效应记忆(EM)或终末分化(TE)细胞中的增殖指数和分裂细胞的百分比。数据代表五位患者和五位对照的个体值(点),均值(中心条)±SEM(上下条)。统计分析通过双面曼-惠特尼非参数检验进行;如果未指示,则p值不显着。识别CD8 +的门控策略T细胞在补充图2中报道 。
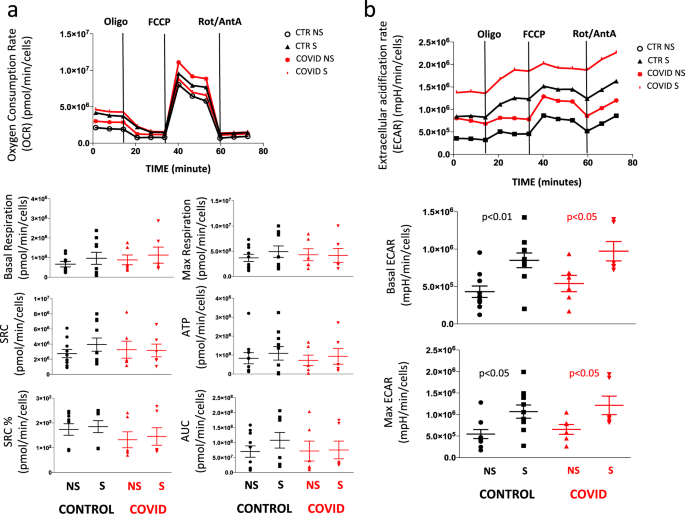
在通过磁选纯化的CD4 + T细胞中研究了细胞生物能,并用抗CD3加抗CD28 mAb刺激过夜或不刺激。与线粒体耗氧率(OCR)分析相关的图 6a显示,受激(S)或非激对照和患者的刺激(NS)细胞。与ECAR分析相关的图 6b显示,来自患者和对照的受刺激(S)或NS细胞具有相同的从呼吸转换为糖酵解的能力,并且具有相似的基础和最大ECAR。
a(来自12个实验的) 代表性示踪,来自健康对照(CTR; n = 7)和COVID患者(n的未刺激的(NS)和受刺激的(S)CD4 + T细胞的耗氧率(OCR) = 5)。在基础条件下以及针对指定的线粒体抑制剂的响应情况下实时测量OCR:寡霉素(Oligo,2μM),氰化物-4-(三氟甲氧基)苯hydr(FCCP,0.5μM)和抗霉素A加鱼藤酮(Rot / AA ,0.5μM)。直方图显示了抗CD3 / 28刺激的细胞中基础呼吸,最大呼吸,备用呼吸能力(SRC),ATP关联呼吸(ATP),SRC百分比和曲线下面积(AUC)的定量或来自对照组和患者的非刺激性(NS)。SRC的百分比表示第七次和第三次测量之间的比率。通过分析从第六次测量到第十一次测量的曲线下面积获得AUC。数据代表7位患者和5位对照的个体值(点),均值(中心条)±SEM(上下条)。b来自一名健康对照(CTR)和一名COVID患者的未刺激(NS)和受刺激(S)CD4 + T细胞的胞外酸化率(ECAR)的代表性痕迹(在12个实验中)。ECAR是在基础条件下和对FCCP的响应下进行测量的。数据代表来自七个对照组和五名患者的个体值,即平均(中心柱)±SEM(上下柱),涉及抗CD3 / 28或未刺激(S)的细胞刺激(S)中基础ECAR和最大ECAR的定量NS)来自对照组和患者。双面Mann-Whitney非参数检验的统计分析表明,对照组和患者之间无统计学差异。
检测患者血浆中的细胞因子风暴
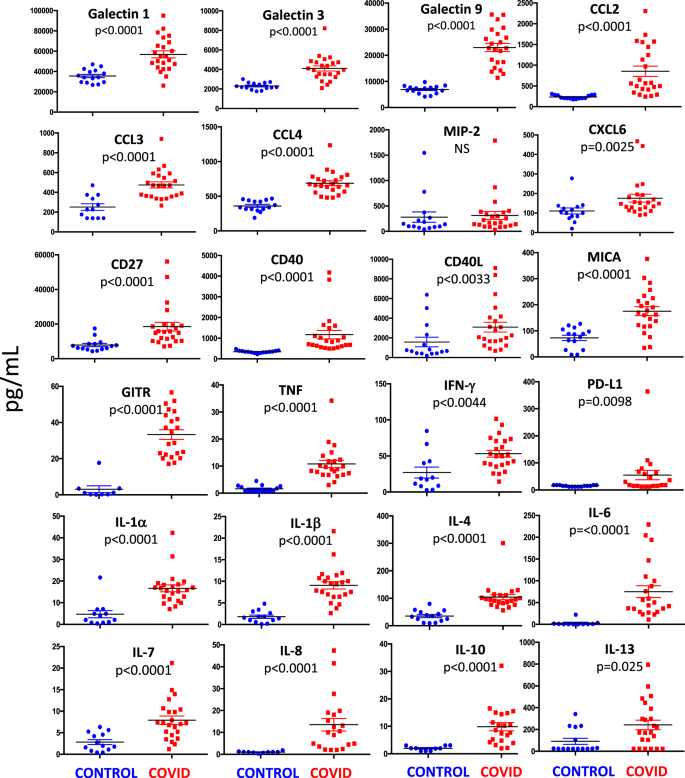
我们测量了21位患者和13位健康对照者的31种细胞因子,趋化因子和免疫相关分子的血浆水平(图 7)。我们发现galectin-1,galectin-3,galectin-9,CC基序趋化因子配体2(CCL2,也称为MCP-1),CCL3(也称为MIP-1a),CCL4(也称为MIP-1b) ),CXC基序趋化因子配体6(CXCL6),CD27,CD40,CD40L,TNF,IFN-γ,IL-1α,IL-1β,IL-4,IL-6,IL-7,IL-8,IL- 10,IL-13主要组织相容性复合物I类链相关蛋白A(MICA),糖皮质激素诱导的TNFR相关蛋白(GITR,也称为受体超家族成员18)和程序性死亡配体1(PD-L1)分别为与对照组相比,COVID-19患者的病死率明显更高。就MIP-2(也称为CXCL2)而言,没有发现统计差异。
可能由于多重分析的技术限制,在大多数患者和对照中未检测到CCL7,GITR,IL-2,IL-3和IL-5。同样由于几乎在所有健康对照中均未检测到IL-12p70,IL-15和IL-17的水平,我们无法进行统计比较,即使在大多数患者中,这些细胞因子的含量也处于可检测水平。
促炎细胞因子的体外生产
我们研究了CD4 +和CD8 + T细胞的六种不同功能,包括IFN-γ,IL-17,IL-2,TNF和颗粒酶B的产生,以及脱粒标记CD107a 18的表达。
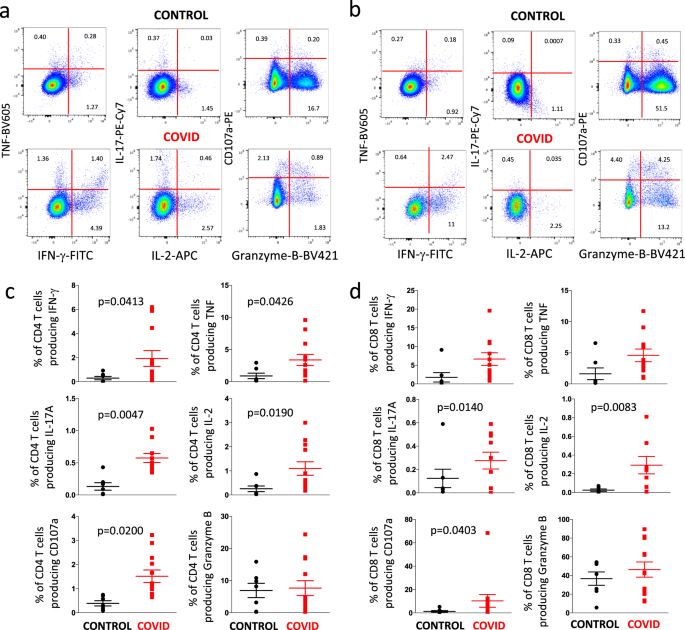
图 8示出了检测细胞内细胞因子和CD107a的在CD4存在的代表性实例+ T细胞(图8 a)或CD8 + T细胞(图8 B)来自健康供体(对照,上部象限)和一个病人(下象限)。补充图3报道了用于研究CD4 +和CD8 + T细胞中细胞 内细胞因子的门控策略。如(图8 c)中所述,与六个对照相比,CD4 + 来自八名COVID-19患者的T细胞能够产生TNF,CD107a,IFN-γ,IL-2,尤其是IL-17(显示出最高的差异)。两组中颗粒酶B的产生相似。在CD8 + T细胞中也存在类似的趋势(图8 d),用抗CD3 / CD28刺激可显着提高CD107a,IL-17,尤其是IL-2的产量。就TNF和IFN-γ的产生而言,存在即使没有达到统计学显着性的趋势。
一个代表性的点图(18个实验中的一个)与抗供体CD3 / CD28体外刺激后,供体(上图)和COVID患者(下图)的CD4 + T细胞的细胞内细胞因子染色有关。补充图3报告了用于鉴定CD4 + T细胞 的门控策略。b代表性点状图(18个实验中的点状图)与对照供体(上图)和COVID患者(下图)在用抗CD3 / CD28体外刺激后CD8 + T细胞的细胞内细胞因子染色有关。补充图3报告了用于鉴定CD8 + T细胞 的门控策略。c 在体外用抗CD3 / CD28刺激后,CD4 + T细胞产生的IFN-γ,TNF,IL-17,IL-2,CD107a和颗粒酶B的总产量之间的比较。数据代表六个对照组和八名患者的个体值,均值(中心线)±SEM(上下线)。通过双面曼-惠特尼非参数检验进行统计分析;如果未指示,则p值不显着。d比较CD8 +产生的IFN-γ,TNF,IL-17,IL-2,CD107a和颗粒酶B的总产量用抗CD3 / CD28体外刺激后的T细胞。数据代表六个对照组和八名患者的个体值,均值(中心线)±SEM(上下线)。通过双面曼-惠特尼非参数检验进行统计分析;如果未指示,则p值不显着。
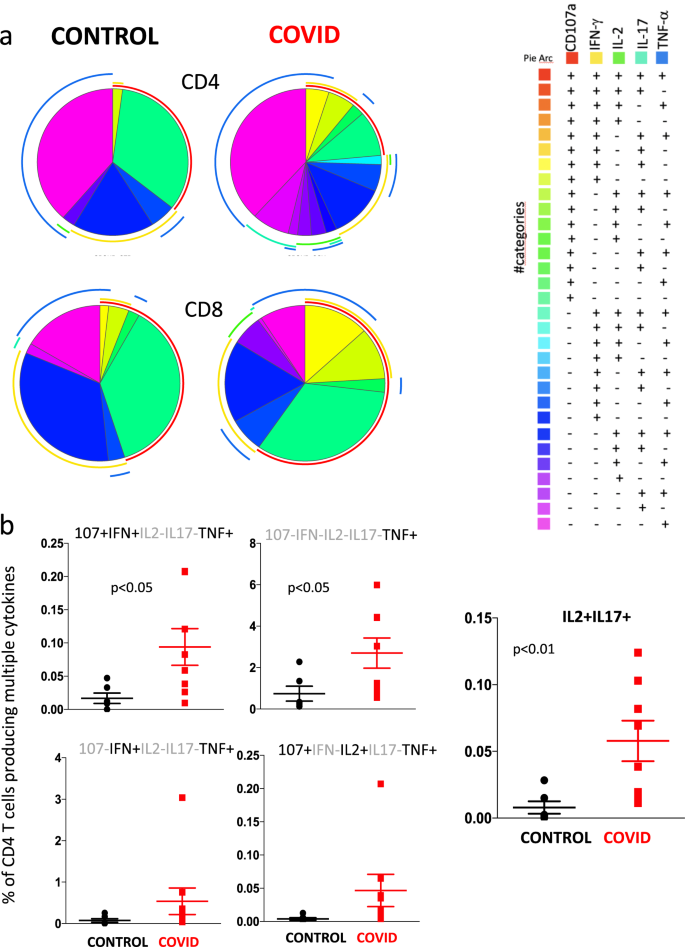
然后,我们通过分析同时产生的TNF,CD107a,IFN-γ,IL-2和IL-17来研究CD4 +和CD8 + T细胞的多功能性(图 9)。要注意的是,在这种情况下,我们指出了发挥一种或多种功能的细胞百分比(考虑整个细胞集合,即100%),而没有考虑全局响应的力量19。基于五个标记的使用,我们可以区分31种不同的CD4 +或CD8 + T细胞群体,它们能够产生一个或多个分子。分析中排除了无活性的人群,即所有五个标记物均为阴性的人群的五倍。图 9a显示了CD4来自患者和对照的+和CD8 + T细胞具有非常全面的多功能模式。然而,与对照相比,患者中以更高的比例存在产生TNF 的CD4 + T细胞的不同功能类型(图 9b)。此外,与对照相比,患者还显示出更多同时产生IL-2和IL-17的细胞,从而证实了上述报道。
讨论区
在这项研究中,我们描述了COVID-19肺炎患者T细胞区室的主要变化。多数患者为淋巴细胞减少症,并且大多数患者不需要无创通气,这表明在采血时该病很严重,但病情尚未发展到需要插管和机械通气的程度。因此,我们的数据表明,当感染变得与临床相关时,存在几种免疫改变。这些数据也与最近描述的轻度至中度COVID-19患者的免疫学变化相符,该患者需要住院治疗,并显示活化T细胞显着增加20。对无症状感染者的研究对于更好地了解COVID-19的免疫发病机制至关重要。
在COVID-19肺炎患者中,我们发现CD4 +或CD8 + T细胞产生体外IL-17的能力增强,该能力能够增强炎症反应并激活中性粒细胞。在外周血中,患者还显示出表达CCR6的CD4 +和CD8 + T细胞的百分比较低,而CD161的水平较高,这分别是TH17和粘膜相关性不变T(MAIT)细胞的典型特征。感染了猿猴免疫缺陷病毒的猕猴中循环CD4 + CD161 + CCR6 +细胞的丢失有助于疾病进展,并且已表明这些细胞在直肠粘膜中蓄积,从而增强炎症21。在相同的感染模型中,肺中存在的产生IL-17的CD8 + CD161 +细胞的百分比可以比外周血 22高四倍。此外,与外周血相比,肺中存在的细胞能够产生更多的IL-17。综上所述,这些发现强调了IL-17在COVID-19中的重要性,并可能为基于IL-17被现有生物药物阻滞的新型治疗方法铺平了道路。
关于SARS-CoV-2感染患者的T细胞区室变化的数据很少。先前的研究表明在T细胞家族,其特征是用尽的体征的变化23,24。在大多数COVID-19的患者的T细胞亚群的比例可以保持在正常范围内,但降低可以在CD4存在+和CD8 + T细胞计数或在CD4 + / CD8 +比例25,26。我们的数据与这些观察结果一致,但通过对CD4 +和CD8 +的不同亚群的分析得到了增强T淋巴细胞。的确,一方面,仅使用与幼稚,记忆或效应细胞相关的标志物就不会检测到患者和对照之间的明显变化,另一方面,我们更复杂,更详细的分析显示出显着差异。
调节性T细胞是调节免疫稳态和自身耐受至关重要的27,28。它们表达叉头框转录因子Foxp3,但也可以通过检测IL-2受体α链(CD25)和IL-7受体α链(CD127)的低/空表达的高表达识别29,沿与其他表面分子如CD39和CD73 30,31。它们会抑制自身免疫现象,浸湿,过敏反应,或块移植排斥反应,但他们也可以抑制对入侵的病原体或肿瘤保护性免疫反应32。在这里,我们显示来自COVID-19患者的外周血中不同类型Treg的百分比增加,并且他们的血浆中含有大量的抑制性细胞因子IL-10。
患有COVID-19的患者表达CD57 的CD8 + T细胞数量增加,这被认为是体外复制衰老的关键标志,并且与人类衰老或长期慢性感染有关33。CD57已被用于检测患有自身免疫性疾病,感染性疾病和癌症的患者的功能性免疫缺陷。有人提出,CD57 +细胞对激活诱导的细胞死亡表现出很高的敏感性,尽管激活后仍保留了分泌细胞因子的能力,但它们却无法进行细胞增殖34。我们发现TE CD4 +和CD8 +之间的增殖指数降低来自COVID-19患者的T淋巴细胞。T细胞表现出疲惫状态的表型特征,包括抑制性受体(如PD1)的表达上调。T细胞衰竭的特征是功能无反应,可防止大规模免疫激活和相关的自身免疫组织损伤。因此,有可能在COVID-19患者中,这些细胞的激活不仅伴随着克隆扩增的缺乏(如增殖减少所显示),而且还伴随着引起炎症分子的产生。
此外,我们观察到来自患者的细胞显示出更高百分比的不同细胞类型的PD1表达,PD1是诱导和维持外周耐受以及维持T细胞稳定性和完整性的关键分子35。PD1 / PD-L1轴还介导有效的抑制信号,以阻断T效应细胞的增殖和功能,从而对抗病毒免疫产生不良影响。我们发现患者的PD-L1血浆水平明显升高,需要进行研究以了解感染是否以及如何通过这种途径抑制有效的抗病毒免疫反应。
通过促炎细胞因子和趋化因子水平升高所证明的过度的炎症反应已受SARS-CoV的疫情患者在2003年被描述36,37。此外,体外实验显示从那些患者,若干不同的细胞类型能够产生大量的细胞因子的38,39。在具有MERS-CoV感染的患者中还报告了血浆高水平的促炎分子,表明TH1 / TH17反应,且IFN-γ,TNF,IL-15和IL-17 40的浓度增加。在被MERS冠状病毒感染的患者中,已经描述了相似的数据,以及T细胞在体外产生的细胞因子偏斜41。在我们的COVID-19患者中,许多促炎性细胞因子和趋化因子的血浆浓度急剧增加,这与上述所有描述所谓“细胞因子风暴”的报道一致42。
必须考虑存在由多种细胞类型产生并作用于先天免疫细胞的大量分子的影响。在这些分子中,IL-8可能特别重要,因为它会从血液中吸收中性粒细胞到感染或受伤的组织中。IL-8的产生可以被多种刺激物诱导,包括TNF,IL-1,细菌,病毒和细胞应激,它可以由多种细胞类型合成,包括单核细胞,巨噬细胞,内皮和上皮细胞,成纤维细胞,T淋巴细胞,肝细胞,滑膜细胞和角质形成细胞43。它的受体CXCR1和CXCR2在嗜中性粒细胞,单核细胞,CD8 + T和NK细胞,肥大细胞,嗜碱性粒细胞和髓样来源的抑制细胞。在中性粒细胞中,受体激活刺激脱粒和产生活性氧44。当呼吸道病毒(例如SARS-CoV-2)进入肺泡时,它首先会遇到并感染肺泡上皮细胞,然后可以产生IL-8,IL-8进而吸引并激活嗜中性粒细胞和巨噬细胞。这些开始损害器官,最终引发一系列更为复杂的致病事件,其中包括内皮损伤,血小板活化和血管内血栓形成。尽管无法精确确定IL-8的产生部位,即使对于我们的肺炎患者,也可以合理地假设肺泡细胞与这种现象密切相关。
出人意料的是,我们还观察到典型的TH2细胞因子(包括IL-4,IL-10和IL-13)的血浆显着增加。这可能表明免疫系统的激活确实是巨大的,不分青红皂白地涉及所有细胞,并且类似于细菌性脓毒症发生时,可能引起某种形式的免疫麻痹45。
与对照组相比,患者的Galectin-1,galectin-3和galectin-9增加。半乳凝素代表可溶性β-半乳糖苷结合蛋白家族,广泛表达于炎症和感染部位,已作为一类新型的损伤相关分子模式(DAMPs)或与分辨率相关的分子模式出现,用于放大或纠正炎性应答46,47。特别地,半乳凝素-1通常通过抑制许多先天性和适应性免疫程序而充当促溶介质。相反,已提出半乳凝素3和-9充当警报蛋白(或DAMP),可在脓毒症和几种感染类型中放大炎症反应。据我们所知,这些是描述COVID-19患者中这些类型可溶性介体存在的首个数据,需要进一步研究以研究其在疾病免疫发病机制中的重要性,或将其视为潜在的治疗靶标。
细胞因子的大量产生和释放与多克隆,超抗原驱动的T细胞活化过程中发生的过程非常相似48。与对照相比,在来自COVID-19患者的血浆中确实观察到TH1分子(如IFN-γ)水平增加了四倍。IFN-γ激活巨噬细胞,产生促炎性细胞因子,然后使系统不堪重负。当用抗CD3 / 28刺激患者的细胞时,CD4 +与健康对照相比,观察到产生IFN-γ,TNF,IL-17和IL-2的T细胞。这表明来自COVID-19患者的T细胞具有比对照更高的能力,在体外对产生潜在危险分子的刺激性挑战做出反应。正在进行研究以研究特定T细胞的功能表型,即那些对源自SARS-CoV-2的肽抗原有反应的细胞。
众所周知,血清促炎细胞因子和趋化因子水平升高是导致细胞因子风暴的原因之一,这是由某些冠状病毒株引起的疾病严重性增加的原因。由T细胞衰竭和抑制性细胞因子(如IL-10)介导的独特的免疫调节系统负责限制过度炎症,并在肺部稳态中发挥重要作用。因此,免疫激活和免疫抑制水平的平衡对于抵抗高致病性冠状病毒感染的宿主防御可能至关重要。
我们深知研究的局限性。首先,事实上,相对较少的患者数量是根据相似的临床特征选择的,因此我们无法将其划分为轻度或严重感染过程的患者,具有足够的统计能力进一步分析。其次,由于以下事实:研究始于根本没有任何治疗的情况,并且在采血后的几天中,某些患者会得到治疗,而其他患者则没有得到治疗,因此很难理解哪些免疫修饰可以被视为肝癌的预测标志物。感染的自然遏制或治疗的成功。第三,对于本研究,我们无法提供纵向数据,而只是将队列与健康捐献者进行了比较。但是,在COVID-19的肺炎患者中,我们发现存在:(i)T细胞衰竭,活化和衰老的标志物增加;(ii)不同T细胞亚型的分化改变;(iii)各种细胞因子的血浆水平高,从具有促炎作用的细胞因子到能够抑制免疫反应的细胞因子,从那些指示向TH1倾斜的信号到显示向TH2倾斜的那些信号;(iv)大量体外产生多种细胞因子,活化细胞可能会向TH17表型倾斜;(v)减少位于肺和其他组织中的循环细胞,并募集嗜中性白细胞。(iii)各种细胞因子的血浆水平高,从具有促炎作用的细胞因子到能够抑制免疫反应的细胞因子,从那些指示向TH1倾斜的信号到显示向TH2倾斜的那些信号;(iv)大量体外产生多种细胞因子,活化细胞可能会向TH17表型倾斜;(v)减少位于肺和其他组织中的循环细胞,并募集嗜中性白细胞。(iii)各种细胞因子的血浆水平高,从具有促炎作用的细胞因子到能够抑制免疫反应的细胞因子,从那些指示向TH1倾斜的信号到显示向TH2倾斜的那些信号;(iv)大量体外产生多种细胞因子,活化细胞可能会向TH17表型倾斜;(v)减少位于肺和其他组织中的循环细胞,并募集嗜中性白细胞。
总之,在COVID-19患者中,存在着在分化不同阶段的细胞内免疫抑制,激活,衰竭和复杂变化的伴随方面,并且产生并释放出多种细胞因子。出现的总体情况突显了SARS-CoV-2在很短的时间内激发出免疫反应的能力,但幸运的是,并非在所有感染的个体中都能激发出这种活性。但是,由于科学界对COVID-19免疫发病机制的研究做出了巨大努力,病毒感染的进展开始显示出一些可能与治疗相关的弱点。例如,目前存在一种基于阻断IL-6途径的药物的治疗方法,13,49。IL-17在募集和激活嗜中性粒细胞中至关重要,嗜中性粒细胞可以迁移到肺并大量参与COVID-19的发病机理。我们在此显示,COVID-19患者中存在T细胞活化朝TH17功能表型的显着倾斜,因此,我们建议通过已经可用并用于治疗不同病理的生物药物阻断IL-17途径可能是一种新颖的方法,治疗SARS-CoV-2感染患者的其他策略。
方法
学习规划
这是一个病例对照,横断面,单中心研究,得到当地伦理委员会(Comitato Etico dell'Area Vasta Emilia Nord,方案编号177 / 2020,2020年3月11日)和大学医院委员会(Direzione)的批准Sanitaria dell'Azienda Ospedaliero-Universitaria di Modena,协议编号7531,2020年3月11日)。每个参与者,包括健康对照者,都根据《赫尔辛基宣言》提供了知情同意,并且人类材料的所有使用均已获得同一委员会的批准。该研究共纳入39名COVID-19患者;他们的中位年龄为64岁(范围在35-94之间),其中女性7位,男性32位。根据年龄和性别对患者进行匹配,总共有25名健康捐献者(CTR),中位年龄为60岁(33-66岁)。我们记录了人口统计数据,病史,症状,体征,体温,以及每位患者的主要实验室检查结果。将数据编码并记录在Excel 14.1.0 for Mac中的传染病诊所中存在的数据库中,并按常规使用。根据常规方法,在大学医院临床实验室通过血细胞计数器分析外周血中白细胞的总数和类型。
血液收集和单核细胞分离
在含有乙二胺四乙酸的抽真空中,从每位患者中收集多达20毫升的血液。立即处理血液。根据标准程序50,使用ficoll-hypaque进行外周血单核细胞(PBMC)的分离。然后将PBMC以5–10百万/ mL的不同等分试样的浓度保存在补充有10%二甲基亚砜的胎牛血清中的液氮中。然后收集血浆,离心两次,并保存在-80°C直至使用。测量来自个别患者;在血浆情况下,每次测量均一式两份,仅考虑并显示平均值。
多色流式细胞仪检测T细胞免疫表型
解冻后的PBMC用补充了10%胎牛血清和1%的谷氨酰胺,丙酮酸钠,非必需氨基酸,抗生素,0.1 M HEPES,55μMβ-巯基乙醇和0.02 mg / ml DNAse 51的 RPMI 1640洗涤两次。
为了详细分析T细胞表型,对PBMC进行了计数,并用Duraclone IM T细胞板(来自贝克曼库尔特,迈阿密,佛罗里达州)添加了另外五种荧光mAb和细胞活力标记,对多达一百万个PBMC进行了染色。除侧面和向前散射信号外,还从不同的荧光染料标记的mAb(即与Krome Orange共轭的CD45,CD3 APC-A750,CD4 APC,CD8 AF700,CD27 PC7,CD57太平洋蓝,CD279(PD1)PC5)获得信号。 5,CD28 ECD,CCR7 PE,CD45RA FITC,HLA-DR BUV661,CD127 BV650,CD25 BV785,CD95 BUV395,CD38 BUV496和PromoFluor-840(Promokine,PromoCell,Heidelberg,Germany)。在CytoFLEX LX流式细胞仪(Beckman Coulter)18上,每个样品至少采集500,000个细胞。
为了分析T细胞偏向TH1,TH2或TH17以及趋化因子受体的表达,将解冻的PBMC用PBS洗涤两次,并用生存力标记AQUA LIVE DEAD(ThermoFisher)染色。然后,洗涤多达一百万个细胞,并在37°C下用以下mAb染色:抗CXCR3-AF488,-CXCR4-PE。再次洗涤细胞,并在室温下用抗CD161-PC7,-CCR6-BV605,-CCR4-PE-CF594,-CD4-AF700,-CD8-APC-Cy7染色。使用Foxp3 /转录因子染色缓冲液组(ThermoFisher)洗涤,固定和透化细胞。最后,将细胞用抗GATA3-BV421和抗TBET-APC染色,并洗涤。使用Attune NxT声聚焦流式细胞仪(ThermoFisher)至少获得500,000 PBMC。
补充表 5显示了本研究中使用的所有克隆和单克隆抗体。
高参数流式细胞仪的表示
将流式细胞术标准(FCS)3.0文件导入到FlowJo软件版本9(加利福尼亚州圣何塞的Becton Dickinson)中,并通过标准门控进行分析以消除聚集体和死细胞,并识别CD3 + CD4 + T细胞和CD8 + T细胞。然后, 按照使用生物导体文库和R统计软件包(CATALYST 1.10.1)的脚本,将每个样品中的5000个CD4 + T细胞和2500个CD8 + T细胞中的数据导出以进行R中的进一步分析。该脚本位于:https : //github.com/HelenaLC/CATALYST)52。在Cytobank高级版本上检查了用于数据转换的辅助因子的选择(请参阅:cytobank.org)。使用FlowSOM平台(位于:https://bioconductor.org/packages/release/bioc/html/FlowSOM.html )执行元聚类(K = 20)。随后使用称为UMAP 2的降维方法显示数据。
细胞因子血浆水平的定量
使用Luminex平台(人类细胞因子发现,R&D系统,明尼阿波利斯,明尼苏达州)对31种分子的血浆水平进行定量,以同时检测以下分子:IL-1α,IL-1β,IL-2,IL-3, IL-4,IL-5,IL-6,IL-7,IL-8,IL-10,IL-12p70,IL-13,IL-15,IL-17,galectin-1,galectin-3,galectin- 9,IFN-γ,TNF,GITR,PD-L1,MICA,CCL-2,CCL-3,CCL-4,CCL-7,CXCL6,MIP-2,sCD27,sCD40,sCD40L,根据制造商的说明。散点图中的数据表示两次技术重复的平均值。
体外刺激和细胞内细胞因子染色
为了进行T细胞产生细胞因子的功能分析,将融化的分离的PBMC在5%CO 2中于37°C刺激16 h。完全培养基(RPMI 1640,补充10%胎牛血清和1%的谷氨酰胺,丙酮酸钠,非必需氨基酸,抗生素,0.1 M HEPES,55)中加入抗CD3 / CD28(1μg/ mL)的空气μMβ-巯基乙醇)。对于每个样品,至少有200万个细胞未刺激作为阴性对照,并刺激了200万个细胞。将所有样品与含有布雷菲德菌素A的蛋白转运抑制剂(Golgi Plug,Becton Dickinson)和预先滴定浓度的CD107a-PE一起孵育。刺激后,将细胞用LIVE-DEAD Aqua(ThermoFisher Scientific)和识别CD3 PE-Cy5,CD4 AF700和CD8 APC-Cy7(Biolegend,圣地亚哥,加利福尼亚,美国)的表面mAb染色。用染色缓冲液洗涤细胞,并用cytofix / cytoperm缓冲液组(Becton Dickinson)固定并透化以检测细胞因子。接下来,用先前滴定的识别IL-17 BV421,TNF BV605,IFN-γFITC,IL-2 APC或颗粒酶B BV421的mAb(所有来自Biolegend的mAb)对细胞进行染色。然后,在Attune NxT声学流式细胞仪(ThermoFisher)上采集每个样品至少100,000个细胞。
增殖测定
在静息条件下,或在用抗CD3加抗CD28 mAb(每支1μg/ mL,Miltenyi Biotech,Bergisch Gladbach,德国)和20 ng / mL IL刺激后,刺激5位患者和5位对照的细胞6天。 -2。根据标准程序,以1μg/ mL(TechnoFisher)的浓度使用5,6-羧基荧光素二乙酸琥珀酰亚胺酯作为荧光染料。通过选通CD4 +和CD8 + T细胞之间的TN,TCM,TEM,TE进行流式细胞术分析,以鉴定属于不同T细胞群的循环细胞16。
线粒体生物能学和代谢测定
由于缺乏细胞,与五个对照相比,我们只能纯化和研究五位患者的CD4 + T细胞。 首先按照制造商的说明,使用磁抗体(Miltenyi Biotech)对CD4 + T细胞进行分选,将一式三份以最小3.5×10 5的浓度接种细胞/孔,静置4小时,并如上所述用抗CD3加抗CD28刺激16小时。根据制造商的程序,使用MitoStress套件在XFe-96海马细胞外通量分析仪(Agilent,美国加利福尼亚州圣克拉拉)上进行OCR和ECAR的实时测量。在XF培养基(包含10 mM葡萄糖,2 mM L-谷氨酰胺和1 mM丙酮酸钠的非缓冲DMEM培养基)中,在基础条件下并响应2μM寡霉素,0.5μM羰基氰化物4-(三氟甲氧基)-苯基hydr(FCCP)和0.5μM的抗霉素和鱼藤酮(均来自Sigma Aldrich)。根据OCR曲线计算线粒体呼吸功能的指标:基础OCR(在添加寡霉素之前),ATP连接的OCR(计算为基础OCR率与寡霉素诱导的OCR率之间的差),53。还测量了基础和最大ECAR值。将OCR和ECAR值标准化为每孔的细胞数。
统计分析
通过在高分辨率细胞中通过高分辨率聚类54在差异化发现中进行了高维细胞分析。使用曼-惠特尼检验比较定量变量。使用难以置信的复杂评估(SPICE)软件(版本6,由Mario Roederer博士,疫苗研究中心,NIAID,NIH,贝塞斯达,马里兰州,美国提供)的简化表示来分析有关T细胞多功能性的流式细胞仪数据17。数据表示为单个值,平均值和平均值的标准误差。使用Prism 6.0(GraphPad Software Inc.,La Jolla,USA)进行统计分析。
|
|