乳腺癌患者引流淋巴结肿瘤浸润与Treg积聚相关
摘要
乳腺癌中转移细胞浸润的肿瘤引流淋巴结(TDLN)与不良预后相关,并与局部免疫抑制有关,局部免疫抑制可部分由调节性T细胞(Tregs)介导。在这里,我们研究了来自匹配的肿瘤侵袭性和非侵袭性TDLN的Treg,以及乳腺肿瘤。我们观察到,Treg频率随着淋巴结的侵袭而增加,并且Tregs表达的协同抑制/刺激受体水平高于效应细胞。同样,尽管Treg在TDLN和肿瘤中显示出保守的抑制功能,但TDLN中的常规T细胞(Tconvs)增殖并产生Th1炎性细胞因子,但在肿瘤中却功能失调。我们描述了从肿瘤和淋巴结,包括CD80,Tregs共享的一个常见的转录组签名,这与患者存活率低显着相关。TCR RNA测序分析表明TDLN与肿瘤之间的运输以及正在进行的Tconv / Treg转化。总体而言,TDLN Treg具有功能并表达可共同治疗的独特受体模式,突出了其作为癌症免疫治疗靶标的潜力。
介绍
在人类乳腺癌中,区域性LN通常是转移的首位。从临床观点来看,肿瘤引流LN(的TDLNs)的肿瘤侵入是在疾病进展的一个重要步骤,并且是复发和存活差的风险的预后指标1,2,3。然而,最近在乳腺癌的临床试验表明,LN切除不增加患者的总生存期4,5。从免疫学的角度来看,关于肿瘤转移对LN免疫功能的影响知之甚少。然而,很明显,肿瘤发展出各种各样的免疫抑制剂机制。这一事实引起的的的TDLNs肿瘤扩散在入侵是否产生免疫抑制的累积问题细胞样FOXP3 + CD4 +调节性T细胞(Treg细胞) -和赋予致耐受性微环境1,2,6,7。目前,我们的大多数的乳腺癌患者的免疫状态的知识来自原发肿瘤和血液样品的分析,而在的的TDLNs免疫特性的数据是稀缺8,9,10,11。
调节性T细胞表达转录因子Foxp3维持免疫系统的自身耐受和内环境稳定,但也限制了灭菌免疫和抑制抗肿瘤免疫12,13。在乳腺癌增加的肿瘤浸润的Treg互相关联数字与存活率降低12,14,15。Treg和Tconv之间的平衡在很大程度上决定了免疫反应的结果。Tregs是高度异构的;它们可能出现在胸腺中,也可能出现在Tconvs的周围。此外,在激活时,Treg可获得与不同功能相关的不同表型。因此,基于某些趋化因子受体和转录因子,调节性T细胞,类似于T辅助细胞(TH)可以进一步分类为TR1,TR2,TR17,Tfr中的表达13,16,17。只有少数研究分析表型8,12 Treg细胞存在于患者用的TDLNs乳腺癌和功能18以及可用的数据表明,总CD4 + T细胞和Treg的低频率的高频18,19,20都具有良好的预后相关联。但是,仍然缺少对肿瘤侵袭性(I)TDLN,非侵袭性(NI)TDLN和原发性管腔乳腺癌肿瘤(T)中Treg的表型和功能的全面全局分析。
免疫检查点,诸如PD-1 / PD-L1和CTLA-4的免疫治疗封锁,已经令人印象深刻的临床结果和可管理的安全性曲线在各种肿瘤类型的21,22。在乳腺癌患者中,最令人鼓舞的免疫疗法之一是抗PD-1 / PD-L1单药疗法。它的客观响应率在12%到21%之间23。但是,CTLA-4阻断抗体仅显示出有限的临床获益24。在管腔乳腺癌的Treg和Tconvs的免疫检查点的表达模式的研究很少12,25。因此,考虑到检查点阻断抗体不仅可以在肿瘤床的效应T细胞期起作用,而且26,而且在TDLN的T细胞启动过程中,了解T细胞(包括Treg)的免疫状态也很重要,这些免疫状态也可以被这些抗体靶向。
在本研究中,我们使用高维流式细胞术,功能测定,T细胞受体(TCR)谱表分析和RNA测序来表征I型和NI型TDLN对以及肿瘤中Treg的免疫表型,功能和动力学。 ; 并确定表达CD80的Treg是乳腺癌患者预后不良的Treg的子集。这些数据使人们对与肿瘤的存在有关的免疫调节机制有了深入的了解,并应有助于指导改进的免疫疗法的合理设计。
结果
“善意”记忆Treg细胞积聚在转移性TDLN中
我们表征并比较了来自乳腺癌患者的NI和I TDLN配对的Tregs的免疫特性。作为参考,我们还分析了Tconvs存在于初级肿瘤,已经被部分地特征12,25,27。为此,我们对刚切除的NI和I TDLNs以及来自接受过照护标准手术切除的管腔型乳腺癌患者的原发肿瘤进行了免疫分析(图 1a)。患者的临床和病理数据总结于补充表 1中。
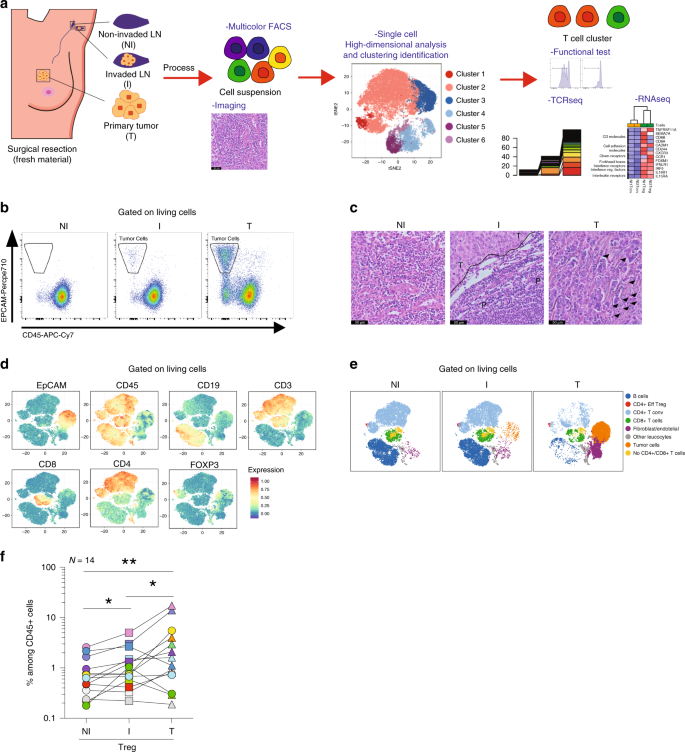
图1:NI和I TDLN中的免疫细胞群和肿瘤的总体分布。 一个研究设计的流程图。收集非侵袭性(NI)和侵袭性(I)TDLN,以及原发性肿瘤(T),将样品分开并进行苏木精-伊红染色或流式细胞仪分析,功能测试或转录组和TCR测序。b对NI和I TDLN和原发性肿瘤中EPCAM + CD45 +细胞群体的代表性流式细胞分析。c从三个独立实验中的一项对NI TDLNs(左图),ITDDLNs(中图)和原发性肿瘤(右图)进行苏木精-伊红染色(P:肿瘤部位; T:肿瘤部位;箭头:白细胞)结果相似。d样品用EpCAM,CD45,CD19,CD3,CD8,CD4和FOXP3染色并通过FACS分析,并显示了t-SNE图,显示了从TDLN和原发肿瘤中随机选择的细胞。Ë叔SNE映射表示NI,I,和T细胞的FlowSOM引导聚类。每种颜色代表一个簇,并与不同的免疫种群相关。f TDLN 和肿瘤中CD45 +细胞之间的Treg频率(NI vs I TDLNs p = 0.0134; NI TDLN vs T p = 0.004; ITDLN vs T p = 0.0494)。Wilcoxon配对配对符号秩检验,* p <0.05,** p <0.01(n = 14)。
根据是否存在转移性肿瘤细胞(鉴定为EPCAM +和CD45-),将TDLN分为NI或I。流式细胞术结果通过病理评估得到证实(图 1b,c)。我们评估了三种组织中不同免疫细胞群体的总体分布。使用无监督数据分析(请参见方法),我们确定了八个主要簇,包括B细胞,Tconvs,Tregs,CD8 + T细胞,无CD4 + CD8 + T细胞,成纤维细胞/内皮细胞,肿瘤细胞和其他白细胞(图 1d, e和补充图 1b)。随后通过手动门控确认了所有星团(补充图 1b–c)。量化不同人群(补充图 1d–f和补充表 2)表明,在NI和I TDLN之间发生显着变化的唯一群体是Treg(图 1f)。尽管样本中存在一定的异质性,但在I TDLN中,对于14例患者中的10例,Tregs在总CD45 + T细胞中的比例要高于NI患者(p <0.05)。此外,我们观察到在原发性肿瘤中,Tregs占整个T细胞浸润的重要部分,达到CD45 +细胞的19%。
接下来,我们分析了淋巴结转移对TDLNs中Tregs幼稚/记忆表型的影响。所报告的坂口和同事28,29,调节性T细胞和Tconvs可分类基于CD45RA和FOXP3的作为表达式:(I)幼稚的Treg,(II)的效应的Treg(Eff为调节性T细胞),(III)FOXP3 +非调节性T细胞(最近激活的Tconvs,(IV)内存Tconvs和(V)天真Tconvs(图 2a)。我们观察到I TDLNs包含较高的Eff Tregs频率(p <0.01)和较低的天真Tconvs(p 在大多数研究的患者中,NI TDLNs <0.05)。在肿瘤中,CD4 + T细胞区室,其特征在于幼稚细胞的非常低的比例和Eff为Treg的相对高的比例和存储器Tconvs 12,30。这些结果让我们假设TDLN中的肿瘤细胞(i)可以被幼稚的Tregs / Tconvs识别,然后获得Eff Treg表型。和/或(ii)可能参与从肿瘤循环到TDLN的Eff Treg的积累。
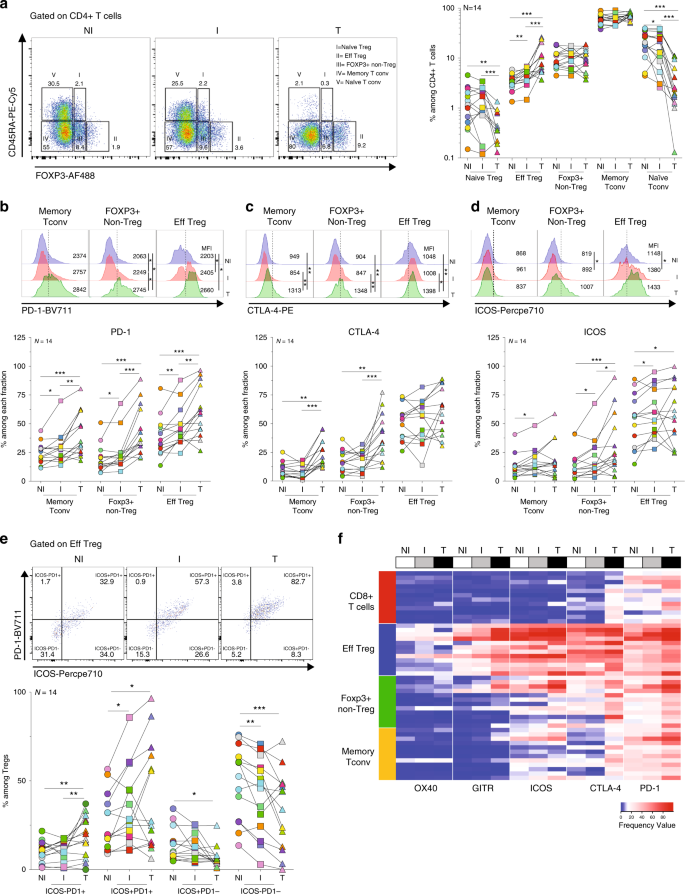
图2:TDLNs和肿瘤中T细胞的原始/记忆表型和免疫检查点表达。 对TDLNs细胞和肿瘤的细胞悬液进行CD3,CD4,CD8,CD45RA,FOXP3,PD-1,CTLA-4和ICOS染色。在TDLN和肿瘤中CD4 + T细胞中代表CD45RA和/或FOXP3的细胞的代表性流式细胞仪分析(左图)和频率(右图)(天真Treg:NI TDLN vs T p = 0.0023; ITDLN vs T p = 0.0004; Eff Treg:NI vs I TDLNs p = 0.0017; NI TDLN vs T p = 0.0004; I TDLN vs T p = 0.0009;天真Tconv:NI vs I TDLNs p = 0.0494; NI TDLN vs T p = 0.0002; I TDLN vs T p = 0.0001)。威尔科克森配对配对签名等级测试。b – db PD-1的代表性直方图和频率(内存Tconv:NI vs I TDLNs p = 0.0436; NI TDLN vs T p = 0.0009; I TDLN vs T p = 0.0012; Foxp3 + non-Treg:NI vs I TDLNs p = 0.0203; NI TDLN vs T p = 0.0001; I TDLN vs T p = 0.0002; Eff Treg:NI vs I TDLNs p = 0.0031; NI TDLN vs T p = 0.0002; I TDLN vs T p = 0.0017),c CTLA-4(内存Tconv:NI TDLN vs T p = 0.0023; I TDLN vs T p = 0.0004; Foxp3 + non-Treg:NI TDLN vs T p = 0.0031; I TDLN vs T p = 0.0004)和d ICOS(内存Tconv:NI vs I TDLNs p = 0.0107; FOXP3 + non-Treg:NI vs I TDLNs p = 0.0295; NI TDLN vs T p = 0.0009; I TDLN vs T p = 0.0245; Eff Treg: 在指定的CD4 + T细胞亚群中,NI vs I TDLNs p = 0.0101; NI TDLN vs T p = 0.0436)表达。威尔科克森配对配对签名等级测试。e在Eff Tregs中ICOS和/或PD-1的代表性流式细胞术分析(上图)和频率(下图)(ICOS-PD-1 +:NI TDLN vs T p = 0.0031; ITDLN vs T p = 0.0022; ICOS + PD-1 +:NI vs I TDLNs p = 0.0215; NI TDLN vs Tp = 0.0245;ICOS + PD-1-:NI TDLN vs T p = 0.0134;ICOS-PD-1-:NI vs I TDLNs p = 0.0023;NI TDLN vs T p = 0.0006)。威尔科克森配对配对签名等级测试。f热图显示OX40,GITR,ICOS,CTLA-4和PD-1在TDLN和肿瘤中指示的T细胞亚群上的表达频率(N = 12)。红色和蓝色分别表示较高和较低的表达频率。Wilcoxon配对配对符号秩检验,* p <0.05,** p <0.01,*** p <0.001。
TDLN中的Treg显示不同的免疫检查点分子
存在于从和的TDLNs的患者的肿瘤上的Treg成药免疫检查点分子的表达模式与乳腺癌小信息12,25。鉴于在天然T细胞中几乎未检测到免疫检查点分子(补充图 2a),我们对记忆T细胞区室进行了分析。在三种组织的Treg中,很高的频率表达了共抑制受体PD-1和CTLA-4(补充图 2a–c)以及共刺激受体ICOS和GITR(图 2d和补充图 2c)。 ; 较低的分数表示OX40(图补充图2c)。TDLN的入侵与表达ICOS,GITR,OX40和PD-1的Treg频率升高,与PD-1和ICOS双重表达的Tregs频率升高(PD-1 + ICOS + Tregs)相关(伴随PD降低) -1-ICOS- Tregs(图 2e),CTLA-4表达没有显着差异(总是很高)(图 2b-d和补充图 2c)。在肿瘤中,观察到表达每个检测点的Treg频率更高(图 2b–d和补充图 2c)。)。这些结果表明,在存在肿瘤细胞的情况下,更高比例的Tregs被激活并表达免疫检查点,并强调靶向这些分子的抗体不仅可以在肿瘤的效应子阶段起作用,而且可以在TDLNs中引发。
由于具有拮抗,拮抗或消耗功能的治疗性Abs可以调节具有相反免疫功能的T细胞亚群,因此有兴趣了解效应子Tconvs和CD8 + T细胞以及抑制性抗体上阳性和阴性免疫检查点的差异表达调节性T细胞(补充图 2 A和3)。在所有部位,Tregs是表达共刺激(ICOS,GITR和OX40)和共抑制(PD-1,CTLA-4)免疫检查点分子的最普遍的T细胞亚群(图 2b-e和补充图。 2c–e)。同样,Tregs显示了ICOS,OX40,GITR,CTLA-4和PD-1的最高平均荧光强度(MFI)值(补充图 2a)。)。Tregs还表达了其他Treg细胞相关分子中最高水平的分子,例如Ki-67,HELIOS,CD25和CD39(补充图 2a–b),这可能代表了其他可靶向药物。肿瘤和ILN Tregs中的CD39表达高于NI LN对应物(补充图 2b),这表明肿瘤细胞的存在触发了Tregs的活化并具有潜在的更高抑制作用。
TDLN和肿瘤中的Treg具有保守的抑制功能
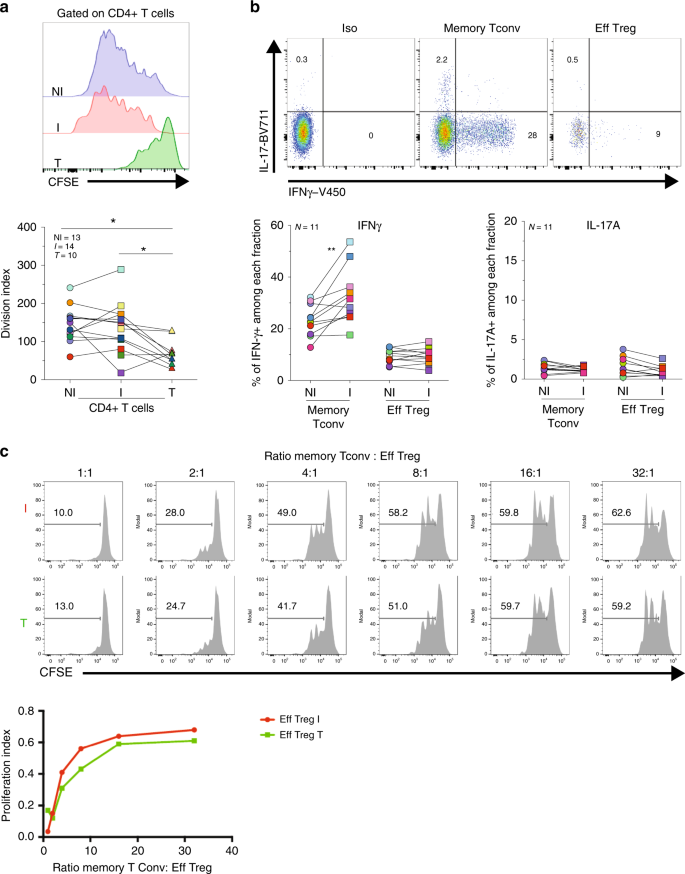
调节性T细胞可以显示出不稳定的表型和失去他们的抑制功能的促炎症微环境31,32。我们评估了NI,TDLN和肿瘤是否代表Treg在其中发挥功能的促炎或抗炎微环境。刺激来自三个组织的离体全细胞悬液,并分析T细胞增殖。如图3a所示 ,来自NI和I TDLN的Tconv高度增殖。然而,来自肿瘤的Tconvs在几个周期后停止分裂。佛波醇12-肉豆蔻酸酯13-乙酸酯(PMA)-离子霉素刺激后,I型患者的IFN-γ+ Tconvs频率明显高于NI TDLNs(图 3b)),所有T细胞中只有一小部分产生IL-17A。为了评估I TDLN中的Tregs(其中Tconvs更具促炎性)是否维持其抑制功能,我们进行了经典的抑制试验。I TDLN和肿瘤的Treg具有类似的抑制功能(图 3c)。
图3:TDLN中CD4 + Tconv和Treg功能的分析。 腋窝TDLNs细胞和肿瘤用CFSE染色,用抗CD3 / CD28珠体外刺激96小时,然后用CD3,CD4,CD8和FOXP3染色。a代表性直方图显示了 TDLN 和肿瘤中CD4 + T细胞的CFSE稀释度(左图)和CD4 + T细胞的分裂指数(右图)(p = 0.0156 NI TDLN vs T;p = 0.0273 I TDLN vs T)。威尔科克森配对配对签名等级测试。bTDLNs细胞悬液用PMA /伊诺霉素离体刺激4小时,并进行CD3,CD4,IFN-g和IL-17A染色。显示的是来自TDLN的门控CD4 + T细胞亚群中IFN-γ和IL-17的代表性流式细胞术分析(上图)和频率(下图)(p = 0.0029 NI vs I TDLNs)。C评估从新鲜I TDLN(I)和相应原发肿瘤(T)中分选的Treg(CD4 + CD25high)对自体记忆Tconv(CD4 + CD25-)增殖的抑制作用。在抗CD3 / CD28珠粒的存在下将细胞培养4天。直方图显示以指定比例存在或不存在Treg的情况下CFSE稀释度(上图)和Tconvs的增殖指数(下图)。 来自两个独立实验中的一个的代表性直方图(N = 1),结果相似。Wilcoxon配对配对符号秩检验,* p <0.05,** p <0.01。
总体而言,这些结果表明:(i)来自TDLN和肿瘤的Treg具有保守的体外抑制功能,并且(ii)尽管来自I TDLN的Tconv容易产生促炎性细胞因子,但那里的Treg却没有,表明它们在侵袭性乳腺癌LNs中未获得促炎功能。
我的TDLN显示出更高比例的Tr1和Tfr细胞
从不同组织的Treg的出版转录签名表明Treg的构成由微环境线索状的异质群体12,25,33。实际上,存在于微环境中的细胞因子和趋化因子的作用会影响具有不同极化模式,功能专一性和迁移能力的肿瘤特异性Tconv的终末分化。此外,鼠标的研究表明,调节性T细胞也可增选转录程序适用于调节Th1,Th2细胞,或Th17细胞反应13,16,17。
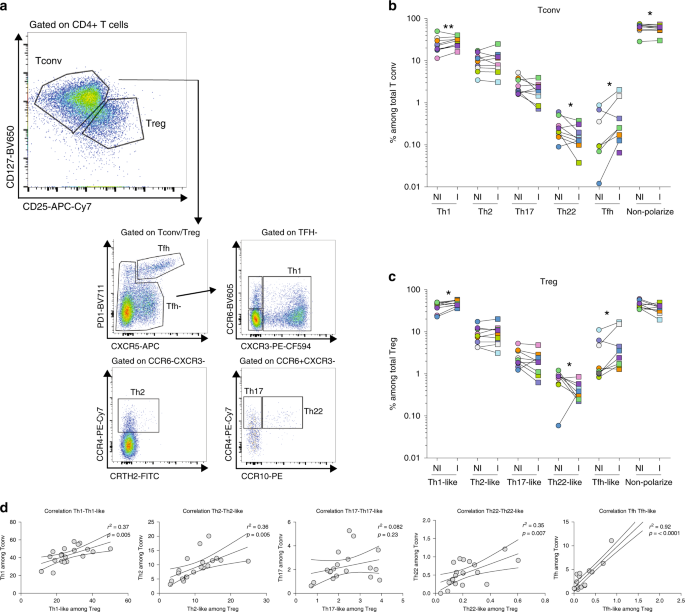
为了评估Tconvs和调节性T细胞存在于I和NI两者的TDLNs的功能多样性,我们分析了CD4 + T细胞趋化因子受体的图案(如描述16,34)。我们首先将Tconvs(CD4 + CD127 + CD25-)的表型评估为Th1(CXCR3 +),Th2(CXCR3-CCR6-CCR4 +),Th17(CXCR3-CCR6 + CCR4 + CCR10-),Th22(CXCR3-CCR6 + CCR4 + CCR10 +) ,和T滤泡辅助细胞(Tfh,PD-1 高 CXCR5 +)(图 4a)。在Tconvs中(图 4b),Th1细胞是最丰富的种群。与NI的TDLNs相比,我那些表明Th1细胞的比例较高(p <0.01),TFH细胞(p <0.05),和TH22细胞的比例较低(p <0.05)。大约10%的Tconvs是Th2细胞(NI和I TDLN之间没有差异),并且极少表达CRTh2,CRTh2是沿袭性Th2细胞子集的标志物34。最后,NI和I TDLN中的Th17细胞比例相似(图 4b)。
图4:TDLN中的CD4 + T细胞趋化因子受体模式。 对TDLNs细胞的细胞悬液进行CD3,CD4,CD127,CD25,PD-1,CXCR5,CCR6,CXCR3,CCR4,CCR10和CRTH2染色。TDLNs 中门控CD4 + CD127 + CD25-(Tconv)或CD4 + CD127 低 CD25 hi(Treg)细胞中CD4 + T细胞表型的代表性流式细胞仪分析。b,c在b Tconv(Th1:p = 0.0078; Th22:p = 0.0371; Tfh:p = 0.0391; non-polarized:0.0371 in NI vs I TDLNs)和c Tregs(Th1中,表达指定趋化因子受体组合的细胞频率 -相似:p = 0.0195; Th22-相似:p = 0.0391; Tfh相似:p = 0.0312)。Wilcoxon配对配对符号秩检验(n = 10)d散点图和Th1与Th1样,Th2与Th2样,Th17与Th17样,Th22与Th22样的频率之间的相关性的线性回归图,和Tfh和Tfr人口。* P <0.05;** TDLN中的P <0.01(n = 20)。相关性的统计显着性是使用Pearson相关性确定的。非极化:CD4 + T细胞对所评估的趋化因子受体阴性。
我们观察到来自TDLNs的Treg遵循与Tconvs类似的趋化因子受体模式。而且,与Tconvs相似,与NI TDLNs相比,在I TDLNs中,Th1类Tregs(p <0.05),Th22类Tregs(p <0.05)和Tfh类Tregs(Tfr)(p <0.05)。在NI和I TDLN中发现相似的Th2样Treg和Th17样Treg频率(图 4c)。辅助性Tconv和辅助性Treg表型的惊人相似模式反映在Th1与Th1-like(r 2 = 0.23; p = 0.008),Th2与Th2-like(r 2 = 0.36 )的频率呈强正相关;p = 0.0005),Th22 vs Th22类(r 2 = 0.41; p = 0.007)和Tfh vs Tfr(r 2 = 0.92; p <0.0001)人群; 但不是Th17与Th17样(r 2 = 0.08; p = 0.23)(图 4d)。FOXP3染色所需的通透化步骤与趋化因子受体的标记不兼容,除了CXCR3和CCR4。我们进一步研究了这两种受体在CD4 + T细胞亚群中的表达,如图2a所示 。我们观察到Eff Tregs中CXCR3 +细胞的频率显着增加(57.9%vs 67.5%,P <0.01),FOXP3 + non-Tregs(38.9%vs 47%, 与NI TDLNs相比,I的P <0.01)和记忆Tconvs(42.3%vs 53.5%,P <0.01)(补充图 4a),我们观察到I与NI TDLNs中CCR4 + CD4 + T细胞亚群的频率相似(补充)图 4b)。我们分析了T-bet和GATA3的表达,这是两个分别与Th1类和Th2类功能相关的规范分子(补充图 4c–d)。在I TDLNs中,与NI TDLNs相比,我们观察到T-bet + Tregs的频率更高,而GATA3 + Tregs的频率更低。这些结果表明,肿瘤的淋巴结浸润诱导了Treg细胞的Th1偏向表型,并指向与效应子(Th1)Tconvs共享的迁移印迹程序,如前所述。16,34。
总之,来自TDLN的Tconv和Treg遵循相似的表型和功能特定程序,从而强化了以下观念:Treg维持局部免疫稳态的能力取决于它们与Tconv的适当共定位。
在TDLN和肿瘤中发现具有共享TCR的Treg
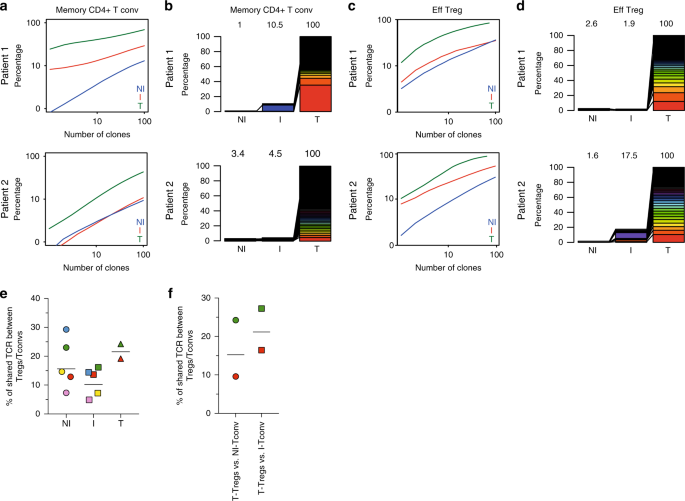
TCR的库已用于探索TDLN和总T细胞肿瘤35之间的克隆多样性和运输模式。为了深入研究CD4 + T细胞亚群,我们对从NI和I TDLN获得的Tregs(CD25 high CD45RA-)和Tconvs(CD25-CD45RA-)(参见方法)的TCR- βCDR3 进行了高通量测序这些患者中的三名患者以及来自其中三名患者的原发性肿瘤(完整样本集的测序TCR-βCDR3s的分布总结在补充表 3中)。每个样品中的TCR-βCDR3的(图的累积频率 5A,C和补充图 5和图5c-d),表明在所有组织中,Tregs比Tconvs克隆克隆更多;并且Tregs和Tconvs的TCR组成在肿瘤中的多样性要比在TDLNs中低,这表明肿瘤特异性CD4 + T细胞在肿瘤中蓄积。接下来,要分析三种不同组织之间的TCR谱库重叠,对于两名患者,我们可以鉴定出肿瘤中存在的Tregs或Tconvs的前100个最大扩展CDR3(可能富含肿瘤特异性克隆),并研究它们在肿瘤中的分布。 NI和I TDLN(图 5b,d和补充图 5b)。对于每位患者的Tconv,在I TDLN中发现100个顶级肿瘤克隆中的10.5%和4.5%,在NI TDLN中观察到100个顶级肿瘤克隆中的1%和3.4%(图 5b))。对于Treg,在ITDLN中观察到前100个肿瘤克隆中的1.9%和17.5%,而在NI TDLN中观察到前100个肿瘤克隆中的2.6%和1.6%(图 5d)。这些结果表明,肿瘤特异性Tconv和Treg克隆在肿瘤和TDLN之间再循环。
图5:分析来自NI和I TDLN的CD4 + Tconv和Treg的TCR库,以及肿瘤。 基于新一代测序的高通量TCR-βCDR3分析,用于对来自相匹配的NI和I TDLN以及原发性肿瘤的大分类T记忆CD4 + Tconv和Treg。图a – d显示了记忆CD4 + Tconv a,b的TCR-βCDR3克隆;或效应物Tregs c,d。图a,c显示了两名代表性患者的NI TDLN(蓝色),ITDLN(红色)和相应的原发肿瘤(绿色)的累积频率。堆积条形图b,d描绘了两名代表性患者的前100个肿瘤TCR-βCDR3序列的使用频率及其在匹配的NI和I TDLN中的分布。图中的数字表示样品中显示的TCR-βCDR3序列占总TCR-βCDR3序列的百分比。e,f Treg和Tconv之间的TCR库重叠。e显示的是TDLN(N = 5)和肿瘤(N = 2)中所有Treg克隆中Treg和Tconv之间共享的独特TCR的数量(%)。f显示的是NI或I TDLN中存在的所有肿瘤Treg和Tconv之间共享的独特TCR的数量(%)(N = 2)。每个符号都是一个样本,来自相同患者的样本具有相同的颜色。
肿瘤特异性的Treg可以在胸腺(tTreg)发起,也可以从Tconvs的转换出现成“周诱导的”调节性T细胞,(pTreg)36,37。外围Treg细胞诱导的TDLNs已被证明在小鼠模型38,但它已经在人类的研究很少12,25。为了评估pTreg的存在,我们评估了Treg和Tconv之间的TCR库重叠。该分析表明,在每个组织中均存在具有共同TCR的Tconv和Treg,在NI TDLN中平均占Tconv共有Treg TCR总数的17.6%,在I TDLN中是14.3%,在肿瘤中是21.7%(图 5e)和补充表 4)。此外,肿瘤-Treg克隆型与Tconvs以组织间方式共享,因为在NI和I TDLNs中存在的Tconvs中也分别发现了16.9%和21.9%的肿瘤-Treg克隆型(图 5f)。这些数据表明,乳腺肿瘤中相当一部分的Treg是pTreg。但是,不能得出结论,是在一个给定的器官中发生转化,还是在TDLN和肿瘤之间pTregs再循环。
I TDLN中的Treg显示独特的转录组特征
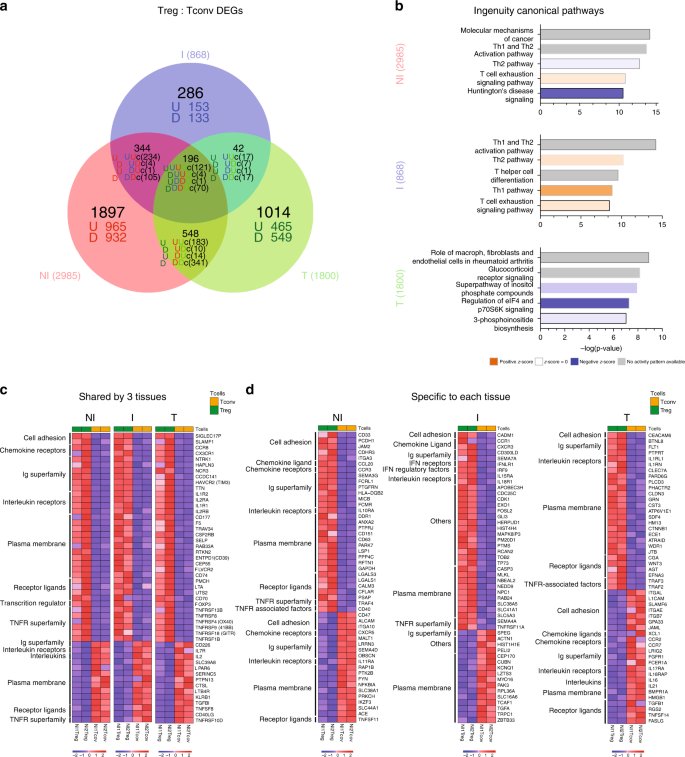
我们对从匹配的NI,ITDLN和肿瘤中获得的大分类Treg和Tconvs进行了RNA测序(请参见方法)。我们 分别在NI TDLN,ITDLN和肿瘤中观察到Treg和Tconv之间的2985、868 和1800个差异表达基因(DEG,倍数变化1.2,p <0.05)(图 6a,补充数据 1)。这三个DEG清单的路径分析确定了一系列典型的生物路径(图 6b和补充数据 2)。)。在前五个经典途径中,NI和I TDLNs共享Th1和Th2激活/极化途径和“ T细胞衰竭信号传导途径”,这表明慢性激活和极化是TDLNs中CD4 + T细胞的主要特征。不同的是,肿瘤CD4 + T细胞主要与翻译调节(“ eIF4和p70S6K信号传导的调节”途径),肌醇磷酸途径的活化以及糖皮质激素介导的信号传导有关。突出与淋巴结驻留细胞的内在差异。
图6:来自NI和I TDLN的CD4 + Tconv和Treg以及肿瘤的转录分析。 来自匹配的NI和I TDLN和原发性肿瘤的大分类T记忆CD4 + Tconv和Treg的RNA测序分析。a Venn图和b通路分析 NI TDLN,ITDLN和肿瘤中Treg和Tconv之间差异表达的基因(DEG,倍数变化1.2,p <0.05)。c,d热图显示了来自三个组织c的 Treg和Tconvs共有的或每个组织d特有的50°。红色和蓝色分别表示较高和较低的表达。标出了家族基因名称(左)。细胞粘附:细胞粘附分子。Ig超家族:包含免疫球蛋白超家族结构域。TNFR受体超家族:肿瘤坏死因子受体超家族。TNFR相关因子:肿瘤坏死因子受体相关因子。IFN受体:干扰素受体。干扰素调节因子:干扰素调节因子。
然后,我们研究了Treg和Tconv共有的分子特征(“共同特征”),分析了来自所有组织的Treg和Tconv之间的共同DEG。为了研究组织适应性,我们使用了每种组织的Treg或Tconvs唯一表达的DEG列表。“常见的Treg签名”由121个基因组成(在三种组织的Treg / Tconv比较中通常上调,图6a的维恩图中的“ UUU”基因 ),包括FOXP3,IL2RA,TNFRSF9,TNFRSF1B和ENTPD1(图 6c),并且与“调节性T细胞”和“ IL-2信号传导途径”以及“ TNFR2信号传导途径”显着相关(EnrichR,#1,补充数据 3)。“常见的Tconv签名”由包括IL7R,CD40LG和IL2在内的70个基因(“ DDD”基因)定义(图 6c),并且与“ CD4 + T细胞”,“ FAS信号通路”以及“ TRAIL信号通路”,图 6c(EnrichR,#2,补充数据 3)。对与每个组织相关的分子标记的分析揭示了特定的程序:(i)NI TDLN的Tregs具有965个基因(“ U”基因)的特征,有助于“外源肽的抗原加工和呈递”以及“ DNA复制”(EnrichR #3,补充数据 3),反映了LN中Treg的基础复制;(二)来自I TDLN的Tregs仅具有153个基因(“ U”基因)的特征,这些基因与以下生物途径相关:“凋亡”,“ IL-12介导的信号事件”和III型IFN信号(EnrichR#4,补充数据 3),可能反映了Treg的膨胀和收缩,以响应IL-12和IFN等促炎信号的局部产生;(iii)肿瘤Tregs独特地展示了465个基因(“ U”基因)参与了异源转录组程序,该程序包含途径“氧化磷酸化”,“ TNFR2信号传导”和“ 4-1BB信号传导”(EnrichR#5,补充数据 3)指出肿瘤中不同的代谢状态,并通过TNFR2和4-1BB发出信号,这些信号先前与肿瘤中活化的Tregs有关39,40。值得注意的是,肿瘤的Treg高度表达 IL1RL1和 IL1RN,已经关联到的抑制IL-1介导的炎症 41,42。这些结果表明,来自肿瘤和TDLN的Tregs表达共同的基因特征,但也表现出基于组织特异性适应的独特转录细胞命运。图 6c,d显示了通过Tconvs和Tregs细胞对T细胞迁移,功能或靶标潜能的影响而选择的特征性标志物的表达水平。例如, CCR8是跨组织Treg的特征(如前所述 12),但其他细胞粘附分子和趋化因子受体与来自不同组织的Treg和Tconvs有差异性关联(图 6d)。更详细地说,Treg可以使用SIGLEC17P表达在所有组织之间循环。CD33,PCDH1,JAM2,CDHR3和ITGA3将协调NI TDLN中的迁移/保留;I TDLNS中的CADM1;和CEACAM6在肿瘤中。值得注意的是,肿瘤Tregs表达的CEACAM6与癌症进展有关43。此外,NI ad I TDLN中的Treg共享CD58,ITGAM,MCAM,CEACAM4,SELPLG和HMMR表达,可以确保TDNL之间的再循环;I TDLN的Treg和肿瘤Treg共享ICAM1表达,这可能是存在肿瘤细胞的组织之间迁移的原因。最后,来自肿瘤的Tconvs比Tregs 差异表达更高水平的IGAL(LFA-1)。这些结果表明,不同的分子线索将Treg和Tconv细胞吸引并保留在TDLN或肿瘤上。
表达CD80的肿瘤Treg与不良预后相关
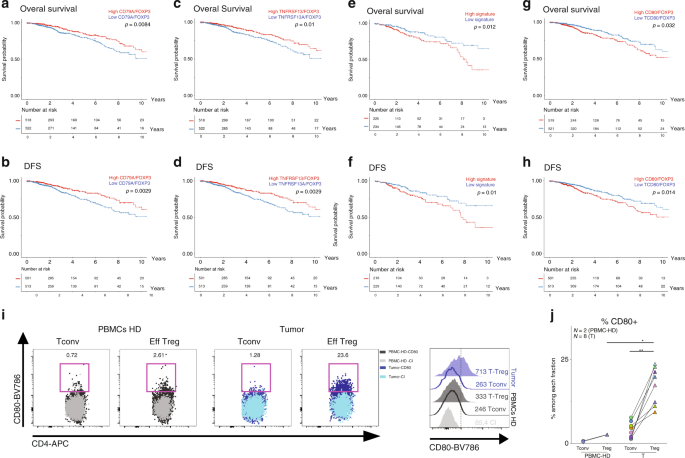
为了评估TDLN和肿瘤的Treg中高表达的DEG的临床相关性(图 6a),我们使用癌症基因组图谱(TCGA-BRCA,请参见方法)的乳腺癌档案研究了这些基因对肿瘤复发和生存的影响。 。我们首先评估了FOXP3基因。Tregs的主要转录因子,并观察到FOXP3 mRNA表达水平本身对总生存期(OS)和无病生存期(DFS)没有影响,如前所述12(补充图 6a–b)。为了确定在TCGA-BRCA队列中表达与FOXP3相关的基因,我们计算了基因:FOXP3所有DEG的mRNA比率(请参见方法)。我们发现了10个基因,其中mRNA水平与FOXP3读数呈正相关(r > 0.5),而高mRNA:FOXP3比与更好的OS和DFS相关,分别是CD79A和TNFRSF13B,这两个与B细胞活化相关的分子41,相关性最高的(图 7a-d和补充图 6c)。此外,我们发现了三个基因的签名,即CD80,CCR8和HAVCR2,它们与FOXP3读数呈正相关(补充图 6d)。),以及哪种高的mRNA:FOXP3比值与不良的OS(p = 0,012)和DFS(p = 0.01)显着相关(图 7e,f)。当独立考虑这三个基因时,只有CD80:FOXP3 mRNA高比率与较差的OS和DFS显着相关(图 7g,h)。我们通过FACS 确认了CD80在肿瘤Tregs上以蛋白水平高表达(图 7i和补充图 6g),但在I-TDLN中却没有,因为患者之间的差异很大(补充图 6e))。我们发现,肿瘤Treg的CD80频率和MFI高于健康捐献者(HD)的Tconv和外周Treg(图 7j)。值得注意的是,我们在mRNA(RNA测序)和蛋白水平(荧光激活细胞分选(FACS))均检测到Tregs中的CD80表达。如CD80可通过的Treg通过trogocytosis获取44或transendocytosis 45,46,无法知道在Tregs中观察到的CD80蛋白是否已由Treg合成,是否已从其他细胞的膜中获得或两者兼而有之。这些结果表明,表达CD80的Treg可以定义与不良预后相关的高度激活/抑制性Treg的子集。这些结果成为与乳腺肿瘤相关的Tregs的潜在治疗靶标。
图7:标准化为FOXP3表达的差异表达基因的临床结果。 一个 - ħ的乳腺癌患者的“高”或表达水平的“低”值强度分层OS(上图)和DFS(下图)CD79,TNFRSF13B,“CD80,CCR8,和HAVCR2签名”和CD80在TCGA乳腺癌数据集中标准化为FOXP3表达。i来自高清PMBC(左图)或肿瘤(右图)的Tconv和Treg细胞上CD80表达的代表性流式细胞仪分析以及不同亚群中CD80 MFI水平的代表性直方图。j HD PBMC(N = 2)或肿瘤CD45 +细胞(N中的CD80 + CD4 + Tconv或Treg的频率 = 8)。PBMC-Treg vs肿瘤-Treg p = 0.044。曼·惠特尼检验。肿瘤-Tconv与肿瘤-Treg的p = 0.0078。Wilcoxon配对配对符号秩检验,* p <0.05,** p <0.01。
讨论区
在乳腺癌研究的Treg表明血液FOXP3 + CD4 + T细胞的比例与健康供体相比增长47,48通过免疫组化和在FOXP3 + CD4 + T的肿瘤高比例的细胞检测(IHC)-are与不良相关的预后14,15,25,49。数据在乳腺癌的TDLNs定量的Treg,稀少18,并已被主要由FOXP3检测获得通过IHC不允许的抑制CD4 + CD25 + FOXP3high T和非抑制性CD4 + CD25 + FOXP3low- T细胞之间的区别12,18,19,50。我们的流式细胞仪结果表明,在TDLN和原发肿瘤微环境中观察到的高比例Treg构成了“真正的” Treg。虽然可以调节性T细胞在失去促炎性微环境他们的表型稳定性和功能13,32,51,我们发现即使存在激活的产生IFN-γ的CD4 + T细胞,I TDLN中的Treg仍保持其离体抑制能力并具有稳定的表型(由细胞因子生成水平低所判断)。此外,TDLN和肿瘤中的Tregs表达高水平的CTLA-4,ICOS,GITR和OX40,其表型与高抑制能力有关。值得注意的是,尽管Tconvs在肿瘤中显示出功能障碍的迹象,但抑制子Eff Tregs却没有,突显了后者的适应肿瘤微环境的能力。对此现象的一种解释可能是,Treg比Tconvs在缺氧,酸中毒和营养缺乏的情况下生存和运行的能力更强52由于肿瘤负荷的差异,可以认为它在肿瘤中比I TDLNs更严格。
我们的观察结果有几个临床意义。对纯分类的Treg和Tconvs进行转录组分析,发现表达CD80的Treg是与乳腺癌预后不良相关的Treg的亚群,代表了免疫调节疗法的设计候选人,值得进一步分析以更好地了解其在生物学中的作用肿瘤相关的Tregs。此外,我们发现,腔内乳腺癌患者的Treg表现出明显的模式,即高表达的共刺激和共抑制分子,包括PD-1,CTLA-4,ICOS,GITR,OX40和CD39,强调了这些分子的价值免疫调节的靶标。如下所示,非消耗性抗CTLA-4 Ab Tremelimumab(但非消耗性Ab Ipilimumab)在转移性黑色素瘤和乳腺癌中的活性有限;24,53,54什么可以由它的低容量来解释耗尽CTLA-4表达的调节性T细胞。同样,我们的数据预测靶向ICOS,GITR和OX40的消耗型Abs(例如消耗性抗OX40 Ab MEDI6469 55)可能是管腔型乳腺癌患者的良好候选药物。
我们观察到,在TDLNs中,Tregs和Tconvs显示趋化因子受体表达的相似模式,从而增强了Tregs维持局部免疫稳态的能力取决于它们与Tconvs 13适当共定位的概念。按照这些思路,Redjimi等人。56还表明,卵巢肿瘤中CXCR3 + Treg的比例与CXCR3 + Tconvs的比例直接相关。另外,在我的TDLNs我们检测到与NI的TDLNs相比Th1细胞的显著增加,这表明节点肿瘤侵袭被关联到一个IFN-γ介导的T细胞应答,这已被链接到有效的抗肿瘤应答57,58。此外,乳腺肿瘤中丰富的CD4 + Th1标志与良好的预后相关59。而且,我的TDLNs显示出更高比例的Tfh细胞。有趣的是,Faghih等。8个在乳腺癌肿瘤中鉴定出产生IFN-γ,IL-4和IL-17的Tfr和CD4 + T细胞,并得出结论,在TDLN中转移后,免疫反应受到更多抑制。
与我们的结果一致,其它研究中发现较高水平的T细胞克隆性在肿瘤中比在血液和juxtatumoral组织(并且在我们的研究中的TDLNs),设有共用的克隆在组织和肿瘤中发现12,25,35,60。假定肿瘤扩大的克隆是肿瘤特异性的克隆,则该观察结果强调了正在进行的抗肿瘤应答,导致肿瘤特异性CD4 + T细胞在肿瘤中积累。此外,检测到肿瘤扩展的T细胞克隆与TDLN中的T细胞之间共有β-CDR3,表明肿瘤与TDLN之间存在循环,并强调了TDLN作为可能被调节的肿瘤特异性T细胞来源的潜在贡献。通过免疫疗法。正如Zemmour等人所建议的。61,具有相同TCR的Treg具有相似的转录特性,这意味着来自肿瘤和TDLN的具有共同抗原特异性的Treg也可能共享一个早期的印迹特定程序,该程序在启动后会持续存在,并通过常见的环境线索将其驱动到解剖位置。此外,Treg克隆的组织间共享也可能表明局部区域抑制机制。最后,约20%的肿瘤Tregβ-CDR3与Tconv细胞共享,指出Treg的重要部分可能通过CD4 + Tconv细胞的外周诱导或转化而产生。沿着这些思路,尽管Helios并不是胸腺Treg的唯一标志物,但Helios在肿瘤和TDLN Tregs中的表达水平很高(补充图 2)。)可以反映原位外周Treg的分化。尽管在不同的亚组中使用相同的TCR提示了共同的克隆起源,但并不能证明这一点,但最近在小鼠模型38中显示,单克隆CD4 + T细胞可能会尽快在TDLN中成为效应子,无反应性或Treg。灌注后7天。值得注意的是,在所有分析过的组织中,Tregs比Tconvs更克隆地扩增,这可能反映了它们更具自反应性。
我们鉴定出了121个常见基因,它们表征了乳腺肿瘤,NI和I TDLN中的Treg,并列出了与每个位置相关的独特基因,指出了它们的组织适应性。NI TDLN-Tregs具有稳态增殖特征,而I-TDLN-Tregs在NI与肿瘤Tregs之间显示一个表型。值得注意的是,NI TDLN的Tregs可以用于抗原呈递,而I TDLN的Tregs倾向于凋亡,这可能增强了它们的抑制能力,如Maj等报道。62。肿瘤Treg的特征在于激活信号和代谢变化,这可能反映了它们对肿瘤微环境恶劣的代谢条件的适应性,其特征为缺氧和酸中毒,营养成分改变(例如葡萄糖限制),高水平的活性氧( ROS),腺苷和前列腺素63。
在这些肿瘤特异性的Treg的功能,我们观察到的更高的表达IL1RL1(IL-33受体,ST2),其已被描述关联与肿瘤数量和大小51,并用抑制IL-1介导的炎症41,42。值得注意的是,我们观察到CD80 / FOXP3 mRNA比率与乳腺癌患者的OS和DFS差有关。据报道,T细胞可以在活化的早期状态获取CD80 64。在调节性T细胞,CD80的在蛋白水平的存在已被描述链接到trogocytosis 44或transendocytosis通过CTLA-4介导的45,46,它与Treg介导的抑制机制有关,因为树突状细胞中共刺激配体表达的限制抑制了CD28介导的T细胞活化。CD80还与大量转录组数据65的 Treg签名相关。只有最近的一项工作还报道了自身免疫性患者活化Tregs 12中CD80的表达,并且有必要进一步了解CD80在Treg生物学中的作用。
超突变的癌症被视为潜在的良好应答者免疫调节剂,由于新的抗原特异性T细胞的活化在肿瘤57,58,66。乳腺癌显示出低的突变载荷,和患有这种癌症已经少包括在免疫检查点抑制剂超过突变肿瘤如黑素瘤或肺肿瘤的临床试验中,但有些疗效已经观察到23,24。使用新抗原特异性自体TILS结合IL-2和检查点封锁的过继性T细胞疗法67在这些患者中也可以有效。因此,增强效应T细胞和Treg细胞耗竭的策略的组合应增加免疫治疗的疗效。沿着这些思路,我们的数据提供了有关管腔癌患者中Treg的表型和功能的信息,并添加了“ LN-T细胞”作为在设计有效的癌症患者免疫疗法时要考虑的一个方面。
方法
临床样本
根据机构伦理指南,从居里研究所(法国巴黎)接受标准护理手术切除的54例腔内乳腺癌患者中收集TDLN和肿瘤,并获得知情同意。该协议已得到居里研究所伦理委员会(“法国研究中心委员会”,CRI-0804-2015)的批准。
该研究队列包括可获得NI和I TDLN样本以及原发性肿瘤的患者。病人的临床和病理特征总结在补充表 1中。使用组织学和IHC技术(细胞角蛋白阳性)诊断TDLN中的肿瘤转移。通过对激素受体(由ESR1编码的雌激素受体1 和由PGR编码的孕激素受体),酪氨酸激酶细胞表面受体HER2(也称为erbB-2受体酪氨酸激酶2和CD340)进行IHC筛选来表征原发性肿瘤,由ERBB2和KI-67 编码。通过流式细胞术通过Epcam / CD45检测证实肿瘤细胞浸润淋巴结。
样品和细胞分离
在初次手术后的几个小时内获得样品,切成小片段,并在存在0.1 mg / ml DNase(Roche)的情况下用0.1 mg / ml Liberase TL(Roche)消化20分钟,然后添加10 m 间乙二胺四乙酸。在40-μm细胞过滤器(BD Biosciences)上过滤细胞。
免疫细胞群的表型分析
TDLN和原发肿瘤用补充表5中列出的抗体染色 。使用抗CD32(干细胞)阻断了非特异性结合。对于细胞内染色,根据制造商的说明,将细胞固定并用固定/通透溶液(eBiosciences)透化。手术后几个小时采集所有样品。补偿使用BD LSR-Fortessa流式细胞仪采集的数据,将其导出到FlowJo软件(版本10.0.8,TreeStar Inc.)中,并使用Cyt MATLAB(版本2017b)进行归一化。为了获得无偏见的概览,我们结合FlowSOM聚类,通过应用t分布的随机邻居嵌入(t-SNE,可显示来自TDLN和所有样品的原发肿瘤的随机选择的活细胞),将流式细胞仪数据系统化为二维。其中显示了来自所有样品的三个单独组织的所有活细胞)68。
细胞内细胞因子染色
在GolgiPlug(BD Biosciences)存在下,用100 ng / ml的PMA和1μg/ ml的离子霉素将TDLN刺激4小时,以培养最后3小时。根据制造商的说明,将细胞固定并用固定/通透溶液(eBiosciences)进行通透。细胞用FOXP3-Alexa488(克隆236 A / E7,eBiosciences),IL-17-BV711(克隆BL168; BioLegend)和IFNγ-V450(克隆B27; BD Biosciences)染色,然后在Fortessa流式细胞仪(BD)上进行分析生物科学)。使用FlowJo软件(版本10.0.8,TreeStar Inc.)分析FACS数据。
CD80染色
首先对8位乳腺癌患者的肿瘤和2位健康供体的PBMC进行表面染色,然后用CD80-BV786(克隆L307.4; BD Biosciences)和IgG1k-BV786(克隆X40; BD Biosciences)同种型进行细胞内染色。
Treg抑制试验
首先使用CD4 + CD25 +调节性T细胞分离试剂盒(Miltenyi Biotec,130-091-301)分离CD4 +,CD25 +和CD4 + CD25-T淋巴细胞,然后用CD25-PE(克隆M-A251; BD Biosciences)染色CD4-PE-CF594(克隆RPA-T4; BD Biosciences)。使用BD FACS ARIA II细胞分选仪通过流式细胞术对CD4 + CD25-(Tconv)和CD4 + CD25high(Treg)细胞进行分选。Tconvs用CFSE(5 ΜM)(Life Technologies)染色,并与不同浓度的自体Tregs在96 孔圆底板(2.5×10 4在存在Dynalbeads CD3 / CD28 T细胞扩增子(Life Technologies)的情况下,以10个细胞/珠的比率存在。将细胞在补充了10%AB人血清和1%青霉素-链霉素的Roswell Park Memorial Institute 1640培养基(生命技术)中于37°C孵育4天,然后使用流式细胞仪进行分析(BD LSR-Fortessa) 。增殖指数是使用FlowJo增殖工具(TreeStar Inc.)计算的。
用于RNA和TCR测序的细胞分选
对匹配的NI,I和TDLN和乳腺癌患者的原发肿瘤进行RNA和/或TCR测序。首先使用Pan T细胞分离试剂盒(Miltenyi Biotec,130-096-535)分离T细胞。使用抗CD32(干细胞)阻断非特异性结合,并用CD25-PE(克隆M-A251; BD Biosciences),CD4-PE-CF594(克隆RPA-T4; BD Biosciences),CD8- Alexa700(克隆3B5; Life Technologies),CD27-APC(克隆L128; BD Biosciences)或CD45RA-PE-Cy7(克隆HI100; BD Biosciences),然后进行4',6-diamidino-2-phenylindole(DAPI)LIVE /死色。CD4 + CD45RA-CD25−(内存CD4 + Tconv),CD4 + CD45RA-CD25 高(Memory Treg),通过流式细胞仪在BD FACS ARIA II细胞分选仪中分选,纯度为98–99。收集细胞,并用含1%β-巯基乙醇的TCL缓冲液(Qiagen)裂解,并保存在-80°C直至后续分析。使用单细胞RNA纯化试剂盒(Norgen)分离RNA,包括无RNase DNase Set(Qiagen)处理。使用Agilent RNA 6000 pico试剂盒评估了RNA完整性编号。根据制造商的说明评估所有样品。
TCR测序
从所有分选的细胞中提取RNA。纯化后,所有RNA均用于逆转录步骤。使用SuperScript IV(ThermoFisher),使用在5'末端偶联至共同序列2(CS2)TACGGTAGCAGAGACTTGGTCT的恒定TCRβ区引物(参见以下引物序列)进行特异性逆转录反应。合成后,使用Agencourt RNAclean XP试剂盒(Beckman Coulter)按照制造商的说明清洁cDNA,然后在40 µl无RNAse的水(Ambion)中洗脱。我们使用了三个PCR步骤进行cDNA扩增和条形码编码。对于PCR反应1,我们使用与逆转录相同的反向恒定引物,并且使用先前描述的正向TCR序列引物69。对于PCR反应1,每个TCR区引物的浓度为0.2 ΜM。。我们使用以下循环条件在第一步PCR中进行了17个循环,以使其保持在指数相中,从而允许其> 10,000倍的扩增和所有TCRβ转录本的无偏表达,使其保持在以下循环条件下:95°C 3分钟,90°C 30 s,63°C持续30 s和72°C持续30 s。第一次多重PCR后,根据制造商的说明使用Agencourt AMPure XP试剂盒(Beckman Coulter)清洗cDNA,并在40 µl无RNAse的水中洗脱。在基于珠的纯化之后,将1/160的纯化产物用作第二个PCR的模板,从而可以很好地表示初始模板。对于PCR反应2,我们使用先前描述的TCR可变区引物69(补充表 6)对TCRβ进行了两种截然不同的半巢式多重PCR。)在5'末端与通用序列1(CS1,ACACTGACGACATGGTTCTACA)引物偶联。我们使用第一个PCR产物作为模板,并根据制造商的说明使用GoTaq G2热启动聚合酶(Promega)在20 µl最终反应体积中进行半巢式PCR。我们在以下循环条件下执行了30个循环:95°C 3分钟,90°C 30 s,63°C 30 s,72°C 30 s。使用Agencourt AMPure XP试剂盒根据制造商的说明清洁cDNA,然后重悬于40 µl无RNAse的水中。在第三次PCR反应中,使用PE1_CS1正向引物和PE2_barcode_CS2反向引物(Fluidigm)在300 n M处进行Illumina测序的条形码和双末端添加步骤。对于此最终PCR,我们使用Platinium Taq DNA聚合酶高保真度(ThermoFisher)在20 µl最终反应体积中以第二个PCR产物为模板,条件如下:94°C 10分钟,94°C 30 s ,60°C 30 s,68°C 4分钟和68°C 3分钟。根据制造商的说明,使用Agencourt AMPure XP试剂盒清洁cDNA。每个PCR产物都有唯一的条形码和Fluidigm配对末端序列,可在Illumina Miseq系统上进行测序。CS2 TCR引物序列为TACGGTAGCAGAGACTTGGTCTTACCAGTGTGGCCTTTTGGGTGTG,共同序列以粗体显示。我们根据细胞的初始数量调整了每个样品的读取次数。
TCR测序分析
使用MiXCR 70(版本2.1.5)及其默认参数从原始TCR序列数据中提取和量化CDR3序列。使用MiXCR输出,根据识别的V,J和CDR3序列定义TCRβ克隆。为了减少噪音,我们首先过滤出少于三个计数的克隆,然后为每个样品选择表达最强的90%TCRβ克隆。对于表 4,对于每个组织,共享克隆的百分比计算为:共享克隆数/ Treg克隆总数×100。
RNA测序
使用SMARTv4低输入试剂盒(Takara)进行逆转录。使用Nextera XTP修复试剂盒,从每个样品的5到10 ng DNA中生成条形码Illumina兼容文库。使用SMART-seq版本4低输入试剂盒(Takara)生成cDNA,使用Nextera XTP修复试剂盒从每个样品的5至10 ng DNA生成条码Illumina兼容文库。使用100 bp配对末端模式在Illumina HiSeq 2500上对文库进行测序,每个样品读取2500万次。
RNA测序分析
使用Hisat2将FASTQ文件映射到ENSEMBL Human(GRCh38 / hg38)参考,并通过Subread R包中的featureCounts进行计数。读数计数归一化和组比较通过三种独立且互补的统计方法进行:Deseq2,edgeR,LimmaVoom。根据归一化为平均覆盖率的计数计算标志。所有<20的归一化计数均被视为背景(标志0),而≥20被视为信号(标志= 1)。用于统计分析的P50列表将至少一半的比较样本中显示flag = 1的基因重组。三种方法的结果在p处过滤值≤0.05并进行1.2倍比较,并根据维恩图进行分组。使用Spearman相关相似性度量和平均链接算法,通过层次聚类进行聚类分析。热图是使用R版本1.1.463(群集和树转换)制作的,并由Java Treeview软件成像。使用Ingenuity Pathway Analysis(IPA,Qiagen),Hugo基因命名委员会(HGNC)和EnrichR进行功能分析。
生存分析
为了评估基因表达水平与总生存期(OS,定义为死亡时间)和DFS(定义为复发或死亡时间)的关联,我们使用了癌症基因组图谱(TCGA-从562 Luminal A,209 Luminal B,190 Basal和82 Her2 +获得的BRCA,TCGAbiolinks软件包)。由于FOXP3 mRNA表达水平本身的OS和DFS 不能很好地从Treg对肿瘤发生的贡献中读出,因此我们采用了生物信息学策略,如Plitas等人提出的。12。简而言之,首先,为了进行生存分析,我们从图6a中获得的DEG列表中选择 ,只有那些正相关的基因(R > 0.5且计数> 20 RPM),每百万映射读取(RPM)包含FOXP3读取。然后,为了评估基因比率,用FOXP3 RPM对DEG RPM进行归一化,并根据中位表达水平,将获得的DEGs:FOXP3比例用于隔离两组乳腺癌患者(低和高)。使用对数秩检验(R包生存期)确定由上述组分层的曲线(OS和DFS)的统计显着性。
统计分析
使用Wilcoxon和Mann-Whitney检验分别对配对和非配对样本以及Pearson相关系数确定了统计学显着性。所有统计分析均使用Prism 6软件进行。在Pearson / Spearman相关分析(R软件环境,版本3.4.0)中探查了免疫学参数与临床/病理数据之间的相关性。
|
|