纤溶酶和甘露糖结合凝集素与成人急性髓细胞白血病的关系
摘要
我们调查了157例急性髓细胞性白血病(AML)患者中ficolins和甘露糖结合凝集素(MBL)的临床关联。测定血清中ficolin -1,ficolin-2,ficolin-3和MBL的浓度(以及在化学疗法之前),以及相应基因(FCN1,FCN2,FCN3和MBL2)的选定多态性。对照组(C)由267名健康无关个体组成。患者中ficolin-1的中位数较低(p <0.000001),而ficolin-2,ficolin-3和MBL的中位数较高(p <0.000001,p <0.000001和p 分别为0.0016和与对照组相比)。这些发现通常与AML本身有关,但是最高的MBL水平预示着严重医院感染的风险较高(伴有菌血症和/或真菌血症)(p = 0.012),而最低的Ficolin-1浓度则往往与长期感染有关(> 7天)发烧(p = 0.026)。基因分型表明G / G纯合性(对应于FCN1基因-542 G > A多态性)与恶性肿瘤相关[ p = 0.004,或= 2.95,95%CI(1.41-6.16)]。基于ROC分析,ficolin-1,-2和-3可被视为AML的候选补充生物标志物。证明了它们在区分非恶性对照患者和其他血液系统癌症患者(多发性骨髓瘤和淋巴瘤)中具有很高的潜力。
介绍
急性髓细胞性白血病(AML)是影响成年人的最常见白血病(约80%;占总癌症的1%以上)。它是一种侵袭性恶性肿瘤,其特征在于肿瘤转化后的祖先造血细胞起源于形态学和功能上不成熟的胚细胞的克隆增殖和积累。它与造血功能障碍导致贫血,对感染和出血的高敏感性有关。AML更常影响男性。它可发生于任何年龄,但发病率是已知会增加老年人的1,2,3,4,5。诱导缓解的化学疗法导致骨髓发育不全,引起贫血,中性粒细胞减少和血小板减少。在发育不全期间(2-3周),必须仔细监测患者并接受支持药物,包括血液制品和抗生素。的严重中性粒细胞有助于增强对感染的易感性和高死亡率在这个阶段6,7,8,9。28%的AML患者生存5年(www.seer.cancer.gov)。
Collectins和ficolins是与胶原蛋白相关的多聚凝集素,可作为模式识别分子,参与抗微生物和抗癌免疫力。所有人类纤维蛋白(ficolin-1,-2,-3)和一些collectin(包括甘露糖结合凝集素,MBL)与甘露糖结合凝集素相关的丝氨酸蛋白酶(MASP)形成复合物,使它们能够通过凝集素途径10,11。它们还能够调理病原体和异常宿主细胞。因此,它们可以防止某些感染或通过细胞的直接裂解一些恶性肿瘤的发展表达病原体/危险相关的分子模式或增强吞噬作用的12,13,14,15。在另一方面,激活补体性的凝集素可以参与过度或慢性炎症,其可以是对宿主有害,导致在某些情况下到器官衰竭或癌变,分别16,17,18。
这项研究的目的是研究开始化疗前血清中的ficolins和/或MBL水平与急性髓细胞性白血病本身及其对化疗后医院感染的敏感性之间的可能联系。我们还旨在研究与这些蛋白编码基因的选定多态性的可能关联。确定血清中ficolin-1,ficolin-2,ficolin-3和MBL的浓度(化疗前),并选择相应基因(分别为FCN1,FCN2,FCN3和MBL2)的单核苷酸多态性(SNP )。总共选择了15个影响基因表达,其产物浓度和/或活性的SNP。对应于-542 G的变异(A)等位基因 > 甲(rs10120023)和- 144 Ç > 甲(rs10117466)FCN1基因多态性与特定mRNA的单核细胞和粒细胞更高的表达以及较高胶凝蛋白-1血清水平相关联19,20。相反,存在A,C,G变体,与+ 6,658 G > A(Ala218Thr,rs148649884),+ 7,895 T > C(Ser268Pro,rs150625869和+ 7,959 A > G(Asn289Ser,rs138055828)SNP分别导致Ficolin-1浓度降低。此外,在位置218和289处氨基酸残基的交换会影响配体的识别,而在位置+ 7895处的C / C纯合子被认为会导致ficolin-1缺乏19。
对于FCN2基因,我们在强连锁不平衡中选择了两对多态性。首先,-64 A > C(rs78654553)和+ 6,424 G > T(Ala258Ser,rs7851696)与次要等位基因携带者中Ficolin-2血清水平相对较低相关。第二个, - 4 甲 > G ^(rs17514136)和+ 6359 Ç > Ť(Thr236Met,rs17549193),具有相反的效果21,22,23。此外,位置+6,359和+6,424的变异等位基因被证明会影响蛋白质21的配体结合能力。
FCN3基因的移码突变(+ 1637 delC, rs28357092)导致变体纯合子中罕见的总ficolin-3缺乏和杂合子24血清中该蛋白的水平低。MBL2基因启动子区域的单核苷酸多态性:-550 G > C(rs11003125,通常称为H / L)和-221 C > G(rs7096206,Y / X)影响MBL血清浓度。编码区SNP:+ 223 C > T(Arg52Cys,rs5030737),+ 230 G > A(Gly54Asp,rs1800450)和+ 239 G > A(Gly57Glu,rs1800451),称为A > D,A > B和A > C(其变异等位基因通常称为O)同时影响MBL水平和活性。O等位基因的存在与降低的调理特性和补体活化有关,这是由于分子的低聚作用减弱以及与MASP形成复合物的能力所致。对内源性金属蛋白酶的敏感性增加又有助于降低MBL浓度。由于上述SNP [和另一个SNP之间存在强连锁不平衡,此处未研究:+ 4 C > T(rs7095891,P / Q,在MBL2基因5'-非翻译区)],仅七个单倍型被认为是相对常见的:HYPA,LYPA,LYQA,LXPA,HYPD,LYPB,LYQC(在10中进行了综述)。
尽管罕见错义变体FCN1(rs148649884,rs150625869,rs138055828)以及的移码突变FCN3(rs28357092)比较少见19,24,它们显着地影响它们的相应的蛋白质的浓度和/或功能。因此,我们认为这些SNP可能会调节对AML本身和相关医院感染的敏感性,并且其作用将足以被检测到。
结果
FCN1基因多态性与ficolin -1的血清浓度
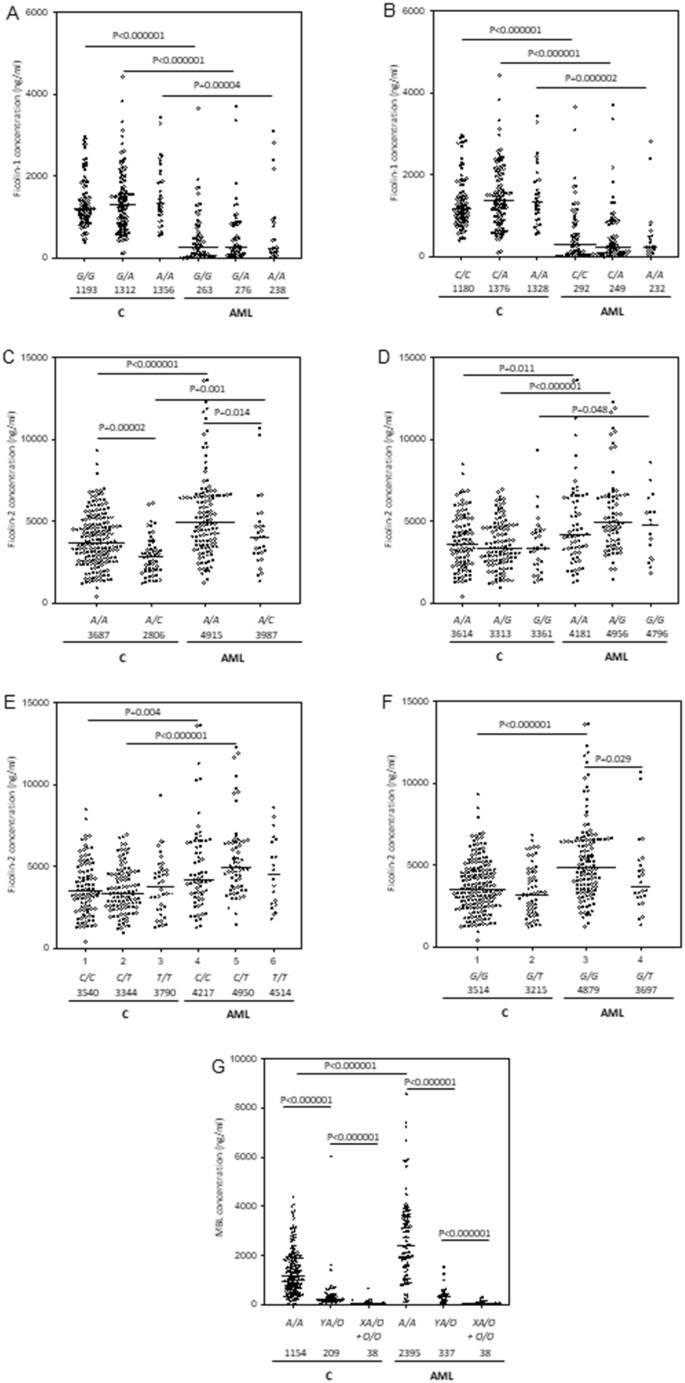
所有患者和对照均为T / T和A / A纯合子,分别具有+7895 T > C(rs150625869)和+7959 A > G(rs138055828)FCN1基因多态性。的G / G基因型( - 542 g ^ > 甲 SNP,rs10120023)是较常见的患者中,与对照组(C组)进行比较[ p = 0.018,OR = 1.6,95%CI(1.1-2.45)](表1)。这主要反映了G / G相对较高的数量在住院4周内无感染并发症的纯合患者。经过多次逻辑回归分析并进行了多次比较校正后,患者和对照组之间的差异仍然很明显[ p = 0.004,OR = 2.95,95%CI(1.41-6.16),已校正性别和年龄,主导模型](表1) 。应该强调的是,与对照相比,患者之间的等位基因分布不符合Hardy-Weinberg平衡:G / G纯合性比预期的更为普遍(p = 0.015)。AML组和C组之间的-144 C > A(rs10117466)或+ 6,658 G > A没有发现显着差异(rs148649884)多态性。但是,首先提到的A / A纯合性在发生菌血症/真菌病(AML-A)的患者中比没有这种并发症的患者(AML-D)更为普遍[ p = 0.01,OR = 6.89,CI为95%( 1.4–33.98)]。用EM最大似然法重建单倍型后(补充表1),我们发现了GCG单倍型(对应于-542 G > A,-144 C > A和+ 6,658 G > ASNP)是所有组中最常见的。然而,不仅与健康对照组相比,而且与没有医院感染的患者相比,其在患有菌血症/真菌病感染的患者中的估计频率明显更低(p <0.01;补充表1)。
相比之下,AML中ACG和GAG单倍型比C组更常见。最后提到的在AML-A组中特别常见(与C组和AML-B组相比有显着差异)。此外,与对照组相比,AML-D中ACG和GAG变体的频率均高于对照组,而AAG变体则存在反比关系(在联合AML组中也是如此)(补充表1)。
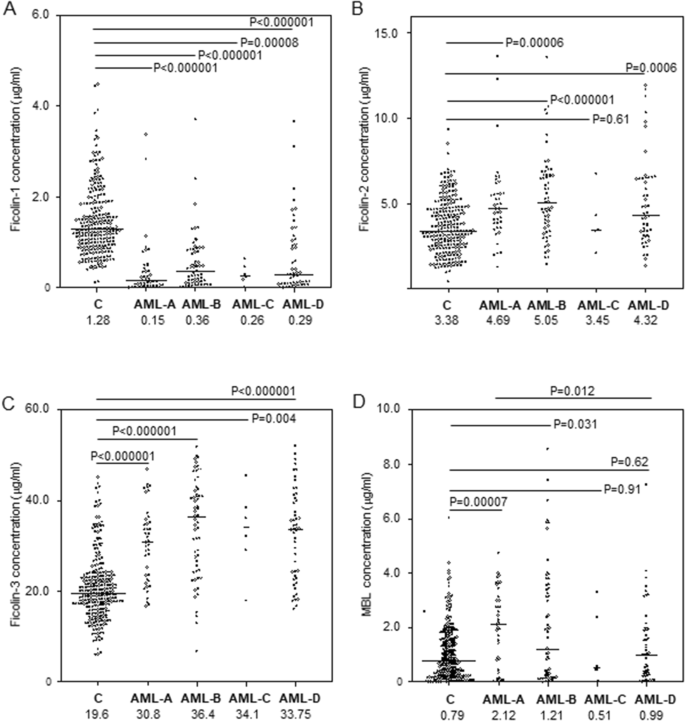
AML患者开始化疗之前的血清中ficolin-1浓度中值几乎比健康对照者低五倍(260 ng / ml对1,277 ng / ml;p <0.000001,Mann–Whitney U检验),与住院期间记录的并发症无关保持或FCN1基因型(图 1 A,2 A,B)。化疗后伴有菌血症/真菌血症的医院感染患者(151 ng / ml)注意到开始治疗前的最低中位数(图 1一个)。此外,化疗前较低的ficolin-1似乎预示着发烧时间延长:发烧超过7天的患者的中位数低至119 ng / ml,而其他患者的中位数为284 ng / ml(p = 0.026) 。但是,在Bonferroni校正后,该结果在统计学上并不显着。此外,与死亡率没有关联。
根据研究的多态性,患者(AML)和对照组(C)的血清Ficolin-1,Ficolin-2和甘露糖结合凝集素浓度。条形代表中值(在基因型描述下方给出)。使用Mann-Whitney U检验比较中位数(当观察到显着差异时给出p)。(A)ficolin-1水平和-542 G > A多态性;(B)ficolin-1水平和-144 C > A多态性;(C)ficolin-2水平和-64 A > C多态性;(D)ficolin-2水平和− 4 A > G多态性 (E)ficolin-2水平和+6,359 C > T多态性;(F)ficolin-2水平+ 6,424 G > T多态性。(G)MBL水平和共同的启动子(Y / X)和外显子1(A / O)多态性。
因此,与健康对照组(10.2%)相比,AML患者(71.2%)的低ficolin-1水平(<620 ng / ml)非常常见[ p <0.00001,OR = 23.4,95%CI(13.64–40.2) ]。经过多次逻辑回归分析和Bonferroni校正后,差异仍然非常显着[ p <0.001 OR = 38.2 95%CI(17.57–83.04)]。因此,低ficolin-1的最高发生率(82.9%)与最严重的感染有关[ p <0.000001,OR = 44.7,相对于C组,CI值为95%(17.95-111.3)]。但是,在其他患者的亚组中也经常注意到浓度<620 ng / ml。即使在不复杂的情况下(n = 50),其频率也等于66%[ p <0.000001,或= 17.9,相对于对照,95%CI(8.73–36.55)。我们观察到高浓度(> 2.9μg/ ml)的频率没有明显差异(AML:2.6%vs. C:5.1%)。有趣的是,尽管Ficolin-1的水平与白细胞(WBC)相关,而与血小板(PLT)计数的相关性较弱(分别为r = 0.49,p <0.000001和r = 0.24,p = 0.003),但高白细胞增多常与低ficolin-1。然而,应该强调的是,没有 观察到与绝对中性粒细胞计数(ANC)的相关性(r = 0.05,p = 0.53)。如图 2 A,B所示,AML组的血清Ficolin-1浓度与FCN1不相关 尽管在不同基因型携带者之间的差异并不显着,但在对照组的– 542和– 144位上的SNP基因位点却处于预期趋势(与变异等位基因相关的水平较低)。
FCN2基因多态性与ficolin-2血清浓度
我们发现患者和对照之间的FCN2基因型或等位基因分布无显着差异(表2)。单体型的重建揭示了AACG(包括在-64,-4,+ 6,359和+ 6,424位的主要等位基因)在AML和C组中都是最常见的。与AGTG变体一起,它占了大约。每个组/亚组中80%的单倍型(补充表2)。该AACG单倍型的患者谁住院(在无感染并发症中发现尤其是经常p = 0.029与控制)。但是,经过多次比较校正后,该结果在统计上并不显着。
尽管患者和对照组之间的FCN2基因型频率没有差异,但AML组中Ficolin-2的中位数浓度(4.69 µg / ml)明显高于对照组(3.38 µg / ml,p <0.000001,Mann–惠特尼ü -test)。在外显子8 SNP的特定情况下,尽管有明显的趋势,但变异纯合子(+ 6,359 C > T)或杂合子(+ 6,424 G > T)之间的差异在统计学上并不显着,也许是由于其数量相对较低(图 2)E,F)。最高值与感染相关,是否伴有菌血症/真菌血症(4.69 µg / ml;p = 0.00006)(5.05 µg / ml;p <0.000001)(图 1 B)。异常地,在10名患者(6.4%)中,ficolin-2水平超过10 µg / ml(最大值13.6 µg / ml)。Ficolin-2浓度与患者发烧持续时间或死亡率之间未发现显着关系。另一方面,与没有医院感染(AML-D)的患者相比,确诊菌血症/真菌血症(AML-A)的患者中+6,359 C > T(rs175491193)多态性的C / C纯合子较少见[ p = 0.033 ,或= 0.37,95%CI(0.15-0.88),经Bonferroni校正后不显着](表2)。
因此,与对照组(5.2%)相比,AML患者(29.5%)的高Ficolin-2水平(> 6.35 µg / ml)过高[ p <0.00001,OR = 7.65,95%CI(3.92-14.57);经过多重逻辑回归分析后:p <0.001 OR = 5.43 95%CI(2.01–14.63)]。在没有菌血症/真菌血症感染的患者中,发现这种高的ficolin-2浓度的频率最高(35.6%)[ p <0.000001,OR = 9.99,相对于C组,CI为95%(4.62–21.62)]。
Ficolin-2水平与Ficolin-1(r = 0.22,p = 0.006)和WBC计数(r = 0.22,p = 0.009)弱相关,但与ANC或PLT计数无关(未显示)。与ficolin-1相反,发现与C反应蛋白(CRP)(r = 0.28,p = 0.002)和纤维蛋白原(FBG)(r = 0.29,p = 0.003)浓度有显着(尽管相对较弱)相关性。
尽管患者和对照组的G / G纯合子和G / T杂合子之间的差异没有统计学意义,但患者和对照中Ficolin-2的浓度均与-64和+6424位的FCN2多态性相关(图 2 C,F) 。但是,我们没有发现在位置− 4和+ 6,359处SNP的预期关联(图 2 D,E)。
FCN3基因+ 1637delC突变和Ficolin-3的血清浓度
尽管157名患者中只有1名患者(0.6%)是杂合子(C / delC),但与对照组相比无统计学差异(测试的257名个体中有7名杂合子,占2.7%)。测试的个体均没有变异纯合子(与ficolin-3原发性缺陷相关的基因型)。与ficolin-2的情况一样,AML患者的ficolin-3血清中值浓度(33.6μg/ ml)明显高于对照组(19.6μg/ ml,p <0.000001,Mann–Whitney U -test)。同样,最高值与无菌血症/真菌血症的感染有关(36.4μg/ ml, 与C组相比,p<0.000001),但在所有亚组中均观察到显着差异(图 1)。C)。没有明显的ficolin-3水平与发烧或死亡持续时间的关联。
与ficolin-2一样,患者中较高的ficolin-3浓度(42%)比对照组(5%)更常见[ p <0.000001,OR = 14.1,95%CI(7.42–26.75);多元逻辑回归分析和多重比较校正仍显示出非常显着的结果:p <0.001,OR = 17.92 95%CI(6.31–50.93)]。大多数(54.2%)经历了与菌血症/真菌血症无关的感染的患者,化疗前血清ficolin-3含量较高(> 34.9μg/ ml)(p <0.000001,OR = 22.4,95%CI(10.52–47.83)vs。 C组)。相比之下,只有一名患者(0.6%)(FCN3 C / delC杂合子)发现低浓度(< 12.9μg/ ml),而对照组中如此低的Ficolin-3水平的频率达到10%[ p <0.000001,或= 0.06,95%CI(0.008–0.43)]。
Ficolin-3与Ficolin-1(r = 0.17,p = 0.038),ficolin-2(r = 0.31,p = 0.0001)和WBC计数(r = 0.25,p = 0.002)弱但显着相关,但与ANC无关或PLT计数(未显示)。
MBL2基因多态性和甘露糖结合凝集素浓度
尽管MBL2基因HYA,LYA,LXA,HYD,LYD,LYB或LYC单倍型的频率在两组之间没有显着差异(补充表3和表4),但与MBL缺乏相关的基因型(LXA / O,O / O)不同在患有AML比对照患者中更常见当与分析χ 2检验(p = 0.026,OR = 1.9,95%CI(1.07-3.43)。然而,在多重逻辑回归,校正性别和年龄(隐性模型)和Bonferroni校正,未发现显着差异[ p = 0.093,OR = 1.77,95%CI(0.91–3.44)](表3)。启动子/外显子1的多态性似乎不影响患者医院感染或发烧持续时间的风险(未显示)。
AML患者化疗前的MBL血清中值明显高于对照组(1381 ng / ml与789 ng / ml,p = 0.0016,Mann–Whitney U检验)。这反映了A / A纯合子之间的显着差异,但没有反映一个或两个O等位基因的携带者之间的显着差异。此外,通常观察到,发现相同基因型(尤其是A / A)的携带者之间MBL水平存在明显差异(图 2 G)。
从后来严重感染并伴有菌血症/真菌血症的患者中获得最高中位数(2,122 ng / ml)(图 1 D)。它与没有短期感染并发症的患者有显着差异(989 ng / ml,p = 0.012)。没有发现血清MBL水平与发烧或死亡时间相关。
通常,与对照组相比,高MBL浓度(> 3μg/ ml)在患者中占较高比例(26%)[4.9%,p <0.000001,OR = 6.7,95%CI(3.44-12.98);经过多重逻辑回归分析后:p <0.001 OR = 9.22 95%CI(3.03–28.02),与医院感染相关的频率特别高,无论是否伴有菌血症/真菌血症[26.8%,p <0.0001,OR = 7.1,95 %CI (2.93–17.27)]与否[33.9%,p <0.0001,OR = 9.94,95%CI(4.58–21.59)]。
AML组中的MBL浓度与ficolin-1(r = − 0.18,p = 0.02)成反比,但与其他ficolins,WBC,ANC,PLT计数,CRP或FBG无相关性(未显示)。
Ficolins和甘露糖结合凝集素作为急性髓细胞白血病的潜在补充生物标志物
ROC分析表明,ficolin-1在区分急性髓性白血病患者和健康受试者方面具有很高的潜力。此外,它可以很好地区分患有AML的人和多发性骨髓瘤或淋巴瘤(表4;补充图1)。Ficolin-2区分AML和C组的可能性较低,但多发性骨髓瘤和淋巴瘤的数据更有希望(表4;补充图2)。就ficolin-3而言,ROC分析显示出在AML患者和对照以及其他血液恶性肿瘤患者之间进行区分的相对较高的潜力(表4;补充图3)。
尽管对MBL的ROC分析显示出统计学意义,但曲线面积似乎相当低。此外,MBL水平没有更大的潜力将AML与多发性骨髓瘤或淋巴瘤区分开(表4;补充图4)。
讨论区
文献中尚未广泛讨论血纤维蛋白胶与血液系统癌症和/或化疗相关感染的临床关联。先前,Schlapbach等。25位报道患有AML和急性淋巴细胞白血病(ALL)的儿童(总共41例)患儿的ficolin-1血清水平低于对照组。他们发现ficolin-1浓度与外周血白细胞计数呈强正相关,与血液和骨髓中白血病母细胞呈负相关。我们从一大批被诊断患有AML的成年人中获得的数据证实,患者和对照组之间的Ficolin-1水平中位数存在显着差异(图 1一个)。不出所料,ficolin-1与WBC和PLT计数相关。没有观察到与嗜中性粒细胞计数的相关性,但这可能只是反映了嗜中性白血球减少症,包括可获得此类数据的143名患者中的61名中性白细胞总数的缺乏。在46例患者中,发现Ficolin-1(<100 ng / ml)极低,这是由于异常的造血作用而非原发性(与FCN1基因相关)缺乏所致。但是,由于G / G基因型频率较高(-542 G > ASNP),AML组中较低的中值可能在一定程度上具有遗传背景(表1)。变异等位基因(A)以前报道与较高的血清纤维胶凝蛋白-1浓度相关联19,20,但是我们发现C和AML组(图中的不同基因型的载波之间没有差异显著 2 A,B)。患者之间的等位基因分布明显受到干扰,因为它不符合Hardy-Weinberg平衡(两组均与对照以及本文研究的所有其他SNP相反)。
Schlapbach等。25还报道了在化疗后的儿科患者(也包括有菌血症的患者),低Ficolin-1(<0.5 µg / ml)与发热性中性粒细胞减少症之间缺乏关联。另一方面,Ameye等。26名发现该蛋白的低(中位数:270 ng / ml)浓度与患有血液系统恶性肿瘤(包括白血病)的成年人中的严重感染有关(无此类事件的患者中位数:470 ng / ml)。来自我们队列的数据显示,确诊菌血症/真菌血症患者的中位数最低,但是该数值也与没有医院感染的患者有关。另一方面,A / A纯合性与− 144 C > A有关SNP(报道与较高的相关FCN1基因-特异的mRNA表达和较高的血清纤维胶凝-1级19,20)似乎是危险因素的患者中最严重的感染(表1)。根据补充表1中的数据,可以推测FCN1 ACG和GAG单倍型(用EM最大似然法重建)是急性髓细胞性白血病的危险因素,尤其是合并有严重医院感染的患者,而GCG似乎是保护性的。
ROC分析表明,ficolin-1不仅有可能区分AML患者和健康对照者,而且还可以区分AML患者与患有其他血液系统恶性肿瘤(多发性骨髓瘤或淋巴瘤)的个体。最近发表了有关这些患者血清中ficolins浓度的详细数据27(表4)。尽管ficolin-1被认为是其他癌症标志物的候选者,大肠癌和腺瘤28,但这种早期的关联尚未被报道。Handschuh等人发表的数据可能支持我们的假设。29名表现出FCN1表达明显不足的人被诊断患有AML的患者外周血单核细胞和骨髓中的这种基因。然而,拉斯穆森等。基于对异质性癌症患者群体的分析,30提出ficolin-1作为疾病的生物标志物是无用的。
与ficolin-1相比,AML组的ficolin-2和ficolin-3血清中值明显高于健康对照组(图 1 B,C)。在某些情况下,我们观察到异常高的ficolin-2浓度。尽管通常在医院感染患者中发现最高值和最高频率的最高频率,但我们发现与发烧或死亡的持续时间无关。可以推测,高水平的ficolin-2和ficolin-3与癌症本身有关,而不是与化学疗法相关的医院感染有关。然而,Ficolin-2与Ficolin-1和-3不同,它与炎症标志物CRP和FBG相关。
几篇较早的报道[ 31],[ 32]表明,在各种血液系统癌症患者中,ficolin-2和/或ficolin-3与感染或发热性中性粒细胞减少症的发病率缺乏关联。然而,低纤维胶凝蛋白-2建议同种异体造血细胞移植后,以预测正弦阻塞综合征(SOS)的发展的风险更高33,34而低胶凝蛋白-3被认为是对儿童发热性中性粒细胞减少(也伴随有菌血症)的危险因素,用抗癌化学疗法治疗35。
帕纳(Pana)等人。在某些位置上发现了36个 FCN2单倍型的关联[对应于位置的启动子多态性:− 986(A > G),− 602(G > A),− 4(A > G)和外显子8位点多态性:+ 6,359(C > (T),+ 6,424(G > T)],经化疗后被诊断为B细胞ALL的儿童患有细菌感染和发热性中性粒细胞减少。我们研究了5个上述多态性位点中的3个,另外一个(-64 A > C)。它们均与AML本身无关(也未重建单倍型,如补充表2所示),但是,与+6,359 C > T SNP 相关的主要(C)等位基因纯合子可能被认为具有抵抗细菌感染/菌血症的保护作用(表2)。
ROC分析显示,ficolin-2和ficolin-3在区分AML患者和对照组以及患有多发性骨髓瘤或淋巴瘤的患者中具有很高的潜力(表4)。此前,Rasmussen等人。30发现,在普通患者与健康患者或非恶性疾病患者之间,ficolin-3的辨别力没有差别。28报道了其区分大肠癌和腺瘤患者(但非对照)的潜力相当弱。在上述两个研究中,未确定丝胶蛋白2的浓度。
单个MBL2基因分析的数据表明,原发性MBL缺乏症(MBL2 LXA / O或O / O基因型)可能与罹患AML的风险更高相关,但是在多对数回归分析和多次比较校正中并未得到证实(p > 0.05)。此外,它不影响患者发生化疗相关感染的风险。最近,我们发现自体造血干细胞移植后遗传性MBL缺乏与多发性骨髓瘤之间存在关联,但与医院感染无关。37。早些时候,Schmiegielow等人。38报道MBL缺陷型基因型与儿童的另一种白血病(ALL)有关。尽管缺乏活性MBL分子,但其发病机制有所不同,因此可能与AML和ALL的发展有关。尽管MBL缺乏可能与癌症有关,但我们通常观察到患者的血清MBL较高。有趣的是,我们较早前在卵巢癌中报告了类似的发现:MBL缺乏与疾病本身有关,但与此同时,患者(手术前)的MBL血清水平显着高于对照组,这主要反映了A / A之间的差异纯合子妇女17,正如我们在此也报道的AML患者一样(图 2G)。此外,AML患者高MBL似乎预示着最严重的感染(伴有菌血症和/或真菌血症)。这可能支持我们先前的假设[ 37],因为在血细胞减少症期间,MBL的调理作用不会促进吞噬作用,即使高水平也不能激活感染,尽管能够激活补体。另一个颇具推测性的解释可能是无症状/隐性感染的存在,导致MBL升高,并且当化学疗法使免疫抑制升级时,MBL被(重新)激活。同样,Bergmann等人较早地报道了在患有急性髓性白血病的患者中缺乏甘露糖结合凝集素缺乏与化疗诱导的感染的联系。39和Klostergaard等。40。此外,从其它一些研究(关于患者与其他白血病,或在一般血液学恶性肿瘤)导致类似的结论数据 41,42,43,44,45,46。与此相反,以我们的结果呈现在这里和前面提到的最近纸 37,一些早期的报道认为增强了对在这种情况下的感染的风险是低的MBL(或相关联的基因型) 31,32,36,47,48,49,50。此外,已证明L-天冬酰胺酶(用于ALL治疗)可导致MBL浓度显着降低,这被怀疑会导致感染引起的发热性中性粒细胞减少症的风险增加51。因此,MBL在血液系统恶性肿瘤中的参与显得复杂而模棱两可。它似乎取决于多种因素,包括患者的基因型,年龄,疾病类型,治疗方案等。
尽管患者和对照组之间MBL血清浓度存在显着差异,但这种凝集素似乎不是急性髓细胞性白血病生物标志物的有希望的候选物(图 1 D,表4)。此前,Storm等人。28和Rasmussen等。30发现癌症患者和健康个体之间无区别的甘露糖结合凝集素效力。
通常,患者和对照之间血清中ficolins和MBL浓度的显着差异似乎反映了相应基因表达的失调。从ficolin-1的主要合成位点(骨髓和白细胞),已知在AML 29中的表达不足以及图2 A,B中提供的数据 来看,这是最明显的。ficolin-1 此处分析的其他基因(FCN2, FCN3,MBL2)主要在肝脏中表达,并且它们在血液中存在的产物主要来自肝。由于肝参与AML的情况并不常见52,可以认为它们的过表达取决于调节与异常造血和致癌作用相关的合成的因素的变化。例如,AML患者中的血清白细胞介素6(IL-6)水平已知会增加MBL 53的表达,其水平高于健康对照者54。同样,肝脏中FCN2和FCN3基因的表达可能会受到较高浓度的促炎剂或较低水平的抑制因子的影响。
另一个问题是ficolins在肝脏以外的器官/组织中异常表达的潜在参与,特别是在呼吸系统中的ficolin-3。Ficolin-3似乎不能预防局部感染,因为在AML患者中肺炎(通常是严重的)很常见。FCN3和FCN2基因在肾上腺和脂肪组织中的正常低表达以及肾脏中的FCN3和前列腺中的FCN2(经Garred 55审查)也可能受到疾病的影响,但是尚无有关其相关不良反应的数据发表效果。FCN2基因表达失调(如上述FCN1)还可能解释了Ficolin-2血清水平出乎意料的缺乏差异,具体取决于− 4 A > G和+ 6,359 C > T SNP(图 2 D,E)。但是,在健康对照组中也观察到了相似的结果,因此,这种直接关联的可能性很小。
我们研究的一些限制,如血液采集管或样品处理过程对纤维胶凝-1和纤维胶凝-2级别的类型可能影响56,57,58或随着年龄的增长胶凝蛋白-3的相关性59,必须要考虑到帐户,但可以简单地克服它们。另一个限制可能是AML组的样本量相对较小和某些异质性(某些患者已复发)。但是,大多数关联(尤其是与血纤蛋白的血清水平相关的关联)都是高度显着的,在新诊断和复发的患者之间未观察到更大的浓度差异(未显示)。
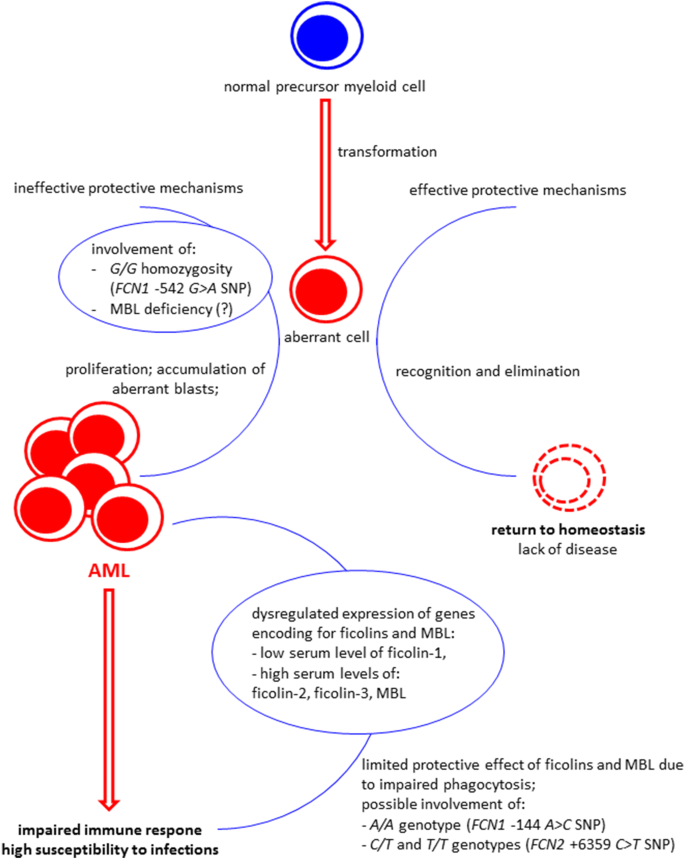
总而言之,我们的数据表明,ficolins可能被认为是AML的候选补充生物标志物:低ficolin-1以及高ficolin-2和ficolin-3似乎与该疾病有关,不仅使患者与健康对照而且与其他患者区别开来患有其他血液恶性肿瘤(至少两组癌症:多发性骨髓瘤和淋巴瘤)的人。然而,这里报道的最重要的发现是FCN1可能与MBL2基因多态性与恶性肿瘤相关。血清MBL对严重感染风险的影响可能具有临床意义。我们的数据的假设解释如图3所示 。
该方案提出了对我们的结果的假设解释。FCN1基因的G / G纯合性-542 G > A多态性(与ficolin-1基因表达水平相对较低有关)以及可能的原发性MBL缺乏可能会导致异常细胞清除功能受损,从而导致疾病发展/进程。这导致编码纤维蛋白和MBL的基因表达失调,导致低ficolin-1和高ficolin-2,ficolin-3和MBL(在MBL充足的患者中)血清浓度升高。异常的造血功能与对病原体的免疫反应减弱有关,而病原体的免疫反应减弱又受到上述可溶性模式识别分子和化学疗法生产失调的影响(图中未显示)。由于吞噬作用受损,ficolins和MBL的保护作用似乎受到限制(吞噬细胞甚至无法消除Ficolin或MBL调理过的细菌/真菌细胞)。但是,A / A(− 144 C > A,FCN1基因),C / T和T / T(+ 6,359 C > T,FCN2基因)基因型与化疗后短期内最严重的感染有关。
材料与方法
患者和对照
招募了157名患有急性髓性白血病的患者(新诊断134例; 23例复发)(女性73例,男性84例,平均年龄:60.3±14.9;年龄范围24-89)。根据3 + 7方案[(阿糖胞苷,在第1-7天给予蒽环霉素(柔红霉素或伊达比星,在第1-3天给予);剂量取决于患者的年龄]或DAC方案(柔红霉素,阿糖胞苷)治疗了81人波兰急性白血病小组(PALG)推荐,并加入克拉屈滨1到5天60。其余患者仅接受阿糖胞苷(n = 18),阿西替丁(n = 14),地西他滨(n = 11)或其他化疗药物(n = 17)的治疗。未考虑进行任何化疗的16名患者仅接受了最佳支持治疗(BSC)。确定了关键的临床参数,例如白细胞(WBC)计数,绝对中性粒细胞计数(ANC),血小板(PLT)计数,炎症标志物[C反应蛋白(CRP)和纤维蛋白原(FBG)]的水平。在住院期间,并发症的发生率[感染(与细菌血症/真菌病无关),发热性中性粒细胞减少症(FN);记录发烧持续时间> 38°C,无中性粒细胞减少症患者的临床症状,并进行4周分析。开始化疗后短时间内(长达1个月)有40名患者死亡。此外,随访至少6个月的96人中有23例死亡。在100例患者中确诊了医院感染(41例伴有菌血症/真菌血症的患者,定义为严重感染),在6例中未发现感染性发热性中性粒细胞减少症。最常见的病原体是葡萄球菌(26株,包括8种耐甲氧西林的MR)和大肠杆菌(13种分离物,包括6个扩展光谱的贝他酰胺酶阳性,ESBL +)。
对照组包括267人(无癌症,自身免疫性疾病或复发感染史的无关志愿者; 174名女性和93名男性;平均年龄:48±13;年龄范围18-84)。Świerzko等人先前曾发表过对照组的更详细特征。37。此外,为了进行某些分析,还使用了其他血液恶性肿瘤患者的数据:多发性骨髓瘤(n = 194)或淋巴瘤(n = 118)(这些组先前已详细描述37)。
该研究通过罗兹医科大学的伦理委员会和W¯¯从获得患者和对照雷农知情同意书。这项工作符合《赫尔辛基宣言》的规定。
DNA和血清样本
化疗前从患者的S-Monovette柠檬酸盐管(Sarstedt,Nümbrecht,德国)中抽取用于DNA提取的血样,并保存在− 80°C下。根据制造商的规程,使用GeneMATRIX快速血液纯化试剂盒(EURx Ltd,格但斯克,波兰)提取DNA。即将开始化疗之前,将具有血清分离物的样品放入带有凝块激活剂(Sarstedt)的S-Monovette管中。将血清储存在-80°C直至测试。
FCN1基因分型
在HpyCH4V(New England Biolabs,)的帮助下,使用PCR-RFLP方法研究了+6585 (G > A ; A218T; 8号外显子,rs148649884)和+7895(T > C ; S268P; 9外显子rs150625869)的多态性。基本上如Świerzko等人(1991年)所述,Taq1(Thermo Fisher Scientific,美国麻萨诸塞州沃尔瑟姆)核酸内切酶。61。
另一个SNP位于外显子9(+ 7,959 A > G ; N299S; rs138055828),另外两个位于启动子区域(− 542 G > A,rs10120023和− 144 C > A,rs10117466)也通过PCR-RFLP测试,使用内部程序27。简而言之,PCR使用适当的跨度引物在C1000 Thermal Cycler(Bio-Rad,Hercules,CA,美国)上运行,该引物是使用PRIMER3软件(0.3.0版)设计的,https://bioinfo.ut.ee /引物3/ 62,63(表5)。将DNA样品(100 ng)添加到反应体积为25μl的溶液中,其中包含2.5μl的10×聚合酶缓冲液,1 U的TaqDNA聚合酶(Thermo Fisher Scientific),2 mM的MgCl 2和200μM的dNTP混合物(Thermo Fisher科学)和0.4μM引物。
PCR条件如下:
95°C 3分钟; 59°C 30 s,然后35个循环(72°C 30 s,95°C 30 s,59°C 30 s)加上最终伸长72°C 3分钟。PCR产物用限制酶处理(所有酶均来自Thermo Fisher Scientific,在生产商推荐的缓冲液中;表5中给出的条件]。对应于等位基因G(位置-542),C(-144)和A(+ 7,959)的产物进行了消化,而分别对应于等位基因A,A,G的产物则保持完整。限制片段的长度在表5中给出。在初步实验中,已经通过测序确认了基因型(未显示)。
FCN2基因分型
FCN2基因的多态性:-64 A > C(rs78654553),(位于启动子内),+ 6,359 C > T(rs175491193),和+ 6,424 G > T(rs7851696)(均为外显子8)被分析PCR,如前所述64。使用MboII限制性内切酶(Thermo Fisher Scientific),使用PCR-RFLP方法研究了另一个启动子多态性− 4 A > G(rs17514136)64。
FCN3基因分型
如Michalski等人先前所述,在ApaI核酸内切酶(Thermo Fisher Scientific)的帮助下,使用PCR-RFLP方法研究了FCN3基因的+1637 delC移码突变。65。
MBL2基因分型
如前所述66,使用等位基因特异性PCR分析了MBL2基因的单核苷酸多态性,其位于启动子(H / L,位于-550,rs11003125和Y / X,位于-221,rs7096206)。外显子1(A / D,52位密码子,rs5030737; A / B,54位密码子,rs1800450和A / C,57位密码子,rs1800451)多态性通过PCR-RFLP程序使用MluI,BshNI和MboII(所有分别购自Thermo Fisher Scientific)酶66。
血纤蛋白和甘露糖结合凝集素的血清浓度测定
血清ficolin-1和ficolin-3的浓度通过TRIFMA(如Wittenborn等人67所述)和ELISA [根据Michalski等人(2002)。65)。通过TRIFMA测量Ficolin-2的水平。简而言之,将微量滴定板(Optiplate-384HB,Perkin Elmer,沃尔瑟姆,马萨诸塞州,美国)涂上抗ficolin-2(ABS 005-16,BioPorto Diagnostics,哥本哈根,丹麦,1 µg / ml)。将板用0.1%BSA封闭,然后与要测试的血清一起孵育(预稀释为1:10)。生物素化单克隆抗体(克隆GN4,1:100,Hycult Biotech,Uden,荷兰)和Eu 3+标记的链霉亲和素(Perkin Elmer)用于检测。与增强溶液(Perkin Elmer)孵育后,使用Varioskan Flash阅读器(Thermo Fisher Scientific,Waltham,MA,USA)测量荧光值。以健康志愿者的血清(ficolin-2浓度:3.5μg/ ml)为标准。MBL浓度是通过ELISA测定的,使用酿酒酵母(美国酿酒厂,美国密苏里州圣路易斯的西格玛-奥尔德里奇)的甘露聚糖作为包被抗原,鼠抗人MBL单抗(HYB131-1,BioPorto Diagnostics,哥本哈根,丹麦)68。
“低”和“高”值分别基于对照组的第10和第95个百分位数任意确定。因此,浓度<620 ng / ml(ficolin-1),<1,670 ng / ml(ficolin-2)和<12.9 µg / ml(ficolin-3)被认为是“低”,而> 2.9 µg / ml,> 6.35 µg / ml和> 34.9 µg / ml分别被认为是“高” 27。例外地,当MBL的浓度小于150 ng / ml(因为MBL缺乏)时,MBL被认为是“低”,而对照组的“高” MBL则相当于95%(> 3 µg / ml)37。
统计分析
Statistica(13.3版,TIBCO软件),SigmaPlot(12.0版,Systat软件)和Arlequin(3.5.2.2版,https: //cmpg.unibe.ch/software/arlequin35/ )软件包用于数据管理和统计。计算。使用Mann-Whitney U检验比较蛋白质浓度的中位数。选择该值是因为值不是正态分布的(未显示)。低或高的级别的频率,以及基因型/等位基因通过比较双面费歇尔精确检验(或χ 2在适当的时候)。EM最大似然法用于FCN1和FCN2的重建单倍型。通过多重逻辑回归分析验证了可能的关联,并针对性别和年龄进行了校正。此外,对分析进行了多次比较校正(邦费罗尼校正)。分析中排除了两个SNP(FCN1基因:+ 7,895 T> C, + 7,959 A > G)(未发现杂合子或变异纯合子)。此外,同一基因的另一个SNP(+ 6,658 G > A)和FCN3基因+ 1637 C > delC隐性模型排除了突变(无变异纯合子)。为了评估测试因子的分化潜力,采用了ROC分析。相关性通过Spearman检验确定。p值<0.05(p <0.0125校正多重比较后)被认为是统计学显著。
|
|