小鼠血浆中血清淀粉样蛋白A3的存在取决于炎症刺激的性质和程度
小鼠血浆中血清淀粉样蛋白A3的存在取决于炎症刺激的性质和程度
血清淀粉样蛋白A3(Saa3)主要来自肝外组织,在中度发炎的肥胖小鼠的血浆中未检测到。相反,它存在于通过注射高剂量脂多糖(LPS)急性发炎的小鼠的血浆中。为了调和这些差异,我们评估了不同的急性炎症刺激是否会影响血浆中Saa3的存在。LPS注射后,Saa3在血浆中呈剂量依赖性。相比之下,尽管用硝酸银进行无菌炎症后仅检测到非常低的水平,尽管Saa1和Saa2的水平与高剂量LPS相当。酪蛋白给药后血浆中未检测到Saa3。尽管大多数Saa3在HDL中发现,但少量与脂蛋白无关。肝脏和脂肪组织的基因表达和蛋白质组学分析表明,注射LPS后血浆中Saa3的主要来源是脂肪组织而不是肝脏。我们得出的结论是,Saa3仅在部分但不是全部炎症刺激引起急性炎症后才出现在血浆中。这些发现与在肥胖等中度慢性炎症状态下血浆中无法检测到Saa3的观察结果一致。
介绍
血清淀粉样蛋白A(Saa)家族蛋白由4种主要形式组成,即急性期蛋白Saa1,Saa2和Saa3,以及组成型表达的Saa4。SAA1和SAA2,急性炎症刺激在等离子体显着和迅速增加1,而且在慢性炎性疾病如肥胖更温和和长期增加2,3,4,5。SAA1和SAA2主要是由肝脏产生的,而SAA3通常视为萨阿的肝外形式分泌的细胞如巨噬细胞和脂肪细胞1在物种如小鼠,虽然它也可以在低的水平由肝细胞制成6,7。但是,SAA3在人类和某些灵长类动物中是假基因,因为它会产生移码突变,产生下游的终止信号,因此在人类1中未发现SAA3 mRNA或SAA3蛋白。与小鼠不同,由肝外细胞(如发炎的巨噬细胞和脂肪细胞)产生的SAA的同种型为SAA1和SAA2,与在炎症条件下肝脏产生的同种型1。有证据表明,肝外SAA发挥功能,其可以是从肝SAA不同8,9。例如,Saa1,Saa2和Saa3在促进Th17介导的炎症性疾病中具有独特的全身和局部功能9。因此,我们已经利用小鼠肝脏(Saa1和Saa2)和肝外组织(Saa3)产生的Saa的不同同种型来专门研究肝外Saa的作用。小鼠和人类之间的同种型差异为我们提供了专门研究肝外Saa的独特而偶然的能力。
蛋白质的SAA家族是被输送于等离子体主要限于高密度脂蛋白(HDL)载脂蛋白10,11。然而,在某些小鼠模型12,13和某些肥胖人中14,一些SAA也可以以较低的密度脂蛋白运输。由于Saa3与Saa1和Saa2仅具有约65%的同源性,因此可以很容易地将其与Saa1和Saa2区分开。因此,研究Saa3在发炎小鼠中的表达和分泌可以为肝外来源Saa的调控和功能提供重要见解。使用高度特异性和灵敏的质谱技术,我们先前表明,Saa3对肥胖小鼠的循环Saa水平没有贡献5。但是,Tannock等。最近证实,高剂量脂多糖(LPS) 6注射的小鼠HDL中存在少量Saa3。为了检查炎症刺激的性质和程度是否确定血浆中是否可检测到Saa3,我们在小鼠中采用了几种急性炎症模式,这些模式先前显示可升高Saa的循环水平。
使用LC-MS / MS(一种高度特异性和灵敏的检测方法),我们发现高剂量LPS导致血浆中Saa3含量降低,而LPS剂量较低以及硝酸银引起的无菌炎症导致非常低的水平Saa3的水平较高,而导致Saa1和Saa2的水平较高。在测试了其他炎症刺激后,血浆中无法检测到Saa3。尽管血浆中发现的大多数Saa3都存在于HDL中,但在高剂量LPS后,在FPLC馏分中检测到少量的Saa3,其分子大小小于HDL。根据脂肪组织和肝脏中的基因表达和蛋白质组学分析,高剂量LPS后血浆Saa3的来源似乎主要来自脂肪组织。
材料和方法
鼠标研究设计
在2至4个月大的C57Bl / 6背景中的雄性C57Bl / 6小鼠或Saa3 -/-小鼠(在7中进行了描述)被注射LPS(腹膜内,0.25、2.5或25 µg,大肠杆菌E111-1B4) ,清单生物实验室),硝酸银(AgNO 3,皮下,0.5 mL 1%溶液,Sigma)或酪蛋白(皮下,0.5 mL 5%溶液)(n = 3只小鼠/组)。通过将Saa3无效的胚胎干细胞注入白化病C57BL / 6胚胎中来产生Saa3 KO小鼠,如先前所述7。将无注射的小鼠用作对照,以消除对照注射可能引起的任何炎症。注射剂量是根据先前的研究选择的15。所选择的时间被基于前一报告,显示SAA1,SAA2和SAA3表达水平16-29ħ以下LPS或酪蛋白注射之间最大15,16。对于所有队列的小鼠,均收集血液,并收集PBS灌注的附睾白色脂肪组织(EWAT)和肝脏,并在液氮中速冻。所有实验程序均已得到华盛顿大学动物保护与使用委员会的批准,并遵循了NIH关于实验动物的护理和使用的指南(NIH出版物编号8023,1978年修订)。
血浆分析
将100 µL血浆样品在磷酸盐缓冲液中的Superose 6 10 / 300GL尺寸排阻色谱柱(GE Healthcare Life Sciences)上进行快速蛋白质液相色谱(FPLC),流速为0.4 mL / min,并进行分馏以0.5 mL的增量收集。如前所述,使用比色法从收集的馏分中定量测定胆固醇12。通过ELISA(R&D Systems)7定量血浆中的总Saa1 / 2 。
基因表达分析
用市售的RNA提取试剂盒(Qiagen RNeasy Mini Kit)提取EWAT和肝样品,以获得总RNA。光谱定量RNA,逆转录2 µg RNA。通过实时定量PCR,通过ABI 7900HT仪器上的标准方案对所得cDNA进行定量。用于测量基因的引物和探针组购自Thermo Fisher Scientific(TaqMan系统)。我们使用Gapdh作为参考基因。各种处理均不影响Gapdh的水平。而且,它们在肝脏和脂肪组织之间相似。使用ΔΔCt公式计算出相对于被测基因的量。为了进行分析,它们表示为对照EWAT的倍数变化。表 1 使用的Taqman引物的摘要登录号。
质谱
血浆消化
血浆样品的消化方法如下:将3 µL血浆在100 mM NH 4 HCO 3中稀释20倍。将稀释的血浆(10 µL)用在100 mM NH 4 HCO 3中的 0.625%脱氧胆酸钠(SDC)进一步稀释至50 µL,并加入0.05 µg 15 N-APOA1和稳定同位素标记的肽(SIL)的混合物以下蛋白质– Apoa1,Saa1,Saa2,Saa3和Apoc3(表2中列出了肽段 )。样品用二硫苏糖醇(DTT)还原(在60°C下30分钟),并用碘乙酰胺(IAA)烷基化(在室温下黑暗中45分钟)。为了除去未反应的IAA,加入更多的DTT,然后用3 µg胰蛋白酶(新泽西州莱克伍德的沃辛顿生物化学公司)(相对于血浆蛋白约1:10 w / w)消化样品。用5 µL 20%三氟乙酸沉淀并离心后,除去SDC。60 µL转移至PCR板中,并在-20°C下冷冻直至分析。
FPLC馏分消化
按照与血浆相同的方案消化相同体积的FPLC馏分(对应于使用Bradford分析测定的最大10μg蛋白质),包括掺入15 N-APOA1和SIL肽。
LC-MS / MS分析
使用数据独立分析(DIA)通过质谱法对所选蛋白质的丰度进行定量。在C18捕集柱(Reprosil-Pur 120 C18-AQ,5 µm,0.1×40 mm,德国Maisch HPLC GmbH,德国)上脱盐后(流速4μL/ min),消化的肽在分析柱上分离(Reprosil-Pur 120 C18-AQ,5 µm,250×0.075 mm,Maisch HPLC GmbH博士)。使用以下多步线性梯度:2分钟内1–5%B,50分钟内5–25%,10分钟内25–35%。在梯度柱的末端,以80%B的斜率洗涤并重新平衡(A-水中的0.1%甲酸,B-乙腈,0.1%的甲酸,流速为0.4 µL / min)。使用由nanoAquity UPLC(Waters,MA)和Thermo Fusion Lumos(Thermo Fisher,San Jose,CA)三混合质谱仪进行电喷雾电离的LC-MSMS进行分析。
与数据无关的分析参数如下:MS1扫描(395–1005 Da,分辨率120,000,最大进样时间50 ms),然后在400–1000 Da范围内进行60次MS / MS扫描,每个扫描都有10 Da的质量选择窗口(分辨率15,000,最大注入时间为22 ms,循环时间为3 sec)在归一化碰撞能量为30%时,HCD活化引起了碎片。使用Skyline 17提取MS2扫描的碎片离子色谱图(表2中列出的衍生自目标蛋白质的肽段的前5个碎片离子 )完成了进一步的数据处理)的窗口精度为10 ppm。对色谱图进行积分,并输出色谱峰面积以进行进一步分析。Apoa1,Saa1,Saa2和Saa3的相对定量是通过内源肽峰面积与相应SIL肽峰面积的比率实现的(将Saa1和Saa2序列特异的肽用于区分这两种高度同源的同工型)。在将代表性肽标准化为15后定量其他蛋白的丰度N-APOA1肽VQPYLDDFQK。为了定量每种蛋白质,对每种蛋白质特异的3个肽的应答进行平均。因此,肽和蛋白质的丰度以任意单位表示。血浆分析的共同标准是血浆的体积。对于FPLC馏分,分母是每个馏分的等体积。
肝脏和脂肪组织的蛋白质组学分析
将组织用8 M尿素,100mMTris,pH8.0、0.05%SDS缓冲液匀浆,并通过BCA分析(Thermo Fisher Scientific)测量其蛋白质浓度。在SDS-PAGE(Nupage,Thermo Fisher Scientific)上分离组织提取物(40μg),并通过在单独的凝胶上平行运行的Western blot(Saa1抗体AF2948,R&D System)确定Saa蛋白的精确定位。然后切下覆盖Saa和相邻区域的凝胶部分,并通过凝胶内消化处理以进行蛋白质组学分析。将提取物干燥并重建,用于LC-MS / MS分析。为了提高检测Saa蛋白的灵敏度,使用平行反应监测方法,对Saa1,Saa2和Saa3使用相同的肽,如血浆分析所示,在前面所述的同一仪器上进行LC-MS / MS分析。
统计分析
除非另有说明,否则使用GraphPad Prism 6软件分析数据,并以均值±标准误差表示。对于血浆ELISA和蛋白质组学数据,单向ANOVA用于比较LPS注射液与对照组,未配对的t检验用于其他急性炎症模型。双向ANOVA用于比较接受不同注射的小鼠组织之间的基因表达和蛋白质组学数据,并通过Sidak事后测试进行多次比较。p值<0.05被认为具有统计学意义。
结果
检测低血浆水平的Saa3取决于炎症刺激的性质和程度
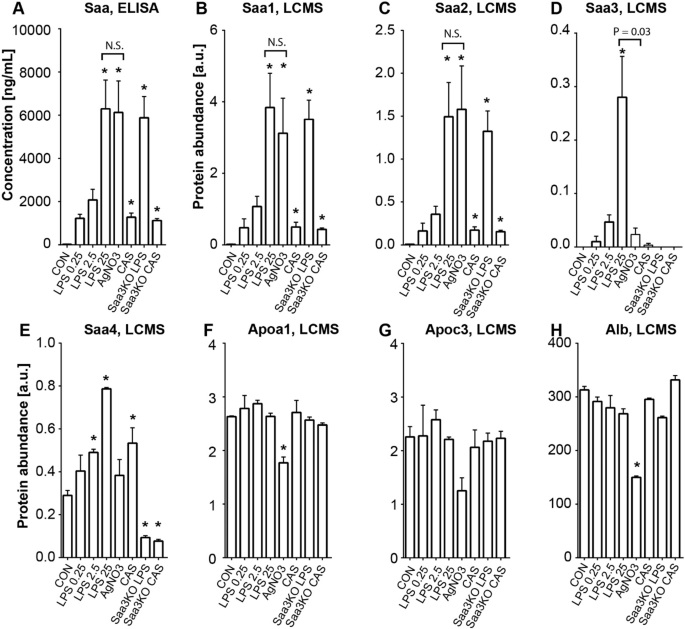
通过LC-MS / MS在来自因LPS,硝酸银或酪蛋白浓度增加而发炎的小鼠的血浆中测量Saa同种型的水平(表 3)。通过ELISA,使用主要检测Saa1和Saa2的抗体,所有炎症形式都会导致血浆Saa水平升高(图 1A)。通过LC-MS / MS对Saa1,Saa2和Saa3进行的特异性测量显示,相对于未接受炎症刺激的对照小鼠,LPS注射后Saa1(图1B)和Saa2(图 1C)水平呈剂量依赖性升高 。硝酸银诱导的炎症导致血浆Saa1和Saa2的水平与高剂量LPS相当(图 1B,C)。LPS引起Saa3血浆水平的剂量依赖性增加,该水平比Saa1或Saa2的水平低约10倍(仅在25μgLPS后才显着升高)(表 3)。注射硝酸银后,血浆中的Saa3水平甚至更低(<LPS 25 µg后观察到的水平的10%),尽管Saa1和Saa2血浆水平与LPS 25 µg观察到的水平相当(图 1)。注射25μgLPS后,在缺乏Saa3的小鼠和对照组中,通过ELISA测定的血浆Saa(图 1A)和通过LC-MS / MS测定的Saa1和Saa2(图 1B,C)增加到相似的水平。确认检测特异性,在缺乏Saa3的小鼠中未通过LC-MS / MS检测到Saa3(图 1D))。综上所述,这些数据表明,Saa3在很大程度上没有对总血浆Saa做出贡献,并且Saa3被不同的炎症刺激高度选择性地诱导。还对血浆中其他几种载脂蛋白(Apoa1,Apoc3)和白蛋白的水平进行了评估,但在各种研究的炎症小鼠模型中,其与对照水平没有显着差异(图 1F,G),除了注射硝酸银后的适度降低。Apoa2和Apoe的血浆水平与Apoa1相似。尽管人们认为Saa4是Saa4的组成形式,但它确实会因注射LPS和酪蛋白而略有增加(图 1E),这可以反映为HDL-低密度脂蛋白相互作用的变化,如前所述18。
注射高剂量LPS引起的血浆中Saa3的分布与Saa1,Saa2和Saa4的分布不同
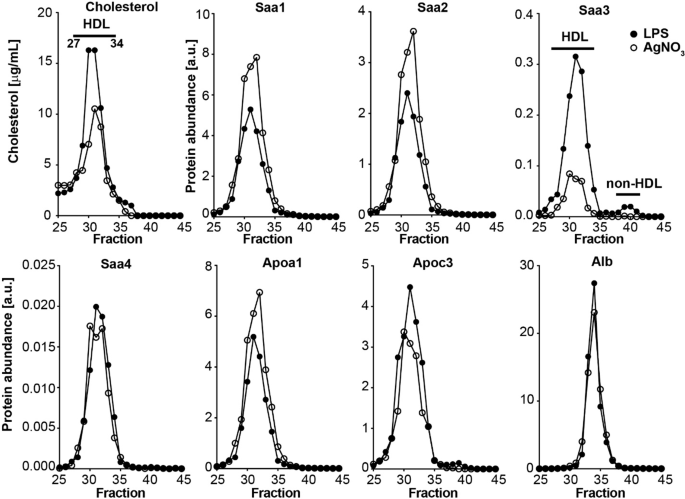
蛋白质的SAA的家族被运送在等离子体主要与HDL相关联,并且通常不被认为是存在于非脂蛋白结合形式10,11,13。为了确定注射25 µg LPS后血浆中检测到的Saa3是否具有与其他形式的Saa相似的血浆分布,通过LC-MS / MS在FPLC分级血浆中评估了Saa所有同种型的分布。虽然SAA1,SAA2和SAA4在对应于HDL的级分仅仅存在(图 2),如先前已描述的10,11,SAA3少量也被在对应于较小的非HDL的级分(图的级分进行检测。 2),如Tannock 等人所报道。LPS注射后6。施用硝酸银后,在非HDL馏分中无法检测到Saa3,这可能是由于血浆中Saa3的含量已经很低而导致LC-MS / MS方法的检测限(图 2)。
血浆中存在的Saa3可能源自脂肪组织
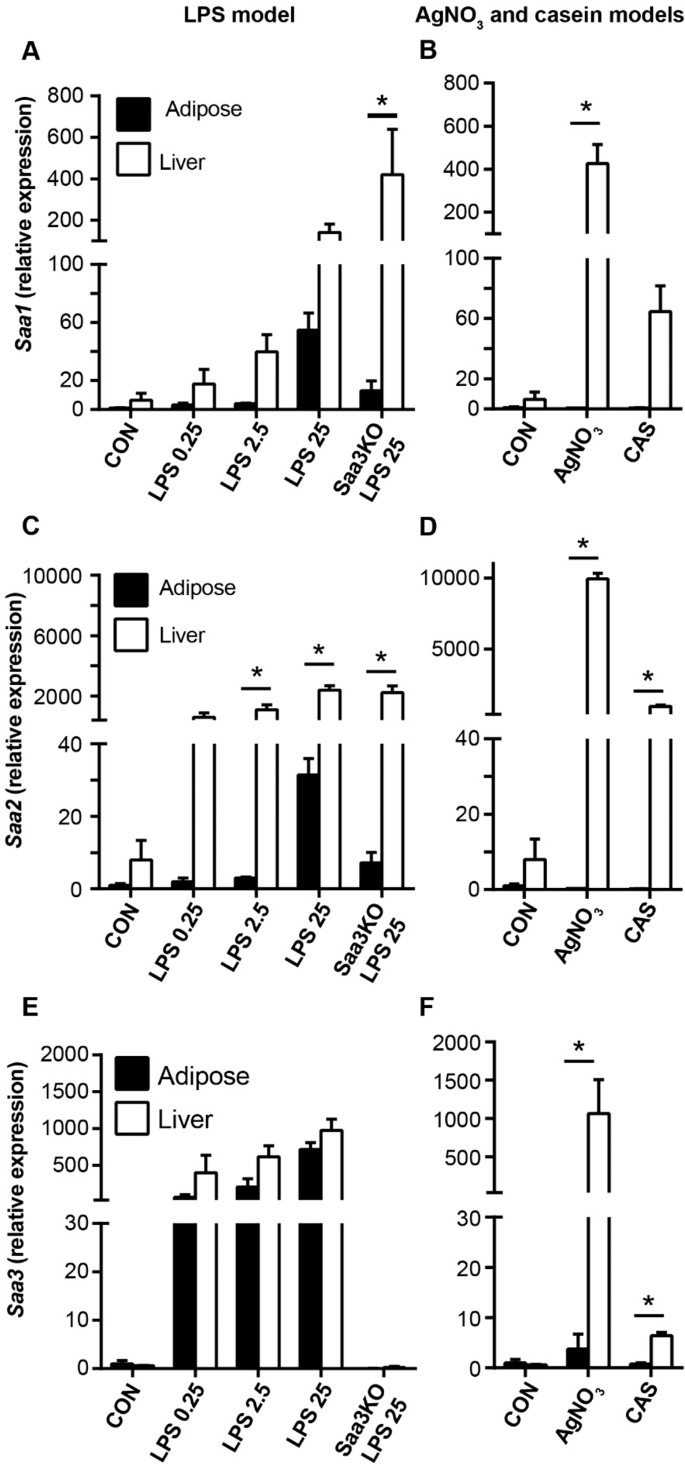
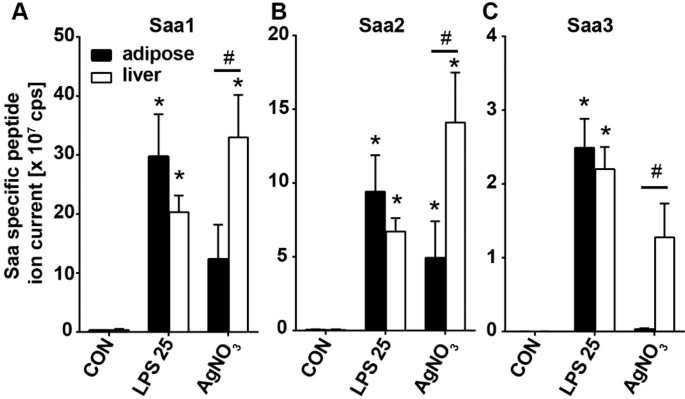
肝和脂肪组织中各种诱导型Saa(Saa1,Saa2和Saa3)的基因表达分析显示出惊人的差异,这为循环Saa3的来源提供了潜在的线索。在所有急性炎症模型中,主要在肝脏中观察到Saa1(图 3A,B)和Saa2(图 3C,D)的高表达水平,而在脂肪组织中,这两种Saa亚型的低表达主要在小鼠中观察到注入25 µg LPS(图 3A,C)。注射25μgLPS和硝酸银的小鼠肝脏中Saa3的表达相似(图 3E,F)。相反,在0.25、2.5和25μgLPS后,Saa3的脂肪组织表达明显更高,并且比硝酸银后更高。而在注射LPS和硝酸银的动物中,Saa3的肝脏表达相当(图 3E,F)。酪蛋白诱导的炎症模型中Saa3的表达(图 3F)远低于肝脏中的Saa1和Saa2,并且在脂肪组织中基本不可检测。表4中显示了每种基因,组织和处理的表达倍数变化 。虽然Saa3在用25 µg LPS和硝酸银处理过的小鼠中,肝脏中的Sac3的表达水平相似,从注射了硝酸银的小鼠血浆中检测到的Saa3少得多。为了调查这是否可能是Saa3蛋白质产量改变的结果,我们通过LC-MS / MS测量了EWAT和这些小鼠的肝提取物中Saa3蛋白质的量。两种处理后,在脂肪组织和肝脏中检测到相似量的Saa1和Saa2(图 4A,B)。但是,尽管在注射25 µg LPS后在脂肪组织和肝脏提取物中可检测到相似量的Saa3蛋白,但在硝酸银注射后,在脂肪组织中几乎检测不到Saa3蛋白(图 4C))。总的来说,这些基因表达和组织蛋白质组学数据强烈表明,LPS模型中循环Saa3的主要来源是脂肪组织,肝脏贡献较小。
讨论区
我们以前已经证明了从注射硝酸银的小鼠和从患有中度炎症的肥胖小鼠以及患有系统性红斑狼疮的人类中分离出来的HDL中存在HDA中的SAA 19。SAA的存在导致HDL钝性炎症刺激19的能力丧失。但是,该文件未定义特定SAA同种型的性质。
使用高度敏感和特异质谱法,我们之前也已经表明,SAA3不能从肥胖小鼠血浆是有他们的血浆SAA水平的慢性,但中度升高被检测5。无法通过质谱法来检测SAA3在血浆中的小鼠中的表达随后报告SAA3在两个脂肪组织和结肠上皮细胞中适度增加20。相反,Tannock 等人。报道了大剂量LPS 6引起的急性炎症后血浆中Saa3的检测。在当前的研究中,我们报告说,只有在某些急性炎症形式后,血浆中才会出现低水平的Saa3,包括高剂量LPS注射以及无菌炎症后的局限性(高剂量LPS的约10%)。由硝酸银注射引起。酪蛋白注射后我们无法在血浆中检测到Saa3。我们的发现与Meek和Benditt 21的较早研究一致,后者使用了针对Saa3的特异性抗体,以及Tannock 等的最新发现,后者使用等电聚焦检测Saa3 6,这两个发现都发现Saa3存在注射大剂量的LPS后血浆中的胆固醇。
在我们的研究中,我们选择使用C57Bl / 6小鼠喂食,以减少肥胖小鼠发生的慢性炎症和血浆Saa水平的适度升高以及脂肪组织中巨噬细胞的积累13。此外,在瘦饲料喂养的小鼠中,Saa在HDL 13中完全在血浆中运输,就像在健康人受试者10中那样,但在肥胖小鼠模型13和某些肥胖人14中却没有,其中SAA可以低密度脂蛋白运输。通过使用瘦小鼠,我们避免了非HDL相关亚型的可能混杂因素。我们还专门使用了避免超速离心的方法,因为超速离心可以使脂蛋白表面的一些松散结合的载脂蛋白解离22。因为我们先前已经证明Saa3对体重和炎症表现出性二态性作用 7,并且由于雄性小鼠比雌性更易发炎,因此我们选择仅将雄性小鼠用于这些研究。但是,我们不能排除雌性小鼠的结果相同。
我们的发现表明,血浆中Saa3的出现取决于急性炎症刺激的方式和程度。LPS注射,尤其是高剂量注射,导致通过本研究中使用的高灵敏度和特异性LC-MS / MS方法在血浆中检测到少量Saa3。较低剂量的LPS导致Saa3的水平低得多,注射硝酸银导致的无菌炎症也是如此,而酪蛋白诱导的急性炎症未能导致可检测到的Saa3(图 1)。因此,我们无法在肥胖小鼠的血浆中检测到Saa3并不奇怪5,也没有在小鼠肠道组织中有轻度炎症的小鼠,肠道菌群20引起的结肠上皮细胞和巨噬细胞中检出。与Tannock 等人的报告一致。使用高剂量LPS诱导急性炎症的研究,我们还观察到大部分Saa3存在于HDL 6上,与其他Saa亚型一样。密度梯度超速离心后,Tannock 等。能够从HDL中解离出相对大量的Saa3,从而得出结论,即Saa1或Saa2 6与HDL的关联更松散。尽管我们在研究中未使用超速离心,但用于分离血浆的低速离心可能足以取代HDL中的某些Saa3,从而导致我们在FPLC中的发现。最近有小部分SAA在炎症状态下循环结合视黄醇而不是HDL循环23。由于我们没有测量视黄醇,因此我们无法推测观察到的非HDL Saa3是否可能与视黄醇结合。然而,与视黄醇结合蛋白4相比,与HDL相关的Saa3的分子量更大,而游离Saa3的分子量更小。
众所周知,脂肪组织是Saa3表达的来源,主要在脂肪细胞中。它的表达在糖尿病小鼠的脂肪组织中24以及通过食用致肥胖的饮食13上调。通过将培养的脂肪细胞暴露于高葡萄糖浓度25和饱和脂肪酸26也可以提高Saa3的表达。在当前的研究中,在所有测试的炎症刺激中,只有在小鼠注射LPS后才能检测到脂肪组织中Saa3表达的高水平,其中在肝脏和脂肪组织中以剂量依赖的方式明显诱导了Saa3表达。Saa3注射25 µg LPS和硝酸银后,肝脏中的mRNA表达水平相似。相反,注射硝酸银后在脂肪组织中检测到的Saa3表达水平要比使用三剂LPS后更低(图 3E,F)。因为我们只能在高剂量LPS注射后检测血浆中的Saa3,而在硝酸银注射后仅在肝脏中观察到高水平的Saa3表达的硝酸银后才能检测到,因此很容易推测血浆Saa3大部分来自脂肪组织。目前尚不清楚为什么Saa3在用25 µg LPS和硝酸银处理的小鼠中,其在肝脏中的表达水平相当,但在注射硝酸银后血浆中却没有以相似的水平出现。我们的发现发现,在注射硝酸银的小鼠的脂肪组织中几乎没有检测到Saa3蛋白,这表明肝脏Saa3 mRNA的稳定性可能较低[ 27],表明Saa3在这些小鼠中翻译不佳,分泌受损或迅速降解。可替代地,可能的是,从局部炎症导致的炎症介质诱导硝酸银28,29与脂多糖在脂肪组织中的直接作用相反,它不能全身性地到达脂肪组织。总的来说,这些数据表明脂肪组织是LPS注射后血浆中Saa3的主要来源。
最近,已经提出巨噬细胞在脂肪细胞衍生的Saa3表达中的重要作用。Sanada 等。结果表明,用LPS刺激的巨噬细胞条件培养液可以C / EBP依赖性的方式诱导脂肪细胞中Saa3表达30。这表明通过LPS将巨噬细胞募集到脂肪组织中可以通过与肝细胞不同的机制促进脂肪细胞中Saa3的表达和分泌。代替脂肪细胞或除了脂肪细胞之外,补充的脂肪组织巨噬细胞也可能是脂肪来源的Saa3的来源。未来的实验可能会挑逗脂肪细胞和巨噬细胞对脂肪组织衍生的Saa3的响应,以应对高剂量LPS。
SAA3是假基因,不会在人类中转录,在肝外组织以及肝脏1中,它们会响应炎症刺激而产生SAA1和SAA2 。例如,SAA1和SAA2通过组织巨噬细胞在几个炎性病症表示31,32,33。脂肪组织来源的SAA是否有助于人体内SAA循环的问题受到以下事实的困扰:人脂肪细胞和巨噬细胞产生的SAA同种型,即SAA1和SAA2与肝脏产生的同型1。肥胖的人类受试者在脂肪组织3中的SAA1和SAA2表达水平较高,34,35,其与血浆SAA水平相关 34。两个组织的mRNA表达水平和血浆SAA水平具有减肥下降 34,35,这表明脂肪组织可能是等离子体SAA的在人类肥胖的来源。但是,肥胖者在脂肪组织中产生的细胞因子可能已经激活了肝中SAA的产生,而SAA可能是循环中SAA的来源。在脂肪组织中特异性表达人SAA的转基因小鼠模型的开发表明,这些SAE在这些转基因小鼠的血浆中存在。但是,观察结果阻碍了解释,因为观察到脂肪组织中的转录水平并未因所用饮食而增加 36。我们的发现表明,在小鼠的脂肪组织中产生的肝外Saa可以在某些但不是全部的急性炎症刺激后进入血浆。这不同于与肥胖相关的慢性炎症状态,在肥胖中,我们以前无法在血浆5中检测到Saa3 。
在我们的研究中,尽管肝脏中响应刺激的Saa2表达高于Saa1,但血浆,肝脏和脂肪组织中Saa1和Saa2的蛋白质水平大致相当。肝的基因表达SAA1和SAA2响应于各种炎性刺激已被广泛地报道8,15。虽然大多数研究发现,大约相等于表达水平SAA1和SAA2,向更高的趋势SAA2各种炎症小鼠模型中的表达水平也获得了我们以前报道及其他7,37。由于我们已经确认用于区分Saa1和Saa2的引物没有序列重叠(ThermoFisher Scientific),因此我们的结果表明基因和蛋白质表达水平不匹配。对于基因表达水平超过翻译的蛋白质水平是用于各种炎性细胞因子,例如肿瘤坏死因子α(TNFα)相对常见的38,39,其被转录类似地调节到萨阿。因此,我们的基因表达结果与先前报道的相符并在此基础上扩展。
LPS介导的炎症被广泛认为是唤起直接全身效应,而通过硝酸银引起的全身性炎症被认为是继发于它的本地炎症效应28,29。因此,LPS和硝酸银有可能在不同组织内引起不同的信号传导机制。LPS诱导涉及转录因子NFkB,激活蛋白1(AP-1)和激活转录因子2(ATF2)40的炎症作用,并且可以调节肝脏和脂肪组织中的不同炎症作用。相反,在小鼠和兔子中有证据表明,硝酸银比肝脏,脾脏,肾脏,骨骼肌,脑,肺和心脏等其他组织更能特异性地靶向肝脏41,42岁。重要的是,硝酸银介导的肝Saa诱导伴随着转录因子的精确协调,包括SAA激活因子(SAF),核因子κB(NFkB)和CCAAT /增强子结合蛋白(C / EBP),具有不同的转录因子组合和动力学表现在其他组织中42。据我们所知,尚未报道脂肪组织中硝酸银诱导的Saa的转录调控。确实,以前的工作支持以下观点:特定的炎症刺激(例如酪蛋白和LPS)可以在不同的组织类型中产生多种炎症作用,从而导致不同的Saa同型表达模式8。还需要进一步的研究以确定脂肪和肝组织对硝酸银和LPS的反应是否不同。
总之,急性炎症刺激后血浆中不同Saa亚型的出现在很大程度上取决于刺激的性质和程度,并且主要是肝外形式的Saa3 Saa3仅在高剂量LPS后在血浆中出现很大程度,并且出现主要来自脂肪组织
|
|