SH3RF3通过JNK激活和PTX3上调促进乳腺癌干样特性
摘要
癌干样细胞(CSC)是致瘤细胞亚群,有助于癌症的复发和转移。但是,对CSC监管机制的理解仍然不完整。通过转录组学分析,我们确定了支架蛋白SH3RF3(也称为POSH2),该蛋白在乳腺癌临床肿瘤和癌细胞系的CSC中上调,并增强了乳腺癌细胞的CSC特性。在机械上,SH3RF3以依赖JNK的蛋白质(JIP)的方式与c-Jun N末端激酶(JNK)相互作用,从而导致JNK的磷酸化增强和JNK-JUN途径的激活。此外,JNK-JUN信号传导通过转录激活Pentraxin 3(PTX3)的表达来扩展CSC亚群。SH3RF3在CSC中的功能作用已通过患者来源的类器官培养进行了验证,并得到了临床队列分析的支持。总之,我们的工作阐明了SH3RF3在乳腺癌CSC中的作用和分子机制,并可能为CSC靶向治疗提供机会。
介绍
癌症是人类健康的主要威胁。由于高度的肿瘤异质性,大多数癌细胞疗法的功效通常会由于癌细胞亚群的存在而受到阻碍,这些亚群具有增强的治疗抗性,从而导致肿瘤复发并最终导致治疗失败。所述CSC理论提供肿瘤的异质性的一个解释1,2和指出的CSC,也称为肿瘤起始细胞,是在配备有无限的自我更新和分化的肿瘤启动能力的肿瘤细胞亚群3,4。更重要的是,CSC对化学疗法和放射疗法的抵抗力增强,通常被认为是治疗反应差,复发和转移的原因。CSC理论已经在乳腺癌中得到了很好的检验。在本世纪初发现,乳腺癌干细胞样细胞(BCSCs)最初的特征是CD44的高表达和CD24 5的低表达或负表达。后来,BCSCs的另一种类型也与高醛脱氢酶(ALDH)活性发现6。虽然一些研究已经确定了调节乳腺癌干性细胞内的微环境和线索7,8,我们对乳腺癌中CSC的了解仍然不完整。阐明BCSC的分子基础,尤其是具有临床相关性的不同BCSC类型的常见调节剂,对于合理设计癌症治疗中的CSC靶向策略至关重要。
SH3RF3(SH3域包含无名指3),也称为POSH2(大量SH3域蛋白2),是最近鉴定的具有四个Src同源3(SH3)域和无名指结构域9的蛋白质。SH3RF3发现功能作为支架与PAK2相互作用并RAC1通过其SH3结构域9,10。此外,无名指结构域还可能赋予蛋白质10自遍在蛋白化的酶活性。临床分析表明,SH3RF3的表达与急性淋巴细胞白血病11,HIV相关的神经认知障碍12和迟发的家族性阿尔茨海默氏病13有关。但是,SH3RF3在病理过程中,特别是在癌症中的功能作用和机制尚不清楚。在这项研究中,我们发现SH3RF3可以上调Pentraxin 3(PTX3)的表达,从而促进乳腺癌细胞的干样特性。PTX3是一种属于五味素家族的分泌蛋白。作为模式识别受体,PTX3在先天免疫14,组织修复和重塑15中起关键作用。PTX3失调也广泛癌症观察到16,17,18,19,20。许多研究已经证实PTX3的潜力,特别是其血清水平,为一些病理状态,包括癌症生物标志物16,17,20,21。然而,PTX3在各种癌症中的作用似乎存在争议,有报道显示PTX3在肿瘤干,生长和转移中具有抑癌和促进作用22。因此,明确定义其在特定癌症类型中的功能对于PTX3在诊断和治疗中的临床应用具有实际意义。
在这项研究中,我们表明支架蛋白SH3RF3在乳腺癌CSC中高表达,并揭示了其通过调节PTX3增强癌细胞干性的功能。
结果
SH3RF3与乳腺癌的CSC特性有关
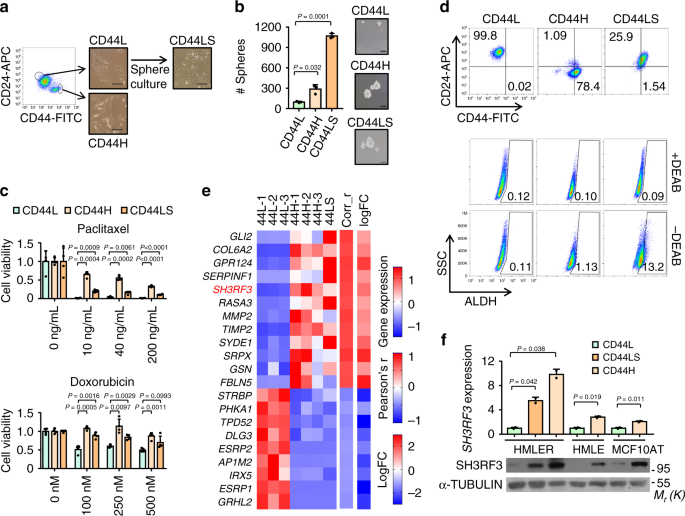
为了鉴定在BCSCs调节分子,我们整理HMLER,人乳腺癌细胞系常常在CSC研究中使用的23,为CD44 + CD24 - (称为CD44H随后)亚群和CD44 -CD24 +(称为CD44L随后)亚群通过流式细胞仪(图 1a)。CD44L细胞在连续的肿瘤球传代中进一步培养,产生了一个新的亚群,称为CD44LS。CD44H和CD44LS子线都显示出增强的肿瘤球形成(图 1b)和对包括紫杉醇和阿霉素在内的化疗药物的耐药性(图 1c)),证实了这两个子行中的CSC富集。有趣的是,CD44H和CD44LS表现出不同的CSC标记表达模式。尽管CD44H主要是CD44 + CD24- ,并且几乎没有ALDH +细胞,但CD44LS细胞显示出高得多的ALDH表达(图 1d)。值得注意的是,虽然球体培养导致CD44表达的逐渐增加(补充图CD44L细胞 1A),所述CD44 + CD24 -CD44LS的含量保持高于CD44H细胞的低得多(图 1D)。这些观察结果符合先前的观点,即CD44 + CD24 -和ALDH +标记不同的BCSC亚群24。然后,我们通过RNA测序分析了CD44L,CD44H和CD44LS的转录组谱,与CD44L相比,鉴定了CD44H和CD44LS中的588个上调基因和706个下调基因(补充数据文件 1)。
一个流程图和HMLER亚系推导的代表性图像。比例尺,100μm。b HMLER子系中肿瘤球的定量(n = 3个培养实验)和代表性图像。比例尺,100μm。c在不同浓度的紫杉醇(0–200 ng / mL)和阿霉素(0–500 nM)处理后,HMLER亚系的MTT分析(n = 4个治疗实验)。d CD44的流式细胞术分析+ CD24 -和ALDH +在HMLER亚系的CSCs。细胞计数图中的数字表示相应亚群的百分比。Ë与临床肿瘤和HMLER亚系中CSC特性相关的基因。热图显示,HMLER亚系的表达,皮尔森- [R相关性CSC签名在TCGA肿瘤(Corr_r)和肿瘤球与原发肿瘤(logFC)表达的对数的倍数变化。f SH3RF3在源自HMLER,HMLE和MCF10AT的不同亚系中的表达(n = 3细胞培养)。数据代表平均值±SD。统计显着性由两尾不成对t检验(b,c和f)确定。(b)和(f)重复3次,结果相似,并显示了一项代表性实验的数据。源数据作为源数据文件提供。
为了确保这些CSC相关基因的临床相关性,我们进一步分析了两个临床队列的转录组数据集。首先,我们通过单样本基因集富集分析(ssGSEA 25)分析了癌症基因组图谱(TCGA)乳腺癌队列,其中先前在人类乳腺癌中鉴定出了CD44 + CD24 - BCSC签名26,然后与表达高度相关的基因选择TCGA样本中的BCSC ssGSEA得分。此外,我们分析了患者来源肿瘤球与相应原发肿瘤(GSE7515 27),以鉴定在肿瘤球中差异表达的基因。这些临床分析导致76个基因(41上调和下调35),其被同时与相关联的CD44 + CD24 -签名并在临床肿瘤中肿瘤球形成能力(补充表 1)。
最后,我们检查了这76个基因与上述在HMLER子系中发现的CSC相关基因的重叠,发现共有21个基因(上调12个,下调9个)(图 1e)。许多在列表中的基因,包括的GLI2 28,COL6A2 29,GRP124 30,SERPINF1 23,31,MMP2 32,TIMP2 33,GRHL2 34,和ESRP1 35,先前已显示出调节正常或癌细胞的干性,或上皮-间质转化(EMT),与CSC特性高度相关的过程36。值得注意的是, SH3RF3以前并未参与CSC调控,但在富含CSC的肿瘤和癌细胞亚系中高度上调了这些基因(图 1e)。进一步的实时逆转录PCR(qRT-PCR)和Western印迹分析证实了 SH3RF3在 HMLER的CD44H和CD44LS亚系中表达升高(图 1f)。此外,当我们分离CD44 + CD24 -和CD44 - CD24 +的两个额外的人细胞系的亚群和HMLE MCF10AT,上调SH3RF3在CD44 + CD24 -还观察到亚群(图 1f),表明SH3RF3在BCSC调节中的作用。
SH3RF3促进乳腺癌细胞的CSC特性
为了研究SH3RF3在BCSCs的功能作用,SH3RF3在HMLE,MCF10AT和MDA-MB-231细胞(图中过表达 图2a)中,随后的在这些细胞系CSC内容流式细胞术分析。SH3RF3过度表达导致CD44 + CD24 -在HMLE和MCF10AT细胞扩张。MDA-MB-231中的ALDH +亚群也有所增加(图 2b)。此外,SH3RF3的过表达显着增强了所有三种细胞系中肿瘤球的形成(图 2c)。在Py8119中,一种源自PyMT驱动的肿瘤Sh3rf3的鼠类乳腺癌细胞系上调也在ALDH观察+亚群相对于ALDH -对应物(补充图 1B),和Sh3rf3过表达由Py8119(补充图增加肿瘤球形成的容量 1c和d)。此外,我们通过有限稀释测定法分析了SH3RF3-过表达癌细胞的体内致瘤能力。各种数量的MDA-MB-231控件或SH3RF3过表达的细胞原位移植到雌性免疫缺陷的NSG小鼠中。当注射1000个细胞时,所有小鼠都出现了肿瘤,两组之间没有观察到差异。然而,当接种较少的细胞时,在过表达组中观察到更强的肿瘤启动能力。虽然在第28天注射了40个对照细胞的小鼠中只有10%死于肿瘤,但在同一时间点上过表达组的致瘤率是60%,在SH3RF3过表达后CSC频率几乎增加了两倍(图 2d)。接种过表达细胞的小鼠的肿瘤体积也明显增加(图 2e)。对于其中SH3RF3的 HMLER细胞也观察到类似现象在有限稀释试验中,过表达导致体内肿瘤发生率增加(补充图 1e和f)。这些结果表明SH3RF3的过表达可以促进乳腺癌细胞的CSC特性。
一个 SH3RF3过表达HMLE,MCF10AT和MDA-MB-231细胞。b的CD44的流式细胞术分析+ CD24 -在HMLE和MCF10AT和ALDH亚群+在MDA-MB-231亚群。流式细胞仪图中的数字表示CSC百分比(n = 3个培养实验)。c 过量表达SH3RF3的乳腺癌细胞中肿瘤球形成的定量图像和代表性图像(n = 3个培养实验)。比例尺,100μm d在体内肿瘤形成的小鼠的MDA-MB-231细胞的连续稀释液注射在第28天ë 注射40只对照和SH3RF3过表达的MDA-MB-231细胞的小鼠的肿瘤图像和体积(n = 10只小鼠)。数据代表平均值±SD。统计显着性由两尾不成对t检验(b和c),卡方检验(d)或曼恩-惠特尼U检验(e)确定。(a),(b)(上)和(c)中的实验被独立地重复了三次,得到相似的结果,并且显示了一个代表性实验的数据。源数据作为源数据文件提供。
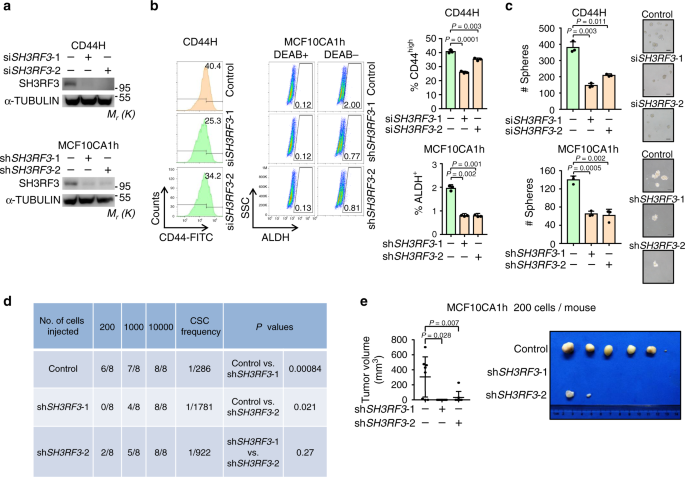
为了进一步测试SH3RF3对于乳腺癌CSC维持是否必不可少,SH3RF3被多个小干扰RNA(siRNA)或短发夹RNA(shRNA)敲低了HMELR-CD44H和MCF10CA1h细胞系(图 3a)。流式细胞仪分析显示,SH3RF3敲低后,HMELR-CD44H中CD44表达明显降低,而MCF10CA1h 中ALDH +分数明显降低(图 3b)。SH3RF3敲低还损害了HMELR-CD44H和MCF10CA1h形成肿瘤球的能力(图 3c)。更重要的是,有限稀释试验表明SH3RF3基因敲低减弱了原位移植后小鼠MCF10CA1h细胞的致瘤能力(图 3d,e)。总而言之,这些结果表明SH3RF3在乳腺癌细胞的CSC促进和维持中的作用。
HMLER-CD44H和MCF10CA1h细胞中的SH3RF3敲低。b流式细胞仪分析HMLER-CD44H中CD44 高亚群和MCF10CA1h中ALDH +亚群(n = 3个细胞培养实验)。c定量和SH3RF3抑制的乳腺癌细胞肿瘤球形成的代表性图像(n = 3个球培养实验)。比例尺,100μm。d在体内肿瘤形成的小鼠的MCF10CA1h的连续稀释液注射在第42天Ë肿瘤图像和体积(Ñ 200控制或注射在小鼠= 8只小鼠)SH3RF3敲低MCF10CA1h细胞。数据代表平均值±SD。统计显着性由两尾不成对t检验(b和c),卡方检验(d)或曼恩-惠特尼U检验(e)确定。(a),(b)(左)和(c)中的实验被独立地重复了三次,结果相似,并且显示了一个代表性实验的数据。源数据作为源数据文件提供。
PTX3受SH3RF3调节并增强BCSC特性
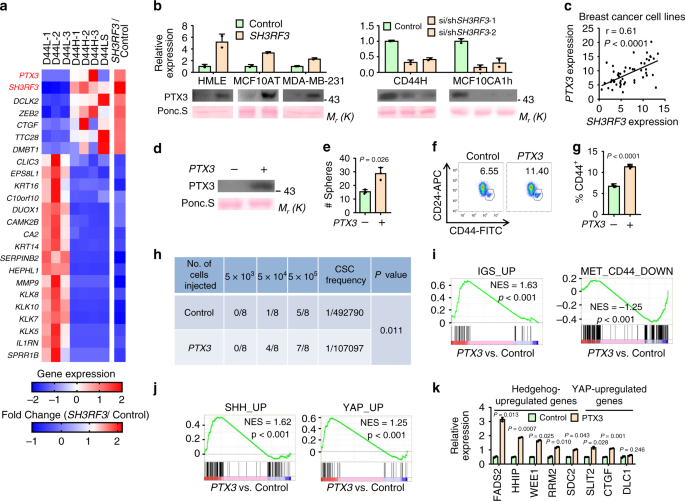
为了阐明SH3RF3在BCSC调控中的机制,我们通过RNA测序分析了MCF10AT细胞的转录组谱,以鉴定SH3RF3过表达后表达明显改变的基因。我们进一步将这些基因与在HMLER子系中差异表达的那些基因重叠。该分析产生了与SH3RF3表达和BCSC特性相关的24个基因的列表(图 4a)。在该列表中,编码戊糖毒素家族分泌蛋白的PTX3是排名最高的基因之一。SH3RF3过度表达和敲低后,RNA和蛋白质水平证实了SH3RF3对PTX3的调节(图 4b))。此外,对癌细胞系百科全书表达数据库37的分析显示,乳腺癌细胞系中SH3RF3和PTX3表达具有很强的正相关性(图 4c),进一步证实了PTX3是SH3RF3调控的下游基因。
a在HMLER子系中差异表达并受SH3RF3过表达调节的基因的表达热图。b 在SH3RF3过表达和敲低后,各种癌细胞系的条件培养基中PTX3 mRNA表达及其细胞外蛋白水平(n = 3细胞培养)。c乳腺癌细胞系(n = 51个细胞系)中SH3RF3和PTX3 mRNA水平的相关性。d PTX3过表达和控制HMLE细胞的条件培养基中的细胞外PTX3水平。e HMLE后肿瘤球形成PTX3过表达(n = 3个培养实验)。f,g PTX3过表达和对照HMLE细胞中CD44 + CD24 - CSC亚群的流式细胞仪分析(f)和定量(g)。比例尺,100μm; n = 3个细胞培养实验。ħ在小鼠中的肿瘤发生率与HMLER细胞的各种数目的注射在90天我 GSEA在CSC和MASC相关基因组分析PTX3 -overexpressing相对于对照细胞。j GSEA分析PTX3中的刺猬和河马调节基因集-过表达相对于对照细胞。PTX3过表达后,hedgehog和Hippo调控基因的k mRNA水平(n = 3个细胞培养实验)。数据代表平均值±SD。统计显着性通过配对t检验(c)或两尾未配对t检验(e,g和k)确定。(b),(d),(e),(f)和(k)中的实验)重复3次,结果相似,并显示了一项代表性实验的数据。源数据作为源数据文件提供。
接下来,研究了PTX3在BCSC中的功能作用。PTX3在HMLE,HMLER和MCF10AT中的过度表达(图 4d和补充图 2a)导致这些细胞系明显促进肿瘤球形成(图 4e和补充图 2b)。PTX3过表达导致CD44的增加+ CD24 -的HMLE(图亚群 4F,G)和体内肿瘤发生由HMLER(图 4H)。此外,对照和PTX3的转录组-overexpressing HMLER细胞通过RNA测序成型,随后与多个先前确定的CSC的和乳腺干细胞(MASC)相关的基因套转录谱基因组富集分析(GSEA)26,38,39。GSEA分析表明,在CSCs或MaSCs中上调的基因组(IGS_UP,MET_CD44_UP,N_CD44_UP)在PTX3过表达细胞中显着富集,而在CSCs或MaSCs中下调的基因组(MET_CD44_DOWN,MaSC_DOWN)在控制细胞中富集。 (图 4i和补充图 2c),证实了PTX3在CSC调节中的作用。
有趣的是,GSEA分析还揭示了PTX3过表达后刺猬和Yes关联蛋白(YAP)信号通路的上调。与控制细胞相比,由Sonic Hedgehog(SHH_UP)40或其下游转录因子GLI1(GLI1_UP)41和YAP(YAP_UP)42上调的基因组显着富集了PTX3过表达的细胞(图 4j和补充图。 2d)。通过qRT-PCR也证实了PTX3过表达后Hedgehog和YAP下游基因的上调(图 4k)。以前许多研究表明,激活刺猬43YAP 44是Hippo通路的转录因子效应子,在癌症干性的调控中起着至关重要的作用。因此,我们的数据可能通过调节刺猬和Hippo-YAP途径来支持PTX3在BCSC中的功能性作用。
PTX3介导SH3RF3在BCSC调节中的作用
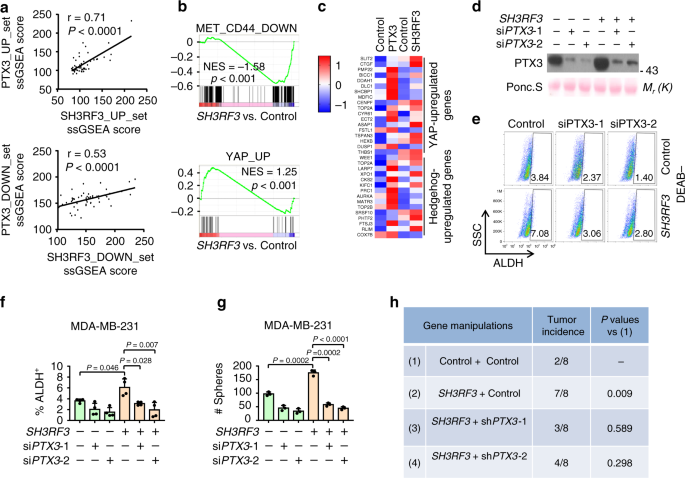
基于上述观察,SH3RF3增强了PTX3的表达,并且PTX3在BCSC调控中起作用,我们推测PTX3是SH3RF3介导其在BCSC 中的主要下游基因。为了验证该假设,我们首先分析了SH3RF3过表达和PTX3过表达引起的转录组变化是否相似。ssGSEA分析显示在乳腺癌细胞系中协调表达SH3RF3和PTX3过表达差异表达的基因(图 5a)。此外,这些基因集富含PTX3-overexpressing细胞后也丰富SH3RF3过表达(图 5B)。此外,受PTX3调控的Hedgehog和Hippo-YAP下游基因也受SH3RF3过表达的调控(图 5c)。这些数据表明SH3RF3和PTX3导致癌细胞的转录组效应一致,尤其是在与癌症干性相关的基因上。
a在乳腺癌细胞系(n = 51个细胞系)中PTX3和SH3RF3过表达后调节的基因集的ssGSEA得分的相关性。b在PTX3过表达与对照细胞中CD44或YAP相关基因集的GSEA分析。c PTX3和SH3RF3过表达后,刺猬和Hippo调控基因的表达热图。d具有SH3RF3过表达的MDA-MB-231中的PTX3敲低。e流式细胞仪分析SH3RF3在MDA-MB-231 中ALDH +亚群 过表达和PTX3敲低。f定量(n = 4 FACS实验)MDA-MB-231中具有SH3RF3过表达和PTX3敲低的ALDH + CSC亚群。g具有SH3RF3过表达和PTX3 抑制的 MDA-MB-231中的肿瘤球定量(n = 3个培养实验)。ħ在小鼠中的肿瘤initation在第28天用MDA-MB-231细胞的40细胞注射的数据表示平均值±SD,Ñ = 3统计显着性由配对确定吨 -test(一)或双尾未配对的吨 -试验(˚F和g)。(d),(e)和(g)中的实验被独立地重复了三次,得到相似的结果,并且显示了一个代表性实验的数据。源数据作为源数据文件提供。
接下来,我们测试了PTX3抑制是否能够通过在对照和过表达 SH3RF3的MDA-MB-231细胞中PTX3的siRNA沉默来挽救SH3RF3对CSC的作用(图 5d和补充图 3a)。流式细胞仪分析表明,SH3RF3扩大了MDA-MB-231中的ALDH + CSC亚群,而PTX3抑制作用使CSC群体收缩并有效地阻断了SH3RF3过表达的作用(图 5e,f和补充图 3b)。此外,PTX3沉默削弱了SH3RF3的促进作用MDA-MB-231和HMLE细胞中肿瘤球形成的相关性(图 5g和补充图 3c)。另外,过表达 SH3RF3的MDA-MB-231细胞中PTX3的shRNA敲低抑制了SH3RF3的体内肿瘤发生的增强(图 5h)。这些结果共同表明,PTX3在SH3RF3的下游起作用,以促进乳腺癌细胞的CSC功能。
SH3RF3 通过JNK-JUN途径增强PTX3表达
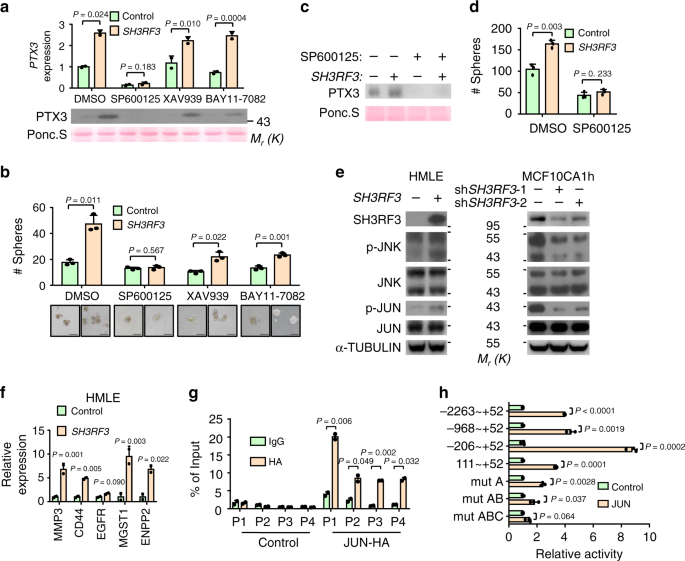
为了研究SH3RF3如何提高PTX3表达,我们测试了几种CSC相关的信号转导途径,包括PI3K,JNK,WNT和NF-κB,是否参与SH3RF3调控PTX3表达。首先,用PI3K抑制剂BKM120处理HMLE细胞。发现BKM120抑制了PTX3的表达和肿瘤球的形成(补充图 4a和b),与先前的报道一致,即PTX3是PI3K-AKT信号调节的靶基因45。然而,SH3RF3的过表达仍然能够上调PTX3的表达(补充图4a)和肿瘤 球的形成(补充图 4b)。)在PI3K抑制作用下。重要的是,SH3RF3不会引起AKT磷酸化的差异(补充图 4c),进一步表明SH3RF3以PI3K依赖性途径调节PTX3。此外,我们发现JNK抑制剂(SP600125)而不是WNT或NF-κB抑制剂(XAV939和BAY11-7082)可以显着抑制PTX3的表达水平并消除HMLE细胞中SH3RF3的作用(图。 6a)。另外,只有SP600125能够完全阻止SH3RF3促进肿瘤球形成,尽管其他抑制剂也能部分减少肿瘤球(图 6b)。SP600125对SH3RF3调节的PTX3的抢救作用在MDA-MB-231细胞中也观察到表达和肿瘤球形成(图 6c,d)。
a,b 用JNK(SP600125,5 nM),WNT(XAV939,5 nM)和NF抑制剂处理 的SH3RF3过表达和对照HMLE细胞的PTX3表达(a)和肿瘤球形成(b,n = 3培养实验)-κB(BAY11-7082,5 nM)。c,d用JNK抑制剂处理 的SH3RF3过表达和对照MDA-MB-231细胞的PTX3表达(c)和肿瘤球形成(d,n= 3个培养实验)。Ë JNK和后Jun磷酸SH3RF3过度表达和击倒。f SH3RF3在HMLE中过表达后JUN靶基因的表达(n = 3 qRT-PCR实验)。g ChIP-qPCR分析HeLa 中JUN与PTX3启动子的结合(n = 3 ChIP实验)。h在JUN过表达和对照HeLa细胞中PTX3启动子的荧光素酶报告基因分析(n = 3个报告基因检测)。数据代表平均值±SD。统计显着性由两尾不成对t检验(a,b,d,f,g和h)。(a - f)和(g)中的实验分别重复进行了3次,结果相似,并显示了一个代表性实验的数据。源数据作为源数据文件提供。
因此,我们进一步研究了SH3RF3对JNK信号通路的影响,发现SH3RF3的过表达导致JNK1,JNK2和下游转录因子JUN的磷酸化增加,而SH3RF3的抑制则抑制了多个细胞系中的JNK和JUN磷酸化(图。 图6e和补充图 4d)。另外,在具有SH3RF3过表达的癌细胞中,包括MMP3,CD44,EGFR,ENPP2 46和MGST1 47在内的一系列已知的JUN靶基因被显着上调(图 6f)。这些结果表明SH3RF3调节PTX3 通过激活JNK途径来促进BCSC特性表达。
此外,我们研究了JNK信号转导调控PTX3的机制。JUN是JNK下游的转录因子,通过形成AP-1异二聚体复合物激活靶基因表达。染色质免疫沉淀(ChIP)-qPCR分析揭示了JUN在PTX3启动子上的结合(图 6g和补充图 4e)。此外,JUN可以直接激活PTX3启动子的转录活性,如荧光素酶报告基因检测所示(图 6h)。对PTX3启动子进行连续截短分析表明,JUN主要靶向启动子中的-206至+52区(图 6h)。)。在该区域中,确定了三个AP-1结合位点(补充图 4e)。突变这些结合位点中的一个或两个部分地降低了JUN对启动子的激活,而突变所有三个位点则完全消除了对JUN的响应(图 6h)。因此,这三个位点均有助于JUN 调节PTX3表达。总体而言,这些数据表明被SH3RF3激活的JUN与PTX3的启动子结合以增强其表达。
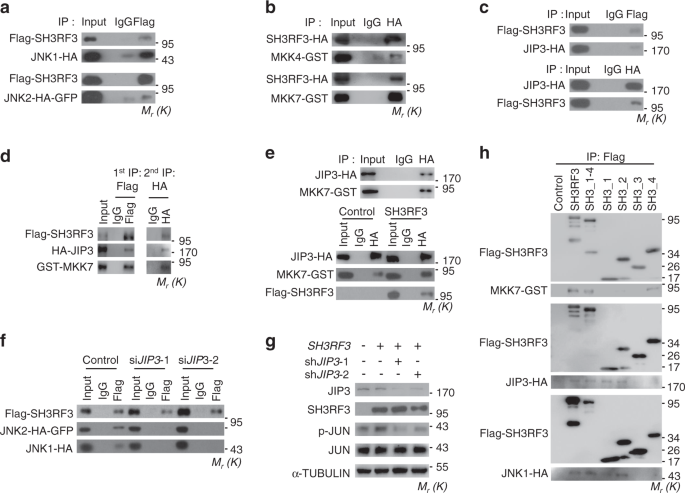
SH3RF3包含多个介导蛋白质与蛋白质相互作用的SH3域9。因此,SH3RF3可能通过与JNK及其激酶相互作用来调节JNK磷酸化。实际上,相互的免疫共沉淀(co-IP)分析表明SH3RF3与JNK1和JNK2相互作用(图 7a和补充图 5a)。还观察到SH3RF3与两种主要的JNK激酶MAP激酶激酶4(MKK4)和7(MKK7)的结合(图 6b和补充图 5b)。JNK和MKKs的复合物中,JNK的磷酸化被协调,而JNK相互作用蛋白(JIPs)作为复杂组织的基本支架48。因此,我们研究了乳腺癌细胞中SH3RF3和JNK之间的相互作用是否依赖于JIP。我们发现SH3RF3可以与293T中的所有三个JIP家族成员JIP1,JIP2和JIP3相互作用(图7c和补充图 5c);然而,JIP3是在乳腺癌细胞MCF10AT中表达的唯一JIP基因(补充图 5d)。此外,顺序IP分析证明了一种复合物中SH3RF3,MKK7和JIP3的存在(图 7d)。有趣的是,SH3RF3增强了JIP3与MKK7的相互作用,但对JIP3-JNK2的相互作用没有影响(图 7e和补充图 5e)。相反,JIP3两个独立的siRNA的敲低(补充图 5f)明显损害了SH3RF3与JNK蛋白的结合(图 7f)和SH3RF3促进了MCF10AT细胞中JUN磷酸化(图 7g)。我们进一步分析了SH3RF3蛋白区域以与JNK信号复合物相互作用,发现它是与MKK7相互作用的第四个SH3域,而第一个和第二个SH3域与JIP3和JNK1相互作用(图 7h和补充图 5g)。这些结果表明,SH3RF3有助于以JIP依赖的方式组装MKK-JNK复合物,并促进JNK-JUN活化。
293T细胞中SH3RF3-JNK1 / 2相互作用的 Co-IP分析。b 293T细胞中SH3RF3-MKK4 / 7相互作用的Co-IP分析。c 293T细胞中SH3RF3-JIP3相互作用的Co-IP分析。d 293T细胞中SH3RF3-JIP3-MKK7相互作用的顺序Co-IP分析。e对MCF10AT中JIP3-MKK7相互作用(有或没有SH3RF3过表达)的Co-IP分析(底部)。f在有或没有JIP3敲低的情况下,MCF10AT中SH3RF3-JNK1 / 2相互作用的Co-IP分析。g在MCF10AT中SH3RF3过表达和JIP3敲低后,JUN磷酸化。HCo-IP分析了各种SH3RF3截短与MKK7,JIP3和JNK1的相互作用。独立地重复实验三次,得到相似的结果,并显示了一个代表性实验的数据。源数据作为源数据文件提供。
SH3RF3与临床肿瘤中的CSC特性相关
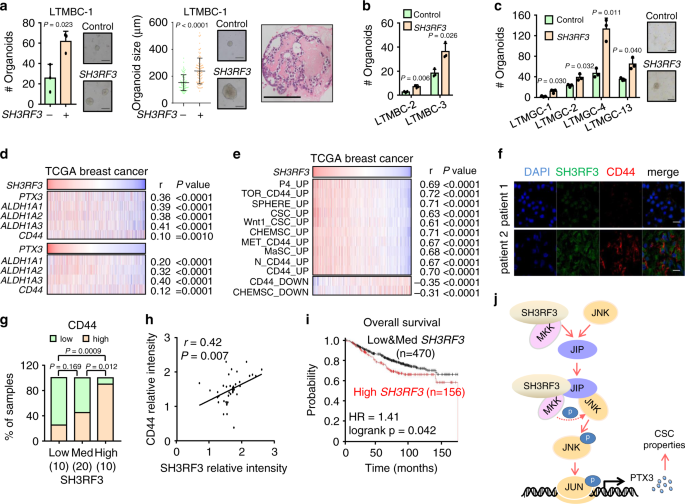
为了评估SH3RF3在CSC调节中的临床意义,我们分析了SH3RF3在患者衍生的类器官中的功能作用,这是一种具有高度临床相关性的3D培养CSC分析法49。用对照或表达SH3RF3的逆转录病毒感染三种乳腺癌的患者来源的肿瘤细胞,并接种到类器官培养基中的基质胶中。值得注意的是,SH3RF3的过表达导致在所有三个肿瘤中形成更多的类器官,并形成更大的类器官(图 8a,b)。在四种人类胃癌的类器官培养物中观察到了相似的结果(图 8c),证实了SH3RF3促进临床肿瘤细胞CSC功能的作用。
一个患者来源的类器官的形成(Ñ = 3类器官培养重复)在人乳腺肿瘤,LTMBC-1,之后SH3RF3过表达。(右图)线表示中位数,而晶须表示标准偏差。苏木精和曙红对代表性类器官的染色显示在右侧。比例尺,100μm。b SH3RF3过表达 后,另外两个人类乳腺肿瘤(LTMBC-2和3)的患者来源的类器官形成(n = 3个类器官培养物重复)。Ç病人衍生的类器官形成(Ñ 的四种人胃癌(LTMGC-1,2,4,和13)= 3类器官培养重复)与SH3RF3过度表达。比例尺,100μm。dTCGA乳腺癌队列(n = 1097例患者)中SH3RF3和PTX3表达与不同CSC标记基因的相关性。e TCGA乳腺癌队列(n = 1097例患者)中SH3RF3表达与CSC和MaSC相关基因集的ssGSEA得分的相关性。f齐鲁队列乳腺癌组织中SH3RF3和CD44的代表性IF图像。比例尺,100μm。克在齐鲁队列具有不同SH3RF3表达(的乳腺癌组织中的CD44表达水平Ñ = 40名患者)。括号中的数字表示样本量。h齐鲁队列乳腺癌组织中SH3RF3和CD44 IF强度的相关性(n = 40例患者)。i通过Kaplan–Meier Plotter乳腺癌队列中的SH3RF3表达进行生存分析(n = 626例患者)。jSH3RF3在BCSC调节中的作用的示意图。数据代表平均值±SD。统计显着性通过两尾不成对t检验(a,b和c),卡方检验(g),成对t检验(h)或双侧对数秩检验(i)。源数据作为源数据文件提供。
然后,我们分析了TCGA乳腺癌临床队列的RNA测序数据。在这些肿瘤中,SH3RF3的表达与PTX3以及CSC标记CD44和ALDH1A1 / 2/3正相关(图 8d)。还观察到PTX3与CD44和ALDH1A1 / 2/3的显着相关性(图 8d)。此外,ssGSEA分析显示,表达SH3RF3呈正CSC和MASC相关基因集在队列TCGA(图的富集相关 8E)。
接下来,我们通过免疫荧光(IF)染色评估了齐鲁队列40例乳腺浸润性导管癌中SH3RF3和CD44在蛋白质水平上的表达。根据SH3RF3 IF强度将样品分为三组,并且在具有较高SH3RF3表达的肿瘤中发现明显更多的CD44 +细胞(图 8f,g)。同时,在这些样品中还注意到SH3RF3信号强度和CD44信号强度之间的正相关(图 8h)。最后,我们观察到SH3RF3表达与远处转移的风险增加(补充图 6a)和较低的生存率(图8i)有关。 )在Kaplan-Meier绘图仪数据库中)50。CPTAC乳腺癌队列中较高的PTX3蛋白表达也与疾病复发相关(补充图 6b)。总而言之,我们的数据证实SH3RF3在BCSC维持中发挥积极作用,并且在临床上与CSC富集和乳腺癌预后不良相关。
讨论区
SH3RF3属于蛋白质家族,其特征在于存在多个SH3域和无名指域。除SH3RF3外,该家族中还有其他两个成员SH3RF1(POSH)和SH3RF2(POSHER)。在这些蛋白中,SH3RF1已经相对充分的研究,与以前的报道显示,以促进细胞凋亡,调节各种病理过程,包括HIV感染和脑缺血角色51,52,53。据报道SH3RF2通过拮抗SH3RF1 54抑制细胞凋亡。然而,尽管SH3RF1和SH3RF3的失调与肺癌和白血病有关,但尚不清楚这些POSH成员在癌症中的作用。11,55。在这里,我们报告以前未知的SH3RF3在乳腺癌的干调节中的作用。通过临床肿瘤和癌细胞系的转录组筛选,我们发现SH3RF3的表达与乳腺癌细胞的CSC特性始终相关。更重要的是,SH3RF3不仅可以促进癌细胞的生长,而且还需要维持其干细胞样特征。我们还证明了SH3RF3有助于MKK-JIP-JNK复合物的组装,导致JNK的活化和 PTX3表达的上调,以调节癌细胞中CSC的表达(图 8j)。SH3RF3对JNK通路的作用类似于SH3RF1,后者也是JNK激活物 53,但与抑制JNK的SH3RF2 54相反。这与这些蛋白质的结构同源性平行,因为SH3RF2仅具有三个SH3结构域,并且我们观察到第四个SH3结构域介导SH3RF3与JNK激酶MKK的相互作用。尽管尚不能确定SH3RF3介导JNK和MKK相互作用的详细机制,但我们的研究将扩大我们对POSH家族蛋白和CSC调节在癌症中的理解。
在我们对HMLER细胞的分析中,非CSC CD44L亚群的连续肿瘤球培养导致了具有CSC特性的新亚系,包括增强的肿瘤球形成和化学抗性。肿瘤性非干细胞向CSC的自发转化符合先前的报道56,并突出了癌细胞的可塑性,这是许多当前癌症治疗方法最终失败的关键原因。值得注意的是,先前的研究表明,癌细胞自发CSC特征的获取通常伴随着EMT过程。在我们的研究中,尽管HMLER的最初CD44L和CD44H亚群确实分别显示了上皮和间充质样形态,但CD44LS细胞仍保持上皮形态(图 1a)。),表示非CSC与CSC之间相互转换的EMT独立机制。
BCSCs还具有异质性特征。先前的研究表明,一种上皮样细胞亚群和间充质样亚群,由ALDH标记的+和CD44 + CD24 - ,分别存在于BCSCs 24。在我们的研究中,虽然两者的CD44H和CD44LS亚系被增强干性特点,CD44H主要是CD44 + CD24 -并且只包含ALDH的一小部分+细胞。相反,CD44LS群体明显转移到较高的ALDH表达上(图 1c)。该观察结果证实了乳腺癌中CSC异质性的概念。更重要的是,SH3RF3能促进BCSCs的两种亚型的在不同细胞系的扩展(图 2 B和图3b)。尽管BCSCs的不同亚型几乎没有重叠并显示出不同的分子谱24,但SH3RF3和JNK信号传导可能代表了异质BCSCs的共同调控机制。因此,这些结果可能对乳腺癌治疗中的CSC靶向设计具有重要意义。
已知JNK途径与炎症,细胞凋亡,细胞分化和增殖有关。最近,多项研究报道了JNK在CSC法规中的关键作用57。此外,JNK损害导致在结肠直肠癌和乳腺癌的癌症细胞的干性的抑制57,58,59。但是,在CSC中激活JNK的机制仍是未知之数。MNK对JNK的磷酸化和激活取决于JNK信号复合物的形成,该复合物由JNK,MKK和支架JIP组成。在这里,我们表明在乳腺癌细胞中,SH3RF3在复合物中也起作用,并有助于JNK磷酸化。这一发现将丰富我们对JNK信号传导的理解,并有必要进一步研究SH3RF3是JNK信号传导复合物的真正组成部分还是它在JNK和CSC调节中的作用是特定于癌细胞的。
先前的报道已经牢固地确立了PTX3在促进去分化60,化疗耐药61和基底样乳腺癌细胞45的干特性中的作用。然而,也有研究报告的沉默PTX3与正常组织相比表达在肿瘤中18,19和其在多种癌症类型致癌抑制效果18,62,63。这些看似矛盾的观察结果可以通过以下事实来证实:PTX3仅在乳腺癌的CSC亚群中高表达,而在非CSC中几乎无法检测到(图 4a)和补充数据文件 1)。考虑到CSC通常仅构成肿瘤细胞的一小部分,PTC3在CSC中的上调可能与其在大块肿瘤中的弱表达并不矛盾。这些数据也可能表明,PTX3在肿瘤调节的CSC和非CSC中可能发挥不同的作用。此外,我们的数据显示PTX3表达导致Hedgehog信号的激活和Hippo信号的抑制,这可能为有关PTX3在癌症调节中的功能机制的未解决问题提供了启示。然而,在将PTX3靶向用于癌症治疗之前,尚未发现PTX3的下游分子事件,尤其是PTX3可能将分泌蛋白信号传递到细胞中的受体。
方法
质粒和试剂
SH3RF3 cDNA分别克隆到pRVPTO-puro-HA 64,pLVX-puro-Flag和pLVX-blasticidin(Clonetech)中,用于过表达和Co-IP分析。将PTX3,JNK1,JNK2(与GFP融合),JIP1,JIP2和JIP3克隆到pLVX-puro-HA中,将MKK4 / 7克隆到pLVX-puro-GST中以进行过表达和Co-IP分析。对于SH3RF3和PTX3击倒,shRNA的设计与在线软件sfold 65,接着退火,以寡核苷酸的克隆到的pSUPER-复古PURO(低聚发动机)或的pSUPER-复古杀稻瘟素,具有以下靶序列:5'-ATTTCGAGATGAAGGACAAAG -3ʹ(SH3RF3KD1); 5ʹ-TCGAGGAAGGGCCACTATAAT-3ʹ(SH3RF3KD2); 5ʹ-GGCCGAGAACTCGGATGATTA-3ʹ(P TX3 KD1); 5ʹ-GCCATGGTGCTTTCAGTTTAA-3ʹ(PTX3 KD2)。序列siRNA敲除,包括SH3RF3 siRNA1(5'-CCAAGAAACGCCACUCCUUTT -3'-),siRNA2转(5'-CCCAACGUCAGUGCCGCAATT -3'-),PTX3 siRNA1(5'-GCACAAAGAGGAAUCCAUATT -3'-),siRNA2转(5'-GGGAUAGUGUUCUUAGCAATT -3'-),JIP3 siRNA1(5'-GCGGCACACAGAGAUGAUATT -3ʹ,siRNA2(5ʹ-CCAGCACCACAGGCACCAATT-3ʹ)和加扰的对照(5ʹ-UUCUCCGAACGUGUCACGUTT-3ʹ)购自GenePharma。
对于PTX3启动子活性分析,将PTX3基因位点的-2263至+52 DNA片段以及截短和突变的序列克隆到具有MluI和BglII位点的pGL3-basic(Promega)中。补充表3提供了该研究中使用的所有引物 。通过DNA测序验证所有构建体。这项研究中使用的所有细胞系均经过无支原体测试。
小鼠抗人β-ACTIN(Sigma,A2228),大鼠抗人CD44(Santa Cruz,sc-18849),小鼠抗HA(Sigma,H9658),小鼠抗Flag(Sigma,F1804),兔抗- HA(Cell Signaling Technology,3724S)。使用前,所有抗体均按照制造商说明中建议的稀释比例稀释。本研究中使用的各种信号通路的抑制剂是BKM120(MCE,HY-70063),SP600125(Merck,420119),BAY11-7082(Selleck,s2913)和XAV939(Sigma,X3004)。
RNA测序
使用Trizol试剂(Invitrogen)从细胞中提取总RNA,并使用2100 Bioanalyzer(Aglient Technologies)进行评估。RNA完整性数(RIN)> 8的RNA样品用于后续测序。文库的构建和测序是在上海的WuXi NextCODE进行的。通过去除rRNA(HMLER CD44L,CD44H,CD44LS亚细胞)或PolyA纯化(SH3RF3过表达的MCF10AT和PTX3)从总RNA样品中富集mRNA。-过表达的HMLER细胞),然后片段化,然后用随机引物进行逆转录。然后根据Illumina的文库构建方案对合成的cDNA进行末端修复,磷酸化和'A'碱基添加。加入Illumina测序适配器后,使用AMPure XP Beads(Beckmen)进行PCR扩增和纯化,按照Illumina提供的方案,使用HiSeq X10测序平台(Illumina)进行测序,得到2×150 bp的配对末端读数。串烧v0.2.2 66用于除去衔接子序列。进行质量控制(QC)以除去碱基质量<Q30的碱基,并从后续分析中读取长度<= 75 bp的读数。在本研究中,分析样品的数据产量为53.90–75.51 M原始读取和53.81–75.28 M QC通过读取。然后经滤波的读段使用软件STAR v2.5.1b映射到人类基因组(hg19)和转录(gencode V19)67以默认参数(“-outFilterMultimapNmax 10,-outFilterMismatchNmax 10,-outFilterMismatchNoverLmax 0.3,-sjdbOverhang 100, - outFilterType正常-alignSJoverhangMin 5,-alignSJDBoverhangMin 3,-alignIntronMin 21,-alignIntronMax 0,-alignMatesGapMax 0”),读取结果的对齐率为93.7–97.3%。这项研究中dupRadar估算的RNA测序数据的PCR重复率68,对于所有样品均为0.303±0.118。所读取的重复物保留在以下表达分析中,因为在该测序方案中很难将PCR重复物与自然重复物区分开。使用RSEM 1.2.29 69使用默认参数(设置“ --estimate-rspd”除外)进行表达估计。使用R包EdgeR v3.8.5 70和M值算法的均值修整来进行跨样本归一化和差异表达分析。可能的多映射SH3RF3读取到整个基因组进行了分析,并发现有0.6% SH3RF3读取多映射到其他基因,但没有其他两个SH3RF家庭成员, SH3RF1和SH3RF2。用CPM(每百万计数)≥5(HMLER CD44L,CD44H,CD44LS亚系细胞)或基因CPM≥1(SH3RF3 -overexpressing MCF10AT和PTX3 -overexpressing HMLER细胞)的至少一个样品中的被带到进一步分析。样品组之间的成对比较通过精确测试进行差异表达分析。鉴定出倍数变化> 2且Benjamini-Hochberg调整的p值<0.05的上调和下调基因。
公共转录组数据集的生物信息学分析
GDC TCGA乳腺癌RNAseq(HTSeq-FPKM-UQ)表达数据集是从UCSC Xena 71获得的。这些TCGA肿瘤的CSC富集通过ssGESA分析25与CD44差异表达先前鉴定的基因签名+ CD24 -的肿瘤细胞与CD44比较- CD24 +同行(CD44_UP_DOWN,[ 26 ])。ssGSEA得分与每个基因表达的相关性通过皮尔逊相关分析进行评估。根据皮尔逊系数(r)和前100个正相关和负相关的基因用于进一步分析。从GEO数据库(GSE7515)下载患者来源的肿瘤球和亲本肿瘤的RNA微阵列数据,并选择倍数变化> 2和Student t -test P <0.05 的基因进行进一步分析。乳腺癌细胞系的表达数据集来自《癌细胞系百科全书》37,并使用ssGSEA进行了分析。国家癌症研究所CPTAC(临床蛋白质组学分析肿瘤协会)乳腺癌蛋白质组学数据来自cBioPortal数据库下载72,73并用于分析PTX3表达与癌症预后的相关性。补充数据文件2中提供了GSEA和ssGSEA中使用的CSC或MaSC相关基因集的完整列表和描述 。
流式细胞仪分析
在对数生长期,将从培养物中收获的癌细胞重悬于PBS中。按照制造商的说明,将500,000个细胞与推荐浓度的抗体在4°C下孵育0.5小时,然后进行PBS洗涤3次。然后,将细胞用70μm过滤器过滤,并通过MoFlo Astrios EQ流式细胞仪(Beckman)进行分选,或通过Gallios Analyzer(Beckman)进行分析。根据制造商的方案,通过ALDEFLUOR试剂盒(StemCell Technologies)进行ALDH活性分析。特定的ALDH抑制剂二乙基氨基苯甲醛(DEAB)在ALDH分析中用作阴性对照。流式细胞仪数据处理是使用FlowJov10(美国Tree Star)进行的。流式细胞仪门控策略显示在补充图 7中。
肿瘤球形成
在具有细胞系特异性附件的无血清培养基中培养细胞(补充表 2)。将5000–10,000个细胞接种到6孔超低附着平板(#3471,美国康宁)中,并培养1或2周。计数直径大于50μm的球。补充表2提供了不同细胞系的肿瘤球培养条件的详细信息,包括培养基,接种的细胞数和培养时间 。CD44L衍生的CD44L连续肿瘤球传代的培养条件与最初的肿瘤球培养相同。
化学抗性测定
将五千个肿瘤细胞接种在96孔板的每个孔中。将各种浓度的化学疗法药物(紫杉醇0–200 ng / mL,阿霉素0–500 nM)或作为阴性对照的溶剂添加到孔中。将细胞培养48小时,然后进行MTT细胞活力测定。在PBS中以5 mg / mL的浓度和pH 7.4制备3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四唑溴化物(MTT)。在每个孔中加入二十微升的MTT溶液。4小时后,将晶体溶解在DMSO中,并在490nm处测量吸光度。
启动子活性测定
由JUN调节的PTX3启动子活性通过荧光素酶报告基因测定法测量。将200微克对照或JUN质粒,200μgPTX3启动子萤火虫荧光素酶报告质粒和100μgRenilla荧光素酶质粒转染到24孔板各孔的HeLa细胞中。将细胞再培养48小时,并收集裂解物用于萤火虫中的萤光素酶活性分析(25 mM甘氨酰甘氨酸,15 mM磷酸钾,15 mM MgSO 4,2 mM ATP,10 mM DTT和1 mM D-萤光素,pH 7.8)和Renilla(0.5 M NaCl,1 mM EDTA,0.1 M磷酸钾,0.04%BSA和2μM腔肠素,pH 7.4)萤光素酶测定缓冲液。
染色质免疫沉淀(ChIP)
在HeLa细胞中进行了JUN 对PTX3启动子结合的ChIP分析。简而言之,将HeLa细胞用JUN过表达或对照质粒转染。两天后,将细胞与1%甲醛交联,并用125 mM甘氨酸淬灭。超声处理细胞核裂解液,并与对照IgG或抗HA抗体孵育以进行免疫沉淀。捕获复合物并通过琼脂糖珠沉淀。将捕获的基因组DNA反向交联,并用GenTLE Dr. Precipitation Carrier(Takara)通过乙醇沉淀进行纯化。纯化的基因组DNA用于qPCR分析。
免疫共沉淀(Co-IP)
在Co-IP之前48小时,用过表达质粒转染细胞。将细胞裂解液与对照IgG或免疫沉淀的一抗在4°C孵育过夜。然后,再用25μl蛋白A / G琼脂糖珠(GE)进行2小时孵育。珠子用裂解缓冲液洗涤五次,并在95°C加热10分钟。进行蛋白质印迹以检测相关蛋白质之间的相互作用。
免疫荧光(IF)分析
将固定的肿瘤组织包埋在石蜡中并切成10μm切片。将切片用二甲苯脱蜡,并用一系列不同浓度的乙醇溶液水合,然后进行抗原修复。将切片与SH3RF3或CD44一抗在4°C下孵育过夜,然后用PBS洗涤3次,然后与荧光标记的二抗和DAPI一起孵育。清洗和密封后,通过共聚焦显微镜(ZEISS)和ZEN blue版软件(ZEISS)对切片进行分析。
动物研究
4-6周龄的雌性NSG小鼠购自上海模型生物中心,保存在标准SPF动物房中,并用于所有研究中。对于肿瘤移植,将从细胞培养物中收获的癌细胞以1×10 7的浓度重悬于PBS中。 细胞/ mL,并稀释至特定浓度。在腹部切开一个切口,使皮肤凹陷以定位#4乳腺脂肪垫,在解剖显微镜下向其中注入细胞。通过触诊确定小鼠的肿瘤发生率,并在实验结束时通过手术打开乳腺进行肿瘤检查来证实小鼠的肿瘤发生率。在测量体积之前将肿瘤从小鼠中移除。所有动物研究均按照上海生物科学研究所机构生物医学研究伦理委员会批准的《实验动物的护理和使用指南》进行。
临床样本和患者来源的类器官(PDO)培养
新鲜和石蜡包埋的乳腺癌组织从山东大学齐鲁医院(中国济南)获得患者的知情同意并获得机构审查委员会的批准。收获新鲜的肿瘤组织,并将其移植到用CD122中和抗体预处理的NOD-SCID小鼠的清除乳腺脂肪垫中,以建立患者衍生的乳腺癌异种移植物。在两个传代中将肿瘤细胞与既定的异种移植物分离,并用对照或SH3RF3感染-过表达逆转录病毒。将感染的细胞接种在24孔板的Matrigel中,并用补充1:50 B27、0.5μg/ mL氢化可的松,20 ng / mL bFGF,20 ng / mL EGF,5μg/ mL胰岛素和2的类器官培养基覆盖%FBS。培养一周后,对类器官的数量进行计数。
统计分析
数据分析使用GraphPad Prism 7.0(GraphPad软件,美国拉荷亚)进行。除非另有说明,否则进行不带均方差假设的两尾Student t检验,以比较不同组的体外和动物试验的数据。通过对数秩检验分析乳腺癌患者的存活率。皮尔逊相关系数用于评估不同数据组之间的相关性。的p值<0.05被认为是统计学上显著。所有成像实验至少重复了3次,结果相似。
|
|