2,4-二烯酰辅酶A还原酶调节抗药性前列腺癌的脂质稳态
摘要
尽管雄激素受体(AR)靶向疗法在临床上取得了成功,但AR信号的重新激活仍然是去势抵抗性前列腺癌(CRPC)进展的主要驱动力。在这项研究中,我们对长期暴露于多种AR抑制剂(ARI)的LNCaP细胞进行了全面的无偏性表征。蛋白质组学和代谢组学相结合的分析暗示了在ARI耐药细胞中常见的,与葡萄糖和脂质代谢紊乱有关的后天代谢表型。为了利用这种表型,我们描述了与ARI抗性始终相关的蛋白质子集,并突出了线粒体2,4-二烯酰辅酶A还原酶(DECR1),β-氧化的辅助酶,作为CRPC的临床相关生物标志物。机械上,DECR1敲除可诱导内质网应激,并使CRPC细胞对肥大症敏感。在体内,DECR1缺失会损害脂质代谢并降低CRPC肿瘤的生长,从而强调DECR1在治疗耐药性发展中的重要性。
介绍
前列腺癌是西方世界男性中最常见的癌症1。由于它依赖于雄激素受体(AR)信号,雄激素剥夺疗法(ADT)一直是晚期疾病的护理标准。然而,尽管大多数患者最初对激素治疗有反应,但最终它们会复发并发展为致命性疾病,称为去势抵抗性前列腺癌(CRPC)。
在过去的几十年中,特定的AR抑制剂(ARI)在临床上显示出令人鼓舞的效果,显着改善了患者的预后2。比卡鲁胺,第一代AR拮抗剂,已被成功地用于近二十年3由enzalutamide(MDV3100),其在体外特性显示更好正在逐步取代前4和患者改善的功效5,6。在第3次阶段临床试验中,治疗enzalutamide在显著转移性提高无进展生存期7,8,和非转移性CRPC患者9。阿帕鲁胺(ARN-509)是另一种新型的AR拮抗剂,最近完成了3期临床评估,显着降低了具有高风险非转移性CRPC的男性转移形成的风险10。
尽管到enzalutamide和apalutamide,初始响应AR突变11,12,13,14,基因扩增15,异常剪接16或信令旁路17可以全部帐户耐AR靶向疗法。因此,更好地理解抗药性后的适应性肿瘤表型将有助于确定新颖的治疗方法,以解决AR熟练CRPC。
增强现实的信号关键调节前列腺癌18的细胞代谢。因此,靶向代谢是克服对AR靶向治疗的耐药性的一个有吸引力的选择。与其他癌症相比,前列腺癌表现出非常特殊的代谢特征19,例如早期依赖线粒体代谢而不是糖酵解,尽管后者随着疾病的进展而变得重要20。前列腺癌的特征还在于胆固醇和脂质代谢的深刻改变21,以脂肪酸合成和氧化途径的失调为重点。脂质代谢的重新连接提供了新的治疗机会,并导致了多种抑制剂的开发,其中一些目前正在临床试验中。
在这项研究中,我们使用蛋白质组学和代谢组学的组合对长期暴露于比卡鲁胺,阿帕鲁胺或恩杂鲁胺治疗的LNCaP衍生的细胞系进行无偏性表征。我们表明,葡萄糖和脂质代谢的深刻变化可维持对AR抑制作用的长期抵抗力。这种代谢重排主要取决于异常的AR信号传导。此外,我们确定了与ARI获得性耐药相关的蛋白质标记。在头号候选药物中,参与多不饱和脂肪酸(PUFA)降解的线粒体酶2,4-二壬基-CoA还原酶(DECR1)代表了CRPC的潜在治疗靶标。DECR1CRPC细胞中的缺失会降低体外增殖并损害CRPC肿瘤的生长。从机制上讲,我们表明缺乏DECR1的前列腺癌细胞会积累更高水平的多不饱和脂质。这会导致强烈的ER应激反应并增加对GPX4抑制的敏感性,并提示DECR1在氧化还原稳态中的潜在作用。
结果
抗ARI的细胞显示出改变但活跃的AR信号
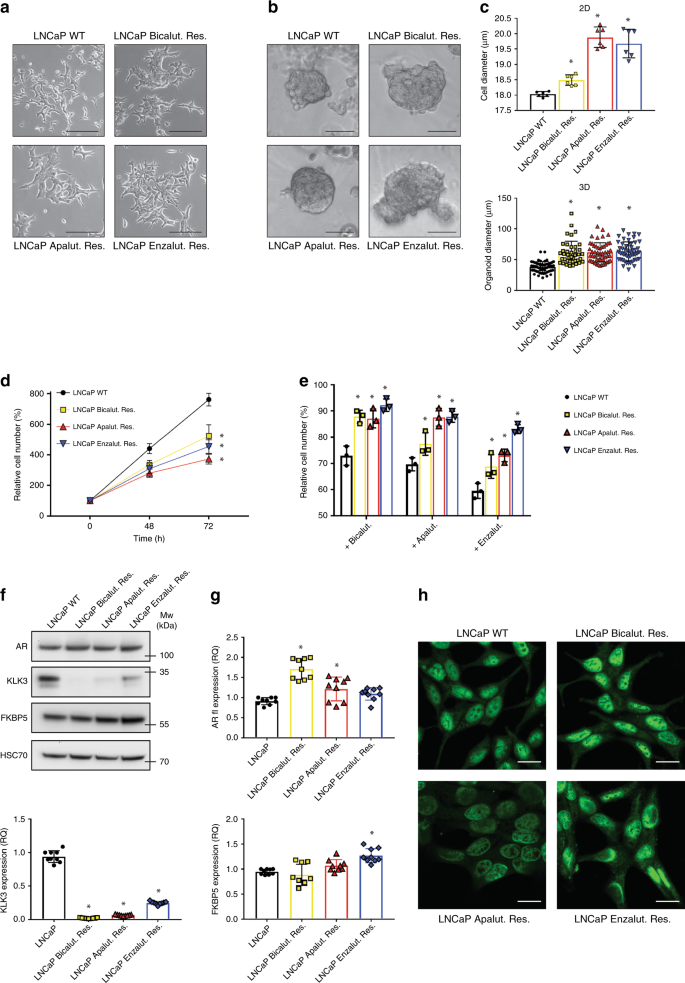
为了研究对AR抑制的抗性,我们对LNCaP细胞的CRPC衍生物进行了表征,这些化合物在三种不同的AR抑制剂(ARI),即比卡鲁胺(第一代ARI),阿帕鲁胺和enzalutamide(第二代ARI)的存在下进行了长期培养。与亲代LNCaP细胞相比,抗ARI的细胞更大,并且表现出增强的细胞间接触。在3D基质中培养时,抗ARI的细胞也产生较大的类器官结构(图 1a–c)。相比之下,抗ARI的细胞的增殖速度要比WT LNCaP慢(比卡鲁胺,恩杂鲁胺和阿帕鲁胺抗性细胞在72 h分别增殖约30%,40%和50%,图 1d)。)。与在患者中观察到的相似,ARI耐药细胞在不同抑制剂之间表现出交叉耐药性(图 1e)。
a在2D条件下培养的WT和ARI耐药LNCaP细胞的代表性图片。比例尺代表100 µm。b Matrigel中嵌入的具有WT和ARI抗性的LNCaP类器官的代表性图片。比例尺代表50 µm。c定量细胞(上图)和类器官(下图)的直径。d 48和72小时后,WT和ARI耐药LNCaP细胞的细胞增殖。将细胞计数标准化为T0时的初始细胞数。e用不同的AR抑制剂(10 µM)处理48小时的WT和ARI耐药LNCaP细胞的细胞增殖。将细胞计数标准化为未处理的条件。FWT和ARI耐药LNCaP细胞中AR,KLK3和FKBP5表达的蛋白质印迹分析。HSC70用作样品上样对照。用 RT-qPCR分析WT和ARI耐药LNCaP细胞中AR(全长fl),KLK3和FKBP5的表达。CASC3用作标准化对照。h免疫荧光显示WT和ARI耐药LNCaP细胞中核AR表达。比例尺代表20 µm。c – e,g数据以平均值+/- SD表示。c,g * p值<0.05,使用带有Dunnett多重比较检验的1向ANOVA。d,e * p值<0.05,使用带有Tukey多重比较检验的2通ANOVA。源数据作为源数据文件提供。
由于AR是这三种抑制剂的直接靶标,因此我们首先试图评估ARI耐药细胞中AR信号的状态。在所有三个细胞系中,全长AR的表达在蛋白质和mRNA水平上均得以维持甚至增加(图 1f,g)。还评估了ARv7变体的表达。比卡鲁胺抗性细胞显示该变体的表达显着增加,而抗阿普鲁胺和恩杂鲁胺的细胞显示ARv7水平无变化或降低(补充图 1a)。然后,我们研究了AR下游两个经典靶基因KLK3和FKBP5的表达。而KLK3的表达在所有耐药细胞中,FKBP5的表达都大大降低,在enzalutamide耐药细胞中,FKBP5的表达不受影响甚至升高(图 1f,g)。有趣的是,我们观察到AR保留在ARI耐药细胞的细胞核中(图 1h,补充图 1b),并且仍然能够结合两个靶基因的启动子(补充图 1c)。总而言之,这些结果表明,AR重编程而非失活是ARI抵抗性前列腺癌细胞的一般生存策略。
ARI抵抗与细胞代谢改变有关
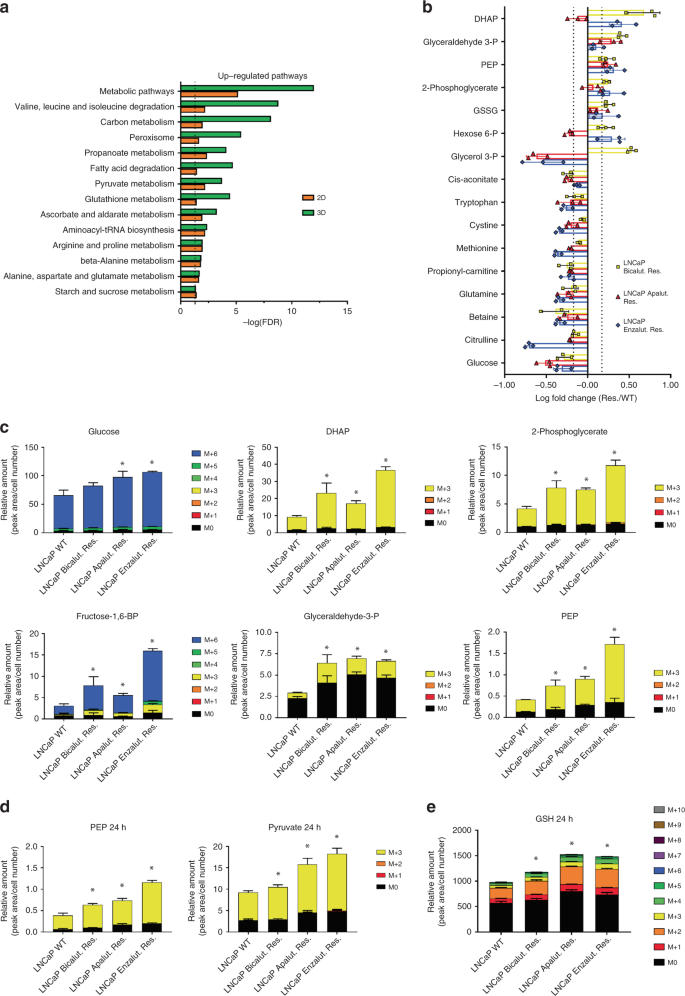
为了解释与治疗抗性相关的机制,我们表征了在2D和3D条件下培养的亲本LNCaP和ARI耐药细胞的蛋白质组(补充数据 1,补充图 2a,b)。与2D培养相比,已提出在3D矩阵中培养癌细胞以更好地模拟体内情况22,因此在生物标记物发现的背景下引起人们的兴趣。接下来,我们进行了途径富集分析,以鉴定2D和3D培养物中ARI抗性细胞中通常失调的途径。有趣的是,无论培养条件如何,在ARI抗性细胞中许多代谢途径都持续上调(图 2a)。)。实际上,每个比较中最上调的途径(FDR <0.05)包括氨基酸,脂肪酸,葡萄糖和谷胱甘肽代谢(图 2a)。
与WT LNCaP相比,在ARI抗性细胞的蛋白质组学分析中上调的富集途径。在3种条件中的至少2种条件下,选定的蛋白质受到了显着调节。使用STRING数据库(http://string-db.org)进行途径富集分析。b与WT LNCaP相比,抗ARI的细胞中稳定调节的代谢物的稳态水平(FC> 1.5,p <0.05,采用带有Dunnett多重比较检验的1向ANOVA方法)。在3种条件中的至少2种条件下,显着调节了选定的代谢物。c掺入13 C-葡萄糖1 h后,ARI耐药和WT LNCaP细胞中所选代谢物的同位素同位素分布。d在13 C-葡萄糖掺入24小时后,丙酮酸和磷酸烯醇丙酮酸的同位素体分布在ARI抗性和WT LNCaP细胞中。È在以下ARI抗性和WT LNCaP细胞还原型谷胱甘肽(GSH)的同位素分布13 C-葡萄糖掺入24小时。b – e数据以平均值+/- SD表示。使用Dunnett多重比较检验的单向方差分析(1-way ANOVA),标记级分的c – e * p值<0.05。DHAP-磷酸二羟基丙酮,PEP磷酸烯醇丙酮酸,GSH还原型谷胱甘肽,GSSG氧化型谷胱甘肽。源数据作为源数据文件提供。
连同外泌体和囊泡蛋白一起,我们发现在ARI抗性细胞中上调的许多蛋白都位于线粒体中(补充图 2c),这表明线粒体代谢可能是与治疗耐药性相关的关键途径。线粒体通过柠檬酸和乙酰辅酶A的产生处于葡萄糖和脂肪酸代谢之间的十字路口。根据这一假设,抗ARI的细胞还显示PPARG和PGC1A(这两个对线粒体生物发生和脂肪酸代谢至关重要的转录因子)以及肝X受体(NR1H2和NR1H3)的两个同工型的表达增加。脂质稳态调节的相关因素23(补充图 2d)。
耐药细胞表现出重新连接的葡萄糖和脂质代谢
为了更好地了解ARI耐药细胞和亲代LNCaP细胞之间的代谢差异,我们分析了66种代谢物并鉴定了在三种耐药细胞系中的至少两种中显着调节的16种分子(图 2b,FC = 1.5)。耐药细胞中的细胞内葡萄糖水平始终较低,这与几种糖酵解中间体(例如H6P,G3P,DHAP,2-PG和PEP)的水平升高形成鲜明对比。ARI抗性细胞进一步显示出葡萄糖转运蛋白GLUT1的表达升高(补充图 2e)。此外,使用2-脱氧葡萄糖(2-DG)抑制糖酵解增强了enzalutamide在LNCaP细胞中的作用(补充图 2f)。结合我们的蛋白质组学数据(图 2a)),这些结果表明,抗ARI的细胞可能会发生代谢转变,从而增加葡萄糖的消耗。为了检验该假设,我们在[U 13 C]-葡萄糖存在下将细胞培养了短时间(1小时),并通过质谱法测量了13 C衍生代谢产物的水平。与葡萄糖代谢增加相一致,与WT LNCaP相比,在ARI抗性细胞中观察到标记糖酵解中间体的大量富集(图 2c)。在以后的某个时间点(24小时),标记的丙酮酸中间体的水平在ARI抗性细胞中保持升高,证实糖酵解在抗性细胞中更活跃(图 2d)。)。有趣的是,很大一部分标记的葡萄糖也用于生成谷胱甘肽,潜在地表明了抗性细胞中氧化还原稳态的重要性(图 2a,e)。
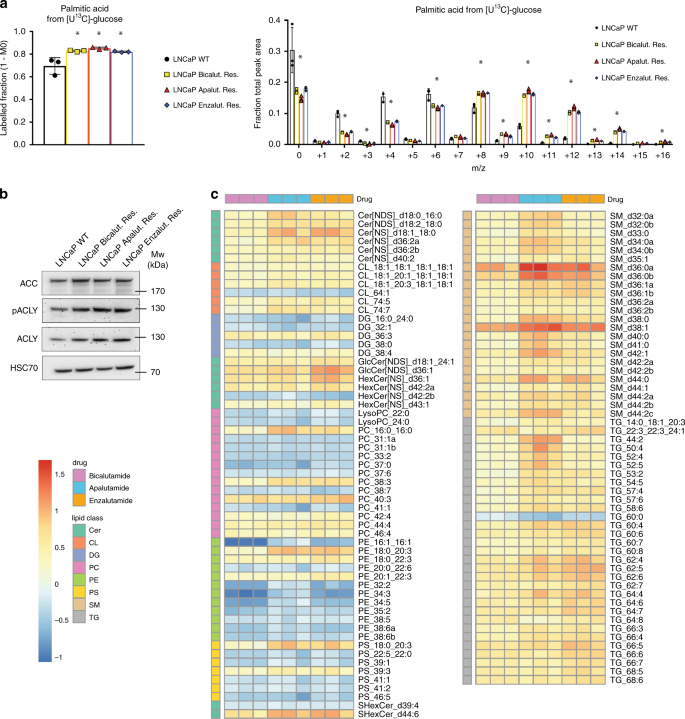
糖酵解最终产生乳酸和丙酮酸。丙酮酸可以依次用于线粒体中以生成乙酰辅酶A和支持从头脂肪酸合成,该过程通常在侵袭性前列腺癌中失调[ 21]。因此,我们在[U 13 C]-葡萄糖中孵育细胞72小时,并追踪到13 C掺入棕榈酸,油酸和硬脂酸中(图 3a和补充图 3)。在所有三种抗ARI细胞系中,13棕榈酸酯,油酸酯和硬脂酸酯的C富集度显着高于WT LNCaP细胞,表明ARI抗性细胞中葡萄糖衍生的从头脂肪酸合成增加。此外,所有三个抗性品系均显示出高水平的ACC和ACLY,这是脂肪酸合成的两种调节酶(图 3b)。)。为了测试葡萄糖衍生的脂肪酸合成水平的增加是否导致耐药细胞中脂质的积累,我们比较了ARI耐药细胞和亲代LNCaP的细胞脂质谱。令人惊讶的是,对AR抑制的抗性与细胞脂质组的深刻重塑有关。我们鉴定出在所有三种耐药细胞系中均被显着调节的114个脂质分子,其中大多数在ARI耐药细胞中被上调(图 3c,FC = 1.5)。所有这三种抗性细胞系均表现出多种甘油三酸酯(TG)(尤其是多不饱和TG和鞘脂)的强而一致的积累(图 3c,右侧面板)。多种神经酰胺和心磷脂衍生物也富集在抗性细胞系中,而相反,WT LNCaP却过度代表了几类磷脂,如磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)衍生物(图 3c,左图) 。
13 C-葡萄糖孵育72小时后,衍生自13 C-葡萄糖的标记的棕榈酸酯馏分(左图)和ARI抗性和WT LNCaP细胞中棕榈酸的相对同位素分布。b WT和ARI耐药LNCaP细胞中ACC,ACLY和磷酸ACLY表达的蛋白质印迹分析。HSC70用作样品上样对照。c热图显示了与WT LNCaP相比,抗ARI的细胞中稳定调节的脂质的稳态水平(FC> 1.5,p <0.05,使用带有Dunnett多重比较检验的1向ANOVA)。值表示为log(FC)。a数据以平均值+/- SD表示。一个* p值<0.05,使用带有Dunnett多重比较检验的1向ANOVA。神经酰胺,CL心磷脂,DG二酰基甘油,LysoPC溶血磷脂酰胆碱,PC磷脂酰胆碱,PE磷脂酰乙醇胺,PS磷脂酰丝氨酸,SM鞘磷脂,TG甘油三酸酯。源数据作为源数据文件提供。
总而言之,这些结果支持这样的想法,即抗ARI的细胞中葡萄糖消耗的增加至少部分地用于支持谷胱甘肽和从头脂肪酸合成。这种代谢重新连接最终导致脂质积累和ARI抗性细胞的细胞脂质组发生重大变化。
AR驱动ARI耐药细胞中的代谢重编程
AMPK是葡萄糖代谢的重要调节剂,针对AMPK依赖性自噬已被提出来增强enzalutamide的敏感性24。因此,我们测试了AMPK激活是否可以促进在ARI耐药细胞中观察到的代谢重排。与WT LNCaP细胞相比,抗ARI的细胞显示出增加的AMPKα表达和活性,这由增加的ACC磷酸化所证明(补充图 4a)。然而,AMPKα表达的沉默(补充图 4b)仅少量降低了由13 C-葡萄糖产生的标记糖酵解中间体的水平(补充图 4c)。
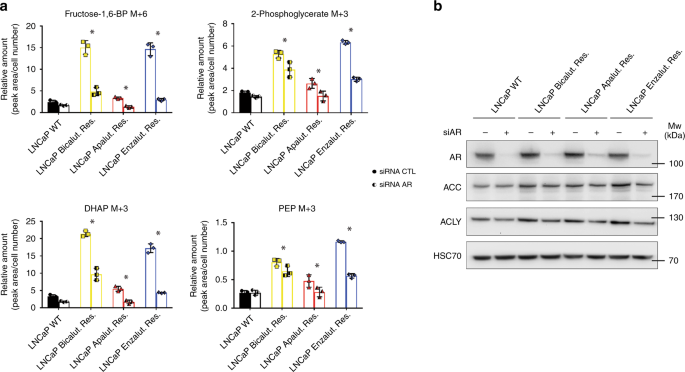
AR本身已被认为是前列腺癌细胞中葡萄糖代谢的关键调节剂18。因此,AR可能是在ARI耐药细胞中观察到的葡萄糖通量增加的原因。在不同细胞系中AR耗尽后,细胞内葡萄糖水平保持不变(补充图 4d)。相比之下,受体的敲除大大削弱了抗性细胞中的葡萄糖利用,如众多糖酵解中间体的标记同位素数量减少所表明的(图 4a)。总体而言,这种作用在野生型LNCaP细胞中不明显。此外,AR耗竭的细胞显示出ACC和ACLY的表达降低(图 4b),增强了AR被重新编程以促进抗性细胞中葡萄糖从脂肪酸合成的想法。
与ARI抗性相关的蛋白质组学特征
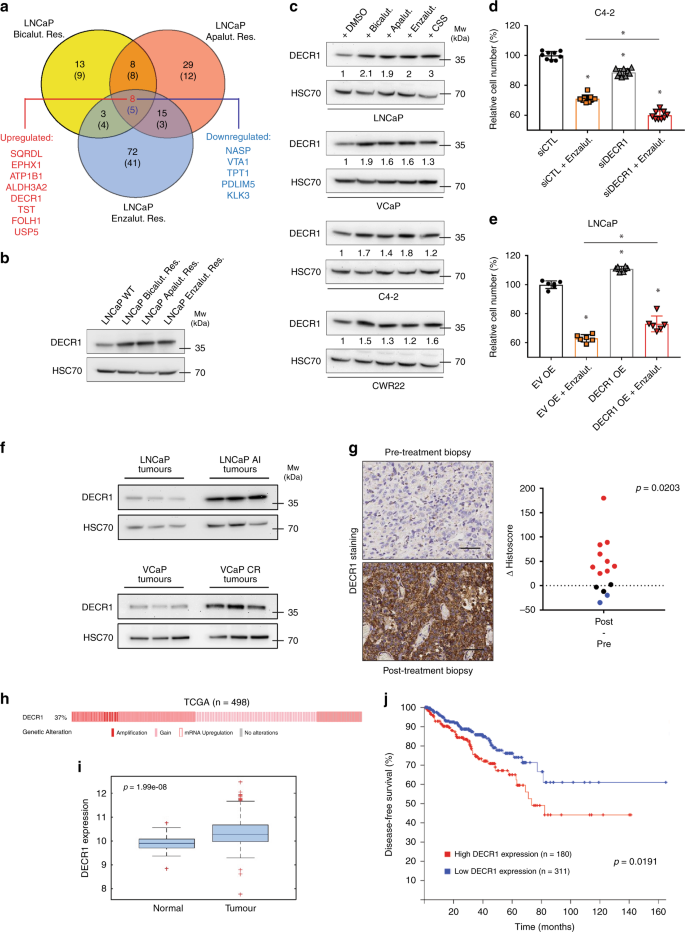
由于在ARI耐药细胞中观察到主要的代谢重编程,我们假设一些最初可分配的酶可能对于维持耐药表型至关重要。这样的候选物将代表ARI抗性的有趣的靶标/生物标志物。因此,我们使用蛋白质组学数据集来识别在2D和3D条件下在所有三种ARI抗性细胞系中均被一致调节的蛋白质。我们生成了由13种候选物组成的蛋白质组学专家组,其对AR抑制的抵抗力受到差异调节,与抑制剂的类型或培养条件无关(图 5a,表 1)。)。与CRPC相关的公认因素的鉴定,例如前列腺特异性抗原(PSA)或前列腺特异性膜抗原(PSMA / FOLH1),增强了所鉴定蛋白质的有效性。值得注意的是,我们鉴定了几种候选物,主要是参与氧化还原过程的酶,尚未在前列腺癌中报道(表 1)。
一个文氏图突出蛋白质中常见调制(p在2D和3D条件下培养ARI抗性细胞值<0.05,FC> 1.5)。上调的蛋白质在最上面;下调的蛋白质放在括号中。b WT和ARI耐药LNCaP细胞中DECR1表达的蛋白质印迹分析。c急性AR抑制48小时后,AR +前列腺癌细胞中DECR1表达的蛋白质印迹分析。d沉默DECR1表达的C4-2细胞的细胞增殖,并用恩杂鲁胺处理(20 µM-48 h)。将细胞计数标准化为未处理的对照(siCTL)。Ë过表达DECR1并用恩杂鲁胺处理的LNCaP细胞的细胞增殖(20 µM-48 h)。将细胞计数标准化为未处理的空载体(EV OE)。f对未进行过激素治疗(LNCaP,VCaP)和去势抵抗性(LNCaP AI,VCaP CR)的肿瘤同种异体移植物中DECR1表达的蛋白质印迹分析。g CRPC组织样品中DECR1表达的免疫组织化学染色(左)和定量(右)。数据表示为治疗后和治疗前活检之间的组织分数差异。比例尺代表100 µm。h使用TCGA数据集显示DECR1 基因组(拷贝数增加或扩增)或mRNA改变(z得分= 1.5)的前列腺癌患者百分比。一世根据TCGA数据集(n = 498)在正常和肿瘤前列腺组织中DECR1的基因表达分析。中心线对应于数据的中位数,框的顶部和底部分别对应于第75个百分点和第25个百分点。晶须延伸到相邻的值(最小和最大数据点不视为异常值)。j使用TCGA数据集根据DECR1表达对前列腺癌患者进行Kaplan–Meier生存分析。b,c,fHSC70用作样品加载控件。d,e数据以平均值+/- SD表示。d,È * p-值<0.05,使用带有Dunnett多重比较检验的1向ANOVA。克使用的Wilcoxon匹配对的符号秩和检验(进行统计分析Ñ = 14)。我用成对ANOVA进行统计分析。Ĵ使用时序检验进行统计分析。源数据作为源数据文件提供。
在这些蛋白质中,与WT LNCaP相比,线粒体2,4-二烯酰基-CoA还原酶DECR1在ARI耐药细胞中始终被上调。DECR1是一种参与多不饱和脂肪酸降解的辅助酶,因此可能对于支持与ARI抗性相关的重新脂质代谢具有重要意义(图 3)。我们首先证实DECR1在ARI耐药细胞中过表达(图 5b)。有趣的是,用任何一种AR抑制剂对多种AR熟练的前列腺癌细胞株进行急性治疗足以调节DECR1表达(图 5c),而DECR1的瞬时沉默增强了enzalutamide在C4-2细胞(一种CRPC的CRPC衍生物)中的作用。 LNCaP(图 5d)。相反,在恩杂鲁胺存在下培养的LNCaP细胞中,DECR1的瞬时过表达略微增加了细胞增殖(图 5e)。
已在DECR1基因25中报道了潜在的AR结合位点,因此我们试图测试AR直接调节DECR1的能力。AR沉默不影响任何LNCaP衍生物中的DECR1蛋白水平(补充图 5a)。类似地,尽管短期雄激素剥夺诱导LNCaP中的DECR1表达,但用二氢睾丸激素(DHT)治疗未显示任何其他作用(补充图 5b)。最后,与野生型和抗ARI的LNCaP相比,DECR1启动子上的AR结合率低,并且与阴性对照H19相比,没有明显富集(补充图 5c)。),表明DECR1可能不是直接的AR目标。
总而言之,这些结果表明DECR1表达可能是对AR抑制的适应性反应的一部分,并促使我们进一步探索该蛋白在CRPC中的作用。
DECR1与CRPC预后不良有关
在体内,在AR割条件(ADT)下生长的LNCaP AI和VCaP CR细胞衍生的AR熟练CRPC同种异体移植物中,DECR1表达被上调(图 5f)。使用免疫组织化学,我们进一步检查了患者对ADT产生抗药性之前和之后进行活检的患者组织微阵列(TMA)上的DECR1蛋白表达。在大多数患者中(14名患者中有9名),复发后DECR1染色增加(阳性组织切片评分)(图 5g)。同样,在Nkx3.1 Pten fl +/- Spry2 fl +/-基因工程小鼠模型(AR驱动的CRPC 26模型)中,去势治疗后持续存在的肿瘤中的DECR1表达也上调。(补充图 5d)。
接下来,我们评估了DECR1在前列腺癌中的临床相关性。在对癌症基因组图谱(TCGA)数据集的计算机分析中,发现在基因和转录本水平上,DECR1表达在前列腺癌中经常失调(图 5h)。前列腺肿瘤样品中的DECR1 mRNA表达水平显着高于正常邻近组织,并且高DECR1表达与患者无病生存期显着降低有关(图 5i,j)。在另一个数据集27中,在从CRPC患者收集的超过70%的转移中观察到了高DECR1表达,与转移部位无关(补充图。 5e)。对第三独立队列28的分析进一步证实,DECR1表达在转移性肿瘤中最高(补充图 5f),并且与转移患者的较差结果强烈相关(补充图 5g)。
DECR1维持CRPC细胞中脂质的稳态
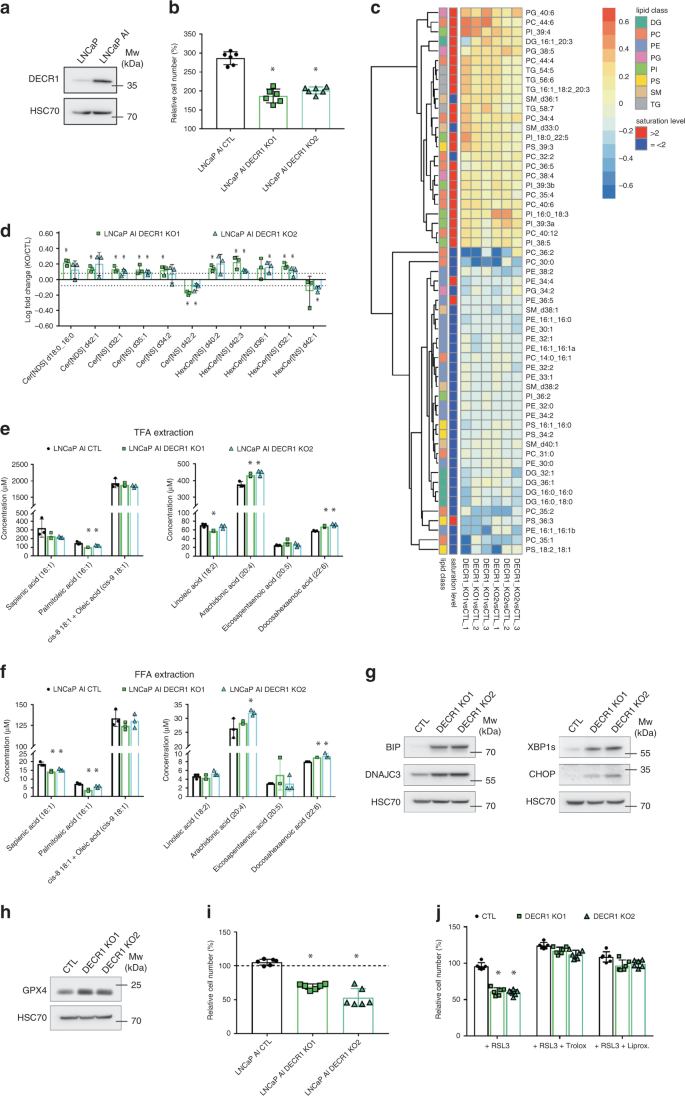
为了评估DECR1在CRPC中的功能影响,我们使用了LNCaP(雄激素响应)和LNCaP-AI(雄激素非依赖)细胞系的同基因对。与亲代LNCaP相比,LNCaP AI细胞显示出更高水平的DECR1蛋白和mRNA水平(图 6a,补充图 6a)。
一个在LNCaP和LNCaP细胞AI表达DECR1的Western印迹分析。b 72小时后,DECR1 KO(敲除)和非靶向对照(CTL)细胞的细胞增殖。在实验开始时将细胞计数标准化为初始细胞数。c与CTL细胞相比(FC> 1.2),DECR1 KO细胞中脂质明显改变的分层聚类。选定的脂质在两个KO细胞中的至少一个中发生了显着变化( 使用双面Student's t检验,p <0.05 )。值表示为log(FC)。d与CTL细胞相比(FC> 1.2),DECR1 KO细胞中神经酰胺(Cer)发生明显改变的稳态水平。选定的脂质在两个KO细胞中的至少一个中发生了显着变化( 使用双面Student's t检验,p <0.05 )。e CTL和DECR1 KO细胞中总MUFA(左图)和总PUFA(右图)的绝对浓度,通过GC-MS定量。f CTL和DECR1 KO细胞中游离MUFA(左图)和游离PUFA(右图)的绝对浓度,通过GC-MS定量。g对DECR1 KO和CTL细胞中BIP,DNAJC3,XBP1s和CHOP表达的蛋白质印迹分析。h在DECR1 KO和CTL细胞中GPX4表达的蛋白质印迹分析。一世用RSL3(10 µM)处理48小时的DECR1 KO和CTL细胞的细胞增殖。将细胞计数标准化为初始细胞数。j用RSL3(10 µM)和Trolox(20 µM)或Liproxstatin(50 nM)处理48 h的DECR1 KO和CTL细胞的细胞增殖。将细胞计数标准化为初始细胞数。a,g,h HSC70用作样品加载对照。b,d,e,f,i,j数据表示为平均值+/- SD。b,e,f,i,j * p-值<0.05,使用带有Dunnett多重比较检验的1向ANOVA。DG:二酰基甘油,PC磷脂酰胆碱,PE磷脂酰乙醇胺,PG磷脂酰甘油,PI磷脂酰肌醇,PS磷脂酰丝氨酸,SM鞘磷脂,TG甘油三酯。源数据作为源数据文件提供。
使用CRISPR-CAS9基因编辑技术,我们删除了LNCaP-AI细胞中的DECR1基因,之后将其称为DECR1 KO细胞(补充图 6b)。DECR1表达的丧失平均损害LNCaP-AI细胞的体外细胞增殖32%(图 6b)。为了评估DECR1缺失对细胞代谢的影响,我们在DECR1 KO和CTL细胞中进行了小极性代谢物的代谢组学分析(补充图 6c)。我们没有观察到TCA循环代谢产物或几种肉碱衍生物的表达有任何显着变化(补充图 6d)。),这可能表明DECR1的丧失不会强烈影响整体β氧化或线粒体代谢。有趣的是,与CTL细胞相比,缺乏DECR1的细胞中的两种糖酵解中间体磷酸二羟丙酮磷酸酯(DHAP)和甘油三磷酸甘油酯(G3P)的含量更低。相比之下,DECR1 KO积累了大量的谷氨酰胺(3.5倍),这可能反映了它们较低的增殖速率;而磷酸乙醇胺(2倍)则是合成磷脂酰乙醇胺(PE)和膜脂(补充图 6c)。对此结果感兴趣,我们决定比较DECR1 KO细胞和CTL细胞之一的脂质分布(图 6c)。)。与受损的PE生物合成相一致,脂质组学分析显示DECR1 KO细胞中几种PE的水平降低。此外,对差异变化的脂质的聚类分析突出显示了不饱和脂质和饱和脂质之间的不平衡,DECR1 KO细胞积累了高水平的高度不饱和脂质(饱和水平> 2),但水平较低,饱和和单不饱和或双不饱和分子(饱和度≤2)(图 6c)。该结果由补充的图6e中改变的磷脂酰胆碱(PC)分子的双重分布所例证 。缺乏DECR1的细胞也显示出高水平的神经酰胺(图 6d),已被证明会扰乱细胞稳态,并且对线粒体功能有害29。为了更好地了解DECR1如何影响脂肪酸(FA)代谢和FA饱和度的变化,我们进一步进行了GC-MS分析,以测量CTL和DECR1 KO细胞的FA组成。与CTL细胞相比,DECR1 KO细胞表现出更高水平的多不饱和脂肪酸(PUFA),尤其是花生四烯酸(AA)和二十二碳六烯酸(DHA),而它们的单不饱和脂肪酸(MUFAs)棕榈油酸(PalA)的水平却降低了)和智人(SA)(图 6e)。虽然已证明MUFA可以抵御氧化应激30,但PUFA的细胞蓄积会导致脂质过氧化和诱导铁减少症31。PUFA诱导的毒性主要来自游离PUFA的积累。因此,我们还比较了不同条件之间的游离FA的细胞内池。类似于对总FA的分析,我们发现DECR1 KO细胞表现出水平的游离PUFA(DHA和AA,尽管后者仅对其中一个KO克隆才有意义)和水平下降的游离MUFA(PalA和SA)(图 6f)。FA组成的这种变化与FA合成的差异无关(补充图 6f)。最后,缺乏DECR1的细胞对棕榈酸(一种饱和脂肪酸)的敏感性不及CTL(补充图 6h)。),棕榈酸酯处理能够消除DECR1依赖性的细胞增殖减少(补充图 6i)。
DECR1的丢失使CRPC细胞易患肥大症
增加的多不饱和脂质含量还可以增加对脂质过氧化的敏感性,并引发肥大症。与这个想法一致,DECR1的缺失导致ER伴侣BIP和DNAJC3的表达增加,并导致未折叠的蛋白质反应的激活,这一过程与脂质体内稳态受损有关,如CHOP的强烈上调所证明和XBP1的剪接同工型(图 6g)。DECR1 KO细胞还显示出脂质解毒酶谷胱甘肽过氧化物酶4(GPX4)32的水平升高(图 6h)。因此,我们用RSL3(一种特定的GPX4抑制剂)处理了CTL和DECR1 KO细胞,以诱导肥大症。DECR1 KO细胞显示出对GPX4抑制的敏感性增加(图 6i,补充图 6g)。与Trolox或liproxstatin(两种受铁素化抑制剂)共同处理能够在RSL3处理下拯救细胞增殖并恢复DECR1 KO细胞的细胞形态(图 6j,补充图 6g)。综上所述,这些结果表明DECR1以脂质依赖性方式在调节氧化还原稳态中的作用。
DECR1表达是体内CRPC肿瘤生长所必需的
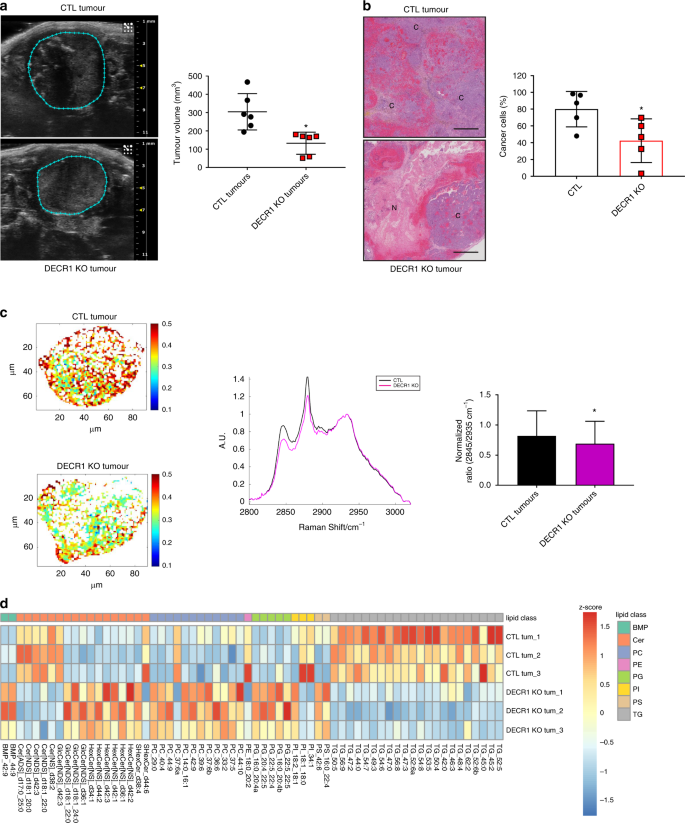
与LNCaP相反,当将LNCaP-AI细胞原位注射到cast割的小鼠的前列腺中时,它们会形成实体瘤。因此,我们检查了减少的DECR1表达对体内CRPC肿瘤生长的影响。沉默DECR1会损害去势小鼠的肿瘤生长,平均使肿瘤体积平均降低41%(通过超声检查评估;图 7a)。此外,DECR1 KO肿瘤是高度坏死的并且显示出比对照肿瘤更低的细胞水平(图 7b)。
a通过超声成像监测的LNCaP AI CTL(上图)或DECR1 KO(下图)肿瘤异体移植的代表性图片(左)。使用超声检查量化肿瘤体积(右)。b在来自LNCaP AI CTL(顶部)或DECR1 KO(底部)细胞的同种异体移植物上苏木精/曙红染色的代表性图片。C =癌细胞,N =坏死区域。量化癌细胞比例(右)。比例尺代表1000 µm。c关于使用532 nm激发的拉曼光谱数据的代表性热图(频率2845 cm -1处的强度/频率2935 cm -1处的强度)在LNCaP AI CTL(上)和DECR1 KO(下)衍生的同种异体移植物上(左)。LNCaP AI CTL(灰色)或DECR1 KO(品红色)同种异体移植物(中)的平均拉曼光谱,并使用2845 cm -1 -peak(右图)对肿瘤脂质含量进行定量。AU =任意单位。d热图说明了与CTL肿瘤相比,DECR1缺乏的肿瘤中脂类的稳定调节水平(FC> 1.5,p <0.05,采用两尾学生t检验)。值表示为z -score。a – c数据以平均值+/- SD表示。a – c * p使用两尾曼-惠特尼U检验,值<0.05 。BMP双(单酰基甘油)磷酸酯,神经酰胺,PC磷脂酰胆碱,PE磷脂酰乙醇胺,PG磷脂酰甘油,PI磷脂酰肌醇,PS磷脂酰丝氨酸,TG甘油三酸酯。源数据作为源数据文件提供。
在肿瘤切片上进行拉曼光谱分析,以测试DECR1表达的缺失是否干扰了脂质和胆固醇基化合物的肿瘤内含量。拉曼光谱法是一种无损无标记的分析技术,可以提供丰富的分子特异性信息,而无需分离所研究的特定分子。可以从它们的特定振动中识别出分子的混合物,特别是脂质具有高拉曼横截面,使其成为通过该技术进行研究的理想候选者。脂质相关分子通过带在2845厘米表示-1,而胆固醇含量通过的带围绕2880厘米证明-1 33。针对DECR1 KO肿瘤获得的拉曼光谱显示,在2845 cm -1(脂质)和2880 cm -1(胆固醇)处的条带强度降低,表明与对照肿瘤相比,缺乏DECR1的肿瘤脂质和胆固醇化合物水平降低(图。 7C)。最后,对冷冻肿瘤进行的LC-MS脂质组学证实了来自拉曼光谱的数据。DECR1 KO肿瘤表现出几种高度丰富的甘油三酸酯种类的明显减少,这占总脂质含量的很大比例(图 7d)。而且,类似于在体外观察到的,DECR1 KO肿瘤显示出几种神经酰胺和多种多不饱和磷脂的增加(图 7d)。
讨论区
尽管在过去的五十多年中,AR一直是激素治疗的主要目标,但AR仍然是前列腺癌发展为CRPC的主要驱动力。选择性ARI在改善CRPC患者生存方面的最新临床成功进一步增强了雄激素受体作为治疗靶标的重要性。然而,对AR靶向疗法的长期耐药性不可避免地导致肿瘤复发,因此,更好地理解治疗耐药性的分子机制代表了迫切的临床需求和首要研究课题。
癌细胞已经开发出多种逃避AR导向靶向的方法。虽然已经报道了AR丢失34或旁路手术17的情况,但有力的证据表明,大多数CRPC患者35仍在激活AR信号。随着采集点突变的12,13,14,AR基因扩增以及在mRNA过度表达和蛋白水平36已经通过激活AR依赖性和独立的途径建议支持enzalutamide电阻37,38。与这些报道一致,我们发现AR信号在对比卡鲁胺,阿帕鲁胺和恩杂鲁胺具有抗性的细胞中保持高活性。AR转录重编程由AR核定位和规范AR靶标(即KLK3和FKBP5)的不同表达水平证明。
抗ARI的细胞的新陈代谢随着葡萄糖消耗的增加而改变。为支持我们的研究结果,葡萄糖代谢增加与晚期CRPC 20相关,与enzalutamide治疗协同作用的糖酵解抑制作用39。我们最初认为此代谢重排的电位驱动器可以是主代谢传感器AMPK,这已在enzalutamide电阻的上下文中被提出作为一个目标24,40。然而,尽管抗ARI的细胞确实显示出增加的AMPK表达,但该蛋白的沉默仅适度影响了葡萄糖的利用。相反,AR沉默显着降低了耐药细胞中的葡萄糖通量,表明这种代谢重编程取决于AR本身。AR是前列腺细胞代谢的重要调节剂18。在一项出色的研究中,Massie及其同事证明了AR可以通过激活关键生物合成酶(例如HK1,HK2,ACC和FASN)的转录,在雄激素刺激的条件下直接调节有氧糖酵解和葡萄糖衍生的合成代谢。有趣的是,追踪13C-葡萄糖掺入脂肪酸表明在耐ARI的细胞中观察到较高的葡萄糖氧化速率有助于增强从头脂肪酸合成。除了降低葡萄糖通量外,这些细胞中的AR沉默还导致脂肪酶ACLY和ACC选择性下调。因此,在抗ARI的LNCaP细胞中观察到的代谢表型与在DHT激活的LNCaP 18中观察到的代谢表型高度相似,因此代表了具有治疗潜力的代谢脆弱性。与这个想法相一致,线粒体丙酮酸载体的药理学抑制作用最近已被证实能特别削弱AR驱动的肿瘤生长41。
除葡萄糖代谢外,我们的蛋白质组学分析还显示许多线粒体蛋白在耐药细胞中过表达。在ARI抗性细胞中观察到的代谢重排最终导致了这些细胞的脂质组的重要重组,其特征是多不饱和甘油三酸酯和鞘脂的大量积累。因此,尽管线粒体对ARI耐药性的影响尚待充分检验,但我们可以假设,需要通过柠檬酸和乙酰辅酶A的产生来支持FA和脂质合成,从而增加耐药细胞中线粒体代谢,以支持FA和脂质的合成,并进行调节脂质稳态,例如通过增加β-氧化。ARI抗性细胞中,与线粒体代谢和脂质稳态有关的几种转录因子(如PGC1α,PPARγ和LXR)的高表达进一步支持了这一假设。脂质合成和脂肪酸降解都是前列腺癌中高度失调的过程20,并且这些途径已经激烈药物开发的主题 42,43。一方面,靶向从头参与脂质合成的酶(例如ACLY 44或FASN)是一项积极的研究重点,目前已开始进行2期临床试验 42。在另一方面,脂肪酸氧化(FAO)可促进胁迫条件下癌细胞存活 45,46和药理学抑制该途径在多种癌症证明是有效的 47,48。在前列腺中,已证明增加的β-氧化作用可促进前列腺癌细胞的存活 49而抑制脂质分解代谢,通过药理学抑制或沉默CPT1A,实现降低肿瘤的生长和恢复enzalutamide灵敏度50,51。
最后,我们的蛋白质组学分析强调了DECR1是β氧化的辅助酶,它与ARI抗性密切相关。另外,抗ARI的细胞系的特征是参与脂质代谢的多种代谢酶(DECR2,ACSL1,HIBCH,HIBADH等)水平高。因此,我们推测DECR1在对AR抑制的抗性中过表达,这是适应性反应的一部分,该适应性反应可使抗性细胞应对其重新连接的脂质代谢。先前已在蛋白质组学分析中检测到了较高的DECR1表达,将局部前列腺肿瘤与非恶性病变进行了比较52或在转移性标本中与局部肿瘤进行了比较53。除此之外,我们证明了DECR1在原发性和转移性前列腺癌中的高表达与不良的患者生存结果相关。短期ARI治疗或雄激素戒断可在前列腺细胞系中诱导DECR1表达,而长期ADT治疗在患者和荷瘤小鼠中会导致该蛋白强烈上调。但是,前列腺细胞中DECR1的水平不受AR沉默或DHT处理的影响,这表明DECR1可能是对AR抑制的长期而非急性反应的一部分。需要进一步的研究来了解在CRPC开发过程中参与DECR1调控的机制。
DECR1是一种线粒体酶,参与β氧化的辅助途径,并在进入线粒体内的降解循环中严格调节PUFA。迄今为止,尚未充分研究DECR1在癌症中的作用。与我们的数据相反,DECR1被提议在HER2阳性乳腺癌中起抑癌作用54。但是,在同一研究中,DECR1的过表达还显示可以保护癌细胞免受葡萄糖戒断诱导的细胞凋亡。有趣的是,Decr1 -/-小鼠在代谢应激条件下发展为低血糖症55,表明DECR1与葡萄糖代谢之间存在联系。我们还观察到DECR1缺失细胞中糖酵解中间体DHAP和G3P的水平降低(补充图。 6c)。但是,Decr1-/-小鼠中描述的主要表型是脂肪酸平衡的紊乱,Decr1 -/-小鼠表现出肝脏三酰甘油55形式的不饱和脂肪酸的积累。因此,在CRPC的背景下,一个有吸引力的假设是DECR1介导的脂质重排对于支持ARI抗性细胞及其相关应激刺激(例如氧化还原应激)的重新代谢是必需的。与在Decr1中观察到的类似-/-小鼠,我们能够证明DECR1是CRPC中脂质稳态的关键条件。实际上,与对照细胞相比,DECR1 KO细胞积累了高水平的多不饱和脂质和低水平的饱和脂质。该观察结果得到了总的和游离的PUFA的积累以及几种MUFA的减少的进一步支持,例如最近报道的MUFA sapienate 56在缺乏DECR1的细胞中。有趣的是,我们没有观察到高度丰富的MUFA油酸(18:1)的水平有任何变化。因为DECR1主要作用于PUFA;该结果表明PUFA组成而不是MUFA的改变可能在更大程度上有助于DECR1 KO表型的产生。这种不平衡反过来又导致了ER应激反应途径的激活和对脂质过氧化作用的敏感性增加,这由观察到的对GPX4抑制作用的敏感性增加所证明。PUFA的积累会增加脂质过氧化和细胞死亡的风险31,最近有人提出药理抑制作用GPX4是一种重要的脂质解毒酶,是抗药性肿瘤中一种有希望的治疗策略32。此外,特定的PUFA衍生介体,例如专业的亲解析介体,由于其抗肿瘤特性,最近引起了人们的关注57。因此,通过调节脂质饱和水平,DECR1可能以多种方式支持癌细胞的存活。最后,在膜脂饱和度的变化是已知的导致内质网应激58,59,有趣的是,DECR1已被报道的DnaK,细菌热休克蛋白70伴侣的同源物的强相互作用配偶60。综上所述,这些结果表明DECR1可能有助于增加应激条件下癌细胞的代谢灵活性,并揭示DECR1功能与ER稳态之间的意外联系。
总之,我们的数据表明,尽管可用的AR靶向疗法存在差异,但去势抵抗性前列腺癌细胞会响应AR抑制而产生共享的代谢表型。除了可直接靶向外,这些代谢适应还与一组特定的蛋白质(如DECR1)的出现有关,这些蛋白质可以用作临床上相关的生物标志物和/或治疗靶标。这些发现支持了结合AR抑制作用靶向特定代谢途径的想法,并为未来疗法的发展打开了大门。
方法
2D和3D细胞培养
所有细胞均在补充了10%胎牛血清(FBS,Gibco,Thermo Fisher Scientific,沃尔玛,马萨诸塞州)和2 mM谷氨酰胺(Gibco,Thermo Fisher)的RPMI(Gibco,赛默飞世尔科技,马萨诸塞州,美国)培养基中培养。 Fisher Scientific,美国马萨诸塞州沃尔瑟姆),并在5%CO 2下保持37°C。LNCaP(ATCC CRL-1740)和C4-2细胞(ATCC CRL3314)从ATCC获得。CWR22Res细胞(CWR22细胞的激素反应型)获自美国俄亥俄州克利夫兰的凯斯西储大学。通过分别用10 µM比卡鲁胺(Sigma Aldrich,美国密歇根州圣路易斯市,Sigma Aldrich)对LNCaP细胞进行慢性处理,产生了耐比卡鲁胺和耐苯甲酰胺类的LNCaP衍生物(LNCaP Bicalut。Res。和LNCaP Enzalut。Res。)。 enzalutamide(Selleckchem,慕尼黑,德国)持续4个月,直到非克隆的存活细胞群体繁殖。对于耐阿普鲁胺的LNCaP细胞系(LNCaP Apalut.Res。),使细胞在10μM阿普鲁胺(ARN509,Selleckchem,慕尼黑,德国)中如上所述生长,并扩增存活细胞的克隆群。
LNCaP-AI细胞维持在无酚的RPMI(Gibco,Thermo Fisher Scientific,沃尔瑟姆,美国马萨诸塞州)中,并补充有10%的木炭剥离的血清(Gibco,Thermo Fisher Scientific,沃尔瑟姆,美国马萨诸塞州)和2 mM谷氨酰胺。
对于3D培养,将细胞悬浮在100%Matrigel(美国纽约州康宁)中,并接种在6孔板中。使Matrigel在37°C下固化15分钟,然后完全覆盖3 ml培养基。在每次实验前,使细胞生长五代。对于每次传代,将Matrigel机械破坏,将类器官以300x g轻轻离心5分钟。将类器官沉淀用PBS洗涤两次,最后将1/4重悬浮在100%Matrigel中。
蛋白质组学分析
将6–8×10 5个细胞接种在6孔板中,并使其附着过夜。第二天,将培养基替换为新鲜的RPMI,并使细胞再生长48小时。然后将细胞用PBS洗涤并在8M尿素中裂解。在室温下,使用55 mM碘乙酰胺将还原的蛋白质烷基化1小时。然后将烷基化的蛋白质用内蛋白酶Lys-C(Alpha Laboratories,英国伊斯特利,英国)于35°C进行两步消化1小时,然后用胰蛋白酶(Promega,麦迪逊,威斯康星州,美国)消化过夜。
使用StageTip 61将消化的肽脱盐,并通过在与Orbitrap Velos质谱仪(Thermo Fisher Scientific,Waltham,MA)相连的EASY-nLC II(Thermo Fisher Scientific,Waltham,MA)上进行纳米级C18反相液相色谱分离。 , 美国)。使用二元梯度用水(缓冲液A)和80%乙腈(缓冲液B)进行洗脱,两者均含有0.1%的甲酸。使用内部装有ReproSil-Pur C 18的20 cm熔融石英发射器(New Objective),以200 nl min -1的流速分离肽混合物。-AQ,1.9μm树脂(Dr. Maisch GmbH)。通过集成在纳米电喷雾离子源(Sonation,Biberach,Germany)中的柱箱将填充的发射器保持在35°C。使用的梯度从缓冲液B的2%开始,以相同的百分比保持5分钟,然后在90分钟内增加到30%,然后在15分钟内增加到60%。最后,进行柱洗,在5分钟内升至B的80%,然后在1分钟内升至95%的B,然后在2%B的条件下进行13分钟的重新平衡,总持续时间为129分钟。洗脱的肽溶液通过纳米电喷雾离子源(Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,美国)自动(在线)电喷雾到质谱仪中。有源背景离子减少装置(ABIRD,ESI Source Solutions,美国马萨诸塞州沃本)用于减少环境污染物信号水平。
使用2.4 kV的喷涂电压和200°C的离子转移管温度,在线性阱四极杆-Orbitrap Velos质谱仪上采集样品。质谱仪以阳离子模式运行,并以数据依赖的采集模式(DDA)使用。以1,000,000离子的目标值获得了全扫描(FT-MS),分辨率为R =在350–1600 amu的质量范围内为60,000。使用碰撞诱导离解(CID),使用最大注入时间为25 ms或目标离子为5000离子,选择前十个最强离子在线性离子阱中进行裂解。通过2 amu窗口从强度大于5000个计数的2到5个电荷中选择带电荷的离子,并使用36的归一化碰撞能量将其破碎10 ms。动态排除了为MS / MS选择的前目标离子25秒钟。
MS Raw文件使用MaxQuant软件62版本1.5.5.1 处理,并使用Andromeda搜索引擎63搜索,查询UniProt 64 Homo sapiens(2016年9月9日; 92,939个条目)。搜索该数据库需要胰蛋白酶切割的特异性,并允许最多两次错过的切割。甲硫氨酸氧化和N-末端乙酰化被指定为可变修饰,半胱氨酸氨基甲酰甲基化被指定为固定修饰。肽,蛋白质和位点错误发现率(FDR)设置为1%。根据MaxQuant 65中可用的无标记定量算法对蛋白质进行定量。使用Perseus软件1.5.5.3版进一步处理和分析了MaxQuant输出66。消除了常见的反向击中和污染击中(在MaxQuant输出中定义)。仅将鉴定出至少一种独特分配的肽的蛋白质组用于分析。使用具有5%FDR 的双向t检验分析选择了显着富集的蛋白质。
代谢组学分析
将6–8×10 5个细胞接种在6孔板中,并使其附着过夜。第二天,将培养基替换为新鲜的RPMI培养基,并使细胞再生长48小时。对于示踪实验,将细胞在补充有10%FBS和10 mM 13 C-葡萄糖(CLM-1396,英国剑桥同位素实验室,英国)的无葡萄糖RPMI(Gibco,赛默飞世尔科技,沃尔瑟姆,马萨诸塞州)中进一步孵育。去提取。然后将细胞用冰冷的PBS洗涤两次,并将极性代谢物在MetOH-乙腈-H 2 O(50-30-20)缓冲液中在缓慢搅拌下萃取5分钟。将收集的上清液剧烈混合10分钟,然后以16,100× g离心再过十分钟。所有步骤均在4°C下进行。最后,将上清液转移到玻璃HPLC小瓶(Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,美国)中,并使用HPLC-MS分析。
根据参考分析样品。67,68。AQ Exactive Orbitrap质谱仪(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)与Thermo Ultimate 3000 HPLC系统一起使用。HPLC设置包括ZIC-pHILIC色谱柱(SeQuant,150×2.1 mm,5 µm,Merck KGaA,德国达姆施塔特)和ZIC-pHILIC保护柱(SeQuant,20×2.1 mm),初始流动相为20%20 mM碳酸铵,pH 9.2,和80%乙腈。注入细胞和培养基提取物(5 µl),并在15分钟的流动相梯度中分离代谢产物,以200μlmin -1的流速将乙腈含量降低至20%。柱温为45°C。总分析时间为25分钟。使用Q Exactive 质谱仪在质量范围为75–1000 m / z的条件下检测到所有代谢物, 分辨率为35,000(在200 m / z时),并通过电喷雾电离(ESI)和极性切换来启用正离子和负离子在同一轮中确定。使用锁定质量,所有代谢物的质量准确度均低于5 ppm。用Thermo Xcalibur软件获取数据。
使用Thermo TraceFinder 4.0软件确定不同代谢物的峰面积,其中通过单电荷离子的准确质量和HPLC色谱柱上的已知保留时间来鉴定代谢物。先前已使用pHILIC色谱柱在此LC-MS系统上分析了检测到的所有代谢物的商业标准品。的13个 Ç标记模式是通过测量峰面积为许多代谢物的每一个同位素的精确质量确定。在实验结束时通过BCA分析(Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,美国),将细胞内代谢物标准化为细胞的蛋白质含量。
血脂分析
除去培养基后,用0.8 ml 1:1丁醇-甲醇从细胞中提取脂质。提取前,将内标(Splash Lipidomix,Avanti Polar Lipids,阿拉巴马州,美国)添加到提取缓冲液中,并进一步用作质量控制。在维持在60°C的Acquity UPLC CSH C18色谱柱(100×2.1 mm; 1.7 µm)(Waters corporation,Milford,MA,USA)上分离脂质。流动相由60:40 ACN:H 2组成O与10 mM甲酸铵,0.1%甲酸和5 µM磷酸(A)以及90:10 IPA:ACN与10 mM甲酸铵,0.1%甲酸和5 µM磷酸(B)。梯度如下:0–2分钟30%(B);2-8分钟50%(B);8–15分钟99%(B),15–16分钟99%(B),16–17分钟30%(B)。在自动进样器中将样品温度保持在6°C,并注入2 µl样品。
极性和非极性脂质的分析使用LC-MS系统进行,其中包括Ultimate 3000 HPLC(Thermo Fisher Scientific,美国麻萨诸塞州沃尔瑟姆)和Q-Exactive Orbitrap质谱仪(Thermo Fisher Scientific,美国麻萨诸塞州沃尔瑟姆,美国)。Q-Exactive Orbitrap MS仪器可使用以下参数进行正极和负极操作:质量范围240-1200 m / z(正)和240-1600(负),喷雾电压3.8 kV(ESI +)和3 kV( ESI-),鞘气(氮气)流量60单位,辅助气(氮气)流量25单位,毛细管温度(320°C),全扫描MS1质量分辨能力70,000。每个极性的数据相关碎片(dd-MS / MS)参数如下:TopN:10,分辨率17,500单位,最大进样时间:25 ms,自动增益控制目标:5e5和归一化碰撞能量为20和25(任意单位)的正极性。TopN:5,分辨率17,500单位,最大进样时间:80毫秒自动增益控制目标:5e 5,负极性的归一化碰撞能量为20和30(任意单位)。使用ESI正负校准溶液(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)将仪器外部校准至<1 ppm。使用Compound Discoverer 3.0(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)处理来自Raw数据的峰检测和积分。文件是使用MSConvert软件也转换为MGF格式,并使用LipiDex软件进行检索针对LipidBlast数据库MS2文件69,70,71。将峰强度标准化为细胞数。使用pHeatmap软件包(v.1.0.12,https ://CRAN.R-project.org/package=pheatmap)在R(v.3.6.1,https ://www.R-project.org )中生成热图。 。
完全和游离脂肪酸提取和GC-MS
根据参考文献进行代谢物淬灭和提取。72,73,74。每个步骤均在干冰和湿冰的混合物中进行。简而言之,用800 µl冷的62.5%甲醇提取先前在液氮中淬灭的细胞板。为了测量游离脂肪酸,每个样品合并两个孔。用移液管吸头刮下细胞,并转移至Eppendorf管中。因此,含有10 µg ml -1的 500 µl冷氯仿加入C17内标物,并将样品在4℃涡旋10分钟。通过在4°C下离心10分钟实现相分离,然后将氯仿相(含脂肪酸的下层相),极性代谢物相和蛋白质布局分离,并在4°C下用真空浓缩器干燥过夜。最终浓度为2 µM至800 µM的标准曲线也被提取出来,用于定量游离脂肪酸和总脂肪酸。
总脂肪酸样品和标准品在500°C下用500 µl 2%硫酸的甲醇溶液酯化过夜,而游离脂肪酸样品和标准品在室温下酯化15分钟。然后通过加入600 µl己烷和100 µl饱和NaCl提取游离脂肪酸和总脂肪酸。将样品离心5分钟,分离出己烷相,并用真空浓缩仪干燥。将样品和标准品重悬于50 µl己烷中。
脂肪酸通过气相色谱法(8860 GC系统,美国加利福尼亚州安捷伦科技公司)与质谱(5977B惰性MS系统,美国加利福尼亚州安捷伦科技公司)相分离。将每种样品一微升以270°C的进样温度(无分流模式)注入DB-FASTFAME色谱柱(30 m×0.250 mm)。氦气用作载气,流速为1 ml min -1。为了分离脂肪酸,将初始梯度温度设置为50°C 1分钟,然后以12°C min -1的升温速率升高到180°C,然后以1°C min -1的升温速率升高。达到200°C。最后,将最终梯度温度设置为230°C,升温速率为5°C min -12分钟 四极杆和离子源的温度分别设置为150°C和230°C。MS系统在70 eV的电子冲击电离下运行,质量范围为100–600 amu。通过GC-MS采集后,使用内部Matlab M文件提取质量分布矢量,积分原始离子色谱图,并通过自然同位素丰度75通过同位素同位素分布进行校正。为了定量游离脂肪酸和总脂肪酸,将总离子计数标准化为内标(C17)和细胞提取物的蛋白质含量。
测定13 C脂肪酸和GC-MS
将6–8×10 5接种在6孔板中,并放置过夜。第二天,更换培养基,并将细胞在补充有10%FBS,2 mM谷氨酰胺和10 mM 13 C-葡萄糖(CLM-1396 )的无葡萄糖RPMI(Gibco,Thermo Fisher Scientific,Waltham,MA,USA)中孵育(英国剑桥同位素实验室)再提取72小时。然后将细胞用冰冷的PBS洗涤3次,并在甲醇-氯仿-PBS缓冲液(750 µl 1:1 v / v PBS:甲醇和500 µl氯仿)中提取脂肪酸。对于所有样品,分别取50 µl 1 mg ml -1的甲醇丁基化羟基甲苯(BHT,Sigma Aldrich,美国密西根州圣路易斯)和20 µl 0.05 mg ml -1添加了17:0 PC(Avanti Polar Lipids,Albster,AL,美国)作为内标。将样品以10,000x g离心5分钟,然后萃取下层氯仿层并在N 2下干燥。将样品在90 µl氯仿中重构,并与10 µl MethPrepII(Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,美国)在室温下孵育20分钟。
使用与Phenomenex ZB-1701色谱柱(30 m×0.25 mm×0.25μm)结合的7000三重四极杆GC-MS系统的Agilent 7890B GC系统分析脂肪酸甲酯(FAME)。将45°C的初始温度设置为在9°C min -1升高5分钟,然后在240°C min -1保持11.5分钟,直到最终温度280°C min -1,保持2分钟。该仪器以50 eV的电子冲击模式在脉冲不分流模式下运行,并使用已知标准品积分质量离子以进行定量,以生成标准曲线。棕榈酸,硬脂酸和油酸峰面积使用质荷比(m / z)分别为270、298和296。在使用内部算法进行自然丰度同位素校正之前,使用Mass Hunter B.06.00软件(Agilent)来量化同位素异构体峰面积。
生物信息学分析
基因表达数据可从TCGA和GEO网站下载。使用每个基因探针的平均值,对TCGA RNASeqV2数据进行对数转换,对GSE21034数据进行对数转换。根据样品类型对表达值进行分组,并使用matlab常规箱形图绘制组分布图,其中的条形图表示中位数,该框从25%到75%百分位,而晶须跨度2.7 \ sigma。超出该范围的异常值以红色表示。使用整体方差分析测量两组之间的显着差异。
为了进行生存分析,将人类样品(不包括细胞系)的基因表达数据像以前一样进行标准化,以均值为中心,并使用k均值分为三组。使用matlab常规kmplot绘制各组的Kaplan–Meier生存曲线。
人类前列腺癌移植
根据ARRIVE指南76并由当地道德委员会根据项目执照P5EE22AEE进行体内异体移植实验,完全遵守英国内政部的规定(《 1986年英国动物(科学程序)法》)。简而言之,20×10 6将细胞/小鼠悬浮在无血清培养基中,并与Matrigel(Corning,NY,USA)以1:1的比例混合。将50 µl细胞悬液原位注入CD1裸鼠的前列腺前叶(Charles River Laboratories,威尔明顿,马萨诸塞州,美国)。注射时进行了睾丸切除术。注射后允许肿瘤生长约6周,并使用Vevo3100超声成像系统(Fujifilm Visualsonics,荷兰)每周监测肿瘤生长。实验结束时,将过量的CO 2安乐死小鼠并收集肿瘤。将肿瘤材料进一步固定在10%福尔马林中以进行组织学检查或在液氮中速冻。
拉曼光谱分析
在配备有532 nm Nd:YAG激光,最大功率为500 mW,1800 l mm -1光栅和尼康NIR Apo 60×/ 1.0 NA水浸物镜的Renishaw inVia Raman显微镜上获得拉曼光谱。在拉曼测量之前,立即在二甲苯(2×15分钟),100%乙醇(5分钟),95%EtOH(5分钟)和90%EtOH(5分钟)中对组织切片进行脱蜡。使用水浸物镜绘制组织切片,x和y的步长为100 µm,采集时间为1 s,激光功率为100%,光谱中心为3000 cm -1。
使用软件中的内置功能,使用Renishaw Wire 4.1进行基本的预处理步骤。除去宇宙射线,然后减去基线。使用内置的基线减法智能拟合函数(将11阶多项式拟合且噪声容限设置为1.50,将其应用于整个光谱数据集)减去基线。然后使用自定义MATLAB®脚本进行进一步分析。使用阈值函数消除离群光谱(由于饱和或荧光导致的高强度)。光谱被切成2800至3020 cm -1之间。然后根据图谱的总光谱强度选择组织区域,并提取所有相关光谱,并按最小-最大比例进行比较。每个组织图的光谱数据集都经过了进一步的质量控制步骤;首先,排除总光谱强度小于60,000的光谱,然后以均值的一个标准偏差除去光谱。将光谱按比例缩放到2933 cm -1处的峰,并合并所有CTL和DECR1 KO样品的光谱数据集,并绘制每种条件的平均值进行比较。对于每个光谱数据点,确定在2845和2935cm -1处的峰强度的比率,以及在2880和2935cm -1处的峰强度的比率。。这些值用于创建条形图,描绘GraphPad Prism 7中的平均值和标准偏差值。GraphPad Prism 7用于执行Mann-Whitney测试,以比较每个比率的CTL和DECR1 KO。
患者材料和免疫组化
这项研究得到了苏格兰西部研究伦理委员会的批准(05 / S0704 / 94)。所有受试者均获得知情同意,并且所有实验均符合《赫尔辛基WMA宣言》和卫生与公共服务部Belmont报告中规定的原则。
对DECR1的免疫组织化学(IHC)染色是在4 µm福尔马林固定石蜡包埋的切片上进行的,该切片先前已在60°C下孵育2 h。IHC染色是在Agilent Autostainer链接48(美国加利福尼亚州圣克拉拉,安捷伦)上进行的。
这些部分经过二甲苯,分级酒精的手动脱蜡,然后在经历热诱导的表位修复(HIER)之前在自来水中洗涤。在Agilent PT模块上进行HIER,其中将4 µm切片在PT模块1缓冲液(美国马萨诸塞州沃尔瑟姆市的Thermo Fisher Scientific)中加热到98°C,持续25分钟。表位取回后,将切片用Tween(Tbt)在Tris缓冲盐水中冲洗,然后装载到自动染色仪上。然后对切片进行过氧化物酶封闭(Agilent,美国加利福尼亚州圣克拉拉),在以1/1000稀释度应用DECR1抗体(Abcam,英国剑桥)之前,先在Tbt中洗涤40分钟。然后将切片在Tbt中清洗,然后再应用兔EnVision(美国加利福尼亚州圣克拉拉的安捷伦公司)二抗35分钟。在使用Liquid DAB(Agilent,Santa Clara,CA,美国)持续10分钟。然后将切片在水中洗涤,用苏木精复染并使用DPX(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆)安装。
siRNA转染
将细胞接种在6孔板中以达到70%汇合,并使其附着过夜。针对AMPKa(L-005027-00),AR(L-003400-00),DECR1(L-009642-00-005)以及非靶向siRNA的ON-TARGETplus smartpool siRNA(D-001810-01-20 )购自Dharmacon(Dharmacon,Horizon启发式细胞解决方案,英国剑桥)。DECR1过表达质粒购自Origene(RC211257,Cambridge Bioscience,Cambridge,UK)。根据制造商的方案,使用Lipofectamine RNAimax(Invitrogen,Thermo Fisher Scientific,Waltham,MA,USA)进行转染。
产生DECR1稳定的KO细胞
使用CRISPR CAS9基因编辑技术进行DECR1缺失。简要地,根据制造商的说明,使用核转染器(Amaxa Biosystems,Lonza,Basel,Switzerland),用市售的DECR1 KO或CTL质粒(Santa Cruz Technologies,Dallas,TX,USA)转染1×10 6细胞。然后在嘌呤霉素(1 µg ml -1)(美国密歇根州圣路易斯,西格玛奥德里奇)的存在下培养细胞,以进行克隆选择。使用蛋白质印迹证实了最终敲除该蛋白质。
细胞增殖
将6–8×10 5个细胞接种在6孔板中,并使其附着16小时。第二天,直接用胰蛋白酶(T0)收获细胞或使其生长48或72 h。然后收集细胞,将其悬浮在确定体积的含血清培养基中,并使用CASY细胞计数器(Roche,巴塞尔,瑞士)进行计数。将最终细胞数标准化为在T0获得的初始细胞数。
qPCR分析
使用带有柱上DNase消化(RNase-free DNase Set,Qiagen,Hilden,德国)的RNeasy Mini Kit(Qiagen,Hilden,德国)从细胞中提取RNA(70-80%汇合)。使用高容量cDNA反转录试剂盒(Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆),从4 µg RNA中制备cDNA。使用TaqMan Universal Master Mix(Thermo Fisher Scientific,Waltham,MA,USA)和适合引物的Universal ProbeLibrary探针(Roche,Basel,Switzerland)和ABI 7500 FAST qPCR系统(Thermo Fisher Scientific,Waltham,USA)进行实时PCR。美国马萨诸塞州)。将基因表达相对于参考CASC3基因标准化,并相对于对照细胞中的水平显示。补充表中提供了本研究中使用的引物列表(Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州)。 1。
免疫印迹
细胞或压碎的冷冻肿瘤组织在SDS缓冲液(1%的SDS中添加了蛋白酶和磷酸酶抑制剂)中裂解,并使用BCA蛋白测定试剂盒(Thermo Fisher Scientific,Waltham,MA,美国)测定蛋白浓度。然后将20微克蛋白质上样到4–12%梯度SDS-PAGE凝胶(Invitrogen,Thermo Fisher Scientific,沃尔瑟姆,马萨诸塞州,美国)上并转移到PVDF膜上(GE Healthcare,芝加哥,伊利诺伊州,美国)。将膜在5%牛奶TBST中封闭1小时,并用一抗探测过夜(请参见补充表 2))用5%BSA-TBST稀释。然后将膜用TBST洗涤3次,与分别稀释在5%牛奶-TBST中的HRP偶联的二抗孵育,再用TBST洗涤3次,并使用ECL试剂盒(GE Healthcare,芝加哥,伊利诺伊州,美国)显示。在MyECL机器(美国马萨诸塞州沃尔瑟姆市的Thermo Fisher Scientific)上采集图像。
免疫荧光
将细胞接种在24孔板的盖玻片上,以达到50%融合度,并使其附着过夜。接下来将细胞固定在冰冷的甲醇/丙酮缓冲液中,用PBS-Tween洗涤3次,在PBS / BSA(5%)溶液中封闭30分钟,并用一抗探测过夜(anti AR,sc-816,Santa美国德克萨斯州达拉斯的克鲁兹技术公司)。第二天,将盖玻片用PBS-Tween洗涤3次,与荧光团偶联的二抗(Abcam,Cambridge,UK)孵育,再用PBS洗涤3次。使用Diamond Prolong和DAPI(美国马萨诸塞州沃尔瑟姆市的Thermo Fisher Scientific公司)安装盖玻片。照片是在尼康A1R共焦显微镜上拍摄的(Nikon Instruments Europe BV,阿姆斯特丹,荷兰)。
染色质免疫沉淀(ChIP)
根据制造商的说明,使用truChIP™染色质剪切试剂盒(英国布赖顿,科瓦里斯)制备染色质。使用Covaris超声仪将每个样品超声处理10分钟。使用IP-Star Compact自动化系统(比利时列日的Diagenode)进行ChIP。简而言之,用1 µg ChIP级抗体(抗AR 17-10489,美国马萨诸塞州密理博灵顿市或抗AR#5153,英国伦敦信号技术公司)免疫沉淀4 µg分离的染色质。 (C15410206,Diagenode,Liege,Belgium)在稀释缓冲液(0.01%SDS; 1.1%Triton X 100; 2 mM EDTA; 16.7 mM Tris-Cl pH 8.0; 167 mM NaCl; 1x蛋白酶抑制剂混合物,Sigma Aldrich,St Louis)中,美国密歇根州)。DNA /蛋白质复合物在IP洗涤缓冲液(100 mM Tris-HCl pH 8.0; 500 mM LiCl 1%; Triton X100; 1%脱氧胆酸)中洗涤四次。交联逆转后,通过常规DNA提取方案纯化免疫沉淀的DNA,并使用RT-qPCR和SYBR-Green Takara(Ozyme,巴黎,法国)和第一步加上应用的实时PCR系统进行分析。PCR条件是在95°C下10分钟,然后是45个循环,分别在95°C下10 s,60°C下30 s和72°C下30 s。使用以下引物:KLK3启动子5'GCC TGG ATC TGA GAG AGA TAT CAT C 3'[R]和5'ACA CCT TTT TTT TTC TGG ATT GTT G 3'[F];和启动子FKBP5 5'GCA TGG TTT AGG GGT TCT TGC 3'[R]和5'AAC ACC CTG TTC TGA ATG TGG C 3'[F]。PCR条件是在95°C下10分钟,然后是45个循环,分别在95°C下10 s,60°C下30 s和72°C下30 s。使用以下引物:KLK3启动子5'GCC TGG ATC TGA GAG AGA TAT CAT C 3'[R]和5'ACA CCT TTT TTT TTC TGG ATT GTT G 3'[F];和启动子FKBP5 5'GCA TGG TTT AGG GGT TCT TGC 3'[R]和5'AAC ACC CTG TTC TGA ATG TGG C 3'[F]。PCR条件是在95°C下10分钟,然后是45个循环,分别在95°C下10 s,60°C下30 s和72°C下30 s。使用以下引物:KLK3启动子5'GCC TGG ATC TGA GAG AGA TAT CAT C 3'[R]和5'ACA CCT TTT TTT TTC TGG ATT GTT G 3'[F];和启动子FKBP5 5'GCA TGG TTT AGG GGT TCT TGC 3'[R]和5'AAC ACC CTG TTC TGA ATG TGG C 3'[F]。
统计分析
使用GraphPad PRISM软件v7.05(GraphPad Software Inc,圣地亚哥,加利福尼亚,美国)进行统计分析。
数据再现性
图1:a,b,f,h小图:来自三个独立生物学实验的代表性图像。图c(上):n = 6个独立的生物学实验。图c(底部): 在两个独立的生物学实验中检查了n = 55(LN),40(BIC),51(APA),51(ENZ)类器官。图d,e:n = 3个独立的生物学实验。小图g:n = 9(一式三份进行三个独立的生物学实验)。
图2:图b:n = 3个独立的生物学实验;图c,d,e:n =来自相同细胞培养物的3个独立孔。
图3:图a:n =来自同一细胞培养物的3个独立孔。B区:来自三个独立生物学实验的代表性图像。C组:n = 3个独立的生物学实验。
图4:图a:n =来自相同细胞培养物的3个独立孔。B区:来自三个独立生物学实验的代表性图像。
图5:面板b,c,f:来自三个独立生物学实验的代表性图像。小图d:n = 9(一式三份进行三个独立的生物学实验)。图e:n = 6(一式三份进行了三个独立的生物学实验)。面板g:n = 14。
图6:图a,g,h:来自三个独立生物学实验的代表性图像。b,i,j组:n = 6(重复进行三个独立的生物学实验)。图c,d:n = 3个独立的生物学实验。图e,f:n =来自相同细胞培养物的3个独立的孔。
图7:图a: 每组n= 6只小鼠。小图b: 每组n= 5只小鼠。图c: 从每组四只小鼠中提取的n = 7203(CTL),5425(KO)峰强度。图d: 每组n= 3只小鼠。
报告摘要
有关研究设计的更多信息,请参见与本文链接的《 自然研究报告摘要》。
资料可用性
原始文件和MaxQuant搜索结果文件已通过PRIDE合作伙伴资料库[Perez-Riverol Y,Csordas A,Bai J,Bernal-Llinares M,Hewapathirana S,Kundu DJ,Inuganti A, Griss J,Mayer G,Eisenacher M,PérezE,Uszkoreit J,Pfeuffer J,Sachsenberg T,Yilmaz S,Tiwary S,Cox J,Audain E,Walzer M,Jarnuczak AF,Ternent T,Brazma A,VizcaínoJA(2019) 2019年的PRIDE数据库以及相关工具和资源:改进对定量数据的支持。具有数据集标识符PXD016836的Nucleic Acids Res 47(D1):D442-D450(PubMed ID:30395289)]。本研究使用以下数据库:癌症基因组图谱(TCGA,https://tcga-data.nci.nih.gov/tcga/ );GSE21034 ; STRING v11.0(https://string-db.org/cgi/input.pl)。支持本研究结果的所有数据均在本文及其补充信息文件中以及应合理要求从相应的作者处获得。本文的报告摘要可作为补充信息文件获得。图1和2的基础源数据。 1 – 7和补充图。 提供1 – 6作为源数据文件。脂质组学实验的原始数据作为补充数据 2提供。
|
|