IL-33诱导的p38- / JNK1 /2-TNFα轴被树突状细胞中β-肾上腺素能受体的激活所拮抗
IL-33诱导的p38- / JNK1 /2-TNFα轴被树突状细胞中β-肾上腺素能受体的激活所拮抗
摘要
IL-33,IL-1细胞因子超家族成员,诱导经典的NF-κB信号传导的活化,和的中号 itogen 甲 ctivated P rotein ķ inases(MAPKs的)。在树突状细胞(DC)中,IL-33诱导产生IL-6,IL-13和TNFα。因此,IL-6的产生取决于RelA,而IL-13的产生取决于p38-MK2 / 3信号传导模块。在这里,我们显示,除了p65和p38-MK2 / 3信号传导模块外,JNK1 / 2对于IL-33诱导的TNFα产生也是必不可少的。JNK1 / 2和p38在DC中的核心作用是由于这两个MAPK途径受活化的β-肾上腺素受体的控制,从而选择性调节IL-33诱导的DC中的TNFα反应。
介绍
该警报素IL-33,其被动地在坏死从内皮细胞和上皮细胞释放的1是相关的过敏反应的发病2,3,4通过激活肥大细胞和表达该T1 / ST2(与IL-33R)的DCs 3,4,5,6。IL-33的结合IL-33R,一个Ť LR- 我 nterleukine-1 - [R eceptor(TIR)家族成员7,导致IL-33 / IL-33R复合物与IL-1R辅助蛋白(IL的关联-1RAcP)8,9。随后,IL-33 / IL-33R / IL-1RacP受体复合物介导TAK1-IKK2信号转导节点的MyD88依赖性激活,导致IκB降解,进而导致NF-κB激活7。IL-33也诱导MAPK途径,如P38-MAPK活化蛋白激酶2和3(MK2 / 3)信令模块,ERK1 / 2和JNK1 / 2的TAK1依赖性活化7,10,11。DC中5,肥大细胞4,12,NK细胞13和先天淋巴样细胞(ILC2)14中,IL-33诱导的细胞因子响应基本上取决于P38-MK2 / 3信令模块上。这导致生产TNFα的5,细胞因子实质上参与过敏性炎症的发病机制15,16,并由此用于治疗过敏反应的一个有吸引力的目标17,18,19。然而,尚未完全了解导致TNFα产生及其在DC中的调节的IL-33诱导的信号传导事件。为了表征在DC中IL-33诱导的信号传导途径,我们使用的骨髓来源的树突细胞(BMDC的),这是一个在体外等效模型炎症的DCs 20,21。
我们显示,除了NF-κB和p38-MK2 / 3-信号传导模块5外,JNK1 / 2对介导BMDCs中IL-33诱导的TNFα的产生至关重要。有趣的是,肾上腺素能受体,其对DC的表达22,23,24,拮抗JNK1 / 2并导致TNFα生物合成的选择性抑制p38的的IL-33诱导的活化,而不是IL-6的生产。总之,我们的数据证明了JNK1 / 2在BMDC中诱导和调节IL-33诱导的TNFα反应中的核心作用。
结果
JNK1 / 2对于IL-33诱导BMDC产生TNFα至关重要
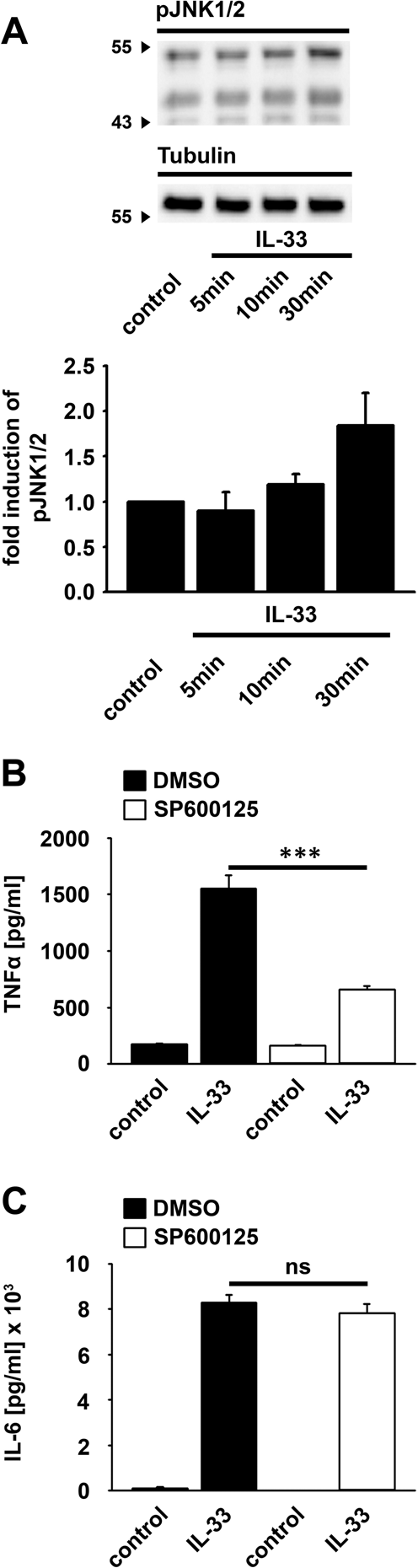
脾脏DC不表达IL-33R 2。与此相反,GM-CSF产生的BMDC表达IL-33R和因此敏感IL-33刺激5,25。因此,我们使用BMDCs作为体外模型来研究DC中IL-33诱导的信号通路。正如最近在BMDC 5中显示的,IL-33诱导MyD88-NF-κB介导的TNFα产生(补充图 1B–D ),这也取决于p38-MK2 / 3信号传导模块(补充图 1E,F )。此外,IL-33激活BMDC中的JNK1 / 2 (图 1A )。SP600125对JNK1 / 2的抑制降低了TNFα的产生(图 1B ),但没有抑制IL-6的产生(图 1C )。这表明除了p38-MK2 / 3信号模块5之外,JNK1 / 2对于IL-33诱导的TNFα产生是必不可少的,但对于在BMDC中产生IL-6却是必不可少的。由于JNK1 / 2和p38-MK2 / 3信号传导模块的重要作用,我们将工作重点放在了这些MAPK途径上。
IL-33诱导的TNFα的产生取决于JNK1 / 2。(A)用IL-33(100 ng / ml)(如所示)刺激Wt BMDC。通过蛋白质印迹分析裂解液(n = 3)。原始印迹显示在补充图 5中。(B,C) Wt BMDC用SP600125(5 µM)处理。之后,将细胞用IL-33(100 ng / ml)刺激(n = 3)。收集上清液并分析TNFα (B)或IL-6 (C)(n = 3)。显示的是平均值±SD;*** p <0.001。
JNK1 / 2对于IL-33诱导的IKK2和p38激活是必不可少的
IL-33诱导JNK依赖的TNFα反应,这也取决于IKK和p38 5。因此,我们推测JNK1 / 2激活IKK2和/或p38。但是,JNK1 / 2抑制剂SP600125 (补充图 2A,B )或JNK1或JNK2缺乏症(补充图 2C-F )均未影响IL-33诱导的IKK2和p38激活。接下来,我们确定了JNK1或JNK2对TNFα和IL-6产生的影响。如图补充图 2G所示JNK1和JNK2缺乏均未降低BMDC中IL-33诱导的TNFα和IL-6产生。这些数据表明,JNK1 / 2不参与IL-33诱导的IKK2和p38的激活,并且SP600125使所有JNK失活,而不是JNK1或JNK2的特定失活,是减少TNFα产生的先决条件。 。
p38-MK2 / 3信号传导模块可用于IL-33诱导的IKK2和JNK1 / 2激活
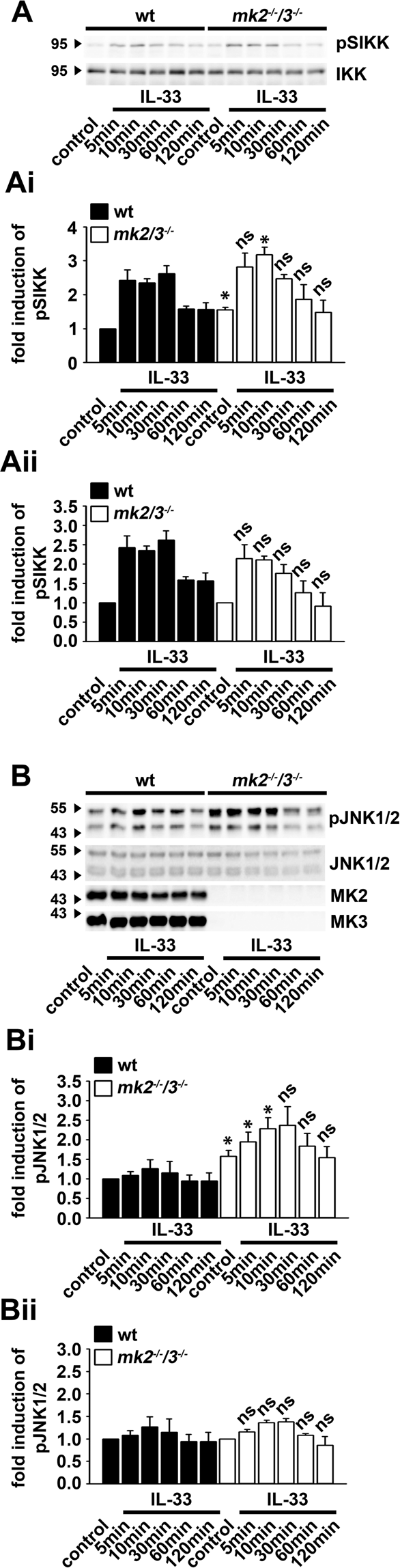
JNK与p38-MK2 / 3信号模块一起介导IL-33刺激后TNFα的产生。P38控制JNKs信号26,27和IKK复合物28,29,30。我们调查了p38-MK2 / 3信号传导模块是否介导IKK2和/或JNK1 / 2的激活,从而介导TNFα的产生。因此,我们使用了mk2 -/- / 3 -/- BMDC。在mk2 -/- / 3 -/-中,IKK2和JNK1 / 2 (图 2A,B和Ai,Bi )的基础激活(未刺激的对照)增加。与wt BMDCs相比,IL-33刺激进一步增强了IKK2和JNK1 / 2的高基础活化(图 2A,B和Ai,Bi )。为了确定MK2 / 3缺陷是否影响IL-33诱导的IKK2和JNK1 / 2的激活,我们计算了wt和mk2 - /// 3- / BMDC 中IKK2和JNK1 / 2的诱导倍数。由此,我们将wt和mk2 -// 3 - BMDC中的未刺激的对照设置为1,并与wt和mk2 - // 3 -/- BMDC中的未刺激的对照相比,计算诱导倍数。如图 2Aii和Bii所示IL-33诱导的mk2 -/- / 3 --/-中IKK2和JNK1 / 2激活的诱导倍数与wt BMDC相似。这表明MK2 / 3控制IKK2和JNK1 / 2的基础活性,但不控制IL-33诱导的IKK2和JNK1 / 2的激活。
MK2 / 3不参与IL-33诱导的JNK激活。(A)用IL-33(100ng / ml)刺激Wt和mk2 -/- / 3 -/- BMDC。通过蛋白质印迹分析裂解物。量化和统计分析了分别从wt和mk2 - /// 3 -//小鼠分别产生的BMDC的3个独立实验的印迹。(Ai)将未刺激的wt BMDC的对照设为1(显示为来自n = 3个独立实验的平均值±SD; ns:不显着; * p <0.05)。(Aii) wt和mk2 -/- / 3 -/-的未刺激控制BMDC设置为1(显示为n = 3个独立实验的平均值±SD; ns)。(B)用IL-33(100ng / ml)刺激Wt和mk2 -/- / 3 -/- BMDC。通过蛋白质印迹分析裂解物。量化和统计分析了分别从wt和mk2 - /// 3 -//小鼠分别产生的BMDC的3个独立实验的印迹。(Bi)将未刺激的wt BMDC的对照设为1(显示为来自n = 3个独立实验的平均值±SD; ns:不显着; * p <0.05)。(Bii) wt和mk2 -/- / 3 -/-的未刺激控制BMDC设置为1(显示为n = 3个独立实验的平均值±SD; ns:否)。原始印迹显示在补充附图中。 5和6。
有趣的是,IKK2和JNK1 / 2控制肥大细胞增殖31。我们发现BMDC中IKK2和JNK1 / 2的基础活性增加。因此,我们假设与wt BMDCs相比,mk2 -/- / 3 -/-增殖增加。如补充图2H所示, 与wt BMDC相比,mk2 - /// 3 - BMDC 的基础增殖速率增加。这些数据表明,功能性p38-MK2 / 3信号传导模块对于控制IKK2和JNK1 / 2的基础活性以及BMDC的增殖至关重要。但是,响应IL-33刺激,JNK1 / 2与p38-MK2 / 3信号模块之间没有串扰。
IL-33主要激活BMDC中的JNK2L
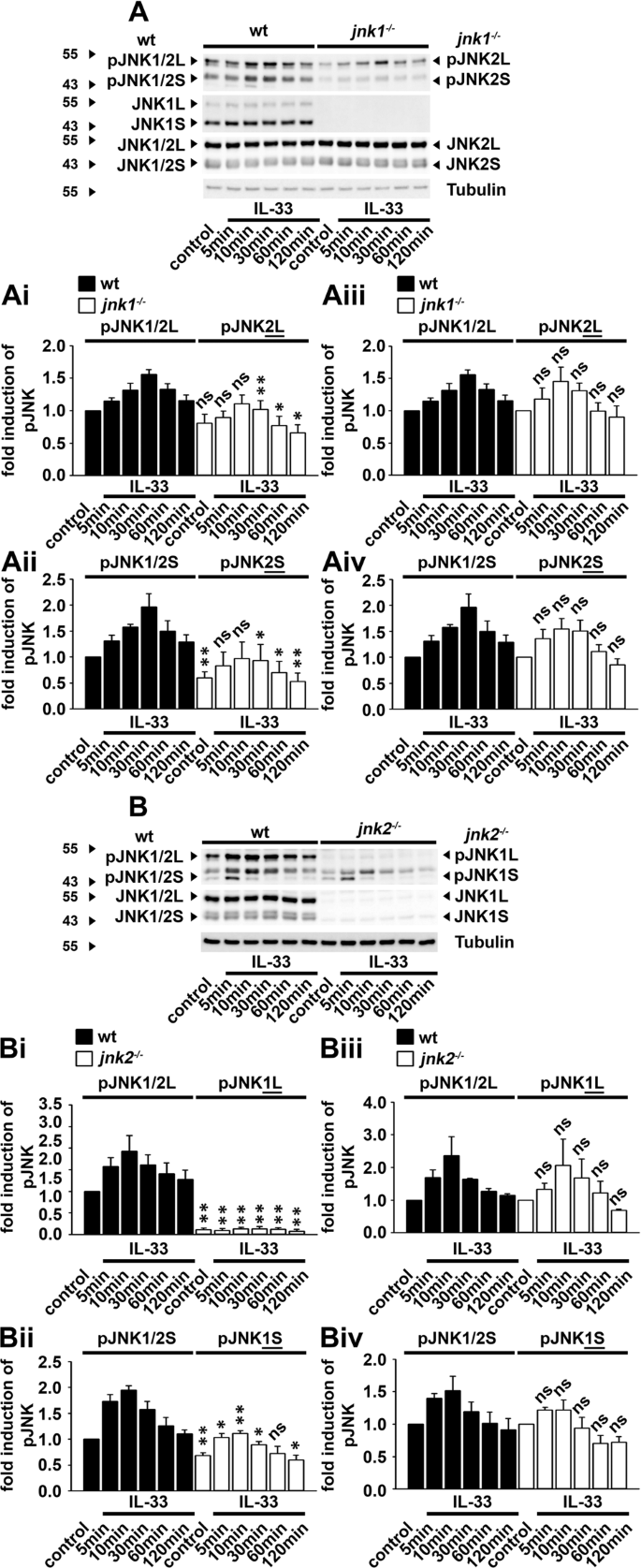
接下来,我们确定了为什么JNK1和JNK2缺乏都不会影响IL-33诱导的TNFα产生。我们假设JNK缺乏BMDCs中JNK亚型的补偿机制。JNK1和JNK2表示为长(L)和短(S)同工型(JNK1L / S和JNK2L / S)32。首先,我们通过使用jnk1 -/- BMDC 评估了JNK1亚型的作用。与wt BMDC中的pJNK印迹相比,jnk1 -/- BMDC中剩余的JNK2L / S的pJNK印迹减少了(图 3A,Ai和Aii )。但是,当控件在wt或jnk1中时-/-将BMDC设置为1,wt BMDC中JNK同工型的折叠激活类似于jnk1 -/- BMDC 中其余JNK2L和JNK2S同工型的折叠激活(图 3A,Aiii和Aiv )。这表明,JNK1的失活降低了BMDC中的总JNK活性,而不影响IL-33诱导的BMDC中JNK2L / JNK2S的激活。接下来,我们通过使用jnk2 -/- BMDC 测试了JNK2的作用。与wt BMDC中的pJNK印迹相比,在jnk2 -/- BMDC 中JNK1L的活性大大降低(图 3B和Bi )。但是,jnk2中的JNK1S的活动-/-与pJNK印迹相比,BMDCs在wt BMDCs中仅略有减少(图 3B和Bii )。这表明随着jnk2 -/- BMDC 中JNK2L的缺失,BMDC失去了主要的JNK L亚型,这有助于大JNK1 / 2(pJNK1 / 2 L)亚型的总活性。与此相反,随着jnk2 -/- BMDC 中JNK2S的丢失,BMDC失去了短的JNK同工型,这对wt BMDC中的小JNK1 / 2(pJNK1 / 2 S)同工型的总活性有轻微贡献。但是,jnk2中的JNK1L (图 3B和Biii )和JNK1S (图 3B和Biv )的折叠诱导-/- BMDC与wt和BMDC中的pJNK印迹相似,表明JNK2缺乏症也不会影响IL-33诱导的JNK1S和JNK1L的激活。在缺乏JNK2的BMDC中几乎无法检测到其余JNK1L同工型的激活表明IL-33主要诱导JNK2L的激活。然而,一种JNK同工型的缺失被剩余的JNK同工型补偿。
IL-33主要激活JNK2L。(A,B) Wt,jnk1 -/- (A)和jnk2 -/- (B)用IL-33(100 ng / ml)刺激BMDC。通过蛋白质印迹分析裂解物。分别定量和统计分析了5个(对于wt / jnk1 -/-)和4个(对于wt / jnk2 -/-)独立于wt,jnk1 -/-或jnk2 -/-小鼠生成的BMDC的印迹。(Ai,Aii)将未刺激的wt BMDC的对照设为1(显示为平均值±SD独立实验; ns:不显着; * p <0.05和**p <0.005)。(Aiii,Aiv)将wt和jnk1 -/- BMDC 的未刺激对照设置为1(显示为平均值±SD独立实验; ns:不显着)。(Bi,Bii)将未刺激的wt BMDC的对照设定为1(显示为平均值±SD独立实验; ns:不显着; * p <0.05和** p <0.005)。(Biii,Biv)将wt和jnk2 -/- BMDC 的未刺激对照设定为1。(显示为平均值±SD独立实验; ns:不显着)。原始印迹显示在补充附图中。 7和8。
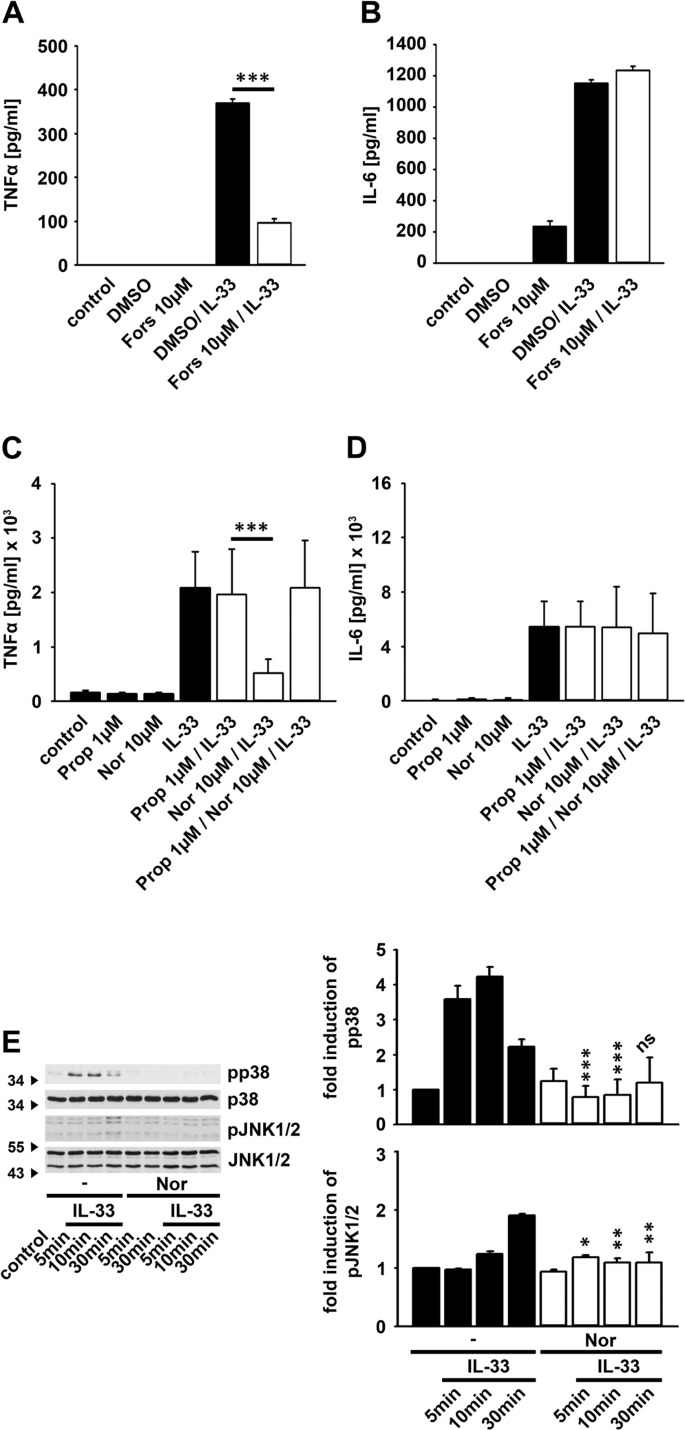
去甲肾上腺素调节IL-33诱导的细胞因子产生
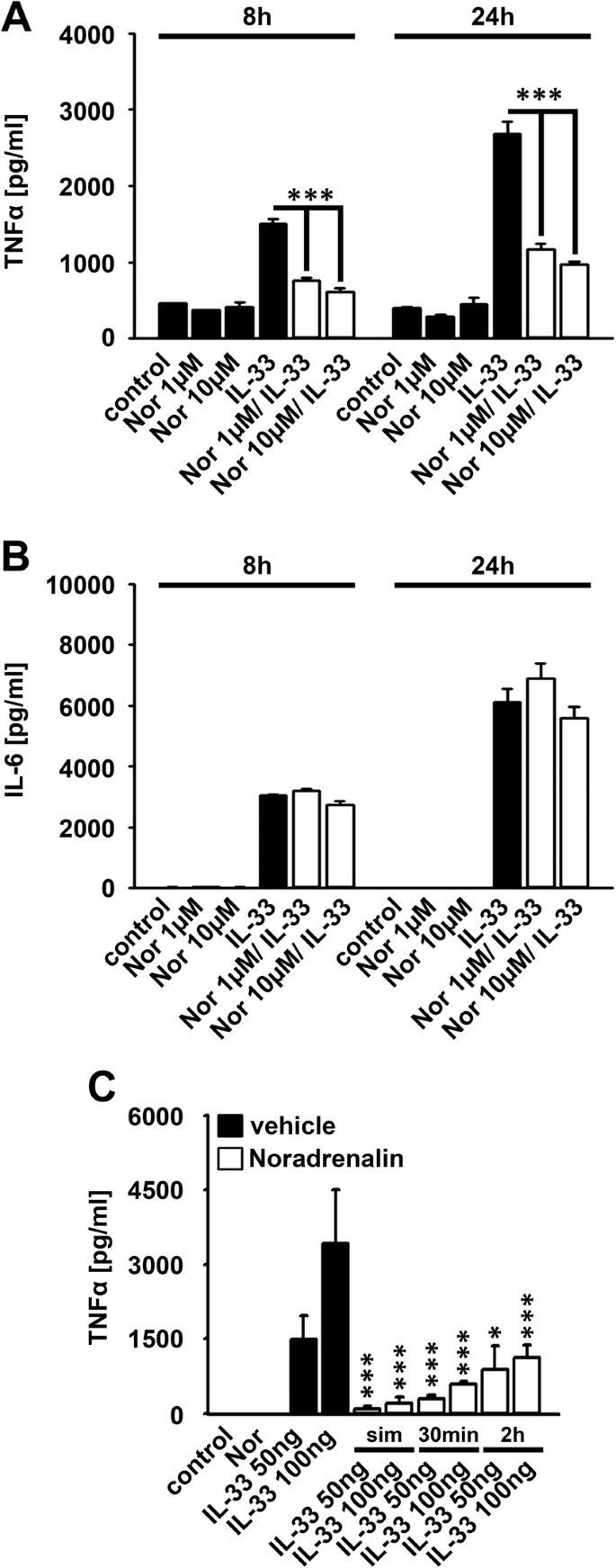
肾上腺素能受体是TIR家族成员介导的信号传导的负调节物23,33。我们调查了肾上腺素能受体的刺激是否影响BMDCs中IL-33诱导的细胞因子反应。如图4A,B所示 ,用去甲肾上腺素处理强烈降低了IL-33诱导的TNFα的产生,但不影响IL-6的产生。因此,1 µM和10 µM去甲肾上腺素对减少IL-33诱导的TNFα反应同样有效(图 4A )。接下来,我们用去甲肾上腺素和IL-33测试了刺激序列。与去甲肾上腺素同时或预孵育30分钟最有效地阻断了IL-33诱导的TNFα产生(图 4C)。肾上腺素能受体介导的刺激腺苷酸环化酶的激活,从而生产第二信使cAMP的34,35。福斯科林,腺苷酸环化酶的激活剂,大大提高了cAMP 34的产量。用福司柯林处理BMDCs阻断了IL-33诱导的TNFα产生(图 5A ),但没有阻断IL-6产生(图 5B )。。这表明经由cAMP的肾上腺素能受体抑制IL-33诱导的信号通路。去甲肾上腺素是肾上腺素能受体的非选择性激动剂。用β-肾上腺素受体拮抗剂普萘洛尔治疗BMDC,可以逆转去甲肾上腺素对IL-33诱导的TNFα产生的作用,而IL-6的产生没有改变(图 5C,D ),表明去甲肾上腺素通过β肾上腺素能受体控制IL-33诱导的TNFα产生。
去甲肾上腺素抑制IL-33诱导的TNFα产生。(A,B)用去甲肾上腺素(如所示)或IL-33(100 ng / ml)(黑色柱)或两者一起(白色柱)刺激Wt BMDC。收集上清液并通过ELISA进行分析(显示为平均值±SD; *** p <0.001)(n = 3)。(C)用去甲肾上腺素(10 µM)或IL-33(100 ng / ml)(黑柱)或两者一起(白柱)刺激Wt BMDC(sim:细胞同时用Nor和IL-33刺激; 30分钟2小时:在用IL-33刺激之前,用Nor预刺激细胞30分钟或2小时。收集上清液并通过ELISA分析。(显示为平均值±SD; * p <0.05; *** p <0.001)(n = 3)。
福司可林抑制IL-33诱导的TNFα产生。(A,B)用Forskolin(10 µM)处理Wt BMDC,并用IL-33(100 ng / ml)刺激。收集上清液并通过ELISA进行分析(显示为平均值±SD; *** p <0.001)(n = 3)。(C,D) Wt BMDCs用普萘洛尔(1 µM)处理,并用去甲肾上腺素(10 µM)和IL-33(100 ng / ml)刺激。收集上清液并通过ELISA分析(显示为平均值±SD; *** p <0.001)(n = 4)。(E)用去甲肾上腺素(10 µM)或IL-33(100 ng / ml)或两者一起刺激Wt BMDC。通过蛋白质印迹分析裂解物。将未刺激的对照设为1(显示为n = 3个独立实验的平均值±SD; * p <0.05,** p <0.005和*** p <0.001)。原始印迹显示在补充图 8中。
去甲肾上腺素阻断IL-33诱导的p38和JNK激活
去甲肾上腺素能阻断BMDC中IL-33诱导的TNFα的产生,但不能阻断IL-6的产生,最有可能是通过阻断参与IL-33诱导的TNFα的必需信号通路,而不是IL-6的产生。TNFα的产生而不是IL-6的产生取决于p38-MK2 / 3信号传导模块和JNK1 / 2。因此,我们测试了去甲肾上腺素的刺激影响这些信号通路中的哪些。尽管单独的去甲肾上腺素不能诱导BMDC中JNK1 / 2和p38的活化,但是用去甲肾上腺素治疗BMDC可以同样降低IL-33诱导的JNK1和JNK2以及p38的活化(图 5E )。这些数据表明,β-肾上腺素能受体通过控制IL-33诱导的p38和JNK1 / 2的活化来特异性调节TNFα的产生。
讨论区
我们最近表明,BMDC中IL-33诱导的TNFα的产生取决于MyD88-IKK2-NF-κB信号传导途径以及p38-MK2 / 3信号传导模块5。在这里,我们显示JNK1 / 2对IL-33诱导的TNFα产生也必不可少。由于JNK1 / 2和p38-MK2 / 3 5信号传导模块的参与,我们推测这两个MAPK途径之间存在串扰。但是,IL-33不会引起JNK1 / 2和p38之间的串扰,表明这两种MAPK途径均独立发挥作用以诱导BMDC中细胞因子的产生。与IL-33相反,我们假设GM-CSF会诱导p38-MK2 / 3信号模块和JNK1 / 2之间发生串扰。肥大类似细胞12,31,36p38-MK2 / 3信号传导模块通过反馈抑制限制了JNK1 / 2的激活,从而限制了BMDC的增殖(补充图 3A )。但是,尚不清楚此调节功能背后的详细机制。我们推测,MK2 / 3通过诱导MAPK磷酸酶(MKPs)的表达通常限制了JNK1 /先天细胞2依赖性增殖37,38。
我们的数据进一步表明,不同MAPK途径的配体依赖性合作模式在DC中介导了不同的细胞应答。p38-MK2 / 3信号模块和JNK1 / 2之间的连锁激活控制了GM-CSF诱导的增殖,而这两种MAPK途径的并行激活介导了IL-33诱导的细胞因子的产生。因此,JNK1 / 2和p38-MK2 / 3信号模块与NF-κB的功能配合对于IL-33激活的BMDC中TNFα的产生至关重要(补充图 3B–D )。与此相反,对IL-33诱导的IL-6产生既不取决于P38-MK2 / 3模块上也没有对JNK1 / 2,但对NF-κB 5 (补充图 3B-d ),而在的BMDC产生IL-13的依赖于p38的-MK2 / 3信令模块上,但不能在NF-κB 5。这巩固了JNK1 / 2在BMDC中IL-33诱导的TNFα产生中的关键和核心作用。然而,没有偏好介导IL-33诱导的TNFα产生的JNK同工型。JNK1或JNK2的失活都不会影响IL-33诱导的TNFα的产生。仅SP600125的药理学JNK抑制作用强烈降低了IL-33诱导的TNFα产生。这是由以下事实解释的:与泛JNK抑制剂相反,在jnk1 -/- BMDC中,JNK2L的活化;在jnk2 -/-中BMDC对JNK1S的激活仍然完整。因此,其余的JNK同工型与p38-MK2 / 3信号模块和NF-κB一起足以介导IL-33诱导的TNFα产生。我们假设JNK1 / 2与NF-κB协同介导TNFα的转录。与此相反,p38-MK2 / 3信号通路稳定了TNFα转录物(补充图 3B–D )39,并通过mTOR-RSK通路5进一步介导了TNFα转录物的翻译。
通过激活的β-肾上腺素能受体抑制MAPK途径和产生的TNFα反应,进一步支持了JNK1 / 2和p38的重要性(补充图 4A,B )。抑制作用的潜在机制尚不清楚。然而,β肾上腺素能受体激活的cAMP依赖性蛋白激酶A(PKA)-CREB信号通路40,41,其介导MKPs的表达,从而控制JNK1 / 2和p38 37,38。因此,我们推测β-肾上腺素能受体诱导BMDC中MKPs的表达,从而限制了p38和JNK1 / 2的激活以及由此产生的TNFα的产生。总之,通过调节JNK1 / 2和p38,β-肾上腺素能受体控制IL-33诱导的DC细胞因子的组成(补充图 4A,B ),从而调节其介导的效应子功能。鉴于GM-CSF生成的BMDC与炎症DC相似21,β-肾上腺素能受体对IL-33诱导的MAPK活化的调节功能对于体内 DC也可能很重要。有趣的是,体内最近在ILC-2中显示了IL-33R的信号传导与β-肾上腺素能受体之间的串扰的相关性。在这些细胞中的IL-33诱导的和p38依赖性IL-13生成14由β阻断2 -肾上腺素能受体,并导致减少的炎症反应在体内42。这些数据一起表明,IL-33诱导的效应子在先天细胞上的神经调节是控制并因此避免过度茂盛的IL-33诱导的炎症的一般机制。因此,这提供了新颖的靶向治疗策略,可调节IL-33诱导的炎症反应。
方法
老鼠
WT(C57BL / 6或Balb / c),Mapkapk2 tm1Mgl(mk2 -/-)/ Mapkapk3 tm1Mgl(mk3 -/-)39,myd88 -/- 43,jnk1 -/- 44和jnk2 -/- 45在基尔汉诺威医学院的动物研究设施和耶拿大学医院的动物研究设施中饲养小鼠。我们使用了与性别和年龄相匹配的基因敲除小鼠和野生型(wt)小鼠。根据机构和政府动物福利委员会的指导饲养动物。对于此手稿,我们从被杀死的小鼠中分离出了器官(小鼠品系见上文)。这些器官隔离得到相应政府部门的批准(ThüringerLandesamtfürLebensmittelsicherheit und Verbraucherschutz;巴特朗根萨尔扎)。
BMDC代
为了生成BMDC,我们使用了最近发布的协议5。简而言之,接种骨髓细胞(2×10 5个细胞/ ml),并在第3、6和8天[RPMI 1640(Sigma Aldrich))中添加X63AG的补充剂和条件化GM-CSF(20 ng / ml)上清液-GM-CSF细胞]。收获BMDC(在第9或10天),并通过流式细胞术通过CD11c和CD11b(均来自eBioscience)的表面表达来鉴定。
流式细胞仪
用PBS(含有0.25%BSA和0.02%叠氮化钠)和碘化丙锭(PI)(Biolegend)中的抗体染色以排除死细胞。我们使用抗CD16 / CD32(克隆2.4G2)和大鼠IgG(杰克逊)来阻断非特异性结合。为了鉴定BMDC,我们使用了抗CD11b(PeCy7)(Biolegend)和抗CD11c(APC)(Biolegend)。对于BMDC分析,我们使用LSR II或Canto II流式细胞仪(BD)和FlowJo版本9(Tree Star,Inc.,Ashland,OR)(补充图 1A )。
刺激BMDC和裂解
在刺激之前,将BMDC饥饿GM-CSF 1小时。之后,将细胞与抑制剂(如图所示)(全部为默克密理博公司)预孵育30分钟,并用IL-33(Peprotech)刺激。在一些实验中(如图所示),将BMDC用去甲肾上腺素(Sigma Aldrich)处理30分钟,然后用IL-33刺激。用标准方案5进行细胞裂解。通过使用BCA测定法(Pierce)测定蛋白质浓度。然后将裂解液在6×Laemmli缓冲液中煮沸。
免疫印迹
免疫印迹法采用标准方案5进行。我们使用了针对pSIKK1 / 2 / IKK1 / 2,pT / Y-p38 / p38,抗MK2,抗MK3,pJNK1 / 2 / JNK1 / 2和JNK1的一抗(除抗IKK1 / 2和微管蛋白外的所有细胞信号传导(来自Santa Cruz)和与HRP偶联的二抗[抗兔Ig,抗山羊Ig(均属于Santa Cruz)和抗小鼠Ig(Thermo Fisher Scientific)]。使用ECL试剂(Pierce)进行检测。Western印迹是使用ImageQuant 4000系统(GE Healthcare Life Science,英国)或X射线胶片(富士)进行数字化开发的。
ELISA法
对于ELISA实验,将BMDC接种(10 6细胞/ ml)在无GM-CSF的培养基中。将BMDC与DMSO(载体),抑制剂(30分钟)(全部来自Merck Millipore)(浓度显示在图例中)或去甲肾上腺素和普萘洛尔(均来自Sigma Aldrich)一起预孵育。之后,用IL-33(Peprotech)刺激BMDC。收集上清液(24小时后),并使用配对抗体(eBioscience)分析TNFα和IL-6。
增殖测定
BMDC渴望获得GM-CSF(1小时)。加入25 µl完全IMDM(PAA)(不含GM-CSF)中的[3 H]-胸苷(1µCi)。将细胞与[3 H]-胸苷(1µCi)孵育18小时。通过使用β-闪烁计数器(Perkin Elmer)测定放射性。
统计分析
为了生成BMDC,合并了几只小鼠的骨髓。对于ELISA实验,每个生物学重复均至少分为6倍测定(技术重复)。蛋白质印迹强度用Image J软件(Fiji;免费软件)进行定量。磷酸化印迹被标准化为总蛋白蛋白质印迹。然后,将wt BMDC或经DMSO处理的BMDC的对照(未刺激的样品)(如果没有另外说明)设置为1。细胞因子浓度表示为测量平均值±标准差(SD)。使用不成对的学生t检验,使用Graph Pad Prism 5进行统计分析。统计学显着性评估的p≤0.05(* p ≤0.05; ** p ≤0.01; *** p ≤0.001)。
|
|