蛋白酶体激活因子REGγ通过降低PP2Acα–SOD2途径加速心脏肥大
蛋白酶体激活因子REGγ通过降低PP2Acα–SOD2途径加速心脏肥大
摘要
病理性心脏肥大最终会导致心力衰竭,而没有适当的治疗。REGγ逐渐成为20S蛋白酶体的11S蛋白酶体激活剂,以不依赖泛素和ATP的方式促进细胞蛋白质的降解。在这里,我们发现REGγ在横向主动脉缩窄(TAC)诱导的肥大性心脏和血管紧张素II(Ang II)治疗的心肌细胞中显着上调。REGγ缺乏症改善了压力超负荷引起的心脏肥大,与抑制心脏活性氧(ROS)积累和抑制蛋白磷酸酶2A催化亚基α(PP2Acα)衰减有关。从机理上讲,REGγ直接与PP2Acα相互作用并靶向其降解,从而导致叉头盒蛋白O(FoxO)3a的磷酸化水平增加和核输出,进而导致SOD2下降,ROS积累和心脏肥大。向人心肌细胞引入外源PP2Acα或SOD2可以显着拯救REGγ介导的Ang II刺激的ROS在体外的ROS积累。此外,用超氧化物歧化酶模拟物MnTBAP处理可防止REGγ在体内引起的心脏ROS产生和肥大特征,从而在心脏氧化应激和肥大中建立REGγ–PP2Acα–FoxO3a–SOD2途径,表明调节REGγ-蛋白酶体活性可能是心脏肥大相关疾病的潜在治疗方法。向人心肌细胞引入外源PP2Acα或SOD2可以显着拯救REGγ介导的Ang II刺激的ROS在体外的ROS积累。此外,用超氧化物歧化酶模拟物MnTBAP处理可防止REGγ在体内引起的心脏ROS产生和肥大特征,从而在心脏氧化应激和肥大中建立REGγ–PP2Acα–FoxO3a–SOD2途径,表明调节REGγ-蛋白酶体活性可能是心脏肥大相关疾病的潜在治疗方法。向人心肌细胞引入外源PP2Acα或SOD2可以显着拯救REGγ介导的Ang II刺激的ROS在体外的ROS积累。此外,用超氧化物歧化酶模拟物MnTBAP处理可防止REGγ在体内引起的心脏ROS产生和肥大特征,从而在心脏氧化应激和肥大中建立REGγ–PP2Acα–FoxO3a–SOD2途径,表明调节REGγ-蛋白酶体活性可能是心脏肥大相关疾病的潜在治疗方法。
介绍
心脏肥大是对病理刺激的重要适应性反应,但长期肥大会导致心脏功能障碍和心力衰竭(HF)[ 1 ]。
蛋白酶体系统和溶酶体自噬途径是调节蛋白降解的两个最重要的细胞内机制2,3,4,5 ]。
26S蛋白酶体全酶由20S蛋白水解核心和激活其所需的调节颗粒组成。19S调控颗粒是经典且经过精心研究的,它由17个亚基(PSMC1-6,PSMD1-4、6-8和11-14)组成[ 6 ],可激活ATP和泛素中的20S蛋白水解核心。依赖的方式。发现三种蛋白酶体调节剂,PA28 / 11S(PSME1-3),PA200 / Blm10(PSME4)和ECM29,以与ATP和泛素无关的方式与19S调节颗粒竞争[ 7 ]。蛋白酶体活性的功能障碍引起许多心脏蛋白病的,并最终导致HF [ 8,9,10,11 ]。
REGγ(也称为PA28γ,PSME3)是蛋白酶体激活剂“帽”的11S家族(REGα,β和γ)的成员,已被证明与20S核心蛋白酶体结合并激活。已显示它以泛素和ATP依赖性方式促进几种重要的细胞调节蛋白降解,包括SRC-3,p21,p16,p19,p53,PKAcα,CK1δ,SirT1,ikBε,GSK3β,SirT7,KLF2 ,c-Myc的及Smad7,等等[ 12,13,14,15 ],在宽范围的生理和病理过程,包括癌症进展[的调节16,17,18,19 ],开发[ 20 ] , 早衰 [21 ],肝脏脂质和能量代谢[ 22,23 ],血管发生和动脉粥样硬化[ 24,25 ],氧化反应[ 26 ],细菌感染[ 27 ],先天免疫和炎性疾病[ 28,29,30 ],和心脏病毒感染[ 15,31 ],但REGγ的在心脏肥大的蛋白质的质量控制的功能尚不清楚。
在这项研究中,我们发现REGγ在横向主动脉缩窄(TAC)引起的肥厚性心脏中显着上调,并且在TAC手术后小鼠中REGγ的消耗导致活性氧(ROS)积累和蛋白磷酸酶2A催化的大量抑制α2亚基(PP2Acα)在心脏中衰减并以PP2Acα–FoxO3a–SOD2依赖的方式改善病理性心脏肥大。
材料和方法
动物模型
具有C57BL / 6遗传背景的REGγ-/-小鼠获自John J. Monaco(辛辛那提大学辛辛那提大学)[ 30 ]。按照贝勒医学院机构动物护理和使用委员会批准的程序,在动物核心设施中饲养小鼠。为了产生本研究所需的动物,我们饲养了REGγ+/-小鼠,并使雄性和雌性之间的杂交保持了六代以上。REGγ+ / +和REGγ-/-小鼠的基因分型是通过对基因组DNA的PCR分析进行的[ 30]。通过TAC手术持续4周,在8周龄的小鼠中诱发了心脏肥大。对于锰5、10、15、20-四-(4-苯甲酸)卟啉(MnTBAP)处理,将MnTBAP溶解在PBS中,并以5 mg / kg /天的剂量给予小鼠4周。使用带15 MHz线性阵列超声换能器的VisualSonics Vevo770超声生物显微镜(VisualSonics Inc,多伦多,加拿大)进行超声心动图检查。外科医生或研究者对小鼠组或基因型不了解。在胸骨旁长轴和短轴视图中以120 Hz的帧速率评估左心室(LV)。收缩末期或舒张末期分别定义为LV面积最小或最大的相。LV收缩末期直径(LVESD)和LV舒张末期直径(LVEDD)是从LV M模式描迹以乳头肌水平的扫描速度50 mm / s测量的。左心室分数缩短(FS)通过([LVEDD-LVESD] / LVEDD)计算。
细胞培养,表达构建体和试剂
人心肌细胞AC16,大鼠心肌细胞H9C2和293T细胞购自ATCC,并在Dulbecco改良的Eagle培养基(DMEM)(Invitrogen,Carlsbad,CA,美国)中培养,该培养基含有10%胎牛血清(FBS)(Invitrogen)。通过校对PCR,将REGγ,PP2Acα,FoxO3a,SOD2和p21质粒构建为在N末端带有Flag / HA / GFP-tag的pcDNA3.1,并通过测序进行验证。血管紧张素II(Ang II)获自Sigma(美国马萨诸塞州伯灵顿)。二甲基亚砜,冈田酸(OA),环己酰亚胺(CHX)和MG132购自Sigma,4',6-diamidino-2-phenylindole和二氢乙啶(DHE)购自Invitrogen,MnTBAP购自Merck(Darmstadt)在该研究中使用了以下抗体:抗β-肌动蛋白抗体(A2228#,Sigma),抗Flag / HA / GFP抗体(14793#/ 3724#/ 2956#,Cell Signaling,Danvers,MA,USA),抗REGγ抗体(ab157157#,Abcam,Cambridge,UK),抗SOD2抗体(13141#,Cell Signaling),抗PP2Acα抗体(ab137825#,Abcam)/(Proteintech ),抗磷酸化的FoxO3a抗体(ab26649#,Abcam)/(细胞信号转导),抗ANP抗体(ab225844#,Abcam),抗p21(2947#,细胞信号转导)和抗免疫球蛋白G(IgG)( 3900#,单元信令)。实时定量聚合酶链反应(RT-qPCR)使用实时PCR试剂盒(宝酒,草津,滋贺,日本)进行。使用FLAG-M2琼脂糖珠(Sigma)或Pierce™蛋白A / G琼脂糖珠(Thermo Fisher,Waltham,MA,USA)进行免疫沉淀,并使用核和细胞质提取试剂盒(Thermo Fisher)进行细胞分级测定。使用萤光素酶测定系统(Promega,Madison,WI,USA)进行萤光素酶测定。®转录/翻译系统(Promega)。
新生大鼠心肌细胞(NRCM)的原代培养
将1-3日龄SD大鼠的心脏切成约9至10片,并用0.04%胰蛋白酶和0.07%II型胶原酶解离。将分散的细胞在100 mm培养皿中于5%CO2中于37°C在37°C下孵育90分钟后,收集未附着的细胞并转移到六孔板中,预先用层粘连蛋白(10μg/ mL)处理,然后加入0.1M的5-溴-2′-脱氧尿苷。将原代心肌细胞在补充有10%FBS的DMEM / F12(Invitrogen)中孵育16小时,然后用不含血清的DMEM / F12代替,其中含有适当的化学物质。
组织学分析
为了进行组织学分析,将心脏在舒张末期用10%氯化钾溶液使心脏停搏,然后在4%多聚甲醛中固定。将固定的心脏包埋在石蜡中,并横向切成5μm的切片。用苏木精和曙红(H&E)或小麦胚芽凝集素(WGA)(Invitrogen)对连续的心脏切片进行染色,以测量心肌细胞的横截面面积;或按照Masson染色的方法,对心脏纤维化区域进行染色,或者按照[ 17 ] 所述进行免疫组化以显示所示的蛋白在心脏组织中的表达。通过Masson染色检测心脏胶原蛋白的沉积程度,并使用定量数字图像分析系统(Image-Pro Plus 6.0)分析图像。
透射电子显微镜(TEM)
将LV组织切成≤1mm 3的小立方块,并用2.5%戊二醛(pH 7.4)固定2小时以上。在0.1 M磷酸盐缓冲液中洗涤3次后,将组织固定在1%四氧化os中。然后将样品用梯度乙醇在90%丙酮中进行最后的脱水步骤进行脱水。以上所有步骤均在4°C下进行。将其包埋在Epon Araldite中并固定后,使用LKB-1超薄切片机(德国Lecia)切割超薄切片(50-60 nm),并用3%乙酸铀酰和柠檬酸铅染色。用CM-120透射电子显微镜(菲利普,荷兰)捕获图像。
RNA干扰,质粒转染和实时定量PCR
GenePharma(上海)合成了针对REGγ,PP2Acα,FoxO3a和阴性siRNA的siRNA(分别为siREGγ,siPP2Acα,siFoxO3a和siNeg)。这些siRNA(5′-3′)的靶序列如下:人siREGγ1#:UCUGAAGGAACCAAUCUUA,siREGγ2#:CUCAUCAUAUCAGAGAGCUGA,siREGγ3#:GAAGGAAAGUGCUAGGUGU,siPP2Acα:GGCAGAUCUUCUGUCUACA,siFoxOTGACA,ACT 根据制造商的说明,使用Lipofectamine™RNAiMAX(Invitrogen)将siRNA转染此研究中的所有细胞,并使用Lipofectamine™LTX试剂和PLUS™试剂(Invitrogen)转染相应的质粒。使用TRIzol试剂(Takara)提取总RNA,并使用逆转录酶(Takara)合成第一站cDNA。用SYBR Green(Takara)进行RT-qPCR,检查指示基因的相对mRNA水平。实时qPCR引物的序列在表中显示 S4。
免疫印迹,免疫沉淀,免疫荧光和细胞分级测定
如先前所述进行免疫印迹,免疫沉淀,和免疫荧光[ 12,14 ],免疫荧光用激光扫描共聚焦显微镜(Lecia,韦茨拉尔,德国)分析,并使用Image-Pro的加6.0软件,的细胞核和细胞质的百分比进行测定通过从三个重复中计数400个阳性细胞来确定定位,并按照[ 17 ] 所述进行细胞分级测定。
萤光素酶测定
pGL3-SOD2启动子Luc报告基因的构建是通过质粒pGL3-basic(Promega,麦迪逊,威斯康星州,美国)通过校对PCR产生的,其中包含荧光素酶基因和人SOD2启动子片段[ 32]以评估SOD2启动子的转录活性。用报告基因构建体和所示质粒或siRNA瞬时转染AC16细胞。接下来,收集细胞并用冷PBS洗涤一次,然后在细胞裂解缓冲液(Promega,麦迪逊,威斯康星州,美国)中裂解。经过一个冷冻和解冻循环后,将全细胞裂解液在冷室(4°C)中以12,000 rpm离心15分钟,并将获得的上清液收集在新的试管中。接下来,将20μL上清液添加到等量的荧光素酶测定底物中,并使用LUMIstar OPTIMA阅读器(德国奥芬堡BMG Labtech)将发光作为相对光单位进行检测。每个测定重复三遍。值的倍数变化表示为三个实验的平均值。
体外蛋白质降解测定
购买了纯化的重组REGγ蛋白和20S蛋白酶体。底物PP2Acα蛋白通过体外转录/翻译系统生成。随后,通过将底物,20S蛋白酶体和纯化的REGγ蛋白(如先前所述[ 14 ])与适当的对照孵育,进行目标蛋白衰减测定。通过免疫印迹分析结果。
细胞内ROS测定
通过分析DHE(Invitrogen)染色产生的荧光强度来评估ROS的产生。简而言之,将冷冻的小鼠心脏切成5μm的切片。连续心脏切片在37°C下用5μMDHE染色30分钟,然后通过荧光显微镜测量。将AC16细胞用Ang II刺激6小时,然后在37°C下加载5μMDHE 30分钟,然后通过荧光显微镜进行测量。
数据收集与统计分析
除非另有说明,否则在所有情况下,对每个细胞实验组至少进行三个独立实验,对每个动物组至少进行五个独立实验,并且所有数据均以平均值±SD(标准差)表示。使用两尾配对的Student's t检验或单向方差分析(≥3组)进行统计学分析。甲P小于0.05的值被认为是统计学显著(* P <0.05,** P <0.01,和*** P <0.001)。
结果
肥大心脏中的REGγ表达上调
为了探索肥大心脏中的蛋白酶体激活剂(亚基)表达谱,我们通过TAC操作在野生型(WT)小鼠中诱导了心脏肥大,并用RT-qPCR进行了评估。我们发现,在22个蛋白酶体激活剂(亚基)中,REGγ(PSME3)在TAC手术的心脏中高度上调达4周(图 1a)。通过RT-qPCR分析显示了REGγmRNA的相对增加的倍数(图 1b)。同时,REGβ(PSME2)的相对mRNA水平也有所增加,但低于REGγ(图 1b)。但是,REGα(PSME1)的表达没有差异(图 1b)。在TAC手术后通过免疫印迹,REGγ的表达在小鼠心脏中也呈时间依赖性上调(图。 1c)(A型利钠肽(ANP);心脏肥大的标志物)。此外,在Ang II处理的NRCM(图1d,e)和AC16细胞(图 1f,g)中, REGγmRNA和蛋白水平 以时间依赖性方式增加。总体而言,这些结果表明,REGγ是11S蛋白酶体激活剂之一,可能在心脏肥大的调节中起关键作用。
在第4周时,在Sham或TAC操纵的小鼠心脏中蛋白酶体激活剂(亚基)表达的概况。b通过RT-qPCR分析,在第4周时,Sham或TAC操纵的小鼠心脏中REGα,REGβ和REGγmRNA表达的相对倍数变化(每组n = 6,** P <0.01,*** P <0.001,Student's t测试)。通过免疫印迹分析,在2或4周后,在深水或TAC手术的小鼠心脏中REGγ的蛋白水平(c)。(d,e)NRCMs和(f,g)中REGγ的mRNA和蛋白水平。)通过RT-qPCR和免疫印迹分析在不同时间点暴露于Ang II的AC16细胞。(实验重复了三遍;误差棒代表标准偏差,** P <0.01,*** P <0.001,Student's t检验)。
REGγ缺乏症改善TAC诱导的心肌肥大表型
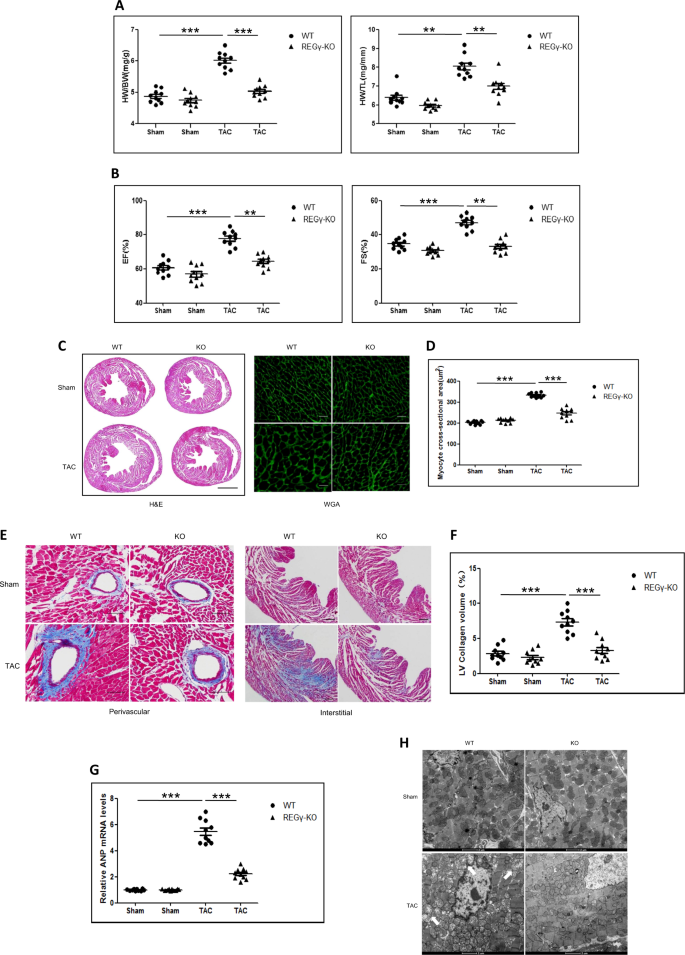
为了研究REGγ缺乏与心脏肥大的关系,我们对REGγ整体敲除小鼠(REGγ-KO)进行了TAC手术4周。对于假手术组,REGγ-KO小鼠的心重与体重(HW / BW)之比与WT小鼠无差别(图 2a)。但是,TAC导致WT小鼠的HW / BW比例显着增加,而REGγ-KO小鼠则无变化(图 2a)。对于心脏重量与胫骨长度(HW / TL)之比,观察到类似的效果(图 2a)。此外,在TAC 4周后,WT小鼠表现出射血分数和FS的代偿性增加,而REGγ基因敲除减弱了心脏对TAC手术的敏感性(图 2b)。)。但是,REGγ-KO和WT小鼠的心率没有区别(表 S1)。H&E和WGA染色的组织学分析表明,在REGγ-KO小鼠中,TAC手术诱导的心肌肥大得到明显改善(图 2c,d)。通过Masson染色对心肌纤维化区域的评估还显示,与WT小鼠相比,TAC手术治疗的REGγ-KO小鼠的心脏纤维化较少(图 2e,f)。与这些数据一致,REGγ缺乏明显抑制了TAC手术引起的ANP mRNA水平的上调(图 2g)。)。我们还进行了TEM分析线粒体形态的变化,因为压力超负荷引起的心肌肥大经常与线粒体损伤有关[ 33 ],与KO小鼠相比,REGγ-WT小鼠观察到更严重的变化,其特征是线粒体,液泡更大改变,并分解cr(图2h中的白色箭头 )。这些结果表明,REGγ缺乏可预防病理性心脏肥大。通过免疫印迹检测到REGγ-KO小鼠的特征(图 S1a)。
REGγ缺乏会改善对肥厚性刺激的心脏氧化应激
众所周知,氧化应激在心脏肥大和HF的发病机理中起着至关重要的作用[ 34 ]。肥厚性刺激如压力超负荷或血管紧张素Ⅱ增加心脏ROS水平,和心脏氧化应激促成肥大刺激诱导的心脏肥大或重塑[ 35,36,37 ]。为此,我们评估了REGγ-WT和KO小鼠心脏中的ROS水平。有趣的是,结果表明TAC操作在WT小鼠的心脏中引起ROS水平的显着增加(通过DHE染色测得的超氧化物),而在REGγ-KO小鼠中这种作用被显着抑制(图 3a,b)。REGγ敲低也抑制了NRCM中Ang II诱导的ROS产生(图。 3c,d)和人心肌细胞AC16细胞(图 3e,f)在体外。总的来说,这些结果表明REGγ能够在心脏肥大期间增加ROS水平。
REGγ与PP2Acα相互作用并指导其降解
为了了解REGγ介导的心肌肥大过程中氧化应激调节的分子基础,我们在TAC手术后4周对小鼠心脏进行了质谱分析,评估了最有潜力的REGγ功能结合和可降解靶标(独特肽≥4)如表S3所示 。在质谱分析和基于由先前的报告和参考文献[氧化应激和心脏肥大有关的功能和途径分析38,39,40,41,42,43,44,45,46,47,48,49],以及TAC手术后小鼠心脏中PP2Acα蛋白水平的降低(图 S2a,b),使我们探索并发现PP2Acα在这一过程中可能是REGγ的潜在靶标。PP2A核心酶由65 kDa支架/ A和36 kDa催化/ C亚基组成,受许多结构上不同的调控B亚基之一的结合调控[ 38 ],并占所有大多数细胞和组织中的Ser / Thr磷酸酶活性[ 39 ]。它还在氧化应激和心脏肥大调节[至关重要的作用40,41,42,43,44,45,46,47,48,49 ]。
首先使用小鼠心脏组织或不同细胞类型的细胞提取物检查PP2Acα蛋白和mRNA的水平。免疫印迹(图 4a)结果显示,在REGγ缺乏的心脏组织中PP2Acα蛋白水平较高。一致地,通过数种REGγ特异性siRNA(siREGγ1#,2#和3#)转染REGγ敲低后,AC16细胞中PP2Acα蛋白水平增加,而通过Flag-REGγ质粒转染REGγ过表达后PP2Acα蛋白水平降低(图 4b)。 ,c)。但是,与REGγ+ / +或siNeg相比,REGγ缺乏的心脏组织或siREGγAC16细胞中的PP2AcαmRNA表达较低(图 4d),这表明REGγ可能通过增强PP2Acα蛋白的更新来调节PP2Acα。
一个 REGγ敲除在小鼠中心脏PP2Acα蛋白水平的增加,并且b REGγ击倒上调PP2Acα蛋白水平,和Ç在AC16细胞REGγ过表达下调PP2Acα蛋白质水平通过免疫印迹分析,而d REGγ敲除或在鼠心脏击倒下调PP2AcαmRNA表达或AC16电池。È在293T细胞REGγ和PP2Acα之间的相互作用是通过免疫共沉淀和免疫印迹分析以下的Flag-REGγ/标记向量和HA-PP2Acα的瞬时转染到293T细胞中来确定。F在将Flag-PP2Acα/ Flag载体和HA-REGγ瞬时转染到293T细胞后,可通过共免疫沉淀法进行REGγ和PP2Acα之间的相互作用。g使用抗REGγ抗体或IgG对照沉淀AC16细胞中的内源REGγ,并通过免疫印迹检测共沉淀的PP2Acα。h通过使用抗PP2Acα抗体或IgG对照进行AC16细胞中内源性REGγ和PP2Acα之间的交互作用,并通过免疫印迹检测共沉淀的REGγ。(i)siNeg和siREGγNRCM 中内源PP2Acα的稳定性以及(j)相对PP2Acα降解的相应定量图或(k)siNeg和siREGγAC16细胞和(l)相对PP2Acα降解的相应定量图。(重复实验3次;误差线代表标准偏差,* P <0.05,** P <0.01,Student's t检验。)将细胞用CHX(100μg/ mL)处理指定的时间,然后进行免疫印迹。内源PP2Acα在(m)siNeg,siREGγ和siREGγ加上GFP-REGγ质粒AC16细胞和(n)用MG132预处理的AC16细胞中的稳定性。细胞用CHX(100μg/ mL)处理指定的时间,然后进行免疫印迹。ØREGγ直接促进PP2Acα的降解。如“材料和方法”中所述和使用纯化的REGγ,20S蛋白酶体和体外翻译的PP2Acα蛋白进行了体外蛋白水解分析。REGγ的已知底物p21显示为阳性对照。
随后,我们通过瞬时表达FLAG(被抗Flag识别的小肽标签)-PP2Acα/HA-REGγ或HA-PP2Acα/FLAG-REGγ的组合以及Flag矢量控制,从而证实了REGγ和PP2Acα之间的物理相互作用。 FLAG-M2琼脂糖珠在293T细胞中进行双向免疫沉淀 标记FLAG的PP2Acα或REGγ成功地共免疫沉淀未标记的REGγ或PP2Acα,而Flag载体对照不能拉下蛋白质(图 4e,f)。为了确保特异性,我们还使用AC16细胞裂解物进行了内源性共免疫沉淀分析,观察到相似的结果(图 4g,h)。
为了检查REGγ在PP2Acα蛋白降解中的活性,我们测试了PP2Acα的降解动力学。经过CHX处理不同时间后,REG2-WT NRCMs或AC16细胞中的PP2Acα降解速度比REGγ-nockdownNRCMs或AC16细胞中降解更快(图 4i-1)。我们在siNeg和siREGγH9C2细胞中证实了这一点(图 S3a,b)。为了确保这一点,我们通过REGγ的预敲除加上质粒的过表达进行了拯救实验,如图4m所示。 PP2Acα在REGγ-WTAC16细胞中显着降解,但在REGγ敲低中未降解,当与外源GFP-REGγ质粒瞬时转移时,REGγ敲低细胞恢复了PP2Acα降解的功能,表明REGγ是PP2Acα蛋白质稳定性所必需的。此外,我们还进行了蛋白酶体抑制剂(MG132)处理实验,以增强REGγ-蛋白酶体在PP2Acα降解中的作用,如图4n所示 ,当用MG132处理时,PP2Acα的降解在REGγ-WT和REGγ中无显着差异。通过CHX处理不同时间段来敲低AC16细胞。
为了确保REGγ对PP2Acα降解的影响是直接的,我们使用了无细胞蛋白水解,如前所述[ 14 ]。将体外翻译的PP2Acα与单独的20S蛋白酶体或纯化的REGγ一起孵育不会显示PP2Acα的显着降解,但是与单独的20S蛋白酶体相比,REGγ和20S蛋白酶体的组合促进PP2Acα的转化要快得多(图 4o)。因此,我们得出结论,PP2Acα是体外和细胞中REGγ-蛋白酶体的直接靶标。
REGγ降低SOD2表达
为了确定在此过程中调节的REGγ的详细途径,我们检查了肥大刺激过程中某些下游直接关键效应子在氧化应激调节中的表达。
在细胞内空间,几个抗氧化酶(例如,SOD2,SOD1,过氧化氢酶,硫氧还蛋白还原酶[的TrxR])是用于确定ROS水平和维持心脏功能[临界34,35,50,51,52,53,54 ]。mRNA表达(图 5a–e)的RT-qPCR分析表明,REGγ基因敲除或敲除(通过几种REGγ特异性siRNA,siREGγ1#,2#和3#转染)显着抑制了TAC在小鼠心脏或Ang II在AC16中诱导的SOD2表达下降。 REGγ过表达(通过Flag-REGγ质粒转染)在AC16细胞中的作用相反。通过SOD2启动子荧光素酶试验在AC16细胞中观察到了相似的结果(图 5f,g)。但是,REGγ不能影响假手术或在小鼠心脏中进行TAC手术时SOD1,过氧化氢酶或TrxR的表达(图 S4a–e,图 5h–l)。小鼠心脏或AC16细胞中SOD2表达的免疫印迹结果与所显示的mRNA组相同,表明与mRNA和荧光素酶结果一致。这些发现表明,REGγ主要在氧化应激和心脏肥大刺激的调节中抑制SOD2的表达。REGγ基因敲低和过表达效率通过实时定量PCR分析进行定量(图 S5a–d)。
一个 REGγ缺乏抑制小鼠的心脏SOD2 mRNA表达响应于TAC操作4周的下降(Ñ 每组= 6; ** P <0.01,*** P <0.001,单向ANOVA检验)。b REGγ击倒上调SOD2 mRNA表达,并Ç REGγ过表达下调SOD2 mRNA在人心肌AC16细胞中的表达。(实验重复三次;误差棒表示标准偏差,** P <0.01,*** P <0.001,单向ANOVA测试)d REGγ敲低抑制在SOD2 mRNA表达的下降,和ÈREGγ的过表达促进人类心肌细胞AC16细胞响应Ang II治疗后SOD2 mRNA表达的下降。f,g通过SOD2启动子荧光素酶测定法在AC16细胞中观察到了相似的结果。(实验重复了3次;误差线代表标准偏差,** P <0.01,*** P <0.001,单向ANOVA测试。)在假手术小鼠心脏中,免疫印迹(h)也观察到相似的一致结果或TAC手术4周,并在指定治疗后AC16细胞中进行免疫印迹(i – l)。
REGγ以PP2Acα–FoxO3a依赖性方式降低SOD2表达
我们假设PP2Acα通路可能是肥大刺激中REGγ依赖性SOD2基因表达调控的必需条件。已知的是,FOXO3A是细胞的存活和活性氧代谢的关键调节剂[ 55,56 ],并且可以响应于在非心源性细胞[氧化应激调节SOD2表达55 ]。此转录因子是通过可逆的磷酸化和亚细胞定位调节中,通过激酶磷酸化定向失活,并通过磷酸酶介导的去磷酸化活化的[ 57,58 ]。激酶,例如Akt以及血清和糖皮质激素诱导的激酶,在相同的位点Thr32,Ser253和Ser315磷酸化FoxO3a [ 59,60 ],尽管具有不同的亲和力。有这些网站Thr32磷酸化的,使得标识可以被用来指示其他两个位点,其活性[磷酸化之间的协同性60,61 ]。磷酸化的FOXO3A的激活可能是通过普遍存在的苏氨酸/丝氨酸磷酸酶,蛋白磷酸酶2A [发生58 ],并在不同的疾病进展[可发挥作用62,63,64 ]。
为了评估SOD2表达中的REGγ–PP2Acα–FoxO3a轴,我们首先测试了REGγ+ / +和REGγ-/-心脏组织以及siNeg和siREGγNRCM和中的PP2Acα,P-FoxO3a(Thr32)和SOD2的蛋白质水平通过免疫印迹鉴定AC16细胞(图 6a)。敲除或沉默REGγ可以防止PP2Acα的降解,FoxO3a磷酸化的大量降低以及REGγ敲除的心脏组织或REGγ敲除的心脏细胞中SOD2表达的增加,并与PP2Acα的蛋白积累有关,提示REGγ可能通过PP2Acα调节FoxO3a磷酸化及其下游目标SOD2表达。为了确定REGγ是否通过PP2Acα调节FoxO3a的磷酸化,我们评估了REGγ+ / +和REGγ-/-心脏组织中的磷酸化(图 6b)),然后在AC16细胞中通过几种REGγ特异性siRNA(siREGγ1#,2#和3#)转染REGγ(图 6c)。敲除或沉默REGγ减少FoxO3a磷酸化。为了确定REGγ是否调节FoxO3a的亚细胞定位并使其磷酸化,我们使用AC16细胞进行了免疫荧光。我们观察到通过siREGγ转染进行的REGγ敲低促进了AC16细胞中FoxO3a从细胞质向细胞核的转运(图 6d,e)。在NRCM中观察到了相似的结果(图 S6a)。细胞分级测定的相似结果(图 6f)),REGγ敲低促进了FoxO3a的核定位。由于PP2Acα是FoxO3a的结合伴侣,并且在FoxO3a的去磷酸化调节中起着至关重要的直接作用,因此核定位和转录激活取决于它们的相互作用[ 62 ]。首先,我们通过在AC16细胞中进行内源性相互免疫沉淀(图S7a,b)并使用可渗透性PP2Acα(OA)处理的抑制剂来证实它们的相互作用 ,内源性P-FoxO3a积累了,而PP2Acα的过表达降低了内源性P-FoxO3a。 AC16细胞中的水平(图 6g),证明PP2Acα对FoxO3a磷酸化的负调控。然后,为了确定REGγ,PP2Acα和FoxO3a之间的因果关系,在OA或PP2Acα质粒转染处理前后,进一步分析了REGγ介导的FoxO3a磷酸化调节。通过OA处理阻止PP2Acα活性或通过质粒转染过表达PP2Acα显着减少了AC16细胞中REGγ敲低引起的FoxO3a磷酸化水平的变化(图 6h,i),表明REGγ以PP2Acα依赖性方式调节FoxO3a磷酸化。(图 6j–m)免疫荧光和(图 6n)观察到细胞分馏分析,表明REGγ以PP2Acα依赖性方式调节FoxO3a细胞内定位。综上所述,我们的结果表明REGγ以PP2Acα依赖性方式调节FoxO3a磷酸化和细胞定位。
aREGγ+ / +和REGγ-/-心脏组织以及siNeg和siREGγNRCM和AC16细胞中PP2Acα,P-FoxO3a和SOD2 的蛋白水平。敲除或沉默REGγ可降低(b)小鼠心脏组织或(c)人心肌细胞AC16细胞中FoxO3a的磷酸化水平。REGγ敲低促进FOXO3A的易位从细胞质到由AC16细胞细胞核d免疫荧光分析(比例尺为20μm)和Ë相应定量图形和˚F细胞分级分离测定法。(重复实验3次。误差线代表标准偏差,** P <0.01,Student's t检验。)gOA处理或AC16细胞中PP2Acα过表达后P-FoxO3a的水平。h通过OA处理过分表达PP2Acα或i阻止PP2Acα活性显着减少了AC16细胞中REGγ敲低,(j – m)免疫荧光分析的相似结果(比例尺:20μm)和相应的定量图所引起的FoxO3a磷酸化水平的变化。FoxO3a易位,并观察n细胞分级测定。(实验重复了三遍。误差线代表标准偏差,** P <0.01,单向方差分析。)oPP2Acα过表达,通过PP2Acα质粒抑制或抑制活性,siPP2Acα转染或OA处理,或者FoxO3a过表达或FoxO3a或siFoxO3a质粒抑制的SOD2表达。p - - [R PP2Acα击倒,过度表达,或活性抑制显着地救出或减毒血管紧张素Ⅱ的SOD2 mRNA表达的刺激无论REGγ水平。s,t FoxO3a的过表达或敲低减弱了REGγ引起的Ang II刺激的SOD2 mRNA表达的变化。ü,v萤光素酶测定的类似的结果在AC16细胞中观察到。(实验重复了三遍;误差棒代表标准偏差,** P <0.01,** * P <0.001,单向方差分析)。
然后我们确定了REGγ介导的SOD2表达调节是否会受到PP2Acα水平和PP2Acα–FoxO3a轴的操纵的影响(图 6o)。)。我们首先通过外源质粒过表达PP2Acα或FoxO3a,或通过对PP2Acα或FoxO3a的RNA干扰敲低PP2Acα或FoxO3a,或分别用PP2Acα-FoxO3a轴抑制剂(OA)处理以阻断途径,并证明SOD2确实需要PP2Acα或FoxO3a在AC16细胞中表达。然后同时进行REGγ敲低和PP2Acα过表达,敲低或抑制,以及FoxO3a过表达或敲除,以确定REGγ是否以PP2Acα–FoxO3a依赖性方式调节SOD2表达。敲除REGγ可以显着抑制Ang II刺激引起SOD2 mRNA表达的下降,但是当细胞过表达PP2Acα(图6p),敲低PP2Acα 时,未观察到这种REGγ引起的下降 (图 6q)。)或用PP2Acα抑制剂OA(图 6r)处理,当在AC16细胞中过表达FoxO3a(图6s)或通过实时qPCR检测敲低FoxO3a(图 6t)时,观察到相似的结果 当同时敲除REGγ和PP2Acα或FoxO3a时,在SOD2启动子荧光素酶测定中观察到了这一点(图 6u,v)。两者合计,我们的研究结果表明,REGγ响应肥大刺激以PP2Acα–FoxO3a轴依赖性方式调节SOD2表达,并可能在氧化应激和心脏肥大中发挥作用。REGγ敲低,PP2Acα敲低和过表达效率(图 S8a–e)和REGγ敲除,FoxO3a敲除和过表达效率(图 S9a–d)通过实时定量PCR分析定量。
REGγ诱导的心脏ROS产生和肥大相关异常取决于PP2Acα–SOD2轴
然后,我们调查了PP2Acα–SOD2轴是否实质上对REGγ对心脏ROS积累和肥大的影响有贡献。为了对此进行评估,我们首先测试了siNeg和siPP2AcαAng II处理的AC16中的ROS水平,无论是否挽救了SOD2过表达,并证明PP2Acα确实需要SOD2来抑制AC16细胞中的ROS积累(图 7a,b)。然后,我们通过PP2Acα或SOD2过表达在AC16细胞中进行了抢救实验(图 7c,d)。PP2Acα或SOD2过表达(图7e,f)抑制了Ang II处理的AC16细胞中由REGγ引起的ROS积累。通过免疫印迹评估了REGγ,PP2Acα的敲低和PP2Acα,SOD2的过表达(图 S10a–c)。然后要确定REGγ是否确实通过抑制ROS积累来体内调节心脏肥大,我们已经证明了这一点。我们还在小鼠中使用超氧化物歧化酶模拟物锰5、10、15、20-四-(4-苯甲酸)卟啉-MnTBAP(MnT)进行了拯救实验(图 7g,h)。MnTBAP(MnT)处理确实阻止了TAC处理的WT和REGγ-KO小鼠心脏中的ROS产生。值得注意的是,向TAC处理的WT小鼠施用MnTBAP使HW / BW比逆转至与REGγ-KO小鼠相同的程度(图 7i),对于HW / TL比观察到相似的效果(图 7i)。 。此外,接受MnTBAP的TAC处理的WT小鼠表现出与REGγ-KO小鼠相似的心脏功能(图 7j)。然而,在指定的REGγ-KO组和WT小鼠组之间,心率无明显区别(表 S2)。根据横截面积(图7k,l)和ANP表达(图7k,1)测得REGγ对肥大性反应的影响。 图 7m)被MnTBAP完全消除了。总的来说,这些数据表明,由PP2Acα降解和随后的SOD2降解引起的增强的氧化应激在REGγ介导的肥大作用中起关键作用。
PP2Acα确实需要SOD2来抑制心肌细胞中的ROS积累。一个,b SOD2过表达抑制引起的PP2Acα击倒ROS积累,Ç,d PP2Acα或é,˚F通过DHE染色SOD2过度表达拯救血管紧张素引起REGγROS积累II处理的人心肌AC16细胞(比例尺为40μm),并DHE相对荧光的相应定量图,表明PP2Acα–SOD2轴基本上有助于REGγ对心脏ROS的积累。(实验重复了三遍;误差棒代表标准偏差,*** P <0.01,单向方差分析。)MnTBAP(MnT)治疗可防止心脏ROS的产生以及由REGγ引起的肥大相关异常。g心脏DHE染色(比例尺:50μm)和h相应的DHE相对荧光定量图,i心脏重量与体重(HW / BW)之比以及心脏重量与胫骨长度(HW / TL)之比,j心脏射血分数(EF)和缩短分数(FS),k苏木精和曙红(H&E)染色(比例尺:40μm),以及(l)相应的心肌细胞横截面积定量图,m进行指定操作(Sham-MnT,TAC或TAC-MnT)4周后,WT和REGγ-KO小鼠的心脏ANP mRNA表达( 每种基因型n = 6;*** P <0.001,** P <0.01 ,单向方差分析测试)。
讨论区
在这项研究中,我们发现REGγ在TAC诱导的肥大性心脏中显着上调,并且我们描述了负责REGγ介导的心脏肥大调节的机制。REGγ通过直接将PP2Acα靶向降解并随后降低SOD2而通过增加心脏ROS积累来调节该过程。响应于肥大刺激,REGγ显着增加并靶向PP2Acα降解,这导致FoxO3a磷酸化和核输出增加,随后心脏SOD2下降和ROS积累,从而导致心脏肥大。
ROS影响的几乎所有的心脏适应不良,包括肥大反应,收缩功能障碍,细胞外基质重塑,和心律不齐[关键特征65,66,67 ]。尽管这项研究并未排除REGγ促进肥大的其他可能机制,但MnTBAP对氧化应激的抑制作用足以阻止REGγ介导的肥大反应,这表明ROS积累在该过程中起主要作用。在人类中,线粒体的抗氧化剂(例如,SOD2,过氧化氢酶,谷胱甘肽过氧化物酶,和的TrxR)增加心血管疾病的风险[突变68,69,70,71]。SOD2为正常的心脏功能和SOD2功能甚至相对轻微的减少或突变必要可导致心功能不全[ 51,67 ]。另外,在小鼠SOD2缺乏导致扩张性心肌病[ 65,72 ],SOD2的蛋白水平在小鼠中显着降低心脏肥厚和人未能心肌[ 73,74 ]。我们的数据表明,REGγ基因敲除可以通过靶向PP2Acα降解来防止TAC或Ang II诱导的SOD2下降,表明REGγ可能是改善PP2Acα氧化应激引起的病理性心肌肥大的关键因素。
尽管以前的研究报告说,PP2A保护对抗氧化应激非心脏细胞在体外[ 38 ]和PP2A负调节PP2A的肥大反应和心肌特异性缺失导致心肌肥厚[ 39,40 ],表明PP2A可在起到保护作用心脏肥大的进展,尚不清楚PP2Acα在心脏氧化应激和肥大中的详细机制,在这里我们演示了PP2Acα在此过程中调控的关键途径,并首先发现REGγ通过靶向PP2Acα在心脏肥大中起作用。并且,虽然以前的报道表明PP2A提神叉头框蛋白O(的FoxO)活性可与Akt的或其它蛋白质[相互作用62,75],并确定PP2A是FoxO3a的结合伴侣,并且在FoxO3a的去磷酸化,核定位和转录激活的调节中起着关键作用[ 62 ],我们也在这里证实了它们的相互作用并证明REGγ调节FoxO3a。在心肌细胞中以PP2Acα依赖性方式进行磷酸化和细胞内定位,可能还有其他激酶或介体参与该调节,并且在此过程中还需要FoxO3a和PP2Acα之间特异性结合位点和/或介体的详细机制并加强以后的学习。
总体而言,我们确定REGγ是心脏肥大的新型调节剂,并提供了蛋白酶氧化应激与心脏肥大之间可能联系的新颖机制,这可能对心脏肥大和HF的理解和治疗产生重大影响,但是REGγ和20S蛋白酶体对心脏肥大的相互作用和活性调节的详细机制,以及REGγ如何将PP2Acα转移到20S蛋白酶体中进行降解尚不十分清楚,应考虑进一步研究REGγ-PP2Acα/蛋白酶体和人体样品的精确调节在未来的研究中,它可能为调节肥大性疾病的蛋白酶体活性提供更多的证据和治疗方法。
|
|