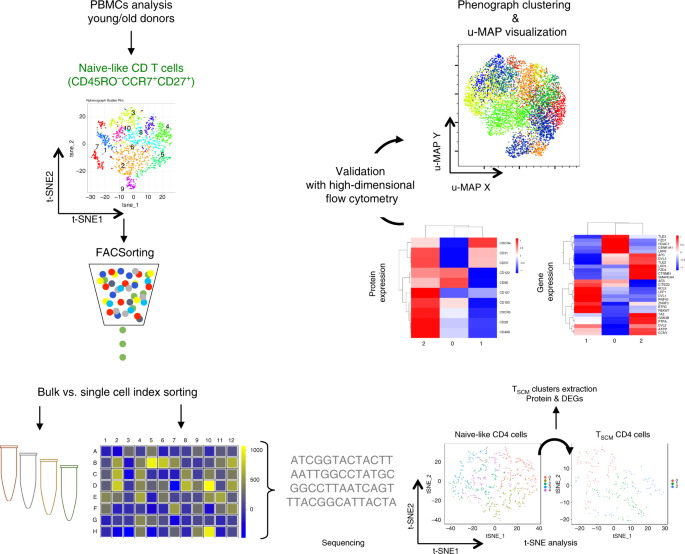
免疫史通过Wnt信号通路控制人类干细胞记忆CD4异质性
免疫史通过Wnt信号通路控制人类干细胞记忆CD4异质性
摘要
幼稚的T细胞库的多样性驱动着记忆T细胞的补充潜力和能力,以应对免疫挑战。免疫系统的减员与老年个体中疾病的患病率增加有关,但是尚不清楚干细胞记忆T淋巴细胞(T SCM)是否有助于这种减员。使用单细胞RNA测序和高维流式细胞仪,我们证明T SCM异质性来自Wnt信号的不同参与。在人类中,衰老与CD4 T SCM中Wnt /β-catenin信号的耦合丧失相关以及Dickkopf相关蛋白1(Wnt /β-catenin途径的天然抑制剂)水平的全身性升高。功能分析支持最近的胸腺移民作为CD4 T SCM的前身。因此,我们的数据表明,通过免疫靶向Wnt /β-catenin途径逆转T SCM缺陷可能是在免疫史的背景下恢复和保持免疫稳态的可行方法。
介绍
干细胞样的自我更新能力是免疫记忆的T细胞的一个重要特征,保留的个体寿命健康1,2。自然获得性免疫或初次感染和疫苗接种期间发生的长期保护的诱导3,4 -即使在没有再暴露于相应免疫剂。维持免疫记忆需要保持T细胞干性和各种T细胞区室的灵活性,以在持久性静止状态和增生状态之间交替,其中特定克隆不对称分裂,从而产生活化的记忆和效应T细胞5,6,这对于抗原再暴露过程中清除病原体至关重要7。
干细胞记忆T淋巴细胞(T SCM)的最新发现填补了一个重要的空白,迄今仍使我们对记忆T细胞的个体发育的理解变得模糊。Ť SCM代表在动物模型(小鼠,非人灵长类动物)和人类的离散但可检测的表型人口8,9,10。这些细胞不仅具有自我更新的能力,而且还具有分化成记忆T细胞和效应T细胞11的所有子集的能力。与它们的寿命相结合,T SCM可塑性的保持可能在维持12岁以后的免疫能力方面起着核心作用。它们在自身免疫性疾病,慢性感染和癌症发展中的重要作用已经将它们确定为未来疫苗或适应性T细胞疗法的假定靶点13。虽然T的缺乏SCM外周血限制体外研究的可能性,T SCM可以按照与IL-7 / IL-15体外刺激从幼稚T细胞演变14,的的Wnt /β-catenin的活化9,15和陷波路径16或mTOR信号传导的调制17。关于T SCM的大多数研究都集中在CD8 T细胞上,但是幼稚的CD4 T细胞的生成和编程到T SCM中可能通过类似的机制发生。无论后者是通过推定的T特异性转录编程实现SCM -precursors,即胸腺近期移民(RTE),幼稚的CD4 T细胞增殖稳态历史(CD31 -,CD103)+幼稚T细胞,记忆T细胞与幼稚表型(T MNP)18,或虚拟记忆T细胞19仍然是未知的20,21,22。此外,尚不清楚在衰老过程中胸腺退化的过程中是否保留了T SCM 23并且内存仓膨胀变得明显。年龄依赖性胸腺衰退限制胸腺近期移民(T的输出RTE),该高度表达PTK7 24和CD31 25,26,27。免疫衰老的过程总结了一系列在衰老过程中累积的免疫缺陷,这不仅是由于免疫细胞代表的部分变化(例如,幼稚28的逐渐下降和记忆分化的T细胞的积累)引起的,由于内在细胞重塑而产生的免疫信号缺陷导致功能丧失。
在本文中,我们检验了以下假设:人类衰老(按时间顺序或“由慢性HIV感染引起的炎症”)会影响T SCM的更新能力。流式细胞仪表型分析,单细胞RNA测序,共聚焦成像和功能分析相结合,为我们的研究提供了支持。我们的结果表明(i)随着年龄和慢性炎症的发生,T SCM频率降低;(ii)老化损害了CD4 T SCM中的Wnt /β-catenin信号;(iii)炎症和衰老促进DKK-1(Wnt /β-catenin途径的天然抑制剂)的产生;(iv)CD4 RTE是最可能的外围CD4 T SCM来源细胞。总体而言,我们的数据因此揭示了通过治疗性靶向Wnt /β-catenin途径复兴CD4 T细胞区室的潜力。具体而言,我们可以通过校准使用Wnt /β-catenin激动剂来恢复受免疫史影响的T SCM功能和多样性丧失。
结果
老化过程中T SCM CD4细胞的耗竭
尽管有大量关于CD4 T细胞分化的文献,但对天真或早期记忆CD4 T细胞亚群的个体发育知之甚少。尽管CD45RO - CCR7 + CD27 + CD62L + CD4 T细胞分组到同质的T NAIVE细胞区室,但研究通常无法理解它们的异质性,尽管它们表达了其他功能性T细胞标记物(补充表 1)。我们假设与全球T NAIVE细胞(CD45RO - CCR7 +),T SCM相比鉴于它们的可塑性,在老年人中可能更具有异质性和更好的持续性,以弥补他们的胸腺生成减少。为了说明这一点,我们使用高维流式细胞术,分子和单细胞分析与多种分析工具(包括t 标记)的组合,将宽泛的原始表型(图1;补充图1A)中的T细胞表征 为不同的种群。 -SNE,uMAP,Seurat和扩散图)。
Workflow of high-dimensional analysis to characterize the heterogeneity of human CD4 TSCM cells. Arrows represent in vitro or in silico experiments, respectively. CCR7+CD45RO−CD27+ CD4 T cells from young (n = 4) and elderly donors (n = 4) were index sorted and distributed as single cells in 96-well plates (two plates per donor) (1). The MFI corresponding to surface protein expression for each individual cell was recorded for CD28, CD31, CD49d, CD95, CD122, CD127, CD150, CXCR3, CXCR4, and CCR7. A library of DNA sequences was established after the RNA extraction of each individual cell (2). The analysis of single-cell RNA-seq data was reported with t-SNE to identify the clusters of cells with similar profile of gene expression (3). Levels of CD95 protein expression were overlaid on the different clusters to identify clusters that were enriched in TSCM (4). The clusters corresponding to CD4 TSCM were extracted and re-analyzed by t-SNE (5). The heterogeneity of CD4 TSCM 已通过FACS Symphony高维流式细胞术染色进行了验证(6)。
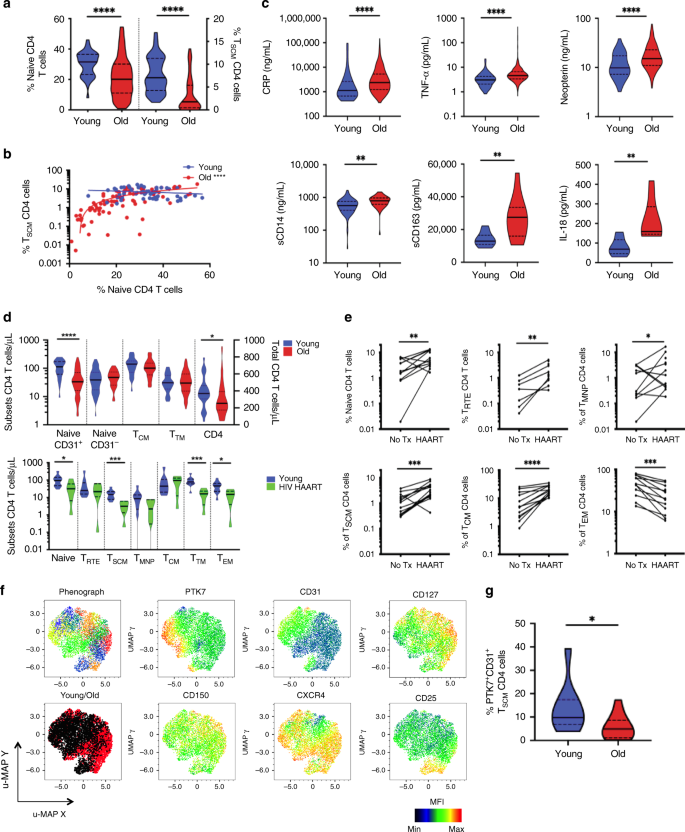
首先,CD4 T SCM频率显示出比T NAIVE细胞更为显着的年龄相关趋势( 对于年轻和较年长的捐助者,p <0.0001,n = 43和n = 166,分别为图 2a),后者可能是如衰老过程中T RTE的周围减少所显示,与胸腺萎缩相关(补充图 1B,C);我们观察到CD8 T细胞的趋势相似(p <0.0001,补充图 1D)。尽管T SCM和T NAIVE频率降低,这两个人群之间的相关性仅存在于老年个体中(图 2b,n = 78,r = 0.7188,p <0.0001),表明衰老过程中体内稳态失调。
在老化过程中T SCM CD4细胞的耗竭。收集新鲜分离的PBMC并染色以进行流式细胞术。对未配对样品进行统计学分析(U Mann–Whitney检验)(****,p <0.0001)。b老化过程中幼稚T细胞亚群之间的关系。比较了年轻人和老年人中T SCM和幼稚T细胞的频率(Spearman等级检验,p <0.0001,r = 0.749)。c炎症和衰老。在年轻和较年长的供体血浆中测量促炎分子(n = 99和n = 874)。对未配对样品进行统计学分析(U Mann–Whitney检验)(**和****分别为p <0.01和p <0.0001)。d在衰老和慢性HIV感染期间,表达CD31的幼稚CD4 T细胞和T SCM CD4细胞的反射。对年轻(n = 28)和老年供体(n = 70)的新鲜血液进行染色。在衰老过程中枚举了总的CD4 T细胞(右Y轴)或CD4 T细胞子集(左Y轴)。在马来西亚健康献血者队列的外周血中监测绝对计数(n = 10)与经cART治疗的HIV感染患者(n = 6)。对未配对样品进行统计学分析(U Mann–Whitney检验; *,**,***和****分别为p <0.05,p <0.01,p <0.001和p <0.0001)。e成功治疗HIV后,恢复CD4 T细胞分布。在启动cART之前和之后48周对CD4 T细胞亚群频率进行了纵向随访。对配对样本进行统计学分析(Wilcoxon符号秩检验)(**,***和****分别用于p <0.01,p <0.001和p <0.0001)。f通过高维单细胞流式细胞仪染色,CD4 T SCM的异质性。串联20个供体的CD4 T SCM细胞。CD4 T SCM簇通过点线仪和冷热图可视化,代表每个标记的强度。它们在衰老过程中的分布以来自年轻和老年患者的CD4 T SCM的覆盖群体为代表。g老化期间“类RTE” CD4 T SCM群集减少。通过流式细胞术定量CD31 + PTK7 + T SCM CD4细胞的频率。对未配对样品进行统计学分析(Mann-Whitney,*为p <0.05)。除了(f)以外,所有图的源数据均作为源数据文件提供。
一个主要的假设是,衰老过程中炎症和慢性感染(如HSV,CMV,登革热或幽门螺杆菌)的增强会影响免疫稳态并有助于病理(补充表 2)。持续刺激病毒特异性T SCM CD4细胞可能会使它们的分化偏向炎症样状态。在老年人中,促炎分子的水平(图 2c)显着升高,这与发炎的概念一致。在艾滋病毒感染期间也观察到这些升高。我们分别展示了较低的绝对绝对CD31 +天真度(包括T RTE和T SCM)和T SCM在独立的衰老(n = 98)和HIV感染的人群(n = 16)中,CD4 T细胞计数(图 2d;补充图 1E)。HAART后29全身炎症标志物(Galectin-9,sCD163)和CD4 T细胞计数(和亚群)水平的逆转支持了HIV在驱动炎症和CD4耗竭中的这种作用(图 2e;补充图。 1F)。尽管CD4 T SCM和T CM似乎最容易感染HIV 30,但其回收率也最为显着(分别为p = 0.0004和p <0.0001;n = 14)。相反, 通过治疗可降低晚期分化T EM的频率(p <0.0001,n = 14)。总体而言,这些结果与这样的假设是一致的,即终身免疫史和炎症水平可能会改变CD4 T细胞亚群的分布,干扰胸腺活性31,并显示出与炎症水平缓解有关的可逆性。
接下来,我们通过高维流式细胞术检查了T SCM的异质性。在这里,在年轻和老年供体中都鉴定出了几个T SCM簇(来自CCR7 + CD45RA + CD27 + CD95 +)(图 2f,分别为黑/红图)。这些簇表现出PTK7,CD31,CD127,CD150和CXCR4的差异表达。我们观察到单个T SCM群集的表示在老化过程中发生了变化。例如,在老年供体中,共表达PTS7和CD31(类RTE)的T SCM群体减少(图 2g,p <0.05,n = 9和n = 13(分别针对年轻和老年捐赠者)。T NAIVE,T RTE和T SCM的丧失在年长的HIV患者中加剧,他们也表现出T MNP和T EM人群同时富集(补充图 1E)。最后,尽管HAART有助于T SCM亚组的短暂恢复,但即使经过长期治疗,T SCM的绝对计数也无法正常化(图 2d,e)。
T SCM和Wnt信号通路的异质性
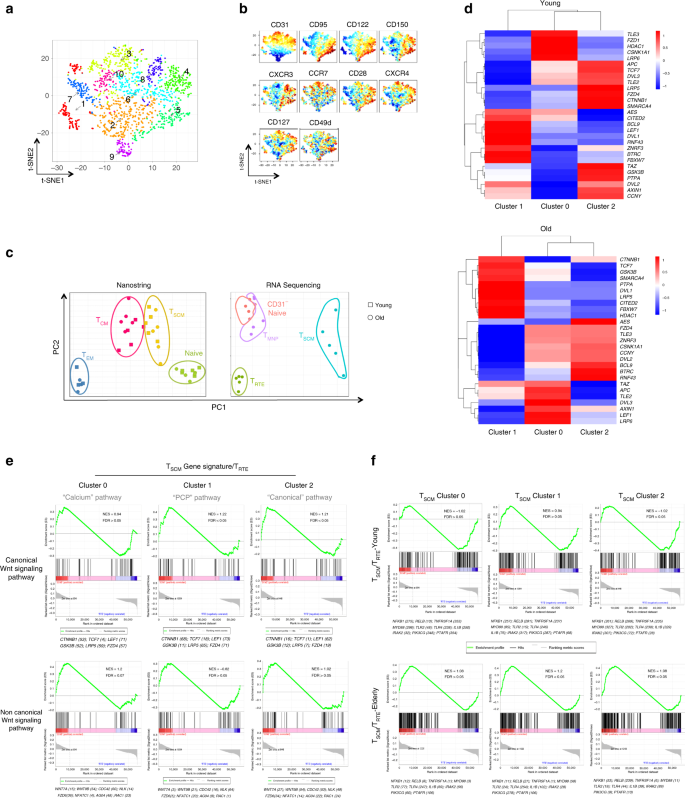
除了在老化过程中改变上述标记外,我们还使用无监督方法研究了其他标记的动力学。在此,基于几种分化相关标记的组合表达,将“天然” CD4 T细胞(CD45RO - CCR7 + CD27 + CD62L +)分为不同的种群(图 3a,b)。从流式细胞仪结果获得的十个簇中,我们能够鉴定出具有T SCM表型的簇(CCR7 + CD45RO - CD27 + CD62L + CD122 + CD95 +,第5组),可以从不成熟来区分Ť RTE(CCR7 + CD45RO - CD27 + CD62L + CD122 - CD95 - CD31 高,第3组),T NAIVE(CCR7 + CD45RO - CD27 + CD62L + CD122 - CD95 - CD31 - ,集群10)和T MNP(CCR7 + CD45RO - CD27 + CD62L + CD122 - CD95 - CD31 -CD49d 高 CXCR3 +细胞,簇8)细胞。为了证明这些子集在转录组水平上是唯一的,我们进行了RNA测序,包括在单细胞索引排序后。无论年龄大小,CD4 T SCM的遗传异质性都比其他CD4 T细胞子集更高(图 3c,左图和补充图 2A,B)。T CD31 阴性NAIVE,T RTE,T MNP和T SCM CD4 T细胞表现出独特的基因表达谱(图 3c,右图),而非RTE幼稚和T MNP紧密聚集;后者的子集的亲近性可以通过它们对CD28,CD122,CD150和CXCR3表达的协同调节得到证实(补充图 1A,2C,D)。
高维流式细胞仪揭示了幼稚CD4 T细胞的异质性。将8个供体(4个年轻的供体和4个老年的供体)的原始CD4 T细胞定义为CCR7 + CD45RO - CD27 +,并通过t-SNE进行分析。簇通过phenograph可视化。b幼稚CD4 T细胞簇的表型。每个标记的荧光强度通过归一化的热图(从蓝色到红色表达增加的梯度)可视化。c在衰老过程中保留CD4 T SCM细胞的特定基因标记。天真的,T SCM,T CM和T EM CD4 T细胞(n 对于按年龄划分的所有子集,除T EM= 5外,n = 3)进行了分类,并通过纳米串分析了其基因表达。原始T细胞亚群被分类为原始,T RTE,T MNP和T SCM CD4细胞,并通过RNA-seq(n = 5)进行分析。进行了mRNA表达的PCA分析,以评估衰老过程中T细胞亚群签名的特异性和保存性。d CD4 T SCM和Wnt /β-catenin信号通路的异质性。通过scRNAseq 鉴定年轻和老年人供体中的CD4 T SCM簇。在年轻的所有幼稚CD4 T细胞亚群中,对应于CD4 T SCM的单个细胞(n = 946)或较旧的供体(n = 993)通过t-SNE分析,并且可以自动识别簇。定量编码Wnt /β-catenin途径的基因的表达,并对年轻和年老供体中的每个簇进行标准化。Ë规范和CD4 + T非经典Wnt信号签名SCM从年轻的捐助者集群。与T RTE比较,计算了CD4 T SCM簇中每个途径检测到的基因表达的富集度签名。GSEA报告的在所有规范和非规范信号通路基因组(GO:0016055)中最丰富的基因组的富集图。该图谱显示了运行富集得分(绿色曲线)和基因组成员在差异基因表达的等级排序列表上的位置(黑色竖线)。f来自新老捐赠者的CD4 T SCM簇中的炎症信号。GSEA报告的所有炎症基因组中最富集的基因集的富集图(GO:0006954)。该配置文件显示为(e)。
基于已建立的T SCM表型(基于在索引排序过程中通过流式细胞仪测量的蛋白质表达),我们研究了与T SCM生成相关的基因(特别是规范Wnt /β-catenin途径(图 3d))是否通过差异表达。不同的T SCM子集以及这些表达模式在衰老过程中是否发生了改变。首先,我们观察到基于与经典Wnt /β-catenin信号传导相关的分子的表达,年轻人中的T SCM分为三个簇(图 3d);这种基因表达模式在衰老过程中也发生了巨大变化(图 3d)。在来自年轻供体(n = 4)的T SCM转录本的基因集富集分析(GSEA,图 3e;补充图 3A)中,我们鉴定了与非经典Wnt-钙和平面细胞极性(PCP)重叠的基因富集簇0和1中的)途径(补充图 3B),而簇2中RNA转录物的表达与典型信号(TCF7,LRP5,GSK3B,CTNNB1和FZD4高表达)最重叠。NFATC1和NLK或RAC1与CDC42和FZD6结合的特异性表达提示钙和PCP途径分别在簇0和1中的参与度增加。除了图2e中列出的那些 基因外,其他基因也参与非规范信号传导(补充图 3A)。值得注意的是,我们发现来自老年供体(n = 4)的T SCM表现出相对较弱的经典Wnt签名(补充图 3B),因为关键分子(如CTNNB1,FZD4,NFATC1,RAC1,CDC42和FZD6在T SCM来自旧捐助者的集群。T SCM中基因签名的完整分析簇揭示了通路,这些通路不仅与Wnt信号无关(补充数据文件 1),而且在衰老过程中也会改变。
T SCM CD4 中Wnt信号信号丧失和炎症
比较来自年轻和老年供体的CD4 T RTE和T SCM的mRNA文库表明,这些亚型可能随着年龄的增长而带有促炎信号(补充图 3C–E;TNF,CD40和NFκB的水平升高); 纳米串进一步验证了这一点(NFκB2和NFκBIZ的p = 0.0067和p = 0.0165,n = 10 ,补充图 2A)。我们进一步观察到,反映激活和功能能力调节的本体簇在T RTE和T 中差异性富集。随年龄变化的SCM(补充图 4A,B)。这些结果使我们推测炎症信号增强,这表现为老年供体所有簇的NFκB和TNF信号变化(图 3f),可能通过改变Wnt信号导致CD4 T SCM稳态失调。
加上艾滋病毒感染的捐助者的观察,我们发现的证据表明其炎症和稳态中的细胞因子水平的变化相伴的是提高水平的32,33,34可能扰乱T的遗传特征SCM和他们的进一步分化。因此,我们检查了由衰老或慢性炎症引起的炎症环境是否会干扰CD4 T细胞发育或破坏T SCM稳态。如上所示,CD4 T SCM和T RTE频率呈正相关,因此可能对重叠的稳态调解人有反应。在研究体内平衡剂,炎症介质和效应介质对健康和HIV供体的影响(补充图 4C,D)时,我们观察到炎症分子的表达与CD4 T SCM的发生率呈负相关(n = 113,p = 0.046, 对于IL-8 ,r = -0.21;n = 23,p = 0.0292, 对于IL-21 ,r = -0.4364;n = 99,p = 0.0063, 对于sCD163 ,r = -0.2727;n = 113,p = 0.0065, 对于sCD14,r= -0.2546,对于n 新蝶呤,n = 98,p = 0.0118,r= -0.2787。在测量的不同促炎细胞因子中,只有IFN-γ与CD4 T SCM频率呈正相关(n = 76,p = 0.0004,r = 0.3967)。如先前针对HIV感染期间的IL-7和幼稚T细胞所述32,IL-21浓度也与CD4 T RTE的百分比呈负相关(分别为n = 23,r = -0.5332和r = -0.5953)。T SCM和T 之间的相关值差异RTE提示对全身炎症环境的敏感性存在差异,这些子集(HLA-DR和Ki-67,补充图4E)激活标记的表达增加也突显了这种差异 。接下来,我们研究了如何将这些分子变化动态地转化为功能或发育特征。
T SCM CD4细胞在衰老过程中的功能侵蚀
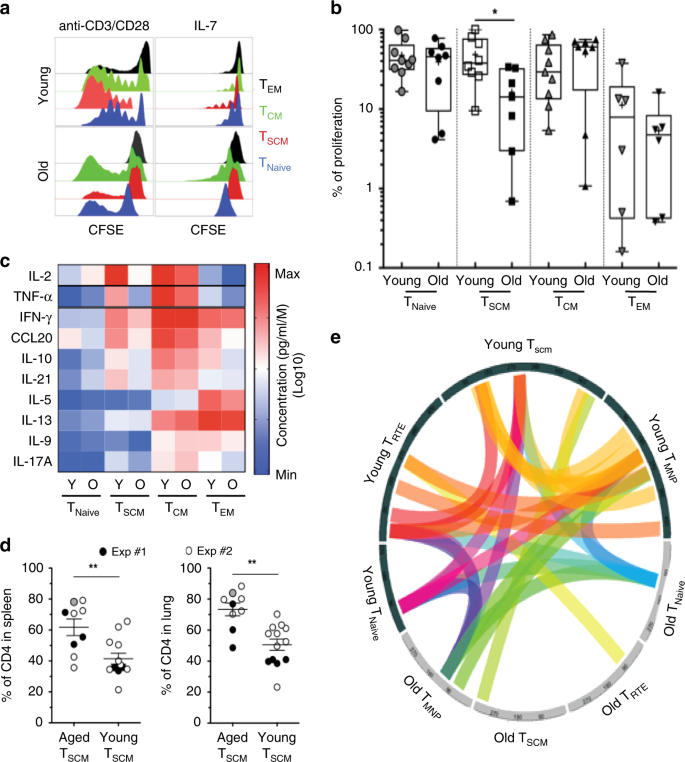
根据我们的发现,我们测试了老化过程中是否发生了特定于T SCM的功能适应。虽然T SCM,T CM,T EM和T NAIVE细胞的主要转录组签名在衰老过程35中保持一致,但编码转录因子(LEF1,TCF7,TBX21,FOXP3,IRF4,BATF,RORC和NOTCH1),细胞因子(IL-5,IL-21,IL-17A和TGF-β),细胞因子受体(IL7R,SOCS1,TNF和IL2R),趋化因子(CCL3,CCL4,CCL15和CCL20)和效应分子(GNLY,GZMB和PRF1)随年龄而变化(补充图 2A,B)。因此,我们测量了年轻和衰老的CD4 T细胞亚群响应TCR或稳态刺激而增殖的能力。正如预期的那样,在健康的年轻供体中,在T SCM细胞中观察到了最高的增殖潜能(图 4a),但是 , 即使与T CM相比,来自成年人的T SCM细胞也显示出增殖能力受损(p = 0.0205,n = 15)。细胞(图 4b)。而且,T的感应IL-7对SCM的增殖以及T SCM的增殖会损害IL-2,IFN-γ和TNF的分泌(补充图 5A)。
在衰老过程中CD4 T细胞亚群的增殖情况。在5天内,从年轻或年长的供体中收集的分类T细胞亚群中CFSE稀释的代表性直方图,并用抗CD3 / CD28微珠或IL-7(10 ng / ml)刺激。b如(a)中所测量,响应TCR刺激,T SCM CD4细胞的增殖潜能的改变。T细胞亚群是从年轻和较老供体的血液中新鲜分离的( 分别为n = 8和9)。对未配对样品进行统计学分析(U Mann–Whitney检验)(*表示p <0.05)。源数据作为源数据文件提供。CT SCM CD4细胞在衰老过程中体内稳态和效应细胞因子的分泌减少。用PMA /伊诺霉素对克隆的CD4 T细胞亚群进行多克隆刺激。细胞因子浓度由热图表示,以可视化分化过程中效应子功能的获得以及与衰老相关的特定特征( 年轻和老年供体n = 6)。源数据作为源数据文件提供。d人源化NOD SCIDγ链(NSG)小鼠中来自老年供体的人T SCM CD4细胞植入的增加。Ť SCM从年轻CD4细胞(Ñ = 2)或旧的供体(Ñ = 2)与T幼稚前体分化,在异种移植到NSG小鼠中之前在体外扩增(分别为n = 13和n = 9)。在人类T SCM CD4细胞转移后21天(Exp#1)或28天(Exp#2),将动物处死并用CO 2安乐死,并收集组织(脾脏,肺脏)。进行了N = 2个独立实验,并在图形上用颜色代码标记(实心圆圈:Exp#1;空心圆圈:Exp#2;实心灰色圆圈代表具有GVHD迹象并在第16天被杀死的小鼠)。对未配对样品进行统计学分析(U Mann–Whitney检验)(**,p <0.01)。Ë幼稚CD4 T细胞中CDR3多样性降低。原始T细胞亚群被分类为原始,T RTE,T MNP和T SCM CD4细胞。T细胞分选后立即进行mRNA提取,并通过RNA序列分析。在细胞亚群之间和衰老期间比较了CDR3的组成。结缔弧表示在分化和衰老过程中CDR3序列之间的高度同源性(80%)。
最后,我们研究了T细胞分化/激活的三个关键标志物Ki-67,T-bet和Eomes的表达(补充图 5B)。在这里,我们发现的T TCR刺激SCM诱导(对应于它们的效应子功能)类似的T-bet表达,却降低EOMES和Ki-67获取比T中CM。此外,来自老年人的经FACS分选和多克隆刺激的CD4亚群的T SCM(图 4c)显示IL-2和IL-21分泌减少(分别为p = 0.0101和p = 0.0303,n = 10)。效应细胞因子(IFN-γ和TNF)的释放(p = 0.0415和p = 0.0186,分别地)和促炎分子(IL-17A和CCL20)也显著降低(p = 0.0496和p = 0.0062,分别地)。
T SCM增殖的保持与克隆性无关
由于CD4 T SCM的体外功能会随着年龄的增长而改变,因此我们合理地认为CD4 T SCM的不对称分裂和增殖能力也可能在体内受到影响。将NOD SCID Gamma(NSG)小鼠分别移植有人CD4 T SCM,该CD4 T SCM是从年轻和年老供体的T NAIVE CD4前体体外产生的(图 4d;补充图 5C)。令人惊讶的是, 当从老供体而不是年轻供体获得细胞时,人CD4 T SCM细胞的植入对于淋巴样(脾,p <0.01)和非淋巴组织(肺,p <0.01)都更有效(图 4d)。)-这表明与CD4 T SCM中的组织迁移或体内稳态功能相关的内在年龄相关因素可能会影响外周T SCM的频率和位置。我们追踪了移植细胞的时间敏感性发展(T SCM移植后31天),并观察到位于三个主要细胞簇内的已移植T SCM细胞的命运,分别对应于T CM,T SCM和晚期过渡记忆细胞(补充信息)。总而言之,我们的数据表明,无论是年轻捐赠者还是老捐赠者,移植的CD4 T SCM都可以保留在宿主中并分化为T TM和T CM-尽管可能要求将它们引入年轻的非炎性环境。
最后,由于TCR多样性通常是失去了在T细胞亚群随着年龄的36,37,我们想测试CD4 T是否SCM受到了同样的命运。在这里,我们将RNA-Seq数据拟合到Circos图中,以通过使用Circos图可视化T SCM的 β链V–(D)–J重排随年龄的变化(图 4e)。在这里,我们观察到在CD4 T MNP中观察到最大的TCR多样性-与年龄无关- 并且在老年捐赠者的CD4 T RTE和T SCM中,TCR克隆型异质性的丧失最为明显。
T SCM CD4细胞稳态的调节:Wnt / DKK-1轴
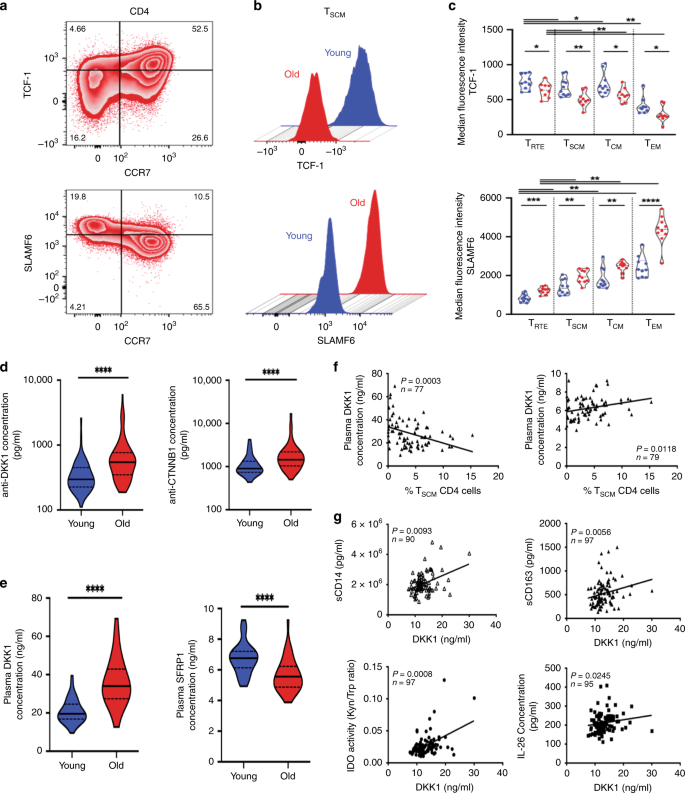
在蛋白质组学水平上进一步证实了衰老过程中Wnt /β-catenin途径的失调。TCF-1,该信号传导途径内的主转录因子已与CD8 T细胞的干性相关的38,39,40和SLAMF-6(CD352)的表达41,42。我们试图验证TCF-1和SLAMF-6之间的关系,并观察到仅在年轻献血者的T RTE和T SCM中n TCF-1和SLAMF-6表达正相关(n = 20)(图 5a–c); TCF-1和SLAMF-6在CD4 T细胞分化和衰老过程中具有独特的动力学。观察到的与年龄相关的TCF-1表达下降和与SLAMF-6表达脱钩可能反映了在支配T SCM稳态的Wnt依赖的扩展调控网络内的扰动。这种扰动包括的信号活性和免疫反应的自身抗体的间接预测增加的频率43,44 -against几个蛋白质靶该行为在Wnt /β-catenin的途径与年龄(Ñ = 60和Ñ = 93为年轻和年长供体,分别包括CTTNB1(p <0.0001),GSK3B(p <0.01),TCF-4(p <0.01),LEF1(p <0.01),IRF4(p = 0.05),HDAC1(p <0.0001)和HDAC3(p = 0.0064)(图 5d ;补充图 6A)。而且,衰老过程中Wnt /β-catenin途径的天然抑制剂DKK-1的血浆浓度增加(图 5e;p <0.0001,n = 78);而Wnt /β-catenin途径的天然激活剂SFRP1的水平降低了(p <0.0001,n = 80)。SFRP1和DKK-1的循环水平都与CD4 T SCM频率相关(图 5f)。
一个 TCF-1和CD4T细胞SLAMF-6的表达。来自有代表性的老年个体的CD4 T细胞中SLAMF-6和TCF-1染色的代表性斑马图。b TCF-1和SLAMF-6 在衰老过程中在T SCM CD4细胞中表达。SLAMF-6和TCF-1表达的代表性重叠直方图,来自年轻(n = 10)和年长(n = 10)个体的门控T SCM CD4细胞。c CD4 T细胞分化和衰老过程中TCF-1的表达降低。在T细胞亚群中测量TCF-1的中值荧光强度。统计分析是在配对(n = 20,Wilcoxon符号秩检验)或未配对样本(n = 20,曼恩·惠特尼;*,**,***和****分别用于p <0.05,p <0.01,p <0.001和p <0.0001)。源数据作为源数据文件提供。d衰老过程中DKK-1选择性激活Wnt /β-catenin途径。冷冻保存的血浆用于测量针对Wnt /β-catenin途径中涉及的分子的自身抗体( 在年轻和老年人中分别为n = 93和n = 60)。对未配对样品进行免疫蛋白阵列数据的统计分析(U Mann–Whitney测试,****,p <0.0001)。源数据作为源数据文件提供。Ë衰老过程中Wnt /β-catenin途径的天然抑制剂和激动剂的调节。通过ELISA直接测量DKK-1和SFRP1的血浆浓度( 在年轻和老年供体中分别为n = 43和n = 37)。对未配对样品进行统计学分析(U Mann–Whitney检验,****,p <0.0001)。源数据作为源数据文件提供。f DKK-1和SFRP1 对T SCM CD4细胞的调节。T SCM CD4细胞的频率分别与DKK-1和SFRP1的全身浓度呈负相关或正相关(p = 0.0003和p = 0.0118)(n = 77)。相关性是通过Spearman等级检验计算的。源数据作为源数据文件提供。g炎症和DKK-1血浆水平。通过ELISA直接测量DKK-1,sCD14,sCD163和IL-26的浓度。通过LC-MS / MS测量血浆中的色氨酸和L-犬尿氨酸水平。相关性是通过Spearman等级检验计算的。源数据作为源数据文件提供。
随之而来的是,SFRP1和DKK-1活性的年龄相关差异可能与TCF-1表达的丧失相互作用,从而限制了经典Wnt /β-catenin途径内的信号传导并限制了T SCM CD4细胞的持久性/扩展性。我们在经常被用作炎症性衰老模型的HIV感染患者中研究了这种现象。在老年HIV供体的血浆中检测到较高浓度的DKK-1(补充图 6B,p <0.0001,n = 97),HAART同时减轻炎症和循环DKK-1(p = 0.0068,n = 12)。在治疗的供体中炎症和DKK-1分布方面的这些改善表明抗逆转录病毒疗法可以促进T通过这些机制进行SCM区分。我们证明了DKK-1与免疫激活的细胞标记物之间的进一步关联(sCD14,p = 0.0093 ,r = 0.2728,n = 90; IL-26,p = 0.0245,r = 0.2306 ,n = 95; IDO活性,p = 0.0008,r = 0.3362,n = 97; sCD163,p = 0.0056,r = 0.2795,n = 97)在图 5g中。总而言之,后者加强了我们的假设,即年龄相关性T SCM障碍稳态可能是由炎症引起的,它通过DKK-1影响Wnt /β-catenin信号传导。值得注意的是,我们对Wnt /β-catenin途径的转录组分析显示,DKK-1基因表达(如在肿瘤中观察到的45)仅富集于来自年轻供体的簇1 T SCM(“富集PCP”);CDH1(另一种Wnt /β-catenin抑制剂)参与了所有供体的非经典Wnt信号传导(补充图 6C),并在T SCM簇中占主导地位。在其他与老年供体Wnt /β-catenin抑制有关的基因中,只有SFRP5和DACT1在簇0(“ PCP样”)和簇1(“ Wnt /β-连环蛋白样”)中分别被上调。因此,增加的DKK-1活性不太可能归因于老年供体的T SCM固有表达DKK-1 。
RTE CD4 T细胞是T SCM的更合适的前体
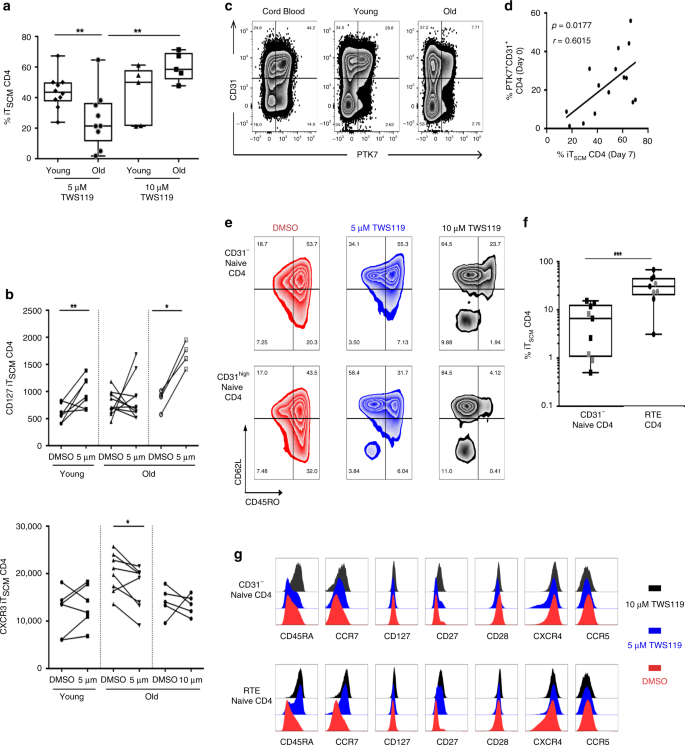
TWS119对糖原合酶激酶-3β的抑制作用可促进幼稚T细胞中Wnt /β-catenin途径的体外活化,从而导致T SCM 9的产生。借用这种方法,我们尝试生成诱导型CD4 T SCM(iT SCM),并观察到该过程在老年供体中效率明显较低(p = 0.0098,n = 20)(图 6a)。增加TWS119(10μM)的剂量可减轻CD4 T SCM的膨胀能力损失(p = 0.007,n = 10)-建议所报告的5μM剂量可能不足以克服该途径的年龄/炎症相关抑制作用。与分离的T SCM的离体表型一致,iT SCM具有CD62L 高 CD45RA + CD45RO- / + CD95 +表型。我们进行了进一步的表型分析,以比较来自不同年龄组的供体的离体和iT SCM(图 6b)。较高浓度的TWS119 使iT SCM的扩增增加也与CD127的回收率有关(p = 0.0317,n = 5)。此外,TWS119诱导的CD4 T SCM表现出较低水平的活化标记:CD95(p = 0.0013),CD26(p = 0.0079),CCR5(p = 0.0159),CXCR3(p = 0.0391)和与对照细胞相比,CCR7表达水平高(p = 0.0079) )(补充图 7A); 总体上表明具有更强的增殖,功能和贩运潜力的年轻表型。IT部门之间的表型相似SCM和体外的CD4 T SCM中(补充图表面标志物表达的条款, 7B),可以通过它们的兼容遗传签名来证实8,15,16,18岁。
一个老化过程中Wnt /β联蛋白途径的低反应性。通过流式细胞术评估特异性TWS119诱导的T SCM CD4细胞的频率,并在减去非特异性DMSO诱导的T SCM CD4细胞频率后进行计算。对未配对样品进行统计学分析(U Mann–Whitney检验,**,p <0.01)。源数据作为源数据文件提供。b CD127表达表征诱导的T SCM CD4细胞。在第7天进行诱导的T SCM CD4 T细胞的表型。对配对样品进行统计学分析(Wilcoxon秩和检验)(*和**为p 分别<0.05和p <0.01)。源数据作为源数据文件提供。c通过流式细胞仪鉴定脐带血或年轻和年老供者外周血中的胸腺新近迁出。T RTE被定义为PTK7 + CD31 + CD4 T细胞。d从RTE细胞中诱导T SCM CD4 细胞。使用Spearman等级检验(n = 15)计算第7天的离体T RTE和体外TWS119诱导的T SCM CD4细胞之间的相关性。源数据作为源数据文件提供。Ë Ť SCMCD4细胞的诱导取决于幼稚CD4 T细胞中CD31的表达。流式细胞术TWS119剂量依赖性诱导-T的染色SCM从CD31来源的CD4 T细胞-或CD31 高幼稚的CD4 T细胞。˚F增加CD31的潜在高幼稚至T SCM CD4细胞分化。的T频率SCM从CD31来源的CD4细胞-或CD31 高响应于与TWS119(5μM)的低剂量中Wnt /β联蛋白途径的刺激幼稚的CD4 T细胞。青年和老年捐助者分别用黑色和灰色符号表示。对配对样本进行统计学分析(Wilcoxon符号秩检验)(***为p <0.001)。源数据作为源数据文件提供。g T RTE和CD31 低幼稚CD4 T细胞诱导的T SCM表型。流式细胞术染色诱导-T的SCM从CD31来源的CD4细胞-或CD31 高(T RTE)幼稚的CD4 T细胞。直方图代表在5或10μM的单独媒介物(DMSO)或Wnt /β-catenin刺激药物(TWS119)存在下培养7天后单个标记物的叠加表达。
T NAIVE和T SCM细胞的平行命运以及与个体发生的亲缘关系表明,与年龄相关的胸腺功能下降很可能导致周围T SCM的丧失。此外,从脐带血到年轻的CD4 T细胞中CD31和PTK7表达的下降,随后是年长的供体(图 6c),支持了一个假设,即终身免疫刺激有助于CD31脱落46。我们还观察到第0天的T RTE细胞频率(定义为PTK7 + CD31 +)与第7天的诱导T SCM频率之间呈正相关(图 6d),支持T SCM可以源自T RTE单元的想法。通过对未加工的CD4 T细胞亚群进行STEM分析,对该假设进行了计算机评估(补充图 7C,D)。T RTE和T SCM CD4细胞之间基因表达的动力学比其他推论的本体发生途径的比较更可信。接下来,Monocle用于从单细胞RNA-seq数据生成伪时间并确定CD4 T细胞分化轨迹-我们的转录组支持一种模型,其中T RTE可以分化为T SCM和CD31 阴性 CD4 T细胞(补充图 7E))。
由于T RTE和T SCM与年龄的重叠特征,尤其是Wnt /β-catenin途径活性随年龄的丧失,我们推测高CD31表达可以降低幼稚CD4 T细胞通过T细胞分化为T SCM的阈值。Wnt /β-catenin激活(图 6e)。我们观察到,与供体年龄无关,浓度为5μM的TWS119可以有效地介导FACS分选的CD31 高幼稚CD4 T细胞进入T SCM CD4细胞(iT SCM)(图 6f,p = 0.0008和n = 9 )。相反,CD31为负原始CD4 T细胞在TWS119浓度为5μM时对转化具有弹性,但在使用10μM时有反应(p = 0.0007,n = 9)。在监测上CD31 CD45RA,CCR7,CD127,和CD27的表达负幼稚的CD4 T细胞,我们也获得了证据表明TWS119可促进CD31更“幼稚”表型负在较高剂量幼稚的CD4 T细胞(图 6克) 。
T SCM CD4细胞在衰老过程中的代谢
几个小组已经描述的基因(与年龄相关的甲基化IFNG,CCR7,CD27等),其结果在幼稚T细胞的行为的功能变化22,47,48。在这些原则的指导下,我们使用STEM分析研究了是否通过渐进性T细胞分化(即从T RTE到T TMNP)同时调节基因组(按行为模式分组)(补充图 7C))。我们确定了与不同年龄组中T细胞分化相关的最常见的经典途径,以及负责观察到的表型的各个上游调节因子。T细胞分化与年轻人和老年人之间不同的代谢谱有关,表明能量管理随年龄的变化而不同。例如,在年轻的供体中,合成代谢途径(如二酰基甘油和磷脂酰甘油的生物合成)受T细胞分化的调节(第11组),而在分解代谢过程(如氧化磷酸化)中涉及的基因则在较年长的供体中突出显示。我们还观察到了第5组的差异,其中在年轻和老年供体中观察到了酸生物合成(谷氨酰胺,丝氨酸和甘氨酸)和糖原生物合成的调节发生了重大变化, 7D)。在检查进行性幼稚CD4 T细胞分化改变的信号转导靶标时,我们观察到了特定信号转导和代谢途径(RhoA,Sirtuin,mTOR和MYC)的激活可能发生改变。这些规范途径由上游调节剂调节,上游调节剂在一致调节的基因的相同簇中对于每个年龄组是不同的。我们检测到天然T细胞分化可能受稳态细胞因子(STAT5A)的影响以及受环境影响(通过交替接触病毒传感器(IRF3,IFNB1和IL12B)而受到差异性引导))在两个年龄段内。例如,对于发展中的能量需求(TSC22D3,POU2F2),分化或采集的效应子功能(TSC22D3,IRF3和LEPR对于Th17细胞)是特定于每个CD4 T细胞子集。因此,幼稚的CD4 T细胞的启动和分化与衰老过程中基因表达和代谢基因标记的特定变化有关。
老化过程中T SCM CD4细胞的极化
除了表型和分子差异外,我们努力确定随着年龄的增长,T SCM中可能发生的形态和结构变化是对Wnt信号通路(尤其是PCP且可能归因于DKK-1)的不同参与的可能响应-表面结构的任何可见差异也可能有助于解释T SCM行为的差异。我们研究了Wnt途径在CD4 T SCM极化中的潜在影响。老年供体的T SCM中Wnt /β-catenin簇中CDC42的非典型表达(补充图 3B))导致我们提出,老年人的细胞骨架事件编排(包括与极性相关的蛋白质分布)可能受到损害。然而,TCR介导的刺激导致年轻供体的CD4 T细胞中Cdc42的预期单极募集,但在老年供体中这种极化并不常见(补充图 8A,B)。后者是特别是用于CD31的情况下-幼稚的CD4 T细胞,但也观察到对于T这种趋势CM和T SCM中CD31的细胞,尽管不存在高幼稚的CD4 T细胞(T RTE)。
由于幼稚的CD4 T细胞亚群的不同偏振型材,我们试图确定是否主调节器和化学能,即源,线粒体,在CD4 + T表现不同SCM细胞衰老过程49,50(补充图 8C)。我们观察到,与年轻的供体相比,老年人的T SCM CD4细胞的平均线粒体体积减少了(但不是线粒体数量,补充图 8D)(p <0.05)(补充图 6D)。
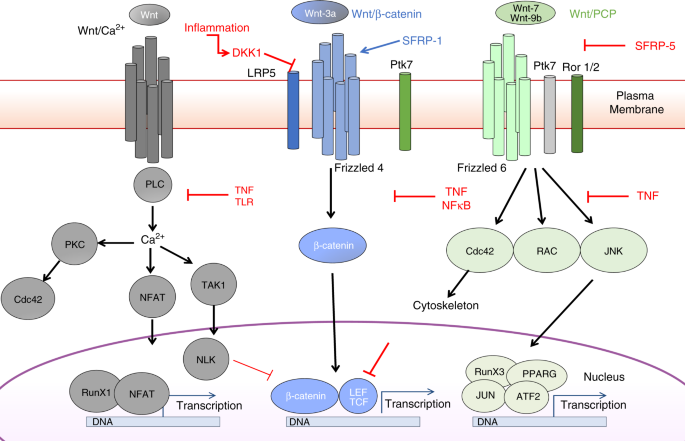
总的来说,T SCM基因和蛋白质表达模式的这些多维变化强烈支持这样的论点,即老年人T SCM细胞的频率和功能的系统性变化在很大程度上可以通过对细胞环境的干扰来解释(总结在图 7中)。
讨论区
幼稚的CD4 T细胞在基因表达,表型和功能方面是异质性种群,分为对外部信号(如慢性感染,疫苗接种和发炎)反应不同的亚类。在这项研究中检查的各种炎症情况表明CD4 T SCM及其祖细胞对外部环境敏感。由诸如HIV和CMV等持续性感染引起的免疫激活可能将特定行为印记在CD4 T SCM细胞上。分化的病毒特异性T细胞的克隆扩增也可能间接影响T细胞库,因此限制了对未来挑战的反应能力。在这项研究中,我们证明了CD4 T中存在定量和定性(增殖,效应子功能)缺陷老化和慢性感染期间的SCM细胞。我们还提供了多种证据,表明持续性炎症确实可以在单细胞水平上干扰这些亚群的功能-这些变化伴随Wnt /β-catenin基因表达的变化,并与特定的蛋白质组学和代谢特征相关。从本质上讲,尽管所有原始T细胞都可以分化,但CD4 T SCM细胞最可能的前体似乎驻留在T RTE中隔室,它在衰老(胸腺生成减少,炎症)和慢性感染(记忆性T细胞的克隆扩增,可能竞争空间和资源)的情况下严重受损。免疫激活,TLR刺激和先天病毒传感器的结合也可能激活推测的上游TF,可能通过DKK-1调节51来协调老年人的偏向T细胞分化。因此,即使在RTE前体阶段,炎症也可能直接或间接影响CD4 T SCM细胞。
在描述伴随着HIV感染引起的衰老和慢性炎症的CD4 T SCM耗竭程度,并将这些现象与这种现象的免疫激活和Wnt /β-catenin途径联系起来时,我们建议调节T SCM基因表达细胞对代谢和信号传导途径的影响最为显着,这可以通过炎性环境的变化得到明显解释(图 7)。T SCM的这种与年龄有关的特征可能会导致次优T SCM通过独立于抗原来源并与炎性环境的性质相关的机制进行分化和增加对细胞衰老的敏感性。因此,我们证明了在衰老和HIV感染过程中观察到的次优免疫反应可能部分是通过改变Wnt信号参与而从CD4 T SCM异质性的丧失演变而来的。
我们的结论是由观察结果的CD8 T进一步证实SCM耗尽了与疾病进展相关联的,在HIV的上下文52,53或症状的克氏锥虫感染54 ; 在急性结核分枝杆菌感染期间,具有更多不同的效应分子(粒酶A,K)和趋化因子(CCR5,CCR6)谱的抗原特异性CD4 T SCM细胞的产生也有助于更好的预后55。RV144初免-HIV疫苗试验的结果也证明了具有足够的CD4 T SCM异质性的重要性56。同样,在致病性而非非致病性猿猴免疫缺陷病毒感染中观察到CCR5 + T SCM CD4细胞的选择性消耗57。这些记忆先兆的丧失可能是由于HIV在CD4 T SCM中的复制,进而影响了宿主重新填充整个T细胞文库并控制当前和进一步感染的能力58。
规范的或非规范的Wnt /β-catenin信号的交替参与是否有助于CD4 T SCM的异构簇,有待进一步研究。Wnt途径激活在HIV复制中59或在HIV潜伏期的建立中的模棱两可的作用可能是由于T SCM在本研究中描述的簇内分布方式的差异所致。或者,HIV预后可能会受到DKK-1或可能与Wnt信号通路相互作用的病毒衍生分子(如HIV TAT和YAP)的影响。最近通过跟踪转基因的T SCM 60并使用稳定的同位素和重水证明了T SCM的动态通量图61支持了这样的模型,其中在由于端粒酶的有效表达而没有任何端粒侵蚀的情况下,通过连续的T SCM周转连续补充和维持T SCM储库。然而,人类T SCM的动力学也遵循二分分布,其中两个亚群被描述为短命或长命(分别为5个月对9年) 11。这些细分促成三种推测:(i)交替的Wnt途径参与可能影响这些不同亚群的寿命,(ii)这些短暂和长期的T SCM可能源于T NAIVE和CD31高原始T细胞,以及(iii)T SCM异质性可能受抗原类型驱动。T SCM对环境信号的整合及其增殖能力可能触发稳态调节,从而保持T细胞区室化57。T SCM细胞与年龄相关的衰落可能因此损害了这种可塑性和整个记忆免疫能力。
接下来,还发现T SCM的多样性和克隆可用性对于产生召回反应62和对成人T细胞白血病的长期维持至关重要63。然而,T SCM中的 CDR3多样性在衰老过程中会降低,并且在没有相关表位的情况下,T SCM的持久性在很大程度上取决于稳态增殖(通过IL-7,IL-15或IL-21介导)和稀有T的分化。RTE 11。IL-7水平的升高与幼稚的64和CD4 T RTE细胞65的丧失进一步相关,它们都预示着HIV预后不良64,65,66。此外,与HCV的共同感染带来了额外的负担,这导致了T RTE 67的损失。老年人和HIV感染期间T RTE和T SCM CD4细胞的存活率和持久性降低可能与炎性细胞因子的存在增加和体内IL-7水平的升高有关。为了支持该假设,我们观察到T SCM簇中CD127表达的差异,该簇强烈表达与规范Wnt /β-catenin信号传导相关的分子。CD127被认为是长期记忆的标志 68。在这里,我们表明该作用可以通过促进Wnt /β-catenin信号传导而演变,从而导致CD4 T SCM增殖能力增强。CD127的丢失已被进一步描述为炎症的标志性作用,我们通过与HIV相关的免疫衰老来证实这一点。此外,一些研究已经描述的CD4 T的增加的感染性SCM 58,69和T RTE(在猕猴的情况下或SIV)在进展者由HIV 57。保留的T RTE隔室也与较高的CD4最低点66相关联。HIV可以通过破坏CD4 T SCM和T RTE来获得进化优势功能表明它们在控制病毒复制中的重要性。此外,CD4 T SCM的重组伴随着成功的HAART管理-无论这是成功控制HIV的原因还是结果,都需要进一步的研究。
这项研究中另一个引人注目的观察结果是,Wnt /β-catenin通路的低反应性增强,并且在衰老和HIV感染过程中,单细胞水平的Wnt /β-catenin活性基因遗传标记随之丧失。除了驱动第t SCM经由CD31途径分化高 CD4 + T细胞,用高剂量激动剂中Wnt /β联蛋白途径的刺激促进了CD4 T的采集SCM表型,即使在CD31 -幼稚的CD4 T细胞,这常具有体内稳态的增殖史。虽然总的天然T细胞对iT SCM分化的抵抗力与较低的T RTE频率有关,但我们观察到T RTE对Wnt /β-catenin途径的刺激最为柔和,因为它们的反应与捐赠者的年龄无关,并且激动剂的剂量最少。还发现CD127在原始CD4 T细胞上的保存(或获取)是iT SCM诱导容易程度的可靠指标。因此,来自这些实验的数据表明,CD4 T RTE对T SCM分化的柔韧性从CD4 T RTE从胸腺流出时开始逐渐恶化,并且这种现象可能是由于Wnt /β-catenin信号传导的改变所致。重要的是,我们的结果表明靶向Wnt /β-catenin信号传导来促进CD4 T SCM的体内发生具有临床潜力。
我们的数据一致地揭示了Wnt /β-catenin途径的天然激动剂和拮抗剂(DKK-1 / SFRP1)的平衡中存在年龄或炎症依赖性失调,并且针对经典Wnt /β-catenin的自身抗体的患病率增加通路信号(CTTNB1,GSK3B,IRF4和HDAC1)。所有这些因素可能进一步导致老年供者的CD4 T SCM中该途径的反应低下,这会抑制下游的T细胞功能。的CD4 + T即损失SCM完整性可通过受损的Wnt /β-catenin信号来介导,可以通过所观察到的高表达DKK-1在各种癌症中支撑45,70,并通过在调节性T细胞的自身免疫性疾病的上下文和结肠炎71。提示DKK-1的抑制性质可直接受肿瘤抑制基因影响,或间接受诱导髓样抑制细胞的间接影响。因此,DKK-1已被提议作为免疫治疗的靶标,抗DKK-1疫苗被证明可增强抗肿瘤免疫力72。
最后,在TCR参与过程中,CD4天真,T SCM和T CM亚群的异常形态变化表明,老年T细胞无法协调对关键信号事件的适当生理反应。在老年人的未成熟CD4 T细胞亚群中,TCR参与后的空间组织仅保留在T RTE中。在HSC中观察到类似的特征,并且该现象与Wnt /β-连环蛋白途径73的非规范参与密切相关。Cdc42,一种Rho GTP酶,参与免疫突触的形成,并参与信号转导,肌动球蛋白的组织,细胞增殖以及Wnt / PCP和Wnt / Ca 2+非经典途径74,75。因此,Cdc42表达缺陷,观察到的极性丧失和线粒体调节可能会导致衰老过程中CD4 T SCM细胞的适应性和代谢活性降低。
胸腺退化和免疫激活共同驱动的老年人T RTE缺乏,导致了定时炸弹的where发,在这种情况下,由于记忆T细胞前体的丧失和幼稚T细胞异质性,对新发和重复感染的反应越来越严重。然而,我们的数据表明,通过引入高水平的激动剂(或更好的激动剂)来调节Wnt /β-catenin途径可能有助于延迟或预防后一种情况。这是一个有吸引力的提议,因为已证明替代方法(例如胸腺再生)会产生不利影响。由于大多数研究都集中在CD8 T SCM上,因此CD4 T SCM在促进生存和免疫能力方面的重要性尚未得到充分探讨。在CD8中,TSCM已被证明是用于预防GVHD重要,促进抗肿瘤免疫性8,13和所需的安装足够响应病原体过多。T的干性SCM CD8 T细胞也相关黄热病特异性CD8 T的长期持久性SCM成功接种过程76。关于CD4的功能,我们的数据支持这样的想法,即保持CD4 T SCM频率对于免疫能力也很重要,尤其是在病毒控制的情况下。因此,促进CD4 T SCM分化可能与增强疫苗效力有关。这与T SCM是合乎逻辑的构成记忆T细胞应答发展的重要储存库。总之,我们的数据表明,减少CD4 T细胞暴露于全身性炎症的策略可能对保持T SCM免疫能力起着重要作用。
方法
供体和样品制备
从新加坡纵向老龄化研究(SLAS)队列的参与者中收集血液。SLAS队列的特征在补充表2和我们之前的出版物中进行了详细介绍 ,涉及身体虚弱77。将血液收集到带有柠檬酸钠的BD Vacutainer CPT细胞制备试管中(BD Biosciences,美国加利福尼亚州圣何塞)。在室温下以300 rcf离心20分钟后,分离出血浆和外周血单核细胞(PBMC)。使用前将血浆保存在-80°C。PBMC在含有10%DMSO的90%胎牛血清(FBS)中冷冻并储存在液氮中。
该研究已获得新加坡国立大学机构审查委员会04-140的批准,所有参与者均已知情同意。年轻的捐助者是在新加坡国立大学招募的。该研究已获得NUS-IRB 09-256道德委员会的批准。所有研究参与者均提供了知情的书面同意。
从参加马来西亚马来亚大学医学中心(UMMC)的受HIV感染的个体中收集血液。有关HIV特异性特征的数据包括HIV RNA,CD4 T细胞计数,抗逆转录病毒药物病史和合并感染史,均来自患者的病历。该研究得到医院机构审查委员会的批准,适用于马来西亚感染HIV的患者(MEC 975.6)。
所有使用人血沉棕黄层的实验均经过Humanitas临床与研究所IRB的批准(2016年1月28日批准)。
动物研究
所有使用小鼠的实验均在意大利卫生部批准(协议256 / 2015-PR)后进行。意大利卫生部已批准进行动物实验。NOD.Cg- PRKDC SCID IL2RG tm1Wjl / SZJ(NSG)小鼠(Jackson实验室)在特定的病原体-自由(SPF)的条件下饲养。
血清筛选
首先使用商业测试试剂盒(Virion \ Serion,Germany)通过抗酶联免疫吸附法(ELISA)对整个SLAS队列的所有血清样品进行抗幽门螺杆菌,EBV,VZV,HSV1,HSV2,CMV的IgG抗体测试),请按照制造商建议的步骤进行。通过ELISA分别从Abcam(美国)和Panbio(美国)检测针对CHIKV和DENV的IgG抗体。
PBMC的表型
通过流式细胞术对来自年轻供体的23个新鲜PBMC样品和来自较老供体的78个新鲜PBMC样品进行细胞表型分析。对于每个染色,使用1×10 6个 PBMC。基于FSC / SSC图谱和双峰/死细胞排斥来门控淋巴细胞。
通过流式细胞仪对10名健康供体和6名HAART HIV感染患者的新鲜血液进行绝对细胞计数。对于每次染色,在Trucount管中使用100μL血液。双重/死细胞排除后,基于FSC / SSC图谱和CD45表达对淋巴细胞进行门控。
抗体在补充表3中列出 。在LSR Fortessa细胞分析仪(BD Biosciences)上进行流式细胞术,并应用自动补偿。
我们使用BDSymphony A5(BD Biosciences)进行高维单细胞免疫表型分析,并鉴定了来自200万冷冻PBMC 的幼稚和T SCM CD4细胞的异质性。
HIV参与者的流式细胞仪在马来亚大学的BD FACS Celesta(BD Biosciences)上进行,并应用了自动补偿。
流式细胞仪功能测定
增殖:CFSE染色的分选的CD4 T细胞亚群分别用抗CD3 / CD28微珠或IL-7刺激5天和7天。通过稀释CFSE来测量增殖。增殖/ ICS:TCR刺激5天后,在4小时内分别用PMA /伊诺霉素(分别为1 µg / ml和100 ng / ml)重新刺激CFSE染色的分选的CD4 T细胞亚群,以检测细胞因子的分泌通过增殖CD4 T细胞。在孵育的最后2小时内加入布雷菲德菌素A和莫能菌素(eBioscience)。有关所用抗体的列表,请参阅补充表 3。流式细胞仪在LSR Fortessa细胞分析仪(BD Biosciences)上进行。
多重分析物筛选
根据CCR7,CD27,CD31,CD45RO,CD49d,CXCR3和CD95在CD4 T细胞中的表达,使用FACS Aria III(BD Biosciences)对12个样品进行细胞分选。有关用于分选的抗体列表,请参见补充表 3。与PMA /伊诺霉素孵育18小时后,收集上清液并通过Luminex分析进行测试。根据制造商的说明和Flexmap检测到的信号使用Milliplex HTH17MAG-14K(Millipore)。
根据制造商的说明,使用Milliplex HCYTOMAG-60K(Millipore)测量年轻和老人供体血浆中的细胞因子。
酶联免疫吸附
根据制造商的说明测量可溶性CD14和Galectin-9(R&D系统),可溶性CD163和IL-21(eBioscience),IL-26,DKK-1和SFRP1(USCN)。将经HIV感染的患者和相应对照的血浆样品进行Triton灭活,并在适当的缓冲液中稀释,然后重复测定。
使用ImmunomeTM蛋白阵列进行自身抗体分析
使用ImmunomeTM蛋白阵列(Sengenics Corporation,新加坡)78测定血浆样品。该阵列包含1627个全长,正确折叠且功能齐全的固定化自身和癌蛋白的一式四份斑点。这些包括癌症抗原(主要是癌–睾丸抗原(CTA)),转录因子,激酶,信号蛋白等。使用健壮的定制管道78处理原始数据并进行标准化。
体内诱导的T SCM CD4细胞向NSG小鼠的转移
转移前7天,从年龄(n = 2)和年轻(n = 2)的健康对照人PBMC中以CD45RO – CCR7 + CD27 + CD95 –的 FACS分选出CD4幼稚T细胞,并用aCD3 / aCD28磁珠激活(Invitrogen) (1:2的珠子:细胞比例)在IL-7和IL-15(每种10 ng / ml,Peprotech)存在下。分选的幼稚CD4 + T细胞的纯度> 97%(未显示)。在第0天,将磁珠分离,将体外产生的富含CD4 T SCM的细胞(8×10 6 /小鼠)与(5–10×10 6)通过与MACS磁珠(Miltenyi)进行负磁分离获得的CD4耗尽的自体PBMC。每周对小鼠称重。转移后三周(第21天; Exp#1)或4周(第28天; Exp#2),处死小鼠,收集脾脏和肺脏,称重,分离成单细胞悬液,用荧光染料偶联的抗体和通过流式细胞仪(LSR Fortessa,BD)进行分析。
T SCM CD4细胞的体外诱导
从年龄(n = 15)和年轻(n = 25)健康供者的PBMC中以CD45RO – CCR7 + CD27 + CD95 – FACS分选出CD4幼稚T细胞,并用aCD3 / aCD28磁珠(Invitrogen)激活(1:2磁珠: DMSO或TWS119(5和10μM)的存在。在第7天,将磁珠分离,并研究了体外诱导的CD4 T SCM的表型和基因表达。
实时定量PCR
立即将分类的CD4 T细胞亚群裂解。使用RNeasy Plus Micro试剂盒(Qiagen)进行RNA提取,并使用SuperScript First Strand试剂盒(Invitrogen)反转录为cDNA。使用KAPA SYBR qPCR Master Mix试剂盒(KAPA Biosystems)或TAQMAN通过实时PCR分析cDNA。Qiagen提供了以下引物:BATF(QT00078449),IRF4(QT00065716),HDAC1(QT00015239),PCNA(QT00024633)或TAQMAN提供:LEF1(Hs01547250_m1),TCF7(Hs01556515_m1)和Notch1(Hs01062014)。
nCounter人类炎症v2
使用NanoString nCounter基因表达系统测量样品的直接mRNA表达水平。总共在65μL来自Qiagen RNeasy Mini试剂盒(Qiagen,德国希尔登,德国)的RLT缓冲液中将18,125–20,714个CD4 T细胞亚群与nCounter Human Inflammation v2小组(Nanostring,美国西雅图,美国)的探针在65℃杂交根据《 nCounter™基因表达分析手册》,在℃放置16-19小时。在nCounter™制备工作站(GEN1)上使用基于磁珠的两步纯化法将多余的探针冲洗掉。nCounter™数字分析仪(GEN1)用于计数单个荧光条形码并定量每个样品中存在的靶分子。对于每种测定,均进行了高密度扫描(600个视野)。
RNA序列
按照双重提取方案提取总RNA:先用硫氰酸胍盐-苯酚-氯仿提取(TRIzol,Thermo Fisher Scientific,Waltham,MA,美国),然后进行Qiagen RNeasy Micro纯化程序(Qiagen,Hilden)进行RNA分离。 ,德国)。在Agilent生物分析仪上分析了所有人类RNA的质量,RNA完整性指数(RIN)为6.2至9.6,中位数RIN为8.9(美国加利福尼亚州圣克拉拉,安捷伦)。使用SMARTSeq v2协议,在对照品(Ambion Thermo Fisher Scientific,Waltham,MA,USA)中,使用1 ng的总RNA和0.5 µl的ERCC RNA Spike的1:50,000稀释液制备cDNA文库79,但进行以下修改:(1)使用20 µM TSO,(2)使用250 pg cDNA与Illumina Nextera XT试剂盒(Illumina,圣地亚哥,加利福尼亚,美国)的1/5反应。使用Perkin Elmer Labchip(Perkin Elmer,Waltham,MA,USA)上的DNA高灵敏度试剂盒监测cDNA文库的长度分布。所有样品在Illumina HiSeq 2000(16个样品/泳道)上进行2×51个循环的索引PE测序。使用STAR比对工具将配对的末端读段映射到人GRCh38参考基因组。映射到每个基因的读取数目使用特征计数(Subread包的一部分)和GENCODE基因注释版本V25进行计数。
单细胞RNA序列
使用SMARTSeq v2协议79对单细胞cDNA文库进行以下修改:(1)1 mg / ml BSA裂解缓冲液(Ambion Thermo Fisher Scientific,美国马萨诸塞州沃尔瑟姆);(2)使用250 pg cDNA和Illumina Nextera XT试剂盒(Illumina,圣地亚哥,加利福尼亚,美国)的1/5反应。使用Perkin Elmer Labchip(Perkin Elmer,Waltham,MA,USA)上的DNA高灵敏度试剂盒监测cDNA文库的长度分布。所有样品均在Illumina HiSeq 2000系统(Illumina,圣地亚哥,加利福尼亚,美国)上进行了2×51个循环的索引末端配对测序操作(192个样品/泳道)。使用RSEM版本1.3.0将成对读取读数与人类参考基因组对齐。使用Gencode发布的人类参考基因组版本25(https://www.gencodegenes.org/human/release_25.html)。使用RSEM版本1.3.0计算每百万笔转录(TPM)值,并将其用于下游分析。
共聚焦显微镜
线粒体含量:分选的细胞在潮湿的培养箱中用100 nm MitoTracker Green(Life Technologies)和1 µg / ml Hoechst 33258染色1小时。在成像之前,将细胞洗涤并重悬于R-10中,然后在八孔玻璃底µ板(德国伊比迪)中进行铺板。使用FV-1000共焦显微镜系统(Olympus)在受控温度条件下使用60倍油镜拍摄图像。使用Imaris(瑞士Bitplane)对线粒体染色进行了分析。
Cdc42极化:冷冻分选的原始CD4 T细胞亚群在37°C的2小时内用可逆的抗CD3 / CD28链霉菌(IBA Lifesciences,德国)解冻并激活。将T细胞接种在PBS + 10%FBS中的纤连蛋白包被的玻璃盖玻片上。在37°C(5%CO 2)在含1%抗生素的RPMI-20%FCS中,用4%PFA固定细胞。固定后,用PBS轻轻洗涤细胞,用PBS中的0.2%Triton X-100(Sigma)透化20分钟,并用10%驴血清(Sigma)封闭30分钟。一抗和二抗孵育分别在4°C过夜和室温1小时。盖玻片用带有或不带有DAPI(Invitrogen,Molecular Probes)的ProLong Gold Antifade试剂固定。用抗α微管蛋白抗体(Abcam,大鼠单克隆抗体ab6160)对细胞进行免疫共免疫,用抗大鼠AMCA偶联的二抗或抗大鼠DyLight488偶联抗体(Jackson ImmunoResearch),抗Cdc42抗体(Millipore)检测,兔多克隆)。样品用配有63×PH物镜的AxioObserver Z1显微镜(Zeiss)成像。使用AxioVision 4.6软件分析图像。或者,用配备有63倍物镜的LSM710共聚焦显微镜(Zeiss)分析样品。将原始原始数据导入到Volocity软件包(Verkin 6.0,Perkin Elmer)中,以进行进一步处理并将其转换为3D图像。至于极性评分,当通过在细胞中间划一条线可以看到清晰的不对称分布时,每个单染蛋白的定位被认为是极化的。每个样品总共分析了50-100个幼稚CD4 T细胞。将数据绘制为每个样品计分的细胞总数的百分比。将原始原始数据导入到Volocity软件包(Verkin 6.0,Perkin Elmer)中,以进行进一步处理并将其转换为3D图像。至于极性评分,当通过在细胞中间划一条线可以看到清晰的不对称分布时,每个单染蛋白的定位被认为是极化的。每个样品总共分析了50-100个幼稚CD4 T细胞。将数据绘制为每个样品计分的细胞总数的百分比。将原始原始数据导入到Volocity软件包(Verkin 6.0,Perkin Elmer)中,以进行进一步处理并将其转换为3D图像。至于极性评分,当通过在细胞中间划一条线可以看到清晰的不对称分布时,每个单染蛋白的定位被认为是极化的。每个样品总共分析了50-100个幼稚CD4 T细胞。将数据绘制为每个样品计分的细胞总数的百分比。每个样品总共分析了50-100个幼稚CD4 T细胞。将数据绘制为每个样品计分的细胞总数的百分比。每个样品总共分析了50-100个幼稚CD4 T细胞。将数据绘制为每个样品计分的细胞总数的百分比。
扫描电子显微镜:为了通过扫描电子显微镜成像,将已分选的细胞在室温下于0.1M磷酸盐缓冲液中的2.5%戊二醛中固定1小时(pH 7.4),在室温下用1%四氧化os(Ted Pella Inc)固定后进行处理温度为1小时,然后通过25%至100%的分级乙醇系列脱水,并使用CPD 030临界点干燥器(Bal-Tec AG,列支敦士登)干燥临界点。使用SCD005高真空溅射镀膜机(Bal-Tec AG)进行溅射镀膜,在其上生长细胞的细胞表面进行涂覆,并在粘合表面上涂覆15 nm的金。使用透镜内二次电子检测器,以场发射JSM-6701F扫描电子显微镜(美国JEOL有限公司)检查涂覆的样品,其加速电压为8 kV。
数据分析
使用FlowJo(Treestar)和FACSDiva(BD Biosciences)分析流式细胞仪数据。使用GraphPad Prism软件(v.8.0c)比较样品。流式细胞术数据的无偏t-SNE分析:使用t分布随机邻居嵌入(t-SNE)算法获得多参数流式细胞术数据的无偏表示。t-SNE是一种非线性降维方法,可以最佳地定位具有相似表达水平的细胞彼此靠近,而具有相似表达水平的细胞彼此分开。使用FlowJo,自定义R脚本和Cytofkit软件执行t-SNE和UMAP分析。基因表达:对幼稚T细胞亚群之间和衰老过程中差异表达的基因进行Metascape,STEM(短时序列表达矩阵)分析。p值<0.05。使用edgeR R软件包版本3.3.2,通过过滤总计数为零的基因并使用TMM算法对计数进行归一化,来计算RPKM(每百万碱基对转录的千碱基数)。RPKM值按条件的平均值已用于STEM分析。用MiXCR进行TCR库分析。分析了来自分类的原始T细胞亚群的相似量的mRNA和相同的序列读数,以标准化结果。scRNAseq:已分别分析了年轻和较老的供体。对于这两种情况,通过去除供体之间差异表达的一些基因,年轻供体的183个基因和老年供体的216个基因,消除了供体的影响,以便将每个供体的密度图与前两个PC匹配。这些去除的基因不参与群体分化。我们根据检测到的基因数量的阈值(每个细胞至少200个独特基因)从数据集中滤除了劣质细胞。丢弃至少在我们所有单细胞的0.4%中未检测到的所有基因,剩下22,116个基因供年轻供体使用,而21,786个供老年供体用于所有进一步的分析。对于所有下游分析,将归一化的数据进行log转换-log(expression + 1)。使用Seurat R封装(对于所有下游分析,将归一化的数据进行对数转换,即log(expression + 1)。使用Seurat R封装(对于所有下游分析,将归一化的数据进行对数转换,即log(expression + 1)。使用Seurat R封装(https://github.com/satijalab/seurat)。用逻辑变换对FACS数据进行变换。为了总结FACS数据在单细胞RNA测序数据中发现的每个簇中的表达,计算“簇分数”作为每个簇中平均蛋白质表达,并在使用pheatmap R软件包生成热图之前按行缩放。为了确定有关Wnt信号传导途径(GO:0016055)和炎症反应途径(GO:0006954)的T SCM CD4细胞群每个簇的富集得分,我们进行了基因集富集分析(GSEA v3.0) 。这些途径是从AMIGO2网站检索的。使用Monocle R软件包版本2.10 80进行Monocle分析。
统计分析
通过Mann-Whitney U检验分析了成年和老年供体组,以比较其值。Wilcoxon配对配对符号秩检验用于对来自同一供体的不同亚组的中值进行配对检验。分析p <0.05(*),p <0.01(**),p <0.001(***),和p <0.0001(****)被认为是组之间显著不同。
报告摘要
链接到本文的《自然研究报告摘要》中提供了有关研究设计的更多信息 。
|
|