一种快速和灵敏的基于荧光素酶的抗体工程设计和嵌合抗原受体的设计
一种快速和灵敏的基于荧光素酶的抗体工程设计和嵌合抗原受体的设计
摘要
使用基因工程抗体和经嵌合抗原受体(CARs)修饰的T细胞的免疫治疗方法的成功,除其他外,取决于对具有所需表达和结合特性的抗原结合域的选择。我们开发了一种基于萤光素酶的测定法,称为Malibu-Glo测定法,该方法简化了具有所需特性的抗原结合域的优化过程,并允许灵敏地检测肿瘤抗原。该测定涉及称为Malibu-Glo试剂的重组免疫缀合物,其包含与海洋荧光素酶遗传连接的免疫球蛋白或基于非免疫球蛋白的抗原结合结构域。Malibu-Glo试剂可作为分泌蛋白在哺乳动物细胞中方便地生产,该蛋白既保留抗原结合结构域又具有荧光素酶的功能活性。此外,含有分泌的Malibu-Glo试剂的粗制上清液可直接用于检测细胞表面抗原,而无需进行繁琐的蛋白质纯化和标记步骤。我们进一步证明了Malibu-Glo分析的实用性,可用于选择具有所需亲和力特征的最佳单链片段变量(scFvs),以纳入CAR。总之,Malibu-Glo检测是一种用于抗原检测的快速,简单,灵敏,特异且经济的检测方法,在抗体工程,抗体人源化和CAR-T细胞治疗领域有多种应用。含有分泌的Malibu-Glo试剂的粗上清液可直接用于检测细胞表面抗原,而无需进行繁琐的蛋白质纯化和标记步骤。我们进一步证明了Malibu-Glo分析的实用性,可用于选择具有所需亲和力特征的最佳单链片段变量(scFvs),以纳入CAR。总之,Malibu-Glo检测是一种用于抗原检测的快速,简单,灵敏,特异且经济的检测方法,在抗体工程,抗体人源化和CAR-T细胞治疗领域有多种应用。含有分泌的Malibu-Glo试剂的粗上清液可直接用于检测细胞表面抗原,而无需进行繁琐的蛋白质纯化和标记步骤。我们进一步证明了Malibu-Glo分析的实用性,可用于选择具有所需亲和力特征的最佳单链片段变量(scFvs),以纳入CAR。总之,Malibu-Glo检测是一种用于抗原检测的快速,简单,灵敏,特异且经济的检测方法,在抗体工程,抗体人源化和CAR-T细胞治疗领域有多种应用。我们进一步证明了Malibu-Glo分析的实用性,可用于选择具有所需亲和力特征的最佳单链片段变量(scFvs),以纳入CAR。总之,Malibu-Glo检测是一种用于抗原检测的快速,简单,灵敏,特异且经济的检测方法,在抗体工程,抗体人源化和CAR-T细胞治疗领域有多种应用。我们进一步证明了Malibu-Glo分析的实用性,可用于选择具有所需亲和力特征的最佳单链片段变量(scFvs),以纳入CAR。总之,Malibu-Glo检测是一种用于抗原检测的快速,简单,灵敏,特异且经济的检测方法,在抗体工程,抗体人源化和CAR-T细胞治疗领域有多种应用。
介绍
可以说,抗体是最通用的生物制剂,在基础研究,疾病诊断和治疗中具有广泛的应用。除了全长抗体,抗体工程进展导致最小的抗原结合片段的产生(例如,Fab),单链片段可变(抗体),双抗体,双特异性和单结构域抗体(sdAb的)1,2。通过诱变,CDR嫁接,亲和力成熟和人源化进一步优化这些抗体,以产生大量变体。总之,这些努力增加了针对特定治疗靶标的抗体库。然而,鉴定具有针对特定应用的所需特性的最佳抗体的挑战仍然存在。为避免浪费的临床前研究工作,迫切需要可靠的测定方法来缩小用于下游评估的候选抗体的数量。
抗体的免疫治疗应用已经超出了其作为可溶性生物制剂的范围。近年来,衍生自抗体的scFv已嫁接到T细胞受体,以创建可以被用于免疫细胞重定向到期望的癌细胞嵌合抗原受体(CAR)3,4。为了这个目的,落入最佳亲和力范围内的scFv的期望5,6。以高亲和力的scFv CAR-T细胞被报道显示出强大的抗肿瘤功效,但是它是伴随着深刻关断肿瘤靶上针对表达抗原的低水平正常细胞毒性7,8。此外,含有极高亲和力的scFv的CAR-T细胞通常会导致强直信号8。相反,使用低亲和性的scFv设计CAR-T细胞更肿瘤选择性具有最小截止肿瘤毒性 6,9。因此,取决于肿瘤的相对抗原密度 VS正常细胞中,scFv的亲和力必须被微调,以生成最优CAR 10,11,12。同样重要的是,用于构建CAR的scFv应该表现良好。因此,开发一种可靠且简单的方法来基于scFv的表达和亲和力筛选现有的scFv库,将加快CAR-T细胞工程的发展。
尽管目前有几种方法(例如 ELISA,免疫印迹,流式细胞术和表面血浆共振等)可用于检测与靶抗原的结合13,但只有少数几种方法(例如流式细胞术和AlphaLISA)适用于检测抗体结合抗原以其天然构象在细胞表面14。所有这些测定法始终都依赖于检测标签,该检测标签直接连接至一抗,二抗或其他可识别一抗的蛋白质15。这些检测标签的历史范围包括放射性同位素,小分子荧光团,荧光蛋白或酶。通常,化学方法用于将抗体缀合至所需的蛋白质或荧光团。但是,这些化学交联反应难以控制,导致化学计量比变化的异质混合物。此外,这种缀合可以改变抗体的生物学活性。可以使用重组DNA技术规避这些限制,该技术允许抗体与所需蛋白质进行基因融合。例如,与报告酶(例如碱性磷酸酶16或β-半乳糖苷酶17)融合的抗体和抗体片段已经开发了。然而,这些酶的较大尺寸和有限的敏感性阻碍了它们的广泛使用。
荧光素酶是多用途的生物医学研究工具,他们结合高灵敏度低背景18,19。尽管萤火虫荧光素酶(Fluc)是研究应用程序中最受欢迎的荧光素酶之一,但其较大的大小(61 kDa)阻碍了其在蛋白质融合研究中的使用。在对比Fluc的,海洋萤光素酶和它们的工程化衍生物在大小(约19 kDa的)小并且具有更大的亮度,使它们用于融合研究理想伙伴18,20。
在这份报告中,我们描述了一种基于海洋荧光素酶的抗原检测方法。由于该检测方法利用海洋荧光素酶,因此以加利福尼亚州的Malibu海滩命名为Malibu-Glo检测法。我们显示,海洋荧光素酶可以与scFvs,单域抗体(vHH)和抗体样支架(Centyrins)融合,以产生通用的Malibu-Glo检测试剂。我们证明了Malibu-Glo分析的效用,可以快速评估不同scFv变体的相对表达和结合能力。我们进一步证明了该分析方法的实用性,可用于选择最佳scFv并入CAR。
结果
Malibu-Glo试剂(scFv-Nluc融合)表达构建体的设计和构建
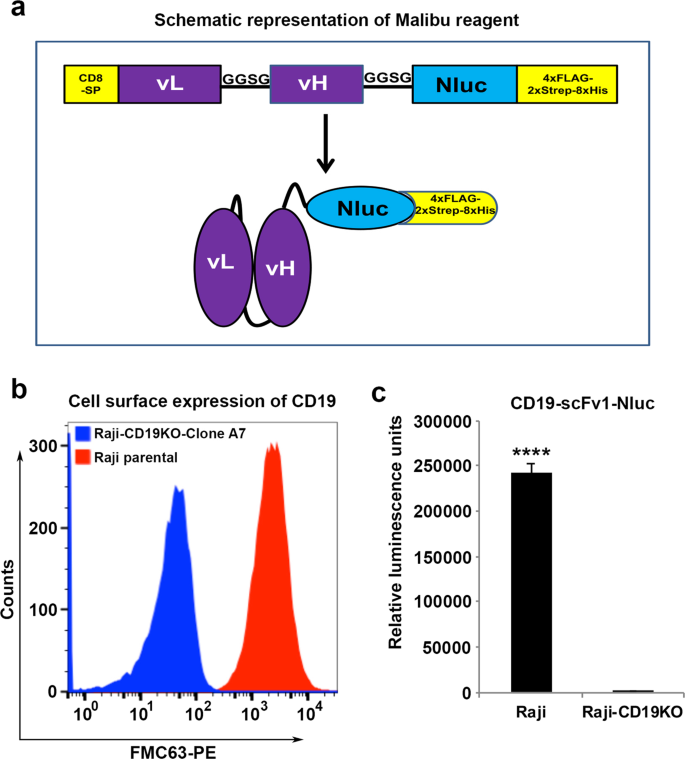
为了开发基于萤光素酶的抗原检测方法(Malibu-Glo检测),我们生成了慢病毒载体,该病毒编码的鼠源于小鼠CD19抗体FMC63的scFv与Nluc融合,通过一个中间的短Gly-Gly-Ser-Gly柔性接头与Nluc融合(图。 1a)。所得的融合蛋白(Malibu-Glo试剂)命名为CD19-scFv1-Nluc。我们选择Nluc进行分析是因为它的亮度,ATP独立性,小尺寸,单体性质,发光型发光和提高的稳定性21。为了促进Malibu-Glo试剂的纯化并允许其通过流式细胞仪进行检测,我们还通过一个插入的甘氨酸-丝氨酸(GGSG)接头在融合蛋白的羧基末端添加了一个4xFLAG-2xStreptag-8xHis盒。Malibu-Glo试剂(即scFv-Nluc)构建体的示意图如图1a所示 。
缺乏CD19的Raji细胞克隆的产生和鉴定。(a) Malibu-Glo(scFv-Nluc)构建体的示意图。(b) Raji-CD19KO克隆A7中CD19表达的缺失是通过用PE偶联的FMC63抗体染色,然后通过流式细胞术确认的。(c)通过Malibu-Glo测定证实了Raji-CD19KO克隆A7中CD19表达的缺乏。将Raji细胞或Raji-CD19KO克隆A7(100 µl中2×10 5)与100 µl含CD19-scFv1-Nluc融合蛋白(Malibu-Glo试剂)的上清液一起在冰上孵育45分钟。然后,如材料和方法所述,在测量与细胞沉淀相关的发光之前,先用含0.5%FBS的PBS洗涤细胞5次。。在星号(****)处,P <0.0001 表示具有统计学意义的差异。
使用CRISPR / Cas9技术开发缺少CD19的Raji细胞
为了证明scFv-Nluc融合蛋白与CD19的特异性结合,我们使用CRISPR / Cas9技术生成了缺少CD19的Raji细胞。我们成功分离了6个完全缺失CD19表达的克隆,通过CD19(FMC63-PE)抗体染色确定。从这些克隆中,我们选择克隆A7(图 1b),称为Raji-CD19KO克隆-A7,作为涉及CD19-scFv-Nluc融合蛋白的所有结合实验的阴性对照。
CD19-scFv1-Nluc融合蛋白的表达及功能评价
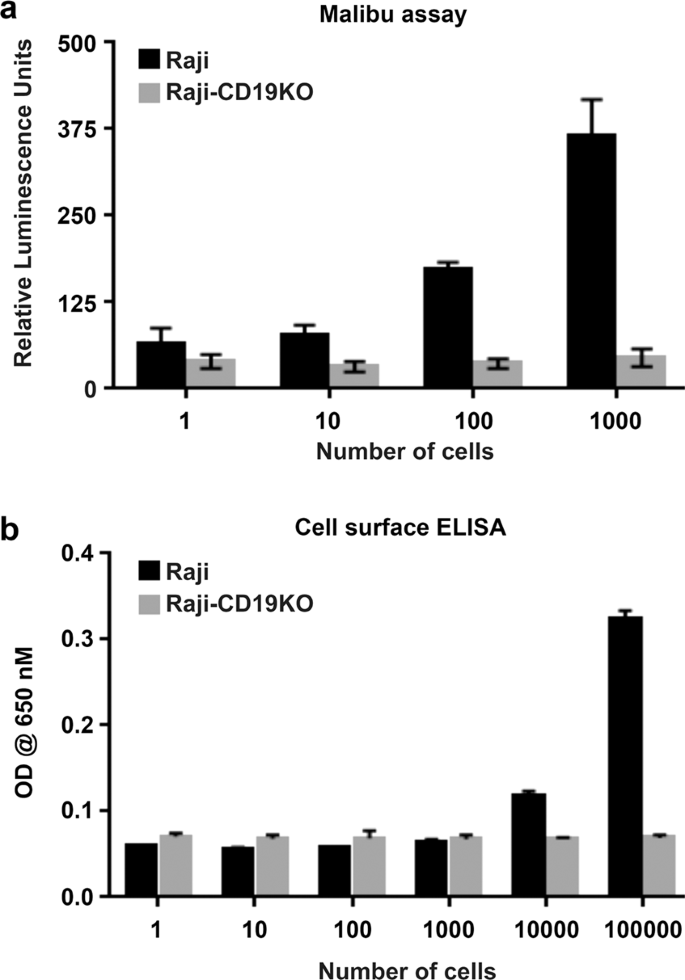
将编码CD19-scFv1-Nluc融合蛋白的表达构建体瞬时转染到293 FT细胞中,在转染后48小时收集含有分泌的Malibu-Glo试剂的上清液,并用于结合亲代Raji细胞和Raji-CD19KO克隆-A7。如图1c所示, 与Raji-CD19KO克隆-A7细胞相比,当被CD19-scFv1-Nluc Malibu-Glo试剂结合时,Raji细胞显示出超过200倍的发光增加。这些结果表明,使用在哺乳动物表达系统中产生的含有Malibu-Glo试剂的粗上清液可以成功地用于使用广泛使用的发光计进行细胞表面抗原的特异性检测。
使用不同海洋荧光素酶产生的Malibu-Glo试剂的功能评估
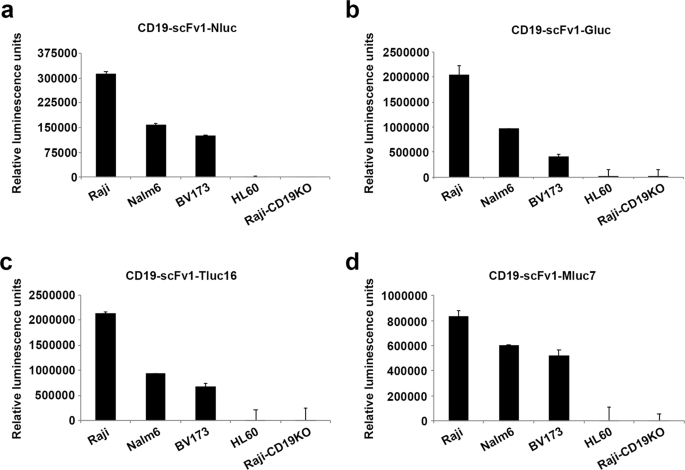
除了Nluc,一些海洋萤光素酶,如GLUC,Tluc16,和型MLuc7已经描述20,22。为了测试基于Nluc的Malibu-Glo分析是否可扩展至其他海洋荧光素酶,我们将原始CD19-scFv1-Nluc融合构建物中的Nluc与Gluc,Tluc16和Mluc7交换了。测试了这些Malibu-Glo试剂检测CD19细胞表面表达的能力。除了Raji,我们还评估了CD19-scFv1-luc Malibu-Glo试剂与Nalm6和BV173(CD19 + ve白血病细胞系)的结合。我们还包括HL60(CD19 -ve急性髓细胞白血病细胞系)和Raji-CD19KO-A7细胞作为阴性对照。所有CD19-scFv1-luc Malibu-Glo试剂仅与表达CD19的Raji,Nalm6和BV173细胞系特异性结合,而与缺乏CD19表达的HL60和Raji CD19KO-A7对照细胞系无明显结合(图 2a- d)。此外,所有四种CD19-scFv1-luc Malibu-Glo试剂在CD19 + ve细胞系中的结合顺序相同(Raji> Nalm6> BV173)。这些结果表明,无论与scFv融合的海洋荧光素酶的类型如何,我们的表达系统都可以实现最佳折叠,既保留荧光素酶的酶促活性,又保留scFv的结合特异性。因此,原则上,可以使用与任何海洋萤光素酶融合的scFv进行Malibu-Glo分析。
Malibu-Glo检测可基于scFv的表达和靶标结合快速筛选scFv
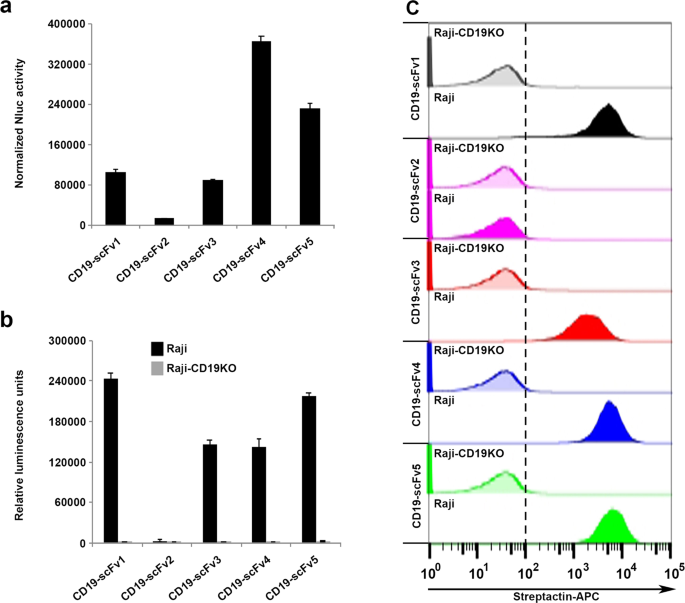
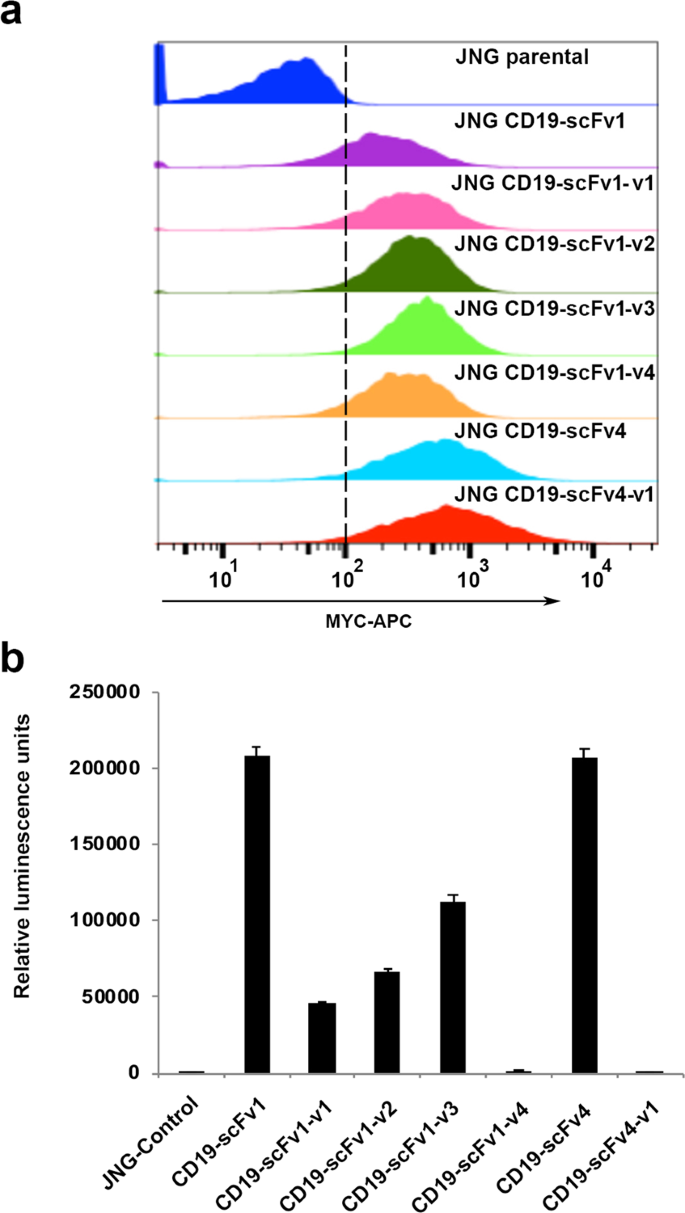
抗体工程项目中的主要挑战是选择一种最佳的治疗性抗体,该抗体不仅要结合所需的靶标并表现出所需的功能活性,而且还要在哺乳动物细胞中良好表达。由于与Nluc的融合可以测量粗上清液中的发光,而无需进行繁琐且耗时的蛋白质纯化和标记步骤,因此我们根据其相对水平检测了Malibu-Glo分析是否可以作为快速筛选scFv的通用工具。表达。为此,我们产生了针对CD19的一组scFv的Nluc融合构建体。我们将每个scFv-Nluc融合构建体与胞内表达的萤火虫荧光素酶构建体共转染293FT细胞,以标准化蛋白质表达。转染后48小时收集含有Malibu-Glo试剂的上清液,并用于测量Nluc发光。在细胞裂解物中测量萤火虫萤光素酶活性,并用于归一化上清液中存在的Malibu-Glo试剂的Nluc值,以控制转染效率的差异。归一化的Nluc活性用于基于scFv的表达对其进行分级。如图。 在图3a中,CD19-scFv4和CD19-scFv5显示高表达,CD19-scFv1和CD19-scFv3显示中间表达,而CD19-scFv2显示最低表达。通过使用Flag抗体通过蛋白质印迹分析不同的CD19-scFv融合蛋白的表达来确认Malibu-Glo测定的结果(补充图 1)。Western印迹进一步证明不存在任何截短的蛋白,并证实仅产生全长Malibu试剂。因此,Malibu-Glo分析提供了一种简单的解决方案,可在抗体发现的早期阶段消除表达不佳的scFv,从而避免了在下游过程中徒劳地投入时间和精力。
Malibu-Glo分析能够评估不同CD19-scFv的表达和靶标结合特征。(a)用不同的CD19-scFv-Nluc Malibu-Glo构建体和对照Fluc构建体瞬时转染293FT细胞。48小时后,在稀释的上清液中(含0.5%FBS的PBS中为1:100)测量Nluc活性。使用D-萤光素作为底物在细胞裂解物中测量萤火虫萤光素酶活性。将每个上清液的Nluc发光值用相应的Fluc发光值标准化以控制转染效率的差异。(b)通过Malibu-Glo测定评估不同CD19-scFv的靶标结合。将Raji和Raji-CD19KO细胞与含有指示的CD19-scFvs等效发光单位的上清液在冰中孵育200分钟,最终体积为200 µl。将细胞洗涤5次,并按照“ 材料和方法”中的描述测量结合发光。(c)通过流式细胞术分析的不同CD19-scFv的靶结合。将Raji细胞和Raji-CD19KO细胞与100 µl含有所示CD19-scFv-Nluc Malibu-Glo试剂的上清液在冰上孵育45分钟。温育后,将细胞洗涤2次,并与链菌素-APC温育45分钟。洗涤两次后,通过流式细胞仪分析细胞。显示了两个独立实验的代表。
接下来,我们检查了含有分泌的Malibu-Glo试剂的粗制上清液是否可用于快速评估不同scFv与它们的靶抗原表达细胞的相对结合亲和力,从而避免了费力的蛋白质纯化步骤。然而,不同scFv的表达水平的差异在这种测定中使用粗上清液提出了问题。为确保结合测定中使用的上清液量包含等量的不同scFv-Nluc融合蛋白,我们利用了抗原结合模块(即scFv)和检测模块(即, Nluc)。因此,我们使用发光值作为不同上清液中存在的scFv-Nluc融合蛋白数量的替代,并使用这些值对结合测定中所用不同上清液的体积进行标准化。为了测试此方法,我们在测定中使用了包含每个scFv等效发光单位的上清液体积,以检查其与Raji细胞和Raji-CD19KO克隆A7的结合。如图。 在图3b中,CD19-scFv1,CD19-scFv3,CD19-scFv4和CD19-scFv5显示出与Raji细胞的强结合,而CD19-scFv2显示出可忽略的结合。scFv中没有一个显示出与Raji-CD19KO克隆A7的显着结合,从而证实了测定的特异性。为了验证使用Malibu-Glo分析获得的结果,我们使用Strep-Tactin-APC通过流式细胞术测量了不同scFv与Raji细胞的结合,该结合与Malibu-Glo试剂上存在的StreptagII具有高亲和力(图 3c))。与使用光度计进行的Malibu-Glo分析获得的结果一致,使用流式细胞仪测量时,CD19-scFv1,CD19-scFv3,CD19-scFv4和CD19-scFv5显示出与Raji细胞的强结合力,而CD19-scFv2显示出的结合力可忽略不计。
Malibu-Glo试验可用于评估不同人源化scFv变异体的表达和相对结合亲和力
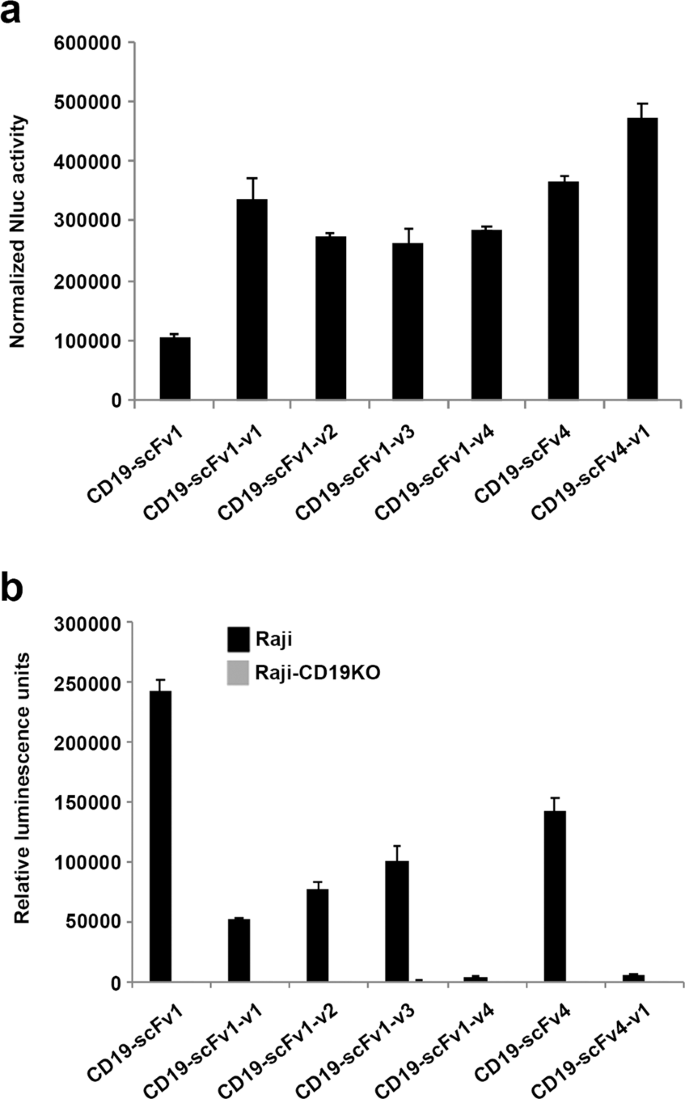
抗体和抗体片段的人源化经常用于治疗性抗体的开发中,以规避由免疫原性引起的问题。然而,必须筛选大量的人源化抗体变体以确保最佳的蛋白表达和靶标结合。与全长抗体相比,scFv的人源化由于其较低的稳定性,受损的亲和力和由于聚集而导致的不良收率,甚至构成了更大的挑战。为了测试Malibu-Glo分析用于选择人源化scFv变体的效用,我们生成了Nluc融合蛋白,该蛋白包含四个CD19-scFv1人源化变体,命名为CD19-scFv1-v1至CD19-scFv1-v4,以及一个CD19- scFv4指定为CD19-scFv4-v1。将scFv-Nluc融合构建体瞬时转染到293FT细胞中,并如前一部分所述检查细胞上清液中分泌的融合蛋白的相对表达。相对于亲本CD19-scFv1,所有四个人源化CD19-scFv1变体均表达良好,后者表现出中等表达(图。 4a)。类似地,与亲代CD19-scFv4相比,CD19-scFv4-v1显示出稍微更好的表达。通过使用Flag抗体的蛋白质印迹法证实了结果(补充图 2)。接下来,评估含有不同scFv-Nluc融合蛋白的上清液与Raji和Raji-CD19KO细胞的结合。如图4b所示 ,与亲本CD19-scFv1相比,CD19-scFv1-v1,CD19-scFv1-v2和CD19-scFv1-v3变体显示出与Raji细胞的结合力更低,而CD19-scFv1-v4变体显示出几乎完全丧失靶标-捆绑。相反,尽管亲代CD19-scFv4与CD19-scFv4-v1相比表达略低,但其与Raji细胞的结合却高22倍。值得注意的是,没有一个变体结合Raji-CD19KO细胞,从而证明它们保留了其对CD19的特异性。综上所述,这些结果表明,Malibu-Glo测定法可用于使用粗上清液快速确定表达水平,靶抗原结合能力和scFv变异体的特异性。
Malibu-Glo分析能够评估不同人源化CD19-scFv变体的表达和靶标结合。(a)分别如图3a,b所述评估不同人源化CD19-scFv的表达和(b)与Raji细胞的结合 。
Malibu试剂的C末端带有抗原决定簇标签(4xFLAG-2xStreptagII-8xHis)。我们通过亲和层析使用链球菌-肌动蛋白柱23纯化了CD19-scFv1-Gluc Malibu试剂。纯化的Malibu试剂用于确定与1×10 4 Raji和RS411细胞结合的最大有效浓度(EC50)的一半。使用可变斜率模型,我们确定CD19-scFv1-Gluc与Raji细胞和RS411细胞结合的EC50分别为4.9×10 -9 M和4.7×10 -9 M(补充图 3)。
Malibu-Glo分析可为CAR设计选择最佳的scFv
为了进一步证明使用Malibu-Glo分析基于表达水平和靶标结合选择的scFvs可以帮助选择scFvs进行CAR-T工程,我们基于CD19-scFv1,CD19-scFv4和CD19-scFv4生成了第二代(BBz)慢病毒CAR构建体他们的人性化变体。将scFv在框内融合至编码MYC表位标签,CD8铰链结构域,CD8跨膜结构域,41BB共刺激结构域和CD3ζ激活结构域的盒。用编码不同CD19-CAR的慢病毒转导表达NFAT-GFP报告基因(JNG)的Jurkat细胞克隆。在嘌呤霉素中选择10天后,将存活的细胞用抗MYC-APC染色,并通过流式细胞仪进行分析以定量细胞表面的CAR表达。通过Malibu-Glo分析测定,与scFv-Nluc融合蛋白的表达一致(图。 在图4a)中,所有CAR均在JNG细胞中显示出相对良好的表达(图 5a)。为了检查scFv-Nluc融合是否也能预测CAR与靶抗原的结合,我们测试了表达上述不同人源化CAR的JNG细胞与靶抗原CD19结合的能力。为了这个目的,我们采用了Topanga测定法。该测定法最近在我们的实验室中开发,用于检测CAR,并利用CD19-细胞外域(ECD)-Nluc融合蛋白23。在冰上将相等数量的表达不同CD19-CAR的JNG细胞与含有CD19-ECD-Nluc的上清液孵育45分钟,洗涤并测量细胞相关的发光。如图5b所示 在图4b中观察到,CD19-ECD-Nluc与表达不同CD19-scFv1-CAR的JNG的结合与相应的scFv-Nluc与Raji细胞的结合密切相关 。因此,CD19-scFv1-CAR显示出最高的结合,CD19-scFv1-v4-CAR显示出几乎可以忽略的结合,而所有基于CD19-scFv1变体设计的CAR构建体均显示出中间结合。同样,与scFv-Nluc结合Raji细胞获得的结果一致(图 4b),CD19-scFv4-v1-CAR不能结合CD19-ECD-Nluc,而CD19-scFv4-CAR显示出牢固的结合(图 5b)。)。总体而言,这些结果证明了使用Malibu-Glo分析法选择最佳scFv来设计CAR构建体的潜力。
靶向不同肿瘤抗原的Malibu-Glo试剂的产生和功能评估
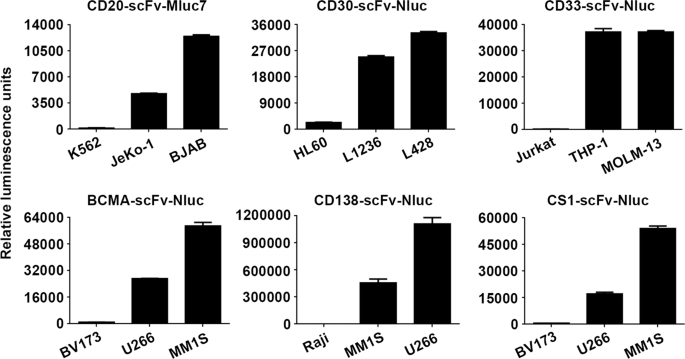
为了将Malibu-Glo分析扩展到其他抗原以治疗血液系统恶性肿瘤和实体瘤,我们基于靶向CD20,CD30,CD33,BCMA,CD138和CS1的scFv生成了Malibu-Glo试剂。使用已知表达各自靶抗原的细胞系测试了不同scFv-Nluc融合蛋白的结合能力(图 6)。因此,使用已知可表达CD20的JeKo-1(套细胞淋巴瘤)和BJAB(伯基特淋巴瘤)细胞系对CD20-scFv-Nluc Malibu-Glo试剂进行了测试,而对CD30-scFv-Nluc Malibu-Glo试剂进行了测试,霍奇金淋巴瘤衍生的细胞系L428和L1236表达CD30。同样,THP-1(人类急性单核细胞白血病)和MOLM-13(人类急性髓性白血病)细胞系用于评估CD33-scFv-Nluc的结合,而MM1S(多发性骨髓瘤)和U266(多发性骨髓瘤)细胞系用于评估BCMA-scFv-Nluc,CD138-scFv-NLuc和CS1-Nluc Malibu-Glo试剂的结合。在每种情况下,我们都使用缺少所需抗原的细胞系来确定非特异性结合。因此,我们使用K562,HL60,Jurkat和BV173作为阴性对照细胞系,以检查靶向CD20,CD30的Malibu-Glo试剂的结合,CD33和BCMA。如图。 在图6a-f中,我们观察到Malibu-Glo试剂与预期的靶抗原表达细胞的特异性结合,同时观察到与阴性对照细胞系的结合可忽略不计。这些结果证明了快速产生Malibu-Glo试剂用于检测任何所需细胞表面抗原的可行性。
Malibu-Glo测定法是一种快速且高度灵敏的测定法,用于检测细胞表面靶标
接下来,我们通过将含有CD19-scFv1-Nluc的上清液与1至1×10 3个细胞的不同数量的Raji细胞一起孵育来评估Malibu-Glo分析的灵敏度。我们使用Raji-CD19KO克隆A7的1×10 5个细胞来评估非特异性结合。将细胞在冰上孵育45分钟,旋转,洗涤5次,然后测量细胞沉淀中的发光。如所预期的,随着Raji细胞数量的增加,观察到了发光的线性增加,表明CD19-scFv1具有特异性结合。在包含100个以上细胞的孔中观察到统计学上的显着差异(图 7a)。此外,Malibu-Glo分析显示了发光值与细胞数量之间的线性关系(补充图 4)。),从而得到理想的相关系数值(R 2 = 1)。我们还比较了Malibu-Glo分析对细胞表面ELISA的敏感性。为此,越来越多的Raji细胞用FMC63(针对CD19的小鼠单克隆抗体)免疫染色,然后用FITC偶联的抗小鼠抗体进行二级标记。如图7b所示 ,可以通过细胞表面ELISA检测到的Raji细胞的最小数量为10,000。因此,Malibu-Glo分析的灵敏度至少比传统细胞表面ELISA高100倍。需要进行更多研究才能将Malibu-Glo分析与其他抗原检测分析进行比较。
Malibu-Glo分析的标准方案涉及4至5个洗涤步骤,以完全消除非特异性结合。但是,由于特异性结合也随每个洗涤步骤而降低,具有高关闭率的scFv可能会解离,从而导致低特异性结合24。为了扩大我们的检测的效用并减少时间和劳力,我们优化了使用CD19-scFv1-Nluc上清液和CD19抗原表达阳性和阴性的细胞系的洗涤步骤。如补充图5所示 ,单次洗涤足以检测CD19-scFv1与表达CD19的Raji和Nalm6细胞的特异性结合与与CD19阴性的HL60和Raji-CD19KO细胞的非特异性结合相比的显着差异。
使用单域抗体的Malibu-Glo分析
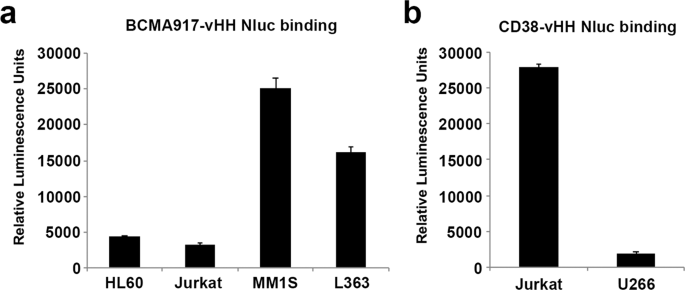
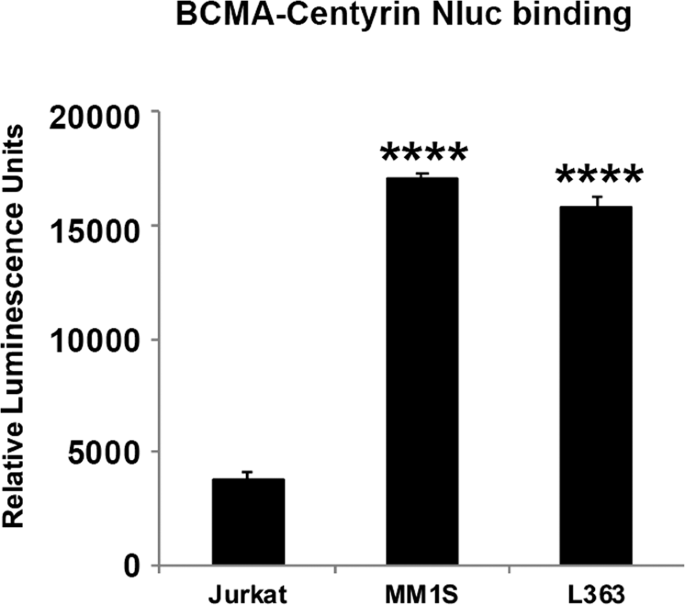
历史上,已经使用scFv作为抗原结合结构域工程改造了嵌合抗原受体。备选地,单结构域抗体可用于产生CAR。为了测试Malibu-Glo分析是否可以扩展到仅重链单结构域抗体(vHH),我们生成了针对BCMA和CD38的vHH结构域的Nluc融合蛋白,并在293FT细胞中进行了表达,如前所述。进行Malibu-Glo测定以评估vHH-Nluc融合蛋白的结合能力。与BCMA阴性HL60和Jurkat细胞系相比,BCMA-vHH-Nluc融合蛋白与表达BCMA的骨髓瘤细胞系(MM1S和L363)具有显着结合(图 8)。)。同样,表达CD38的Jurkat细胞结合CD38-vHH-Nluc融合蛋白,但不能结合缺乏CD38表达的U266细胞。因此,Malibu-Glo测定法还可用于筛选单结构域抗体以鉴定潜在的结合物。
使用非scFv支架蛋白的Malibu-Glo分析
在努力非人scFv的降低免疫原性衍生的CAR,这导致排斥和有限的持久性,非基于的scFv的CAR正在使用来自纤连蛋白结构域的蛋白的支架蛋白,如centyrins和阿德奈汀开发25,26,27。为了测试使用Malibu-Glo分析是否可以可靠地检测到这些抗原结合支架,我们生成了靶向BCMA的百草枯的Nluc融合构建体。我们瞬时转染了293FT细胞,并评估了上清液与表达BCMA的细胞的结合。如预期的那样,BCMA-centyrin选择性结合表达BCMA的多发性骨髓瘤细胞MM1S和L363,但不结合BCMA阴性的Jurkat细胞(图 9))。总而言之,这些结果表明,可以将任何抗原结合部分与海洋荧光素酶融合以开发用于可靠检测其靶抗原的Malibu-Glo试剂。
讨论区
基于抗体的免疫疗法和嵌合抗原受体改造的T细胞疗法正在成为治疗癌症的有前途的方法。的这些方法的成功依赖于对肿瘤细胞表面上的靶抗原的表达水平11,12和免疫治疗剂的抗原结合结构域的相对结合能力10。需要一种快速,经济和方便的方法来选择具有最大的靶向作用和最小的脱靶毒性的免疫治疗剂。
当前可用的抗原检测方法,例如蛋白质印迹和流式细胞术是费时,费力的,需要纯化的试剂和/或昂贵的设备。一些生物物理方法(例如,表面等离子体共振)和免疫学检测细胞表面抗原的方法需要纯化抗原或抗体。但是,纯化程序可能会导致功能上重要的构象表位丢失。由于这些限制,理想的是在其自然环境中检测细胞表面抗原,而流式细胞仪仍然是选择的方法。然而,流式细胞术是费时费力的,需要昂贵的设备并且需要购买荧光标记的一抗或二抗。
为了开发一种检测肿瘤细胞表面抗原的替代方法,我们对不同海洋荧光素酶抗体的scFv进行了遗传标记。先前大多数产生抗体-荧光素酶融合蛋白的尝试都使用了大分子量的荧光素酶。我们使用海洋荧光素酶作为融合伴侣,因为它们的体积小且具有良好的发光特性20。其它基团已经融合使用海洋萤光素酶的抗体片段的大肠杆菌或噬菌体表达系统,其中的抗体片段的最佳折叠和糖基化是不可预测的28,29。此外,在评估表达水平或与哺乳动物细胞结合之前,需要从干扰细菌污染物中纯化抗体-荧光素酶融合蛋白。另外,细菌中抗体的表达水平可能与其在哺乳动物细胞中的表达水平不相关。我们的测定规避了这些限制,因为在哺乳动物细胞中进行了表达和结合研究,从而节省了时间和精力来纯化抗体。
用于细胞表面抗原检测的基于抗体的常规方法通常需要第二检测剂或纯化的抗体与荧光团或标记酶的化学结合。但是,抗体的化学偶联会导致其部分失活和偶联物异质性,从而影响特异性和敏感性。由于抗原结合模块(例如scFv)直接耦合到检测模块(例如Nluc),因此在Malibu-Glo试剂中可以避免这种情况。因此,与使用化学合成获得的抗体-酶结合物相比,Malibu-Glo试剂具有多个优势,包括均质组成,化学计量比为1:1和高灵敏度。
当细胞数量有限时,基于流式细胞仪的表面抗原检测可能会很费时,因为样品采集的速率与样品浓度成反比。为了进行最佳的流量实验,最少需要50-100 K个细胞。在需要使用有限数量的患者来源细胞进行细胞表面抗原检测的情况下,Malibu-Glo分析将是有利的,因为即使使用100个细胞也可以检测到抗原。此外,流式细胞术通常需要在染色之前封闭,以减少由与细胞上Fc受体结合引起的高非特异性荧光。由于Malibu-Glo试剂缺少任何Fc区,因此在我们的测定中消除了这种非特异性结合。
AlphaLISA是另一种以天然构象检测细胞表面抗原的方法。但是,使用AlphaLISA检测细胞膜结合抗原需要针对每种抗原30优化细胞裂解缓冲液。此外,必须分别购买专有的供体和受体珠以结合捕获和检测抗体。预制试剂盒仅适用于几种抗原,价格昂贵。对于三明治式AlphaLISA,需要两种与空间上不同的表位结合的抗体。相比之下,Malibu分析提供了一种简单,灵敏且经济高效的方法来检测可轻松适用于任何实验室的细胞表面抗原。
Malibu-Glo分析的一种潜在应用是对scFv的选择和优化。我们证明,Malibu-Glo分析提供了一种简单,灵敏,快速,经济高效的方法,可通过一步分析形式同时评估scFvs与细胞表面靶标的相对表达和结合亲和力,从而消除弱表达的scFvs在抗体优化的早期阶段。
从迅速增长的抗体清单成功设计CAR取决于选择具有最佳表达和结合特性的scFv。尽管很明显,CAR的靶标特异性源自其抗原结合结构域,但是选择特定表位或理想抗原结合结构域的规则并不明确。并非所有抗原都有可用的抗体,可用的抗体可能尚未经过临床前或临床评估。相反,对于已建立的靶标,可能有几种抗体可用,并且目前没有简单,灵敏和快速的方法来筛选最佳的scFv片段,以掺入CAR构建体中以进行进一步开发。
我们测试了使用Malibu-Glo分析评估的scFvs的表达和靶标结合是否可以预测相应CAR的表达水平及其与同源抗原的结合。我们证明了表达水平(通过MYC染色评估,图 5a)和抗原结合能力(通过Topanga分析评估,图 5b)CAR的)与包含其抗原结合结构域的scFv的表达水平和抗原结合能力密切相关。实际上,当将所有测试的人源化scFvs变体掺入CAR中时,其表达和靶标结合与亲本scFv非常相似。因此,Malibu-Glo分析是一种快速鉴定具有所需表达和抗原结合特性的抗原结合模块(例如,scFv)的有效方法,以整合到CAR中。通过在早期消除表达和结合特性较差的scFv,Malibu-Glo分析可简化CAR的构建过程,并有可能消除针对特定抗原构建和测试大量CAR构建体的需要。
但是,Malibu-Glo分析的用途不限于scFv的选择和优化。除scFv以外,我们还基于单域抗体(vHH)和centyrins生成了Malibu-Glo试剂。在所有情况下,用海洋荧光素酶标记既不会影响融合蛋白与其靶抗原的结合,也不会损害荧光素酶的活性,因此证明了该方法的多功能性。
最后,Malibu-Glo分析的另一种应用是鉴定细胞表面蛋白。尽管许多基因组学和蛋白质组学方法可用于鉴定癌细胞特异性蛋白,但它们无法区分细胞内靶标与细胞表面靶标。我们相信,Malibu-Glo分析法可提供一种简单,快速且功能强大的工具来鉴定用于细胞标志物分析和靶向疗法开发的新型细胞表面蛋白。
总之,我们已经开发了一种快速,简单,经济和有效的检测细胞表面抗原的检测方法,在抗体和细胞治疗产品的开发中具有潜在的应用前景。Malibu-Glo分析法可以作为一种多功能工具,用于在抗体开发计划的早期阶段筛选具有最佳表达和结合特性的治疗性抗体,并指导将scFv掺入CAR构建体的选择。但是,Malibu-Glo检测不仅限于scFv,还可以扩展到双特异性抗体,单域抗体和其他支架蛋白。海洋荧光素酶与其他临床上重要的结合域和治疗性蛋白的融合可以在生物医学的各个领域中广泛应用。
材料和方法
细胞系和试剂
从ATCC获得Raji,Jurkat,HL-60,JeKo-1,BJAB,RS411和K562细胞系,并按照提供的说明进行培养。JNG细胞系(用N FAT依赖的E G工程化的J urkat细胞FP报告基因)由Arthur Weiss博士(加利福尼亚大学,旧金山,美国)提供。Nalm6和BV173细胞系是Markus Muschen博士(美国加利福尼亚州洛杉矶儿童医院)的慷慨礼物。MM1S,U266,THP-1和MOLM-13细胞系由Drs。艾伦·利希滕斯坦(美国加利福尼亚州洛杉矶退伍军人事务医院),格里戈尔·亚当斯(美国南加州大学洛杉矶分校),李在荣(美国南加州大学洛杉矶分校)和李玲(希望之城美国加利福尼亚州洛杉矶分校) ,美国)。L428和L1236细胞系是Markus Mapara博士(美国纽约哥伦比亚大学医学中心)的亲切礼物。为了生产慢病毒,从ThermoFisher(Cat#R70007)购买了293FT细胞,并按建议进行维护。聚乙烯胺(PEI)购自Polysciences Inc(目录号24765-1)。分别从Sigma和Nano light技术获得Polybrene(Cat#107689)和腔肠素(Cat#303)。细胞培养裂解液5X试剂购自Promega(Cat#E153A)。
Malibu-Glo试剂(scFv-荧光素酶融合)表达构建体的生成
将密码子优化的编码不同海洋荧光素酶(Nluc,Gluc,Mluc7和Tluc16)信号肽缺失变体的cDNA序列与scFv和其他抗原结合域框内融合31靶向不同的靶抗原,并使用标准分子生物学技术将其克隆到pLenti-EF1α表达载体中。在scFv和荧光素酶序列之间包括一个中间的短Gly-Gly-Ser-Gly(GGSG)柔性接头。scFv的可变轻链(vL)和可变重链(vH)也被GGSG接头分开。这些构建体还由T2A核糖体跳跃序列和随后的嘌呤霉素抗性基因(PAC,嘌呤霉素乙酰转移酶)组成。在萤光素酶基因的框架内和下游克隆了带有4个FLAG表位标签,2个Strep-tagII标签和8个组氨酸标签的合成盒4xFLAG-2xStreptagII-8xHis。
Malibu-Glo试剂的生产
通过使用聚乙烯胺(PEI)瞬时转染所需的慢病毒构建体,在293FT细胞中产生了scFv-Nluc融合蛋白(Malibu-Glo试剂)。简而言之,将293FT细胞在100mm组织培养板中过夜接种。对于每种构建体,将10 µg慢病毒融合质粒和0.25 µg EGFP质粒(用于评估转染效率)悬浮在960 µl没有FBS或抗生素的DMEM培养基中。在涡旋下向该溶液中滴加21μl的PEI溶液(1mg / ml)。孵育15分钟后,将含有DNA / PEI复合物的溶液添加到293FT细胞上。转染后约48小时,收集上清液,通过0.45 µm过滤器过滤并保存在-80°C。为了评估不同scFv-Nluc融合蛋白的相对表达,在24孔板中一式两份进行瞬时转染。对于每个孔,将1 µl PEI添加到40 µl DMEM(不含FBS或抗生素)中,其中含有500 ng所需的scFv-Nluc融合质粒,30 ng萤火虫luc质粒和20 ng EGFP质粒。在室温下孵育15分钟后,将DNA-PEI复合物添加到含10%FBS的0.5 ml DMEM中的细胞中。48小时后,将细胞用PBS轻轻清洗一次,然后用150 µl 1X细胞培养裂解试剂(Promega)裂解。在使用D-荧光素作为底物测量发光之前,将细胞裂解物在4°C下以10,000 rpm旋转5分钟。在室温下孵育15分钟后,将DNA-PEI复合物添加到含10%FBS的0.5 ml DMEM中的细胞中。48小时后,将细胞用PBS轻轻清洗一次,然后用150 µl 1X细胞培养裂解试剂(Promega)裂解。在使用D-荧光素作为底物测量发光之前,将细胞裂解物在4°C下以10,000 rpm旋转5分钟。在室温下孵育15分钟后,将DNA-PEI复合物添加到含10%FBS的0.5 ml DMEM中的细胞中。48小时后,将细胞用PBS轻轻清洗一次,然后用150 µl 1X细胞培养裂解试剂(Promega)裂解。在使用D-荧光素作为底物测量发光之前,将细胞裂解物在4°C下以10,000 rpm旋转5分钟。
使用CRISPR / Cas9技术生成缺少CD19的Raji克隆
缺乏CD19的Raji细胞是通过CRISPR / Cas9介导的基因编辑产生的。我们采用了一种多合一的慢病毒载体pLenti-U6-SFFV-Cas9-2A-Puro,该载体编码CD19-sgRNA和Cas9核酸酶(Applied Biological Materials Inc. )。使用10微克CD19gRNA / Cas9载体,7.5微克PSPAX2的通过瞬时转染产生的慢病毒上清液编码的gag / POL包膜蛋白和2μgPLP / VSVG的如先前所描述18。在聚丙烯存在下(8μg/ ml),通过旋转感染(在37°C下以1800 rpm旋转45分钟),用CD19 gRNA / Cas9慢病毒转导Raji细胞。过夜孵育后,将细胞洗涤并悬浮在含有0.8μg/ ml嘌呤霉素的新鲜培养基中。两周后,将细胞用抗CD19-PE染色,并用FACS分选CD19 -ve 然后通过有限稀释克隆单个细胞。
Malibu-Glo分析
为了使用含Malibu-Glo试剂的上清液建立基于细胞的结合测定,对表达所需表面靶标的细胞进行计数,以1300 rpm离心5分钟,然后重悬于含0.5%FBS的PBS中(每毫升2×10 6个细胞) )。对于每个反应,一式两份将100 µl靶细胞与融合蛋白上清液(100 µl或相当于等效发光单位的体积)混合。在冰上孵育45分钟后,将细胞用1 ml冰冷洗涤缓冲液(PBS中0.5%FBS)洗涤5次,然后将沉淀重新悬浮在100 µl洗涤缓冲液中。向白色384孔lumitrac板的三孔中接种30μl细胞,并使用腔肠素(CTZ)作为底物18测量发光。
基于慢病毒的嵌合抗原受体(CAR)的构建和JNG-CAR细胞的产生
之前我们已经报道的慢病毒载体pLenti-EF1α-FMC63-MYC-BBZ-T2A-PAC 18。通过将FMC63-scFv与从其相应的scFv-Nluc载体上切下的所需scFv片段交换来生成编码该研究中不同CAR的慢病毒载体。如先前所述,通过慢病毒转导产生的JNG细胞稳定表达不同的车18。
统计分析
使用GraphPad Prism 5软件,使用两尾未配对的Student t检验来测试两组之间的差异。用差异P ≤0.05被认为是统计学显著。
|
|