维生素A和D在BCR-ABL Arf -/-急性淋巴细胞白血病中的作用
维生素A和D在BCR-ABL Arf -/-急性淋巴细胞白血病中的作用
摘要
在Arf -/- BCR-ABL急性淋巴细胞白血病小鼠模型中研究了维生素A和/或维生素D缺乏的影响。与缺乏维生素D(VDD)的小鼠相比,足够维生素D的小鼠死亡更早(p = 0.003)。维生素A缺乏症(VAD)小鼠的表现最差,疾病进展更快,生存期降低。缺乏维生素A和D(VADD)的小鼠的疾病进展与VAD小鼠相似。先前显示与不良BCR-ABL白血病控制有关的调节性T细胞在 维生素A缺乏症小鼠与充足小鼠的CD4 +脾细胞中的频率较高。体外研究表明1,25-二羟基维生素D(1,25(OH)2 VD 3)仅在与骨髓基质共培养时才增加BCR-ABL ALL细胞的数量。1,25(OH)2 VD 3诱导基质细胞在体内和体外表达CXCL12,CXCL12增加基质迁移和BCR-ABL母细胞的数量。维生素D和白血病重新编程了骨髓,增加了胶原蛋白的产生,可能会诱捕所有胚细胞。维生素A(全反式维甲酸,ATRA)处理的白血病细胞凋亡增加,S期细胞减少,G 0 / G 1细胞增加。ATRA通过类视黄醇X受体发出信号,从而降低BCR-ABL白血病细胞的生存能力。总之,维生素A和D缺乏症对BCR-ABL ALL小鼠的存活具有相反的影响。
介绍
维生素d缺乏症(VDD)影响了大约十亿人在世界上所有种族和年龄组1,2,3。VDD是导致普通人群死亡的独立危险因素4,几乎60%的恶性疾病儿童的维生素D(VD 3)水平都不理想5。同样,世界卫生组织(WHO)估计有2.5亿学龄前儿童缺乏维生素A(VAD),这增加了严重感染所致疾病和死亡的风险。VAD和VDD不仅限于发展中国家。相反,最近的一项研究发现,在田纳西州孟菲斯接受测试的45人中,维生素A和维生素D的水平只有两个人同时具有足够的维生素6水平6。
维生素D是脂溶性维生素,不仅可以调节钙的吸收和骨骼的代谢,还可以调节细胞的增殖,分化和免疫反应。维生素D的生物活性形式1,25(OH)2 VD 3与与类维生素X受体(RXR)异源二聚的维生素D受体(VDR)结合。然后,该复合物与靶基因中的VDR-RXR反应元件结合以调节转录。VDR在肠,肾和骨中高表达,在骨髓中的正常和赘生性造血细胞和间充质干细胞中也高表达7。1,25(OH)2 VD 3可以修饰胚胎造血干和祖细胞产生8。1,25(羟基)2VD 3抑制小鼠和人类骨髓性白血病细胞9的增殖,并刺激骨髓细胞分化为成熟的巨噬细胞。的确,与1,25(OH)2 VD 3类似物治疗的急性髓细胞性白血病(AML)小鼠比未治疗的小鼠10存活时间更长。此外,维生素D功能不足/缺乏与临床不良结果以及AML 11,慢性淋巴白血病12和非霍奇金淋巴瘤13患者的无进展生存严重恶化有关,表明这些类型的白血病患者的维生素D水平具有临床意义和淋巴瘤。
急性淋巴细胞白血病(ALL)是儿童癌症占儿科白血病近80%的最常见的形式14,和多个报告表明,大多数白血病患者是VD 3不足在诊断时5,15。因此,Dana Farber(ClinicalTrials.gov识别号:NCT01574274)和洛杉矶儿童医院(识别号:NCT01317940)均正在进行儿童儿科ALL临床试验,以监测患者的VD 3水平并给予补充以恢复充足。但是,尚不知道VD 3缺乏或补充可能如何影响ALL进展或生存。在VD 3的少数报告中对ALL(B-ALL)(小儿ALL的最常见形式)的B细胞谱系的影响存在矛盾的结果;一项研究得出结论,VD 3对悬浮培养物中的白血病细胞生长没有影响16,而另一项研究得出结论,VD 3在克隆性软琼脂试验中抑制了B细胞ALL的生长17。考虑到文献中的争议,以及相当多的ALL患者VD 3缺陷且其中一些患者正在接受VD 3补充的事实,测试VD 3水平是否影响B-ALL细胞生长,存活和预后很重要。
维生素A有多种形式,一组脂溶性类维生素A。人的饮食通常包括视黄醇,视黄酯和原维生素A类胡萝卜素,它们每一种都可以在体内代谢成其活性最高的代谢物全反式维甲酸(ATRA)。类维生素A可以调节细胞的生长和分化,ATRA现在被用于治疗某些形式的癌症,包括某些白血病。类视黄醇部分作为根据细胞类型激活许多核受体(例如,视黄酸受体(RARs),类视黄醇x受体(RXRs))的配体起作用。
根据许多染色体异常和功能丧失或显性负序列突变,B-ALL可分为不同的亚型。3-5%的儿童ALL病例和25%的成人ALL病例携带9号和22号染色体之间的易位[t(9; 22)],从而创建BCR-ABL1融合基因(费城染色体(Ph +))18。在诊断时,约有67%的儿科Ph + ALL患者还患有Ink4-Arf缺失(Arf -/-)(以下称为BCR-ABL ALL或BCR-ABL + ALL),约80%的患者患有IKAROS(IKZF1)改变对于高风险的特点B-ALL 19,20。最近发现,在体外用类维生素A进行治疗会降低BCR-ABL Arf -/-和BCR-ABL IKAROS突变的急性淋巴细胞白血病的存活率21,但是,维生素A功能不足如何影响其生长或存活尚不清楚来自体内 BCR-ABL白血病。因此,我们在小鼠BCR-ABL白血病模型中测试了维生素A,D以及维生素A和D的充足与不足对存活率的影响,并探讨了其差异作用的机制。
结果
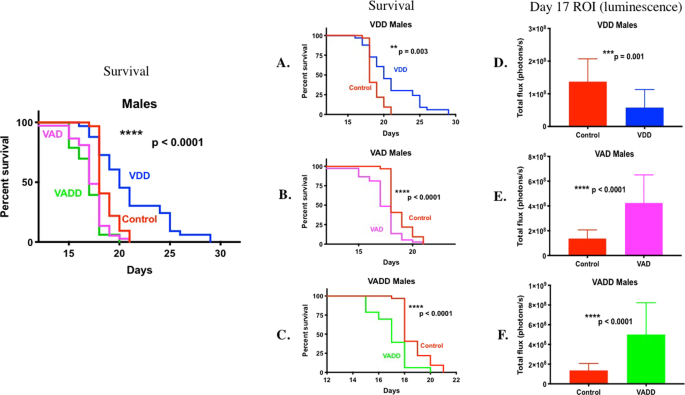
维生素D缺乏症改善存活率,维生素A缺乏症降低BCR-ABL + B-ALL 小鼠的存活率
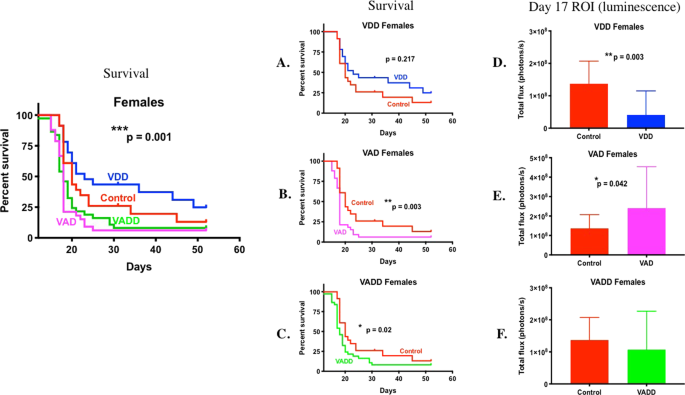
从男性注射后第8天起,通过体内生物发光成像对白血病细胞进行了体内生物发光成像,从而比较了维生素充足的对照小鼠和VDD,VAD和VADD小鼠之间BCR-ABL Arf -/-荧光素酶标记的B前白血病细胞的进程和疾病存活率和雌性小鼠(补充图 S1,S2)。在对照组,VAD和VADD雄性小鼠中在第8天检测到白血病,但直到第10天在VDD雄性小鼠中才检测到白血病。到第14-17天,VAD和VADD小鼠开始屈服于高度侵袭性的肿瘤负担。它们的中位生存时间更短,这与对照组小鼠的全身疾病负担相比明显更高(图 1B,C,E,F,**** p <0.0001,所有研究合并)(补充图 S3,单个研究)。出人意料的是,与VD 3足(对照)雄性小鼠相比,VDD雄性小鼠随着时间的推移显示出较慢的肿瘤进展,并且每只小鼠的平均疾病负担较低(补充图 S1,图1D, *** p = 0.001)。因此,与VD 3足够的雄性小鼠相比,VDD小鼠的存活时间长得多(图 1A,** p = 0.003)。通过比较在给予白血病后每天存活的小鼠的比例,可以很容易地看出这一点(补充表 S1)。例如,对于第18天的研究1,只有47%的对照雄性小鼠存活,而VDD雄性小鼠则为80.95%;因此,对照雄性小鼠的中位生存期为18天,而VDD雄性小鼠为21天。在雌性小鼠中观察到维生素水平对白血病生存的相似影响(最短至最长:VAD <VADD <对照<VDD)(补充图 S2和图 2所有研究合并)(补充图 S4),个人研究)。由于疾病的生长较慢并且女性的中位生存时间比男性长,因此我们使用PCR方法确定了白血病细胞中X和Y染色体特异性基因,从而确定了鼠BCR-ABL白血病细胞的性别。此PCR分析法依赖于雄性的Y染色体特异性Zfy扩增(雌性不存在)和雄性的280 bp Y染色体特异性Sly基因产物的扩增,以及480/685 bp的X染色体特异性Xlr基因产物的扩增。女22。如Zfy和Sly Y染色体PCR产物所示,发现BCR-ABL细胞是雄性的(补充图 S5)。
雄性维他命充足的小鼠(对照组,n = 34)与VAD(n = 41),VDD(n = 34)和VADD(n = 35)小鼠的Kaplan Meier生存曲线和第17天的白血病负担。绘制雄性(A)对照和VDD小鼠的Kaplan Meier存活曲线。(B)对照和VAD小鼠;(C)对照和VADD小鼠。(D-F)第17天BCR-ABL雄性小鼠与(D)个VDD小鼠的Bf-/-白血病感兴趣的全身区域(ROI)发光;(E)VAD小鼠;和(F)VADD小鼠。使用Long-Rank(Mantel-Cox)检验来发现对照组和所有维生素缺乏组的生存曲线之间的差异(左图)(**** p <0.0001)。使用Gehan-Breslow-Wilcoxon检验来发现对照组和每个维生素缺乏组的生存曲线之间的差异(**** p <0.0001,** p <0.01)。使用未配对的t检验和Welch校正,比较各组之间第17天的白血病身体负担(**** p <0.0001,*** p = 0.001,** p <0.01,* p <0.05)。
通过分析对照,VDD和VADD小鼠中的25-OH-VD 3以及分析对照,VAD和VADD小鼠中的RBP水平,确认了从终末血液样本中获得的血清中维生素D和A的缺乏(补充表 S2)。比较了患有BCR-ABL白血病的对照,VAD,VDD和VADD小鼠和非白血病健康小鼠(无疾病对照(ND))的全血细胞计数(CBC)和血清化学(补充表 S3,S4)。与白血病对照小鼠相比,缺乏维生素A或D的雄性白血病小鼠和缺乏维生素A的雌性小鼠的红细胞数量,血细胞比容和血红蛋白减少,与这些小鼠中较高的白血病负担相一致。比较两组之间的血清化学,维生素缺乏的雄性小鼠的HDL水平升高,而VAD小鼠的LDL水平升高。在检查HE染色的胫骨纵切片时,白血病对照小鼠和VDD小鼠之间的骨血管,小梁体积,成骨细胞和破骨细胞数量没有差异。白血病注射前第0天小鼠体重(g)的比较显示,只有维生素A缺乏的体重与对照组不同:雄性对照组(21.58±1.95)vs. VDD(21.5±1.99),VAD(20.54±1.86)和VADD (20.35±1.41)小鼠;
与具有足够维生素的小鼠相比,VAD小鼠的骨髓和脾脏BCR-ABL白血病负担更高,而VDD小鼠则更低
为了进一步评估白血病复制的主要部位(如骨髓和脾脏)的相对白血病负担,我们量化了骨髓中荧光素酶标记的BCR-ABL细胞的数量(补充图 S6A)。此外,由病理学家(圣裘德儿童研究医院的Laura Janke博士)对H&E染色的后肢和脾脏组织学切片中的疾病负担进行了盲目评分(补充图 S6B,C)。雌性小鼠在维生素充足和不足组之间的骨髓或脾脏疾病负担方面无差异(补充图 S6)。符合较低的总白血病身体负担(补充图 S1),VDD雄性小鼠的骨髓,后肢和脾白血病的水平较低(补充图 S6A–C)。相比之下,尽管总白血病的身体负担较高(补充图 S1),但单独缺乏维生素A(VAD)和维生素A和D(VADD)的雄性小鼠的后肢白血病明显较低(补充图 S6B,**)与对照小鼠相比,* p = 0.0007,* p = 0.015,* p = 0.045)和较低的骨髓白血病细胞(补充图 S6A,* p = 0.016,* p = 0.031)。这可能表明在缺乏维生素A的小鼠中,大量白血病细胞已转移至外周/全身血室(未测量)。
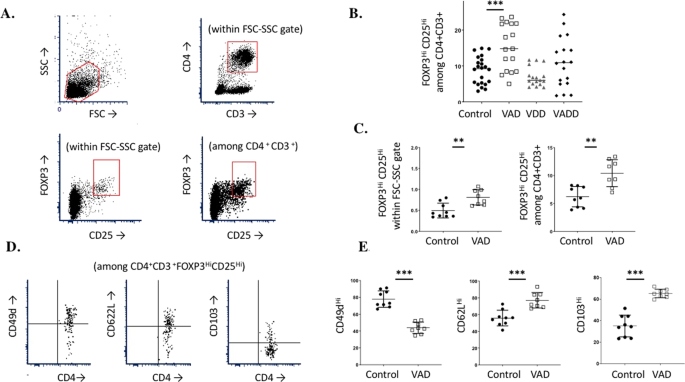
VAD和VADD小鼠中CD25 + FoxP3 + CD4 +细胞的频率增加
先前的研究23描述了叉头盒P3(FOXP3)阳性,CD4 +调节性T细胞(Treg)与BCR-ABL Arf -/- ALL生长之间的正相关。因此,我们使用流式细胞术来确定在牺牲时维生素A和D缺乏症如何影响测试动物脾细胞中的这些免疫细胞。 与VDD和对照小鼠相比,白血病VAD和VADD小鼠 中CD4 +脾细胞中CD25 + FoxP3 +细胞的频率明显更高(图 3)。,*** p <0.001)。为了确定高Treg频率是否是对肿瘤生长的反应,我们另外测试了非白血病VAD动物。再次,我们观察到 CD4 + 脾细胞中CD25 + FoxP3 +细胞的频率较高,并进一步将细胞表征为表达高CD103,高CD62L和低CD49d膜标志物。
VAD和VADD小鼠中增强的Treg。(A)显示了流量门控配置文件。使用FSC-SSC(左上方)选择淋巴细胞门,然后选通CD4 + CD3 +细胞(右上方)。在FSC-SSC门(左下)和CD4 + CD3 +门(右下)中识别出FoxP3 Hi CD25 Hi细胞。(乙)将脾细胞在处死在肿瘤研究的时间对于四个饮食组的分离,和Foxp3的百分比您好 CD25 您好 CD4中细胞+ CD3 +,测定细胞。(C通过两个联合实验测试了无肿瘤的对照组和VAD小鼠的FSC-SSC淋巴细胞门内(左)和CD4 + CD3 +细胞内(右)的FoxP3 Hi CD25 Hi细胞百分比。每个脾脏(在FSC-SSC门内)FoxP3 Hi CD25 Hi细胞的总数,对照动物平均为3.8×10 5,而VAD动物平均为5.7×10 5(未显示)。每个符号代表来自单独鼠标的结果。(D)显示了用于分析CD49 Hi细胞(左),CD62L Hi细胞(中心)和CD103 Hi的样品流程图天真小鼠CD4 + CD3 + FoxP3 Hi CD25 Hi细胞中的细胞(右)。(E)在两个组合实验中测试了无肿瘤的VAD和对照小鼠的CD4 + CD3 + FoxP3 Hi CD25 Hi群体中CD49 Hi细胞(左),CD62L Hi细胞(中心)和CD103 Hi细胞(右)的百分比。每个符号代表一只鼠标的结果。使用未配对的t检验比较结果(GraphPad Prism,**表示p <0.01,***表示p <0.001)。
与足够维生素D的小鼠相比,在较短时间间隔内缺乏维生素D的小鼠仍显示出BCR-ABL白血病的存活率增加
通过在怀孕和分娩期间将怀孕的雌性动物置于维生素A和D缺乏饮食上并在这些饮食中保持断奶幼仔,对所有维生素缺乏的小鼠进行了所有小鼠存活研究。尽管此饮食计划对于产生维生素A缺乏症的小鼠是必需的(请参见方法),但是因为我们可以在较短的时间内产生维生素D缺乏症,所以我们比较了维生素D充足的小鼠和通过放置VDD的小鼠之间BCR-ABL ALL的存活率在4周(断奶)时使用维生素D缺乏饮食,并在10周龄后使用它们。尽管维生素D缺乏症的持续时间较短,但VDD小鼠仍能从BCR-ABL Arf -/- ALL 存活更长的时间(补充图 S7))。我们无法从断奶VAD饮食执行与小鼠类似的研究,因为我们不能让小鼠缺乏维生素A在这短短的时间24,25。
仅当与骨髓基质细胞共培养时,1,25(OH)2 VD 3会增加BCR-ABL ALL细胞的数量
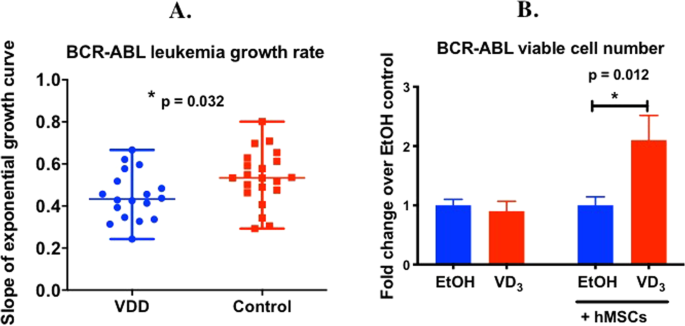
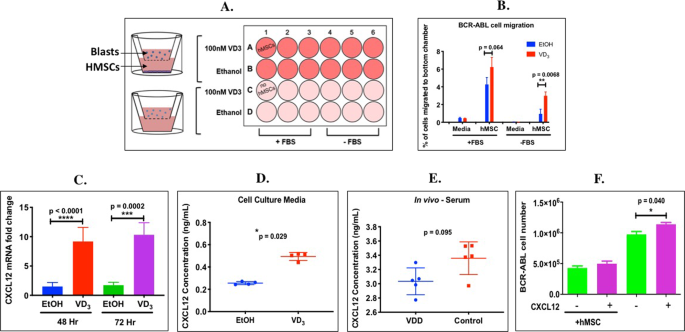
开始探索如何BCR-ABL ALL是维生素d足以与缺陷小鼠更迅速扩大的机制在体内(图 1 - 2,图4A),我们研究了1,25效果(OH)2 VD 3治疗上体外 BCR-ABL Arf -/-白血病细胞。因为像人类原代B-ALL细胞17一样,小鼠BCR-ABL + Arf -/-白血病细胞缺乏介导VD 3所需的维生素D受体(VDR)(补充图S8)。 由于白血病细胞在骨髓中增殖,因此BCR-ABL ALL细胞与永生化的人间充质基质细胞(hMSCs)共培养,该细胞表达模仿骨髓微环境的VDR。1,25(OH)2 VD 3对没有hMSC的存活BCR-ABL ALL细胞的数量没有影响(p = 0.5972);然而,当与hMSCs共培养时,1,25(OH)2 VD 3显着增加了BCR-ABL细胞的数量(2.102±0.415倍,p = 0.012)(图 4B)。该结果表明1,25(OH)2 VD 3通过基质起作用以增强BCR-ABL ALL细胞的生长。总的来说,该结果表明1,25(OH)2 VD3 在体外可提高BCR-ABL ALL细胞的数量,这需要与骨髓基质共培养。
增加BCR-ABL ALL迁移至1,25(OH)2 VD 3条件的 hMSC
由于与VDD小鼠相比,体内足够的维生素D小鼠(对照)显示出骨髓中ALL疾病负担增加(补充图 S6),因此我们接下来测试了这是否也反映了维生素D增加了白血病母细胞向白血病细胞的迁移。骨髓基质。使用体外细胞归巢测定法,其中我们测量了BCR-ABL白血病细胞从transwell培养的供体室通过半透膜迁移到装有培养基或hMSC(有或没有1,25)的底部室的百分比(OH)2 VD 3调节(图 5)。1,25(OH)2 VD 3没有作用在没有hMSC的情况下所有细胞的迁移。然而,显着更大百分比的BCR-ABL ALL细胞迁移到hMSCs中,该hMSCs用100 nM 1,25(OH)2 VD 3适应48小时(图 5B,** p = 0.0068)。胎牛血清(FBS)本身也可以为培养基提供BCR-ABL ALL迁移所需的因子,从而进一步提高了1,25(OH)2 VD 3的作用(p = 0.064)。该结果表明1,25(OH)2 VD 3增强BCR-ABL白血病细胞迁移的能力不是BCR-ABL blast固有的,而是归因于VD 3引发的hMSC重编程以吸引更多BCR-ABL ALL细胞。
1,25(OH)2 VD 3 BCR-ABL白血病细胞对骨髓基质和诱导的增加的迁移CXCL12 mRNA和hMSCs的蛋白质表达和小鼠的血清体内和CXCL12在悬浮培养中增加BCR-ABL ALL细胞的数量。(A)将hMSC培养在transwell培养皿的接收器隔室中,并用乙醇(载体)或1,25(OH)2 VD 3预处理48小时,每组n = 3。将BCR-ABL ALL LUC + 细胞添加至供体隔室并培养24小时。(B)BCR-ABL ALL Luc +总数的百分比 确定迁移至底部腔室的细胞与两个隔室中的细胞总数。(C)用100 nM 1,25(OH)2 VD 3处理的hMSC细胞中相对于乙醇(EtOH)对照(设置为1)的CXCL12(GAPDH标准化)mRNA转录水平的倍数变化,n = 8或10组。使用未配对的t检验确定两组之间的显着性(** p <0.01)。(D)用乙醇(EtOH)或100 nM 1,25(OH)2 VD 3处理的hMSC细胞的培养基中CXCL12蛋白表达,每组n = 4(E)VD 3血清中的CXCL12蛋白表达足够的(对照组)或VDD小鼠,每组n = 5。使用GraphPad上的Mann-Whitney非参数检验确定两组之间的显着性(**** p <0.0001,*** p <0.001,* p <0.05)。(F)CXCL12处理(48小时)对单独培养或与hMSC共培养的活BCR-ABL LUC细胞数量的影响,每组n = 3。未配对的t检验用于比较细胞数的变化(* p <0.05)。
1,25(OH)2 VD 3增加hMSCs 体外和体内小鼠血清中 CXCL12 mRNA和蛋白表达
CXCL12(基质细胞衍生因子-1,Sdf-1)是由基质细胞,CXCL12丰富的网状(CAR)细胞,内皮细胞和成骨细胞产生的趋化因子,在正常的B细胞淋巴细胞,细胞运输和归巢于骨髓26,它已显示出增加原发性B前ALL 27的增殖。与媒介物处理的细胞相比,在用1,25(OH)2 VD 3处理48或72 hr的hMSC中,CXCL12 mRNA(图 5C)表达更高(9.179±2.415倍(**** p <0.0001)和10.320±2.060倍(*** p = 0.0002)。同样地,将hMSC的细胞培养上清液用1,25(OH)2 VD 3调节72小时,与载体处理的对照相比,CXCL12的分泌增加了2倍(图 5D,* p = 0.029)。有朝向VD更高血清CXCL12蛋白水平趋势3足以与VD 3缺陷型小鼠(图 6C,p值= 0.095)。但是,我们没有发现在用1,25(OH)2 VD 3处理的BCR-ABL ALL细胞中CXCL12受体CXCR4的mRNA表达有差异(未显示)。因此,1,25(OH)2 VD 3重新编程骨髓基质以产生并分泌CXCL12以吸引白血病细胞。
CXCL12增加悬浮培养中BCR-ABL ALL细胞的数量
为了确定CXCL12是否可以直接影响BCR-ABL ALL细胞的数目,我们在悬浮培养中用CXCL12处理它们。由于VD 3刺激的hMSC细胞向培养基中分泌了0.5 ng / ml的CXCL12(图 5D),因此将悬浮培养或与hMSC共培养的BCR-ABL ALL细胞用0.5 ng / ml CXCL12处理48小时。在悬浮培养中,CXCL12的BCR-ABL ALL细胞数量显着增加(图 5F,* p = 0.04),但与hMSC共培养时,其数量没有进一步增加。这证明外源CXCL12可以直接刺激BCR-ABL白血病细胞的生长。
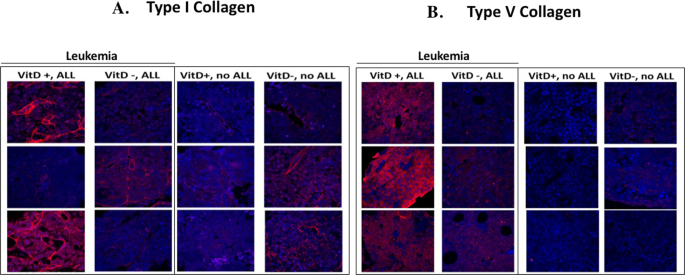
维生素D加ALL 在体内重新编程骨髓基质
越来越多的文献表明,VD 3在重塑基质中具有重要作用,进而可以影响癌症的生长和化学治疗反应28。同样,白血病在骨髓中的存在已显示将骨髓小生境转变为白血病允许的微环境29。为了测试维生素D是否能重塑骨髓细胞外基质的产生,对I型和V型胶原蛋白的免疫组化反应是在健康的维生素D充足和不足的小鼠的骨髓以及处死时获得BCR-ABL ALL的小鼠的骨髓上进行的。无论维生素D水平如何,健康小鼠的I型和V型胶原蛋白最低限度都可检测到,而VD 3的骨髓中I型和V型胶原蛋白却增加了足够的(不是VDD)小鼠具有ALL(图 6A,B)。因此,BCR-ABL ALL和维生素D的存在正在重新编程骨髓基质,以增加I型和V型胶原蛋白的产生。
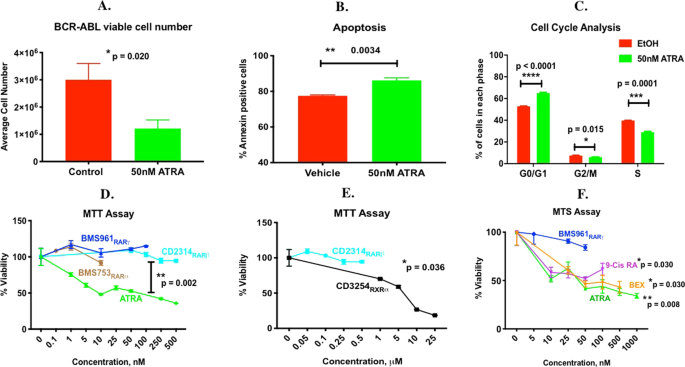
ATRA通过RXR发出信号,以减少BCR-ABL ALL存活细胞数
由于携带VAD的白血病雄性小鼠的存活率下降(图 1),但骨髓疾病负担较低(补充图 S6),尽管全身(外周)疾病水平较高(图 1),所以我们首先测试是否与或不与骨髓基质细胞一起培养时,ATRA处理均会影响存活白血病细胞的数量。ATRA减少了悬浮培养(图7A)或与hMSC(未显示)共培养的活BCR-ABL细胞的数量 ,因此ATRA直接调节BCR-ABL白血病细胞。随后对在悬浮培养中单独生长的BCR-ABL ALL细胞进行了研究。经ATRA处理的BCR-ABL ALL细胞显示出凋亡增加(图 7B),细胞周期中G 0 / G 1的细胞百分比增加,而S期的细胞百分比降低(图 7C)。为了帮助识别负责ATRA作用的核受体,对BCR-ABL ALL细胞进行了全视黄酸受体(RARs)和类视黄醇X受体(RXRs)或RARα,RARβ或RARγ或RXRα特异性激动剂的泛激动剂处理(表 1),并通过MTT和MTS分析确定了活细胞的数量。如果将ATRA转化为9-顺-视黄酸(一种RXR和RAR激动剂),则直接激活RAR,并间接激活RXR。BCR-ABL ALL细胞表达RAR和多种形式的RXR 21。在我们的研究中,ATRA似乎是利用RXR而不是RAR来影响活BCR-ABL ALL细胞的数目,因为RARα,RARβ和RARγ特异性激动剂都未能减少活白血病细胞的数目,而ATRA是9-顺式-RA,RXR泛激动剂贝沙罗汀和RXRα特异性激动剂有效且有效地减少了存活的BCR-ABL ALL细胞的数量(图 7D–F)。因此,饮食中的维生素A 在利用RXR 直接调节体内活的BCR-ABL ALL细胞的数量方面很重要。
维甲酸和RAR和RXR特异性激动剂对活BCR-ABL Arf -/- ALL细胞数量的影响。悬浮培养中BCR-ABL ALL细胞48小时ATRA或媒介物(对照)对(A)BCR-ABL ALL活细胞数的影响,每组n = 3 (B)凋亡(膜联蛋白V阳性)细胞的百分比,每组n = 3;(C)细胞周期每个阶段的细胞百分比,每组n = 3。(D–E)用各种剂量的(A)ATRA或RARα,β,γ特异性激动剂治疗48小时后,通过MTT或MTS分析测量的存活BCR-ABL白血病细胞数(E)RARβ与RXRα特异性激动剂或(F)ATRA,9-顺-视黄酸(9-Cis RA),贝沙罗汀(BEX)或RARγ特异性激动剂,每组n = 4。采用韦尔奇校正的不成对t检验,适当地确定图7A,B,D–F中的治疗之间的显着性(** p <0.01 * p <0.05)。
讨论区
尽管全世界范围内维生素A和/或D缺乏症的发生率很高,但这是第一个测试并证明宿主维生素A和D缺乏会影响BCR-ABL ALL Arf -/-白血病的生长和小鼠存活的研究从这种疾病。我们的研究发现,与维生素A足够的小鼠相比,维生素A缺乏的小鼠从BCR-ABL ALL显着加速了疾病进展并降低了存活率。令人惊讶的是,维生素D缺乏症具有相反的作用-减缓白血病的生长并延长其生存时间。
虽然最近的工作表明,治疗全反式维甲酸治疗BCR-ABL ALL的培养的细胞显著降低它们的生存能力,如果白血病细胞也有IKZF1 -mutated或Arf的无效合子等位基因21,现在还不清楚主机维生素A的缺乏是否有这样的不利BCR-ABL Arf对宿主存活的影响-/-白血病。ATRA对BCR-ABL ALL生存力的影响不需要与骨髓基质细胞共培养,但似乎是白血病细胞固有的,维生素A似乎通过RXR发出信号。然而,值得注意的是,维生素A缺乏症小鼠的全身白血病水平明显高于正常小鼠,而非骨髓或脾脏白血病(补充图 S1与图 S6)。这可能是由于在VAD小鼠骨髓的已知变化,包括在骨髓微环境的改变30以及细胞和代谢特征31,32。
使小鼠缺乏维生素A的困难性要求我们在分娩后将妊娠雌性在妊娠期间的VAD饮食中放置,并在断奶后继续使用相同VAD饮食的幼崽以成功生产六周大的VAD小鼠(请参见方法)。为了保持维生素缺乏症组之间的一致性,使用相同的方法生成两种维生素缺乏症的小鼠。由于维生素确实会影响小鼠的许多器官系统,因此怀孕期间这些维生素在这些系统上的不足可能会影响ALL结果。当母亲和后代的饮食中缺乏维生素A和D时,保护性反应可能会受到结构性障碍和适应性免疫的影响。33,34。此外,多项研究报道,维生素A缺乏症可能导致贫血和血清铁水平改变(在大鼠中) 35。尽管在未患病的维生素充足的代表性小鼠中血清铁水平(µg / dl)(161.3±18.27)与未患病的VDD(185.3±35.81),VAD(187.5±62.47)和VADD(132.80 + 64.31)并无差异。小鼠,我们不能排除妊娠期维生素缺乏对造血的影响。但是,无论小鼠在妊娠期间是否接受VDD饮食(图 1)或在断奶时开始饮食(补充图 S7),都可以观察到维生素D缺乏对BCR-ABL ALL存活的相似影响 。 ),证明该小鼠模型中维生素D水平对BCR-ABL白血病发生的影响在妊娠期间不需要维生素D缺乏症。
维生素A的缺乏似乎也对宿主适应性免疫反应产生消极影响,以根除BCR-ABL ALL。 与对照组相比,有和没有肿瘤的维生素A缺陷小鼠 在CD4 +脾细胞中表现出更高的Treg FoxP3 + CD25 +细胞。这些结果与Manlove 等人的研究一致。23这表明BCR-ABL白血病细胞逃脱抗白血病T细胞反应的一种机制是通过支持细胞转化为Treg表型。鉴于VAD小鼠的Treg频率已经比对照组高,因此可以看出VAD小鼠特别容易发生肿瘤逃逸。我们进一步确定与对照组相比,细胞显示出低CD49d,高CD103和高CD62L。低CD49d的调节性T细胞已具有最高抑制活性相关的36,37。CD103和CD62L各自归巢标记,在细胞运输和组织滞留器乐38,39,40。我们提出,VAD小鼠中Treg的归巢标记异常水平有助于维持脾脏和外周血中高Treg数量和抑制功能,从而进一步支持肿瘤的生长。我们的数据微调了维生素A驱动FoxP3 + Treg发育同时下调Th17细胞和免疫反应的普遍假设。与教条相反,肖等。发现,维生素A没有上调的Treg当小鼠免于炎症遭受实验性自身免疫性脑脊髓炎的模型41,和我们的实验室已经证明,VAD小鼠通过频繁的FoxP3特征+ CD25 + T细胞和减少的适应性免疫应答38,42,43,44。尽管已描述小鼠对维生素A缺乏引起的体重减轻具有抵抗力 25,但我们观察到,与富含维生素的小鼠相比,VAD和VADD小鼠在研究的第一天体重较低。这强调了VAD和VADD小鼠遭受多种维生素缺乏症的影响,包括那些影响免疫系统功能和修复的维生素 45。正如我们在白血病研究中观察到的那样,动物适应性免疫反应降低可能导致早期死亡。CD4 + CD3 +淋巴细胞中较高的Treg频率可能导致VAD和VADD小鼠的预后不良。
令人惊讶的是,宿主VD 3的充足性与缺乏性对宿主从BCR-ABL Arf -/- ALL的存活有害。重要的是,在悬浮培养中,1,25(OH)2 VD 3对白血病细胞的生长没有影响,但是需要与骨髓基质共培养。该结果与小鼠BCR-ABL + ALL Arf -/-白血病细胞中明显缺乏VDR 以及类似的在人原代B-ALL细胞中缺乏VDR一致17。我们的结果也提醒了很多研究,这些研究测试了化学物质对悬浮培养中没有骨髓基质细胞共培养的白血病细胞生长的影响,因为这些研究可能会错过重要的白血病细胞反应,而这种反应只出现在共培养环境。骨髓基质细胞是公知的,以形成一个微环境,不仅有利于对白血病细胞的生长,但也可以调节响应性的抗白血病疗法,如天冬酰胺酶和酪氨酸激酶抑制剂46,47。我们的研究结果将此范式扩展到1,25(OH)2 VD 3对BCR-ABL + ALL Arf -/-白血病细胞生长和迁移的影响。
1,25(OH)2 VD 3主动诱导骨髓基质在体外释放CXCL12 ,并在体内增加CXCL12血清水平,从而增强了将BCR-ABL + Arf -/- ALL 吸引至骨髓和支持细胞的能力它的增长。骨髓中其他产生CXCL12的细胞(但hMSC中不存在)也可能对1,25(OH)2 VD 3有反应并增加趋化因子CXCL12的产量。例如,已知血管周CAR细胞(丰富的CXCL12)会增加造血干细胞向血管周围生态位的归巢,并在这些位置活跃增殖,我们的初步数据表明,与维生素D相比,骨骼和骨髓CAR细胞的数量明显多于缺陷小鼠(K. Annu,未公开数据)。
在体内,在存在BCR-ABL + Arf -/-白血病的情况下,维生素D 也会重塑骨髓基质,诱导1型和V型胶原蛋白的表达。其他人报道说,骨髓网状蛋白和胶原纤维的增加与恶性疾病有关,并可能将白血病细胞锚定并捕获在骨髓中,从而为它们提供了更高的耐药性48。虽然这项研究探讨了通过共培养的骨髓基质细胞对1,25(OH)2 VD 3信号的相互作用,但体内骨髓中多种其他细胞类型也表达了VDR,包括成骨细胞。因此,体内维生素D可能通过VDR在骨骼和骨髓中其他细胞中发出信号,从而影响微环境并有差异地改变白血病细胞的生长和生存能力。
重要的是要确定维生素A和D水平显着影响体内小鼠BCR-ABL + Arf -/- ALL 的生长的发现是否可以扩展到其他小儿白血病亚型。此外,小鼠中的这些结果会转化为人类吗?有趣的是,一项针对测量新诊断为ALL的儿童的饮食中维生素D摄入量的儿童的研究发现,高风险ALL与标准风险ALL的患者维生素D摄入量存在显着差异。如果不能满足每日膳食量的维生素d是标准的风险与高风险的患者高,而患者谁见了维生素d的比例饮食要求是在高风险与标准风险的患者高49。显然,我们的发现表明,白血病患者在治疗过程中应同时测量维生素A和D的临床水平,以确定人类的维生素充足性与不同亚型白血病的存活率之间是否存在关联,以及是否补充维生素维生素缺乏症患者会影响急性淋巴细胞白血病的生存。
材料和方法
动物
C57BL / 6J,第4-5天发情怀孕的雌性小鼠(E4-5)从Jackson实验室(美国缅因州巴港)获得。将抵达圣裘德儿童研究医院(SJCRH)动物设施的动物置于Purina Mills(美国密苏里州圣路易斯,Purina Mills)的饮食中-两种饮食(目录号5W9M含有1.5 IU的维生素D和15 IU / g维生素A棕榈酸酯),VDD(目录号5W9X,包含0 IU维生素D和15 IU / g维生素A棕榈酸酯),VAD(目录号5WA2包含1.5 IU维生素D和0 IU / g维生素A棕榈酸酯)和VADD(目录号5WA5,包含0 IU维生素D和0 IU / g维生素A棕榈酸酯)用于存活和其他体内学习。从到达之时,整个怀孕期间和分娩后,都要对这些饮食进行孕期水坝维护。断奶时,将幼鼠维持在各自的饮食中。获得维生素A缺乏症小鼠的这一时间表的基本原理是因为多项研究表明,在小鼠体内造成维生素A缺乏症很困难。剥夺断奶小鼠的维生素A不会使小鼠维生素A缺乏,或者至少需要一年才能产生维生素A 24。小鼠承受长期维生素A剥夺的能力归因于断奶时最初大量储存的维生素A(来自分娩)25。从分娩后的E5天开始,在妊娠期间将怀孕的女性置于维生素A缺乏的饮食中,在断奶后继续进行相同的饮食会在50岁的6周成功产生维生素A缺乏症。因此,我们使用了这种策略,因为它可以确保测试动物在达到高龄之前就缺乏维生素A。此外,为了保持所有维生素缺乏和足够组之间的一致性,我们使用了相同的策略来生成维生素A和D缺乏小鼠。
但是,通过在断奶时将小鼠转变为缺乏维生素D的饮食,有可能在小鼠中引起维生素D缺乏。这样可以消除维生素D缺乏饮食对妊娠第5天采用VDD饮食的怀孕母亲的幼仔中任何其他系统的状态的任何潜在影响。因此,将一组单独的存活研究的小鼠置于断奶状态。 VDD饮食(Harlan目录号5A69,0 IU维生素D)和维生素D足以控制饮食(目录号5BV8,3.3 IU维生素D)。
常规从VDD组(从4周龄开始)中测量代表性小鼠的血清25-OH VD 3水平,以确定维生素D的状态。20–50 ng / mL的水平被认为足以满足维生素D的需求;维生素D不足12–20 ng / mL,维生素D不足12 ng / mL。血清被送到密歇根州立大学(美国密西根州兰辛市)进行25-OH-VD 3测试。对来自VAD和VADD组的代表性小鼠的血清进行视黄醇结合蛋白(RBP)(R&D Systems,小鼠RBP4 Quantikine ELISA试剂盒,目录号MRBP40)的水平(从6周龄开始)进行测试,以作为维生素A状态的指标。在所有测试的VAD和VADD小鼠中,RBP值均小于5,000 ng / mL。血清25-OH VD 3 在白血病存活研究的终点,还在小鼠中测量了RBP和RBP水平。
道德批准声明
小鼠的所有实验程序和饲养都遵循实验室动物护理评估和鉴定协会(AALAC)指南和机构动物护理与使用委员会(IACUC)批准的方案。所有方法均按照相关指南和规定进行。
白血病和骨髓基质细胞
带有荧光素酶(Luc +)或绿色荧光蛋白(GFP +)51标记的鼠BCR-ABL + Arf -/-细胞,由Charles Sherr博士(圣裘德儿童研究医院)创建,并由Mary Relling博士(St.裘德儿童研究医院)的培养如先前所述52。由端粒酶53无限增殖的人间充质基质细胞(hMSCs,骨髓基质)由Dario Campana博士创建,由Jun Yang博士(圣裘德儿童研究医院)提供,并按53所述进行培养。
BCR-ABL ALL疾病的产生和监测
在第0天,2,000 BCR-ABL Arf -/- Luc +将细胞经眼眶后注射到同基因的,无条件的6-10周龄的小鼠中,在笼子和组之间交替注射顺序。第一个实验是使用对照男性(M)(n = 17),VDD M(n = 23),VAD M(n = 31),VADD M(n = 27)和对照女性(F)(n = 14)进行的),VDD F(n = 14),VAD F(n = 28),VADD F(n = 31)小鼠。腹腔注射200 µL 100 mg / kg D-荧光素(Caliper Life Sciences,霍普金顿,马萨诸塞州)后,用异氟烷麻醉小鼠,并使用Xenogen IVIS-200(Caliper Life Sciences,霍普金顿,马萨诸塞州)获取图像。从注入白血病细胞后的第8天开始,从固定的感兴趣区域(ROI)获取生物发光信号(光子/秒),并每3-4天重复一次以监测疾病的进展。使用Living Image 3.1软件(Caliper Life Sciences)分析获取的图像。+ 疾病负担,由(光子/秒)从图像中整个动物总萤光素酶通量测量定量。小鼠的后遗症状态是根据后肢瘫痪,被子sc,嗜睡或无法获取食物或水而确定的。在安乐死之前的这个时间,采集血液用于分析胆固醇,甘油三酸酯,高密度脂蛋白(HDL)和低密度脂蛋白(LDL),白细胞数和血清中25-(OH)VD 3和RBP水平。收获脾脏。使用具有细胞培养基或RNAlater(ThermoFischer Scientific的Invitrogen,维尔纽斯,LT)的针头从股骨冲洗骨髓细胞。将细胞转移至1.5 mL Eppendorf管中并沉淀,将细胞沉淀重悬于100 µL PBS中,并转移至白色的透明底96孔板(Costar,Corning Inc.,Kennebunk,ME,美国)中,添加了100 µL Bright-Glo™(美国威斯康星州麦迪逊市的Promega)。为了将发光值转换为每孔BCR-ABL细胞的数量,使用了范围为3,000至200万的BCR-ABL细胞的标准曲线。使用BioTek Synergy™4杂交酶标仪测量发光。脾脏和后肢分别用10%福尔马林固定;24小时后,将组织转移至Cal-Rite(Thermo Scientific,匹兹堡,宾夕法尼亚州)至少48小时。将组织包埋在石蜡中,切成4 µm的切片,用苏木精和曙红染色。病理学家对载玻片进行了评估,以确定白血病负担的程度,以0-5的6分制对组织进行评分。重复整个实验,并将两项研究结合起来用于数据分析,总共包括对照M(n = 34),VDD M(n = 34),VAD M(n = 41),VADD M(n = 35)和对照组F(n = 27),VDD F(n = 25),VAD F(n = 36),VADD F(n = 38)小鼠。为了测量骨髓血管和小梁体积,使用具有20倍物镜的Aperio ScanScope(Aperio Technologies,Vista,CA)扫描载玻片。使用ImageScope软件进行测量。干phy端区域定义为始于物理点并在其远端1 mm处终止;概述该骨髓区域以获得总的睑裂区域。为了测量骨髓血管,在该区域内概述了所有血管腔(正弦曲线)。从这些测量结果中得出了两种数据,即血管面积百分比(um2血管腔/ um 2骨髓)和长度(um血管/ um 2骨髓)。对于小梁体积,所有小梁都在该区域内勾勒出轮廓,并以小梁面积百分比(um 2骨小梁/ um 2骨髓)计算输出。兽医病理学家(LJJ)使用5分制对患者的成骨细胞和破骨细胞数量以及白血病负担进行了半定量评估。
PCR检测BCR-ABL ALL细胞的性别
鼠BCR-ABL + Arf -/-细胞的性别是通过X和Y染色体特异性标记22的基因组DNA的PCR来确定的。用以下引物对扩增DNA:Sly / Xlr_F,5'-GATGATTTGAGTGGAAATGTGAGGTA-3';Sly / Xlr-R,5'-CTTATGTTTATAGGCATGCACCATGTA-3'和Zfy_F,5'-GAC TA GACATGTCTTAACATCTGTCC-3'和Zfy_R,5'-CC TA TTGC ATGGACTGCAGCTTATG-3'和扩增条件如22所述。
分析体内白血病的增长
从全身发光数据的变化分析了白血病负担随时间的变化。将每只小鼠的发光数据从第8天起用其基线发光值进行标准化。将基线上的发光倍数变化与天数作图,并假设其遵循指数增长方程,,其中,A是截距,B是指数增长曲线的斜率。使用基于Microsoft Excel的趋势线分析,通过拟合每只小鼠的发光倍数与天数的倍数变化来估算参数A和B。仅当r 2时,相关才被认为是可接受的 > 0.7。由于这些小鼠中没有可测量的白血病,因此将所有幸存者从分析中删除。其他过滤标准为:(1)发光倍数变化必须> 1,即发光量超过基线,(2)发光倍数变化与天数呈正相关,(3)至少必须三个数据点用于评估相关性;(4)由于将相同数量的白血病细胞注入小鼠体内,我们预期截距A不会有显着差异,因此从分析中删除了异常截距。过滤数据后,计算每只小鼠的个体斜率(B),并在各组之间进行比较,将数据表示为中位斜率±范围,并使用p <0.05的Mann-Whitney检验分析显着性。
BCR-ABL ALL活细胞数测定
将标记有萤光素酶的BCR-ABL细胞以每孔500个细胞的密度接种在24孔板上,并用1,25(OH)2 VD 3(50或100 nM)或乙醇(载体)处理,并将板孵育在37°C时8%CO 2。我们测试了1,25(OH)2 VD 3浓度范围对BCR-ABL ALL活细胞数量的影响,发现1–10 nM无效,但50–100 nM等效。选择100 nM 1,25(OH)2 VD 3进行实验的原因如下:首先,由于我们的1,25(OH)2 VD 3的持续时间研究通常为48小时(但长达96小时),并且在零时给药后维生素无法补充,并且1,25(OH)2 VD 3的半衰期为15小时,有效浓度保持为100 nM处理后48小时实验的结束时间估计为25 nM。在人类中,血浆中1,25(OH)2 VD 3的浓度为30 pg / ml(0.072 nM),但骨髓浓度则高出500倍(36 nM)35。或者,将细胞以125,000个细胞/ mL接种,并用ATRA(50nM)处理48小时。为了测量细胞数,将每个孔的全部内容物转移到1.5 mL Eppendorf管中,沉淀细胞,重悬于100 µL PBS中,然后转移到白色的透明底96孔板(Costar Corning Inc.,Kennebunk,加入美国ME)和100 µL Bright-Glo™(美国威斯康星州麦迪逊市Promega)。使用BioTek Synergy™4混合酶标仪读取发光。使用已知数量的Luc + BCR-ABL细胞一式三份制作标准曲线,然后通过插值法确定实验样品中BCR-ABL细胞的数量,并绘制平均细胞数/治疗组或维生素处理后维生素与维生素B的倍数差异的结果图车辆处理过的水井。
细胞周期分析
将悬浮培养物中的BCR-ABL-ALL-gfp细胞用DMSO和ATRA处理48小时,收获并用膜联蛋白/ DAPI(4',6-二dia基-2-苯基吲哚)染色。细胞用RNA酶(不含DNA酶)预处理,并悬浮在低渗碘化丙啶(PI)荧光染料溶液中,以定量染色CD45 +细胞的细胞核中的DNA 。通过直径为40μm的滤网过滤染色的细胞,以去除结块的细胞核,并通过荧光激活细胞分选术(FACS)进行分选。使用BD Biosciences FACSDIVA TM软件分析每个细胞周期阶段中的细胞百分比,即G 0 / G 1,S,G 2 / M。
细胞计数仪进行免疫细胞表型分析
流式细胞术是在肿瘤实验中处死小鼠时进行的(首次施用肿瘤细胞时,小鼠的年龄为6-10周),另外还对幼稚,无肿瘤的小鼠(年龄大于6个月)进行了流式细胞术。使用70μM细胞过滤器(Corning Falcon TM(美国北卡罗来纳州达勒姆)。沉淀细胞,并使用红细胞裂解缓冲液(Stem Cell 07850 Canada)裂解红细胞。使用Biorad TC20自动细胞计数器对脾细胞进行计数。在96孔圆底平板中每孔加入大约一百万个细胞并沉淀。轻弹药丸并涡旋以悬浮细胞。将抗体混合物以40μl/孔添加,在黑暗中在冰上孵育15分钟。每种抗体以1:100的稀释度用于膜标记物的染色。用染色洗涤缓冲液(SWB,具有1%胎牛血清[FCS]的磷酸盐缓冲盐水[PBS])洗涤板。对于随后的细胞内FOXP3染色,将细胞固定并用FOXP3染色缓冲液组(货号00-5523-00,eBioscience)透化。抗FOXP3抗体(以1:100稀释,将eBioscience)从缓冲液组中添加到Perm缓冲液中15分钟。洗涤细胞并将其悬浮在100μlSWB中进行分析。来自Biolegend或eBioscience的一种组合形式的污渍包括抗CD3(145-2C11,BV711,目录号100349),抗CD4(GK1.5,BV421,目录号100443),抗CD8(53.67,AF700,目录号100730) ),抗CD25(PC61,APC,目录号102012)和抗FOXP3(PCH101,PE,目录号12-4776-41)。用于研究幼稚小鼠脾细胞的其他混合物包括(但不限于)抗CD4(DAPI),抗CD8(APC Alexa 700),抗CD3(BV711),抗CD25(PE-Cy7),抗FOXP3(PE),抗CD62L(BV605),抗CD49d(PE-德克萨斯红)和抗CD103(FITC)。使用LSRFortessa X-20(BD Biosciences)和FCS Express软件分析细胞。来自Biolegend或eBioscience的一种组合形式的污渍包括抗CD3(145-2C11,BV711,目录号100349),抗CD4(GK1.5,BV421,目录号100443),抗CD8(53.67,AF700,目录号100730) ),抗CD25(PC61,APC,目录号102012)和抗FOXP3(PCH101,PE,目录号12-4776-41)。用于研究幼稚小鼠脾细胞的其他混合物包括(但不限于)抗CD4(DAPI),抗CD8(APC Alexa 700),抗CD3(BV711),抗CD25(PE-Cy7),抗FOXP3(PE),抗CD62L(BV605),抗CD49d(PE-德克萨斯红)和抗CD103(FITC)。使用LSRFortessa X-20(BD Biosciences)和FCS Express软件分析细胞。来自Biolegend或eBioscience的一种组合形式的污渍包括抗CD3(145-2C11,BV711,目录号100349),抗CD4(GK1.5,BV421,目录号100443),抗CD8(53.67,AF700,目录号100730) ),抗CD25(PC61,APC,目录号102012)和抗FOXP3(PCH101,PE,目录号12-4776-41)。用于研究幼稚小鼠脾细胞的其他混合物包括(但不限于)抗CD4(DAPI),抗CD8(APC Alexa 700),抗CD3(BV711),抗CD25(PE-Cy7),抗FOXP3(PE),抗CD62L(BV605),抗CD49d(PE-德克萨斯红)和抗CD103(FITC)。使用LSRFortessa X-20(BD Biosciences)和FCS Express软件分析细胞。用于研究幼稚小鼠脾细胞的其他混合物包括(但不限于)抗CD4(DAPI),抗CD8(APC Alexa 700),抗CD3(BV711),抗CD25(PE-Cy7),抗FOXP3(PE),抗CD62L(BV605),抗CD49d(PE-德克萨斯红)和抗CD103(FITC)。使用LSRFortessa X-20(BD Biosciences)和FCS Express软件分析细胞。用于研究幼稚小鼠脾细胞的其他混合物包括(但不限于)抗CD4(DAPI),抗CD8(APC Alexa 700),抗CD3(BV711),抗CD25(PE-Cy7),抗FOXP3(PE),抗CD62L(BV605),抗CD49d(PE-德克萨斯红)和抗CD103(FITC)。使用LSRFortessa X-20(BD Biosciences)和FCS Express软件分析细胞。
体外归巢测定
将hMSC(100,000 /孔)平板接种到24孔板的底部,并用乙醇溶媒或100 nM 1,25(OH)2 VD 3处理48小时,其中一半的孔/组用缺乏胎牛血清的培养基处理(FBS)。制备没有hMSC的相同的24孔板。然后将带有3 µm聚碳酸酯膜的6.5 mm Transwell渗透性支持物(美国明尼苏达州肯纳邦克的Costar Corning公司)添加到每个孔中,并在100 µL培养基中添加100 万个BCR-ABL荧光素酶(luc)+细胞供体区室并在8%CO 2下孵育24小时(图 3A))。然后用培养基洗涤每个transwell膜的底部以收集任何附着的细胞。使用细胞刮板除去孔中的所有细胞,将其沉淀并重悬于100 µL PBS和100 µL Bright-Glo™(Promega,麦迪逊,威斯康星州)中。BioTek Synergy™4混合酶标仪用于读取白色透明底96孔板(Costar,Corning Incorporated,Kennebunk,ME,美国)上的发光。3,000至2百万个BCR-ABL ALL luc +细胞的发光用于生成标准曲线,并从标准曲线内插接收器隔室中的BCR-ABL ALL相对细胞数,用于确定已经从供体迁移到接收室。
通过实时PCR定量mRNA
用载体或100 nM 1,25(OH)2 VD 3处理端粒酶53永生的人骨髓间充质干细胞(hMSC)汇合层持续48或72小时。使用Trizol(美国加利福尼亚州Ambion Life技术公司或美国加利福尼亚州Thermo Fisher Scientific公司)和Qiagen RNEasy清洁试剂盒(德国希尔登)提取RNA。使用ThermoScript™RT-PCR系统(Invitrogen ThermoFischer,CA,美国),使用500 ng RNA产生cDNA,然后将其稀释至60 µL的总体积。(F)5′-AGAACTGTTGGCAAGGTGACA-3′和(R)5′-CTGACATTCATATGGCTCTCATCAT-3′是用于扩增人CXCL12 /SDF-1α的引物。小鼠CXCL12 /SDF-1α为(F)5'–CAGTGACGGTAAACCAGTCAGC-3'和(R)5'–TGGCGATGTGGCTCTCG-3'。实时PCR样品在95°C下运行15分钟,然后在92个温度下进行30秒钟,60°C进行30秒,在68°C进行40分钟的循环1分钟,然后进行解离步骤。通过比较Ct方法由平均Ct值确定CXCL12 mRNA表达水平。
PCR检测VDR mRNA
通过PCR确定BCR-ABL ALL细胞和小鼠十二指肠和肾脏中小鼠VDR(mVDR)mRNA的表达,以及人LS180肠细胞和hMSC中人VDR(hVDR)mRNA的表达。使用以下引物对从cDNA扩增VDR和对照GAPDH mRNA:
mVDR-F,CTCCTCGATGCCCACCACAAGACCTACG;
mVDR-R,GTGGGGCAGCATGGAGAGCGGAGACAG;
hVDR-F,CGGCCGGACCAGAAGCCTTT;
hVDR-R,CGGGGCACGTTCCGGTCAAA;GAPDH-F,ACCACAGTCCATGCCATCAC;GAPDH-R,TCCACCACCCTGTTGCTGTA和Promega PCR预混液(目录编号M7505)。在95°C下持续2分钟后,通过在95°C下变性30秒,在60°C下退火30秒,在72°C下延伸30秒的循环来扩增mVDR和hVDR;并在72℃下延伸5分钟;保持4°C。将产物与6x DNA上染染料(Promega,WI,USA)混合,并在2%琼脂糖凝胶(用于SYBR Safe DNA凝胶染料)上于100 V电泳90分钟。使用Image Lab Software TM拍摄图像。
CXCL12 ELISA测定
根据制造商的协议,用于人类CXCL12 /SDF-1α的Quantikine ELISA试剂盒(R&D Systems,明尼阿波利斯,明尼苏达州)用于测定细胞培养基和小鼠血清。使用随附的对照生成标准曲线,并将其与阳性对照以及未知样品进行比较。在用乙醇或100 nm 1,25(OH)2 VD 3处理48小时后,未稀释的在6孔培养皿中的hMSCs的细胞培养基样品(n = 3)进行了测定。足够VD 3(对照)或VD 3的小鼠未稀释血清饮食不足(VDD组;每组n = 5)也用这种方法进行了测定。BioTek Synergy™4混合酶标仪用于测量450 nm和540 nm的荧光。用于比较的最终值是通过从450 nm的读数中减去540 nm的读数来确定的;此步骤旨在纠正印版中的光学缺陷。
免疫组织化学
VDD和对照小鼠灌入4%多聚甲醛,后肢固定在10%中性福尔马林缓冲液中,脱钙,包埋在石蜡中,切片( 4μm)并置于载玻片上进行染色。IHC抗体从Abcam获得,并在磷酸盐缓冲液中用0.3%Triton X-100(PBST)稀释。将含有小鼠胫骨或小鼠后肢的载玻片脱蜡,并使用Target Retrieval pH 6.0(Dako,Carpinteria CA,USA)在高压锅中恢复抗原15分钟。取出后,将载玻片用PBST冲洗,用3%过氧化氢处理,并用Background Sniper(Biocare Medical,Pacheco,CA,美国)封闭。将载玻片与一级特异性抗体(兔抗胶原蛋白I,ab34710(1:500)和兔抗胶原蛋白V(ab7046)(1:50)或适当的同型对照抗体在4°C孵育过夜,然后用PBST,并与二抗(Donkey anti-rabbit 568,ab10042)孵育2小时。TM,Eugene,OR,USA),并使其干燥过夜,然后观看。使用Marianas显微镜系统(Intelligent Imaging Innovations)获得图像(放大60倍)。
凋亡分析
将含有载体或50-100 nM ATRA的BCR-ABL Arf -/- GFP +细胞以125,000细胞/ mL的密度接种在6孔板中,并在37°C,8%CO 2下孵育48小时,然后转移到15 mL猎鹰管中,制成颗粒,并除去培养基。细胞沉淀用PBS洗涤两次,重悬于100μL的膜联蛋白-V结合缓冲液中,该缓冲液包含10μL膜联蛋白-V-APC(BD Bioscience,目录号550475)和10μLDAPI。然后将样品涡旋并在黑暗中于室温孵育15分钟。添加额外的150μL冷结合溶液,并通过40μm尼龙网过滤细胞,并置于冰上,直到使用FACS分析Annexin-V阳性细胞。按治疗组比较膜联蛋白-V阳性细胞的百分比。
活力测定
ATRA可以结合RARα,RARβ和RARγ,但在转化为9-顺式视黄酸后,ATRA只能结合RXRα。为了确定ATRA影响BCR-ABL细胞生存力的途径,我们用RARα(BMS753)特异性激动剂测试了白血病细胞的生存能力。RARβ(CD2314); RARγ(BMS961); 或RXRα(CD3254),或与pan-RXRα,β,γ,激动剂贝沙罗汀[targretin]或pan-RXR / RAR激动剂9-顺-视黄酸[Tocris Bioscience,布里斯托尔,英国](表 1)。将结果与使用ATRA的结果(美国密苏里州圣路易斯的Sigma-Aldrich Inc.)进行了比较。根据每种激动剂对其受体的已知亲和力(Kd)选择使用的浓度。6,250个荧光素酶标记的BCR-ABL Arf -/-将小鼠细胞以100 µL /孔的白色透明底96孔板(Costar Corning Inc.,肯纳邦克,ME,美国)与每种受体激动剂一起铺板,并在37°C,8%CO 2下孵育48小时。MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物)和MTS((3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2根据制造商的协议(Abcam,Cambridge,MA,USA),使用-(4-磺基苯基)-2H-四唑)测定法来测量代谢活性活细胞数,MTT和MTS测定法通过测量线粒体酶活性来测定细胞活力。线粒体功能的替代与反应产物的形成取决于代谢活性活细胞的数量,使用BioTek Synergy TM测量吸光度 4 Hybrid Microplate读板器,OD = 490 nm。
数据分析
产生Kaplan Meier曲线以比较各组之间的存活数据,并使用Gehan-Breslow-Wilcoxon检验确定显着性。韦尔奇t检验用于确定两组之间ROI均值的显着差异。使用GraphPad Prism版本5和7的Mann-Whitney非参数测试分析了血液,脾脏和骨髓的荧光素酶信号以及ELISA数据。使用1way ANOVA和Tukey多重比较测试对血液化学数据进行了分析。显着性计算为p <0.05,并使用GraphPad QuickCalcs上的Grubb检验确定离群值。
未配对的t检验用于确定其他用1,25(OH)2 VD 3或ATRA或溶媒处理的细胞的显着性。使用GraphPad Prism软件使用不配对t检验进行流式细胞术比较。
|
|