人体样本采集
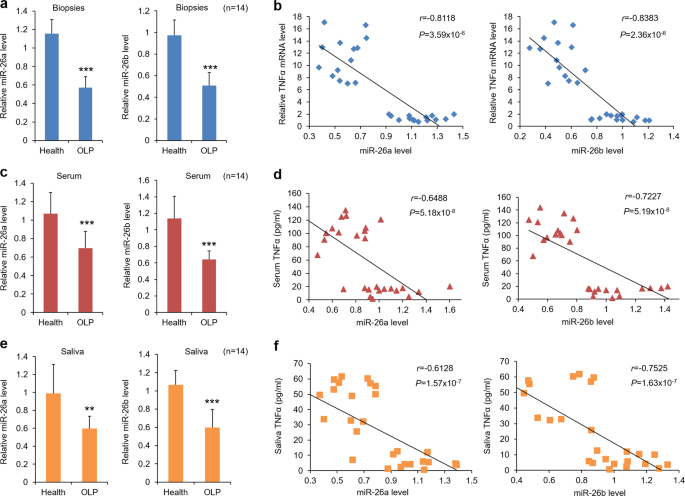
OLP患者和健康参与者均被纳入山西医科大学口腔医院。药物治疗前,采集口腔黏膜标本、血清和唾液进行实验检测。正常的健康样本是从接受保留智齿拔除,没有临床可见的口腔炎症的参与者中获取的。根据经修订的世界卫生组织诊断标准,确定了病人纳入和鉴别扁平苔藓的标准35,36。该项目得到了山西医科大学机构伦理委员会的批准,并得到了所有个人的同意。每组的人体样本数目为14份。健康对照者的临床参数载於补充表格内。1。在先前的研究中提供了更多的OLP患者的信息。6.
动物研究
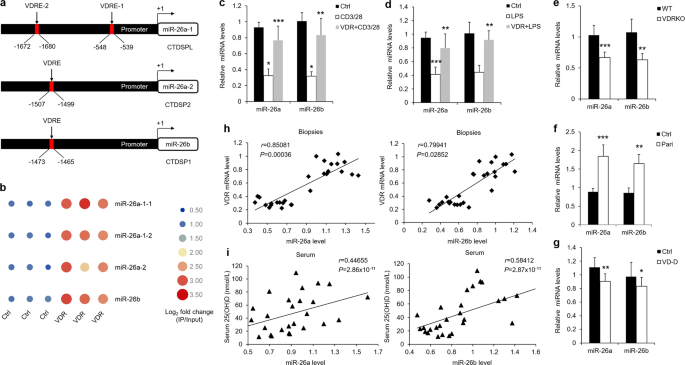
选用6~8周龄雄性C57BL/6小鼠作为研究对象。VDR-/-小鼠按报告策略生成。37。为建立维生素D缺乏模型,3周龄小鼠断奶后,饲喂维生素D缺乏(维生素D)。3 < 25IU/kg) or vitamin D normal (vitamin D3=1000 IU/kg(如前面所述,为期8周)38。这些老鼠被放置在一个黑暗的房间,以防止他们受到紫外线的照射。在体内给药过程中,用Invivofectamin2.0(Invitrogen,CAT:1377901)试剂盒,经尾静脉静脉注射20 mg/kg miRNAs寡核苷酸,连续2周。本次调查的动物部分得到了山西医科大学附属机构伦理委员会的批准。每组小鼠5只,年龄相近的小鼠随机分为不同组。在对数据进行分析之前,进行实验的人不知道具体样本的身份。
口腔粘膜上皮细胞分离
从人或动物口腔中分离出3 mm×3mm的口腔组织,并分离上皮层。6。简单地说,用0.25%的分散酶Ⅱ(Sigma-Aldrich)消化12 h,然后用肌肉钳直接分离上皮层。
细胞培养
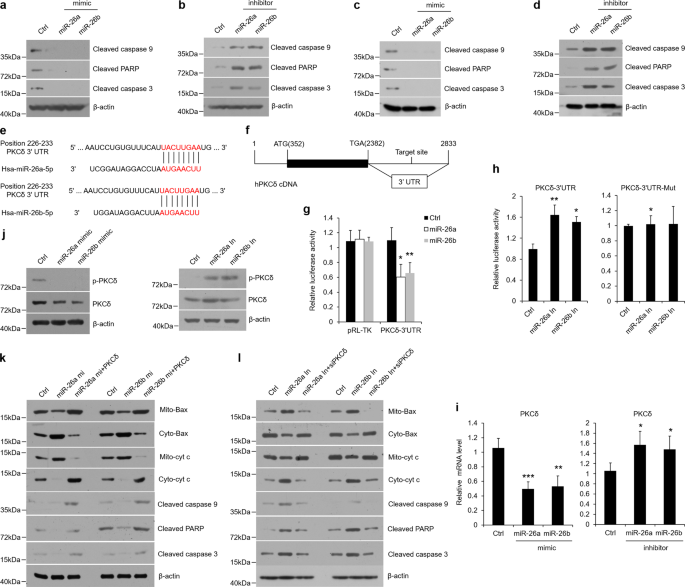
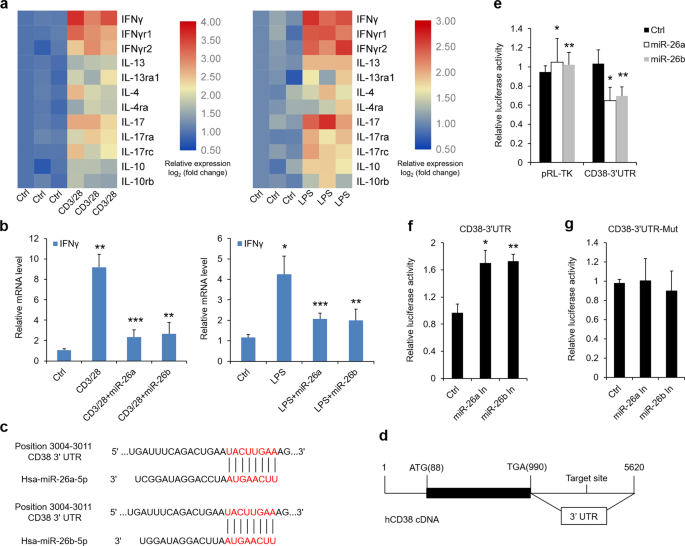
将人口腔角质形成细胞(HOK)(中国北京北方研究所)置于口腔角质形成细胞培养液(OKM,Sciencell,CAT:2611)中进行培养。对小鼠口腔角质形成细胞培养,将分离的上皮细胞切成小块,消化成胰蛋白酶(Invitrogen),得到单个角质形成细胞。39。用含1%两性霉素B(Sigma-Aldrich)的OKM洗涤和再悬浮后,将角质形成细胞置于重组人1型胶原(Sigma-Aldrich)包被的盘子中。加入培养基,每2天更换一次。第三代角质形成细胞已准备就绪。为了模拟OLP的体外微环境,我们分别建立了两种细胞模型。一种是用LPS(100 ng/ml,Sigma-Aldrich)处理口腔角质形成细胞24 h,以模拟感染所致olp的情况;另一种是用抗CD3/cd 28(bd生物科学)刺激的T细胞上清液以30%的终体积浓度加入细胞板,以模拟炎症所致olp的情况。6。T细胞的分离和刺激按照先前的报道进行。6。在剂量依赖性实验中,hk被LPS(100 ng/ml)或活化的CD4处理。+T细胞(30%终体积浓度)分别作用0、4、8、16、24h。在一些实验中,在36-h vdr质粒转染后(4g),12-h1,25 vd(20 nm,Sigma-aldrich)或12 h pkcδ/cd 38抑制剂(20 nm,medChemExpress)预处理后,hks被LPS或活化的cd4刺激。+用miR-26a/b模拟物或抑制剂(200 NM)转染口腔角质形成细胞36h后,再转染LPS或活化的CD4。+T细胞产生处理。所有实验重复三次。
质粒构建
VDR质粒由李燕春博士提供。针对pkcδ或CD 38质粒的构建,根据前人的研究,将人pkc基因的编码序列克隆到pcDNA3.1载体中。40,41。为了构建荧光素酶报告质粒,我们合成了pkcδ或cd38cDNA 3‘UTR片段中包含miR-26a/b预测靶位点的50 bp序列,并按照已发表的方法将其亚克隆到prl-tk载体中。42。50 bp序列和突变也被使用。插入的序列如下:
AGGGAAATTGTAAATCCTGTGTTTCATTACTTGAATGTAGTTATCTATTG(PKCδ);AGGGAAATTGTAAATCCTGTGTTTCATCGACCTGGTGTAGTTATCTATTG(PKCδ突变);TTGATTTCAGACTGAATACTTGAAAGGACACACACACACATACGTAAGTG(CD 38);TTGATTTCAGACTGAACGACCTGGAGGACACACACACACATACGTAAGTG(CD 38突变)。
转染试验
利用脂质体2000(Invitrogen)将微RNA寡核苷酸(200 NM)、siRNA寡核苷酸(40 M)和质粒(4g)瞬时转染口腔角质形成细胞。miRNA-26a/b模拟物、miR-26a/b抑制剂和阴性对照者从(Thermo Fisher Science)购买。hVDR-siRNA序列为5‘-CCCCUGGCUGAUCU UGUCAGUUA-3’和5‘-AAUGCUUCACAUAGCAUCC-3’;hPKCδsiRNA序列为5‘-CCAUGUUUAUCGCCACC-3’,hCD 38 siRNA序列为5‘-UUGGCAGCUUCUGUCUUCUCAUCUC-3’。18,40,41.
荧光素酶分析
将PRL-TK-3‘UTR质粒或对照载体转染HOKs 36h,转染后收集细胞裂解物,用双荧光素酶报告系统(Promega,CAT:E 1910)检测荧光素酶活性。
TUNEL和免疫染色试验
TUNEL染色如前面所述进行了调整。6。用10%福尔马林固定口腔组织,然后包埋切开。根据“原位细胞死亡检测试剂盒”(Roche LifeScience,CAT:12156792910)对4微米切片进行处理。免疫染色用抗磷脂蛋白激酶Cδ或抗CD 38抗体在冷室过夜,然后用二次抗体和二氨基联苯胺处理。用显微镜系统观察玻片。
ELISA法
在第1天采集的人血样本被放置在4°C过夜。分离后第2天,血清保存25-羟基维生素D检测使用免疫诊断系统的特殊试剂盒后,手册。用EBioscience ELISA试剂盒检测血清和唾液中肿瘤坏死因子α的浓度。用微板系统测定OD值。
WESTERNBLOTTING
Westernblotting试验是在先前的研究之后进行的。43。细胞和组织用laemmli缓冲液溶解和超声处理。用8%-12%SDS-PAGE对蛋白质进行负载分离,然后转移到PVDF膜上.经1-h5%BSA阻断缓冲液处理后,在4°C下,隔夜与一系列初级抗体共同孵育,然后在25°C下孵育1小时,VDR(Cat:SC-13133)、CD 38(Cat:SC-374650)和β-actin(Cat:SC-47778)抗体分别来自圣克鲁兹。CTDSPL(Cat:17532-1-AP)和CTDSP 1(Cat:10952-1-AP)抗体来自蛋白质技术.CTDSP 2(Cat:ab97463)和PKCδ(Cat:ab182126)来自ABCAM。磷脂激酶Cδ(Tyr 311,CAT:2055),caspase 3(Cat:9664),Caspase 9(Cat:9505,9509)和切割PARP(Cat:5625,94885)均来自细胞信号转导。细胞色素c(CAT:MA5-11674)和bax(猫:MA5-14003)抗体来自Invitrogen。用ECL westernblot底物检测印迹。选择ΒETA-actin作为加载对照.
共免疫沉淀
用免疫沉淀裂解缓冲液收集口腔角质形成细胞裂解液,用抗PKCδ抗体进行免疫沉淀。用凝胶电泳法对所得沉淀进行分析。
细胞分馏
Bax和细胞色素c经转位检测,将口腔角质形成细胞分为胞浆和膜结合的细胞器组分,进行免疫印迹分析。在RT条件下,细胞在含0.05%洋地黄素的等渗缓冲液中孵育2 min.将混合物中的可溶部分保存为胞浆组分,再将残留的不溶性物质溶于2%SDS中,收集膜结合有机组分。
RNA的提取与实时PCR
分别用Trizol试剂(Invitrogen,CAT:15596026)和miRNA分离试剂盒(QIAGEN,CAT:217004)从HOKs或参与者中分离出总RNA或miRNAs。分别用PrimeScript RT试剂试剂盒(Takara,CAT:RR037B)或特异性miRNA第一链cDNA合成试剂盒(Aidlab生物技术,CAT:PC 4801)进行mRNA或miRNA的第一链cDNA合成。实时PCRS用SYBR预混快递试剂盒(Takara,CAT:RR420L)或miRNA实时PCR检测试剂盒(Aidlab BioTechnologies,CAT:PC 4901)完成。mRNAs转录本的相对量用该方法计算。-ΔΔCT公式。以GADPH和U6为内对照,分别进行mRNA检测和miRNA检测。循环miRNA样品,在提取miRNA前加入相同量的外源细胞-miR-39,作为正常化。PCR引物在补充表中显示2.
caspase-3活性测定
caspase-3活性的测定如前所述。6。将口腔角质形成细胞用溶解缓冲液溶解10 min。离心后取上清液作为细胞裂解液。用caspase底物ac-DEVD-AFC(Bio Vision)检测裂解液的caspase-3活性,并在X 360/EM 530平板阅读器上进行分析。
染色质免疫沉淀(芯片)试验
芯片按照前面描述的方式执行,并作了一些修改。42,43。转染VDR或对照质粒后,用1%甲醛固定HOKs,用甘氨酸中和。收集细胞裂解液,经超声剪切层析,得到400~500 bp的片段。40微米剪切样品作为输入。其余样品用BSA和蛋白A琼脂糖珠纯化2h,加入4微克的VDR或对照IgG抗体,结合和拉出碎裂的染色质。经过一夜孵化后,蛋白A琼脂糖珠被处理以沉淀抗体。沉淀和剪切后的DNA样品用一组洗涤液洗脱纯化,然后用实时PCR对IP和输入样品进行定量。作为内部控制的输入。补充表中提供了实时PCR的引物。2.
生物信息学分析
TargetScan数据库(http://www.targetscan.org/)对miR-26a/b.ucsc数据库(https://genome.ucsc.edu/cgi-bin/选择hgGateway)搜索启动子区域进行结合位点分析。
统计分析
数据以均值±SD表示。这些差异在统计学比较的各组间是相似的。这些数据符合测试的假设。学生的t两组差异分析采用方差分析,多组间差异有显着性。邓恩的多重比较用于单因素方差分析,费舍尔的最小显着性差异是双向方差。P < 0.05 was considered to be significant.