在临床相关的小鼠模型中进行3型进行性家族性肝内胆汁淤积的基因治疗
在临床相关的小鼠模型中进行3型进行性家族性肝内胆汁淤积的基因治疗
摘要
进行性家族性肝内胆汁淤积症3型(PFIC3)是一种罕见的单基因疾病,由ABCB4基因突变引起,导致胆汁磷脂酰胆碱减少。胆汁磷脂酰胆碱的减少不能抵消胆汁盐的去污作用,从而导致胆汁淤积,胆管炎,肝硬化并最终导致肝衰竭。在这里,我们报告了用表达人ABCB4的AAV载体治疗两周或五周大的Abcb4 -/-小鼠的结果,导致PFIC3疾病生物标记物显着减少。所有雄性小鼠在整个12周内都达到了持续的治疗效果,但只有50%的雌性达到了这种效果。但是,两周大的女性在三周后接受第二次接种仍保持了治疗效果。处死后,PFIC3疾病的标志物,例如肝脾肿大,胆汁磷脂酰胆碱和肝脏组织学得到了明显改善。因此,AAV介导的基因治疗成功地在临床相关的小鼠模型中预防了PFIC3症状,代表了在改善PFIC3患者潜在治疗选择方面的进步。
介绍
进行性家族性肝内胆汁淤积症(PFIC)描述了遗传性疾病的遗传异质性组,其中几种类型是由参与胆汁产生和调节的少数转运蛋白的异常引起的,这些异常大多数在肝细胞的小管膜中表达1。在PFIC 3型(PFIC3或与PFIC相关的MDR3缺乏)的情况下,突变会影响ABCB4基因,该基因编码多药抗性蛋白3(MDR3),这是一种磷脂酶,参与磷脂酰胆碱(PC)从肝细胞膜的移位到胆汁。PC是胆汁的重要成分,与胆汁盐和胆固醇2形成混合胶束是必需的。在没有PC的情况下,胆汁具有去污剂的特性,并且对肝细胞和胆管细胞的膜具有很大的毒性,从而导致胆管小管和上皮损伤,从而导致胆汁淤积,肝硬化,最终导致肝衰竭3。此外,胆汁中磷脂含量低通常会导致胆固醇结晶,导致胆管阻塞。
PFIC3是一种罕见的常染色体隐性遗传疾病,在全世界约100,000人中有1人受到影响4。在PFIC3患者中已鉴定出ABCB4的 30多种不同的突变,其中三分之一的突变导致MDR3蛋白被截短的表达。由于突变可以许多不同方式改变MDR3的功能,因此PFIC3患者的表型表现出高度的变异性。胆汁淤积的迹象通常在生命的第一年出现,尽管有时直到儿童晚期甚至成年初期才被发现4。通常,患者的血清胆汁盐和转氨酶水平高,中度瘙痒。PFIC3患者的护理标准是基于熊去氧胆酸(UDCA)的,这是一种亲水性胆汁盐,可以代替肝脏中更具毒性的疏水性胆汁盐5。但是,只有约50%的患者受益于UDCA治疗,而肝移植是唯一的治疗方法。考虑到肝移植固有的风险和高昂的成本,迫切需要针对PFIC3患者的新疗法。例如,基于基因校正或补充的基因治疗方法可以为PFIC3患者提供确定的治疗方法。基因治疗正日益显示出其作为一种创新且安全的治疗方法的价值。事实上,基于使用腺相关病毒载体(AAV的)的基因治疗最近已显示对几种遗传疾病,如B型血友病提供安全的长期校正6,7和勒伯尔先天性黑蒙8。
其中用于PFIC3小鼠模型ABCB4基因被消除它的两个第一外显子的破坏已经描述9。这些小鼠完全缺乏MDR2的表达(人类MDR3的小鼠直系同源物),并且无法将PC分泌到胆汁中。这会导致症状重现人类PFIC3的大多数生物标志物和病理迹象,包括肝脾肿大和肝纤维化,尽管该疾病的严重程度和进展取决于小鼠品系10。
在本研究中,我们已经开发了一种基于AAV8载体的PFIC3治疗策略,该载体设计用于自发进展为严重胆汁性纤维化的Abcb4 -/-小鼠品系中的肝特异性人MDR3表达11。这种疗法能够提高胆道PC水平,从而使所有血清生物标志物正常化,完全预防肝纤维化,并长期纠正所治疗小鼠的疾病。
结果
选择MDR3变体
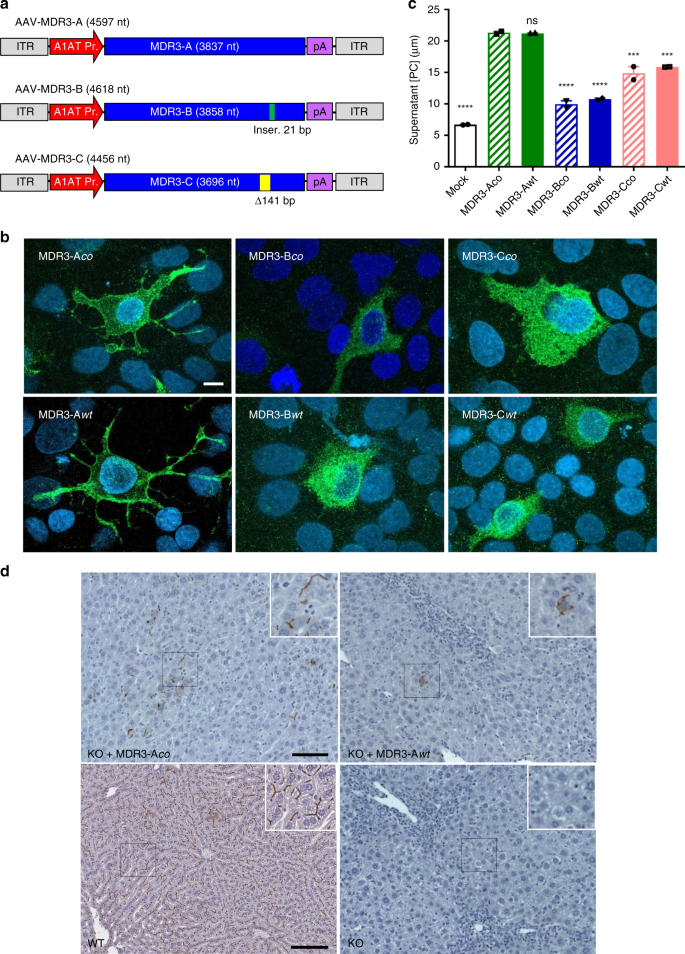
由于已经确定了人类MDR3(A,B和C)12的三种潜在同工型,因此我们首先在体外测试了每种同工型的表达。同工型B与同工型A不同,这是由于在核苷酸结合结构域2附近插入了七个氨基酸,而同工型C具有47个氨基酸的缺失,其中包括跨膜结构域11(图 1a)。我们生成了AAV表达质粒,其包含在肝脏特异性α-1抗胰蛋白酶(A1AT)启动子的转录控制下的人MDR3-A,-B或-C cDNA的野生型(wt)或密码子优化的(co)版本。 (图 1a)。将这些质粒瞬时转染到人肝细胞系HuH-7中,以分析和比较六种变体的表达及其将PC从细胞质转移到细胞外层的能力(脂酶活性)。利用免疫荧光和共聚焦显微镜,对MDR3表达染色呈阳性的细胞显示只有同工型A(wt和co)位于细胞膜上(图 1b)。)。同时,同工型B和C仅在细胞质中表达,表明这两个变异体最有可能在PC跨细胞膜转运时不起作用。对来自转染细胞的上清液中的PC浓度进行定量时,检测到了絮凝酶活性的差异,发现MDR3同工型A的活性分别比同工型B和C高四倍和1.6倍(图 1c)。对于三种同工型中的任一种,wt和co形式之间均未观察到差异。
a在av-1抗胰蛋白酶启动子(A1AT Pr。)下游表达MDR3亚型A–C的AAV载体图。标出了分别存在于同工型B和C中的插入(Inser。)和缺失(Δ)。ITR,AAV反向终端重复;pA,合成的聚腺苷酸化信号。b MDR3在体外表达。用含有所示MDR3同工型的AAV质粒转染HuH-7细胞,并在48小时通过共聚焦免疫荧光与针对MDR3的抗体进行分析。对于MDR3-Aco和MDR3-Awt,图像对应于MDR3阳性细胞的代表性序列平面,显示清晰的膜定位表达。对于亚型MDR3-B和C,图像显示所有平面的组合,因为在任何平面上均未观察到膜染色。细胞核用DAPI染色。比例尺= 10μm。c MDR3体外活性。通过荧光测定法定量转染AAV质粒的细胞上清液中的PC浓度。用表达GFP的质粒转染的细胞用作阴性对照(模拟物)。通过qPCR用特异于A1AT启动子的引物验证了等效的转染效率。各个条上方的标签表示相对于MDR3-Aco的显着性(单向ANOVA / Tukey多重比较检验):ns,不显着,***,p <0.001;****,p <0.0001。数据表示为平均值±标准差(SD)。F值和自由度(分子,分母):F(6,7)= 151.1。源数据作为源数据文件提供。d体内MDR3表达。用具有指示的MDR3-A基因变体的AAV质粒对Abcb4 -/-小鼠(KO)进行HDI注射,并在24小时后通过IHC和抗MDR3特异性抗体对MDR3表达进行分析。Abcb4 + / +(WT)和未治疗的KO小鼠分别用作阳性和阴性对照。显示了每组中一只鼠标的代表图片。比例尺= 100μm。
通过Abcb4 -/-小鼠水动力注射肝脏表达
为了在体内测试MDR3的表达,通过流体动力注射在7周大的雄性Abcb4 -//小鼠中测试了具有MDR3-Aco和-Awt变体的质粒。24小时后处死动物,并通过免疫组织化学(IHC)分析肝脏切片中MDR3的表达。接种了pAAV-MDR3-Aco的两只小鼠显示出清晰的MDR3表达。特别是,一只小鼠在整个肝组织的离散口袋中显示了MDR3表达(图 1d),MDR3明显位于肝细胞的小管膜上。相比之下,pAAV-MDR3-Awt注射仅导致一只动物显示MDR3表达,可以从整个样品中的单个细胞周围检测到它(图 1d)。这些结果表明,MDR3-Aco序列可以比MDR3-Awt在体内更有效地表达。
AAV-MDR3诱导的PFIC3肝生物标志物正常化
所述ABCB4 - / - FVB小鼠模型已经显示出能够可靠地复制几个PFIC3相关标记物,如血清肝转氨酶升高,碱性磷酸酶(ALP),胆汁盐,和胆红素; 肝脏和脾脏增大;胆汁中PC浓度降低;和严重的肝脏形态异常,如纤维化,胶原蛋白沉积和细胞浸润9。这些小鼠的症状发作非常早,至少在11岁4周之前。
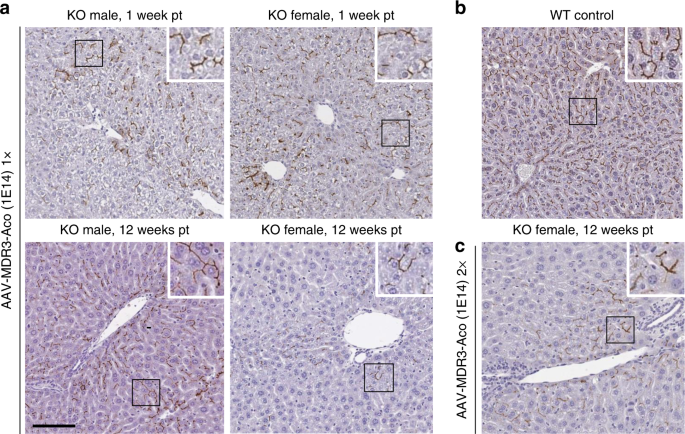
我们首先测试了带有密码子优化的MDR3同工型A cDNA(AAV-MDR3-Aco)的AAV8载体在Abcb4 -/-小鼠肝脏中建立转基因表达的能力。通过以1×10 14病毒基因组(VG)/ kg 剂量的AAV-MDR3-Aco静脉内(IV)注射治疗的两周龄小鼠在治疗后1周显示出强劲的肝MDR3表达。IHC对MDR3的染色显示了在整个肝脏中的弥散表达,该表达明显位于胆管小管中(图 2a,上图),平均占Abcb4 + / +(WT)动物中MDR2染色水平的62±13%。治疗十二周后,仍在胆管小管中检测到表达(图 2a),较低的图像)。然而,雄性WT小鼠的表达水平下降至31±9.7%,雌性则下降至8.5±0.5%(补充图 1)。
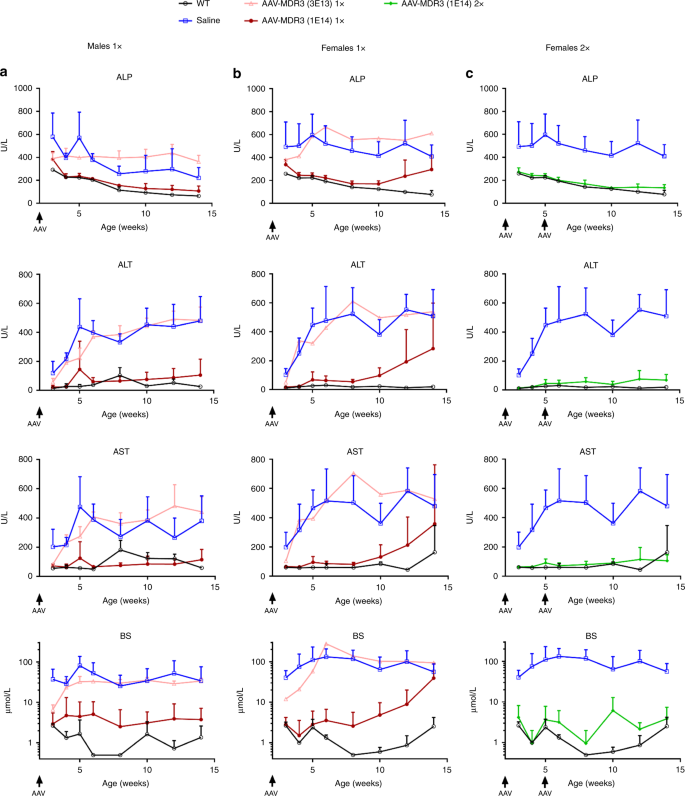
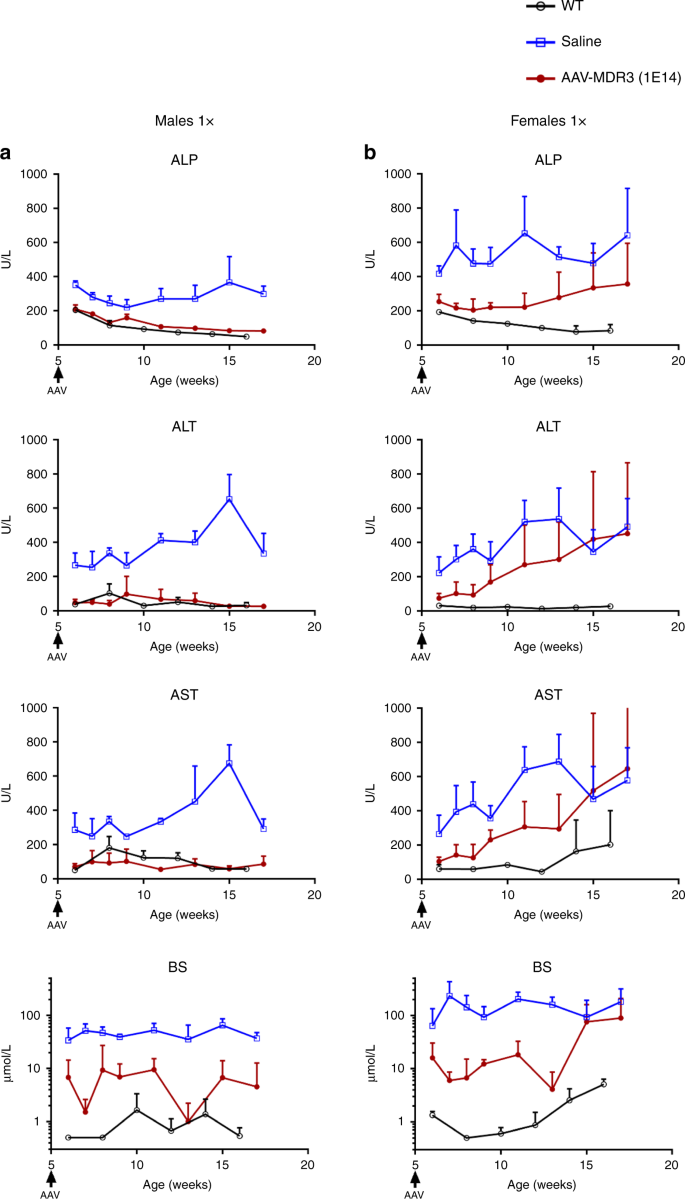
为了测试AAV载体的治疗效果,我们首先通过静脉注射3×10 13 VG / kg(低)的AAV-MDR3-Aco来治疗2周龄的雄性和雌性Abcb4 -/-小鼠在接下来的12周中,监测血清中的PFIC3生物标志物为1×10 14 VG / kg(高)。高剂量治疗的雄性小鼠在12周内达到了持续的治疗效果,因为所用的ALP,丙氨酸转氨酶(ALT),天冬氨酸转氨酶(AST)和胆汁盐水平均显着降低至与野生型小鼠相似的水平。作为控件。相比之下,盐水处理的小鼠和低AAV剂量处理的小鼠均未显示出这些生物标记物的显着降低(图 3a)。)。在接受高剂量的雌性动物中,也观察到了治疗效果,在100%的动物中持续了6周。然而,从治疗后的第8周开始,随着血清肝生物标志物水平的升高,所治疗的女性中有一半的治疗效果逐渐减弱(图 3b)。另一半女性在整个12周内维持较低的生物标志物水平。
AAV的治疗效果在以3×10 13 VG / kg的AAV-MDR3-Aco处理过的雄性(a)和雌性(b&c)中显示了一次(1次,粉红色,空心三角形;n = 3 M(男性)/ 1 F(女性)),每次1×10 14 VG / kg(1×,红色,实心圆圈; n = 7 M / 6 F),或1×10 14 VG / kg 使用生理盐水处理过的小鼠(蓝色,空心正方形;n = 4 M / 8 F)和未经处理的Abcb4 + / +(WT)小鼠(黑色,开放)两次(2次,绿色,实心菱形;n = 5 F)作为对照圈; ñ = 3 M / 3 F)。数据表示为平均值+ SD。ALP碱性磷酸酶,ALT丙氨酸转氨酶,AST天冬氨酸转氨酶,BS胆汁盐。源数据作为源数据文件提供。
为了提高该疗法的疗效,我们进行了第二项研究,在该研究中,Abcb4 -/-小鼠在2周龄时接受了AAV-MDR3-Aco高剂量治疗,并于3周后(在5周龄)。在这种情况下,雄性Abcb4 -/-再次显示出与野生型小鼠相似的血清肝生物标志物值(补充图 2),两次治疗的雌性Abcb4 -/-在整个12周随访中也显示出持续的治疗作用(图 3c)。
胆汁PC的增加和肝病理的预防
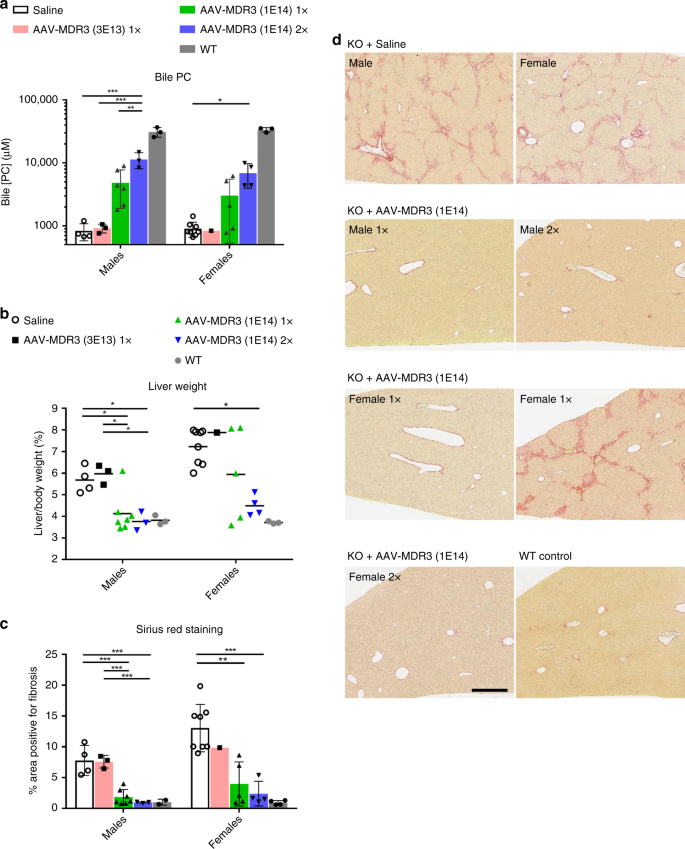
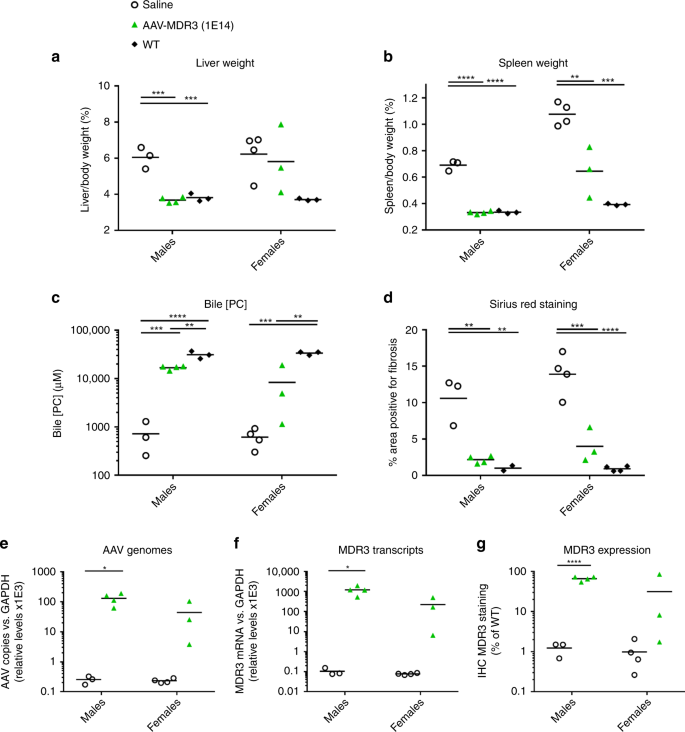
我们假设,AAV-MDR3-Aco处理的Abcb4 -//小鼠的血清PFIC3生物标志物的改善最可能是由于PC分泌恢复为胆汁,这是由肝细胞中MDR3的表达和胆汁细胞膜的定位介导的。小管。为了评估是否是这种情况,处死后从胆囊中收获处理小鼠的胆汁,并测量PC浓度。与盐水处理或低剂量处理的动物相比,高剂量AAV-MDR3-Aco处理的Abcb4 -//小鼠胆汁中PC水平升高。此外,用高剂量两次(2x)处理过的动物胆汁中的PC平均水平要比仅一次(1x)处理过的动物高2倍(图4a)。 )。但是,低载体剂量对PC水平没有影响。
处死时,对接受AAV-MDR3-Aco 3×10 13 VG / kg 1× 处理的Abcb4 -/-小鼠,测量胆汁中PC浓度(a)和肝脏重量占体重的百分比(b)。(粉红色或黑色正方形; n = 3 M / 1 F),1×10 14 VG / kg 1×(绿色条或绿色三角形; n = 7 M / 5 F),或1×10 14 VG / kg 2×(蓝色条形或蓝色倒三角形;n = 3 M / 4 F),以及盐水处理的对照组(白色条形或空心圆圈;n = 4 M / 8 F)和未治疗的WT小鼠(灰色条形或灰色圆圈;n = 3 M / 3 F)。肝切片用picrosirius红色染色以指示纤维化(d),并定量红色染色的组织量(c)。示出了每组中一只小鼠的代表性图片,除了以1×10 14 VG / kg 进行1x处理的雌性,分别显示了响应者组(左图)和非响应者组(右图)的一只动物。比例尺= 500μm。统计量(单向方差分析/ Tukey多重比较检验):*,p <0.05;**,p <0.01;***,p <0.001;数据表示为平均值±SD;˚F值和自由度(分子,分母):一个男性:˚F(3,12)= 14.52,女性:F(3,15)= 4.58;b男性:F(3,13)= 8.548,女性:F(3,14)= 4.501;c男性:F(3,13)= 23.13,女性:F(3,14)= 11.58。源数据作为源数据文件提供。
我们还观察到了其他PFIC3症状的改善。在高剂量治疗的动物(1x和2x)中,肝脏和脾脏的大小减小了,这是因为2x雌性以及1x和2x雄性的肝体重比达到WT值附近(图 4b和补充图 3)。除了在盐水处理的Abcb4 -//小鼠中肝脏的大小和刚度大大增加外,组织学分析还显示出肝脏损害的严重程度,包括纤维化和细胞浸润。与其他疾病标记一样,在高剂量AAV处理的Abcb4 -/-中,胶原蛋白染色的程度显着降低至几乎完全消除雄性(1x和2x)和2x雌性中的小鼠,表明纤维化几乎完全丧失(图 4c,d)。在1x雌性中,50%的动物显示出纤维化的明显减少,而在其余动物中,纤维化的程度与盐水处理的小鼠相似(在图 4d中,分别显示了有代表性的反应者和无反应的雌性)。 )。纤维化的丧失是该疗法治疗效果的最明确证据。
虽然据报道该Abcb4 -//小鼠品系会发展成肝癌,但所有小鼠都需要16个月才能发展出肿瘤13。由于我们的研究还不够长,无法评估该参数,因此我们分析了研究人群中肾盂前病变的几种标记,这些标记在3.5个月至4.5个月大时就被牺牲掉了。我们测试了甘氨酸的表达水平Ñ -methyltransferase(GNMT)和α-甲胎蛋白(AFP)的基因,它们分别下调和上调,在人类肝癌和ABCB4 - / -小鼠肝脏肿瘤14,15,16。此外,我们还通过IHC定量了磷酸化的组蛋白H2AX(γH2AX),这是DNA双链断裂的指示剂,据报道是Abcb4 -/-小鼠中HCC的良好肿瘤前标志物17。我们的研究结果显示,在盐水治疗癌前病变的更大的证据ABCB4 - / -男性比盐水处理ABCB4 - / -女性相比,同年龄的WT。在对AAV治疗有反应的男性中(胆汁PC浓度高于3900μM,请参见下一部分和讨论),与盐水治疗或无反应的男性相比,γH2AX有了显着改善,并且GNMT有改善的趋势和AFP(补充图 4,5)。对于女性,与生理盐水治疗或无反应女性相比,AFP和γH2AX水平均有显着改善。然而,尽管所有三种标记都有趋势,但对于任何一种标记,盐水处理的Abcb4 -/-和WT雌性之间均没有显着差异。这些结果表明,对我们的治疗有反应的小鼠的肿瘤形成可能减少。
治疗效果所需的转基因表达阈值
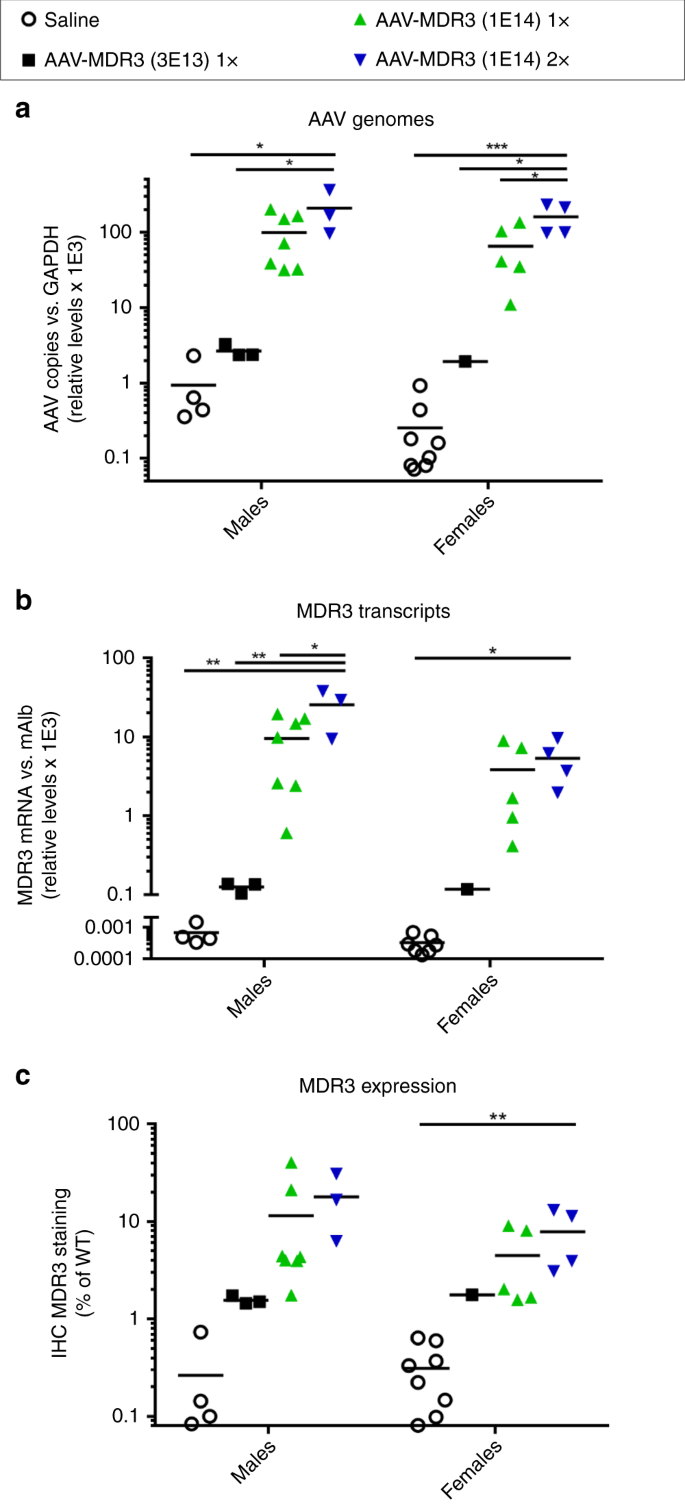
处死后从研究动物的肝组织中分别提取DNA和RNA,以定量AAV-MDR3-Aco的转导效率和转基因表达。通过AAV基因组拷贝确定的载体转导,雄性比雌性稍好,雄性和雌性的2x小鼠比1x小鼠高2到2.5倍(图 5a)。MDR3 mRNA的水平密切反映了转导效率(图 5b))。值得注意的是,在低剂量治疗的小鼠中,基因组和MDR3 mRNA的相对水平比1x高剂量治疗的小鼠低约50至100倍,这可以解释观察到的缺乏治疗效果在低剂量治疗的小鼠中。在剂量反应曲线中似乎存在拐点,在该拐点以下,转导和/或表达随时间而大大降低或丢失,并且在该拐点以上,可能具有治疗效果。为了更准确地确定拐点,我们用额外的中间剂量治疗了2周大的小鼠,并在处死时分析了载体基因组和MDR3 mRNA。这项额外的研究表明,拐点在7×10 13和1×10 14 VG / kg之间(补充图 6)。
从3×10 13 VG / kg的AAV-MDR3-Aco处理的Abcb4 -/-小鼠的肝组织中定量测定AAV基因组水平(a),MDR3 mRNA转录(b)和MDR3蛋白表达(c)。1×(黑色正方形),1×10 14 VG / kg 1×(绿色三角形)或1×10 14VG / kg 2×(蓝色倒三角形),以及盐水处理的对照(空心圆)。分别通过qPCR和RT-qPCR对AAV基因组和MDR3转录本进行定量,并将蛋白表达定量为对MDR3表达呈阳性并标准化为WT小鼠水平的组织百分比。在处理后12至16周之间处死动物。统计量(单向方差分析/ Tukey多重比较检验):*,p <0.05;**,p <0.01;***,p <0.001;数据表示为平均值±SD;˚F自由的值和度(分子,分母):一个男性:˚F(3,13)= 6.057,女性:˚F(3,14)= 12.74; b男性:F(3,13)= 7.59,女性:F(3,13)= 4.135; c男性:F(3,13)= 2.073,女性:F(3,14)= 5.696。源数据作为源数据文件提供。
IHC肝脏切片上的MDR3蛋白染色证实,从转导效率来看,男性中的MDR3表达高于女性。另外,2x组的蛋白质表达量是1x组的两倍(图 2和5c)。)。再次,低剂量治疗的小鼠显示出明显较低的MDR3表达,表明这些动物中转基因表达的丧失可能更为严重。为了确定MDR3表达的量是否决定治疗结果,我们分析了通过IHC测量的MDR3染色与疾病标志物的严重性(包括胆汁PC浓度,肝脏大小和纤维化)的相关性。对于PFIC3的所有标志物,MDR3表达量与疾病标志物严重度降低之间存在明显的相关性(补充图 7 – 9)。)。该分析表明,WT MDR3表达的阈值约为2-3%足以发挥治疗作用,因为表达水平高于该值的动物表现出胆汁PC,肝脏大小和纤维化严重程度的明显改善。
AAV-MDR3对5周大的Abcb4 – / –小鼠有效
我们感兴趣的是确定我们的载体是否可以在已经表现出肝脏炎症和纤维化的老年小鼠中诱导治疗作用(补充图 10),以查看已建立的PFIC3疾病表型是否不利于AAV载体的转导。因此,我们用1×10 14 VG / kg的AAV-MDR3-Aco 处理5周龄的小鼠一次。有趣的是,经过治疗的小鼠达到了明显的治疗效果,因为ALP,ALT,AST和胆盐水平均显着降低至WT水平,对雄性和雌性的影响持续了12周,而在2020年,这种作用逐渐减弱。另一半的女性在治疗后约4-5周开始(图 6)。处死时的生物学参数的改善(肝脾肿大,胆汁PC浓度和纤维化)与在2周龄时治疗的小鼠相似(图 7和补充图 10)。这支持了在已经显示疾病表型并且肝纤维化可能不构成潜在治疗候选药物排除标准的小鼠中使用我们的AAV载体的可能性。
处死时,肝脏(a)和脾脏(b)的重量占体重的百分比,胆汁中PC的浓度(c),肝纤维化(d),AAV基因组(e),MDR3转录本(f)和测量了以1×10 14 VG / kg 1×(绿色三角形; n = 4 M / 3 F)和AAV-MDR3-Aco处理的Abcb4 -/-小鼠和盐水处理的对照组的MDR3蛋白表达(g)。空心圆圈;n = 3 M / 4 F)和未经治疗的野生型小鼠(黑菱形;n = 3 M / 3 F)。治疗后12周处死动物。统计量(单向方差分析/ Tukey多重比较检验):*,p <0.05;**,p <0.01;***,p <0.001,****,p <0.0001。一个-d ˚F值和自由度(分子,分母):一个男性:˚F(2,7)= 44.52,女性:˚F(2,7)= 3.558; b男性:F(2,7)= 265.5,女性:F(2,7)= 30.81;c男性:F(2,7)= 69.93,女性:F(2,7)= 35.8;d男:F(2,6)= 21.02,女性:F(2,8)= 39.88。e–g不成对的t检验(t值和自由度):e男性:(t = 3.938,df = 5),女性:(t = 1.737 df = 5);f男:(t = 3.557,df = 5),女:(t = 1.836,df = 5);g男性:( t = 12.61,df = 5),女性:( t = 1.37,df = 5)。源数据作为源数据文件提供。
讨论区
基因治疗解决PFIC3的可能性具有很大的前景,因为它具有几个有利方面,使其非常适合开发此类治疗。例如,PFIC3是一种单基因疾病,其致病基因仅在肝脏中表达,其病理包括非常明确的生物标记物18。为了研究PFIC3基因疗法的可行性,我们使用了基于表达人MDR3的AAV8载体的基因补充策略来转导Abcb4 -/-小鼠的肝脏。MDR3 12的三种同工型的存在需要初步选择最合适的同工型以恢复MDR3在肝细胞质膜的表达和活性。这是通过体外分析进行的,该分析清楚地表明同工型A是具有膜定位的三种同工型中的唯一一种,因此具有将PC转运入胆汁的功能潜力。体外酶活性分析还指出,同种型A在发挥特定表型结果方面优于同种型B和C,这重现了Siew等人的发现。19。此外,与wt版本相比,设计并评估了密码子优化版本,因为先前的工作表明基因的密码子优化版本可能导致表达增加20。虽然我们没有检测到体外表达水平或活性的差异,但我们发现在Abcb4中,密码子优化的形式比wt形式的表达效率高得多。小鼠通过HDI传递质粒后。虽然这种差异的原因尚不清楚,但有一些迹象表明,与MDR3-Aco相比,MDR3-Awt cDNA序列的不稳定性更大。首先,将MDR3-Awt克隆到AAV质粒中时,观察到频繁的突变和重排,最终通过改变细菌菌株并使它们在较低温度(30°C)下生长而减少。其次,AAV-MDR3-Awt载体的生产效率非常低,导致效价通常比使用密码子优化版本的等效批次低两个对数。这些低滴度以及在HDI实验中观察到的低表达,表明选择AAV-MDR3-Aco作为最佳候选载体。
为了进一步评估AAV-MDR3-Aco纠正疾病的功效,我们使用了具有FVB遗传背景的Abcb4 -/-小鼠基于临床相关的PFIC3模型。虽然这种动物模型呈现了女性比男性更严重的症状10,疾病的严重程度足以在任何性别不以对比的是已被他人描述不同的背景应变必要饮食攻击21。我们选择治疗2周大的Abcb4 -/-小鼠,因为年幼的小鼠代表了更适合PFIC3治疗的模型,因为该疾病在儿童早期就表现在人类中。此外,年龄较大的动物肝脏炎症水平较高,这种现象可能会降低AAV介导的表达22。在治疗1周后分析的小鼠中观察到,雌性和雄性的AAV转导相似(图 2和补充图 1)。但是,当在治疗后1周和12周之间比较MDR3染色时,我们观察到男性和女性均明显减少了MDR3表达(补充图 1)。),这很可能是由于这些小鼠在治疗时(2周)的肝脏仍然不成熟,导致部分AAV基因组的丢失是由于肝脏生长引起的细胞分裂23。令人惊讶的是,与男性相比,女性在治疗后12周的MDR3表达明显更低(图 2和5c)。它已被他人观察到,在肝脏AAV介导的基因转移是在男性比女性更有效的24,25而不管启动子,转基因,或小鼠品系,并显示出可能与病毒基因组的雄激素介导的稳定在男性中26。除了在男性中公认的提高的转导效率外,在12周后女性中表达水平的下降可能是女性肝脏患病更多的结果,随着时间的推移,这可能导致MDR3表达的损失更高细胞再生。但是,仅在单次剂量和6周后观察到一半的女性没有治疗效果。这种治疗效果的丧失可能是这些动物中转导不足的结果,从而使MDR3表达的最低阈值无法抵消该疾病的影响。因此,在这些情况下,疾病的进展将占主导地位,导致进一步的肝损伤和再生,这可能与其他疾病相关因素结合在一起,
已经报道了支持逆转疾病所必需的最低表达阈值概念的证据。De Vree等。观察到PFIC3疾病可能在被颠倒ABCB4 - - /经由移栽这些小鼠与来自健康WT小鼠原代肝细胞的小鼠模型27。人口仅增加12%Abcb4 + / +肝细胞达到阈值,肝脏病理完全消失,并且在1年后仍存在校正。我们观察到以较低AAV剂量(高剂量的30%)治疗的小鼠与盐水治疗的动物在疾病症状上无差异。这些肝脏中表达MDR3的细胞的定量显示其表达低于野生型小鼠的2%。类似地,在一次治疗的高剂量雌性组中,一半的动物的表达水平也低于2%WT。这些动物是在治疗后8周失去治疗效果的动物,被处死的动物具有最大的肝脏和脾脏,最低的胆汁PC水平,最高的肝纤维化程度以及最大的前肝硬化证据。我们认为,表达MDR3的细胞的这种2-3%的WT水平构成一个阈值,在该阈值之上,足够的PC被还原到胆汁中,以防止PFIC3症状的发展。根据我们的数据,可以预防疾病的胆汁PC阈值浓度约为4000 µM(补充图。 7)。由于与小鼠MDR2相比,载体介导的蛋白表达的确切量和人类MDR3的活性均不清楚,因此,将此临床前研究转化为未来研究时,胆汁PC浓度阈值可能更有用。胆汁PC浓度为4000 µM的阈值代表了我们WT小鼠中的水平,约为12–13%,这与de Vree等人报道的Abcb4 + / +肝细胞再繁殖的数量相当。27。这样,我们针对PFIC3的方法可以模拟涉及涉及分泌蛋白的疾病的基因疗法28,例如针对A和B型血友病,α1-抗胰蛋白酶缺乏症和Pompe病29的疾病。,其中少量的转导细胞可能足以逆转疾病。
该ABCB4 - / -小鼠模型使我们能够在非常年幼的小鼠,翻译到诊所的时候,因为有PFIC3折磨的孩子将成为治疗目标人群可以证明是有用的进行功效研究。个体动物之间疾病严重程度的任何变化都可能是该模型的缺点,但是由于ABCB4中的无数突变,人类PFIC3患者也构成了高度异质的种群该基因可导致广泛的表型,涵盖从缺乏MDR3到酶促功能障碍乃至活动受损的一切事物。事实证明,通过基因疗法获得治疗效果仅在一部分患者中是可行的,尽管我们相信,即使不是全部,所有需要治疗的患者也可以从中受益。按照同样的思路,PFIC3患者的50%的人不关心的当前标准与UDCA回应,与那些保持MDR3活动一定水平作为那些最受益于这种治疗30,31。如果AAV介导的基因修复在目前无法从UDCA获益的患者中甚至仅能稍微增加MDR3活性,那么使他们成为UDCA治疗反应者就足够了。
令我们惊讶的是,在5周龄时已经建立了疾病表型的小鼠对治疗的反应与2周龄小鼠的反应几乎相同。这对于将其翻译成临床患者来说是个好兆头,在该诊所中,患者人群在诊断时已经表现出疾病症状。
我们还报告了在两次用AAV载体治疗的小鼠中所有参数的改善,与单一治疗相比,它导致更高的AAV转导和MDR3转基因表达,而没有长期的不良影响。可以通过第一次注射时免疫系统的不成熟来解释第二次治疗的功效,或者可以解释为在达到抗AAV中和抗体的峰值之前先给予第二次剂量。在临床中,若干选项涉及重复施用,包括使用不同的AAV血清型的用于随后的注射显影疗法存在32,33和免疫调节剂,以控制到AAV的潜在免疫应答34。
本次的改版中也发表手稿有两个非常最近的研究涉及利用AAV介导的基因疗法治疗PFIC3的可能性19,21。在这些研究之一中,仅通过使用转座子介导的整合策略19才能达到治疗效果,由于这种治疗的潜在致癌性,这可能会使翻译复杂化至临床。在第二项研究中,在具有C57BL / 6背景的Abcb4 -/-小鼠模型中测试了基于AAV的疗法,该模型只有在补充胆汁酸饮食的情况下才会出现PFIC3症状21。尽管这种疗法是成功的,但是在治疗时这些小鼠中没有PFIC3症状极大地促进了AAV载体的转导和维持,这种情况在患者中不太可能发生。
总之,我们在这里报告PFIC3疾病生物标志物的持续显著逆转以下使用携带MDR3亚型A的在密码子优化的序列的AAV载体治疗ABCB4 - / -小鼠在2或5周龄处理。在两周大的女性人群中,需要三周后再次注射AAV才能维持治疗效果。这些结果支持了这种方法的主要兴趣,因为它是针对治疗选择有限的患者的这种使人衰弱和威胁生命的疾病的治疗方法。
方法
细胞系
在补充了10%FBS,2 mM谷氨酰胺和100μg/ mL的DMEM(Gibco BRL)中培养了HuH-7(日本研究生物资源库:0403)和HEK-293T(ATCC®CRL-3216™)细胞链霉素和100 U / mL青霉素。
AAV载体的克隆和构建
人类ABCB4的合成野生型和密码子优化序列编码MDR3亚型A(NCBI参考序列:NP_000434.1),B(NP_061337.1)和C(NP_061338.1)的cDNA从GenScript(中国南京)克隆到pUC57中,其两侧为SalI和NdeI位点(pU57) -MDR3)。为了产生AAV-MDR3质粒,通过SalI和NdeI消化从pUC57-MDR3中提取编码每个MDR3同种型变体的DNA片段,并将其亚克隆到先前在我们实验室中使用相同的限制性酶切位点产生的pAAV2克隆质粒中,从而得到pAAV-MDR3 -Aco,pAAV-MDR3-Awt,pAAV-MDR3-Bco,pAAV-MDR3-Bwt,pAAV-MDR3-Cco和pAAV-MDR3-Cwt质粒。这些质粒包含野生型AAV2反向末端重复序列(ITR),并在人A1AT肝特异性启动子35的下游具有相应的MDR3开放阅读框(ORF)和合成的聚腺苷酸化信号36在ORF的3'末端。
AAV载体的产生
为了产生具有血清型AAV8的AAV病毒颗粒(VPs),使用线性聚乙烯亚胺25 kDa(Polysciences,Warrington,PA)与两种不同质粒共转染含有融合HEK-293T细胞的150 cm 2烧瓶:pAAV-MDR3-Aco和pDP8.ape(Plasmid Factory,Germany),包含腺病毒辅助基因以及AAV2 rep和AAV8 cap基因。72小时后,收集上清液,并在4°C下用聚乙二醇溶液(PEG8000,终浓度8%v / v)处理48–72 h。将上清液于1378x g离心15分钟,并将沉淀重悬于裂解缓冲液(50 mM Tris-Cl,150 mM NaCl,2 mM MgCl 2,0.1%Triton X-100)并保持在-80°C。收集含有AAV VP的细胞,并用裂解缓冲液处理,然后在-80°C冷冻。经过三个循环的冷冻和解冻后,从细胞上清液和裂解液中获得的VP通过在350,000× g的条件下以15–57%的碘恶醇梯度在2.5 h 下超速离心来纯化37。最后,使用Amicon Ultra Centrifugal Filters-Ultracel 100K(Millipore)浓缩纯化的病毒。通过定量PCR(qPCR)测定AAV-MDR3载体滴度(VG / mL)。使用高纯病毒核酸试剂盒(Roche)从DNAase处理的VP中提取VG。补充表1中列出了用于qPCR的A1AT启动子特异性引物 。矢量滴度范围从1×10 13到3×1013 VG /毫升。
体外MDR3表达和活性分析
使用lipofectamine 2000(Thermo Fisher),用pAAV-MDR3质粒转染HuH-7细胞。细胞在48-72 h固定,并使用特异性针对MDR3的小鼠单克隆抗体通过免疫荧光检测MDR3的表达(Millipore克隆P 3-II-26,1:100)。使用驴抗小鼠Alexa-488缀合的抗血清(Invitrogen ref。A21202,1:1000)进行检测。为了进行活性分析,在转染后,将细胞用新鲜培养基洗涤,并在含有0.5 mM牛磺胆酸钠(NaTC)的情况下与含有0.1%牛血清白蛋白(BSA)的DMEM一起孵育。温育24小时后,根据制造商的说明使用磷脂酰胆碱测定试剂盒(Sigma,MO)测定培养基中PC的含量。转染效率通过在CFX96实时检测系统(BioRad)中使用iQ™SYBR Green(BioRad)以及补充表1中所列的A1AT肝启动子特异性引物进行检查 。
动物研究
FVB.Mdr2 -/-小鼠(FVB.129P2-Abcb4 tm1Bor)(Abcb4 -//)(JAX股票#002539 )9以及FVB.Mdr2 + / +(Abcb4 + / +)小鼠(The Jackson Lab,Bar在我们自己的工厂(西班牙潘普洛纳的Cima纳瓦拉大学)繁殖。将小鼠以12小时的明暗循环圈养,并通过标准的日常饮食随意饮水和食物。在质粒处理的动物的情况下,小鼠用25微克的pAAV-MDR3-阿索或的pAAV-MDR3-AWT的使用高压注射系程序注入38并在24小时后牺牲。通过眶后静脉注射在2周和5周龄的雄性和雌性小鼠中进行AAV载体的治疗。为了进行血清分析,在指定的时间将小鼠眶后放血。从安乐死的小鼠中收集肝,脾和胆囊样品,用于器官大小,PC测定,组织学分析和核酸提取。所有动物实验和程序均按照动物测试的道德规范进行,并且研究由Navarra大学机构伦理委员会审查和批准(协议编号:繁殖的编号为082c-17,动物研究的编号为086-17)。
血清和胆汁样品分析
通过在微量离心机中以2300x g离心15分钟将血清与全血分离。使用HITACHI C311分析仪对血清ALP,ALT,AST和总胆汁盐进行定量。为了分析胆汁,将小鼠禁食24 h,处死,并小心切除胆囊并将其置于1.5 mL Eppendorf管中。然后,用29G U100胰岛素针反复穿刺胆囊以释放胆汁,根据制造商的说明,使用磷脂酰胆碱测定试剂盒(Sigma)从其中2 µL用于测量PC水平。
核酸提取和qPCR
使用iQ™绿(BioRad)在CFX96实时检测系统(BioRad)中使用针对A1AT肝启动子的特异性引物通过qPCR测定存在于肝提取物中的载体基因组拷贝。小鼠GAPDH(3-磷酸甘油醛脱氢酶)用作标准化基因(补充表1中列出的引物 )。
为了分析转基因和neooplasia标记表达,使用Maxwell®16 LEV简单RNA组织试剂盒(Promega)根据制造商的指示从肝脏中分离总RNA并进行定量。使用M-MLV反转录酶(Invitrogen)将提取的RNA反转录为互补DNA(cDNA)。使用TaqMan引物和密码子优化的MDR3(FAM,NFQ-MGB)和小鼠GADPH(VIC,NFQ-MGB)或由应用生物系统公司设计的小鼠白蛋白(FAM,NFQ-MGB)进行特异性PCR(序列未提供给研究人员),并在ViiA 7(ThermoFisher)上运行。对于瘤形成标记,使用GAPDH作为归一化基因,在CFX96实时检测系统(BioRad)(补充表1中列出的引物)中,使用iQ™SYBR Green(BioRad)进行qPCR 。
石蜡包埋切片的组织学分析
在指定的时间点从安乐死的小鼠收集肝脏。将福尔马林固定石蜡包埋的肝脏切片(3 µm厚)脱蜡并水合。使用20 µg / mL蛋白酶K的溶液在37°C下进行抗原提取30分钟。对于MDR3染色,用3%H 2 O 2封闭内源性过氧化物酶在去离子水和肝脏切片中,在4°C下与1:2000稀释的抗MDR3抗体(LS-B5729,LS-Bio,Seattle WA)或与1:400稀释的抗磷酸化组蛋白H2AX(γH2AX)孵育过夜(# 9718,Cell Signalling,Danvers,MA)。在TBS-Tween中冲洗后,将样品与未稀释的山羊抗兔EnVision(K4002,Dako,Glostrup,丹麦)孵育30分钟,并使用3,3'-二氨基联苯胺(Dako)显示过氧化物酶活性。最后,将切片用哈里斯苏木精轻度复染色,脱水后盖上盖子。肝切片也用苏木精和曙红(H&E)进行常规组织学染色,并用苦橙红染色以分析肝纤维化。
图像分析
图像核心设施(CIMA,Navarra大学)开发了几个FIJI V1.46b插件(ImageJ)来进行图像分析。插件包含图像处理操作,例如颜色分割,过滤和粒子计数,这些操作有助于从背景进行组织分割,并可以确定阳性面积与组织总面积的比率。使用FIJI插件对肝脏中存在的胶原蛋白,MDR3或γH2AX进行定量。定量表示为在WT小鼠(MDR3)中观察到的相对于MDR2信号标准化的阳性组织面积(胶原蛋白),阳性核(γH2AX)或阳性染色面积的百分比。
统计分析
数据以平均值±标准差表示,并使用单向方差分析和Tukey多重比较检验对男性和女性分别进行统计学分析,或者当仅有两组(p <0.05被认为具有显着性)时使用不配对t检验。 GraphPad Prism 7.05软件(GraphPad Software Inc.,CA,美国)。
报告摘要
有关研究设计的更多信息,请参见与本文链接的《 自然研究报告摘要》。
|
|