流感的免疫力取决于MHC II多态性:使用2种HLA转基因菌株进行的研究
流感的免疫力取决于MHC II多态性:使用2种HLA转基因菌株进行的研究
摘要
主要的组织相容性复合物II(MHC II)分子参与抗原呈递和功能适应性免疫应答的发展。有效清除传染原的MHC分子的进化选择为人类带来了好处。但是,某些II类分子与自身免疫性疾病有关。在这项研究中,我们用H1N1流感病毒感染了自身免疫易感性DRB1 * 0401.AEo和非易感性* 0402.AEo小鼠,并确定了对H3N2病毒的清除率和保护性免疫力。* 0401小鼠产生了强大的TLR触发的免疫反应,并清除了H1N1流感病毒感染。接种疫苗并用H1N1攻击后,* 0401小鼠在用H3N2攻击时,产生了针对异型H3N2流感病毒株的交叉保护免疫,而* 0402小鼠清除了H1N1感染,但没有产生针对H3N2流感病毒株的交叉保护免疫。MHCII的细胞内运输途径表明,* 0401分子运输通过晚期内体/溶酶体,而* 0402分子运输通过早期内体。这表明,MHCII的贩运可能会影响先天免疫反应的功能输出和病毒感染的清除。而且,DRB1 * 0401小鼠的寿命比HLA-DRB1 * 0402小鼠的寿命长。该研究为* 0401分子的进化选择提供了潜在的假设,即使它与自身反应性相关,这可能取决于自身抗原的肽库。MHCII的细胞内运输途径表明,* 0401分子运输通过晚期内体/溶酶体,而* 0402分子运输通过早期内体。这表明,MHCII的贩运可能会影响先天免疫反应的功能输出和病毒感染的清除。而且,DRB1 * 0401小鼠的寿命比HLA-DRB1 * 0402小鼠的寿命长。该研究为* 0401分子的进化选择提供了潜在的假设,即使它与自身反应性相关,这可能取决于自身抗原的肽库。MHCII的细胞内运输途径表明,* 0401分子运输通过晚期内体/溶酶体,而* 0402分子运输通过早期内体。这表明,MHCII的贩运可能会影响先天免疫反应的功能输出和病毒感染的清除。而且,DRB1 * 0401小鼠的寿命比HLA-DRB1 * 0402小鼠的寿命长。该研究为* 0401分子的进化选择提供了潜在的假设,即使它与自身反应性相关,这可能取决于自身抗原的肽库。这表明,MHCII的贩运可能会影响先天免疫反应的功能输出和病毒感染的清除。而且,DRB1 * 0401小鼠的寿命比HLA-DRB1 * 0402小鼠的寿命长。该研究为* 0401分子的进化选择提供了潜在的假设,即使它与自身反应性相关,这可能取决于自身抗原的肽库。这表明,MHCII的贩运可能会影响先天免疫反应的功能输出和病毒感染的清除。而且,DRB1 * 0401小鼠的寿命比HLA-DRB1 * 0402小鼠的寿命长。该研究为* 0401分子的进化选择提供了潜在的假设,即使它与自身反应性相关,这可能取决于自身抗原的肽库。
介绍
主要的组织相容性复合物(MHC)II类分子将肽呈递给T细胞,从而导致对病原体的免疫应答的产生。传统上,MHC II型分子本发明的肽衍生自胞外病原体经由通过内涵体投放,通过自噬产生替代地胞质抗原已显示被呈现1,2,3。尽管尚未涉及任何病原体,但已针对包括风湿性关节炎(RA)在内的许多自身免疫疾病提出了针对自身免疫的传染性病因。在大多数人群中,RA的易感性与HLA-DRB1 * 0401的存在有关4。另一方面,与* 0402共享第三高变序列的MHC II等位基因与对RA的耐药性相关。疾病易感性HLA等位基因进化选择的基本范例是这些等位基因可以有效清除感染。观察结果支持了这一点,即HLA-DR4与清除乙型肝炎病毒感染显着相关[ 5],尽管DR4与RA易感性相关。与携带其他MHC II等位基因2相比,DR4个体对流感病毒表位的反应高得多。最近,有2项研究表明需要内源性加工流感病毒才能产生初级CD4反应,这表明II类分子的作用3,6。
为了定义MHC II基因的作用,我们已经产生了表达与自身免疫性疾病相关的人类HLA II类基因但缺乏内源II类分子的转基因小鼠。免疫应答的效应臂受到与人类病理学7相关的HLA基因的限制。这是我们以前表达HLA-DRB1 * 0401基因的转基因小鼠的工作所支持的,HLA-DRB1 * 0401基因可发展为模拟人类RA的炎症性关节炎,在疾病组织病理学,自身抗体和性别偏见8中,而表达DRB1 * 0402的小鼠可免受关节炎9的侵害。HLA转基因小鼠模仿人类的II类分子表达,并且可以呈现与人类相似的蛋白质表位7。使用转基因小鼠,我们表明,由HLA转基因选择的T细胞是预先确定的,可以发育出一定的细胞因子谱10。因此,虽然某些MHC II等位基因可产生强大的反应和清晰感染比更有效得多其它等位基因2,5,随后的免疫应答或表位模仿可能导致易患疾病在遗传易感的个体。
MHC基因在与年龄有关的感染反应中也起着重要作用,因为在衰老过程中,大多数疾病具有与T细胞反应下降和自身免疫反应性增加相关的免疫病原学。还建议II类分子参与流感的清除。我们假设自身免疫可能是MHC分子选择的结果,在进化过程中,选择了MHCII分子以提供免受感染的保护,这可能取决于不同MHCII分子的细胞内体运输途径。事实上,11。在这项研究中,我们使用了2种表达自身免疫相关* 0401或非相关* 0402 HLA转基因的小鼠品系来验证这一假设。此处提供的数据描述了与RA相关的* 0401分子在清除感染方面提供的优势优于* 0402,即使贩运方面的差异导致结合自身抗原也可能导致自身免疫。观察结果表明,* 0401小鼠清除了流感病毒感染并产生交叉反应性免疫,而* 0402小鼠产生的抗体比* 0401小鼠高得多,但不产生交叉保护性免疫。此外,我们显示* 0401分子通过晚期内体/溶酶体运输,而* 0402主要进入早期内体。
结果
* 0401小鼠对流感病毒株产生交叉保护免疫
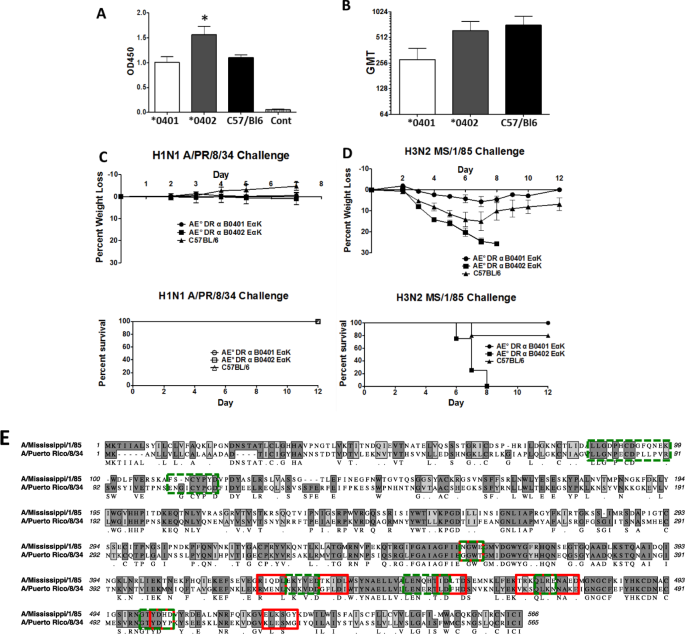
为了确定自身免疫敏感性等位基因在清除感染方面是否更有效,我们使用了关节炎易感性* 0401小鼠和耐药性* 0402小鼠体内清除流感。用表达流感病毒A / PR / 8/34的血凝素(HA)的重组腺病毒对小鼠进行免疫,并测定血清中的总体抗流感A / PR / 8/34抗体和功能性血凝抑制(HI)效价。与* 0401疫苗接种的小鼠(图1B)相比,* 0402疫苗接种的小鼠产生了更高水平的抗流感反应(图 1A)以及功能性HI抗体滴度。 )。当用H1N1 A / PR / 8/34流感病毒感染时,所有经疫苗接种的小鼠,* 0401和* 0402以及对照C57 / BL6小鼠,经体重和存活率测试,均清除了感染(图 1C)。但是,当这些小鼠在H1N1感染异源H3N2 MS / 1/85流感病毒后3个月受到攻击时,* 0401小鼠(N = 5)可以存活并在10天内恢复体重,而* 0402小鼠(N = 5)到第8天,体重减轻了30%,并死亡(图 1D))。在对照组中,有20%的小鼠在第8天死亡,尽管幸存者在攻击后并未完全恢复正常体重,这表明* 0401保留了通过交叉保护性免疫应答清除感染的优异功效。这些观察结果表明,即使两种品系的小鼠都受到了流感的保护,但仅* 0401小鼠可以产生交叉保护性免疫。
HLA-RB1 * 0401可以防御异源流感病毒。用表达流感A / PR / 8/34的全长血凝素的重组Ad5-ΔE1/ 3病毒免疫转基因和对照C57 / BL6小鼠(N = 5只小鼠/组)。分析血清中的(A)总流感结合抗体,* 0402小鼠对* 0401,C57 / BL6小鼠,P <0.05和(B)保护性功能性抗体。数据代表置信限为95%的几何平均滴度(GMT)。用小鼠适应性的A / PR / 8/34流感病毒攻击的小鼠为(监测Ç)重量损失,疾病和存活。随后用适应异源小鼠的H3N2 A /密西西比州/ 1/85流感病毒攻击小鼠,并监测(D)减肥和生存。N = 5 /应变。(E)显示了属于同源和异源流感挑战的HA蛋白的Clustal比对。深灰色和浅灰色阴影框分别指示序列同一性和相似性。* 0401小鼠血清识别的蛋白质区域用红色框表示,* 0402小鼠识别的蛋白质区域用绿色框表示。
为了确定两种菌株中用于清除感染的抗体之间的差异,筛选了MS / 1/85 H3蛋白的肽微阵列。在接种的小鼠中观察到抗体的肽结合方面的差异。* 0402小鼠产生针对MS / 1/85株的抗头部抗体反应,而* 0401小鼠则没有(补充图 1和图 2)。识别流行性感冒的球形头部结构域的抗体表明了菌株特异性,因为这是HA中包含许多中和抗体表位的区域。* 0402小鼠产生针对表位LLGDPHCDGFQNEK和FSNCYPYD的抗体应答,而* 0401小鼠则没有(表 1E)。两种小鼠品系均产生抗HA茎定向抗体。但是,被接种动物的血清所识别的确切肽序列几乎没有重叠。
* 0401小鼠在接种疫苗后比* 0402小鼠产生更强大的T细胞反应
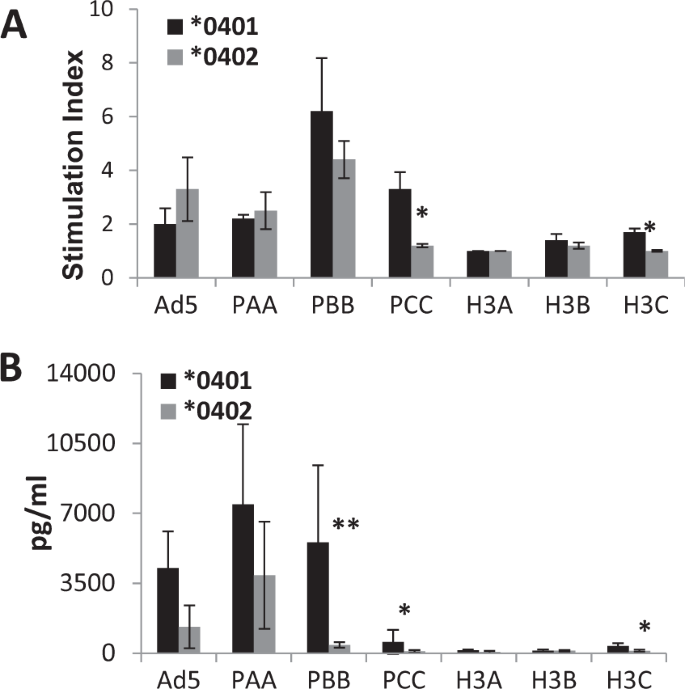
接种疫苗后2周,来自H1N1流感HA基因和共有的H3N2流感HA基因的重叠肽库刺激了来自幼稚小鼠的脾细胞。* 0401小鼠比* 0402小鼠表现出对H1N1肽和H3N2肽的H3C库的更大的增殖(图 2A)。与* 0402小鼠相比,* 0401小鼠的体外培养上清显示出更大的IFN-γ产生(图 2B))。这可能表明* 0401小鼠中T细胞免疫力的作用更强,导致H3N2流感病毒攻击期间存活率更高。从疫苗接种的小鼠中分选出CD4 + T细胞,并用成熟的骨髓来源DC培养,对H1N1肽库PBB和PCC也显示出强健的反应(补充图 3)。
* 0401和* 0402分子的回收运输是通过不同的区室进行的
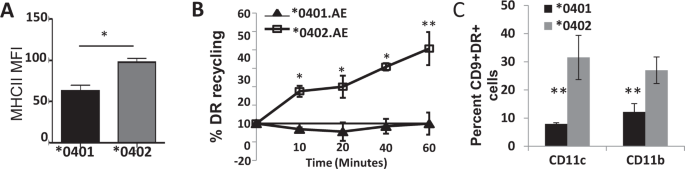
基于以上观察和最近的研究表明,需要进行流感的内源加工才能产生强大的CD4依赖性反应3,我们认为* 0401和* 0402分子的运输可能不同。最初,我们发现* 0401骨髓树突状细胞(BMDC)上MHCII的表面表达显着低于* 0402细胞(图 3A,补充图 4)。)。该数据表明,要么MHCII表达存在差异,要么正如我们所预测的,受体转运存在差异。新生和回收II类分子的肽上载发生在不同的内体区室中。回收的MHC II分子在DC的早期内体中上传肽。通过在* 0401和* 0402 BMDC上使用流式细胞仪定向回收测定,确定了* 0401和* 0402 MHCII分子之间的受体运输差异(图 3B,补充图 5))。如图所示,* 0402 MHCII等位基因显示出HLA-DR荧光的减少,因此在测定的整个过程中HLA-DR循环利用的百分比稳定增加。相反,* 0401 MHCII等位基因在整个时间过程中显示出HLA-DR荧光的最小减少,表明有缺陷或延迟了循环回细胞表面。综上所述,这些结果表明,MHCII的这两个等位基因具有非常不同的再循环特性,这可能影响它们调节适应性免疫的能力。由于已证明CD9参与MHCII贩运12,因此我们分析了CD9c和DR在CD11c和CD11b细胞上的共表达(图 3C)。)。* 0401小鼠的DC的CD9和DR共表达较低,这表明它们可能被溶酶体相关膜蛋白(LAMP)区域阻滞。
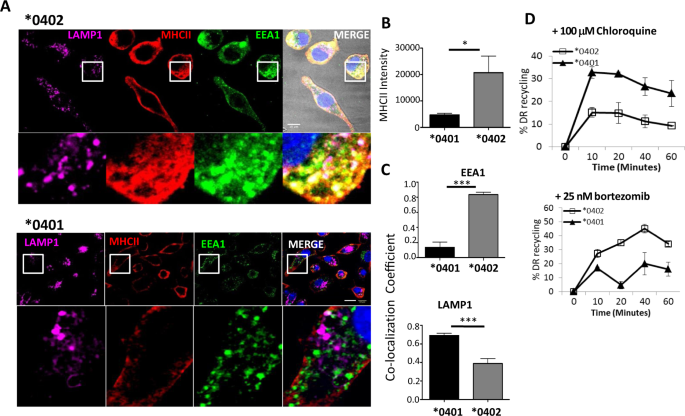
接下来,我们通过免疫荧光定向内吞试验检测了内吞后表面衍生的MHCII的定位。用抗DR抗体培养来自转基因小鼠的BMDC,并通过共聚焦显微镜观察DR分子的内在化(图 4A)。来自* 0402小鼠的BMDC的z堆栈的单个普通图像显示出比来自* 0401小鼠的更高的HLA-DR,这通过明显更高的整合强度得到了证实(P <0.05)(图 4B)。* 0401小鼠的BMDC比* 0402 BMDC的HLA-DR荧光强度低约4倍。* 0401 BMDC 与* 0402相比,还显示HLA-DR与早期内体抗原(EEA1)的共定位降低了约50%,与LAMP1 +的共定位提高了约40%(图 4C)。另一方面,* 0402 BMDC与* 0401 BMDC相比,与EEA1的MHCII共定位增加了4倍(P <0.001)。数据表明,这些MHCII分子利用了不同的内体运输途径,* 0401中的MHCII可能更多地被隔离在溶酶体中,导致降解,从而导致回收损失和较低的表面表达。
* 0401定位于溶酶体,* 0402定位于早期的内体。(A)3D共聚焦显微镜图像显示来自* 0401和* 0402小鼠的DR(MHCII),早期内体抗原(EEA1)和溶酶体相关膜蛋白1(LAMP1)染色的BMDC。(B)使用FIJI(NIH)从(A)中的图像定量MHCII整合强度。(C)使用ZEN(Carl Zeiss)中的皮尔逊共定位系数分析图像的MHCII与(顶部)EEA1和(底部)LAMP1的共定位。缩放的图像用白框标出。对于每种条件,对20多个单个细胞进行成像。比例尺,10 µm。数据代表平均值±SEM(每组n = 3只小鼠)。(D处理过的BMDC中的MHCII回收)溶酶体抑制剂氯喹和(E)蛋白酶抑制剂Bortezomib。数据代表两次独立实验的平均值±SEM(每组n = 3只小鼠),P <0.05。
由于* 0401与LAMP1共定位,因此我们接下来确定* 0401分子是否通过溶酶体运输。的BMDC用溶酶体抑制剂,氯喹,和蛋白酶抑制剂硼替佐米培养13,14,并使用回收测定法分析贩卖物。氯喹和硼替佐米恢复了* 0401分子的表达和再循环,证实了这2种分子的运输差异(图 4D,E,补充图 6和7)。该数据表明,与* 0402相比,* 0401的MHCII表达较低是由于向* 0401细胞降解的MHCII向溶酶体的运输增加。
* 0401小鼠对非TCR和TCR依赖性抗原产生强烈反应
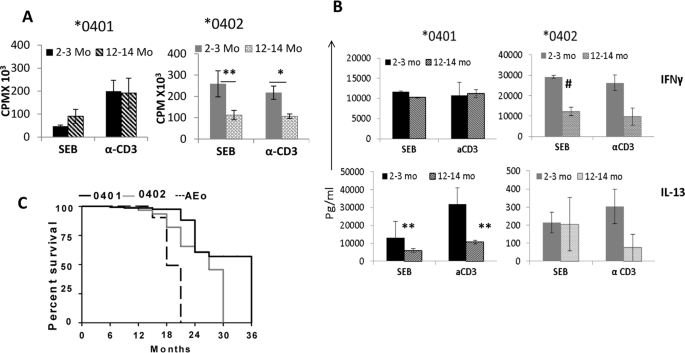
对流感的观察表明,按照假设,它们应该对病原体产生强有力的反应。我们以前曾表明,* 0401小鼠产生强大的TLR4和TLR9依赖性反应,而* 0402小鼠没有8,10。由于流感在老年人中更为严重,因此我们测试了两种菌株之间是否对葡萄球菌肠毒素B(SEB),超抗原和TCR依赖性应答存在年龄依赖性差异。有趣的是,在两种品系中都观察到相反的趋势,* 0402小鼠仅在年轻小鼠中产生了更强的应答,而* 0401小鼠在年轻和老年小鼠中产生了相似的应答(图 5A))。同样,在具有* 0401小鼠产生非常高水平的IL-13的菌株之间的免疫应答谱是不同的,而* 0402小鼠产生更高水平的IFN-γ(图 5B)。另一方面,在两种菌株中产生相似的IL-6(补充图 8)。这些数据表明,即使两种菌株都产生了对超抗原的反应,但清除感染的信号传导途径却不同。
HLA-DRB1 * 0401小鼠的存活时间比* 0402小鼠更长,并对超抗原产生不同的免疫应答。(A)在指定的时间点对从幼稚小鼠收获的脾细胞对葡萄球菌肠毒素B(SEB)和α-CD3的体外反应,* P = 0.06,** P = 0.03,(B)来自4A培养上清液的细胞因子反应。# P = 0.01,** P = 0.03。数据代表平均值±SEM(N = 3小鼠/株)。* 0401与* 0402,IFN-γ,2-3mo- SEB,* P <0.001,CD3,P <0.07; IL-13,* 0401与* 0402,SEB和CD3,2-3mo和12-14mo P <0.001。(C)* 0401(N = 23),* 0402(N = 21)和AEo(N = 10)的纯净小鼠的Kaplan Meier图,* 0401对* 0402,P <0.001。
* 0401小鼠的寿命比* 0402小鼠更长
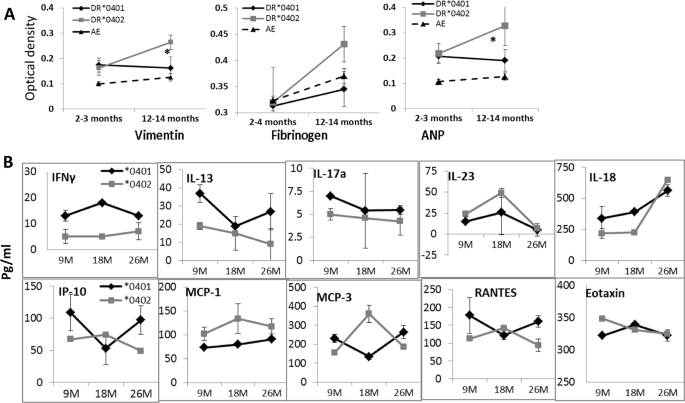
确定* 0401是否提供进化优势;我们通过评估幼稚小鼠在正常条件下的存活时间来测试* 0401和* 0402基因的拮抗多效性作用。我们先前已经发表了* 0401小鼠发展成胶原诱导的关节炎,而* 0402小鼠却没有。我们假定* 0402小鼠通常是健康的,并且应该寿命更长。如图5C所示, 与* 0402小鼠相比,* 0401小鼠具有更长的寿命(P <0.001)。自蛋白的免疫应答已被证实与自身免疫,癌症和其他疾病15,16,17,18,这可能会在年轻时导致死亡。为了排除这些因素导致* 0402小鼠寿命缩短的原因,我们通过测量年轻血清中这些蛋白质的抗体产生,测试了对某些自身抗原(包括波形蛋白,纤维蛋白原和心钠素)的自反应性和天真的老鼠。有趣的是,这两种菌株在年轻时都表现出相似的抗体水平,尽管在* 0402老年小鼠中,自身抗原,波形蛋白和ANP的抗体明显更高,P <0.05(图 6A)。),即使* 0402小鼠对自身免疫不敏感。有趣的是,* 0401小鼠的特征在于较高的促炎细胞因子,IFN-γ,IL-17,IL-18,IL-13和趋化因子IP-10和RANTES(CCL5)水平,而* 0402小鼠具有较高的IL-10水平以及MCP-3和MCP-1的水平,表明这两种品系的幼稚小鼠均具有不同的免疫特性(图 6B)。在所有细胞因子和趋化因子中,观察到细胞因子,IFN-γ和MCP-1在整个生命中存在显着差异。这些数据表明,在* 0401小鼠中,高CCL5导致DC成熟并激活产生IFN-γ的T细胞,而在* 0402小鼠中CCL2导致总体Th2反应19。
衰老小鼠的特征在于差异抗体和细胞因子反应。(A)在指定时间测试小鼠血清中波形蛋白,纤维蛋白原和心房利钠肽(ANP)的抗体;波形蛋白和ANP,* 0402较老的P <0.05,ANP较老的* 0401与* 0402,P <0.02,波形蛋白,老的* 0401与* 0402,P <0.08。Vimentin和ANP的年轻AEo对照* 0401和* 0402小鼠,P <0.02,Vimentin和ANP的老AEo对比* 0402,P <0.01(N = 4-6 /组)。原始小鼠中指定年龄的血清细胞因子(N = 5-6 /株/时间点)。* 0401与* 0402,* P <0.04,** P <0.005,# P <0.05。
讨论区
常规接种疫苗可以保护个人免受各种感染。但是,疫苗并未为所有人提供类似的保护。我们假设即使疫苗本质上是混杂的,HLA等位基因等遗传因素也决定了最终的结果,这些因素决定了感染和疫苗接种后细胞因子的分布。从进化上讲,某些HLA等位基因通过提供多个表位来激活T细胞而在提供保护方面具有优势。大多数自身免疫性疾病与某些HLA II类分子的存在有关。大约30%的高加索人携带DRB1 * 04,这是一个具有50多个亚型的等位基因。在所有DRB1 * 04等位基因中,* 0401是频率最高的等位基因,发生频率为57%,而* 0402等位基因的频率为6.3%20。但是,* 0401与包括RA 4在内的各种自身免疫性疾病有关。当前的观察结果表明,即使这两种小鼠都可以预防流感,但只有* 0401小鼠可以产生交叉保护性免疫。可以推测感染后这些细胞的激活可能导致自身反应性。先前的观察结果支持了这一点,即* 0401小鼠将记忆Th17 CD4 + T细胞隐藏在自身表位10中。已证明遗传易感小鼠的病毒感染会导致自身免疫性疾病21。另一方面,DRB1 * 0402小鼠虽然能够清除感染,但却屈服于异源感染,提示T细胞记忆缺陷,因为这两种菌株均对除两个以外的所有表位产生反应。流感疫苗已显示出可诱导猪的异源保护性免疫22。与* 0402小鼠相比,* 0401小鼠表现出更大的增殖反应和惊人地更高的IFN-γ反应。考虑到这些菌株之间的唯一区别是HLA等位基因,这清楚地表明,I类和II类等位基因在对病原体的免疫以及最有可能的自身免疫发展中都起着重要作用。免疫反应的各个臂之间的相互联系远未得到很好的理解,但是,这些数据可能会提供一些见识。
回收的MHC II分子在DC的早期内体中上传肽。最近的一项研究表明,有效的CD4对流感3的初级应答需要内源加工。根据我们的观察结果,发现* 0401和* 0402在回收时位于不同的隔室中,可以推测它们可以使用不同的肽。由于溶酶体可以与自噬体融合,并包含胞溶蛋白以及自噬体产生的自身肽,因此II类分子呈递的自身肽的利用率很高。为了支持这一点,麦醇溶蛋白(一种用于腹腔疾病的抗原)已显示在呈递给T细胞之前易位至溶酶体23。确实,仅* 0401只小鼠带有DR限制性CD4 + T细胞,可与Th17型II型胶原肽反应10。另外,来自* 0401小鼠的幼稚CD4 + T细胞可对波形蛋白产生反应,波形蛋白是一种主要的细胞骨架蛋白,可在凋亡细胞中释放 24。的早期和晚期内涵体已建议从抗原产生不同的MHC II肽 6,25。尽管晚期内体和溶酶体上载肽至MHC II是DM依赖性的,但早期内体中的表位上载并非如此。从* 0401和* 0402洗脱的肽显示来自两个回收分子的波形蛋白衍生的表位(未发表的数据),某些分子特异于每个分子,而其他分子相似。有趣的是,与* 0402分子相比,从* 0401分子洗脱的肽数量更少。2个分子之间的这种差异可能导致病原体以及自身蛋白上载和呈递不同的肽,部分解释了与RA共享的表位关联。但是,两种分子的结合能力不同可能解释了洗脱肽的差异。洗脱肽的进一步研究将有助于确定其致病性。
非抗原特异性免疫反应也显示了2种分子的不同信号通路。对超抗原的反应是,* 0401小鼠产生更高水平的IL-13,而* 0402小鼠产生IFN-γ。该数据支持了我们先前的观察,从* 0402小鼠可带动产生更高的IFN-γ比* 0401小鼠的细胞10。IL-13的增加的生产已被证明在RA患者中,以及人源化关节炎* 0401的小鼠26,27。IL-13具有多效作用,并分化的B细胞到产生抗体的细胞28,29从祖细胞和趋化因子CCL18(47,48)的诱导,并有助于DC增长。IFN-γ可增强趋化因子如RANTES和MCP-1的产生30如在* 0402小鼠中观察到的,[ 31]表明,IFN-γ诱导的趋化因子的产生可能是保护免受病原体的最初反应。
此处报道的观察结果描述了MHC II分子如何调节感染的结果。数据进一步阐明了某些MHCII分子的进化优势,即使它们与疾病的易感性有关。这种拮抗多效作用具有延长寿命的优势,并解释了MHCII基因的进化选择。数据表明需要进一步测试与自身免疫性疾病相关的其他MHC II等位基因,以证明回收利用差异是否可以预测某些个体对感染和疫苗接种的反应。
方法
转基因小鼠
HLA-DRB1 * 0401.AEo和*的生成0402.AEo转基因小鼠先前已描述8,32,33。在该研究中使用的两性小鼠(8–104周龄)均在罗切斯特梅奥诊所的无病原体菌落中饲养和饲养。所有实验均包括同窝对照,AEo,并且是在Mayo诊所机构动物使用和护理委员会(IACUC)的批准下使用ARRIVE指南进行的。
为了进行衰老研究,将小鼠饲养在常规菌落中,并监测是否有任何明显的困扰迹象。从不同年龄,2-3月龄(年轻)和12-14月龄(大)的幼稚小鼠中以及9个月,18个月和26个月时收集血清。
感染和疫苗接种
用表达H1N1流感病毒A / PR / 8/34的血凝素(HA)的重组腺病毒5型E1 / E3缺失载体接种转基因小鼠和对照C57 / BL6小鼠。肌内免疫包括用PBS稀释的50 µl疫苗(10 10 vp /小鼠),并使用27号针头以两次25 µl注射液注入两个股四头肌。疫苗接种后三周,将小鼠放血并用10 µl致死小鼠适应性同源A / PR / 8/34流感病毒攻击。简而言之,用100MLD 50鼻内攻击麻醉的小鼠将小鼠适应的A / PR / 8/34型流感病毒注入每个鼻孔。在攻击时确定基线体重,并监测小鼠的体重减轻和疾病。为了感染,将10 µl流感病毒滴入小鼠鼻孔(10 µl /鼻孔)。攻击后三个月,他们接受了1.0 MLD 50异源MS / 1/85小鼠适应流感病毒的攻击。所有流感病毒均从美国农业部的ATCC或生物防御和新兴传染病资料库获得。
ELISA和血凝抑制(HI)滴度
如先前所述34,从接种疫苗的小鼠血清中筛选抗流感A / PR / 8/34抗体。简而言之,使用Spectra / Por Float-A-Lyzer(MWCO:1000 KD),将感染了受感染胚胎卵的绒囊尿液中收获的A / PR / 8/34病毒针对3-1 L的PBS透析进行透析。该病毒用于在4°C下包被ELISA板过夜。用3%BSA封闭板,然后与来自疫苗接种小鼠的稀释血清一起温育。使用皮尔斯山羊抗小鼠(H + L)-HRP检测了小鼠抗流感抗体。使用1-Step Ultra TMB-ELISA开发ELISA,并用硫酸终止,并使用880DTX多模式酶标仪读取OD450。HI效价的测定如先前所述35。简而言之,将血清在96孔圆底板中的50 µl DPBS中稀释两倍,并在室温(RT)下与四个血凝单位(HAU)的A / PR / 8/34病毒(稀释为50 µl)一起孵育)1小时。将50μl的1%鸡RBC溶液添加至血清病毒稀释液中,并在室温下孵育1小时。HI滴度测量为抑制血凝的最高血清稀释度的倒数。
通过标准ELISA,使用涂有相应抗原的平板,通过标准ELISA测量了2-3月龄和12-14月龄的纯龄小鼠血清中的Vim,纤维蛋白原和ANP抗体。
细胞因子与T细胞增殖
使用Bio-Plex阵列系统和小鼠细胞因子23-plex面板按照制造商的说明测量在各个时间点收集的血清中的细胞因子,并使用Bio-Plex Manager 2.0软件(Bio-Rad实验室,Hercules,CA)进行分析。
用H1N1流感HA基因的重叠肽池体外攻击从接种10 10 vp /小鼠表达A / PR / 8/34 HA基因的Ad5ΔE1/ E3的小鼠收获的脾细胞(1×10 6)2周。共有H3N2流感HA基因。将肽组合成3个库A,B和C。库A和B代表HA蛋白的球状头结构域更加多样化,库C代表茎结构域更为保守。上清液用于通过ELISA测量IFN-γ。
在另一项实验中,将从转基因小鼠中收获的骨髓细胞在含有GM-CSF(10 ng / ml)和IL-4(1 ng / ml)的培养基(含有1%青霉素-链霉素和补品的RPMI1640)中培养5天。树突状细胞(DC)的成熟,如先前所述10。培养5天后,将成熟的CD11C + DC与通过阳性选择(Miltenyi Biotech)分离的脾CD4T细胞(1×10 6细胞)一起培养,并测量T细胞增殖。
通过挑战从幼稚小鼠中收获的脾细胞来研究对LPS和CPG(10ug / ml)的体外反应。
肽微阵列
针对代表A /密西西比州/ 1/85 HA蛋白全长的15-mer肽重叠肽对来自接种小鼠的血清进行筛选,以确定由Ad-载体HA疫苗诱导的特异性线性抗体表位。PEPperCHIP®肽微阵列是由B-Bridge International(加利福尼亚州库珀蒂诺)使用厚度为13.5 nm的聚乙二醇基接枝共聚物涂层和另外三个氨基酸接头(ß-丙氨酸,天冬氨酸)生产的酸,β-丙氨酸)连接到每个肽段。
使用Pepper CHIP免疫测定规程36中所述,使用来自免疫的转基因小鼠的血清探测微阵列。简而言之,将微阵列用PBS(pH 7.4 / 0.05%Tween 20/1%BSA)封闭30分钟。在室温下,然后用标准缓冲液(PBS,pH 7.4 / 0.05%Tween 20)洗涤,并与在标准缓冲液+ 0.1%BSA中以1:1000稀释的血清一起温育1小时。使用Cy3山羊抗小鼠IgG(H + L)抗体(Life Technologies,Eugene,OR)来检测结合抗体的特异性。洗涤阵列并干燥以进行扫描。使用标准抗HA和抗FLAG DyLight 680和800抗体检测对照肽,如先前所述36。使用Axon GenePix 4000B扫描仪以5 µM的分辨率扫描微阵列。
免疫荧光和DR的表达
在#1.5 LabTek II八腔盖玻片(Nunc)上培养BMDC至少30分钟,以使其牢固附着。加入冰冷的固定液(PBS中的4%低聚甲醛和0.5%戊二醛)固定细胞,并在黑暗中于室温下孵育30分钟,然后用PBS中的0.2%Triton X-100透化15分钟。然后将细胞与10μg/ ml一级抗体(Abs)在IF缓冲液(TBS加人血清混合物)中于4°C培养过夜。原发性抗体由在IF缓冲液中稀释的小鼠单克隆抗HLA-DR(L227),大鼠多克隆抗LAMP1(BD Biosciences)和山羊多克隆抗EEA1(Santa Cruz)组成。用PBS洗涤细胞,并与第二抗体(在成像缓冲液中以1:500稀释)一起孵育1小时。在室温下。用PBS洗涤并加入Hoechst 33342核染色后,将慢褪色金抗褪色试剂(Molecular Probes)添加到孔中。使用具有ZEN软件(Carl Zeiss)的带有100X / 1.4 Oil Plan-Aprochromat物镜的LSM-710激光扫描共聚焦显微镜获得图像。每个图像表示从z堆栈中获取的单个切片,该堆栈由深度为0.25 µm的多个切片组成。
将来自小鼠的BMDC以10 6个细胞/ ml的浓度悬浮在FACS缓冲液中,并用抗HLA-DR-AF647进行染色,并使用流式细胞仪进行分析。使用FlowJo 8.8.7软件(Tree Star Ashland,OR)分析数据。使用结合的抗体通过FAC在CD11c和CD11b细胞上分析DR和CD9的表达。
MHCII内吞测定和回收测定
为了特异性地追踪内吞作用后表面衍生的MHCII的定位,我们如先前所述进行了IF定向内吞作用(内在化)测定37。如上所述,在#1.5 LabTek II八腔盖玻片上培养BMDC。培养30分钟后,将细胞培养基换成含10 µg / ml抗HLA-DR的无血清DMEM,然后在37°C孵育30分钟以使其内在化。
为了进行循环测定,将来自小鼠的BMDC用抗HLA-DR-AF647抗体表面标记30分钟,在DC培养基(RPMI-10%FBS + GM-CSF + IL-4)中洗涤,并孵育30分钟允许内部化。离心细胞,并重悬于冰上的FACS缓冲液剥离溶液(含有2%BSA馏分V [Sigma Aldrich]和0.1%NaN 3,pH 2.5的PBS )中10分钟。然后将细胞在FACS缓冲液(pH 7.4 PBS中洗涤,该溶液含有2%BSA级分V [Sigma Aldrich]和0.1%NaN 3),然后重悬于DC培养基中,并孵育0、10、20、40和60分钟,以便重新铺装内部化的HLA-DR。孵育后,将细胞离心分离并在冰上重悬于FACS缓冲液剥离溶液中10分钟。然后洗涤细胞,重悬于500 µl FACS缓冲液中,并使用FACSCanto II流式细胞仪(BD Biosciences)通过流式细胞仪进行分析。使用FlowJo 8.8.7软件分析数据。使用公式(T 0 -T x)/ T 0 ×100 测量回收的HLA-DR的百分比。T 0表示在零时和T x处第二次酸洗后的平均荧光是每个时间点剥离的细胞的平均荧光强度。酸汽提方法改编自先前的出版物37。再循环测定法测量与荧光偶联的抗DR抗体结合的细胞内/内吞MHCII受体的运输。
图像分析
使用ZEN软件(Carl Zeiss)通过皮尔逊相关系数和重叠系数评估共定位。使用Fiji:Image J(美国国立卫生研究院:http; // rsb.info.nih.gov/ij/)进行综合强度测量。
统计分析
数据始终表示为平均值±标准误差平均值(SEM)。使用两尾未配对的学生t检验比较数据集。对于多个组,使用单向方差分析重复测量以及Bonferroni的多重比较测试。统计分析(学生t -使用Prism 4(的GraphPad,罗拉霍亚,CA)进行和图形测试,方差分析和列统计)。生存曲线的比较通过Kaplan Meier生存曲线进行。当p <0.05 时,差异被认为具有统计学意义。
|
|