胰蛋白-稳定的金纳米颗粒诱导三阴性乳腺癌细胞中超数中心体的单极聚集和G1阻滞
胰蛋白-稳定的金纳米颗粒诱导三阴性乳腺癌细胞中超数中心体的单极聚集和G1阻滞
摘要
不同大小,形状和装饰的金纳米粒子会对生物系统产生多种影响。我们报告化学修饰的,胰蛋白-稳定的金纳米颗粒(T-GNPs)在三阴性乳腺癌(TNBC)细胞系MDA-MB-231中的新型作用机理。使用HAuCl 4 .3H 2 O和胰蛋白synthesized合成的T-GNP,通过多种光谱技术与高分辨率电子显微镜相结合,显示出对MDA-MB-231细胞具有强大的抗增殖和抗克隆能力,并将其停滞在G 1期的细胞周期促进细胞凋亡。这些粒子的作用的分子机制涉及单极性簇的诱导和超扩增。多余的中心体(许多肿瘤细胞,包括TNBC细胞的显着特征)。具有抑制的动力的微管促进了聚集。质谱辅助的蛋白质组学分析表明,T-GNP诱导的G 1阻滞至少部分地通过核糖体生物发生途径的下调而得以促进。由于在许多类型的肿瘤细胞中都存在多余的中心体,因此我们提出化学诱导其单极簇化是一种潜在的治疗策略。
介绍
不同尺寸,形状,和装饰的金纳米颗粒已被研究用于其治疗,成像和诊断潜力1,2。但是,对探索癌细胞内金纳米颗粒的分子水平相互作用的精细细节,这些相互作用的表现及其临床意义的研究知之甚少。
中心体是哺乳动物细胞中的微管组织中心。具有分裂潜能的正常哺乳动物细胞通常在其非分裂阶段(“中间阶段”)拥有一个中心体,并在分裂阶段(“有丝分裂阶段”)复制中心体。但是,许多癌细胞在相间具有多个中心体拷贝。例如,“超数中心”是多数积极浸润性乳腺癌细胞,包括MDA-MB-231的特征3,4。尽管这些多余的中心体的确切作用尚不清楚,但它们被认为促进了肿瘤转移4。由于正常细胞分裂需要两个中心体(每个极上各一个),因此中心体的数字像差在细胞分裂过程中提出了严峻的挑战。然而,具有多个中心体拷贝的细胞在两个极点都将它们聚集在一起,以模仿双极性-这是细胞通过其分裂周期5前进的必要先决条件。从治疗的角度看,这两极通过“去簇”的中心体的破坏已被研究作为一种潜在的治疗策略6,7,8,9。但是,已知会引起中心体脱簇的药物(如灰黄霉素10)与包括肝损害在内的严重副作用相关11,需要鉴定具有减少的副作用的新药物分子或寻找替代的以中心体为靶点的策略。
微管是在参与多种功能,包括定位和中心体的维护和向细胞提供结构稳定性的真核细胞的细胞骨架的动态聚合物12,13。这些细胞骨架细丝是通过可逆添加双亚基蛋白微管蛋白生成的。一旦组装,根据细胞的需要,微管表现出选择性的稳定性。相间微管往往比有丝分裂微管更稳定。微管的稳定性由几种翻译后修饰决定。例如,微管微管蛋白亚基的乙酰化是持续稳定的微管的标志12。由于微管蛋白和微管参与了重要的细胞功能,因此是几种临床批准的抗癌药物的靶标,包括紫杉烷类,依沙贝比隆和甲磺酸依布林14。至今尚未充分了解的机制,已发现乳腺肿瘤对抗微管蛋白药物反应良好。上述所有药物均主要用于治疗乳腺肿瘤。然而,为了克服与当前化学疗法有关的剂量限制和脱靶毒性,必须开发可以通过利用它们的不同构成来特异性消除癌细胞的潜在治疗候选物。
胰蛋白,是通过胰蛋白酶消化酪蛋白而形成的肽混合物,可稳定溶液中的金纳米颗粒。胰蛋白try对纳米颗粒的表面改性使其稳定并降低了颗粒聚集的趋势15。由于这些肽在金纳米颗粒上形成了涂层,它们也使它们具有生物相容性16。这项研究报告了一种新型的T-GNP作用机制,该机制涉及三阴性乳腺癌(TNBC)细胞系MDA-MB-231的多余核体。
结果
T-GNP的表征
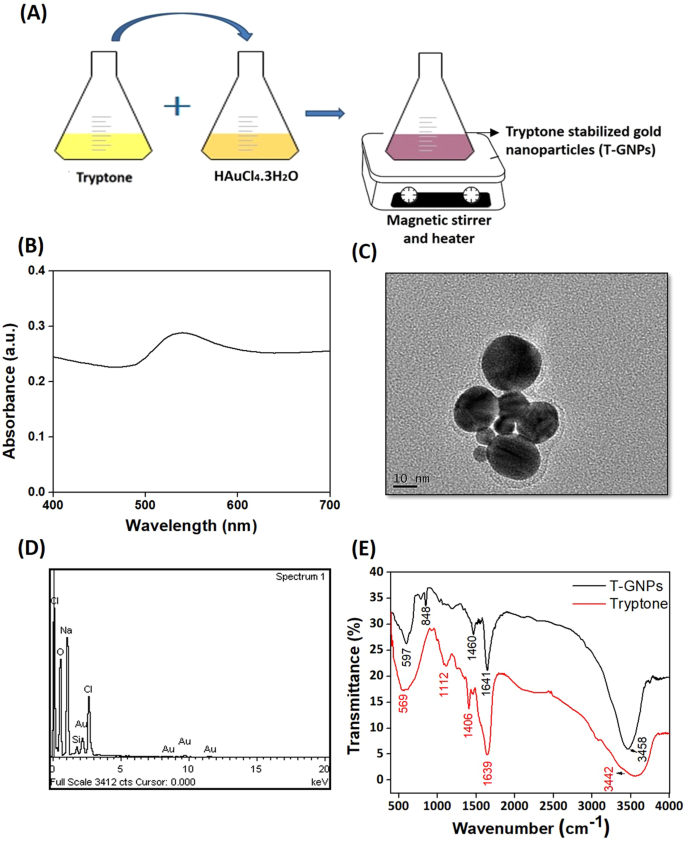
本研究中使用的T-GNP由HAuCl 4 .3H 2 O和胰蛋白synthesized合成(图 1A)。溶液的颜色从浅黄色变为红粉红色,是形成纳米颗粒的第一个迹象。T-GNP的形成及其可能的球形由540 nm处的吸光度峰值表示(图 1B)17。纳米粒子的透射电子显微镜(TEM)图像证实了其球形形状和平均尺寸分布(约25 nm)(图 1C)。纳米粒子的能量色散X射线(EDX)光谱分析表明存在元素金(Au)(图 1D)。通过傅立叶变换红外(FTIR)分析验证了合成的T-GNPs上参与Au 3+还原的胰蛋白functional官能团和封端分子(图 1E)。胰蛋白and和T-GNP分别在3442 cm -1和3458 cm -1处出现强烈的宽峰,这是由于胺NH的拉伸振动所致。对于胰蛋白tone,在1639 cm -1处存在一个强峰表示–C = C–拉伸振动,而在1406 cm -1处的谱带表示CH 2弯曲振动。吸收峰在1112 cm -1可以归因于胺基团的C–N伸缩振动。因此,证实了蛋白p分子充当T-GNP的还原剂和封端剂。T-GNPs的生物还原后的FTIR光谱在1641 cm -1处显示一个尖峰,代表酰胺基团的弦C = O拉伸振动。在1460 cm -1处的峰是中等CH 2形变弯曲振动的特征,在848 cm -1处的尖峰代表胺基团18的对称C–N–C拉伸振动。通过动态光散射(DLS)测定的颗粒的尺寸分布直方图显示出流体动力学尺寸,其强度分布的平均值(Z平均值)为269±10.0 nm(补充图 1A)。多分散指数(PdI)为0.474证实了T-GNP的稳定性(补充图 1B)19。另外,T-GNP显示出-18.5±5mV的负ζ电势(补充图 1B),表明颗粒具有较少的聚集趋势。
T-GNPs抑制细胞活力,克隆性和细胞周期进程,并诱导细胞死亡
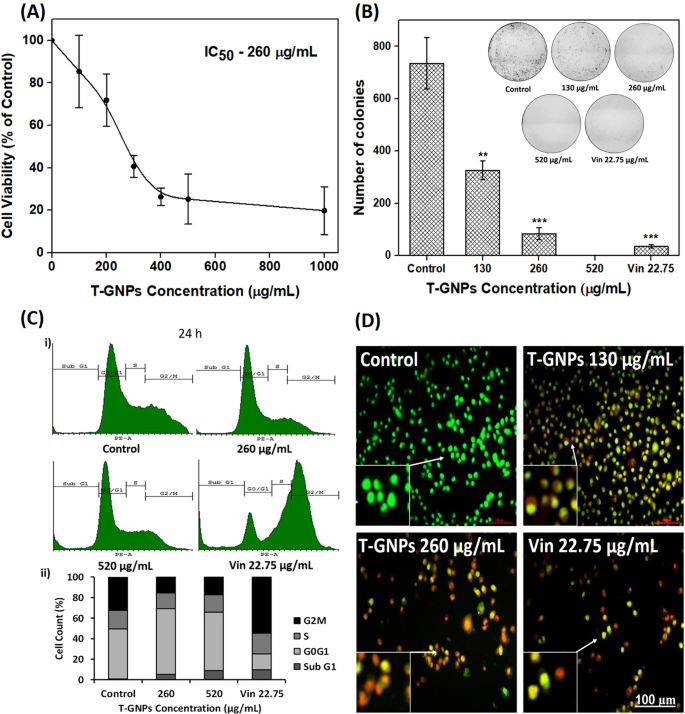
经T-GNPs处理的细胞显示出对细胞活力的浓度依赖性抑制(图 2A)。例如,浓度为100 µg / mL,300 µg / mL和500 µg / mL的T-GNP分别将细胞活力抑制15%,59%和75%,产生最大抑制浓度的一半(IC 50)为260±5 µg / mL。纳米颗粒还以浓度依赖性方式抑制细胞的克隆形成繁殖(图 2B)。)。例如,130 µg / mL和260 µg / mL的颗粒分别抑制了克隆形成性,分别为56%和89%,而520 µg / mL的颗粒几乎完全抑制了克隆形成性。长春花碱用作对照,使菌落数减少了95%。如通过流式细胞术证明的,用T-GNP处理24小时的细胞将细胞停在G 0 / G 1期(图 2C)。具体而言,与对照细胞相比,用IC 50(260μg/ mL)T-GNPs处理的细胞具有更高的生存能力,显示出G 0 / G 1群体增加了31%(从49%增至64%)。当细胞暴露于该浓度的两倍(520 µg / mL)24小时后,sub-G 1阶段显着增加,表明与细胞死亡相关的降解DNA的积累(图 2C)。用T-GNP进行48小时处理后,亚G 1期细胞蓄积,其他相中几乎没有或没有细胞(补充图 2),表明细胞死亡随时间增加。因此,T-GNP能够诱导强健的G 1阻滞并促进其死亡。如所料,长春碱显示出强大的G 2 / M阻滞作用(G 2中 55%的细胞/ M,与对照相比)。使用DNA插入荧光染料a啶橙和溴化乙锭(AO / EtBr染色)确认细胞死亡。AO可以通过完整的细胞膜进入细胞并染色DNA,而EtBr只能染色膜完整性受损的细胞DNA 20。T-GNPs诱导细胞死亡的浓度依赖性诱导。进行了以下观察:(1)未经处理的细胞大部分被染成绿色,表明健康细胞占主导地位;(2)处于凋亡早期的细胞呈淡黄色染色;(3)处于凋亡晚期的细胞呈橙色染色;以及(4)死细胞显示深橙色至红色荧光(图 2D)。
T-GNP对MDA-MB-231细胞群体的影响。(A)抑制细胞活力。将细胞暴露于T-GNP(100 µg / mL – 1000 µg / mL),并使用MTT法测定细胞活力。(B)。抑制克隆形成性。在短暂暴露于纳米颗粒(24小时)后八天,T-GNPs抑制了细胞生长的集落形成能力。(C)细胞周期停滞。用T-GNP(260 µg / mL和520 µg / mL)处理细胞24小时,并使用流式细胞仪分析细胞周期分布。结果表示为直方图(C i)。曲线图(C ii)代表细胞周期不同阶段的细胞百分比。(D)诱导细胞凋亡。T-GNPs 的细胞存活力为IC 50,大大增加了凋亡(绿黄色–早期凋亡,橙色–晚期凋亡)和死细胞(深橙色至红色)的数量;(n = 3)。对于A和B,结果表示为平均值±SD(n = 3);**(p <0.01)和***(p <0.001)。Vin,长春碱,22.75 µg / mL(25 µM)。
T-GNPs诱导多余中心体的单极聚集
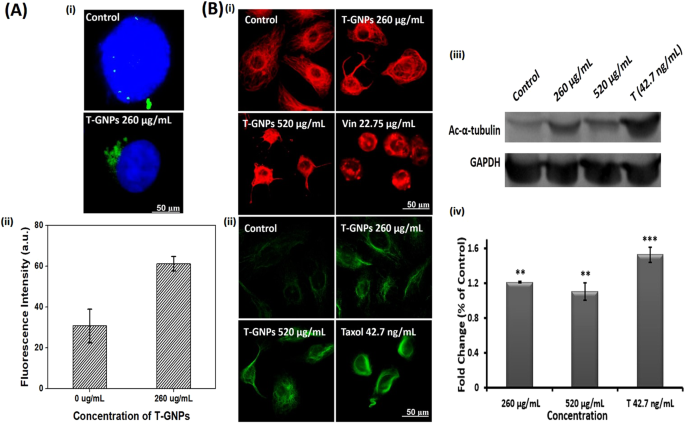
用抗γ-微管蛋白抗体对细胞进行免疫染色显示,间期细胞中存在多余的中心体(图 3A),呈分散的点状,据报道21。在未经处理的细胞中,每个细胞平均有5–6个中心体(图 3Ai)。用T-GNPs(260 µg / mL)处理的细胞显示中心体聚集到一个极点(图 3Ai)。这样聚集的中心体也显示出进一步的扩增(图 3Aii)。
T-GNP的细胞内作用。(甲 .I。)的T-的GNP簇伽玛微管蛋白的细胞的一个极。用IC 50(260μg/ mL)T-GNP处理细胞活力的MDA-MB-231细胞用抗γ-微管蛋白抗体(对于中心体;绿色)和Hoechst 33342(对于DNA;蓝色)染色。(甲 ii)所述群集中心体的扩增。使用Image J软件定量对应于中心体染色的荧光强度。(B i)捆绑和(B ii)由T-GNP诱导的细胞微管的高度稳定化。使用抗-α-微管蛋白抗体(红色)或抗-乙酰-α-微管蛋白(绿色)抗体观察用260 µg / mL或520 µg / mL T-GNP处理的细胞。(Biii和B iv)在T-GNPs处理的细胞中乙酰基-α-微管蛋白的表达水平增加。Western印迹显示存在T-GNP(260 µg / mL和520 µg / mL)时乙酰化微管蛋白的水平。从相同印迹的不同部分裁剪印迹。补充信息中提供了不同暴露水平的全长印迹。对于一个。②。和B iv, 与对照组相比,数据在“ **”(P <0.01)和“ ***”(P <0.001)上具有统计学意义。结果表示为平均值±SD;(n = 3)。Vin,长春碱22.75 µg / mL(25 µM);T紫杉醇,42.7 ng / mL(50 nM)。
T-GNP稳定和捆绑细胞微管
用T-GNPs(260 µg / mL或520 µg / mL)处理24小时的细胞显示微管广泛聚集(图 3Bi)。诱导有丝分裂停滞的长春碱将细胞微管解聚。通过用抗α-乙酰基微管蛋白抗体进行免疫染色(图3Bii)和对处理过的细胞蛋白进行免疫印迹(图 3Biii,iv),进一步揭示了微管的持久稳定性 。在这两种情况下,使用的对照紫杉醇也显示出乙酰化微管蛋白水平升高。紫杉醇显示微管的广泛乙酰化。还通过用抗α-微管蛋白抗体免疫染色来估计总α-微管蛋白(补充图 3)。
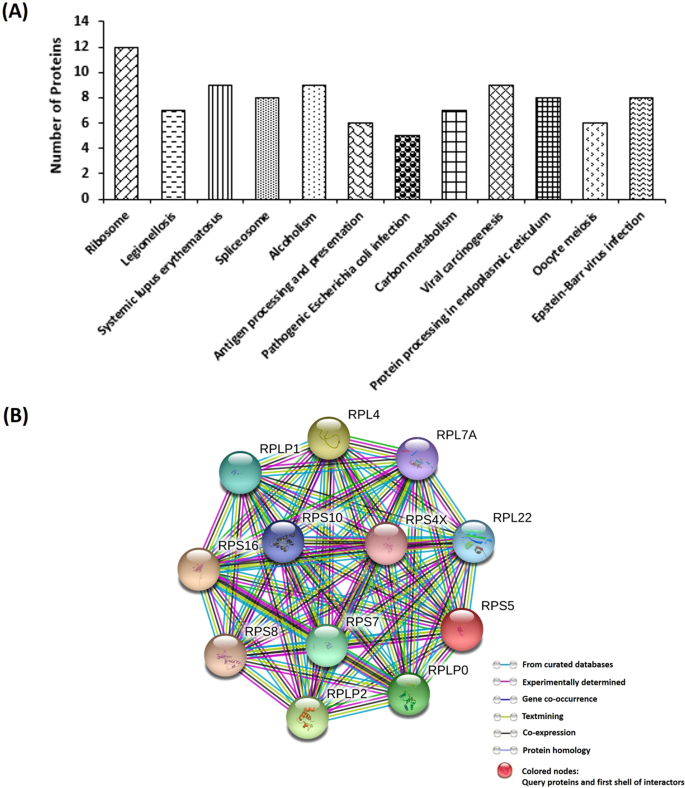
为了进一步了解T-GNP对TNBC细胞的作用机理,进行了蛋白质组学分析。根据既定标准22在未处理和处理过的细胞中进行蛋白质鉴定。来自人类蛋白质组数据库(从UniProt下载)的Fasta文件用于蛋白质搜索,并生成已鉴定蛋白质的列表。使用无标记定量方法定量处理的细胞与对照细胞相比的蛋白质表达水平的变化,并在补充表1中给出 。R 2未经处理和经处理的组中两次重复的值均大于0.99(方差单向分析)。使用检索相互作用基因/蛋白质的搜索工具(STRING)数据库分析了被T-GNP下调的155种蛋白质的相互作用网络(补充图 4A)。对如此差异表达的蛋白质进行基因本体分析(GO),该分析鉴定了134个生物学过程(BP),81个细胞成分(CC)和68个分子功能(MF),它们丰富了数据集。其中56个MF,61个CC和98个BP显示p <0.05(补充图 4B–D)。京都基因与基因组百科全书(KEGG)途径分析显示,核糖体生物发生途径被最明显地下调,共有12种蛋白质(图 4A,B)。剪接体途径显示出八个蛋白的下调,以及七个蛋白的碳代谢(图 4A)。
T-GNPs增加ROS的产生并诱导线粒体膜电位的损失
T-GNPs显着(p <0.01)升高了细胞内ROS的水平。具体而言,与未经处理的细胞相比,用130 µg / mL和260 µg / mL的T-GNP处理的细胞的ROS水平分别提高了2.6倍和3倍(按其相对荧光强度测量)(补充图 5A)。为了确认在处理过的细胞中观察到的ROS产量增加是否由T-GNP介导,我们先用N-乙酰半胱氨酸(NAC),然后再用T-GNP对细胞进行预处理。如图所示(补充图 5A),当用NAC预处理细胞时,在T-GNPs处理的细胞中ROS产生的增加被显着淬灭。H 2 O 2使用已知的ROS诱导剂作为阳性对照,其使ROS增加5倍(补充图 5A)。由于ROS含量的增加会不利地影响线粒体膜电位的完整性,因此我们接下来使用膜可渗透的亲脂性染料若丹明123 检查了颗粒对电位(Δψm)的影响。若丹明123表现出异质染色未经处理的细胞中红色和绿色荧光共存于同一细胞中的模式(补充图 5B))。用130 µg / mL的T-GNPs处理的细胞显示出明显的膜电位损失,红色荧光显着减少,绿色荧光增加。当浓度加倍时,观察到几乎没有红色荧光,表明线粒体膜电位的实质损失。
讨论和结论
当暴露于细胞环境中时,金纳米颗粒的独特作用才刚刚被完全理解。这项研究使用T-GNP(〜25 nm)揭示了这些颗粒对抗最具攻击性的转移性乳腺癌细胞系MDA-MB-231的新作用机制。该机制涉及单极簇和超数中心体的过度扩增和强健的G 1阻滞,导致细胞死亡。
我们通过评估T-GNP对细胞的抗增殖潜力开始了我们的研究。在证实微克量的T-GNPs通过抑制细胞的增殖,克隆形成和循环潜力来抑制细胞活力(图 2)后,我们着手研究颗粒的分子作用机理。TNBC细胞的一个特征是多余的中心体21的存在。据认为,中心体的这种数量丰富有助于细胞重组其细胞骨架,促进存活和转移4。因此,我们首先检查了纳米颗粒是否对这些多余的中心体有任何影响。使用抗伽玛微管蛋白抗体,我们在治疗细胞中鉴定了这些中心体的新型重组。与未处理的TNBC细胞显示出分散的中心体不同(图 3A),处理过的细胞表现出单极簇集和中心体的扩增(图 3A)。由于中心体的定位主要由微管13传递的力控制,因此我们接下来检查颗粒是否改变了微管网络的结构或稳定性。如荧光显微镜所揭示的,T-GNPs诱导了微管的捆绑(图 3Bi)。此外,经颗粒处理的微管显示出增强的乙酰化,表明其动态性受到抑制(图 3Bii)23。具体而言,α-微管蛋白可在其赖氨酸40处被乙酰化。乙酰化是微管稳定化的原因还是结果尚不清楚。然而,增强的乙酰化模式表明存在持续稳定的微管23。接下来,我们检查了颗粒是否直接与微管蛋白(微管的构建基蛋白)相互作用,以排除观察到的微管捆绑是T-GNP对微管的间接作用的可能性。使用色氨酸荧光猝灭测定法验证了颗粒与微管蛋白的直接结合(补充图 6)。接下来要回答的是微管的稳定和捆绑如何引起分散的中心体的单极聚集。优雅地研究睫状功能24,Pitavel及其同事证明,超稳定的微管会施加推动力,从而将中心体推向一个极点。因此,可以认为,通过干扰微管的结构和动力学,从而促使微粒的超稳定化,从而使微粒将质体推进并聚集为一个极点(图 3B)。这样聚集的中心体也明显地被扩增了(图 3Aii),这可能是由于颗粒(补充图5A)25施加的氧化应激通过线粒体膜电位的损失补充了(补充图 5B)26所致 。最后,细胞如何在G 1处失去循环潜力阶段进行了调查。尽管线粒体功能的丧失(补充图 5B)可以促进G 1阻滞27,但我们试图通过质谱辅助蛋白质组学分析揭示可能有助于阻滞的其他机制。的分析表明,核糖体生物发生途径(图的下调 4A)在诱导ģ起到了关键作用1阻滞28,29。已经发现靶向核糖体生物发生途径的药物可通过抑制前rRNA加工,rRNA合成和翻译干扰来有效阻止癌细胞增殖。几个化学治疗剂靶向核糖体生物发生作为一种有效的抗增殖策略30,31。在这里,如KEGG通路分析所揭示,在暴露于T-GNPs的细胞中,至少十二种相互之间具有紧密相互作用的核糖体蛋白被下调(图 4A,B)。这些蛋白是核糖体P-复合蛋白(RPLP0 [用于核糖体蛋白侧柄亚基[P0],RPLP1,RPLP2),RPL4,RPL7A,RPL22,RPS4X,RPS5,RPS7,RPS8,RPS10和RPS16。值得注意的是,已知P复合蛋白(例如RPLP0)的下调会促进G 1阻滞32。实际上,从任一核糖体亚基中耗尽核糖体蛋白可引起G1阻滞33。T-GNP下调的其他核糖体蛋白也对癌症具有治疗意义。例如,SK-OV-3细胞中RPS4X蛋白的消耗会强烈阻碍其增殖潜能34。此外,ROS水平升高之间也有关系(补充图 5A)和抑制核糖体功能。具体而言,氧化应激是已知的以延缓全球蛋白质的合成,通过核糖体的径流较慢的速率很大程度上起因于对翻译延伸或终止的抑制作用35。此外,威利及其同事的一项优雅研究表明,氧化应激会损害核糖体内部的rRNA 36。
总而言之,这项研究阐明了金纳米颗粒在癌细胞中的新作用机理,其特征在于超数中心体的单极聚集。微管动力学的丧失促进了聚集。聚集,再加上核糖体生物发生途径的下调促进了强大的G 1阻滞,导致细胞死亡。
材料和方法
用料
三水合氯化金(III)(HAuCl 4 .3H 2 O),二乙酸二氯荧光素(DCFH-DA),罗丹明123,蛋白酶抑制剂混合物,苯基甲磺酰氟(PMSF),碘化丙啶(PI),甲醛,紫杉醇,溴化乙锭,鸟苷-5'-三磷酸(GTP),谷氨酸盐,哌嗪-N,N'-双(2-乙烷磺酸)(管),硫酸镁(MgSO 4),乙二醇四乙酸(EGTA),长春碱,二硫苏糖醇(DTT),碘乙酰胺(IAA),碳酸氢铵(ABC),三氟乙酸(TFA),甲酸,氯化钠,Triton X-100和脱氧胆酸钠来自Sigma(密苏里州圣路易斯)。Dulbecco改良Eagle培养基(DMEM),胎牛血清(FBS),胰蛋白酶-EDTA(0.25%)溶液,青霉素,链霉素,牛血清白蛋白(BSA),马血清,(3-(4,5-二甲基噻唑-2- yl)-2,5-二苯基四唑溴化物(MTT),核糖核酸酶A,二甲基亚砜(DMSO),乙腈和HPLC级水购自印度Himedia。胰蛋白,、 Tris缓冲液,a啶橙和结晶紫来自Sisco Research Laboratories(SRL,印度班加罗尔)。磷酸酶抑制剂,胰蛋白酶,和Prolong Gold防褪色试剂购自Thermo Scientific(Waltham,Massachusetts)。尿素来自印度的兰肯。所有其他化学药品和溶剂也具有分析纯和最高纯度。
T-GNP的合成与表征
胰蛋白tone稳定的金纳米颗粒(T-GNPs)合成如下。通过在25℃下连续搅拌将三水合氯化金(III)(1mM)与胰蛋白((1mg / mL; pH 12)混合。然后在连续搅拌下将溶液在热板上于100°C加热15分钟。然后将样品在Sorvall™Stratos Biofuge离心机(Thermo Scientific,Waltham,MA)中以14,000 rpm(26,200×g)离心30分钟。然后将沉淀的金纳米颗粒中洗涤三次以去离子水,并冷冻干燥使用FREEZ-区冷冻干燥系统(LABCONCO (R) ,堪萨斯城,MO),得到粉末状的金纳米颗粒。
合成的T-GNP的存在下首先验证通过UV-可见分光光度法(无限® 200 PRO,Tecan公司,瑞士)17通过取样品的吸光度(400纳米-700纳米)。使用JEOL JEM-2100F透射电子显微镜(JEOL,东京,日本)37检查颗粒的尺寸和形状。为了检查元素金的存在,进行了能量色散X射线光谱(EDX)(英国牛津仪器公司INCA)。为了鉴定纳米颗粒表面上的官能团,在FTIR分光光度计(Spectrum RX1,Perkin Elmer,美国)中以透射模式(400 cm–4000 cm -1)在室温下进行了傅里叶变换红外(FTIR)光谱分析。分辨率4 cm -1 37。使用Zetasizer Nano-ZS90尺寸分析仪(Malvern Instruments Ltd,伍斯特郡,英国) 37获得T-GNP的表面电荷,稳定性,尺寸分布和平均流体动力学直径。
细胞培养
MDA-MB-231(三阴性乳腺癌)细胞获自美国典型培养物保藏中心(ATCC,马纳萨斯,弗吉尼亚州)。细胞中,在其21 日通过,在DMEM中培养在补充有10%热灭活的FBS和青霉素(100U /毫升)/链霉素(0.1毫克/毫升)溶液中。在Forma SteriCycle培养箱(Thermo Scientific,沃尔瑟姆,马萨诸塞州)中,将细胞保持在37°C和5%CO 2的湿润气氛中。细胞的传代数低。通过使用MycoAlert支原体检测试剂盒(瑞士巴塞尔,Lonza),确定它们不含支原体。
细胞活力和集落形成测定
使用MTT分析评估了T-GNP对细胞活力的影响38。简而言之,将细胞以5000细胞/孔的密度接种在96孔板中,并孵育24小时。第二天,在37°C下用不同浓度的T-GNP(100 µg / mL–1000 µg / mL)处理细胞24小时。在指定的时间点后,将磷酸盐缓冲盐水(PBS)中的MTT(5 mg / mL)加入每个孔中,并在37°C下孵育4小时。将由活细胞形成的甲maz晶体溶解在DMSO中。在酶标仪(570 nm; TECAN infinite 200 PRO;瑞士Tecan)中进行吸光度测量。实验一式三份进行三次。对于集落形成测定,将细胞以1000个细胞/ mL接种在6孔板的每个孔中,并使其粘附24小时。然后将它们分别用130 µg / mL,260 µg / mL和520 µg / mL的T-GNP处理24小时。在指定的时间点之后,将含颗粒的培养基替换为新鲜的完全培养基,并使细胞在其中生长八天,第四天更换一次培养基。将形成的菌落用3.7%甲醛(37°C; 15分钟)固定,并用结晶紫(0.5%(w / v); 1 h,25°C)染色。然后将孔用蒸馏水洗涤,风干,并使用Image J软件(美国国立卫生研究院)对菌落进行计数。重复该实验至少两次。然后将孔用蒸馏水洗涤,风干,并使用Image J软件(美国国立卫生研究院)对菌落进行计数。重复该实验至少两次。然后将孔用蒸馏水洗涤,风干,并使用Image J软件(美国国立卫生研究院)对菌落进行计数。重复该实验至少两次。
细胞周期分析
用T-GNP(260 µg / mL和520 µg / mL)处理细胞24小时或48小时。温育后,收集粘附的和漂浮的细胞,用1X PBS洗涤,并在-20℃下在冷却的乙醇(70%)中固定12小时。RNase A(100 µg / mL)处理固定细胞10分钟后,将它们与碘化丙锭(50 µg / mL;溶于0.1%Triton X-100)一起孵育。在配备FACS DIVA软件的BD FACS Aria(加利福尼亚州圣何塞的BD Bioscience)中分析样品。使用FlowJo软件(BD Bioscience)确定周期中每个阶段的细胞百分比。此外,使用Cyflogic软件(1.2.1版,Cyflo Ltd.,Turku,Finland)确定在该循环的每个阶段(G 0 / G 1,S和G 2 / M)中存在的细胞数。
检测细胞凋亡
如先前报道39,研究了诱导细胞死亡的方法。简而言之,将细胞接种在12孔板中并生长24小时。第二天,将它们用T-GNP(130 µg / mL或260 µg / mL)处理24小时。通过胰蛋白酶消化收集细胞,并用1X PBS洗涤。然后将细胞悬液与PBS中的1 µL AO / EtBr染料(每种100 mg / mL)一起孵育。在Nikon Eclipse 90i荧光显微镜(Nikon,东京,日本)下观察染色的细胞。
中心体,微管和乙酰化微管的可视化
为了对中心体进行免疫荧光显像,将细胞用抗伽玛微管蛋白抗体染色。简而言之,单元格(5×10 4将细胞接种在经表面处理的盖玻片上,并在12孔板中生长过夜。然后将细胞用T-GNP(0 µg / mL或260 µg / mL)处理24小时,并固定在3.7%甲醛中(37°C,20分钟)。然后在无水甲醇中(4°C,15分钟)使细胞通透。在加湿室中使用5%马血清(25°C,1 h)封闭非特异性结合位点。随后将细胞用偶联FITC的γ-微管蛋白抗体(Biorbyt,CA,USA; 1:200稀释; 25°C,2 h)染色。与抗体孵育后,将其用1X PBS洗涤,并与Hoechst 33342(Molecular Probes,Eugene,OR; 1:1000稀释; 25°C,10分钟)孵育以观察DNA。为了检查T-GNP对细胞微管的作用,将如上所述生长的细胞用T-GNP(260 µg / mL,50和2×IC 50如所提到的,分别在24小时内将细胞活力(固定在细胞活力上)固定,透化和封闭非特异性结合位点。然后将它们先用抗α-微管蛋白抗体(Sigma,1:300稀释; 25°C,1 h)染色,然后再用Alexa-568缀合的山羊抗小鼠抗体(Molecular Probes)染色相同的时间和温度。为了观察处理过的微管的乙酰化模式,用抗乙酰基-α-微管蛋白(Lys40)抗体(Cell Signaling Technology,MA; 1)对纳米颗粒(260μg/ mL,520μg/ mL)生长和处理的细胞进行染色。 :200稀释; 25°C,2 h),然后加入FITC偶联的驴抗兔抗体(Santa Cruz Biotechnology,TX; 1:1000; 25°C,2 h)。盖玻片用PBS洗涤,并使用Prolong抗褪色试剂固定在载玻片上。
免疫印迹
单元格(1×10 6细胞/ mL)接种到100mm细胞培养皿中并生长过夜。然后将它们用T-GNP(260 µg / mL或520 µg / mL)处理24小时,并在放射免疫沉淀测定缓冲液[RIPA缓冲液:氯化钠(150 mM),Triton X-100(1%),钠脱氧胆酸盐(0.5%),SDS(0.1%),Tris-HCl(50 mM; pH,8.0)],并补充蛋白酶抑制剂混合物(1%)和PMSF(1 mM)。细胞裂解后,将样品离心,小心收集上清液,并保存在-80°C直至使用。分别使用兔单克隆抗乙酰-α-微管蛋白(Lys40)抗体(1:1000稀释度)和小鼠抗α-微管蛋白抗体(1:1000稀释度)进行免疫印迹,目测并评估乙酰化微管蛋白和总α微管蛋白的水平。 。3-磷酸甘油醛脱氢酶(GAPDH; 1:1000稀释度; Cell Signaling Technology,Danvers,MA)被用作加载对照。使用SuperSignal™West Pico化学发光底物(Thermo Fisher Scientific)显影印迹,并在ChemiDoc系统(BioRad,Hercules,CA)中成像。带强度通过ImageJ软件评估。
质谱
为了进行质谱辅助的蛋白质组学分析,将在260 µg / mL颗粒存在下生长24小时的细胞以2000 rpm(25°C,5分钟)离心。使用裂解缓冲液(20 mM Tris-HCl,150 mM NaCl,1%Triton X-100、0.5%脱氧胆酸钠,1 mM DTT,1 X蛋白酶抑制剂混合物,1 X磷酸酶抑制剂混合物)进行蛋白质提取。
蛋白质的沉淀,还原,烷基化和消化
提取的蛋白质样品(对照和处理样品)通过丙酮沉淀40沉淀。通过添加8M尿素将由此获得的蛋白质沉淀溶解。然后通过添加100 mM DTT还原样品,并在90°C的干浴中加热15分钟。冷却样品后,通过添加200 mM IAA将其烷基化,并在黑暗中孵育(25°C,15分钟)。然后加入ABC(100 mM),并用1 mg / mL胰蛋白酶蛋白酶消化蛋白质(37°C,16 h)。通过添加浓缩的TFA终止反应。然后使用真空离心将肽干燥24小时,并溶解在0.1%TFA中进行MS分析。
肽分离与鉴定
使用连接到Agilent 1260 Infinity HPLC-Chip / MS系统(加利福尼亚州圣克拉拉的安捷伦科技公司)的高性能芯片(芯片ID : G4240–62030)分析样品(每个5 µL )。据报道41,来自HPLC-Chip系统的带电肽直接注入质谱仪中进行检测。
光谱分析,蛋白质数据库搜索和相对定量
使用Agilent Mass Hunter软件(Mass Hunter定性分析B.08.00 Service Pack 1(SP1))进行数据采集和总离子色谱图的分析。蛋白质搜索是使用Morpheus软件(Howell,MI)参考人类蛋白质组数据库22进行的。手动分析每个色谱图的总质谱图,以进行准确鉴定。蛋白质数据分析:对差异表达的蛋白质进行途径富集,蛋白质-蛋白质相互作用(PPI)分析和基因本体论(GO)分析。使用DAVID(对于进行的分析d atabase为一个 nnotation,v isualization和我 ntegrated discovery)生物信息学资源6.8 42,43和参与分子功能富集(MF),细胞成分的富集(CC),生物过程富集(BP),并且基因和基因组的京都百科全书(KEGG)途径富集。报告重大调制的网络节点使用蛋白质数据集44。使用检索互作基因/蛋白质(STRING / P)数据库(10.5版)的搜索工具分析了蛋白质-蛋白质相互作用(PPI)。
微管蛋白的纯化
PEM缓冲液(50 mM管道,3 mM MgSO4、1 mM EGTA,pH 6.8)用于通过温度和GTP依赖的多次聚合和解聚循环从山羊脑中分离和纯化微管蛋白,据报道38并保持在-80 ℃。
色氨酸猝灭测定
在不存在或存在T-GNP(500 µg / mL)的情况下,在水循环浴中(35°C; 45分钟)孵育微管蛋白(2μM)。孵育后,样品在295 nm处激发,并获得310 nm–400 nm范围内的发射光谱。通过FluorEssence 3.5软件支持的FlouroMax®4荧光分光光度计(堀场科学,爱迪生,NJ)被用于荧光法滴定45。
活性氧的测量
细胞(5×10 4细胞/ mL),在12孔板中生长,并用T-GNP(130 µg / mL或260 µg / mL),H 2 O 2(400 µM)或N-乙酰基处理半胱氨酸(NAC,16.3 µg / mL)与DCFH-DA(2.4 mg / mL)孵育后,检查了ROS生成的证据,如先前报道[ 46]。使用Nikon Eclipse 90i荧光显微镜测量DCF荧光的强度,并使用Image J软件分析图像。使用Image J软件定量对应于ROS水平的荧光强度。计数至少200个细胞,并记录和计算其荧光强度。
校正了总细胞荧光(CTCF)。
线粒体膜电位分析
用T-GNP(130 µg / mL或260 µg / mL)处理在12孔板中聚L-赖氨酸包被的盖玻片上生长的细胞(5×10 4个细胞/ mL),并进行可视化以寻找证据如前所述47使用若丹明123线粒体膜电位的损失。
统计分析
值表示为平均值±标准偏差(SD)。使用GraphPad Instat软件(加利福尼亚州圣地亚哥)使用单向方差分析(ANOVA)进行统计分析。如果p值<0.05,则认为该值具有统计学意义。
资料可用性
在当前研究期间生成和/或分析的数据集可根据合理要求从通讯作者处获得。
|
|