调查和恢复患者突变型RPEs的BEST1活性
调查和恢复患者突变型RPEs的BEST1活性
摘要
将Best1是CA 2+ -活化氯-信道在视网膜色素上皮细胞(RPE)中表达,并且在超过250遗传突变将Best1基因已被鉴定,以使通常称为bestrophinopathies视网膜退行性疾病。由于大多数BEST1突变是常染色体显性遗传,因此确定其致病机制和基因治疗的治疗潜力具有重要的生物医学意义。在这里,我们的特点六个最佳卵黄样黄斑营养不良(BVMD)相关将Best1显性突变通过记录患者的表型,研究内生将Best1的亚细胞定位和表面的Ca 2+依赖氯-源自患者的RPE中的电流,并分析这些突变对HEK293细胞中BEST1的功能影响。我们发现,所有6个突变是具有不同水平和类型的缺陷失功能,并且进一步证实Ca的恢复2+依赖性氯-由WT电流在患者来源的RPE细胞将Best1基因补充。重要的是,BEST1显性和隐性突变都可以通过腺相关病毒(AAV)进行基因增强而以相似的功效被挽救,从而为治愈绝大部分的石棉病提供了概念验证。
介绍
人类的基因突变将Best1基因引起bestrophinopathies,其由视网膜变性病症,包括最佳卵黄状黄斑营养不良(BVMD)的光谱的1,2,常染色体隐性bestrophinopathy(ARB)3,成年发病的卵黄状营养不良(AVMD)4,5,常染色体显性遗传性玻璃体脉络膜病变(ADVIRC)6和色素性视网膜炎(RP)7。BVMD是最常见的骨质疏松症,其特征是中心性黄斑变性的早期发作和使人衰弱的形式。由于RPE和感光器外部部分8之间的流体和/或电解质动态平衡异常,这种疾病导致形成浆液性视网膜脱离,并形成类似于蛋黄或玻璃状的病变,而视杆和视锥光感受器的功能仍不受影响。除ARB以外的所有类型的雌激素病均源于BEST1的常染色体显性突变。患者容易遭受不可治愈的进行性视力丧失,这会严重影响生活质量。因此,了解BEST1致病突变的机制和恢复受损细胞功能的设计策略对于开发对虫病的治疗方法至关重要。
由编码的蛋白质将Best1基因是C -信道命名BESTROPHIN1(将Best1),其响应于细胞内Ca激活2+和传导的Ca 2+ -依赖性氯-对细胞膜视网膜色素上皮(RPE)的当前1,2,9,10。一致的是,钙2+依赖性氯-当前已经提出,以产生在曝光时的关键视觉响应,即光峰(LP)11,12,13,这是在几乎所有的缺陷将Best1如图电图(EOG)-mutated患者14,15。这BEST1-氯-电流- LP相关性表明基因作为补充固化bestrophinopathies有前途的方法。事实上,我们报道了受损氯-当前在RPE从ARB患者轴承派生将Best1隐性突变是由杆状病毒(BV)的WT的介导的补充rescuable 将Best1基因9。此外,最近在犬模型中的研究表明,BEST1隐性突变引起的视网膜异常可以通过腺相关病毒(AAV)介导的视网膜下BEST1基因增强来纠正。16。然而,基因扩增对 BEST1显性突变的挽救功效仍然未知。这是一个非常重要的问题,因为首先,大多数 BEST1突变是显性的,其次,它将确定在治疗干预中是否需要破坏/抑制显性突变的等位基因。原则上,WT BEST1的过量可能使突变体BEST1不知所措,尽管后者以1:1的比例比前者占优势。由于犬没有将Best1显性突变基因型同时将Best1基因敲除小鼠没有表现出任何的视网膜表型或Cl -电流异常 17,18,患者衍生的RPE提供了更相关的模型来测试BEST1显性突变的挽救。
在这里,我们使用临床检查,患者衍生的RPE,电生理记录和结构分析了BVMD患者的六个BEST1显性突变,即p.A10T,p.R218H,p.L234P,p.A243T,p.Q293K和p.D302A。楷模。我们的结果表明,这些突变都是功能丧失,通道活性完全或部分缺失,而其中一些影响BEST1 的亚细胞定位和/或Ca 2+敏感性。值得注意的是,有缺陷的Ca 2+ -依赖性氯-电流在患者来源的RPE细胞通过WT的病毒介导的补充恢复将Best1以时间和剂量依赖的方式的基因。此外,BEST1的显性和隐性突变它们可以相似的功效被拯救,并且BV和AAV都可以用作基因递送的载体。在一起,我们的发现强调了基因增强疗法在治疗骨虫病中的巨大潜力,包括由BEST1显性突变引起的那些。
结果
六例具有不同BEST1突变的BVMD患者的视网膜表型
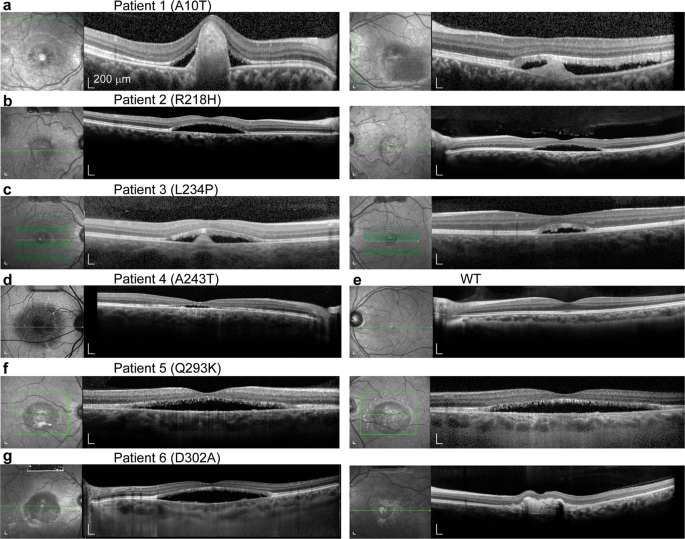
我们检查了来自无关家庭的六名BVMD患者。在所有六名患者中均发现了普遍的视网膜功能障碍。眼底自发荧光成像和光学相干断层扫描(OCT)显示位于视网膜下间隙的玻璃状病变,以及黄斑区的浆液性视网膜脱离和囊性液(图 1和补充图 S1)。不同于BEST1隐性患者,其视网膜电图(ERG)和EOG结果与野生型人群9明显不同,BVMD患者显示正常的ERG但异常的EOG结果(补充图 S2)19。
患者1,一个6岁,健康的女孩,杂合c.28 G> A;p.A10T突变显示右眼和左眼分别在20/80和20/125的视敏度降低(表 1)。在两只眼睛的黄斑中观察到大面积,大规模的玻璃状病变,并且在眼底自发荧光成像中表现出低自发荧光。右黄斑视网膜下纤维化。OCT揭示了两只眼睛的视网膜脱离,在玻璃状病灶的中央出现了纤维化的丘块,并且异常,细长的感光细胞外段。还从两只眼睛的OCT中观察到了视网膜内液(图 1a和补充图 S1)。)。患者2,一个52岁,其他年龄健康的人,杂合子c.653 G> A;p.R218H突变在右眼和左眼分别显示出20/100和20/50的视敏度降低(表 1)。OCT在每只眼睛中检测到薄薄的感光层,广泛的视网膜下浆液和可能的玻璃状病变(图 1b和补充图 S1)。患者3:一个7岁,其他健康的男孩,杂合c.701 T> C;p.L234P突变显示两只眼睛的视敏度降低(20/25 )(表 1)。彩色眼底图片和OCT显示在双眼的黄斑区域有标准的边界清除的淡黄色玻璃状病变,以及视网膜下浆液和视网膜外段碎片(图 1c)。和补充图 S1)。患者4,一名61岁其他健康的女性,杂合c.728 G> A;p.A243T突变显示右眼20/100视力下降(表 1)。没有记录到她的左眼的数据,该左眼由于先前有异物眼内损伤而没有光感。她的右眼的玻璃状物质在眼底自发荧光成像中显示出超自发荧光,并通过OCT在黄斑区域检测到(图 1d和补充图 S1)。她的EOG测试包括嘈杂的背景,并且两只眼睛的光上升都减少了(补充图 S2)。患者5,一个44岁,其他年龄健康的人,杂合子c.877 C> A;p.Q293K突变显示两只眼睛的视力降低(20/50 )(表 1)。在两个黄斑区均观察到淡黄色的视网膜下玻璃状沉积物的超自发荧光(图 1f和补充图 S1)。EOG结果显示出光上升损失(补充图 S2)。患者6是一个19岁的健康人,杂合子c.905 A>C。p.D302A突变,其最佳矫正视力未知(表 1)。在两个黄斑区域均发现了具有自发荧光,浆液性视网膜脱离和囊性液的粉状病变(图 1g和补充图 S1)。)。
BEST1显性突变削弱BEST1的通道活性
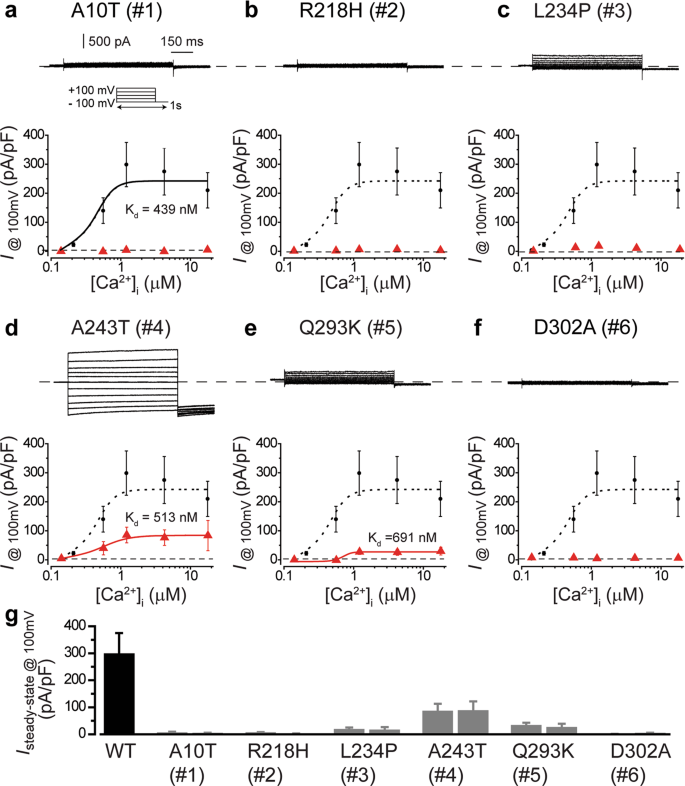
为了测试将Best1通道活性突变的影响,WT和六个突变体将Best1通道被单独引入到HEK293细胞中,其不具有任何内源性的Ca 2+ -活化氯-质膜上(图通道 2a中)9。在1.2μM[Ca 2+ ] i下,表达BEST1突变体的HEK293细胞显示出比WT小得多的电流(图 2a和补充图 S3),其中表达WT BEST1的细胞的峰值电流振幅为20。特别是,五个突变体(A10T,R218H,L234P,Q293K和D302A)产生的电流很小,与未转染的细胞没有显着差异(图5)。 参见图2a和补充图 S3),而A243T突变体进行的稳健电流显着大于未转染细胞的稳健电流,但显着小于WT BEST1的稳健电流(图 2a和补充图 S3)。因此,这六个显性突变导致BEST1通道活性完全或部分丧失。
BEST1突变的致病机制。(a)条形图,显示了在1.2μM[Ca 2+ ] i下 HEK293细胞中瞬时表达的BEST1 WT和突变体在100 mV时的群体稳态电流密度;每个点n = 5–6。* P = 4×10 -5(A10T),7×10 -4(R218H),2×10 -3(L234P),3×10 -2(A243T),2×10 -4(Q293K),2× 10 -3(D302A),与WT相比,分别与#P = 6×10 -4对A243T相比未转染细胞,用双尾非配对Student 吨试验。(b将WT或突变体BEST1-YFP-His与WT BEST1-CFP-Myc共转染至HEK293细胞,并通过直接在细胞裂解液(输入)中或在共免疫沉淀后免疫印迹法进行检测。全长印迹显示在图 S6中。该图中的所有误差棒均代表sem(c)。BEST1五聚体的两个相对朝向(144°)的protomer的带状图显示,其细胞外侧位于顶部。关键残基的侧链为红色。(d)从侧面看,患者突变的位置与通道孔的关系。A10(红色),Q293(绿色)和D302(蓝色)的颜色不同。R218,L234和A243用原子着色。(e)突变残基的可能相互作用。每个单体单元用不同的颜色绘制,突变的残基用洋红色着色。黑色和黄色虚线分别表示配位键和可能的氢键。(f)用H代替R218的效果。洋红色棒显示H218可能的构型,没有空间位阻。每个单体单元用不同的颜色绘制。氢键用黄色虚线表示。(g)更换A243和L234的效果。每个单体单元用不同的颜色绘制,突变的残基用洋红色着色。红色虚线表示可能的范德华接触或位阻。黄色虚线表示可能的氢键。
BEST1显性突变体与野生型相互作用
BEST1频道是五角星。为了测试BEST1单体之间的相互作用是否受任何显性突变的影响,我们在HEK293细胞中过表达了突变的BEST1-YFP-His和WT BEST1-CFP-Myc,然后用抗Myc抗体进行免疫沉淀并用抗His抗体进行免疫印迹和Myc分别。在瞬时转染后,所有六个显性突变体均以与WT BEST1相似的水平表达,并保留了与WT BEST1的相互作用(图 2b)。
BEST1突变的结构影响
寻求的功能结果的结构基础,我们分析了来自鸡bestrophin1(cBEST1)(图的结构所产生的将Best1同源性模型 图2c,d)9,21,22,23,其具有与将Best1 74%的序列同一性。在该模型中,A10,Q293和D302位于N末端的Ca 2+结合位点或S4a和S4b之间(图 2c,d)。预测A10T和Q293K突变会削弱Ca 2+的结合,这由Ca 2+ -clasp 的酸性侧链和A10和Q293的主链羰基氧(图2e)协调 21:A10T突变可能与周围残基(包括Ca 2+配体之一N296)形成额外的氢键;用赖氨酸残基取代Q293将形成新的相互作用,包括与G26形成氢键以及与Ca 2+结合环上的D303发生静电相互作用。由于D303与相邻分子的跨膜螺旋S3b上的L234形成氢键,其含有控制通道门控的残基,因此Q293K突变似乎也对通道门控有间接影响。D302A突变可将羧基环中的负残基改变为疏水残基,从而可能削弱Ca 2+与通道的结合(图 2e)。此外,这种突变可能会使Ca不稳定2+结合环,因为它可能消除了与G26的氢键和与K30的静电相互作用。因此,A10T,Q293K和D302A突变可以通过减少钙通道禁止激活2+结合,这是绝对需要将Best1传导电流9,24。
R218是局部上的α螺旋的S3a(图 2c中,d),其落在推定氯- (图中的信道内腔结合位点 2F)21。因此,R218H突变可能会降低渗透孔中阴离子的局部浓度,从而破坏通道活性。与R218相比,R218H突变体的模型结构还预测H218的灵活性更高,因为组氨酸的侧链较小。此外,H218与其自身的羰基O原子缺少氢键,并且与R218相比,其位置可能更靠近相邻分子上的D104。因此,R218H突变体可能会破坏局部结构的稳定性并削弱单体之间的相互作用。
L234和A243被定位于跨膜α螺旋S3b中(图 2c中,d),其包含多个残基(例如P233和Y236)为通道门控(图临界 2克)25,26。实际上,模型结构预测L234P突变不能与相邻分子的D303形成氢键,而A243T突变可能与同一分子中的I78和相邻分子的F283具有空间位阻(图 2g)。而且,由于连续的脯氨酸残基,L234P突变体在突变位点附近可能具有高度柔性的结构。
参与Ca 2+结合的残基突变破坏BEST1的膜定位
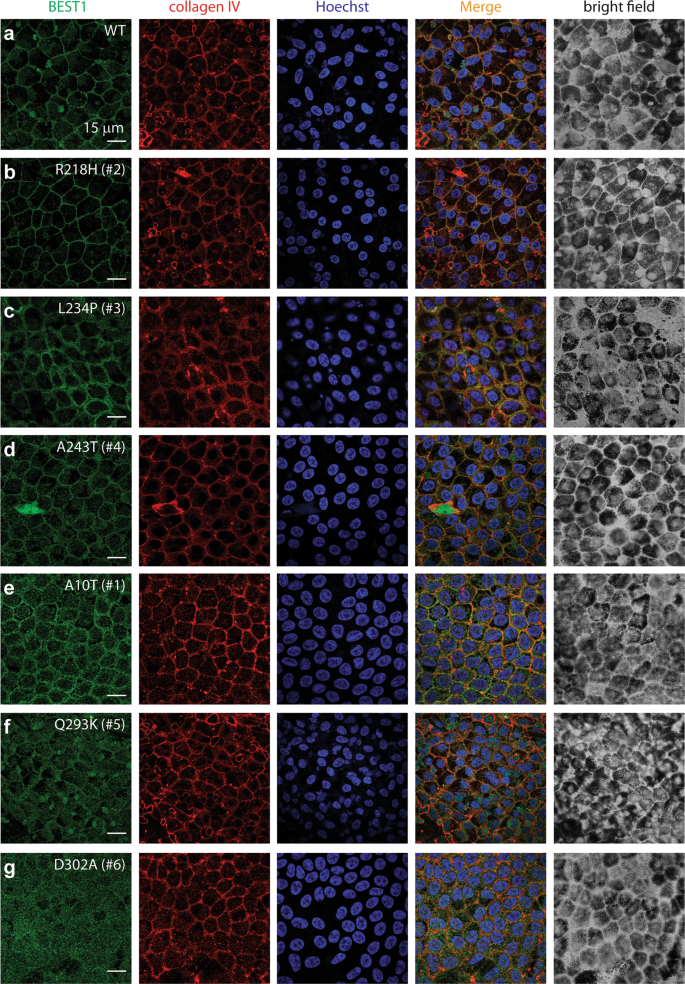
为了直接检查这六个患者特异性BEST1显性突变的生理影响,从患者的皮肤细胞中重新编程了诱导多能干细胞(iPSC),然后分化为RPE细胞(iPSC-RPEs)27。细胞的RPE状态通过包括细胞内色素和六边形的形态特征被证实(图 3)。RPE65特异性标记蛋白RPE65(视网膜色素上皮特异性65 kDa蛋白)和CRALBP(细胞视黄醛结合蛋白)在源自BEST1 WT供体和患者的iPSC- RPEs中表达良好(如免疫印迹所示)(补充图 S4)),确认所有iPSC-RPE的成熟状态。此外,与源自BEST1 WT供体的iPSC-RPE相比,来自患者的所有六种iPSC-RPE均显示出相似的总体BEST1表达水平(补充图 S4),表明这六个突变均未损害其整体蛋白表达。这个频道。
然后,我们通过免疫染色检查了iPSC-RPE中BEST1的亚细胞定位。R218H,L234P和A243T像WT一样在质膜上显示正常的BEST1信号(图 3a–d)。相比之下,参与Ca 2+结合的所有三个残基突变均显示BEST1的膜靶向不足:D302A具有最强的表型,质膜上BEST1抗体染色信号完全丧失,而A10T和Q293K均部分丧失膜BEST1的定位(图 3e–g)。一致地,免疫印迹显示细胞膜上的A10T,Q293K和D302A突变蛋白水平降低(补充图 S4)。
缺乏钙2+依赖氯-在iPSC的的RPE电流承载将Best1显性突变
为了阐明在将Best1的生理活性突变的影响,我们测量的Ca 2+ -依赖性氯-在通过全细胞膜片钳的患者来源的iPSC-的RPE电流(图 4A-F 。和补充图 S5) 。值得注意的是,在所有测试的[Ca 2+ ] i中,在A10T,R218H和D302A患者来源的iPSC-RPE中检测到微小电流(<6 pA / pF)(图 4a,b,f和补充图 S5)。),表明这些突变体中BEST1通道活性完全丧失。另一方面,在来自患者的L234P,A243T和Q293K iPSC-RPE中检测到了强劲的电流,但与使用WT BEST1的iPSC-RPE相比,电流幅度明显降低了(图 4c-e和补充图。 S5),表明部分功能丧失。此外,由于来自A243T和Q293K iPSC-RPE的电流足够大,可以拟合Hill方程,因此可以计算出它们的Ca 2+敏感性:与来自WT iPSC-RPE的电流相比(K d = 439 nM),Ca 2 + -sensitivity在A243T的iPSC-RPE正常(K d = 513纳米),但在Q293K的iPSC-RPE显著右移(K d =691nM ,图 4d,e),与其中Ca 2+结合涉及Q293而不参与A243的结构模型一致(图 2c)。L234P不会影响Ca 2+敏感性,因为L234位于Ca 2+环的外部(图 2c)。对于每个突变,从两个克隆的iPSC-的RPE(图获得了类似的结果电 4克),这表明在钙所观察到的缺陷2+依赖性氯-当前是突变特异性的。
表面的Ca 2+ -依赖性氯-在源自患者的iPSC的的RPE电流。(一)的Ca 2+ -依赖性氯-电流通过全细胞膜片钳在源自患者的iPSC的的RPE轴承A10T的突变测定。顶部,代表性的电流迹线记录为1.2μM[Ca 2+ ] i。插图,用于引发电流的电压协议。底部,与WT(•)相比,Ca 2+依赖性电流密度,每个点n = 5-6。WT曲线拟合到Hill方程。(b - ˚F)的Ca 2+ -依赖性氯-全细胞膜片钳测量的电流分别来自患者衍生的iPSC-RPEs ,这些iPSC-RPEs分别带有R218H(b),L234P(c),A243T(d),Q293K(e)和D302A(f)突变。顶部,代表性的电流迹线记录为1.2μM[Ca 2+ ] i。底部,与WT(•)相比,Ca 2+依赖性电流密度,每个点n = 5–6。将WT,A234T和Q293K图拟合到希尔方程。(g)在1.2μM[Ca 2+ ] i下具有WT或突变体BEST1的iPSC-RPEs中电流密度的比较,n = 5–6。每个患者有两个克隆iPSC-RPE。黑色,WT。灰色,耐心。该图中的所有误差线均表示sem
综上所述,我们的结果表明,这项工作中分析的六个突变可以根据它们的表型分为两个不同的组:完全丧失功能(A10T,R218H和D302A)和正常丧失部分功能(A243T和L234P)或(Q293K)Ca 2+敏感性降低。
通过基因补充挽救BEST1显性突变
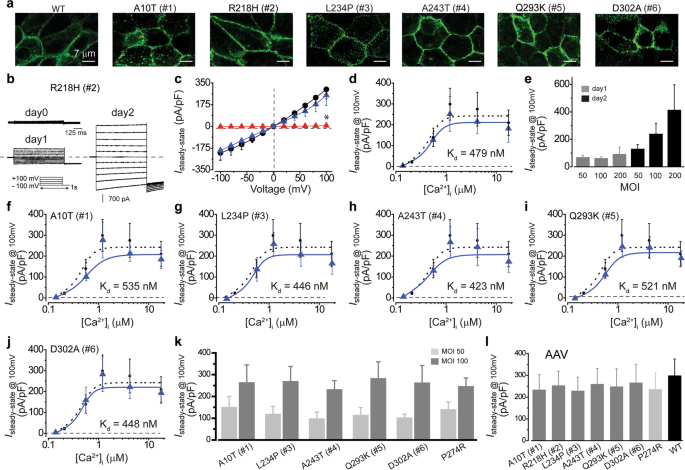
我们以前报道,有缺陷的Ca 2+ -依赖性氯-携带隐性患者来源的iPSC-的RPE电流将Best1的突变可通过杆状病毒(BV)的WT的介导的补充被营救将Best1基因9。为了研究如果CA 2+依赖氯-电流在iPSC的的RPE轴承rescuable 将Best1显性突变,WT将Best1-GFP从六种来自患者的iPSC的一个的RPE BV载体表达。共聚焦成像证实,WT BEST1-GFP位于所有六个患者来源的iPSC-RPE的质膜上(图 5a)),包括A10T,Q293K和D302A iPSC-RPE,其中内源性BEST1的膜定位受到不同程度的损害(图 3)。
通过WT BEST1补充来挽救患者来源的iPSC-RPE。(a)共聚焦图像,显示了来自BacMam病毒的WT BEST1-GFP在供体来源的iPSC-RPEs中的表达。(b)从补充有WT BEST1-GFP的R218H iPSC-RPE(患者#2)以1.2μM[Ca 2+ ] i记录的代表性电流迹线。(c)与未补充R218H(红色三角形)和WT(•)iPSC-RPEs相比,在1.2μM [Ca 2+ ] i下添加WT BEST1-GFP(蓝色三角形)的R218H iPSC-RPE中的电流密度。每个点n = 5–6。* 与WT相比,P = 9×10 -4,使用两尾未配对的Student t检验。(d)与WT(•)iPSC-RPE相比,补充了WT BEST1-GFP(蓝色三角形)的R218H iPSC-RPE中Ca 2+依赖性电流密度。在+ 100 mV处记录的稳态电流密度与游离[Ca 2+ ] i的关系图;每个点n = 5–6。地块符合希尔方程。(e)在R218H iPSC-RPE的第二个克隆中以1.2μM [Ca 2+ ] i的电流密度补充了不同剂量的BacMam病毒WT BEST1-GFP。每个点n = 5–6。(f–j)带有A10T(f),L234P(g)突变的患者来源的iPSC-RPE中Ca 2+依赖性电流密度),A243T(h),Q293K(i)和D302A(j),并附加WT BEST1-GFP(蓝色三角形),与WT(•)iPSC-RPE相比,每个点n = 5–6。地块符合希尔方程。(k)5个BEST1显性iPSC-RPEs的第二个克隆和隐性P274R iPSC-RPE的克隆中的电流密度为1.2μM [Ca 2+ ] i,当日补充了不同剂量的BacMam病毒的WT BEST1-GFP 2.(i)在来自患者的iPSC-RPEs中添加了WT BEST1的AAV2病毒在1.2μM [Ca 2+ ] i下的电流密度。该图中的所有误差线均表示sem
对于电生理分析,我们首先利用携带BEST1 R218H突变的iPSC-RPE优化病毒感染的时程和MOI,因为R218H是内源性BEST1的正常膜定位的无效突变,代表具有强表型的“干净”情况。的Ca 2+ -依赖性氯-电流在1.2μM测量的[Ca 2+ ] 我通过全细胞膜片钳从24至48小时显著增加,并且在感染后48小时一个剂量依赖的方式(图 5B-E)。的氯的完整救援-在峰值电流的[Ca 2+ ] 我在感染后48小时观察到最小100(图的MOI。 5C-E和补充图 S5),其中的Ca 2+ -依赖性氯-电流在全范围内的的[Ca 2+ ] 我小号也完全恢复(图 5D)。一致的是,钙2+依赖性氯-电流在其他五个源自患者的iPSC的的RPE均救出到相同的条件下(图下相似的水平 5F-K内源),而不管缺陷的类型或级别的BEST1功能。免疫印迹结果表明,外源BEST1的表达水平与内源BEST1的表达水平相当(补充图 S4)。
另外,Ca的救援功效2+依赖性氯-轴承将Best1显性突变电流在iPSC的的RPE是比得上在先前报道的iPSC-RPE与隐性P274R突变(图 5K)9。总之,我们的结论是,Ca的缺陷2+依赖性氯-引起的电导将Best1丧失功能的突变,无论是显性或隐性,是rescuable由WT的BV介导的补充将Best1基因具有相同的剂量和时间课程。
为了测试已被批准用于人类视网膜28基因治疗的腺相关病毒(AAV)是否可以介导BEST1的补充,我们用表达BEST-1-T2A-的AAV血清型2(AAV2)病毒载体感染了iPSC-RPE。 GFP。与来自BV介导的扩增的结果一致,钙2+依赖性氯-电流是AAV感染的iPSC-的RPE轴承或者是显性或隐性之后恢复将Best1突变(图 5I为固化),提供了证明的概念通过AAV介导的基因扩增,在显性和隐性病例中,BEST1相关的视网膜变性疾病。
讨论区
在这里,我们在跨学科平台上全面检查了来自BVMD患者的六个BEST1占主导地位的致病突变(A10T,R218H,L234P,A243T,Q293K和D302A),包括具有患者衍生的iPSC-RPE和HEK293细胞表达的全细胞膜片钳突变体通道,iPSC-RPEs中内源性BEST1的免疫检测,人类同源性模型的结构分析以及病毒介导的BEST1基因补充。总的来说,我们的结果说明在视网膜色素上皮表面钙这六个显性突变的生理影响2+依赖氯-当前和BEST1通道功能,提供有关其致病机制的结构见解,并通过基因补充展示了iPSC-RPE中BEST1功能的拯救。值得注意的是,减小的Ca 2+ -依赖性氯-在R218H,L234P和A243T患者来源的iPSC-的RPE电流在与所述缺陷的Ca协议2+刺激的氯-经Cl所示分泌-在这些细胞敏感的荧光染料29。
以前,我们报道了受损的Ca 2+ -依赖性氯-在从患者ARB轴承衍生的iPSC-RPE电流将Best1隐性突变(P274R)是由WT将Best1的BV介导的补充rescuable 9。在这里,我们发现了同样的策略,既BV和AAV2,可普遍应用于恢复的Ca 2+依赖氯-电流受损将Best1丧失功能的显性突变,它可以细分为空(如A10T,R218H和D302A)和部分缺陷,而Ca 2+敏感性不受影响(例如L234P和A243T)或转移(例如Q293K)。我们的结果为临床应用提供了概念验证。BEST1基因扩增,但仍需要进一步优化:由于其强大的佐剂活性30,BV尚未被批准用于人体治疗,而其他AAV血清型(例如AAV5和AAV8)的转导效率也有待研究31。
在过去的20年中,视网膜一直是转化基因治疗的前沿领域。最近,第一基因治疗药物,携带的正确拷贝的基于AAV的载体RPE65基因,被用于治疗视网膜变性莱伯先天性黑蒙2型(LCA2),这是由隐性突变引起FDA批准RPE65 28,32,33,34,35。作为另一种明显与单个基因突变相关的遗传性视网膜疾病,最佳脊椎病是基因治疗的一个有吸引力的目标。但是,由于绝大多数已知的BEST1突变是常染色体显性遗传的,在治疗干预期间是否应有目的地抑制显性突变等位基因仍然是一个关键问题。我们的研究结果表明,病毒介导的WT将Best1基因补充恢复减弱的Ca 2+依赖性氯-患者衍生iPSC的的RPE电流以相同的剂量和时间依赖性功效不管突变型(显性隐性对比)或缺陷水平(零位还是部分水平),提供了第一批证据,表明BEST1显性突变可通过WT基因扩增而得到挽救,而无需破坏/抑制突变等位基因。与我们的发现一致,Sinha 等人的预印本。显示另外两个BEST1显性突变,即R218C和N296H,可以通过慢病毒介导的iPSC-RPE细胞36中的基因扩增来挽救。有趣的是,该报告中的第三个显性突变A164K对基因扩增没有反应,这可能归因于作者提出的结构不稳定36。尽管如此,由于AAV介导的视网膜下将Best1基因增强疗法已经成功地在狗倒车临床检测视网膜病变和弥漫性microdetachments 将Best1隐性突变模型16,我们预测相同的策略可以应用到治疗的患者无论是显性或隐性将Best1突变只要突变导致功能丧失。
我们最近发现了几个功能获得性突变(例如D203A,I205T和Y236C),这些突变显着增强了BEST1通道的活性25。从机理上讲,这些突变在两个依赖Ca 2+的门上失调了BEST1的门控,从而导致通道开口增加25。尽管尚不清楚BEST1活性升高的病理基础,但我们推测除补充WT BEST1之外,还可能需要敲除或敲除功能获得突变体等位基因在这些情况下可恢复正常的BEST1活性的基因。然而,由于无法获得带有功能获得突变的患者源RPE,因此尚不清楚内源BEST1蛋白水平是否受到这些突变的负面影响。然而,确定患者源性突变是导致功能丧失还是获得功能,对于设计治疗策略至关重要。
与我们之前的报告将Best1负责钙通道一致2+依赖氯-在RPE电流9,在HEK293细胞中异源表达将Best1突变体的通道活性普遍反映钙的完整性2+依赖氯-上的电流相应的患者衍生的iPSC-RPE的质膜(图 2和4)。尽管在HEK293细胞中WT和突变通道的异源表达是BEST1功能研究的一种标准且功能强大的方法,但我们注意到两个主要局限性:首先,瞬时转染BEST1的HEK293细胞的电流密度明显小于RPE细胞的电流密度。 ; 其次,钙2+在HEK293细胞将Best1介导的电流的-sensitivity左移相比于的RPE 9,37。这些差异是可能的两种细胞类型之间的内在差异的结果,而不是将Best1的外源与内源表达,作为CA 2+ -依赖性氯-患者来源的iPSC-RPEs中补充的WT BEST1-GFP产生的电流与WT iPSC-RPE中的内源性BEST1产生的电流密度和Ca 2+敏感性非常相似(图 4和5)9。我们推测,有BEST1的RPE特定的促进因素。
预测参与Ca 2+结合的残基中的所有三个突变在iPSC-RPE中内源性BEST1的膜靶向中均表现出不足,这表明可以通过Ca 2+结合来促进BEST1的膜运输。但是,先前对瞬时转染的HEK293细胞的研究表明,Ca 2+环附近的突变(N296L,E300Q,D301N,D302N,D303L,D304N,E306Q和N308D)不会影响通道运输37。这种差异可能归因于这些作品中不同的细胞类型和/或突变。
总之,我们分析了6个BEST1显性突变的临床,电生理和结构影响,并在我们所知的第一个方面证明了通过病毒介导的基因扩增在带有显性突变的iPSC-RPE中恢复BEST1功能。重要的是,基因增强疗法在治疗视网膜中其他遗传性疾病方面也具有巨大潜力,例如常染色体显性遗传性色素性视网膜炎(adRP),其可能是由超过25种已知基因(包括RHO和RPE65 38)的突变引起的。RHO是与adRP相关的最常见突变基因。AAV介导的RHO增强部分地拯救视网膜变性在充分表征的R23H转基因小鼠模型39,40,其表现出失功能所证明降低视紫质的水平41,42,43。另一方面,虽然RPE65主要与LCA相关,但其中的D477G突变已与adRP 44关联。杂合RPE65 D477G敲入小鼠表现出降低的异构酶活性和延迟的暗适应45,表明功能丧失的表型。因此,我们的结果提高了固化与RPE65相关的adRP的可能性由FDA批准的AAV-RPE65载体不抑制显性D477G突变等位基因。
方法
人类iPSC的产生
使用CytoTune™-iPS 2.0仙台重编程套件(Thermo Fisher Scientific,A16517),将供体提供的皮肤成纤维细胞重编程为多能干细胞(iPSC)。免疫细胞荧光试验按照先前公布的方案进行,以对iPSC多能性进行评分46。通过检测四种标准的多能性标记物(SSEA4,Tra-1-60,SOX2和Nanog)来表征来自参与该研究的所有受试者的iPSC。通过Hoechst染色检测细胞核。所有iPSC品系每3-6天进行一次传代,同时保持在mTeSR-1培养基中(STEMCELL Technologies,05850)。密切监测形态和核/胞质比,以确保iPSC系的稳定性。将所有iPSC品系通过G带进行核型分析,以验证Cell Line Genetics(美国威斯康星州)的基因组完整性。
iPSC分化为RPE
将iPSC品系在用1:50稀释基质胶(CORNING,356230)预处理的6孔培养皿中培养至汇合。在开始的14天中,分化培养基包括敲除(KO)DMEM(Thermo Fisher Scientific,10829018),15%KO血清替代品(Thermo Fisher Scientific,10829028),2 mM谷氨酰胺(Thermo Fisher Scientific,35050061), 50 U / ml青霉素-链霉素(Thermo Fisher Scientific,10378016),1%非必需氨基酸(Thermo Fisher Scientific,11140050)和10 mM烟酰胺(Sigma-Aldrich,N0636)。在分化的第15–28天,向分化培养基补充了100 ng / ml的人类激活素A(PeproTech,120–14)。从第29天起,再次使用未添加激活素-A的分化培养基,直到分化完成。大约8-10周后,对分散的有色扁平团簇进行格式化,并手动将其挑选到基质胶涂层的培养皿中。如前所述,将这些细胞保存在RPE培养基中47。培养需要另外6-8周的时间才能形成功能性单层膜,然后即可进行功能测定。除了成熟的经典成熟RPE标记(Bestrophin1,CRALBP和RPE65)之外,还使用了另外两个标记(PAX6和MITF)来验证细胞的RPE命运。该研究中的所有iPSC-RPE细胞均在第1代。DNA测序用于验证突变iPSC-RPEs中的基因组突变。
细胞系
罗切斯特大学的David Yule博士友善地赠送了HEK293细胞。由于HEK293包括在国际细胞系鉴定委员会的常见错误鉴定细胞系列表中,因此本研究中使用的细胞已通过短串联重复序列(STR)DNA谱图鉴定。测试细胞对支原体污染呈阴性,并在补充有100μg/ ml青霉素-链霉素和10%胎牛血清的DMEM(4.5 g / L葡萄糖,Corning 10013CV)中培养。
电生理学
使用由Patchmaster(HEKA)控制的EPC10膜片钳放大器(HEKA Electronics),在RPE细胞分裂或HEK293细胞转染后24-72小时进行全细胞记录。1.5毫米薄壁玻璃用灯丝(WPI Instruments)上进行拉动并构造用于微量,和填充有含有(以mM计)的内部溶液:130氯化铯,10 EGTA,1的MgCl 2,2 MgATP(新鲜添加),10个HEPES( pH 7.4(通过CsOH调节)和CaCl 2以获得所需的游离Ca 2+浓度(maxchelator.stanford.edu/CaMgATPEGTA-TS.htm)。串联电阻通常为1.5–2.5MΩ。没有电子串联电阻补偿。包含的外部溶液(以mM为单位):140 NaCl,15葡萄糖,5 KCl,2 CaCl 2,1 MgCl 2和10种HEPES(pH 7.4,用NaOH调节)。溶液的摩尔渗透压浓度在310到315之间。使用一系列的阶跃电位(从0 mV的保持电位从−100到+ 100 mV)生成IV曲线。电流以25 kHz采样并以5或10 kHz滤波。以4 s 48的重复间隔获取痕迹。本研究中的所有实验均在环境温度(23±2°C)下进行。
免疫印迹分析
用具有蛋白酶抑制剂(Roche,04693159001)的M-PER哺乳动物蛋白提取试剂(Thermo Fisher Scientific,78501)或Mem-PER Plus膜蛋白提取试剂盒(Thermo Fisher Scientific,89842)提取细胞沉淀。由Bio-Rad蛋白质读取器定量。在95°C下变性5分钟后,将样品(20μg)在室温下以4%至15%的梯度SDS-PAGE凝胶电泳,并在4°C下湿法转移至硝酸纤维素膜上。将膜在含有5%(w / v)脱脂牛奶的封闭缓冲液中于室温孵育1小时,然后在4°C下在补充了一级抗体的封闭缓冲液中孵育过夜。针对以下蛋白质的一抗用于免疫印迹:CRALBP(1:500 Abcam,ab15051),RPE65(1:1,000 Novus Biologicals,NB100-355),β-肌动蛋白(1:2,000 Abcam,ab8227),BESTROPHIN-1(1:500 Novus Biologicals,NB300-164),His(1:1,000 Fisher Scientific,PA1983B)和Myc(1:1,000 Fisher Scientific ,PA1981)。使用荧光团偶联的小鼠和兔二抗(分别为LI-COR Biosciences,925-68070和925-32213),其浓度为1:10,000,室温下孵育时间为1 h,然后进行红外成像。
免疫沉淀
使用PolyJet™ 体外,以1:1的比例将在6厘米培养皿上培养的HEK293细胞与pBacman-BEST1(WT)-CFP-myc和pBacman-BEST1(突变或WT)-YFP-His共转染。遵循制造商的标准规程的DNA转染试剂(SignaGen Laboratories,SL100688)。48小时后,通过在室温下以1000×g离心5分钟来收获细胞。将细胞沉淀在预冷的裂解缓冲液(150 mM NaCl,50 mM Tris,0.5%IGEPAL®CA-630,pH 7.4)中溶解,在冰上溶解30分钟,然后在80°C下离心在4°C下以13,000 rpm的转速运转12分钟。收集上清液(300μg),并与2μgMyc单克隆抗体(Thermo Fisher Scientific,MA1-980)混合。在4°C旋转过夜后,将混合物与Dynabeads M-280绵羊抗小鼠IgG(Thermo Fisher Scientific,11202D)在4°C孵育5小时。彻底洗涤珠子后,将结合的级分洗脱到1x SDS样品缓冲液(Biorad,1610747)在75°C下加热10分钟。然后通过SDS-PAGE解析蛋白质,并通过免疫印迹进行分析。
免疫荧光
将盖玻片上培养的RPE细胞用PBS洗涤两次,并在室温下于4%蔗糖和4%多聚甲醛中固定45分钟。将固定的细胞在室温下在含有0.25%Triton X-100的PBS中透化10分钟。为了封闭非特异性结合位点,将样品与含有5%BSA的PBS在室温下孵育1小时。一抗按照如下方法在封闭溶液中稀释:小鼠抗白蛋白1(Novus Biologicals,NB300-164),1:1000; 兔抗胶原IV(Abcam,ab6586),1:500。将样品与一抗在封闭溶液中于4°C孵育过夜。第二天,将样品用PBS洗涤三次。然后,将Alexa Fluor 488偶联的驴抗小鼠IgG(Thermo Fisher Scientific,A-21202)和Alexa Fluor 647共轭驴抗兔IgG(Thermo Fisher Scientific,A-31573)在封闭溶液中稀释,并在室温下与细胞孵育1小时。未结合的二抗用PBS洗涤三次。然后在室温下将样品与在PBS中稀释至1μg/ ml的Hoechst 33342孵育10分钟。彻底清洗后,将盖玻片固定在ProLong Diamond防褪色固定剂(Thermo Fisher Scientific,P36966)上。使用奥林巴斯激光扫描共聚焦显微镜采集图像,然后在斐济(然后在室温下将样品与在PBS中稀释至1μg/ ml的Hoechst 33342孵育10分钟。彻底清洗后,将盖玻片固定在ProLong Diamond防褪色固定剂(Thermo Fisher Scientific,P36966)上。使用奥林巴斯激光扫描共聚焦显微镜采集图像,然后在斐济(然后在室温下将样品与在PBS中稀释至1μg/ ml的Hoechst 33342孵育10分钟。彻底清洗后,将盖玻片固定在ProLong Diamond防褪色固定剂(Thermo Fisher Scientific,P36966)上。使用奥林巴斯激光扫描共聚焦显微镜采集图像,然后在斐济(https://fiji.sc/)。在斐济,使用滚球法减去背景,半径为50个像素。
病毒
的BacMam杆状病毒轴承将Best1-GFP在内部作出如前所述49,并且在期望的MOI(50-200)加入到RPE培养基。从Applied Biological Materials购买了带有CMV启动子驱动的BEST1-T2A-GFP表达盒的高滴度AAV2病毒(1×10 12 GC / ml)。
分子克隆
使用输液克隆试剂盒(Clontech)通过定点诱变PCR在BEST1中进行点突变。所有构建体均已完全测序。
转染
转染前20–24 h,将HEK293细胞与0.25%胰蛋白酶在室温下孵育5分钟,以提起细胞,然后以50%汇合的方式分成新鲜的3.5 cm培养皿。使用PolyJet转染试剂(SignaGen SL100688)用带有WT BEST1或所需突变体(1μg)的质粒转染HEK293细胞。6-8小时后,移出转染混合物,将细胞用PBS冲洗一次,并在补充的DMEM中培养。转染后24小时,通过胰蛋白酶处理将细胞再次提起,并分裂到涂有纤连蛋白的玻璃盖玻片上,用于膜片钳50。
电生理数据和统计分析
使用Patchmaster(HEKA),Microsoft Excel和Origin,可以离线分析膜片钳数据。使用Origin中的内置功能进行统计分析。为了进行两组之间的比较, 使用Student's t检验确定了均值之间的统计学显着性差异(P <0.05)。数据表示为平均值±标准误差51。
人类BEST1的同源性建模
使用Swiss-Model服务器从鸡肉Best1地壳结构21中生成BEST1的同源性模型。所有数字均使用PyMOL制作。
患者与临床分析
健康对照供体(WT BEST1)和患者(突变BEST1)均由哥伦比亚大学医学中心/纽约长老会医院眼科的视网膜医师进行了全面的眼科检查。这包括眼底镜检查,最佳矫正视力和裂隙灯生物显微镜检查。对患者进行OCT和彩色眼底照相52,53。从健康对照供体和患者那里获得皮肤活检样品,并按照前述方法进行处理和培养46。对于这些程序,所有这些均已获得哥伦比亚大学机构审查委员会(IRB)协议AAAF1849的批准,患者2、4-6和患者1和3的父母/法定监护人均提供了书面知情同意书。所有方法均按照相关法规和指南进行。
资料可用性
经合理要求,可以从通讯作者处获得支持该手稿发现的数据。
|
|