细胞外囊泡(EV)-多酚纳米聚集体,用于基于microRNA的癌症诊断
细胞外囊泡(EV)-多酚纳米聚集体,用于基于microRNA的癌症诊断
摘要
体液中的小细胞外囊泡(EVs),包括外泌体,在基于无创液体活检的癌症诊断中具有重要的应用。当前基于电动汽车的诊断技术仍面临实际挑战,例如电动汽车隔离效率低下。在这里,我们报告了一种高效,无资源的预富集方法,该方法使用多酚生物分子(–)-epigallocatechin-3-gallate(EGCG)来分离和检测人血浆样品中的外泌体microRNA(miRNA)。我们的系统包括三个步骤:(1)EGCG介导的EV聚集,(2)基于过滤器的EV分离,以及(3)EV中目标miRNA的基于分子信标的检测。使用来自胃癌或肝细胞癌癌症患者的血液样本,我们构建了EGCG辅助的miRNA诊断系统。对于这两种癌症,靶标miRNA的水平(miR-21,-27a,和-375)的电动汽车与公众可获取的GEO数据库中的电动汽车密切相关。我们的方法是一种易于使用的方法,用于有效的EV分离和临床样品中miRNA的检测,适用于精密医学中的分子诊断。
介绍
胞外囊泡(电动汽车)为球形双层磷脂囊泡从包含各种生物组分,如RNA,DNA,蛋白质和脂质的细胞释放的1,2,3,4。因此,电动汽车可以提供有关特定癌症的全面信息,例如遗传改变和基因表达模式1。几项研究已经表明,肿瘤衍生的外来体是可以与微创被串行检测重要癌症标记物5,6。尽管它们由微型和纳米工程策略被显著提高7,8,9,10,11,12,13,14,15,16,17,基于外来体的诊断仍然难以满足涉及床边血糖检测(POCT)临床应用的需求 18,这需要一个免费资源的方法,可放心使用,低成本,可靠性和可扩展性。特别是,由于其极低的浓度(<10 9个囊泡),外泌体的临床应用受到与它们的物理特性(即小于100 nm的小尺寸)相关的技术障碍以及测量前需要大量样品制备的限制/ mL血清) 7。因此,显然需要修改现有的外泌体在临床诊断中的利用方法。
多酚的生物分子,包括( - ) -没食子儿茶素-3-没食子酸酯(EGCG),含有许多儿茶酚和通过疏水相互作用,氢键合邻苯三酚官能团影响蛋白结合和聚集,和π-π堆积相互作用19,20,21,22,23,24。多酚对生物分子的强粘合性能25允许收集生物流体(例如全血,血浆,血清和尿液)中的外泌体,以进行诊断和临床评估。最近的一项研究表明,绿茶来源的多酚分子与各向同性的比塞勒脂质膜相互作用。同样地,EGCG与脂膜的表面上的三甲基铵基相互作用的邻苯三酚环21,24,26。基于这种机理多酚的磷脂结合的21,24,26,我们推测多酚分子,包括EGCG,可作为外来体分离/预富集策略为基于液体的活组织检查诊断的一部分。
在这项研究中,我们设计了有效的预富集和分离方法,用于基于外泌体miRNA的癌症诊断。为了实现这一目标,我们采用了一种顺序程序,包括通过粘附到EGCG来富集外泌体(图1a),并通过手动过滤从EGCG /生物流体混合物中收集外泌体聚集体。包括条件培养基(CM)和人血浆样品在内的生物流体中的纳米级外泌体通过EGCG和外泌体之间的牢固相互作用形成了数百个纳米级聚集体(图1b)。)。通过过滤有效地分离了成束的聚集外泌体,并使用分子信标(MB)杂交方法分析了多重外泌体miRNA,以检测和定量癌症生物标志物。然后,我们使用实时逆转录聚合酶链反应(RT-qPCR)分析和比较了miRNA的表达结果。
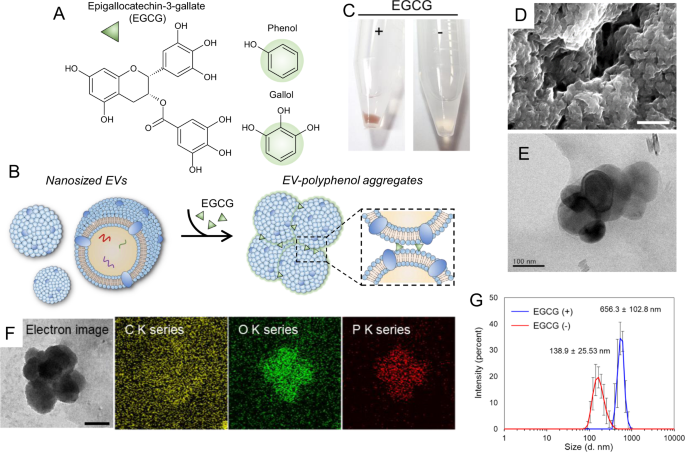
(-)-epigallocatechin-3-gallate(EGCG)(一种多酚生物分子)的化学结构。b EGCG辅助的EV纳米聚集体形成示意图。纳米电动汽车形成了由数百辆电动汽车组成的集合体。EGCG的胆甾醇环与磷脂膜的三甲基铵头基相互作用。c使用(+)和(-)EGCG处理时,在相对较低的离心力(3000 rpm)下从条件培养基(CM)沉淀出EV的光学图像。d纳米聚集体的扫描电子显微镜(SEM)图像(比例尺= 1μm)。e纳米聚集体的透射电子显微镜(TEM)图像。F纳米聚集体的化学组成,通过能量色散X射线光谱(EDS)分析。化学成分包括碳(C,黄色),氧(O,绿色)和磷(P,红色)(比例尺= 100 nm)。g经过EGCG处理的(EGCG +)和未经处理的(EGCG–)电动汽车的尺寸分布。EGCG处理后,电动车的平均直径从〜138 nm增加到656 nm。
材料和方法
胃癌(GC)细胞培养和条件培养基收集
将AGS,MKN-74和Hs746T人GC细胞系在补充有10%胎牛血清(FBS; WelGENE)和1%青霉素/链霉素(P / S; WelGENE)的RPMI 1640(韩国,WelGENE)中培养。SKGT-4细胞,一种人食道腺癌细胞系,也要在补充有10%FBS和1%P / S的RPMI 1640中培养。将HEK293T细胞和人成纤维细胞(hTERT成纤维细胞)用作代表性的正常人细胞,并分别在补充了10%FBS和1%P / S的Dulbecco改良的Eagle培养基(DMEM)和DMEM / F12(WelGENE)中进行培养。补充媒体被视为完整媒体。将细胞在37°C的潮湿培养箱中与5%CO 2一起孵育。为了获得外泌体,将细胞在完全培养基中培养至70-80%融合,然后在无FBS的培养基中再培养48 h(对于HEK293T细胞则为24 h),以最大程度地减少与FBS相关的外泌体的水平。48小时后(对于HEK293T细胞为24小时),收集培养基,并使用450 nm注射器滤膜(Pall Life Sciences,美国)过滤以除去细胞碎片,并保存在4°C下;将该培养基视为条件培养基(CM)。
从癌症患者和健康捐献者制备血浆样品
根据机构审查委员会(IRB)指南,收集来自GC和肝细胞癌(HCC)患者以及健康供体的血浆样品。这项研究已获得延世大学遣散医院的IRB(4-2017-0379)和韩国科学技术高等研究院(KAIST; KH2018-53)的IRB批准。从三名GC患者,三名HCC患者和五名健康供体中获得血浆样品。预计分别在延世大学遣散医院因胃癌或肝癌行胃切除或肝切除术的患者符合这项研究的条件。在手术前一天或手术当天抽取每毫升五毫升全血,并将其放入EDTA管中。通过离心来自健康供体和患者的全血获得至少500μL血浆。
基于绿茶提取物的外泌体分离
使用超纯水(WelGENE)中的1 mg / mL EGCG(Sigma,美国)溶液分离血浆和多种其他细胞系CM的外泌体。将血浆和CM分别以3:1的比例与EGCG溶液合并,在4°C下保持过夜,并在4°C下以3000 rpm离心20分钟。
基于滤波器的EV隔离
为了轻松分离外泌体聚集体,我们使用了无资源且可重复使用的塑料滤纸架(Pall Life Sciences)和膜滤纸(Supor-450; Pall Life Sciences);过滤器支架和膜式过滤器用橡胶O形圈紧密组装。EGCG处理的CM和血浆样品通过组装的滤纸架过滤,并用Dulbecco的磷酸盐缓冲盐水(DPBS)洗涤两次。使用在DPBS中稀释10倍的各种体积的CM(0-10 mL)和血浆样品(500μL)。高压灭菌后将滤纸架重新使用,并将膜滤纸用于后续工作,包括通过RT-qPCR和MB检测外泌体miRNA。
尺寸分布分析
使用Zetasizer仪器(英国Malvern)一式三份确定在有和无EGCG处理的情况下,CM中外泌体聚集体的大小分布。
电子显微镜EV成像
使用场发射扫描电子显微镜(FE-SEM)和场发射-透射电子显微镜(FE-TEM)对分离的外泌体聚集体的微观结构进行成像。在准备进行FE-SEM成像时,将分离的外泌体聚集体用2.5%(v / v)戊二醛(Sigma)固定2小时;然后将固定的样品分别用连续稀释的乙醇(30%,50%,70%,90%,95%,100%和100%)脱水15分钟。将脱水的样品冷冻,真空干燥过夜,并在涂覆薄Pt涂层后直接通过FE-SEM(日本日立)进行观察。在准备进行FE-TEM成像时,将外泌体沉淀重悬于DPBS中两次。然后,我们向Formvar /铜网格(Electron Microscopy Sciences,美国)中添加10μL含外泌体的DPBS溶液,1分钟后,用滤纸吸收除去过量的溶液。然后,用1%磷钨酸溶液(pH 7.5,中性; Sigma)对Formvar /铜网格上的外泌体进行30 s负染色,并通过FE-TEM(JEM-2100F; JEOL,日本)以200的加速电压进行分析千伏。为了确定外泌体聚集体中的化学成分,通常使用带有TEM的K系列进行能量色散X射线光谱(EDS)。
使用MB的合成miRNA检测
荧光标记的MB和合成的miRNA由Macrogen(韩国)合成。MB被设计为靶向miR-21,miR-27a和miR-375。补充表S2显示了MB和合成miRNA的序列。合成的miRNA具有与天然成熟miRNA相似的序列,除了天然miRNA中的尿嘧啶被胸苷代替。
使用MB检测外泌体miRNA
我们将裂解液(DPBS中的1%Triton X-100溶液)直接引入到离心的EV团粒中,然后裂解并与MBs杂交。对于已过滤的电动汽车,将具有MBs的裂解液直接引入1.5 mL微管(1.5 mL TubeOne微量离心管,Starlab)中的滤膜中。为了检测单个外泌体miRNA,将分离的外泌体与200 nM MB的裂解溶液(在DPBS中的1%Triton X-100溶液)在室温(RT)下孵育30分钟。为了检测多重的外泌体miRNA,将溶解溶液中的200 nM MBs(DPBS中的1%Triton X-100溶液)一起在室温下孵育30分钟。使用多模式酶标仪(SpectraMax ID3; Molecular Devices,美国)测量信噪比(S / B)。
外来体聚集体的总RNA提取和RT-qPCR分析
使用TRIzol RNA裂解试剂(美国安邦公司)通过苯酚/氯仿方法从外泌体聚集物中分离总RNA。简而言之,将TRIzol试剂直接引入离心的EV沉淀中,并在滤膜上过滤EV,然后使用氯仿(Sigma)进行相分离。分离出包含RNA的透明相后,通过在–20°C下用异丙醇和糖原处理1 h,沉淀出RNA。然后收集沉淀的RNA,并用70%乙醇洗涤。将干燥的RNA溶解在适量的焦碳酸二乙酯(DEPC)水中(WelGENE)。通过使用SpectraDrop Micro-volume酶标仪(Molecular Devices,USA)测量260 / 280nm处的吸光度来确定总RNA浓度。
RT-qPCR检测
进行了RT-qPCR分析CM和人血浆中的外泌体miRNA。使用miScript RT II试剂盒(Qiagen,德国),用5×HiSpec缓冲液将提取的RNA样品逆转录为cDNA。miR-21,-27a,-375和RNU6B的引物购自Qiagen。将靶miRNA标准化为RNU6B miRNA,用作参考基因。使用miScript SYBR绿色PCR试剂盒(Qiagen)进行RT-PCR扩增成熟的miR-21,-27a和-375,并使用CFX Real-Time系统(美国Bio-Rad)进行测量。
基于GEO数据库的miRNA表达谱分析
我们从在线可访问的GEO数据库中获得了信息,以比较分析GC,HCC和正常细胞中miR-21,-27a和-375的水平。我们从miRNA数据库中选择了GEO号GSE23739和GSE54397作为代表性的GC细胞数据,并选择了GEO号GSE21362和GSE22059作为HCC代表性细胞数据。
EV隔离效率和纯度与商用套件和EGCG的比较
为了比较分离出的电动汽车的效率和纯度,我们针对了外泌体表面标志物(CD9和CD63)和ApoB。我们分析了来自条件培养基和患者血浆的电动汽车。当使用患者血浆时,由于样品量小,我们以相等的体积合并了5个样品。简而言之,在添加了Halt蛋白酶抑制剂混合物的1×RIPA缓冲液(Sigma)(Invitrogen,美国)中提取使用EGCG和市售试剂盒(#1和#2)沉淀的外泌体中的外泌体蛋白。通过Bradford测定法(Bio-Rad)测量提取的蛋白质的浓度。将含有等量蛋白质的提取物上样到15%SDS-PAGE凝胶上,并转移到硝酸纤维素膜上(英国Amersham)。抗CD9,抗CD63和抗Apo B抗体购自Santa Cruz Biotechnology(美国)。将成员与一抗在4°C孵育过夜,并在室温下加入HRP偶联的二抗1 h。白蛋白(最丰富的血浆蛋白)的水平通过Ponceau S(Sigma)染色进行了分析。通过使用ECL Western印迹检测试剂(Invitrogen)检测条带信号,并使用膜成像系统(ImageQuant LAS 4000 mini,GE Healthcare,美国)对膜成像。
统计分析
来自独立实验的标准化值表示为平均值±标准偏差(SD)。使用两尾学生t检验对显着性进行统计学分析,p值用星号(*)表示,如下所示:* p <0.05,** p <0.01,*** p <0.001和**** p <0.0001。所有实验均一式三份进行。
结果
隔离式电动汽车的特性
我们观察到生物流体中的纳米级EV通过EGCG的粘合特性形成了EV聚集束(图1b)。与采用超速离心法(高达1,000,000× g)的EV骨料沉淀不同 ,EV提取的金标准方法27,我们能够使用低得多的离心力(3000 rpm)轻松沉淀EV骨料束(图1c)。为了确定最佳分离条件,我们根据EGCG浓度和处理时间测量了总RNA浓度(图S 1)。为确保在高浓度提取的总RNA时具有更好的性能,最佳的分离条件包括使用1 mg / mL EGCG溶液(图S 1A)在10-12小时的处理时间内(图S 1B)。其他多酚生物分子儿茶素(在50%乙醇中为1 mg / mL),没食子酸(GA,在50%乙醇中为1 mg / mL),鞣酸(TA,在蒸馏水中为1 mg / mL)和柚皮苷( 1 mg / mL的50%乙醇溶液)形成的CM中含有EV的沉淀,其沉淀率高于DPBS,DPBS用作阴性对照(图S 2)。
在使用FE-SEM和HR-TEM检查EV生物粘附纳米聚集体的形态后(图2d,e),我们观察到沉淀的聚集束大小为100-200 nm。电动车呈圆形,带有厚度约为5 nm的薄磷脂双层。我们使用EDS详细分析了化学EV成分,化学图谱显示EV生物粘附纳米聚集体在其磷脂双层中包含磷(红色)(图2f)。EGCG(EGCG(+))处理后的纳米聚集体的平均直径为656.3±102.8 nm,而未经EGCG处理的CM中的纳米聚集体的平均直径为138.9±25.53 nm(EGCG(-),图2g),表明EGCG处理增加了整体纳米聚集体的大小。
通过多酚辅助分离的电动汽车的纯度和分离效率与通过商用套件进行的电动汽车的纯度和分离效率的比较
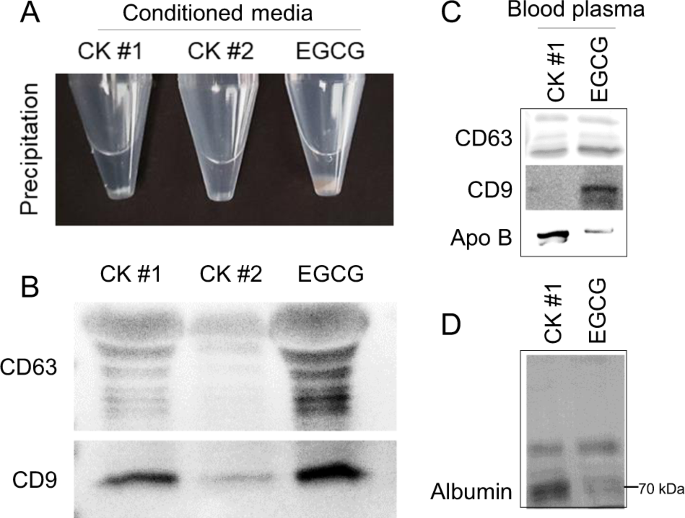
使用市售试剂盒(CKs)中的试剂,将多酚辅助的EV分离与EV分离进行了比较:ExoQuick外来体沉淀溶液(System Biosciences,CK#1)和总外来体分离试剂(Invitrogen,CK#2)。补充表S1简要描述了CK。按照制造商的说明,我们将10 mL CM与CK#1,CK#2和EGCG混合以进行比较。然后通过推荐用于CK的适当离心力(CK#1:3,000 rpm,CK#2:10,000 rpm)或我们的基于过滤器的方法(对于EGCG处理)通过离心分离电动汽车。我们观察到了离心沉淀电动汽车数量的差异(图2a)。),并确认沉淀后明显增加的沉淀量与分析后外泌体表面标志物CD9和CD63的含量增加相对应(图2b)。这些结果表明,与商业化试剂盒中使用的聚合物相比,EGCG与CM中的生物分子反应性更高,从而导致沉淀增加。相比之下,CK#1的电动汽车隔离效率比CK#2更好,而EGCG的总体隔离效率最高。
为了评估分离的EV产量,我们将通过我们的方法获得的总蛋白浓度与通过Bradford分析法使用CK#1获得的总蛋白浓度进行了比较(图S 3A)。与CK#1方法相比,我们从CM和血浆中分离出的基于EGCG的方法分别产生了9倍和10倍高的总蛋白浓度(图S 3B)。此外,我们评估了CD63,CD9,Apo B和白蛋白水平,以评估分离的EV的纯度和回收率。CD63和CD9用作EV标记,Apo B用作脂蛋白标记。靶向白蛋白是因为它是血浆中最丰富的蛋白质。通过CK#1方法回收了EV,这通过检测EV标记CD9和CD63反映出来(图2c)。但是,脂联素标记(Apo B)和白蛋白也可以通过Ponceau S染色(70 kDa,白蛋白)检测到(图2d)。我们确认,与CK#1方法相比,我们的方法可实现更有效的EV回收,同时减少来自非EV组件的污染。与EG#1处理的血浆相比,在EGCG处理的血浆中EV标记CD63和CD9的条带信号强度更高(分别高1.3倍和9.9倍)。相比之下,EGCG处理的血浆中非EV标记物的水平比CK#1处理的血浆中的低EV标志物水平低1.6倍(Apo B)和4.9倍(白蛋白)(图S 3C)。在各种EV隔离方法中,使用商用EV沉淀套件的主要原因是CK易于使用且易于使用,尽管价格昂贵。商业工具包使用基于聚合物的沉淀物,在EV周围形成网状网,其大小范围为60至180 nm。28这些包裹的电动汽车纯度低。这项研究表明,EGCG辅助方法比市售EV分离套件更有效,并且可以更高纯度分离EV。因此,EGCG及其衍生物的使用是对常用但昂贵的商业产品的一种经济且更有效的替代。
基于滤波器的EV隔离
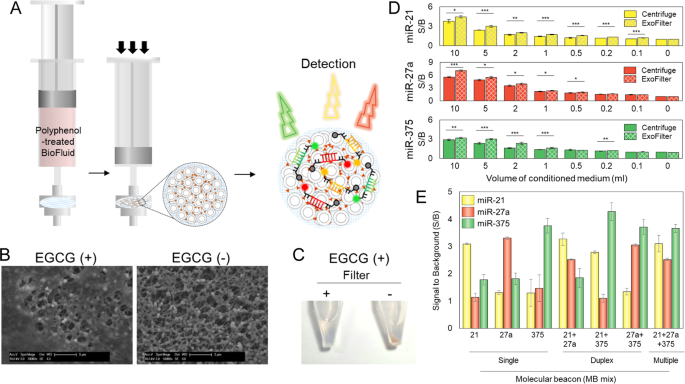
然后,我们执行了基于滤波器的EV隔离和收集,我们将其称为exofilter程序(图3a)。根据尺寸分析的结果(图1g),我们使用孔径为450 nm的膜滤器收集EV生物粘附纳米聚集体。为了易于分离和进一步分析已过滤的电动汽车,我们使用了可组装的过滤器支架作为注射器过滤器的滤芯。图3b显示了在EGCG处理的(EGCG +)CM中过滤的EV生物粘附纳米聚集体的SEM图像。EGCG处理的培养基在过滤后再次沉淀(图3c)),以验证基于过滤器的隔离的效率。基于过滤器的EV隔离似乎很有效,因为在EGCG(+)过滤器(+)CM样本中未观察到再沉淀,这与过滤器(-)CM样本不同。
一个基于滤波器的EV-生物粘附nanoaggregate分离和检测的原理图。手动过滤多酚处理的生物流体。使用基于荧光的多重分子信标(MBs)分析了过滤后的电动汽车中的miRNA。b在注射器滤器上过滤后的电动汽车的SEM图像。仅在EGCG处理过的培养基(EGCG +)中观察到过滤的EV。c用(+)或(-)过滤沉淀经过EGCG处理的(EGCG +)培养基。d比较基于离心机和过滤器的EV分离物的miRNA检测效率。用MB检测到目标miRNA miR-21,-27a和-375。基于过滤器的分离方法比基于离心机的分离方法对miRNA检测更有效(* p <0.05,**p <0.01,*** p <0.001)。È多p从与MB的细胞衍生的电动汽车LEX miRNA检测。
基于分子信标的电动汽车miRNA直接检测
我们进行了基于分子信标(MB)的多重miRNA检测,这是一种简化的检测方法,以确认基于过滤器的分离后EV miRNA分析的效率。甲MB是含有在其3'和5'末端,分别荧光团和淬灭剂发夹状分子探针29,30,31。在靶序列存在下,MB发夹结构被释放,随后其与靶序列特异性杂交并产生强荧光信号。在本研究中用于靶向miRNA的MB汇总在补充表S2中。电动汽车中的miR-21,miR-27a和miR-375旨在检测癌症,因为它们是具有异常表达的已知癌变调节剂32,33,34,35。差异miRNA表达密切与多种疾病相关联36,37和miR-21和miR-27A是公知的被上调,而的miR-375被下调,在GC 32,33,肝细胞癌(HCC)35和食道腺癌34。
为了测试使用我们的MB进行合成靶点miRNA检测的效率,我们首先分析了miRNA的检出限(LOD),交叉反应性和多重检测,这些均在图S 4中进行了详细说明。为了直接检测过滤后的电动汽车中的miRNA,我们首先通过同时一步式电动汽车裂解和与MBs的杂交来优化稀释和杂交缓冲液(图S 5)。选择RIPA缓冲液和Triton X-100溶液进行测试,因为它们是透明的并且是最常用的EV裂解缓冲液。将MB21与裂解液预混以进行一步检测,将DPBS溶液用于对照组。经过EV裂解和MB杂交后,基于荧光强度评估了它们的效率,并且我们确定Triton X-100溶液比RIPA缓冲液更适合此目的,因为Triton X-100溶液产生更高的S / B比。
与基于离心机的分离相比,使用exofilter程序检测5 mL样品中的miR-21,-27a和-375的S / B比分别高约1.26、1.3-和1.13倍(分别为p <0.05,p <0.01和p <0.001;图3d)。因此,我们的方法比传统的基于离心机的分离更有效。为了对CM电动汽车中的miRNA进行多重检测,我们将MB21,MB27a和MB375的组合与分离的电动汽车共同孵育(图3e))。使用MB21在电动汽车中检测三种miRNA(miR-21 + miR-27a + miR-375)的S / B比率与单独检测miRNA(miR-21)的比率几乎相同。同样,使用MB27a和MB375分别在电动汽车中检测miR-27a和miR-375的S / B比分别比单独检测miR-27a和miR-375的S / B比分别低23.6和2.6%。因此,在过滤的EV-生物粘附纳米聚集体中成功检测到EV中的多个miRNA。
电动汽车中miRNA的细胞类型依赖性表达
为了进一步证实miRNA的细胞类型依赖性表达模式,我们测量了各种GC细胞系(AGS,MKN-74和Hs746T细胞)和食管腺癌细胞系(SKGT4细胞)的CM中分泌的EV以及HEK293T和人成纤维细胞作为代表正常细胞。我们执行了exofilter程序,并将结果与CK确定的结果进行了比较(图4a)。
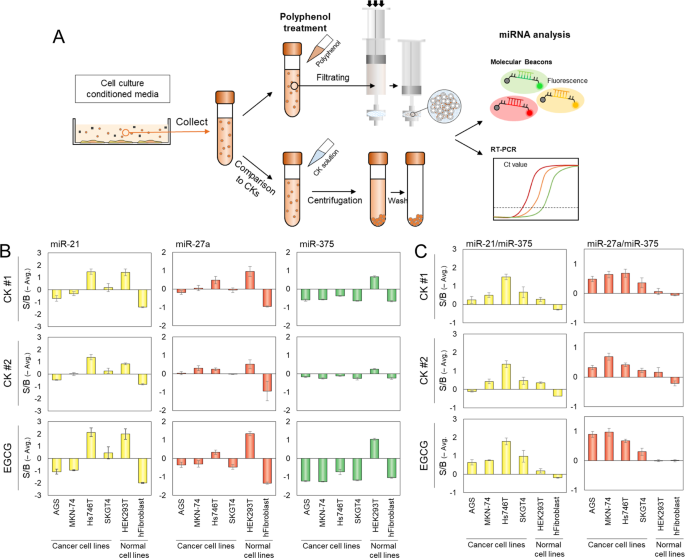
一个 miRNA在CM中的电动车的分析原理。收集CM,去除细胞碎片。然后将EGCG应用于CM,并通过过滤分离出EV生物粘附纳米聚集体。为了将这些结果与带CK的EV隔离的结果进行比较,将CK溶液应用于CM,并按照制造商的说明通过离心分离EV。根据来自多重MB测定的荧光强度和PCR循环阈值(Ct)分析外泌体miRNA。b在不同癌症和正常细胞系中检测miR-21,-27a和-375的信噪比(S / B)。比较了用CK#1,CK#2和EGCG隔离后的S / B比。C 比较了用CK#1,CK#2和EGCG分离的不同细胞类型的EV中的miR-21 / miR-375和miR-27a / miR-375表达比率。
通过exofilter程序确定的S / B比远远高于使用CK#1和CK#2确定的S / B比。特别是,使用exofilter程序在HEK293T细胞中检测miR21的S / B比分别比使用CK#1和CK#2的S / B高约1.44和2.3倍(图4b)。同样,检测miR27a的S / B比分别使用CK#1和#2进行检测的S / B比分别高1.44和2.3倍,而检测miR-375的S / B比则为1.42。分别是使用CK#1和#2进行检测的结果的-和2.1倍。但是,在肿瘤细胞和正常细胞系之间,miR-21,-27a和-375检测的S / B比没有显着差异(图4b))。但是,EV和EV中的miRNA表达水平在不同细胞系之间有所不同。HEK293T细胞在检测miR-21,-27a和-375方面具有比其他癌细胞更高的S / B比,因此我们怀疑HEK293T细胞仅比其他癌细胞释放出更多的EV。通过测量提取的总蛋白的浓度并分析外泌体表面标记CD9和CD63(图S 6),证实了这一推测。
为了进行更适当的比较,我们分析了上调(上调)和下调(下调)表达之间的比率。在肿瘤细胞系中,miR-21(上)/ miR-375(下)和miR-27(上)/ miR-375(下)的表达率高于正常细胞系(图4c)。在喉鳞状细胞癌(SCC)细胞中,通过将上调的miRNA的表达水平除以下调的miRNA的表达水平,将miR-21 / miR-375的表达比率用作组合生物标志物38。在肿瘤细胞系和正常细胞系之间,miR-21 / miR-375和miR-27a / miR-375的表达比例显着不同(p <0.001)。我们进行了RT-qPCR,以确认这些结果与从MBs获得的结果相似(图S 7)。因此,我们的方法具有无需RT-qPCR所需的复杂步骤即可诊断癌症的潜力。
患者血浆电动汽车中miRNA表达的分析
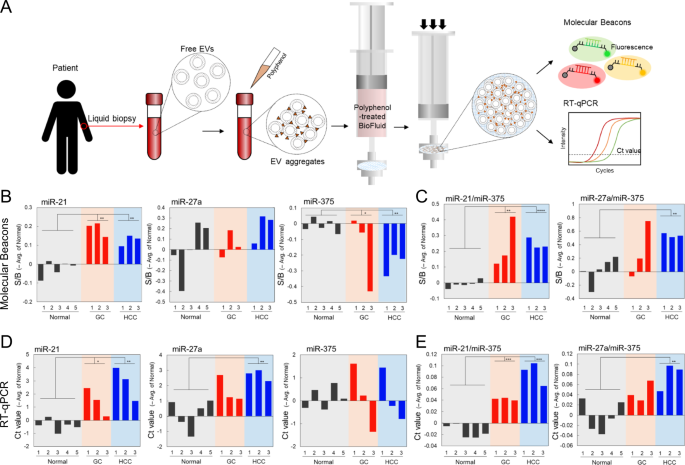
为了验证我们方法的临床实用性,我们在人血浆样本的电动汽车中进行了基于exofilter的miRNA检测。我们 使用多酚辅助方法从GC(n = 3)和HCC患者(n = 3)和健康供体(n = 5)的血浆中分离出EV (图5a)。我们使用在线可访问的基因表达综合(GEO)数据库确认了miR-21,-27a和-375表达谱,并准备了GC和HCC患者中这些表达谱的热图,以与健康供体中的表达谱进行比较(图。 S 8A,C)。以往的研究结果32,39与我们的miRNA热图分析(GSE23739,GSE54397,GSE21362,GSE22059)一致的是,与正常样品相比,在GC和HCC样品中均检测到miR-21和miR-27a表达增加且miR-375表达降低。使用GEO数据库,我们发现GC患者样品中miRNA-21和miR-27a表达显着增加,而miR-375表达显着降低(图S 8A,B p <0.01,p <0.001和p 分别<0.0001)。在HCC患者样品中,miR-21显着升高,而miR-375显着降低。miR-27a表达无明显差异(图S 8C,D,p <0.0001)。我们的数据表明,miR-21表达在GC(p <0.001)和HCC(p <0.01)患者中显着升高,而miR-375在HCC(p <0.001)患者中的表达低于健康供体(图5b))。为了量化GC血浆样品中的miRNA表达,我们使用RT-qPCR测量了miR-21,miR-27a和miR-375的相对水平(图5d)。来自癌症患者和健康供体的血浆中的miR-21 / miR-375和miR-27a / miR-375表达比率存在显着差异。在GC(p <0.05)和HCC(p <0.001)患者中,miR-21 / miR-375的表达率更高,而在HCC中,miR-27a / miR-375的表达率更高(p <0.01)患者比健康供体患者(图5c,e)。尽管癌症患者样品显示出显着更高的miR-21 / miR-375和miR-27a / miR-375表达比,但应在以后的研究中分析大量队列,以鉴定适用于无创液体活检的癌症生物标志物。
miRNA在人血浆EV分析中的示意图。通过液体活检从癌症患者和健康捐献者那里采集血样。收集血浆并用EGCG处理并通过过滤分离。通过分析多重MB检测的荧光强度和PCR循环阈值(Ct)结果,在过滤的EV中检测到miRNA。b在健康供体(黑色,n = 5),胃癌(GC;红色,n = 3)和肝细胞癌(HCC )中,miR-21,-27a和-375的信噪比(S / B);蓝色,n = 3)位患者;多重MB检测的结果。C通过分析多重MB检测结果确定健康供体以及GC和HCC患者中的miR-21 / miR-375和miR-27a / miR-375表达比。d使用逆转录聚合酶链反应(RT-qPCR)对GC和HCC患者以及健康供体的血浆样品进行基于Ct值的miR-21,miR-27a和miR-375定量分析。通过RNU6B将靶标miRNA标准化为miRNA中的参考基因。e使用RT-qPCR获得的健康供体以及GC和HCC患者中的miR-21 / miR-375和miR-27a / miR-375表达比。
结论
我们设计了一种新颖,经济高效的方法,可通过使用多酚分子来分离纳米级电动汽车。我们的研究证明了潜在的可翻译,有效且易于使用的策略及其在临床样品分子诊断中的应用。这项研究进一步强调了生物粘附介导的临床样品制备方法的使用,该方法可以有效地用于基于外泌体的分子诊断的样品分离和富集。对GC和HCC患者血浆中的外泌体miRNA进行分析后发现,miR-21 / miR-375和miR-27a / miR-375的表达率更高,这表明我们的方法可用于基于外泌体的分子诊断,从而进行个性化治疗并监视癌症。
|
|