对泛素识别和Npl4的Ufd1相互作用的结构见解
对泛素识别和Npl4的Ufd1相互作用的结构见解
摘要
Npl4可能是识别酵母中蛋白酶体降解途径中Lys48连接的多泛素化底物的最上游因素。Npl4与Ufd1一起形成异二聚体(UN),并充当Cdc48 ATPase的辅因子。在这里,我们报告与Lys48连接的双泛素和Ufd1的Npl4结合基序复杂的酵母Npl4的晶体结构。Lys48连接的泛素的远端和近端泛素部分分别主要与Npl4 C末端域(CTD)的C末端螺旋和N末端环相互作用。突变分析表明,CTD有助于连接选择性和泛素链的初始结合。Ufd1占据Npl4的Mpr1 / Pad1 N端(MPN)域的疏水槽,它对应于JAB1 / MPN / Mov34金属酶(JAMM)家族去泛素化酶的MPN域的催化槽。这项研究为Cdc48–UN复合物及其组装对多聚泛素链识别提供了重要的结构见解。
介绍
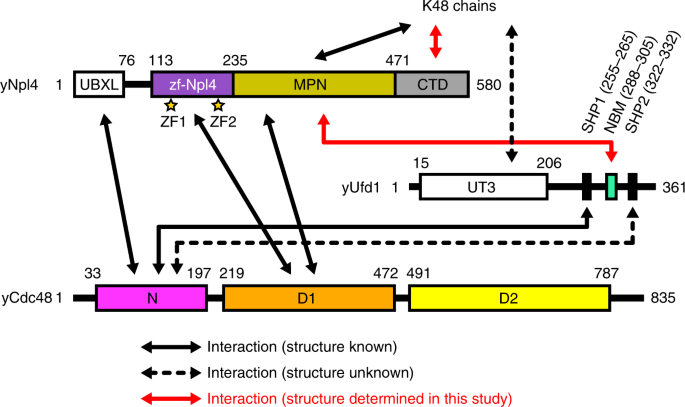
泛素(UB)是从酵母保守到哺乳动物的重要的翻译后修饰1,2,3。通常,Ub的C端甘氨酸残基与底物蛋白的赖氨酸残基共价连接。Ub本身也是泛素化的底物,并形成共价连接的Ub链。通过Lys48(K48链)连接的泛素链是蛋白酶体降解的主要靶向信号1,2,3,4,5。分离的泛素化蛋白可以是蛋白酶体的直接靶标,而嵌入膜中或组装成多亚基复合物的蛋白则需要借助保守的AAA家族ATPase Cdc48(酵母)或p97 / VCP(metazoan)进行提取或分离。其辅因子复合物,Ufd1-NPL4(UN),之前的蛋白酶体降解6,7,8,9,10,11。Cdc48 / p97 ATPase的细胞功能或定位受许多辅助因子控制。联合国异二聚体是最佳表征的辅因子之一12,13,14,15。
Cdc48 / p97 ATPase由一个N端(N)域和两个ATPase域(D1和D2)组成。D1和D2形成具有中心孔16的六聚双环。相对于D1-D2环的N结构域的构象与D1的核苷酸状态偶联;N结构域位于ATP状态(向上构象)的D1环的上方,并且是共面的与所述ADP状态D1环(向下构象)17,18,19,20,21。另外,D1和D2环之间的相对旋转是在ATP与D2结合时发生的。尽管了解伴随Ub链结合和ATP水解的底物易位机制一直是一个长期存在的问题,但最近的结构和功能研究为Cdc48 / p97-UN复合物的反应步骤提供了重要的力学见解22。在最初的步骤15中,UN异二聚体捕获与底物连接的Ub链。
Npl4负责识别连接有底物的Ub链,因此可能介导与Ub链相关的反应步骤15。哺乳动物Npl4(也称为NPLOC4)由Ubx样(UBXL)域,锌指结构域(以前称为zf-Npl4),Mpr1 / Pad1 N末端(MPN)域,C末端域(CTD)组成)和NZF域。哺乳动物Npl4结合Ub链而没有通过NZF域的连接特异性。在另一方面,酵母NPL4缺乏NZF域,并结合通过ZF-NPL4-MPN-CTD具体地K48链15,23,24。Npl4的MPN结构域在拓扑上类似于JAB1 / MPN / Mov34金属酶(JAMM)-家族去泛素化酶(DUB)的催化结构域19,可容纳Ub的C末端尾巴。因此,对应于JAMM DUB的催化位点的槽25,26已经被提出作为NPL4的电位UB-结合位点。但是,最近对以3.9Å分辨率与底物结合的Cdc48–UN复合物进行的冷冻-EM分析表明,底物上的K48链与yNpl4 MPN的凹槽不相互作用,而与CTD和MPN 22的其他区域相互作用。然而,由于低的地方的分辨率,用于Ufd1密度没有与原子模型和NPL4之间的相互作用解释和两个折叠部分泛素尚未详细表征22。
在这里,我们介绍了酵母Npl4(zf-Npl4-MPN-CTD)的晶体结构,分别与Lys48连接的双泛素(K48-Ub 2)和Ufd1分别具有2.55和1.58Å的分辨率。晶体结构显示K48-Ub 2的远端和近端Ub(分别为Ub dist和Ub prox)部分分别与Npl4 CTD的C末端螺旋和N末端环(N环)相互作用,并且Ufd1结合到Npl4的对应于JAMM催化槽的槽。体外和体内突变分析证实,Npl4 MPN沟是结合Ufd1而不是K48链所必需的。同样,旨在破坏Ub结合的Npl4突变体显示,Npl4 C末端螺旋和Ub之间的相互作用对于Ub链结合和Cdc48–UN复合物的ATPase活性刺激至关重要。此外,我们揭示了Npl4的近端Ub结合位点上的突变会影响其连锁特异性。我们的晶体学和生化研究为了解Cdc48 / p97-UN复合物的反应机理提供了重要的见解。
结果
Npl4与K48-Ub 2复合的结构
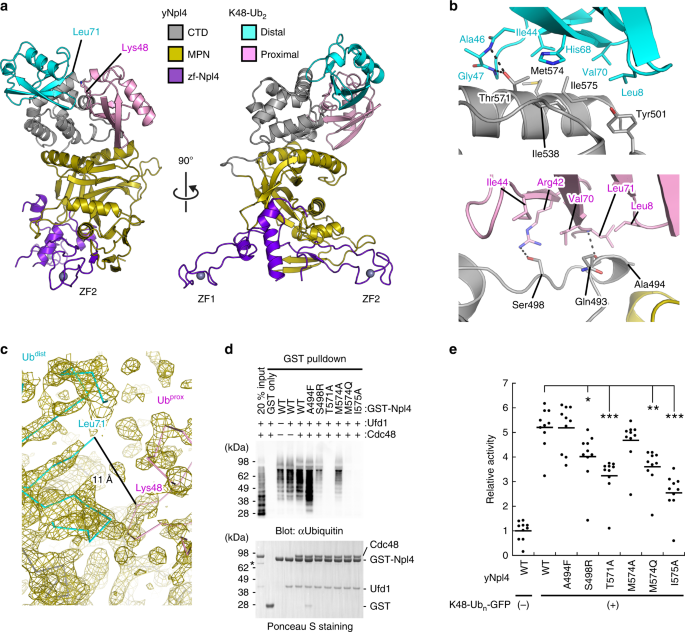
包含酿酒酵母 Npl4的残基113-580的区域(yNpl4 113-580,前缀“ y”表示酿酒酵母蛋白)在体外可特异性识别K48链(图 1)15。引入了三重E123A K124A E125A突变,以减少过量的表面构象熵27。yNpl4 113–580(E123A K124A E125A)蛋白产生了高质量的晶体,并使用锌边缘通过单波长异常衍射(SAD)方法以1.72Å的分辨率确定了其结构(表 1)。我们还尝试结晶yNpl4 113–580与K48链条配合使用。尽管测试了K48-Ub 2,K48-Ub 3,K48-Ub 4和K48-Ub 5的结晶,但只有K48-Ub 2与yNpl4 113-580成功共结晶。最终,我们确定了以2.55Å 分辨率与硒代蛋氨酸(SeMet)标记的K48-Ub 2配合的yNpl4 113–580的晶体结构(图 2a和表 1)。结构是通过分子置换法确定的,仅使用yNpl4 113–580作为搜索模型。尽管使用Ub(PDB 1UBQ [https://doi.org/10.2210/pdb1ubq/pdb ])28作为搜索模型是不成功的,我们发现对应于K48-UB残余电子密度2和手动内置K48-UB的模型2。最终模型在不对称单元中包含一个yNpl4 113–580 –K48-Ub 2复合物和一个分离的yNpl4 113–580分子。我们在这里注意到,K48-Ub 2的电子密度很弱,尤其是Ub prox(补充图 1a)。泛素的yNpl4相互作用部分的电子密度PROX被观察到的,而泛素的溶剂暴露的部分PROX被遮盖(补充图 1a,b)。为了确认泛素的位置DIST和UB PROX,我们替换Pro19 Val26或UB的Ile30与蛋氨酸和在yNpl4中计算出的异常的差值Fourier图113-580 -K48-UB 2复合物(补充图 1C)。尽管来自蛋氨酸衍生的一些信号是难以区分的或没有检测到,我们发现从SeMet1,SeMet19,和泛素SeMet26中得到的信号DIST和SeMet1,SeMet26,和泛素SeMet30 PROX。
yNpl4-K48-Ub 2复合物的两个方向的总体结构。b yNpl4和K48-Ub 2之间相互作用的特写视图。氢键显示为黑色虚线。c K24-Ub 2异肽键周围区域的特写视图。A 2 ˚F ø - ˚F Ç复合省略图被示出为在橄榄1级网眼轮廓σ水平。d通过下拉分析分析K48链与包含野生型或突变GST-yNpl4的Cdc48–UN复合物之间的结合。通过用抗Ub抗体免疫印迹检测结合的K48链(上图)。印迹膜用丽春红S染色(下图)。总之,输入的20%表示与GST-yNpl4结合的谷胱甘肽树脂混合的样品(K48链,Cdc48和yUfd1)的体积的20%。星号表示污染。用不同的样品重复该实验(补充图 3a)。源数据作为源数据文件提供。e含有或不含K48-Ub n的含有野生型或突变yNpl4的Cdc48–UN复合物的ATP水解速率-GFP。将速率标准化为不具有K48-Ub n -GFP 的野生型Cdc48-UN复合物的ATP水解速率的平均值。该线代表归一化后速率的平均值(平均值,n = 10个独立实验; * P < 0.05; ** P < 0.01; *** P < 0.001,来自Tukey检验)。
该yNpl4 113-580结构由三个子域,ZF-NPL4,MPN和CTD,NPL4的先前报告的结构类似于19,22。yNpl4 MPN子域由MPN核心和两个插入片段Ins-1(残基287-317)和Ins-2(残基403-462)组成,与其他MPN DUB相似。泛素DIST部分接触yNpl4的CTD子站点460埃的埋表面积2(图 2B)。泛素PROX部分接触yNpl4的CTD和MPN子域具有468埃的埋表面积2。尽管电子密度对应于Ub dist的C端五个残基(Arg-Leu-Arg-Gly-Gly)和UB的Lys48的侧链PROX是看不见的(图 2C),泛素Leu71之间的Cα-Cα距离DIST以及Lys48泛素的PROX(11 A)是那些在K48链先前报道的晶体结构的范围内与其特定的效应子(SARS PLpro 29,AIRAPL 30和Mindy-1 31;9-20Å)形成复合物。此外,我们通过SDS-PAGE 检查了yNpl4-K48-Ub 2晶体(补充图 1d),并确认K48-Ub 2的键合保留在晶体中。因此,我们得出结论,异肽键连接Ub dist和Ub prox在目前的yNpl4-K48-Ub 2结构中。仅在yNpl4 113–580和yNpl4 113–580 –K48-Ub 2之间没有观察到大的构象差异,除了在Ins-1中包含残基290–300的区域,其构象受晶体堆积限制(补充图 2a)。 。
Npl4的C末端螺旋在Ub结合中起关键作用
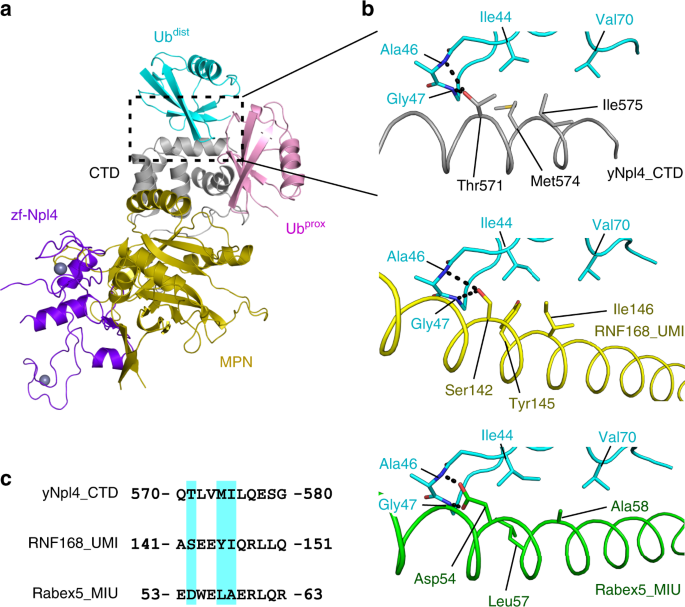
K48-Ub 2的 Ub dist主要与yNpl4 CTD的C末端螺旋相互作用(图 2b)。Met574和Ile575形成疏水表面,与Ub dist的以Ile44为中心的疏水膜相互作用。疏水相互作用通过yNpl4的Thr571与Ub dist中的Ala46和Gly47的主链NH基团之间的氢键进一步稳定。与C末端螺旋介导的相互作用相邻,yNpl4的Tyr501和Ile538突入由Ub dist的 Leu8,His68和Val70形成的疏水口袋中。为了评估这些相互作用在Npl4识别Ub链中的作用,我们通过表面等离子体共振(SPR)光谱检查了yNpl4的T571A,M574A,M574Q和I575A突变体与K48链的结合(表 2)。使用K48-Ub 4进行突变yNpl4的SPR分析,因为对K48-Ub 2的亲和力太低,无法分析。较长链泛素结合到其与一般的更高的亲和力效应30,32,33。yNpl4的T571A突变113-580为K48-UB降低的亲和力4至5.0野生型亲和力%(表 2)。yNpl4的I575A突变113–580将亲和力降低到无法衡量的水平。yNpl4的M574A突变113-580有微弱的作用和对K48-UB的亲和性降低4到野生型的亲和力的43%。另一方面,M574Q突变比M574A突变具有更大的作用,并且对K48-Ub 4的亲和力降低至野生型亲和力的9.1%。这可能是因为Gln的亲水性侧链抑制了yNpl4 113–580和Ub dist之间的疏水相互作用。我们进一步分析了yNpl4 113–580突变体与K63-或M1-Ub 4之间的亲和力。T571A,M574A,M574Q或I575A突变降低了对K63-或M1-Ub 4的亲和力达到不可衡量的水平(表 2)。这些结果表明,yNpl4–Ub dist接口主要是对Ub链的亲和力而非连锁特异性。
接下来,通过GST下拉分析法分析了Cdc48–UN复合物与K48链之间的结合。将GST-yNpl4突变体固定在谷胱甘肽珠上,并与Cdc48,yUfd1和K48链一起孵育。洗涤后,将结合的蛋白用LDS上样缓冲液洗脱,并用抗Ub抗体进行免疫印迹分析(图 2d和补充图 3a)。在该分析中,yUfd1或Cdc48对与K48链的结合影响很小,并且本研究中检测到的yNpl4突变不影响UN或Cdc48-UN复合物的形成。另一方面,T571A,M574Q或I575A突变对K48-Ub 4产生了严重影响结合,完全废除了Cdc48–UN对K48链的结合。对K48-Ub 4的亲和力有轻微影响的M574A突变并未完全消除结合。使用GST-yUfd1代替GST-yNpl4进行的相似的GST下拉试验显示出一致的结果(补充图 3b)。为进一步评估体内yNpl4–Ub dist相互作用的功能意义,突变yNpl4-3xFLAG在其自身的启动子下在npl4Δ细胞中表达。用抗FLAG抗体免疫沉淀yNpl4-3xFLAG,用抗K48链抗体分析Lys48连接的多泛素化蛋白的共免疫沉淀(补充图 3c)。与体外结合测定的结果一致,T571A,M574Q或I575A突变减少了共免疫沉淀的Lys48连接的polyUb共轭物的量,尽管这些突变对Cdc48结合的影响很小。
以往的研究表明Ufd1结合到K48链通过其UT3域24,34。但是,我们的下拉分析未能检测到yUfd1与K48链的结合(补充图 3b)。接下来,我们通过GST下拉分析法分析了GST-yNpl4和K48链之间对yUfd1浓度增加的结合,但未观察到实质性影响(补充图 3d)。使用纯化的yUfd1-yNpl4 113-580复合物和K48-Ub 4的 SPR分析还显示yUfd1的存在对yNpl4对K48-Ub 4的亲和力影响很小(表 2)。虽然ķ dpolyUb的yUfd1值尚未估算,monoUb的yUfd1估算值在1-2 mM 34范围内。该值远高于针对K48-Ub 2或K48-Ub 4的yNpl4 的K d值(表 2),表明yUfd1对K48链的亲和力远低于对yNpl4的亲和力。总的来说,这些体外和体内结果表明,yNpl4的C末端螺旋是Cdc48–UN复合物识别Ub链的关键决定因素。
Npl4 CTD的N环有助于K48链特异性
UB PROX K48-UB的2主要与yNpl4 CTD(残基493-501)(图的N环相互作用 图2b)。yNpl4 CTD相互作用的N-环与由Leu8,Ile44,和泛素Val70形成的疏水补丁PROX。yNpl4的Ser498形成与泛素Arg42氢键PROX。在yNpl4主链CO基Gln493的形成与在泛素的主链NH基Leu71的氢键PROX。通过使用His 6 -yNpl4 113-580的A494F,S498L和S498R突变体进行SPR分析,证实了这些相互作用的功能重要性(表 2)。yNpl4的S498L突变对K48-,K63-和M1-Ub 4的亲和力几乎没有影响,而yNpl4的S498R突变将对K48-Ub 4的亲和力降低至野生型亲和力的36%(表 2)。这些结果表明,yNpl4 CTD的N环为泛素的结合位点PROX,虽然N个循环到K48-UB的贡献4结合比C端螺旋的小。这反映,差距在yNpl4和UB之间的界面发现PROX。其中的差距所在yNpl4的Ala494和UB的Leu8之间PROX。yNpl4中Ala494的Phe替代增加了yNpl4对K48-Ub 4的亲和力2.2倍(表 2)。苯丙氨酸的庞大侧链可能填补了缺口并增加了亲和力。yNpl4 CTD在泛素的N个循环的参与PROX识别通过使用CDC48-UN复杂含有GST-yNpl4突变体GST pulldown测定进一步支持:yNpl4的A494F突变增强了CDC48-UN和K48链之间的结合,而S498R突变降低了它(图 2d)。即使当GST标签融合到Ufd1而不是Npl4时,也获得了相似的结果(补充图 3b)。
与对K48-Ub 4的亲和力相比,S498R或A494F突变几乎不影响对K63-或M1-Ub 4的亲和力,从而改变了连接特异性(以解离常数的倒数比表示;表 2)。野生型yNpl4对K48-Ub 4的亲和力分别比对K63-或M1-Ub 4的亲和力高11和15倍。yNpl4的S498R突变降低了连接特异性。相反,yNpl4的A494F突变体增加了连接特异性,因为该突变体增加了对K48-Ub 4的亲和力,但几乎不影响对K63-或M1-Ub 4的亲和力(表 2)。这些结果表明,泛素之间的相互作用PROX和yNpl4 CTD的N环有助于yNpl4的特异性K48链。
K48链–CTD结合刺激Cdc48 ATPase活性
Lys48联polyubiquitylated GFP(K48-UB Ñ -GFP)已被用作,能刺激CDC48-UN复合物的ATP水解的模型基板13,14。为了评估与Cdc48–UN复合物中K48链的结合与ATP水解之间的耦合,我们分析了含有突变yNpl4的Cdc48–UN复合物对ATP水解的速率。根据yNpl4对K48链的亲和力,添加K48-Ub n -GFP可以提高Cdc48-UN复合物的ATP水解速率(图 2e和补充图 3e)。例如,K48-Ub n-GFP将Cdc48–UN复合物的ATP水解速率提高了约5倍。yNpl4-Ub dist界面的T571A,M574Q或I575A突变会严重降低与K48链的亲和力,从而降低ATP的水解速率。在yNpl4-UB的S498R突变PROX接口,其示出了在亲和温和的效果,也比T571A,M574Q,或I575A突变降低了ATP酶水解速率,但以下。这些结果表明,刺激Cdc48–UN复合物的ATPase活性需要yNpl4 CTD与K48链的结合活性。
Npl4与Ufd1复合的结构
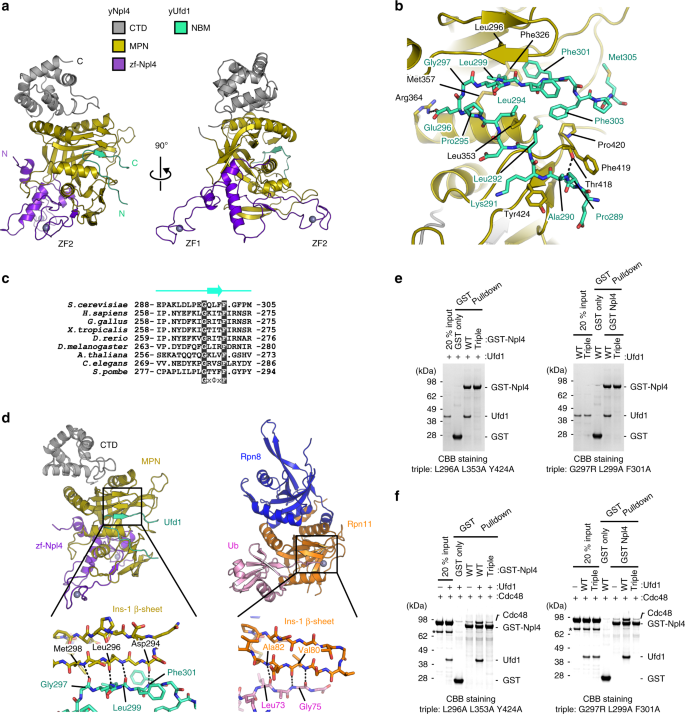
即使没有Cdc48 / p97或多泛素化的底物,Npl4和Ufd1也可以形成异二聚体。尽管人Ufd1的残基258-275(hUfd1 258-275,带前缀“ h”表示人类蛋白),但Ufd1-Npl4相互作用的机制仍不清楚,相当于yUfd的残基288-305(yUfd1 288-305)。 )已被指定为Npl4-结合基序(NBM)(图 1)35。确实,使用FlAsH标记的yUfd1 288-305进行的基于荧光各向异性的亲和力测量显示yUfd1 288-305与yNpl4结合,K d为85.7 nM(表 3)。)。为了进一步揭示Npl4与Ufd1之间相互作用的结构基础,我们确定了yNpl4 113–580(E123A K124A E125A)与yUfd1 288–305的复合物的晶体结构(图 3a,b和表 1)。结构是通过分子置换法确定的,仅使用yNpl4 113–580作为搜索模型。在晶体中,yNpl4 113-580与yUfd1 288-305形成了化学计量的配合物。yNpl4之间没有观察到大的构象差异113-580单独和yUfd1 288-305结合的yNpl4 113-580(补充图 2B)。
yNpl4–yUfd1复合体的两个方向的总体结构。b yNpl4和yUfd1之间相互作用的特写视图。氢键显示为黑色虚线。c Ufd1的NBM区的序列比对。序列上方显示了yNpl4–yUfd1结构中NBM区中β链的位置。d的yNpl4-yUfd1的MPN区域的比较和Rpn8-Rpn11-UB(PDB 5U4P [ https://doi.org/10.2210/pdb5u4p/pdb ])25种复合物。yNpl4–yUfd1复合体的着色方案与图 3a相同。Rpn8–Rpn11–Ub复合体的Rpn8,Rpn11和Ub分别为蓝色,橙色和粉红色。氢键显示为黑色虚线。e,f通过下拉分析分析GST-yNpl4和yUfd1单独(e)或yUfd1-Cdc48(f)之间的结合。显示了yNpl4的三重突变体(L296A L353A Y424)(左)或yUfd1的三重突变体(G297R L299A F301A)(右)的结果。总之,输入的20%表示与GST-yNpl4结合的谷胱甘肽树脂混合的样品(yUfd1和/或Cdc48)的体积的20%。星号表示污染。通过SDS-PAGE分析结合的蛋白质,并用考马斯亮蓝染色。源数据作为源数据文件提供。
在复合物中,yUfd1 NBM的残基298-300与yNpl4的Ins-1形成一个β-折叠(图 3c,d)。yNpl4的Leu296,Phe326,Leu353,Met357,Phe419,Pro420和Tyr424形成疏水凹槽,以容纳yUfd1的Pro289,Leu292,Leu294,Gly297,Leu299,Phe301,Phe303和Met305。通过基于荧光各向异性的结合分析检查了除yNpl4的Pro420和yUfd1的Pro289以外的所有这些残基的突变(表 3)。yNpl4的Leu296,Leu353或Tyr424或yUfd1的Leu292,Gly297,Leu299或Phe301的突变严重影响yUfd1 288-305和yNpl4 113-580之间的亲和力。阿拉置换Leu292,Leu299,或Phe301在yUfd1 288-305降低了亲和力至野生型亲和力的1.6%,0.68%或0.41%。yUfd1 288-305的Gly297的Leu,Arg或Tyr替代将对yNpl4 113-580的亲和力分别降低至野生型亲和力的14、0.41或4.0%。Gly297的主链二面角分别为90.1°和-8.5°。蛋白质结构验证的标准程序MolProbity 36将这些角度判断为Gly的偏爱角度,但将其视为非Gly / Pro残基的允许角度。Gly比残基297处的非Gly / Pro残基更有利。yUfd1 NBM在Gly297处扭结,从而适合yNpl4的MPN子域中的疏水性凹槽(图 3b))。yUfd1的Gly297和Phe301从酵母到人都是保守的,而yUfd1的Leu299被其他真核生物中功能上等效的疏水残基取代(图 3c)。尽管Ufd1 NBM的序列在真核生物之间是可变的,但该GxΦxF基序(x和Φ分别代表任何氨基酸和疏水性氨基酸)都非常保守,反映了其功能重要性(图 3c)。yNpl4 113–580的Leu296,Phe326,Leu353或Tyr424的Ala替代将亲和力分别降低至野生型亲和力的1.2%,33%,6.2%或1.0%(表 3)。值得注意的是,yNpl4的Leu296,Phe326和Tyr424在hNpl4中是保守的(补充图 4)。)。yNpl4的Leu296和Phe326与yUfd1的Leu299和Phe301相互作用,它们分别占据GxΦxF基序的第三和第五个位置,而yNpl4的Tyr424疏水地与Ala290的主链CO基团和yUfd1的Lys291的Cα原子相互作用。这些疏水性相互作用可能从酵母到人都是保守的。除疏水相互作用外,yNpl4的Arg364和Thr418分别与yUfd1中的Glu296和Ala290的主链NH基团形成氢键。yUfd1的E296A突变288-305或yNpl4的R364A突变113-580的亲合性降低到20%或分别与野生型亲和力,27%(表 3)。这些残基在酵母和人之间不是保守的。Npl4和Ufd1之间的亲水相互作用在物种之间可能是可变的。
Ufd1与Npl4上的K48链不重叠
在JAMM家族的DUB的MPN域的催化槽容纳泛的用于切割的C-末端尾部25,26,37。在JAMM核中的第一个插入(即Ins-1)形成一个β-折叠,在催化槽中Ub的C末端为尾(图 3d)。Npl4是无酶活性的,但是具有Ins-1和类似于JAMM家族DUB 19的催化槽的槽。因此,已假定该凹槽和Ins-1形成了潜在的Ub链结合位点。然而,目前的yNpl4 113–580 –yUfd1 288–305结构显示,MPN域的凹槽可容纳yUfd1 NBM(图 3d)。所述NPL4结合yUfd1不重叠K48-UB 2在yNpl4-K48-UB 2络合物。一致地,yUfd1不会抑制K48链与yNpl4的结合(图 2d,补充图 3d)。此外,最近报道的与底物结合的Cdc48-UN的cryo-EM结构表明,结合的K48链和Ufd1不相互重叠。尽管Npl4和JAMM DUB的MPN域相似,但是Ins-1和凹槽的功能在它们之间是不同的。
Cdc48–UN组装取决于Ufd1–Npl4相互作用
为了分析Ufd1-Npl4相互作用与Cdc48-UN装配之间的关系,我们首先通过全长蛋白质的GST下拉实验筛选了有效抑制yUfd1和yNpl4相互作用的突变。尽管yNpl4或yUfd1的单点突变几乎不会影响yNpl4–yUfd1的相互作用(补充图 5a,b),但yNpl4(L296A L353A Y424A)或yUfd1(G297R L299A F301A)的三重突变分别完全抑制了联合国异二聚体的形成, (图 3e和补充图 5a,b)。三突变体yNpl4被证实与野生型yNpl4结合到K48链上(补充图 5c)。接下来,我们通过GST下拉实验分析了yNpl4或yUfd1突变对Cdc48-UN装配体的影响,发现yNpl4或yUfd1的三重突变体显着减少了Cdc48-UN复合物的形成(图 3f和补充图。 5d)。因此,尽管yNpl4和yUfd1都可以直接与Cdc48结合,但UN异二聚体的形成促进了Cdc48-UN的组装。
为了进一步评估Ufd1-Npl4体内相互作用的功能重要性,突变的Npl4-3xFLAG或Ufd1-3xFLAG分别在npl4Δ或ufd1Δ细胞中表达。我们检查了这些细胞中Ub共轭物在总细胞裂解物中的积累。所述npl4-1温度敏感型株还检查作为NPL4缺陷控制。在表达yNpl4或yUfd1单点突变体的细胞中,Ub缀合物的水平没有改变(补充图 5e)。相反,在表达yNpl4或yUfd1的三重突变体的细胞中,我们观察到Ub共轭物的大量积累,这与npl4-1细胞中的积累相当(补充图 5e))。相应地,这些表达三重突变体的细胞显示出对温度敏感的生长表型,尽管它比npl4-1表型温和(补充图 5f)。这些发现表明,Ufd1-Npl4相互作用对于Ub共轭物的降解和细胞生长很重要。
人类Npl4的CTD参与与K48链的结合
Npl4是从酵母到哺乳动物的高度保守的蛋白质。在哺乳动物Npl4中,位于其C末端的NZF域与K48链和与Lys63连接的Ub链(K63链)结合。缺少NZF域的人Npl4(hNpl4)突变体几乎不与Ub链结合15。在另一方面中,子囊菌和植物界 NPL4蛋白质缺乏在它们的C-末端(补充图的NZF域 6A,B)。来自酿酒酵母和嗜热链球菌的Npl4蛋白通过zf-Npl4-MPN-CTD域19与K48链结合。包括yNpl4和hNpl4的多个氨基酸序列比对显示Ub dist在CTD的C末端螺旋中的相互作用残基在酵母和人之间部分保守;yNpl4的Thr571是保守的,而yNpl4的Ile575被hNpl4中的Leu取代,其功能应等同于Ile(补充图 6a)。有趣的是,hNpl4的T551A突变(相当于yNpl4的Thr571)将其对K48-Ub 4的亲和力降低至野生型亲和力的58%(表 2)。另一方面,yNpl4的Met574在hNpl4中被Gln取代,在粟酒裂殖酵母中被 Ala取代。yNpl4的M574Q突变将其对K48-Ub 4的亲和力降低至野生型亲和力的9.1%,而M574A突变将其降低至仅43%(表 2))。相反,hNpl4的Q554M突变(相当于yNpl4的Met574)使对K48-Ub 4的亲和力增加了约两倍(表 2)。这些发现表明,hNpl4 CTD的C末端螺旋也与yNpl4 CTD的Ub链结合。
hNpl4 NZF可以弥补yNpl4 CTD的缺陷
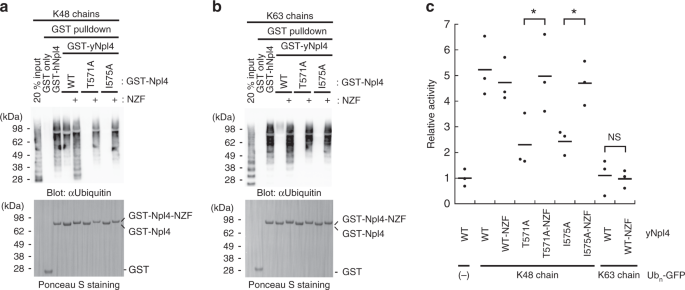
为了评估Ub链结合和Cdc48 ATPase活性下yNpl4 CTD和hNpl4 NZF之间的功能等效性,我们研究了yNpl4蛋白,其中hNpl4的NZF域(包括CTD和NZF域之间的连接子区域)为融合到全长yNpl4(yNpl4-NZF)的C末端,有或没有与Ub链结合不足的突变(T571A或I575A)。GST下拉分析表明,即使有T571A或I575A突变,yNpl4-NZF仍与K48和K63链结合,这表明NZF融合可以挽救CTD突变的Ub链结合缺陷(图 4a,b和补充图)。 。 6C)。接下来,我们分析了yNpl4-NZF蛋白是否支持Cdc48复合物的K48链依赖性ATPase活性(图 4c和补充图 6d)。NZF与野生型yNpl4的融合没有使ATPase活性高于野生型水平,这可能是因为野生型yNpl4对K48链的亲和力足以刺激Cdc48的全部ATPase活性。另一方面,NZF融合体完全恢复了由T571A或I575A突变引起的ATPase刺激的降低,这表明yNpl4 CTD和hNpl4 NZF在功能上是等效的。这也增加了ATP水解的增强不依赖于Lys48键特异性的可能性。但是,K63链不会刺激含有yNpl4-NZF的Cdc48–UN复合物的ATPase活性,该复合物可以与K63链以及K48链结合(图 4c)。)。因此,对Cdc48–UN复合物ATPase活性的刺激实际上取决于yNpl4的Lys48连锁特异性。考虑到yNpl4 CTD的Lys48-连接特异性对于刺激ATP水解是可有可无的,因此可以预期yNpl4,yUfd1和/或Cdc48除了Npl4 CTD之外还具有其他Lys48-linkage特异性识别位点。底物结合的Cdc48–UN的冷冻EM结构表明yNpl4 MPN与未折叠的Ub结合,后者在Ub 受体和Cdc48 22的中心孔之间架桥(补充图 6e)。这种结合可能与Cdc48的ATPase活性的K48链特异性刺激有关。
a,b通过下拉分析分析GST-hNpl4,GST-yNpl4或GST-yNpl4-NZF与K48链(a)或K63链(b)的结合。通过用抗Ub抗体进行免疫印迹检测结合的Ub链(上图)。印迹膜用丽春红S染色(下图)。输入20%表示与结合GST-yNpl4-或GST-yNpl4-NZF的谷胱甘肽树脂混合的样品(Ub链)体积的20%。用不同的样品重复这些实验(补充图 6c)。源数据作为源数据文件提供。c包含yNpl4或yNpl4-NZF和K48-Ub n -GFP或K63-Ub n的Cdc48–UN复合物的ATP水解速率-GFP。将速率标准化为没有Ub n -GFP 的野生型Cdc48-UN复合物的ATP水解速率的平均值。该线表示归一化后的速率的平均值(平均值;n = 3个独立实验; * P <0.05,来自Student t-检验)。
讨论区
在这项研究中,我们确定了yNpl4 113–580 –K48-Ub 2复合物的晶体结构。既泛DIST和UB PROX与yNpl4 CTD,这是一种新鉴定的泛素结合结构域(图交互 图5a)。yNpl4 CTD的C末端螺旋是yNpl4的主要Ub结合位点。在先前报道的Ub结合域(UBD)中,Ub相互作用基序(UIM),与Ub相互作用的基序(MIU)以及UIM和MIU相关的UBD(UMI)具有单个螺旋作为Ub结合位点。yNpl4 CTD,MIU和UMI但UIM相对于绑定的Ub显示相同的螺旋方向。因此,我们比较了yNpl4 CTD和RNF168 UMI的Ub结合螺旋(PDB 5XIS [ https://doi.org/10.2210/pdb5xis/pdb ])38和Rabex5 MIU(PDB 2C7N [ https://doi.org/10.2210/pdb2c7n/pdb ]) 39(图 5b)。这些UBD具有一个N端亲水残基,用于与Ub的Ala46和Gly47的NH基团进行氢键键合,以及一个中央疏水残基,用于与Ub的Leu8,Ile44和Val70形成的疏水口袋相互作用(图 5b,c)。Ub结合螺旋中N末端亲水残基和中央疏水残基的差异会影响其相对于Ub的方向。中心疏水残基是Npl4 CTD和UMI中的Ile和MIU中的Ala。yNpl4 CTD或UMI中Ile的较长侧链推出了螺旋UBD的C末端,而那些N末端的亲水残基则移动到Ub的Ala46和Gly47的NH基团附近。由于这种邻近性,yNpl4 CTD和UMI的N末端亲水残基分别为Thr和Ser,它们比MIU的N末端亲水残基Asp短。
yNpl4–K48-Ub 2复合物的总体结构。着色方案与图 2a相同。b yNpl4(本研究中),RNF168 UMI(PDB 5XIS [的C端螺旋的泛素-结合的接口结构比较https://doi.org/10.2210/pdb5xis/pdb ])38 Rabex-5和MIU (PDB 2C7M [ https://doi.org/10.2210/pdb2c7m/pdb ])39。yNpl4-Ub dist复合体的着色方案与图 2a相同。RNF168 UMI和Rabex-5 MIU分别染成黄色和绿色。氢键显示为黑色虚线。参与yNpl4和Ub结合的残基dist和RNF168 UMI和Rabex-5 MIU的相应残基显示为棒。c yNpl4,RNF168 UMI和Rabex-5 MIU的C末端螺旋序列比对。yNpl4和Ub dist之间的结合涉及的残基以及RNF168 UMI和Rabex-5 MIU的相应残基以青色突出显示。
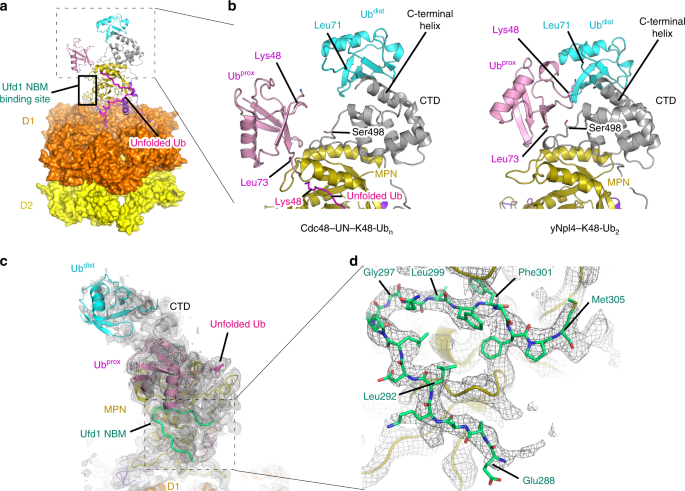
基板接合CDC48-UN的冷冻电镜结构22包含两个折叠部分泛素,它们对应于泛素DIST和UB PROX在yNpl4本晶体结构113-580 -K48-UB 2(图 6A)。在这两种结构中,yNpl4 CTD的C末端螺旋与Ub dist的以Ile44为中心的疏水性斑块相互作用(图 6b),因此,yNpl4 的Ub dist识别模式基本相同。另一方面,Ub 代理识别模式不同。在yNpl4-K48-Ub 2结构中,yNpl4的Ser498与Ub的Arg42形成氢键代理。yNpl4的S498R突变体的GST下拉和SPR分析表明yNpl4的Ser498实际上参与了与K48链的结合(图 2d,补充图 3b和表 2)。在该结构衬底接合CDC48-UN,泛PROX移向CDC48由〜10埃,与yNpl4-K48-UB相比2,并且不相互作用与yNpl4的Ser498(图 6B)。这种Ub 邻近运动似乎与未折叠的Ub部分的穿线有关。即,Ub 代理在最初的Ub链识别步骤中与yNpl4的Ser498相互作用。在随后的基底线程步骤中,展开的泛素插入CDC48的中心孔,并且拉动泛PROX,其失去其与yNpl4的Ser498相互作用。
一个的CDC48-UN复合物(PDB 6OA9 [的冷冻电镜结构的总体视图https://doi.org/10.2210/pdb6oa9/pdb ])22。着色方案与图 1相同。展开的Ub为洋红色。b比较yNpl4–K48-Ub 2和底物结合的Cdc48–UN复合物的K48链结合位点。着色方案与图6a中的相同 。c,d使用Coot LSQ协议以yNpl4的zf-Npl4-MPN-CTD结构作为参考47,将yNpl4–yUfd1的结构叠加在与底物结合的Cdc48–UN复合物中。。将yUfd1 NBM作为刚体进一步拟合到与底物结合的Cdc48-UN(EMD-0665)22的冷冻电磁图中,并在Phenix 45中对其进行了实际空间优化。着色方案与图 3a相同。低温EM贴图显示为灰色网格。Ç yNpl4-yUfd1的总体视图,并与两个折叠部分泛素冷冻电镜地图在5轮廓σ水平。d与yNpl4和yUfd1之间的相互作用的特写视图冷冻电镜地图在8轮廓σ水平。
我们还确定了yNpl4 113–580 –yUfd1 288–305的晶体结构。我们将Ufd1的NBM区的结构对接至与底物结合的Cdc48–UN 22的冷冻EM结构中(图 6c)。当前的yUfd1 288-305模型很好地适合了在冷冻电磁图(图6c,d)中观察到的未分配密度,该密度 应该对应于yUfd1 22的一部分。这表明联合国复合物的晶体学揭示的yNpl4–Ufd1相互作用类似地发生在与底物结合的Cdc48–UN中(图 6d)。
Ub-蛋白酶体系统(UPS)的抑制剂最近已被开发为抗癌药物40。由于p97 / Cdc48-UN复合物在蛋白酶体的上游起关键作用,因此它的抑制作用已成为癌细胞中的一种新型治疗靶点41。但是,由于p97 / Cdc48在UPS途径之外也起着各种作用,因此其抑制作用可能会影响许多细胞功能。在上下文中,特异性p97-辅因子缔合的破坏将可能导致具有增强的抗癌活性特异性的新型p97抑制剂。Ufd1和Npl4之间相互作用的抑制阻止了Cdc48-UN复合物的形成(图 3f)。yNpl4 113–580 –yUfd1 288–305的当前结构 通过用作基于结构的设计的有用平台,可能有助于此类抗癌药物的开发。
方法
Npl4,Ufd1和Cdc48的制备
合成了密码子优化的yNpl4,hNpl4和yUfd1 cDNA(Eurofins),以改善它们在大肠杆菌中的表达。为了结晶,分别使用Bam HI和Xho I位点将编码yNpl4 113–580或yUfd1 288–305的基因克隆到pGEX-6P1表达载体中,或分别使用Nde I和Xho I位点克隆到pCold-GST表达载体中,以产生N端GST融合蛋白。对于GST下拉分析,使用Bam HI和Xho I位点将全长yNpl4和yUfd1基因克隆到pGEX-6P1表达载体中15,然后使用Bam HI和Xho I位点将Cdc48基因克隆到pET21a表达载体中。对于SPR分析,使用Nde I和Xho I位点将编码yNpl4 113-580或hNpl4 105-608的基因克隆到pET28a表达载体中,以产生N端His 6标记的蛋白。对于基于荧光各向异性的亲和力测量,将GWCCPGCC序列连接到yUfd1 288-305的C末端。使用Nde I和Xho I位点将yUfd1 288–305 -GWCCPGCC基因克隆到pCold-SUMO表达载体中,以产生N端His 6标记的SUMO融合蛋白。通过基于PCR的诱变产生突变。这项研究中使用的引物序列见补充表 1。用每种表达载体转化大肠杆菌菌株Rosetta(DE3)细胞(Invitrogen),并在LB培养基中培养,该培养基含有100 mg L -1氨苄青霉素用于pGEX-6P1或pCold表达载体或50 mg L -1卡那霉素用于pET28a表达载体在37°C下。当培养物在600 nm的光密度达到〜0.5时,异丙基-β- D加入-硫代半乳糖吡喃糖苷(IPTG)至终浓度为0.1 mM以诱导蛋白质表达,对于pGEX-6P1和pET28a表达载体,在20°C下继续培养18 h,在15°C下继续培养24 h。 pCold表达载体。用pGEX-6P1或pCold-GST表达载体转化的细胞在含1 mM二硫苏糖醇(DTT)和0.5%Triton X-100的磷酸盐缓冲盐水(PBS)中进行超声处理以破坏细胞,并通过谷胱甘肽琼脂糖凝胶FF柱(GE医疗保健)和资源Q阴离子交换柱(GE医疗保健)。GST-yNpl4 113–580的GST标签被HRV3C蛋白酶裂解,并通过Resource Q阴离子交换柱和HiLoad 16/60 Superdex 75柱(GE Healthcare)在含50 mM NaCl和5 mM的10 mM Tris-HCl缓冲液(pH 7.2)中进一步纯化。 β-巯基乙醇。为了制备yNpl4 113-580 -yUfd1 288-305复杂结晶,两倍摩尔过量的GST-yUfd1的288-305在4℃下温育10分钟,yNpl4 113-580。GST-yUfd1 288–305 –yNpl4 113–580复合物在包含50 mM NaCl和5 mMβ-巯基乙醇的10 mM Tris-HCl缓冲液(pH 7.2)中通过HiLoad 16/60 Superdex 75色谱柱纯化。GST-yUfd1 288–305 –yNpl4 113–580的GST标签被HRV3C蛋白酶切割。为了除去GST,使样品通过预先用含有50 mM NaCl和5 mMβ-巯基乙醇的10 mM Tris-HCl缓冲液(pH 7.2)预平衡的谷胱甘肽琼脂糖凝胶FF柱。用pCold-SUMO或pET28a表达载体转化的细胞通过在含有150 mM NaCl和0.5%Triton X-100的50 mM Tris-HCl缓冲液(pH 8.0)中进行超声处理而破裂,并通过镍-三三乙酸镍(Ni- NTA)柱(Qiagen)和Resource Q阴离子交换柱(GE Healthcare),Cdc48除外。为了制备Cdc48,将表达Cdc48的细胞在含有300 mM NaCl,10%甘油,1 mM Tris(2-羧乙基)磷化氢盐酸盐(TCEP),5 mM的裂解缓冲液(50 mM磷酸钠缓冲液(pH 7.0))中裂解氯化镁2,以及100μMATP)并通过超声处理破坏。加入Triton X-100(终浓度为0.1%)后,将裂解物通过29,300 xg离心30分钟进行澄清。将得到的上清液与TALON树脂(Takara)一起温育。充分洗涤后,在CDC48含有100mM NaCl的,0.3M咪唑,5毫摩尔MgCl的50mM的HEPES-NaOH缓冲液(pH 7.1)洗脱2, 100μMATP和0.5mM TCEP。为了进一步富集六聚体Cdc48,将溶液加载到Superose 6 10/300色谱柱上,该柱平衡至50 mM HEPES-NaOH缓冲液(pH 7.5),该缓冲液包含100 mM NaCl,5 mM MgCl 2和0.5 mM TCEP,流速为0.25 mL min -1。准备yUfd1–His 6 -yNpl4 113–580在用于SPR分析的复合物中,将表达GST-yUfd1的细胞和表达His 6 -yNpl4 113-580的细胞混合,并在含1 mM DTT和0.5%Triton X-100的PBS中超声处理,同时破坏细胞。将澄清的裂解物上样到谷胱甘肽琼脂糖凝胶FF柱(GE Healthcare)上。GST-yUfd1–His 6 -yNpl4 113–580的GST标签被HRV3C蛋白酶切割,样品通过Ni-NTA柱(Qiagen)和HiLoad 16/60 Superdex 75柱(GE Healthcare)进一步纯化。含有150 mM NaCl的10 mM HEPES-NaOH(pH 7.5)。
Ub链和泛素化底物的制备
UB在被过量产生大肠杆菌菌株携带在含有50毫克的L LB培养基中的泛素基因的pET26b表达载体转化的Rosetta(DE3)细胞(Invitrogen)-1卡那霉素在20℃下。SeMet标记的Ub,Ub(P19M V26M)和Ub(I30M)在蛋氨酸营养缺陷型大肠杆菌 B834(DE3)细胞中在与LeMaster培养基等效的定制培养基(代码06780,Nacalai tesque)中过量生产用30微克毫升-1 升 -SeMet(NACALAI TESQUE)和50毫克的L -1卡那霉素在20℃下。通过在50 mM醋酸铵缓冲液(pH 4.5)中进行超声处理破坏细胞。清除的Ub和Ub变体裂解物分别在80和60°C孵育5分钟。变性和不溶通过以30,000 ×g离心60分钟使大肠杆菌蛋白质沉淀。上清液通过在含有50 mM NaCl的10 mM Tris-HCl缓冲液(pH 7.2)中的Resource S阳离子交换柱(GE Healthcare)和HiLoad 26/60 Superdex 75尺寸排阻柱(GE Healthcare)进行纯化。用Amicon Ultra-15 10,000 MWCO过滤器(Millipore)浓缩纯化的Ub。
酶促合成K48-,K63-和M1-Ub 4以及SeMet标记的K48-Ub 2。对于K48-Ub 4合成,将E1(0.25μM),E2-25K(5μM)和Ub(2 mM)在反应缓冲液(50 mM Tris-HCl(pH 9.0)包含10 mM ATP,10 mM中混合) MgCl 2和0.6 mM DTT),在37°C下孵育15小时。对于SeMet标记的K48-Ub 2合成,将E1(0.25μM),E2-25K(5μM)和Ub(2 mM)在反应缓冲液中混合,并在37°C下孵育15 h。对于K63-Ub 4合成,将E1(0.25μM),Ubc13(10μM),MMS2(10μM)和Ub(2 mM)在反应缓冲液中混合,并在37°C下孵育15 h。对于M1-Ub 4合成中,将E1(0.2μM),UbcH7(5μM),HOIP(残基697–1072; 0.1μM)和Ub(2 mM)在反应缓冲液中混合,并在37°C下孵育15 h。将每种反应溶液与四倍体积的50 mM乙酸铵缓冲液(pH 4.5)混合,并加载到用50 mM乙酸铵缓冲液(pH 4.5)预平衡的Resource S阳离子交换柱(GE Healthcare)上,该缓冲液含有140 mM NaCl。合成的Ub 4物种或SeMet标记的K48-Ub 2在50 mM乙酸铵缓冲液(pH 4.5)中用140-400 mM NaCl线性梯度洗脱。包含Ub 4物种或SeMet标记的K48-Ub 2的峰馏分将其装载到装有10 mM含150 mM NaCl的HEPES-NaOH(pH 7.5)的HiLoad 16/60 Superdex 75尺寸排阻色谱柱(GE Healthcare)上。将纯化的Ub链浓缩至〜1 mM,并保存在-80°C直至使用。
为了制备Ub n -GFP底物,使用Nde I和EcoR I位点将编码Ub-sfGFP-细胞色素b 2衍生的尾巴(Ub-GFP)42的基因克隆到pET21a表达载体中。Ub n -GFP底物酶促合成,并通过柱色谱法14纯化。对于K48-Ub n -GFP合成,将10μMUb-GFP,1μME1、20μMgp78RING-Ube2g2和400μMUb在含有10 mM ATP和10 mM MgCl的20 mM HEPES-NaOH缓冲液(pH 7.4)中孵育2在37°C下过夜。对于K63-Ub n -GFP合成,使用20μMUbc13 / MMS2,而不是20μMgp78RING-Ube2g2。泛ñ将-GFP底物与Ni-NTA珠粒结合,洗涤,然后在含有100mM NaCl和0.3M咪唑的50mM HEPES-NaOH缓冲液(pH 7.5)中洗脱。将洗脱液加载到Superdex 200增量10/300色谱柱上,该色谱柱平衡至含有100 mM NaCl和10%甘油的50 mM HEPES-NaOH(pH 7.5)缓冲液。收集含有长Ub链的馏分(平均约Ub 10)用于ATPase分析。
结晶
对于yNpl4 113-580和yNpl4 113-580 –yUfd1 288-305复合物的结晶,将E123A,K124A和E125A突变引入yNpl4 113-580,以减少过量的表面构象熵27。用于结晶的yNpl4 113-580 -SeMet标记K48-UB 2(WT,P19M V26M,或I30M)络合物,yNpl4 113-580与蛋氨酸标记的K48-UB混合2摩尔比为1:1.2。使用Mosquito液体处理机器人(TTP Lab Tech)在20°C下采用坐滴式蒸汽扩散法进行初始结晶筛选。我们用Hampton Research和Qiagen提供的结晶试剂盒测试了约500种条件。最初的命中进一步优化。yNpl4 113–580的最佳晶体通过坐滴蒸汽扩散法在20°C下生长,方法是将0.5μL蛋白质溶液与等量的含4%醋酸(pH 6.0)和12%PEG3350的储液混合,并与500μL的储液。yNpl4 113–580 –yUfd1 288–305的最佳晶体通过坐滴蒸汽扩散法,通过将0.2μL蛋白质溶液与等量的含90 mM Bis-Tris-HCl缓冲液(pH 7.5),19%PEG3350和10 mM ATP的储液混合,使复合物在20°C下生长并针对50μL的储液进行平衡。yNpl4 113–580 –SeMet标记的K48-Ub 2(WT)复合物的最佳晶体在20°C下通过坐滴式蒸汽扩散法生长,方法是将0.5μL蛋白质溶液与等量的100 mM Bicine-含34%PEG3350和200 mM Li 2 SO 4的 NaOH缓冲液(pH 9.0)并与500μL含100 mM Bicine-NaOH缓冲液(pH 9.0),18%PEG3350和200 mM Li 2 SO 4的储液平衡。yNpl4 113–580 –SeMet标记的K48-Ub 2(P19M V26M)复合物的最佳晶体在20°C下通过坐滴蒸汽扩散法通过将0.5μL蛋白质溶液与等量的100 mM Bicine混合而生长-含24%PEG3350、200 mM NaCl,3%1,5-二氨基戊烷和10 mM MgCl 2的NaOH缓冲液(pH 9.0),并针对500μL含100 mM Bicine-NaOH缓冲液(pH 9.0)的储液进行平衡%PEG3350和200 mM NaCl。yNpl4 113–580 –SeMet标记的K48-Ub 2的最佳晶体(I30M)复合物通过坐滴蒸汽扩散法在20°C下生长,方法是将0.5μL蛋白溶液与等量的100 mM Bicine-NaOH缓冲液(pH 9.0)混合,其中含有23%PEG3350、200 mM Li 2 SO 4,3%1,5-二氨基戊烷和10 mM MgCl 2,并与500μL含100 mM Bicine-NaOH缓冲液(pH 9.0),12%PEG3350、200 mM Li 2 SO 4和10 mM MgCl 2的储液平衡。数据收集,将晶体转移到cryostabilizing解决方案,这是一种含有30%甘油为yNpl4各个储库溶液113-580,20%甘油为yNpl4 113-580 -yUfd1 288-305或yNpl4 113–580 –SeMet标记的K48-Ub 2(WT,P19M V26M或I30M)的饱和海藻糖。将冷冻保护的晶体在液体N 2中快速冷冻。
结构确定
衍射数据集在SPring-8(日本兵库县)的SPring-8光束线BL41XU处收集。PILATUS36 M(Dectris)用于yNpl4 113–580和yNpl4 113–580 –SeMet标记的K48-Ub 的数据收集2和EIGER X 16 M(Dectris)用于yNpl4 113–580 –yUfd1 288–305的数据收集。yNpl4 113–580,yNpl4 113–580 –SeMet标记的K48-Ub 2和yNpl4 113–580 –yUfd1 288–305的数据收集波长分别为1.28260、0.97904 和1.00000Å 。使用HKL2000 43和CCP4程序套件44处理数据集。为了使用锌异常散射从SAD数据集中解决yNpl4 113–580的结构,Phenix程序用于重原子搜索,相位计算和密度修正45。yNpl4 113–580 –yUfd1 288–305和yNpl4 113–580 –SeMet标记的K48-Ub 2复合物的结构是通过分子替代方法使用程序MolRep 46确定的。yNpl4 113–580的晶体结构用作搜索模型。使用程序Ub的晶体结构MolRep(PDB 1UBQ []无法找到yNpl4-K48-Ub 2结构中Ub部分的溶液。https://doi.org/10.2210/pdb1ubq/pdb ])28作为搜索模型。我们使用程序Coot 47手动分配了剩余密度的Ub模型。yNpl4-K48-Ub 2(P19M V26M)和yNpl4-K48-Ub 2(I30M)结构中硒原子的异常差傅里叶图证实了K48-Ub 2的位置(补充图 1c)。使用Coot 47在仔细检查的情况下校正了原子模型。使用Phenix进行细化,并进行迭代校正和原子模型的细化。yNpl4 113-580或yNpl4 113-580的不对称单元中有一个结构的副本–yUfd1 288–305晶体。另一方面,在yNpl4 113-580 –SeMet标记的K48-Ub 2晶体的不对称单元中,有两个yNpl4 113-580和两个Ub(Ub dist和Ub prox)分子。yNpl4–SeMet标记的K48-Ub 2结构的精制过程中应用了扭转角NCS约束。yNpl4 113–580,yNpl4 113–580 –yUfd1 288–305和yNpl4 113–580 –SeMet标记的K48-Ub 2的最终模型具有出色的立体化学(表 1)。所有分子图形均使用PyMOL(DeLano Scientific;http://www.pymol.org)。
序列比对
使用程序ClustalW 48进行多序列比对。yNpl4和hNpl4之间的序列比对图是使用程序ESPript 3 49准备的。
SPR分析
使用Biacore T200(GE Healthcare)在25°C下进行SPR分析。通过胺偶联法将野生型或突变型His 6 -yNpl4 113-580,yUfd1-His 6 -yNpl4 113-580或His 6 -hNpl4 105-600固定在CM5传感器芯片上,在10 mM HEPES-NaOH中(pH 7.5)含有150 mM NaCl和0.05%Tween-20。每个实验中固定配体的量以补充图7中的响应单位(RU)表示 。Ub 2或Ub 4以两份系列稀释系列制备样品,然后将每份稀释样品以每分钟10μL的流速注入含有150 mM NaCl,0.05%Tween-20、10 mM HEPES-NaOH缓冲液(pH 7.5)的流速为60 s。和0.5g L -1 BSA。补充图7中示出 了Ub 2或Ub 4的浓度范围。使用Biacore T200软件计算平衡解离常数(K d)。数据显示为每个样品的三个独立实验的平均值±标准差。
基于荧光各向异性的亲和力测量
纯化的His 6 -SUMO-yUfd1 288-305 -GWCCPGCC在室温下用等摩尔比的FlAsH-EDT2(Santa Cruz)在50 mM含0.1%β-巯基乙醇的Tris-HCl缓冲液(pH 8.0)中标记。用PD-10脱盐柱(GE Healthcare)除去未反应的FlAsH-EDT2。为了测量yNpl4 113-580与yUfd1 288-305的结合亲和力(K d),将10μL1 nM FlAsH标记的His 6 -SUMO-yUfd1 280-305分成等分于384孔黑色,小体积和圆形底板(Corning)。他的6 -yNpl4 113–580以两倍系列稀释系列制备。将每个稀释样品10微升添加到含有FlAsH标记的His 6 -SUMO-yUfd1 280-305的孔中。荧光偏振记录通过使用Envision读板器(PerkinElmer)上λ EX = 480 nm和λ EM 在25 = 535纳米℃。用程序KaleidaGraph(HULINKS)计算K d(补充图 8)。在包含100 mM NaCl,5 mMβ-巯基乙醇和0.1 g L -1 BSA的50 mM Tris-HCl缓冲液(pH 8.0)中,对每个样品进行了三次测量。
酵母菌株和培养基
本研究中使用的酿酒酵母菌株列于补充表 2中。所有菌株对W303都是同基因的。除非另有说明,否则我们在低于25℃的YPD培养基(1%酵母提取物,2%蛋白ept,2%葡萄糖,400 mg L -1腺嘌呤硫酸盐和10 mg L -1尿嘧啶)中使用指数生长的酵母细胞。OD 600为0.8(在我们的培养物中,OD 600为1包含3.80×10 7个 细胞mL -1)。
酵母全细胞裂解液的免疫印迹
收获对应于1 OD 600的细胞,并用弱碱法提取50。通过在具有MES缓冲液(Thermo Fisher Scientific)的4-12%NuPAGE Bis-Tris凝胶(Life Technologies)上通过SDS-PAGE分离蛋白质,并在XCell II印迹模块(Life Technologies)上将其转移到PVDF膜(GE Healthcare)上。使用以下抗体进行免疫印迹:抗K48链的兔单克隆抗体(Apu2;以1:1000用于免疫印迹; Millipore,目录号05-1307),抗FLAG标签的小鼠单克隆抗体(M2,HRP缀合; 1) :2000; Sigma-Aldrich,目录号A8592),针对Cdc48的兔多克隆抗体(1:1000; Kimura博士的礼物)和针对Pgk1的小鼠单克隆抗体(22C5D8; 1:1000; Life Technologies,目录号459250)。用作二抗的HRP偶联山羊抗小鼠或兔Ig(1:10,000)购自Jackson ImmunoResearch Laboratories(Cat#315-035-048或Cat#111-035-144)。
酵母平板测试
酵母细胞在SC培养基(不含氨基酸的0.67%酵母氮碱基,0.5%酪氨基酸,2%葡萄糖,10 mM磷酸钾(pH 7.5),400 mg L -1腺嘌呤硫酸盐,10 mg L -1尿嘧啶,和20 mg L -1色氨酸)在25°C下。然后将过夜培养物的系列稀释液(1:5)点到SC琼脂平板上。
ATP酶测定
含有150nM的CDC48,150nM的UN异二聚体和150nM的泛素溶液(40μL)ñ -GFP衬底在反应缓冲液(50mM的HEPES-NaOH(pH7.5)中,50mM NaCl中,10毫摩尔MgCl 2,0.5mM的TCEP,0.1毫克(mL -1 BSA)在37°C下孵育15分钟。为此,添加了10μL1 mM ATP溶液和50μLBIOMOL Green。在Enspire2300(Perkin Elmer)中以5秒的间隔测量吸光度(600 nm)。曲线的初始线性部分(0至50 s)的斜率用于计算速率。将数据标准化为无底物的野生型Cdc48–UN复合物的ATP水解速率的平均值。
GST下拉测定
为了分析Cdc48复合物的形成,将GST-Npl4或GST-Ufd1(0.5μM)固定在5μL谷胱甘肽琼脂糖4B珠(GE Hearthcare)上,并在室温下与0.5μM结合伴侣(未标记的Ufd1或他的6标记的Npl4)和3μMCdc48(0.5μM六聚体)在100μL的50 mM Tris-HCl(pH 7.5)缓冲液中,其中含有100 mM NaCl,10%甘油和0.1%Triton X-100(结合缓冲液)。为了分析Ub链结合,在100μL结合缓冲液中加入1μgpolyUb链。为了分析随着浓度增加的yUfd1进行的Ub链结合,将50μL的polyUb链和0、0.25、0.5、1、2或4μMyUfd1添加到50μL的结合缓冲液中。用结合缓冲液洗涤3次后,将结合的蛋白用NuPAGE LDS样品缓冲液(Thermo Fisher Scientific)在70°C下洗脱10分钟。洗脱的蛋白通过在4–12%NuPAGE Bis-Tris凝胶上的SDS-PAGE分离,并用Bio-Safe考马斯亮斑(Bio-Rad)可视化。如上所述用抗Ub的小鼠单克隆抗体(P4D1,HRP缀合; 1∶500; 1∶500; 1∶500; 1∶500; 1∶500; 1∶500)进行免疫印迹。
3xFLAG标签的NPL4蛋白的免疫沉淀
细胞裂解和免疫沉淀基本上如先前所述进行15。对于抗FLAG免疫沉淀,通过在4°C下孵育1 h,使用5μL抗DDDDK标签的mAb-磁珠(MBL M185-11)从1 mg细胞裂解物中沉淀FLAG标签的蛋白复合物。用缓冲液A(50 mM Tris-HCl(pH 7.5),100 mM NaCl,10%甘油,10μM硼替佐米(LC Laboratories),10 mM碘乙酰胺和1x完全蛋白酶抑制剂混合物(不含EDTA; Roche)洗涤3次后含有1%Triton X-100的蛋白质,将结合的蛋白质在70°C下用1X NuPAGE LDS样品缓冲液洗脱10分钟。
报告摘要
有关研究设计的更多信息,请参见与本文链接的《 自然研究报告摘要》。
资料可用性
yNpl4,yNpl4–K48-Ub 2和yNpl4–yUfd1 的坐标和结构因子已保存在蛋白质数据库中,登录号为6JWH [ https://doi.org/10.2210/pdb6jwh/pdb],6JWI [ https://doi.org/10.2210/pdb6jwi/pdb ]和6JWJ [ https://doi.org/10.2210/pdb6jwj/pdb ]。图1和2的未裁剪的凝胶和印迹图像。 2 d,3 e–f和4a–b以及补充图。 1 d,3 a–d,5 a–e和6c作为源数据文件提供。根据合理的要求,其他数据可以从相应的作者处获得。
|
|