STING信号和宿主防御微生物感染
STING信号和宿主防御微生物感染
摘要
宿主抵抗传染原的第一道防线涉及识别特定病原体相关分子模式(PAMP)的先天免疫信号通路的激活。现在已知先天免疫信号的关键触发因素包括微生物特异性核酸,该核酸可在细胞的细胞质中快速检测到。例如,RIG-I样受体(RLR)已进化为检测病毒RNA种类并激活刺激防御性免疫反应的宿主防御分子和细胞因子的产生。此外,宿主防御对策,包括产生I型干扰素(IFN),也可以由细菌,病毒甚至寄生虫产生的微生物DNA触发,并受胞质传感器,干扰素基因刺激物(STING)调控。STING依赖性信号传导是由感染后细胞内细菌产生的环二核苷酸(CDN)引发的。在与侵入性胞质自身DNA或微生物DNA物种相互作用后,CDN也可以通过细胞合酶cGAS合成。由于许多病原体已开发出预防STING功能的策略,因此STING信号在宿主防御中的重要性显而易见。在这里,我们审查了STING控制的先天免疫信号在抵抗病原体入侵的宿主防御中的相关性,包括微生物努力破坏这一关键过程。由于许多病原体已开发出预防STING功能的策略,因此STING信号在宿主防御中的重要性显而易见。在这里,我们审查了STING控制的先天免疫信号在抵抗病原体入侵的宿主防御中的相关性,包括微生物努力破坏这一关键过程。由于许多病原体已开发出预防STING功能的策略,因此STING信号在宿主防御中的重要性显而易见。在这里,我们审查了STING控制的先天免疫信号在抵抗病原体入侵的宿主防御中的相关性,包括微生物努力破坏这一关键过程。
介绍
先天免疫系统包括宿主防御到计数器侵入微生物剂最前面线1,2。在过去的二十年中,宿主模式识别受体(PRR)已显示在识别非自我的,病原体相关的分子模式(PAMP)中起关键作用。现在已经报道了多种PRR,包括Toll样受体(TLR),核苷酸结合寡聚域(NOD)样受体(NLR)和RIG-1样受体(RLR)1。TLR识别细胞外或内体PAMP,例如脂多糖(LPS),鞭毛蛋白,单链RNA,双链RNA和CpG DNA,以激活通过NF-κB,干扰素调节因子(IRF)和MAP激酶信号传导途径的信号传导,诱导细胞因子产生2。NLR还可以识别PAMP以及与损害相关的分子模式(DAMP),包括受损细胞释放的尿酸,从而触发促炎性细胞因子的产生 3。RLRs特异性识别病毒RNA种类并激活类似的转录因子和相应的宿主防御相关分子 1。此外,已知胞质DNA种类的存在可以类似地触发细胞因子的产生 4。发生这种活性的原因是,细胞质通常是无DNA的区域,并且这种核酸的存在通常表示入侵细胞内微生物的到来,或者由于DNA损伤事件甚至从核中泄漏了自身DNA。现在已知通常长度超过70 bp的胞质dsDNA能够激活宿主环GMP-AMP合酶(cGAS),后者会生成环二核苷酸(CDN)。这些分子结合,进而,于内质网(ER)相关传感器称为干扰素基因(STING),刺激器,其结果在NF-κB-和IRF3依赖性细胞因子产生4,5,6,7。还已知细胞内细菌会产生并分泌直接激活STING信号传导的CDN。事实上,大量的DNA的微生物现在已经牵连在无意中触发STING依赖性先天免疫信令和诱导细胞因子的产生,包括I型干扰素(IFN)的4,7。作为响应,越来越多的证据表明,多种微生物已尝试发展抑制STING依赖性信号传导的策略。在这里,我们回顾了STING控制的先天免疫在预防微生物感染中的重要性,强调了其中一些病原体如何试图破坏这一关键的宿主防御过程。了解这种宿主-病原体的相互作用对开发新的抗传染病治疗策略具有重要意义。
STING信号的激活
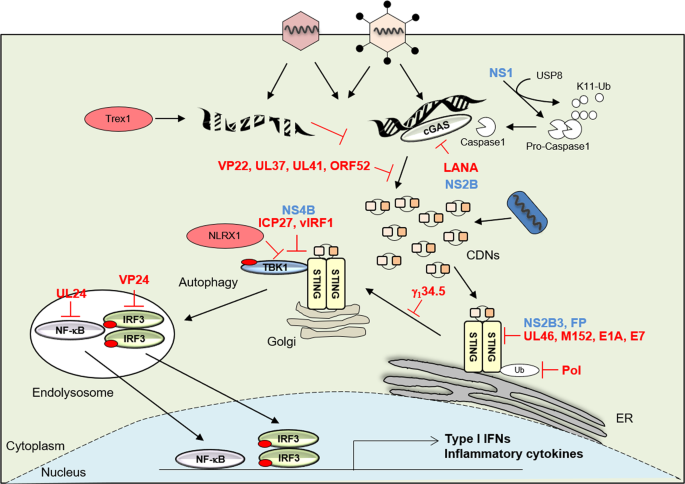
该传感器STING发现以下的高通量,可以激活所述启动子的IFNβ的细胞分子的筛选4,5。斯汀,也称为跨膜蛋白173(TMEM173),是一个379或378在人或小鼠的细胞,分别氨基酸蛋白4,5,8,9,10。在正常情况下,STING位于ER内,主要在造血细胞(包括巨噬细胞,树突状细胞,自然杀伤细胞和T细胞)以及可能暴露于环境中的内皮和上皮细胞中表达易受感染剂4,5。STING是一种由CDN激活的传感器,例如循环di-AMP,循环di-GMP和循环GMP-AMP(3'3'-cGAMP; cyclic [G(3',5')] pA (3',5')p),由单核细胞增生性李斯特菌等胞内细菌分泌,或由非规范的环状GMP-AMP(2'3'-cGAMP;环状[G(2',5')] pA分泌(3',5')p))通过产生CGAS 11,12,13,14,15,16,17。的CDN的感测和相互作用诱导STING和构象变化的触发器从ER与TANK结合激酶1(TBK1)螫络合的贩卖到内体/溶酶体核周区域4,5,18。此事件模拟自噬的形式4,19。易位TBK1导致转录因子的磷酸化干扰素调节因子-3(IRF3)和核因子κB(NF-κB),其易位至细胞核并启动先天免疫基因转录20,21(图1)。在这些事件之后,STING活性受到抑制,然后STING迅速降解,以避免持续的细胞因子产生,这可能导致自身炎症性疾病20。
现在是有据可查的STING起着响应于序列非特异性胞质DNA种类,在人类细胞比〜70 bp的更大的诱导I型IFN起重要作用4,5。对大型dsDNA物种的需求可能是因为cGAS需要呈二聚体形式才能具有活性,这一事件需要两个dsDNA分子,可能自身折叠。这样的DNA可以构成双链DNA寡核苷酸,单链DNA形成双链发夹,质粒和viral-,细菌-或寄生虫相关DNA 4,5。与野生型小鼠相比,敲除ing毒的小鼠在HSV-1感染后显示出高死亡率4。STING也已显示出对巨细胞病毒(CMV),牛痘病毒(VVΔE3L)和杆状病毒4诱导的I型干扰素的产生至关重要。此外,细胞内细菌,如李斯特菌和许多其他国家,可以直接分泌STING活化的CDN 22,23。STING不参与dsRNA信号传导,例如由poly(I:C)参与,而后者主要受RLR 4支配。尽管如此,STING的损失使小鼠更易于感染通过选择RNA病毒,如水泡性口炎(VSV),表明可以STING在维持免疫稳态中发挥重要作用4,5,24。集体而言,瞬时STING信号传导在保护宿主免受多种病原体的侵害中起着关键作用,如下文更详细描述。然而,慢性STING活动可以发挥自身炎症性疾病的发展中的作用,强调的严密控制这一关键先天免疫信号通路的重要性25,26。这种现象可能表明,由慢性感染引起的炎症事件也可能与STING通路有关,尽管这种可能性有待进一步阐明25。
DNA病毒的激活和逃避STING依赖的先天免疫
各种DNA病毒已报道激活STING信令4,5。该机制仍不清楚,但大多数的这些病毒注入其基因组从它们的衣壳进入细胞核,当他们到达核孔4,6,27,28。因此,微生物DNA可能会暴露并易于与cGAS / STING相互作用。STING或CGAS基因敲除小鼠,以及分离的巨噬细胞和树突状细胞从那些小鼠,已被证明是容易受到单纯疱疹病毒1(HSV1)和其它DNA病毒4,6。但是,尽管此类试剂可能会无意中激活STING,但许多病毒已开发出抑制STING信号存活的策略。例如,据报道,许多HSV编码产品消除了cGAS / STING介导的信号传导,包括ICP27,γ34.5,UL24,UL36,UL37,UL41,UL42,VP11 / 12,VP22和VP24。 。1和表1)29,30,31,32,33,34,35,36,37。HSV编码一个约150,000 bp的大dsDNA基因组,并且主要保留在周围神经元的潜伏期38。在一种情况下,克里斯滕森(Christensen)等人。表明ICP27易位至细胞质,与TBK1和STING相互作用并抑制IRF3活化29。还已经报道了HSV-1γ34.5通过破坏STING从内质网向高尔基体的转运36而使STING失活。HSV 1种丝氨酸蛋白酶VP22和VP24已经显示出有选择地阻断STING激动剂诱导的磷酸化和IRF3的二聚化而不是NF-κB活化30,31。VP22还与cGAS相互作用以抑制其酶活性31。已显示UL24通过选择性阻断核因子-κB(NF-κB)而不是IFN-调节因子3的功能来预防cGAS / STING介导的IFNβ和白介素6(IL-6)的产生35。已证明最丰富的HSV皮膜蛋白之一UL46与STING相互作用以防止活性32。也有报道说,另一种被膜蛋白UL41减少了cGAS的积累,从而阻止了CDN的产生33,以及UL37脱酰胺化的cGAS,同样导致CDN的产生受损34。最后,HSV-1泛素特异性蛋白酶(UL36USP)拮抗STING途径诱导的NF-kB激活37。目前尚不清楚为什么HSV可以编码这么多种明显的方法来预防STING信号传导,但是抑制该途径对其生存必不可少。也许该疱疹病毒成员在其生命周期的不同阶段(从进入到潜伏期到其裂解阶段)都采用了多种抑制方法。
但是,疱疹病毒家族的另一个成员卡波西氏肉瘤疱疹病毒(KSHV),称为人疱疹病毒8(HHV-8),同样是一种大型双链DNA病毒,能够触发STING活性,从而引起卡波西氏肉瘤(KS)39。然而,马等人。报道说,KSHV编码的vIRF1通过阻止STING与TBK1 40相互作用而抑制了该途径。Wu等。另有报道称,KSHV ORF52是一种丰富的伽马疱疹病毒特有的被膜蛋白,可能通过与DNA激动剂和cGAS 41结合而阻碍CDN的产生。此外,KSHV的潜伏期相关核抗原(LANA)可能通过直接结合cGAS抑制STING信号传导。可以想象这种作用可以拮抗cGAS介导的KSHV裂解复制的限制42。疱疹病毒家族的其他成员是否抑制STING信号仍有待观察。例如,CMV具有以下感染被报道触发STING信令 43,44。至少在小鼠中,鼠CMV(MCMV)可能编码称为M152的产物,该产物与STING结合以抑制该反应 45。水痘带状疱疹病毒(VZV / HHV3)也已被证明可以触发STING信号传导,尽管尚未报道直接抑制信号传导。但是,应该指出的是,这些病毒和其他病毒中的许多也已显示在IRF3或Jak / STAT信号传导水平抑制STING下游的干扰素信号传导,表明对宿主防御反应的抑制在许多水平发生 46,47,48。
包含环状DNA基因组的乙型肝炎病毒(HBV)特别感染肝细胞并引起慢性肝炎49。有证据表明,HBV可以降低瞬时转染HBV的Huh7细胞中IFNβ的产生。稳定产生HBV的细胞系,例如HepAD38;HBV感染的HepaRG细胞;和原代人肝细胞。HBV的病毒聚合酶(Pol)已通过其逆转录酶(RT)域50干扰STING的K63连锁多聚泛素化。然而,至少在STING中,HBV感染是否在肝细胞中引起可检测的细胞因子应答仍存在争议。虽然一组报道,人肝癌细胞以及永生化小鼠肝细胞表达刺痛低水平51,52另一个小组指出,人类和鼠类肝细胞不表达STING,也不响应外来DNA或HBV感染而产生I型干扰素51。实际上,很容易推测某些病毒可能针对的细胞可能缺乏某些先天的免疫感应途径。然而,作为肝中的星状巨噬细胞的库普弗细胞可能表达STING,并有助于清除垂死的感染肝细胞,从而可能影响炎症。
其他双链DNA病毒,如腺病毒(AD)和人乳头状瘤病毒(HPV),已同样被证明拮抗CGAS / STING DNA感测通路27,28,53。以下广告感染,将细胞在STING或CGAS表达缺陷的,注意到缺少IRF3磷酸化,和IFNβ或IRF3应答基因,如ISG15和ISG54活化,被攻破27,53。据报道,来自Ad的致癌基因E1A和来自HPV的E7通过直接与STING结合来抑制cGAS / STING途径。抑制E1A和E7表达可以恢复I型干扰素的产生28。最后,Eaglesham等。结果表明,大的细胞质DNA病毒,痘苗病毒通过裂解CDN的Poxin的产生同样抑制STING。总的来说,DNA病毒已经发展出抑制dsDNA触发的先天免疫信号转导的机制,这也许不足为奇。这里提到的许多病毒可以保持潜伏状态,甚至有助于肿瘤发生。尚不清楚抑制STING信号是否会影响转化过程。证据现在指示STING信令在许多类型的肿瘤细胞被抑制,可能是为了避免DNA损伤激活的免疫应答54,55。另外,已经表明STING活性对于产生抗病毒以及抗肿瘤T细胞是重要的。因此,抑制cGAS / STING不仅可以帮助DNA病毒存活,还可以促进细胞转化。
STING信号通路与逆转录病毒感染
据报道,宿主防御基因的诱导在逆转录病毒/慢病毒进入56后也发生。感染后,病毒单链RNA基因组被逆转录并通过成熟的整合复合物传递至细胞核。据报道STING与此类复合物共定位57。也许是这样的结果,cGAS / STING基因敲除小鼠在HIV,鼠类白血病病毒和猿猴免疫缺陷病毒触发的I型IFN产生中存在缺陷7。但是,I型IFN的产生通常较弱。这种现象可能是由于细胞质中的激动剂病毒DNA被细胞质DNase降解,例如Trex1,一种3'-5'核酸外切酶58。在没有Trex1的情况下,基因组或病毒DNA会积聚在细胞质中并激活STING依赖性先天免疫信号传导59。在人类中,在TREX1突变引起的炎性疾病,如Aicardi-Goutieres综合征(AGS)和严重的系统性红斑狼疮(SLE)26,60,61。在实验条件下,据报道Trex1缺乏导致HIV复制增加和I型IFN产生61。此外,已在人类中记录到Trex1中的两个单核苷酸多态性(SNP)与HIV-1疾病进展加快和HIV复制增加有关62。另一个先天免疫的负调节剂,即核苷酸结合结构域的成员,富含亮氨酸的重复序列蛋白(NLR),NLRX1,也被描述为与STING相关联,以降低TBK1活性并增加HIV-1感染63,64。人类T淋巴病毒1型(HTLV-1)是三角洲逆转录病毒家族的成员,是成人T细胞白血病(ATL)和热带痉挛性轻瘫(TSP)65的病原体。HTLV-1逆转录中间体(RTIs)已显示在分化的人类巨噬细胞(包括THP1细胞)中触发STING依赖的IFNβ产生。也有报道称HTLV-1 RTI与STING相互作用并诱导IRF3-Bax络合,导致细胞凋亡66。HTLV-1蛋白税已被证明可通过影响STING的K63连锁泛素化来破坏STING与TANK结合激酶1(TBK1)67的相互作用,从而削弱IFNβ的产生。因此,逆转录病毒/慢病毒已经进化以避免鲁棒的STING活化,并可能由诸如Trex1的分子辅助。应该注意的是,多达10%的人类基因组包含称为人类内源性逆转录病毒(ERV)68的古代逆转录病毒的版本。此外,超过40%的人类基因组由逆转录转座子组成,逆转录转座子是可以转录成RNA并通过逆转录转座子本身编码的逆转录酶转换回相同DNA序列的DNA成分68。目前还不清楚活化引起的炎性疾病时,例如ERVs或反转录转座子是否加重先天免疫信号59,69,70。
RNA病毒感染和STING依赖的先天免疫
如所讨论的,STING信号传导控制CDN和胞质DNA触发的先天免疫信号传导。但是,早期研究很快表明,STING基因敲除小鼠也容易感染RNA病毒,例如VSV 4。通常,这些途径是由RLR途径,TLR3和TLR7管辖1,2。但是,在感染了VSV的STING基因敲除细胞中,I型IFN的产生减少了。该结果表明,STING对于保护某些RNA病毒4也是必要的。最近,有报道称STING也可能在翻译后水平上限制各种RNA病毒的复制71。这种效果可能是由于STING驻留在细胞的ER和与所述转位子,其中蛋白质目的地为糖基化和/或分泌被保持为适当的成熟门户相关联的5,25。STING在translocon功能中的作用仍有待阐明。无论如何,现在越来越多的证据表明某些RNA病毒靶向STING进行抑制(图1和表2)。
丙型肝炎病毒(HCV)是黄病毒科中的一种有包膜的,正义的,单链RNA病毒,可引起肝炎并促进癌症的发展,例如肝细胞癌72。NS3 / 4A和NS4B是HCV的丝氨酸蛋白酶,靶向IPS1 / MAVS / Cardif(一种含CARD的衔接蛋白)来阻断I类IFN通过RLR的产生73。另外,观察到STING依赖性IFNβ激活被NS4B 74抑制。可能的是,NS4B破坏STING和TBK之间在STING-和TBK1过度表达细胞与转染NS4B质粒的相互作用75,76。与HBV感染情况相似,尚不清楚STING是否在HCV感染的肝细胞中高表达。但是,枯否细胞可能在病毒清除中起关键作用,并且在与肝炎相关疾病相关的炎症中可能起关键作用。
登革热病毒(DENV)是蚊子传播的单链正链RNA病毒,属于黄病毒科,可引起人类出血热77。已经证明DENV NS2B3蛋白酶可以通过其蛋白水解活性抑制I型IFN的产生。已经表明,DENV的蛋白酶靶向并切割野生型STING以阻止I型IFN的产生。DENV复制在STING缺陷型的原代细胞高度增加78,79。最近,Aguirre等人。报道NS2B还以自噬-溶酶体依赖性机制降解cGAS为目标,以防止感觉到DENV感染期间释放的线粒体DNA 80。此外,登革热病毒2(DENV2)的蛋白酶可切割人但不切割灵长类动物STING,从而减少I型干扰素的产生并提高病毒效价81。然而,另一种类似于DENV的正链RNA病毒是寨卡病毒(ZIKV),该病毒于1947年在乌干达首次分离出来。最近,2015年在巴西发现了一次大规模的不适病,涉及寨卡病毒感染。此后,爆发病例和传播证据很快就在世界范围内出现,包括在美洲。据报道,ZIKV的不同的非结构蛋白,例如NS1和NS4B,会降低先天的抗病毒反应,从而逃避宿主的免疫反应82。与DENV相似,ZIKV的NS2B3蛋白酶在人类STING 83的细胞质环中切割R78和G79。。在对ZIKV宿主嗜性的分析中,与人类不同,啮齿动物对ZIKV感染不敏感。这种差异可能是由于R78和G79在STING 83的鼠直系同源物中仅部分保守的缘故。另外,Zheng等。已经显示ZIKV的NS1蛋白募集去泛素酶USP8以在caspase-1的赖氨酸134处裂解K11连接的泛素链。随后,caspase-1将cGAS靶向切割,导致IFN产生减少84。已知ZIKV会导致新生儿小头畸形,尽管尚不清楚该综合征的机制和发生频率。一组研究表明,依赖STING的信号传导在抗病毒的巨噬细胞自噬/自噬中发挥作用,以限制果蝇ZIKV感染。这项研究果蝇揭示了保护宿主细胞从病毒入侵关键洞察STING的进化功能在抗病毒防御和进一步证明自噬的祖传功能85,86,87。
相比之下,甲型流感病毒(IAV)是可能抑制STING信号传导的负义单链分段病毒88。在这方面,据报道,IAV的血凝素融合肽(FP)与STING相互作用,以STING依赖但cGAS独立的方式拮抗I型IFN的产生89。
因此,STING在保护宿主免受微生物感染方面也可能起进化上的重要作用。有鉴于此,值得注意的是,许多RNA病毒,包括DENV和ZIKV,都能够感染人类和昆虫细胞。尚不清楚如果表达STING,此类病毒是否会抑制其昆虫宿主中的STING。实际上,许多病毒可能只能在缺少STING或类似先天免疫途径的宿主/细胞中成功。
细菌,CDN和依赖STING的先天免疫
STING是的CDN的直接传感器,包括c-二GMP和c二AMP,由许多细胞内细菌,如产生的李斯特菌90。CDN在这种细菌的生命周期中起着重要的作用,起着第二信使的作用11。李斯特菌(L.菌等)感染据说诱导野生型鼠成纤维细胞,巨噬细胞,和树突状细胞和体内,这是通过的CDN依赖STING I型IFN和IL-6 4,23,91。单核细胞增生李斯特氏菌通过多药外排泵(MEPs)11分泌c-di-AMP 。此外,单核细胞增生李斯特菌DNA还能够刺激人巨噬细胞STING / cGAS途径中的IFN反应22。STING可能演变为在进化的早期阶段检测CDN。合成酶cGAS可能在与DNA相互作用后进化为CDN。因此,在成为由DNA 5触发的先天免疫信号传导途径的中心之前,STING可能主要参与了对细菌感染甚至RNA病毒感染的先天免疫(通过其推测的转录功能)。
细胞外病原体,例如肺炎链球菌(S. pneumoniae),是65岁以上人群死亡的一些主要原因。肺炎链球菌已经已知诱导I型IFN和通过STING调节RANTES生产92,93。肺炎链球菌感染后,老年小鼠中STING依赖性I型IFN的产生减少。肺炎链球菌感染诱导内质网应激,并增加肌醇需求蛋白1 / X-box结合蛋白1介导的自噬相关基因9(Atg9a)的产生94。Saito等。结果表明,Atg9的缺失增强了STING / TBK1的装配并增加了先天免疫信号19。该结果表明内质网应激引起的Atg9诱导可降低肺炎链球菌感染引起的STING活性,为为什么老年人更易受感染提供了新的证据。
结核分枝杆菌(结核分枝杆菌)仍然是慢性传染性肺病的主要原因之一95。结核分枝杆菌激活细胞溶质监视途径(CSP),并在吞噬体膜穿孔后诱导先天免疫应答。这种作用是由微生物的ESX-1分泌系统与目标巨噬细胞96相互作用后介导的。由ESX-1介导的通透性可使泛素介导的自噬途径的胞质成分进入吞噬体中的结核分枝杆菌。因此,STING途径识别细胞外细菌DNA并激活先天免疫应答96,97,98,99。的CDN还可以通过这样的微生物,它可以直接激活STING产生100,101。Dey等。报道,C-二AMP产生由结核分枝杆菌对照感染的命运通过刺激IFNβ生产,即实际上可促进细菌存活的事件100,101。
除了这里描述的细菌外,据报道还有其他各种微生物,如衣原体,弗朗西斯菌,布鲁氏菌,志贺氏菌,沙门氏菌和奈瑟菌,也参与了STING依赖性途径102。然而,尽管STING可能已经通过识别所产生的CDN进化为识别细菌感染,但是此类CDN在操纵STING信号传导中甚至可能促进其生存的作用仍然是一个有趣的研究领域,这很可能将有助于解释发病机理。102。
寄生虫,疟疾和STING信号
疟原虫寄生虫引起疟疾,这是一种使人衰弱的疾病,影响全世界数百万人。疟疾的感染是由蚊子叮咬宿主后,通过注入感染性子孢子而引发的。这些子孢子通过血流转移到肝脏。在肝脏中复制后,感染性外红细胞裂殖子被释放到血液103中。米勒等。结果表明,肝脏中的疟原虫可诱导I型干扰素介导的先天免疫反应。I型干扰素激活NKT细胞,后者产生干扰素γ以抑制继发性肝阶段感染104。红细胞内的疟疾特异性寄生虫分泌含有寄生小RNA和基因组DNA的细胞外囊泡(EVs)。人类单核细胞可以吸收电动汽车,寄生DNA被释放到宿主细胞的胞质溶胶中,在那里STING被激活105。然而,还已经显示,在鼠模型106中,pDC中的TLR7还可以响应于疟疾感染而促进I型IFN产生。因此,STING信号传导可有助于保护宿主抵抗疟疾。STING是否在保护宿主免受其他类型的寄生虫侵害中也起着关键作用尚待观察。
STING在新的抗病原体策略中的潜力
STING信号传导在响应于微生物感染而刺激免疫系统中起着重要作用,表明对该途径的控制可能在控制疾病的抗菌策略中很有用。如所描述的,各种的CDN,例如环状二AMP,环状二GMP,和cGAMP(和合成类似物),能刺激STING活动12,14,15,16。事实上,STING激动剂现在正在临床评估,以增强抗肿瘤免疫力107,108,109,110。有证据表明,将CDN注入肿瘤会刺激周围的抗原呈递细胞(APC)增强抗肿瘤CTL活性111,112。同样,可能的比较策略可能会发挥有用的抗菌活性。在一个实例中,报告表明全身或局部应用2'3'-cGAMP可以减少生殖器HSV-2复制并改善感染的临床结果,并在人细胞和体内小鼠体内强烈诱导I型IFN 113。
除CDN外,还报道了其他的STING激动剂。例如,5,6-二甲基呫吨-4-乙酸(DMXAA)和10-(羧甲基)-9(10H)吖啶酮(CMA)是有效地结合并激活STING信令黄酮114,115。在乙型肝炎病毒(HBV)流体动力学小鼠模型中,DMXAA诱导了IFN刺激的基因,并降低了小鼠肝脏中HBV DNA复制。由于慢性HBV感染涉及宿主无法诱导足够的免疫反应来清除病毒,因此此类策略表明激动剂激活STING途径可用于治疗此类疾病116。在另一个实例中,一个小组通过高通量体外筛选鉴定了新的诱导IFN / IRF3的分子,称为4-(2-氯-6-氟苄基)-N-(呋喃-2-基甲基)-3-氧-3,4-二氢-2H-苯并[b]噻嗪-6-羧酰胺(G10)和N-(甲基氨基甲酰基)-2-{[5-(4-甲基苯基)-1,3,4-恶二唑-2基]硫基} -2-苯基乙酰胺(C11)117,118。据报道,G10诱导IFN / IRF3依赖性信号传导,但不诱导NFĸB信号传导。该化合物介导的抗基孔肯雅病毒(CHIKV),委内瑞拉马脑炎病毒(VEEV)和辛德比斯病毒(SINV)的抗α病毒活性,需要STING依赖性,但不需要IPS-1 / MAVS依赖性信号传导118。C11还能够以需要STING但不需要MAVS或TRIF的方式诱导人细胞中的IFN分泌。经C11处理的细胞有效地阻止了多种新出现的alphavirus类型的复制,包括基孔肯雅热,罗斯河,委内瑞拉马脑炎,Mayaro和O'nyong'nyong病毒117。因此,使用STING激动剂在治疗微生物疾病以及免疫癌症治疗中可能是有益的。
最后,值得注意的是,STING激动剂也可用作疫苗佐剂,用于刺激STING依赖性先天免疫途径。许多例子都表明这些方法的有用性在疫苗开发,以防止微生物107,108,109,110,116,117,118。例如,CDN配制的疫苗在鼠模型中引起了针对结核分枝杆菌的长期保护性免疫,类似于目前使用的减毒活疫苗株(如BacilleCalmette-Guérin(BCG)119)引起的鼠模型。
STING信号通路的发现为微生物发病机理,宿主防御机制以及炎症性疾病甚至癌症的成因提供了相当多的见识。这些发现导致了对控制STING途径是否可以产生新疫苗以及控制多种疾病的抗菌剂的研究
|
|