PKD1的猴子突变概括了人类常染色体显性多囊肾疾病
PKD1的猴子突变概括了人类常染色体显性多囊肾疾病
摘要
由PKD1突变引起的常染色体显性遗传性多囊肾疾病(ADPKD)是最常见的遗传性疾病之一。但是,由于在啮齿动物模型中没有概括关键的疾病表型,包括杂合子中的疾病发作,因此在症状发生前阶段囊肿发展和恶化的关键病理过程仍然是未知的。在这里,我们使用CRISPR / Cas9 在食蟹猴中生成具有PKD1突变的ADPKD模型。与人类和小鼠一样,PKD1几乎完全耗尽,主要在集管中引起严重的囊肿形成。重要的是,与小鼠不同,PKD1杂合子猴在远端肾小管周围形成囊肿,这可能反映了人类的初始病理。这些模型中的许多猴子在囊肿形成后存活,并且囊肿随着年龄的增长而发展。此外,我们成功地使用等位基因特异性靶向产生选择性杂合突变。我们建议我们的模型阐明ADPKD的发生和发展,这将成为建立新的治疗策略(包括药物治疗)的关键基础。
介绍
常染色体显性多囊肾病(ADPKD)是最常见的遗传性疾病之一,在出生估计为1 400至1 1000的入射(参考文献1,2,3),并且是10,15,和20分别是镰状细胞病,囊性纤维化和亨廷顿病的4倍4。据估计,全世界有600万人患有ADPKD,其中一半以上会发展为终末期肾脏疾病,并在60岁之前需要透析或肾脏移植(参考文献5)。尽管许多重要发现进行了报道,并基于使用动物疾病模型和细胞组织培养模式研究许多治疗方法已经被提出了ADPKD 6,7,8,9,10,11,而实际上一些药物已经用于缓慢症状进展12,没有明确的治疗目前已经上市。
合理地假设生理和遗传差异可以解释为什么ADPKD药物在小动物和人类之间产生不同的反应的原因。在小鼠模型中,人类疾病的病理概括是有限的,因为人与小鼠之间的生理机能存在明显差异。某些疾病,如帕金森氏病,阿尔茨海默氏病,艾滋病和流行性感冒,不能在小鼠体内概括13。大多数人的多囊肾患者PKD1杂合子在一个等位基因胚系突变14,15。这种疾病的表现通常不会出现数十年,而是Reed等人的一项大规模研究。16结果表明,在有ADPKD家族史的420名儿童中,有46%的人患有肾囊肿。鉴于一半的儿童带有致病突变,因此92%的ADPKD儿童最终应表现出囊肿发展。早期的囊肿形成也与诱导的突变杂猪,猫和狗的观察自发突变17,18,19。相比之下,杂合缺失Pkd1基因在小鼠很少导致囊肿的形成,直到接近生命的尽头,出生后左右1.5年20,21。尽管有许多类型的鼠标ADPKD模型,包括Pkd1或Pkd2敲除(KO),条件性KO和亚型突变的诱导,一致的囊肿形成在大多数模型中需要双等位基因突变22。此外,在多囊肾病研究,如JCK小鼠,小鼠PCY,汉使用其他疾病的动物模型:SPRD-CY老鼠,老鼠PCK,在其他基因如突变NEK8,Nphp3,Pkdr1和PKHD1, 分别。因此,啮齿动物模型不能精确地概括人类疾病状态。为了克服这些局限性,我们旨在在与人类密切相关的物种食蟹猴中创建一种新型ADPKD模型动物。在通过CRISPR / Cas9基因组编辑产生的物种中,食蟹猴在生理和遗传上是与人类最接近的物种之一23。
在这里,我们使用CRISPR / Cas9技术生成了具有不同程度囊肿形成的PKD1 KO或镶嵌猴,并揭示了囊肿上皮细胞的谱系。此外,我们生成具有常规或等位基因特异性基因靶向的杂合猴子,这些猴子揭示了围产期存在囊肿,代表了该病的最早表现。
结果
PKD1突变猴子的囊性严重程度不同
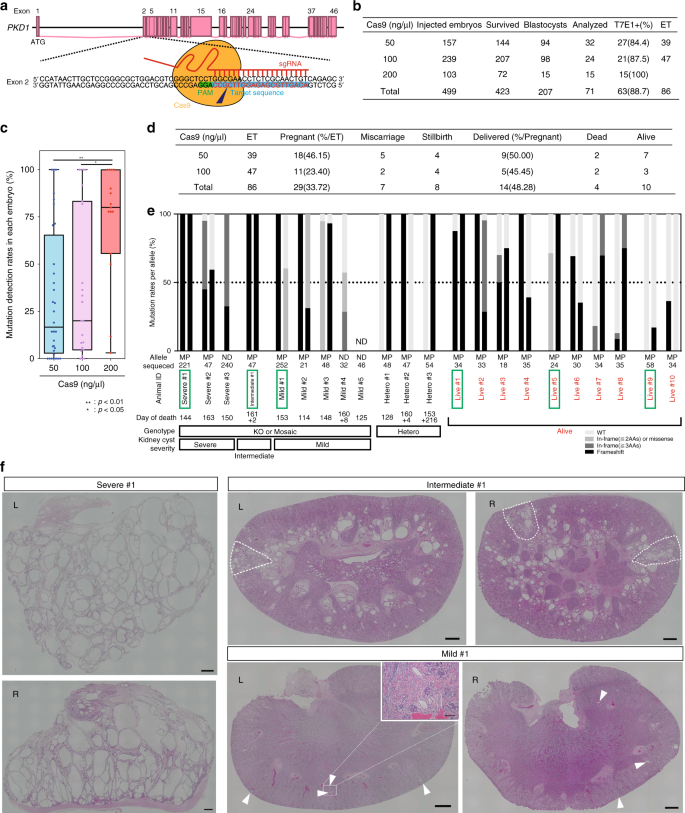
为了有效引入功能缺失突变,我们在PKD1外显子2中设计了sgRNA,因为该区域的移码突变会导致PKD1的翻译产物polycystin-1(PC1)大量丢失(参考。24)(图 1a)。然后,我们使用单链退火(SSA)分析25(补充图 1a,b)选择了最有效的sgRNA 。
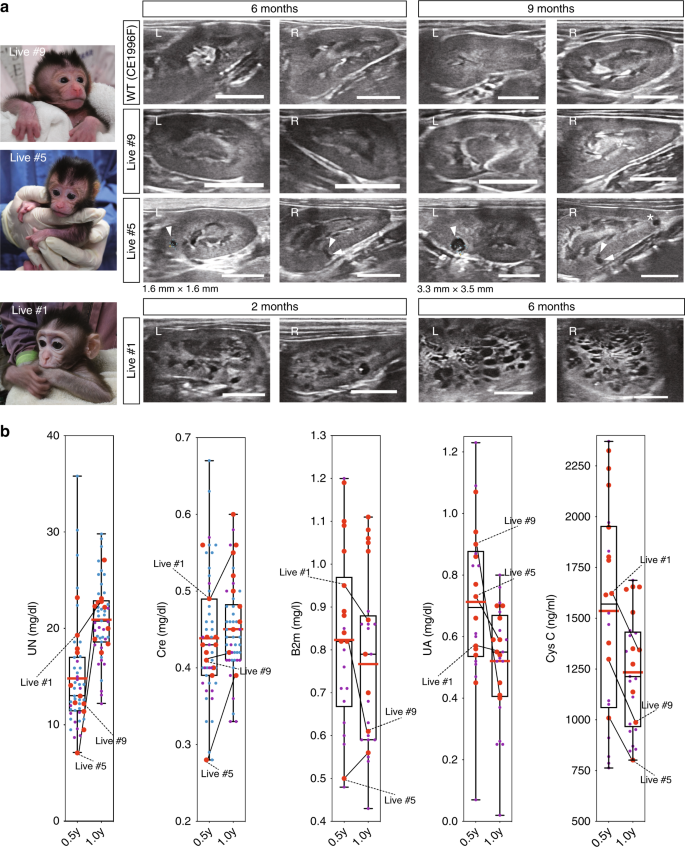
PKD1突变猴子的囊性严重程度不同。a猴子PKD1基因中靶向位点的示意图。b注射了50、100或200 ng / µl Cas9 mRNA和50 ng / µl sgRNA的胚胎数。“存活的”表示注射后存活的胚胎数。我们使用发育为胚泡的胚胎进行基因分型分析(分析)或胚胎移植(ET),并将其余胚胎冷冻。c每个注入mRNA的胚胎中突变检测率的箱形图。框的顶部和底部分别指示第一和第三四分位数;中心线表示中位数,晶须的末端分别表示最大值和最小值。ñ = 71个生物学上独立的样品。d流产的胎儿和分娩的猴子的数量。Ë分类流产的胚胎和交付的猴子的基因型。黑条表示移码突变的速率。深灰色条表示涉及两个以上氨基酸的框内突变率。浅灰色条表示一个或两个氨基酸的读框突变和错义突变的发生率。灰白色条表示野生型(WT)速率。在标记为“等位基因”的行中,“ M”表示母本等位基因,“ P”表示父本等位基因,“ ND”表示等位基因是母本还是父本,尚不确定。“已测序”表示在此分析中检查的序列数。“死亡日”表示堕胎日。对于猴子在出生后死亡的情况,“ +”之前的数字表示分娩日,而“ +”之后的数字表示死亡日。f和图 5a。f低功率,H&E染色图像,表明严重,中度和轻度肾脏。中间型肾脏中显示出与严重型肾脏相似特征的隔室被虚线包围。“ L”表示左肾,“ R”表示右肾。箭头指示囊肿形成。大图中的比例尺为1毫米。小盒子中的比例尺为100 µm。源数据作为源数据文件提供。
为了确定最佳实验参数,我们将三种浓度(50、100或200 ng / µl)的Cas9 mRNA和50 ng / µl sgRNA之一注入了食蟹猴胚胎。总体而言,注射后存活的423个胚胎中有207个发育为胚泡。在207个胚胎中,有71个被用于基因分型,86个被用于胚胎移植以产生猴子,其余50个被冷冻(图 1b)。在第8天收集的胚泡胚胎的T7核酸内切酶I(T7E1)分析显示,几乎所有胚胎都在目标区域具有突变。总的来说,具有突变的百分比为88.7%(63/71个胚胎)(图 1b,补充图 1c-e)。DNA测序证实了胚胎在Cas9裂解位点附近存在indel突变(补充图。 1f – 2b)。该效率与以前的研究相当甚至更高23。尽管效率很高,但PKD1突变胚的胚泡发育率(46.7%)与野生型(WT)胚(43.8%)26相当,尽管观察到一些发育迟缓(补充图 2c)。比较三种Cas9 mRNA浓度下每个胚胎的突变率,发现使用200 ng / µl Cas9 mRNA倾向于比50和100 ng / µl诱导更高的突变率(图 1c)。但是,考虑到在小鼠体内观察到的胚胎致死性,我们决定使用50或100 ng / µl Cas9 mRNA来增加活体动物的产量。Pkd1缺陷小鼠21。
在分别转移给代孕母亲的86个胚胎中(图 1d,ET),植入了29个。植入胚胎的母亲的妊娠率(33.7%)与我院2016年至2018年通过单胎移植的WT胚胎的母亲(8/23,34.8%)相当。随后有7个胚胎第150天前流产,第151天后8个死胎,分娩了14胎。大多数流产的猴子在围生期死亡,因为食蟹猴的妊娠期约为160天(图 1e)。,死亡日)。很难确定流产猴子的死亡原因,但至少在某些猴子中,胎盘早剥被认为是主要原因。胎盘早剥在WT猴子中也很常见。PKD1突变胎儿的活产率(14/29胎儿,48.3%)低于野生型胎儿(7/8胎儿,87.5%),表明在怀孕期间PKD1突变胎儿的发育缺陷。四名新生儿在出生后自然死亡。因此,获得了10只活猴子(图 1d,e)。总共从19只流产或死亡的猴子中的12只恢复了肾脏样本(图 1e))。通过DNA测序进行基因分型后,将这些流产或死亡的动物分为KO组,镶嵌组和杂合组(图 1e,补充图 3)。此外,通过组织学分析将KO或镶嵌组动物的肾脏分为三类:(1)严重型,(2)中间型和(3)轻型(图 1e,f,补充图 3)。)。在一些猴子(1号,1号,3号)中,许多组织(肾脏,肝脏,脾脏,胃,胰腺,小肠,结肠,子宫,膀胱,卵巢,肾上腺,胸腺,甲状腺,心脏,使用肺,脑,骨骼肌,皮肤,胎盘,羊膜和脐带进行基因分型。但是,我们无法检测到组织之间基因型的明显差异。鉴于突变是在发育早期被诱导的,因此在单个组织内而不是组织间观察镶嵌是合适的。因此,在其他猴子中,从死动物的肾脏以及活猴子的胎盘,羊膜和脐带中收集基因组DNA样本,以减少侵袭性。严重的肾脏显示出许多囊肿,覆盖了标本面积的30%以上,PKD1异常27。中型肾脏表现出中等程度的囊肿形成,占标本面积的5–30%。温和型肾脏显示出零星囊肿形成,包围试样面积的小于5%,和类似的形态,以早期肾脏ADPKD在人类杂合子28,29(图 1F,补充图 3)。值得注意的是,在具有中型肾脏的猴子中,有几个肾脏隔室,其中超过30%的区域充满了多个囊肿(图 1f,用虚线包围的隔室),类似于重度肾脏的猴子。肾脏类型,而其他隔室中的囊肿则偶发(图。 1f)。这表明中型肾脏可能构成重度和轻度肾脏之间的过渡状态,因为它具有两者的特征。总的来说,尽管表型是可变的,但是由于镶嵌现象,表型的严重性倾向于与突变率相关。
PKD1 -KO猴的肾脏肿大,囊肿众多
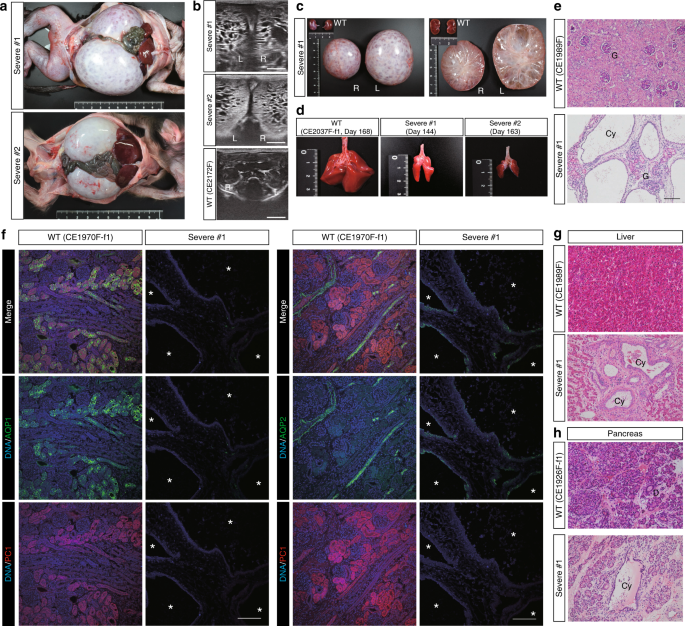
15名流产胎儿中有3名表现出极度的腹胀。肾脏大大肿大(图 2a,补充图 4a),通过超声检查和两等分肾脏的横截面观察到无数囊肿(图 2b,c,补充图 4b)。另外,胎儿具有未成熟的肺,表明存在因肺发育不全而死亡的波特表型(图 2d,补充图 4c)。肾脏的组织学分析显示间质纤维化和具有薄上皮内层的囊肿(图 2e)。该表型不仅与Pkd1缺失小鼠相似,而且21但也包括双等位基因PKD1异常的人类婴儿27。确认基因分型结果(补充图 3a),使用抗PC1抗体进行的免疫荧光分析实际上未检测到信号30,表明PC1蛋白几乎完全耗尽(图 2f)。蛋白质印迹分析还显示,严重型肾脏不表达全长PC1蛋白(补充图 4d)。使用抗Ki67进行的免疫组织化学分析显示了一些小囊肿中一些上皮细胞的增殖,但在大多数扩张的囊肿中没有明确的信号(补充图 4e))。此外,在猴子的肝脏和胰腺导管中观察到几个囊肿(图 2克,H,补充图 4F,G),证实如在Pkd1基因 KO小鼠20,21,PC1起着在这些器官中具有重要作用。两者合计消耗PKD1猕猴导致类似的表型在看到PKD1 -null人类和小鼠21,27。
模仿几个“两次命中”突变的结果
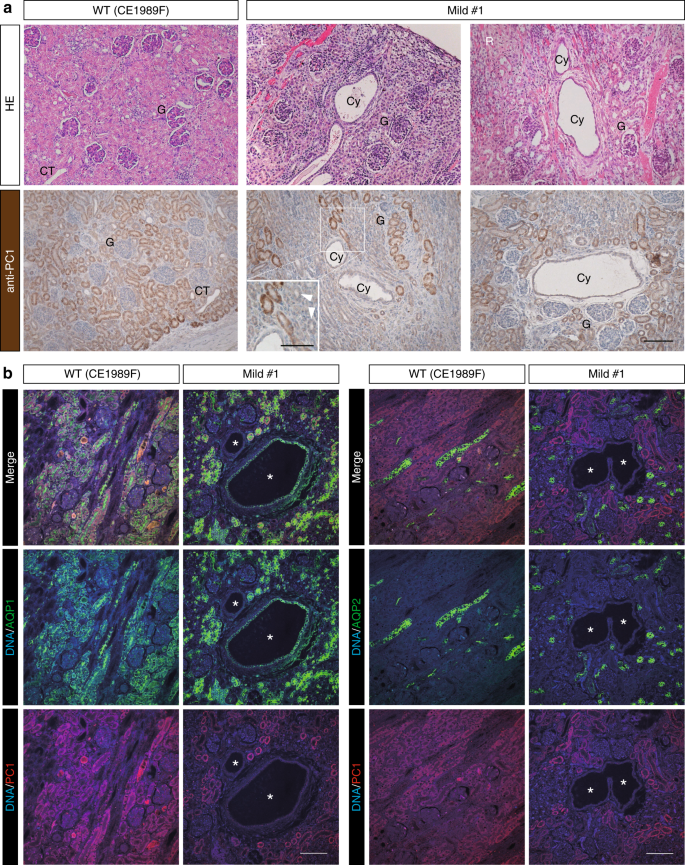
在一个等位基因中具有杂合突变的人ADPKD患者中,数十年后,当另一个等位基因2中发生第二个突变时,可能会形成囊肿。尽管这种“两次打击”的假设仍然存在争议,但我们认为镶嵌动物可能至少部分模仿了这种情况。与PKD1几乎完全耗竭相反,在具有轻型肾脏的猴子中偶发地出现了几个囊肿(图 3a)。尽管大多数正常出现的肾小管表达PC1的水平与野生猴相似,但囊肿内衬的细胞却不表达PC1(图 3a,b)。目前尚不清楚是否在囊肿中缺乏PC1染色是由于缺乏PC1还是归因于信号强度较低的节段(即来自WT细胞的节段)衍生的囊肿的扩大。但是,大多数野生型皮质为PC1阳性,未观察到广泛的PC1阴性区域。相反,在镶嵌肾脏中,PC1阴性区域广泛。因此,我们认为广泛的PC1阴性区域是由于基因组编辑而导致双等位基因缺陷的区域。有趣的是,PC1阴性囊肿周围一部分正常出现的肾小管也几乎不表达PC1(图 3a,箭头),表明WT和PKD1之间的细胞间通讯空细胞可能会改善突变细胞的囊肿严重性,或者PC1蛋白的丧失不足以形成囊肿,并且可能需要“三击”假说31规定的其他因素。
囊肿上皮细胞的谱系身份
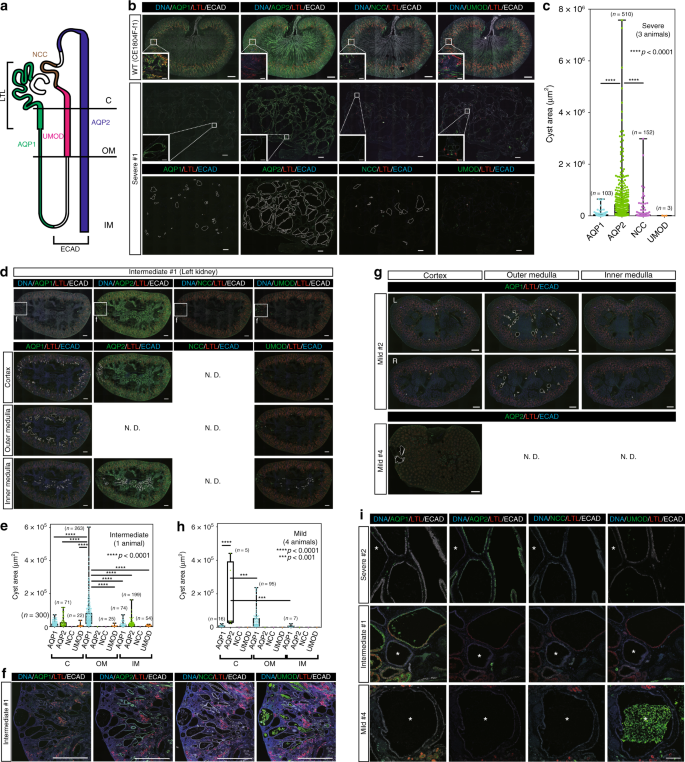
为了研究囊肿的起源,将切片用莲花四方叶凝集素(LTL)(近端肾小管的标记)染色。Aquaporin-1(AQP1),肾小管近端和Henle's环下肢的标志物;尿调节素(UMOD),亨利氏环粗大上升肢的标志物;Na–Cl协同转运蛋白(NCC),远端弯曲小管的标志物;Aquaporin-2(AQP2),连接小管和收集管的标记;和E-cadherin(ECAD),这是从Henle's环的上升肢到集管的区域的标记(图 4a)。使用阴性对照免疫球蛋白检查自身荧光或非特异性染色未产生明确的信号。此外,我们能够使用AQP1,AQP2,NCC和UMOD抗体分别染色每个肾单位片段(补充图 5a)。在严重类型的肾脏中,大多数囊肿为AQP2阳性,而少数囊肿为AQP1,NCC或UMOD阳性(图 4b,补充图 5b),表明大多数囊肿均来自连接小管或收集管。 。重要的是,AQP2阳性的囊肿大于其他囊肿(图 4c,补充图 5c)。与此观察结果一致,据报道,AQP2-到AQP1阳性囊肿的比例在人终末期肾脏ADPKD囊肿扩大增加28,以及类似的结果已经在ADPKD的小鼠模型已报道32,33。
囊肿上皮细胞的谱系身份。图2是显示每个标记阳性的肾单位段的示意图。“ C”表示皮质,“ OM”表示外延髓,“ IM”表示内延髓。b在严重型肾脏中,肾单位标记的表达。小框表示包含分别代表AQP1,AQP2,NCC或UMOD阳性的囊肿的区域;每个标记呈阳性的囊肿区域被白线包围。大图中的比例尺为1毫米。小盒中的比例尺为100 µm。c三个严重肾脏中AQP1,AQP2,NCC或UMOD阳性囊肿区域的箱形图。 在三只动物中,n = 768个囊肿。d中间型肾脏中肾单位标记的表达。小方框表示f中高倍放大显示的区域。分别对AQP1,AQP2或UMOD呈阳性的囊肿区域被白线包围。ND表示未检测到。比例尺,1毫米。e中间型肾脏中AQP1,AQP2,NCC或UMOD阳性囊肿区域的箱形图。“ C”表示皮质,“ OM”表示外延髓,“ IM”表示内延髓。 一只动物中n = 1008个囊肿。f在包含多个囊肿的中型肾区隔中,肾肾节标记物的表达与严重型肾脏相似。比例尺,1毫米。G轻度型肾脏中肾单位标记的表达。在皮层,外部延髓或内部延髓中,AQP1或AQP2阳性的囊肿区域被白线包围。“ L”表示左肾,“ R”表示右肾。ND表示未检测到。比例尺,1毫米。h中型肾脏中AQP1,AQP2,NCC或UMOD阳性囊肿区域的箱形图。“ C”表示皮质,“ OM”表示外延髓,“ IM”表示内延髓。n =四个动物中的123个囊肿。一世代表性的ECAD阳性和AQP1,AQP2-,NCC和UMOD阴性的囊肿。星号表示囊肿。比例尺,100 µm。在方框图中,方框的顶部和底部分别指示第一和第三四分位数;中心线表示中位数;晶须的末端分别指示最大值和最小值。源数据作为源数据文件提供。
在中型肾脏中,AQP1阳性囊肿由各种结构形成(图 4d,补充图 6a)。髓质外AQP1阳性囊肿的大小大于其他区域的囊肿(图 4e)。但是,在多个囊肿占面积超过30%的腔室中(图 1f,虚线包围的腔室),大多数囊肿都是AQP2阳性的,类似于重症肾脏(图 4f,补充)。图 6b),表明在AQP2阳性节段中的囊肿形成比在其他节段中更严重。
在轻度型肾脏中,大多数囊肿均为AQP1阳性并在髓质外发育,与中型肾脏一致(图4g,补充图 6c-e),而在皮质和肾中 发育出一些AQP2阳性的囊肿。尺寸较大(图 4g,h)。有趣的是,轻度和中型肾脏中AQP1阳性囊肿的大小与重度肾脏中的相当,而重度肾脏中AQP2阳性囊肿的大小远大于轻度和中型肾脏(补充图 6f)。据报道,在患有晚期ADPKD的人和一些小鼠模型中,近端肾小管衍生的囊肿比来自收集管的囊肿小,并且早期的大多数囊肿均以渐进性从近端节段衍生而来。小鼠模型28,32,33。因此,这些结果表明,AQP1阳性,近端小管衍生的囊肿可能先于AQP2阳性形成,收集导管衍生的囊肿。
此外,在所有肾脏类型中均观察到ECAD阳性和AQP1,AQP2,NCC和UMOD阴性的囊肿(图 4i),表明这些囊肿在PKD1突变的猴子中很常见。因为NCC是远端小管的一部分的标记物,所以这些囊肿可能已经从远端小管的其他部分衍生而来。总的来说,囊肿起源于几种肾单位上皮类型,包括AQP1阳性近端小管,ECAD阳性远端小管和AQP2阳性收集管,在两只猴子中PKD1和花叶猴几乎完全缺失,而收集物中的囊肿形成导管与囊肿严重程度有关,因为在AQP2阳性收集导管中检测到广泛或高密度的囊肿形成。
具有许多囊肿的PKD1突变的猴子可以存活
对十只活猴子进行肾脏超声检查和血液生化检查。尽管直到出生后9个月,活体#9的肾脏中均未检测到囊肿,突变率很低,但在出生后6个月,活着#5的肾脏中出现了几个囊肿,其突变率大于10。 50%(图 5a,补充图 3f)。此外,在那之后的3个月,左肾中出现了一个新的囊肿,右肾中又出现了一个囊肿(图 5a,Live#5)。有趣的是,在出生后2个月之前,Live#1的肾脏中已经检测到许多囊肿,其突变率很高(图 5a,补充图 3f))。两只具有93.8%和69.6%移码突变的猴子(分别为Live#1和#4)显示出许多囊肿的形成。另一方面,两只具有8.6%和18.2%移码突变的猴子(分别是Live#9和#10)没有囊肿形成。另外六只猴子表现出轻度的囊肿形成(补充表 1),表明囊肿形成的频率倾向于与PKD1基因的突变率相关。
具有许多囊肿的PKD1突变的猴子可以生存。通过超声检查在活猴子中发现的囊肿形成。箭头指示囊肿形成。比例尺,10毫米。b出生后6个月和12个月时每只猴子的肾功能方框图。“ UN”表示尿素氮,“ Cre”表示肌酸酐,“ B2m”表示β2-微球蛋白,“ UA”表示尿酸,“ Cys C”表示半胱氨酸蛋白酶抑制剂C。大的红点表示突变的猴子。紫色小点表示在滋贺医科大学生长的野生猴。小蓝点表示在Shin Nippon Biomedical Laboratories生长的野生型猴子。框的顶部和底部分别指示第一和第三四分位数;中心线表示中位数;晶须的末端分别指示最大值和最小值。红线表示平均值。源数据作为源数据文件提供。n = 55只动物。
出生后6个月和12个月的血液检查显示,在任何猴子中都没有明显的异常表现出囊肿形成(图 5b),这表明与人类一样,肾脏中发生了肾单位补偿。该结果是合理的,因为已知在进行性肾脏肿大的人中,肾单位补偿可使肾小球滤过率保持在正常范围数十年,直到超过50%的功能实质被破坏为止5。鉴于猴子的寿命比啮齿动物更长,而且我们的灵长类动物模型中的囊肿形成不仅类似于晚期人类患者的囊肿形成,而且类似于儿童患者的囊肿形成,因此我们可以长期监测疾病状况,从而阐明其分子机制。 ADPKD的机制以及评估药物疗效和毒性的机制。
杂合子表现出远端小管衍生的小囊肿
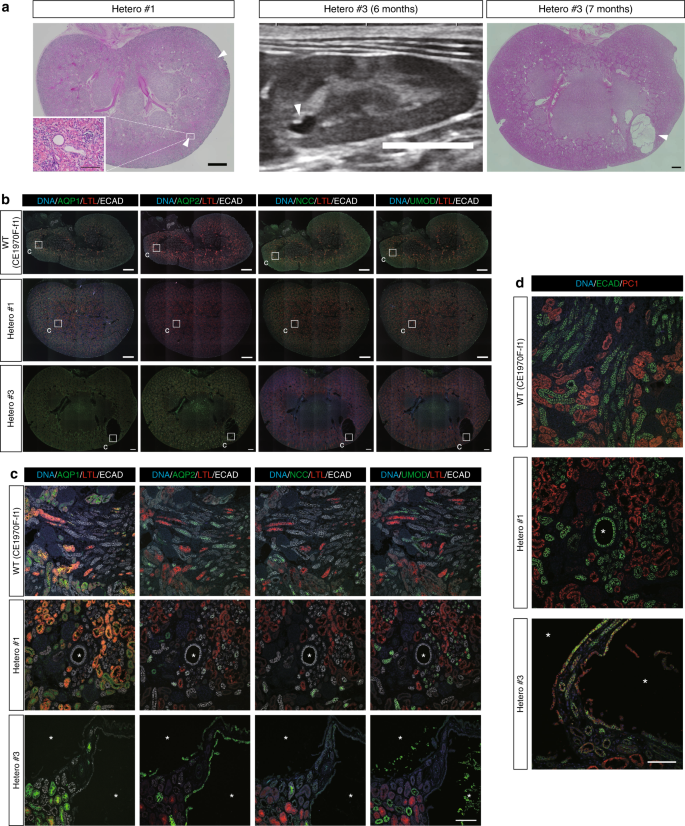
杂合动物在一个等位基因中具有WT序列,在另一个等位基因中具有突变,这在人类ADPKD患者中也可能如此(补充图 7a)。杂合子中的肾脏在围产期显示出一些囊肿的形成(图 6a,补充图 7b)。尽管大多数囊肿很小,但我们证实,在足月妊娠后流产的野生猴中很少发现这些囊肿(补充图 7c)。值得注意的是,通过超声检查在活的杂合子猴中发现了一个清晰的囊肿(Hetero#3),并且在肾脏切开的表面证实了该囊肿(图 6a)。)。这些结果清楚地证明了囊肿在杂合猴存在围产期,其类似于在人类杂的情况,但不小鼠16,20,34。
尽管杂合子中的少数囊肿为AQP2阳性,但大多数为ECAD阳性,但其他标记为阴性(图 6b,c,补充图 7d)。如上所述,这种类型的囊肿也形成在猴子中,PKD1几乎完全缺失,并且在镶嵌体中也是如此(图 4i)。因此,这种囊肿类型可能在AQP1或AQP2阳性囊肿形成之前,并且可能代表该病的最早表现,尽管需要长期监测以确证。杂合子中的大多数囊肿均为PC1阴性,与“两次打击”假说一致(图 6d,杂项1)。在早期,多个PC1阴性囊肿的形成是令人惊讶的,因为人们认为多个囊肿的形成是由于随着年龄的增长第二突变的积累。有趣的是,还观察到了几个PC1阳性囊肿(图 6d,杂#3)。我们使用与抗PC1抗体(20μg/ ml)相同浓度的阴性对照免疫球蛋白检查了自身荧光或非特异性染色的存在,未检测到清晰的信号(补充图 7e)。这表明这些囊肿可能是由PKD1单倍体功能不足引起的,尽管由于在蛋白质印迹中检测到一些额外的条带,所以信号可能是非特异性的(补充图 4d)。)。与此观察一致的是,据报道,一些囊肿人类PC1正35,36。这些结果与小鼠明显不同,在小鼠中,有效的囊肿形成需要双等位基因突变22。
在人类中,ADPKD的疗法是有限的。因此,对于没有明显症状的小儿患者,不建议进行积极的治疗干预37。因此,在ADPKD患者中,从症状发生前阶段到早期的病理过程仍然是一个黑匣子。了解囊肿在杂合子的早期如何发展和恶化可能有助于设计预防囊肿扩大的药物。
通过等位基因特异性靶向产生杂合子
使用常规方法靶向第2外显子,我们能够获得5个杂合子,包括两只动物,这些动物没有收集肾脏样品,但效率很低(29只猴子中有5只;补充表 1)。由于马等。38成功高效地纠正了人类胚胎中的特定致病等位基因,我们尝试使用等位基因特异性多态性来靶向单个等位基因。我们在猴子PKD1中搜索了多态性编码区,发现外显子4的区域具有单核苷酸多态性。来自不同国家(中国和印度尼西亚)饲养的猴子的卵母细胞和精子被用来在母体等位基因中产生具有这种多态性的胚胎。在这些胚胎中,靶向该区域的引导RNA(gRNA)无法识别母体等位基因,但可以特异性识别母体等位基因。因此,仅在父本等位基因中诱导突变(图 7a)。为了减少此实验中的脱靶效应,我们不是在胞浆内注射精子(ICSI)6小时后注射mRNA,而是将iRNA 38后立即将gRNA / Cas9蛋白RNP复合物与精子一起注射或将RNP复合物电穿孔入胚胎中,39。在使用低浓度(20 ng / µl)Cas9蛋白的体外实验中,观察到不完全的诱变和镶嵌现象(补充图 8a)。因此,我们决定使用高浓度(200 ng / µl)的Cas9蛋白将突变完全引入单细胞胚胎中,从而避免镶嵌。
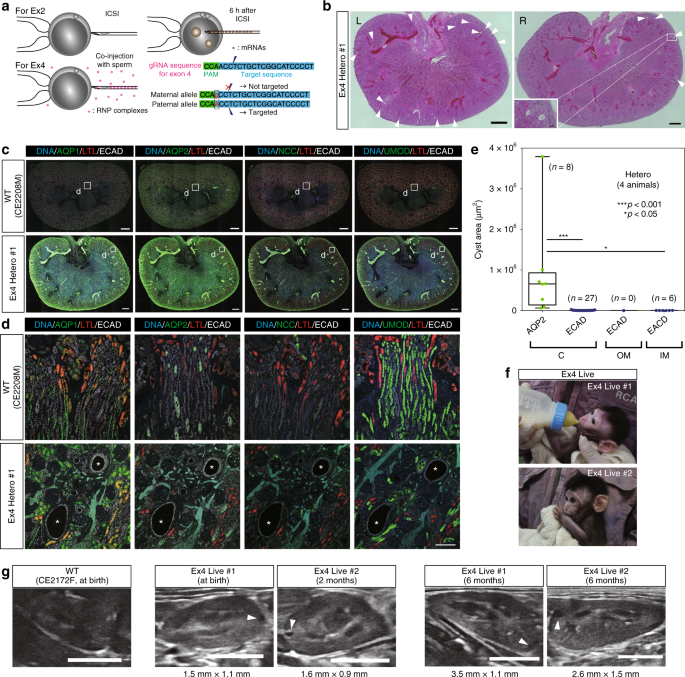
通过等位基因特异性靶向产生杂合子。图4是显示外显子2靶向和外显子4靶向之间差异的示意图。在外显子2靶向中,将ICSI后6小时将mRNA注入合子。在外显子4靶向中,将gRNA / HiFi Cas9蛋白RNP与精子共同注射到MII卵母细胞中。多态性阻止了母亲等位基因中gRNA靶序列的切除。b外显子4杂合子肾脏的低功率,H&E染色图像。“ L”表示左肾,“ R”表示右肾。箭头指示囊肿形成。大图中的比例尺为1毫米。小盒子中的比例尺为100 µm。c外显子4杂合子肾脏中肾单位标记的表达。小方框表示以高倍率显示的区域d。比例尺,1毫米。d外显子4杂合子肾脏中的代表性ECAD阳性和AQP1,AQP2-,NCC和UMOD阴性的囊肿。星号表示囊肿。比例尺,100 µm。e所有杂合子肾脏中ECAD阳性或AQP2阳性囊肿面积的箱形图。框的顶部和底部分别指示第一和第三四分位数;中心线表示中位数;晶须的末端分别指示最大值和最小值。n =四只动物中的41个囊肿。f两只外显子4杂合突变的活猴子。G通过超声检查发现外显子4杂合子的囊肿形成。箭头指示囊肿形成。比例尺,10毫米。源数据作为源数据文件提供。
自发地流产了两个胎儿(Ex4 Severe#1和Ex4 Hetero#1),并获得了两只活猴子(Ex4 Live#1和Ex4 Live#2)。一位流产的胎儿(Ex4严重性#1)在两个等位基因中都有移码突变,并且表现出与PKD1耗竭的猴子相似的表型(补充图 8b-g),清楚地表明该表型是由PKD1的突变引起的,而不是由gRNA off引起的。 -靶作用,因为两种不同的gRNA能够诱导相似的表型。DNA测序表明,其他三只猴子是杂合子(补充图 8h,)。迄今为止,已经另外产生了八只猴子,并且已经显示出十二只猴子中的十只受到杂合子或单等位基因影响。此外,在这10只猴子中,有9只具有单个突变,因此12只猴子中只有3只显示出镶嵌性。这与第2外显子的定位有很大不同,在第2外显子上,大多数动物都表现出镶嵌性,这说明我们产生非镶嵌杂合子的能力有了显着提高(补充表 1)。组织学分析检测到流产胎儿肾脏中的小囊肿(Ex4 Hetero#1)(图 7b),囊肿为ECAD阳性,AQP1,AQP2,NCC和UMOD阴性(图 7c,d)。这些结果与外显子2杂合子相似,表明外显子2和外显子4杂合子具有共同的生物学特性。总体而言,杂合子中的大多数囊肿都是ECAD阳性的,而有些囊肿的AQP2也呈阳性,并且比其他囊肿要大(图 7e)。此外,对两只活猴子(Ex4 Live#1和Ex4 Live#2)的肾脏进行超声检查,分别在出生时或出生后2个月检测到一些囊肿的形成(图 7f,g)。这些囊肿在出生后6个月时增大(图 7g,右图)。由于一些肾囊肿在人杂的孩子识别16,34,我们建议本研究中的杂合猴子可以作为研究人类ADPKD(包括儿童患者)的有用模型。
在猴胚胎中产生等位基因
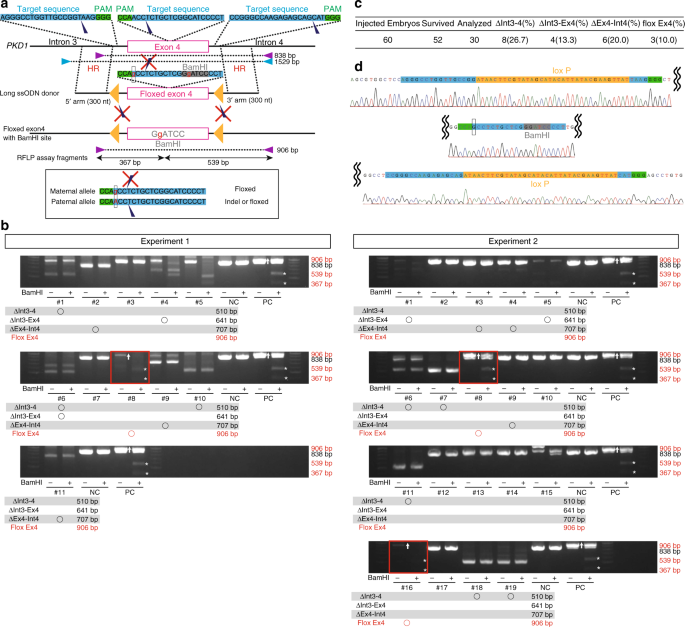
最后,我们根据“两次打击”假说将条件性KO应用于PKD1诱变,以详细验证囊肿形成的机制。我们使用的长的单链寡核苷酸(长ssODN)40,41,42,43具有两个取代的碱基和三个gRNAs高效地创建在F0代(图一两侧装接loxP /插入缺失猴 8A)。通过限制性片段长度多态性(RFLP)分析(图8b,c)和DNA测序(图 8d)确定,30个胚胎中的三个具有等位基因 。通过PCR扩增出含有同源臂外部区域的基因组片段(图 8a),蓝色三角形),然后将这些片段克隆到载体中并进行测序。测序分析证实了LoxP位点顺式插入了所有三个胚胎中(图 8d)。在一个胚胎中(实验1,#4),我们检测到单个LoxP插入。此外,我们确认了三个亚麻胚中的两个中的接合区的序列保真度。这是在非人类灵长类动物中成功产生的等位基因。将Cre重组酶引入该等位基因将进一步加速灵长类动物ADPKD的研究。一旦产生了猴类,就删除PKD1肾小管细胞中的病毒可以通过病毒递送Cre酶来实现。尽管病毒传递可能会导致镶嵌Cre表达,但我们可以利用镶嵌的优势进行长期研究。
讨论区
总之,我们生成了多种类型的PKD1食蟹猴的突变体。完全或镶嵌缺失导致严重程度不同的囊肿形成,这往往与突变率相关。在杂合子中,囊肿频繁发生需要很长时间,因此开始临床前测试可能需要花费时间。另一方面,在具有部分双等位基因突变的镶嵌动物中,显示出一定程度的囊肿形成的动物很可能可以在早期获得,因此对于临床前研究应是有用的。其他大型动物模型,例如涉及猪中的诱导突变和猫和狗中的自发突变的模型,也可用于临床前测试。但是,与这些动物相比,猴子在基因和生理上与人类更相似。另外,像人类一样 猴子的遗传多样性高于其他模型动物。这些特征对于临床前研究是有利的。当然,猴子的使用确实涉及昂贵且长期的研究。然而,尽管ADPKD是一种非常常见的单基因疾病,并且经常发生,但是尽管迄今为止已经进行了数十年的研究,但是治疗方法仍然是有限的。即使花费时间和金钱,我们也认为是时候尝试一种新的研究方法了。
在确定具有ADPKD的人杂合子中囊肿如何发育和加重方面,杂合猴子比小鼠模型具有优势。与需要条件敲除以模仿人类表型的小鼠相反,使用我们的猴子模型研究更自然状态的囊肿形成过程是可行的。我们使用等位基因特异性靶向设计了PKD1等位基因,并首次有选择地生成了PKD1杂合子非人类灵长类动物,其形成的囊肿与人类小儿患者相似。由于可以制备没有镶嵌的杂合子,因此我们认为可以在相对同质的群体中进行遗传研究。尽管这当然会花费一些时间,但将来我们可以通过分析F1代,在家族谱系中在遗传上更均一的条件下进行这项研究。我们尚未评估过所产生的猴子的繁殖力,但是鉴于人类ADPKD患者是可繁殖的,我们相信这些猴子会繁殖,并且可以产生多个血统书。杂合子的病理与人类相似,因此在F1代中可以预期相同的病理进展。因此,我们希望阐明囊肿发展和恶化的机制可能会确定可从儿童期开始的治疗方法。通常,不建议在儿科患者中进行积极的治疗干预,包括分子诊断,并且在道德上对ADPKD患者的儿童进行研究非常困难,因为ADPKD表现出100%的外显率并且没有明确的治疗方法。因此,在人类中,仅发现自儿童时期就已形成囊肿,其细节尚不清楚。另外,由于啮齿动物模型不能准确地概括人类的疾病状态,因此人类从症状发生前阶段到早期的病理过程仍然是一个黑匣子。我们确定了囊肿上皮细胞的谱系身份,发现杂合子中的大多数囊肿均来自远端小管,这可能反映了囊肿发生的初期,代表了该病的最早表现。因此,尽管收集管是成年患者的唯一药物靶标,但我们的结果表明,在目前尚无临床干预的儿科患者中,远端小管可能是新型药物靶标。
我们还发现,收集管中的囊肿形成与囊肿严重程度有关。尽管托伐普坦是一种选择性的加压素V2受体拮抗剂,目前是用于治疗ADPKD患者并有效抑制肾脏体积增加的最常用药物12,长期治疗后的结局和副作用尚不清楚,尤其是在小儿患者中。托伐普坦靶向收集管,因为它们是加压素V2受体表达的位置。在我们的动物模型中,结果表明即使在很小的时候,收集管中也会出现严重的囊肿。尽管预计在囊肿形成的早期开始开始托伐普坦治疗会抑制囊肿增大,但是在动物模型中进行临床前研究之前,对儿科患者进行临床研究是不可行的。我们的猴子模型在这方面很有价值,因为它允许从年轻开始就进行长期药物评估。
由于食蟹猴中有限的基因组信息,很难以全基因组的方式清楚地证明脱靶序列的改变。因此,我们使用两种不同的gRNA来显示观察到的表型是由目标突变引起的。有趣的是,与野生猴相比,我们不仅观察到外显子2靶向,而且观察到外显子4更高的流产率。在小鼠中,Pkd1的丢失导致胎盘缺损44。因此,我们怀疑PKD1的功能异常可能是流产率高的原因。
近日,在人的肾脏组织体研究进展启用的产生PKD1 -null囊肿形成体外45,46。尽管类器官可以直接利用人类细胞来阐明囊肿形成的机制,但这些细胞分化差,并且培养期有限。在我们的模型中,有些猴子甚至在形成许多囊肿后仍然存活(图 5a)。因此,我们认为该模型可用于长期观察,阐明ADPKD的分子机制以及评估药物疗效和毒性。
方法
研究批准
我们遵循了由国家研究,替代和精制与减少动物研究中心(NC3Rs)制定的体内实验报告(ARRIVE)指南。我们还遵循了环境部的《动物福利和管理法》,在教育,文化,体育,科学和技术部管辖下的学术研究机构中正确进行动物实验及相关活动的基本准则,以及日本科学理事会制定的正确进行动物实验的指南。所有动物实验程序均由滋贺医科大学动物保护与使用委员会批准(批准号:2015-5-13、2016-6-1)。
动物
为了收集卵母细胞,选择年龄在4至13岁之间的雌性食蟹猴(Macaca fascicularis)。在这项研究中,从未杀死猴子,仅使用自然死亡的动物进行采样。光照周期为从上午8点至晚上8点的12 h人造光。每只动物在早上以20 g / kg体重的商业颗粒猴饲料(CMK-1; CLEA Japan)喂食,补充20– 50 g体重的下午的地瓜。随意提供水。动物室的温度和湿度分别保持在25±2°C和50±5%。
矢量构造
pX330购自Addgene(Plasmid#42230)47。为了构建pX330-monPKD1,将补充表2中列出的寡DNA 退火并连接到pX330 的Bbs I位点。为了构建pCAG-EGxxFP-monPKD1,将扩增的PCR产物克隆到pCAG-EGxxFP 25的Eco RI– Nhe I位点。PCR的引物在补充表2中列出 。
SSA分析
293FT细胞同时用pX330-monPKD1和pCAG-EGxxFP-monPKD1 25转染。在含有10%胎牛血清(Sigma)的Dulbecco改良的Eagle's培养基(Sigma)中孵育两天后,收集细胞并用流式细胞仪进行分析。
mRNA体外转录
为了将T7启动子序列添加到Cas9编码区和sgRNA序列,进行了PCR扩增48。PCR产物在50°C下用0.5%SDS,0.2 mg / ml蛋白酶K处理30分钟,用苯酚-氯仿纯化,并用乙醇沉淀。然后,将纯化的PCR产物用作体外转录的模板。分别使用mMESSAGE mMACHINE T7转录试剂盒和MEGAshortscript T7转录试剂盒(Thermo Fisher Scientific)转录Cas9和sgRNA mRNA。用MEGAclear转录清除试剂盒(Thermo Fisher Scientific)纯化mRNA。补充表2中列出了用于体外转录的引物 。
胞浆内精子注射
皮下注射0.9 mg促性腺激素释放激素拮抗剂(注射试剂盒Leuplin;武田化学工业公司)两周后,使用微输注泵(iPRECIO SMP-200,ALZET渗透泵)与15 IU / kg刺激人卵泡的激素。 (hFSH处理,Gonapure注射液;飞鸟制药)皮下麻醉下嵌入并注射7微升/小时10天49,50。hFSH处理后,肌肉内注射400 IU / kg人绒毛膜促性腺激素(hCG,促性腺激素;明日香制药)。hCG处理后40小时,使用腹腔镜(LA-6500,Machida Endoscope)通过卵泡抽吸收集卵母细胞。在含有10%血清替代品补充剂(Irvine Scientific)的Eagle培养基(MP Biomedicals,Solon)的alpha修饰液中回收卵母细胞复合物(COC)。用0.5 mg / ml的透明质酸酶(Sigma Chemical)从卵丘细胞中剥离出COC。在含有HEPES的mTALP中,使用微操纵器在中期II(MII)期卵母细胞上进行ICSI。在不麻醉的情况下,通过电刺激阴茎收集新鲜的精子。
将mRNA微注射到ICSI胚胎中
对于mRNA显微注射,通过ICSI后6小时培养来制备前核阶段胚胎。在ICSI之后,将胚胎在补充有20%牛血清(Invitrogen)的CMRL Medium-1066(Invitrogen)中于38°C,5%CO 2和5%O 2中培养。mRNA的显微注射是在显微镜下用显微操纵器进行的。ICSI 6小时后,将50、100或200 ng / µl Cas9 mRNA和50 ng / µl sgRNA的混合物注入胚胎的细胞质中。
T7核酸内切酶I(T7E1)测定
为了减少扩增的偏倚,用REPLI-g Mini Kit(Qiagen)扩增了来自胚胎的基因组DNA。从样品中扩增靶序列,并用Wizard SV Gel和PCR Clean-Up System(Promega)纯化。将纯化的序列变性,重新退火,并在37°C下用T7E1(NEB)消化2小时。电泳使用2%琼脂糖凝胶进行。为了从组织样品中提取基因组DNA,在裂解缓冲液(10 mM Tris-HCl(pH 8.0),100 mM NaCl,50 mM EDTA,0.5%SDS和0.5 mg / ml蛋白酶K)中消化样品。用苯酚和苯酚-氯仿处理裂解物,并用乙醇沉淀,然后变性,重退火并用T7E1消化。
DNA测序
对于DNA测序,将通过T7E1分析检测到的具有突变的PCR产物克隆到pBRBlue II 的Eco RV位点。对于每个样品,克隆来自不同试管的多种PCR产物以减少偏差。为了确定胎儿和后代的基因型,从死亡动物的肾脏以及活猴子的胎盘,羊膜和脐带中收集基因组DNA样本。通过多态性分析确定每个序列的亲本来源。
胚胎移植
当发展到扩张囊胚的胚胎,一个胚胎转移到每个适当受体雌性49,50。在立体显微镜下将胚胎抽吸到导管中(ETC3040SM5-17; Kitazato Medical Service)。将导管通过腹腔镜下的纤维膜插入受者的输卵管,并用少量培养基移植培养的胚胎。在ICSI 30天后通过超声检查确定妊娠。
组织切片和苏木精-伊红(H&E)染色
对于组织切片,将样品在Bouin溶液中于4°C固定过夜,在70%乙醇中洗涤,然后包埋在石蜡中。在切片机上将石蜡块切成2–4μm的厚度,并安装在载玻片上(Platinum Pro,Matsunami)。用二甲苯将石蜡切片脱蜡,然后再水化。每个载玻片用H&E染色。
免疫组织化学
对于免疫组织化学,将石蜡切片用二甲苯脱石蜡,然后再水化。将每个玻片在Histofine溶液(Nichirei Biosciences)中于121°C高压灭菌20分钟,以回收抗原。然后将载玻片用PBS洗涤,并在0.3%H 2 O 2中孵育在室温下用甲醇干燥30分钟以灭活内源性过氧化物酶。用PBS洗涤3次后,将玻片在室温下用2%正常山羊血清/ PBS封闭30分钟,并在封闭溶液中与一抗在室温下孵育1小时。用PBS洗涤3次后,将玻片与HRP偶联的二抗在封闭溶液中于室温孵育1小时。用PBS洗涤三次后,将载玻片在0.1毫克/毫升DAB / 0.03%H孵育2 ö 2 / 50mM的Tris-盐酸(pH7.6)中,在室温下3-5分钟。最后,在苏木精复染和疏水化后,将切片用封固剂(MP500,Matsunami)封固。
对于免疫荧光分析,抗原回收后,将玻片在室温下用0.2%Triton-X / PBS渗透30分钟。用PBS洗涤后,将玻片用10%正常驴血清/ 2%脱脂乳/0.1% Tween-20 / PBS于4°C封闭1 h,并在封闭溶液中与一抗在4°C孵育过夜。用0.1%Tween-20 / PBS洗涤3次后,将玻片与Alexa 488、546、594、633,或647结合的二抗和Hoechst 33342在2%脱脂奶/0.1% Tween-中孵育20 / PBS在室温下放置1小时或在4°C下放置4小时。用0.1%Tween-20 / PBS洗涤3次后,将载玻片用封固剂(Vectashield; Vector Laboratories)封固。本研究中使用的抗体如下:抗PC1(7E12)(sc-130554,1:10稀释; Santa Cruz Biotechnology),
蛋白质印迹
对于蛋白质印迹,冷冻断裂后立即用10%三氯乙酸固定组织,以避免蛋白质降解。固定的样品用9 M尿素,2%Triton X-100和1%二硫苏糖醇溶液处理以溶解蛋白质。超声处理后,将10%的十二烷基硫酸锂溶液施加到样品上。再次超声处理样品,并通过SDS-PAGE分离。印迹后,将膜在室温下用5%脱脂奶/0.1% Tween-20 / TBS封闭1 h,并与抗PC1抗体(7E12,sc-130554、1:100稀释度,Santa Cruz Biotechnology; E8)一起孵育,8C3C10、1:3000稀释度,巴尔的摩PKD核心中心,5F4D2,MABS1252、1:200稀释度,Millipore)在1%脱脂奶/0.1% Tween-20 / TBS中的温度在4°C过夜。用0.1%Tween-20 / TBS洗涤3次后,在室温下,将膜与HRP偶联的二抗在1%脱脂奶/0.1% Tween-20 / TBS中孵育1小时。用0.1%Tween-20 / TBS洗涤3次后,通过增强的化学发光(Cemi-Lumi One Super,纳卡拉)和ImageQuant LAS 4000成像仪(GE Healthcare)检测到免疫反应蛋白。用WB Stripping Solution Strong(Nacalai)进行剥离后,用抗β-actinpAb-HRP-DirectT(PM053-7,MBL)检测到β-actin蛋白。
gRNA / Cas9蛋白RNP复合物的构建
crRNA,tracrRNA和HiFi Cas9蛋白购自Integrated DNA Technologies。gRNA / Cas9蛋白RNP复合物的构建按照制造商的说明进行。
敲入载体和长ssODN的构建
为了构建flox外显子4敲入载体,将三个含有loxP序列的扩增PCR产物克隆到pBRBlue II 的Xho I– Not I位点,然后将两个含有两个取代碱基的扩增PCR产物克隆到Xho I中。 – 不是 pBRBlue II的I网站。来自载体的扩增的PCR产物用作长ssODN的模板,其是使用Guide-it长ssDNA生产系统(TaKaRa)生产的。PCR的引物在补充表2中列出 。
RNP复合物与精子的共同注射和电穿孔
如上所述收集MII卵母细胞。在ICSI 38期间,将RNP复合物与精子一起注射。将MII卵母细胞和精子在opti-MEM(Invitrogen)中以200 ng / µl RNP复合物的液滴洗涤,并以ICSI的形式进行。使用超级电穿孔仪NEPA21(Nepa基因)将RNP复合物电穿孔到ICSI胚胎中。简而言之,在ICSI后10分钟,将受精卵置于1毫米间隙的铂电极(Nepa Gene)之间的玻璃室中。该腔室装有6 µl含有200 ng / µl RNP复合物的opti-MEM 39。调节脉冲参数如下:电压为40 V;电压为40V。脉冲宽度3.5毫秒; 脉冲间隔50毫秒 和脉冲数,+ 4。传输脉冲参数如下:电压5 V;脉冲宽度50毫秒 脉冲间隔50毫秒 和脉冲数,±5。
血液分析
在血液学分析中,我们检查了白细胞计数(WBC),红细胞计数(RBC),血红蛋白浓度(HGB),血细胞比容值(HCT),平均红细胞体积(MCV),平均红细胞血红蛋白(MCH),平均红细胞血红蛋白浓度( MCHC)和使用ADVIA120(西门子医疗诊断制造)的血小板计数(PLT)。在血液生化测试中,我们检查了天冬氨酸转氨酶(AST),丙氨酸转氨酶(ALT),乳酸脱氢酶(LDH),总胆红素(T-bil),总蛋白(TP),白蛋白(ALB),球蛋白(Glob),白蛋白/球蛋白比(A / G),葡萄糖(GLU),尿素氮(UN),无机磷(IP),钙(Ca),钠(Na),钾(K),氯化物(Cl),β2-微球蛋白(B2m),甘油三酸酯(TG),总胆固醇(T-cho),肌酐(Cre)和尿酸(UA),以及JCA-BM6070(JEOL),
统计分析
|
|