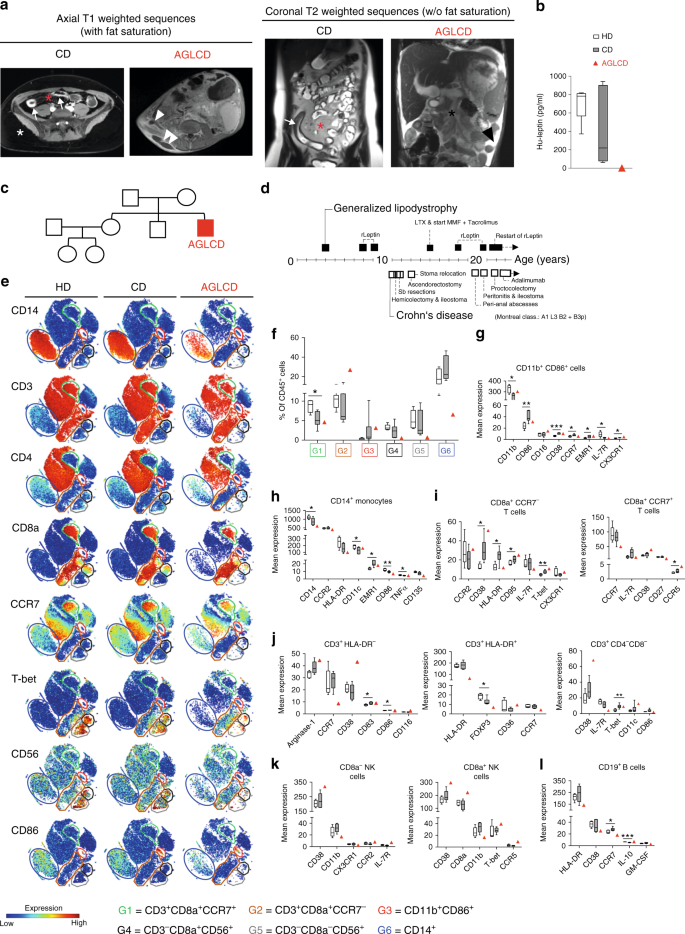
AGLCD患者的临床表型分析 目前尚不清楚肠系膜脂肪和脂肪来源的瘦素是如何在CD中形成全身炎症的,很少有临床情况存在,其中应用重组脂肪因子是合理的,其免疫调节功能可以在人体病理生理学中进行研究。AGLCD患者的特征是完全缺乏内脏脂肪组织和皮下脂肪组织(如图所示)。 1A ),缺乏瘦素产生(图一。 1B ),严重的肠道炎症(见补充说明 1 和补充表 1 详细病例报告和AGLCD患者自身免疫血清标记物概述)。值得注意的是,没有一个病人的亲属表现出类似的症状。 1C )并且通过外显子测序没有发现与泛发性脂肪营养不良相关的基因突变(数据未显示)。AGLCD患者最初在4岁时就出现了获得性全身性脂肪营养不良,11岁时被诊断为CD(蒙特利尔分类A1 L3B2+B3p),患有CD的攻击性变异。由于全身性脂肪营养不良,AGLCD患者随后发展为脂肪肝变性,需要在15岁时进行肝移植。图形 1D 总结了AGLCD患者的临床历史,并编制了与脂肪营养不良和克罗恩相关的干预措施和并发症。
图1 21岁男性表现为AGLCD,免疫表型连续改变。将AGLCD患者与克罗恩病患者(CD)和健康献血者(HD)进行比较。 a MRI扫描了CD患者和AGLCD患者两种不同的序列,显示出AGLCD患者完全缺乏皮下和内脏脂肪组织。白色星表示CD患者皮下脂肪,红星显示肠系膜脂肪(“蠕动脂肪”),注射血管包裹发炎的肠段(梳征),白色箭头标记CD患者发炎的病变。单个白色箭头显示AGLCD患者出现瘘管,两个白色箭头显示皮下脓肿,单个黑色星形突出显示AGLCD患者无肠系膜脂肪,黑色箭头标记游离腹腔液。 b ELISA法测定AGLCD患者、CD患者血清瘦素水平( n =7)及房屋署( n =5)在生物独立样品中。 c AGLCD患者家谱。 d AGLCD患者临床病史的图解总结。 电子-l AGLCD患者、CD患者PBMC的比较免疫分析( n =6)及房屋署( n =5)在不依赖于生物的样品中,采用大量的流式细胞术。 e PBMC的t-SNE产生的单细胞数据的二维投影。对所需的亚群体(G1-G6)进行门控。每个标记的热颜色表示每个标记的表达水平,而红色表示高和蓝色的低表达。f 盒状图显示不同细胞亚群(G1-G6)的频率。 G-l Box图显示每个细胞子集中所选标记的平均表达水平(任意单位)。方框从第25百分位数延伸到第75百分位数。晶须图显示最小(最小)和最大(最大)值。方框中的线表示中间值。* P < 0.05, **P < 0.01, ***P < 0.001, two-tailed unpaired t检验 没有经过多次比较的校正。源数据作为源数据文件提供。
AGLCD患者免疫细胞组成的改变 为了研究脂肪组织的缺乏如何影响AGLCD患者的系统免疫细胞组成,并获得其免疫组成的基线,我们首先将AGLCD患者的外周血单个核细胞(PBMCs)与健康供者(HD)的淋巴细胞和CD患者的外周血单个核细胞(PBMCs)进行了比较,并进行了高维免疫细胞分析,使我们能够更好地鉴别脂肪营养不良相关免疫细胞的改变和CD特异性免疫细胞的改变。类似于我们之前发布的协议 21 ,antibodies against lineage markers for T cells(CD3,CD4,CD8),monocytic cells(CD11b,CD11c,CD14,EMR1),B cells(CD19)and NK cells(CD16,CD56),as well as antibodies against functional makers(CD36,CD163,TREM2,arginase1,CD206),differentiation markers(CD33,CD40,CD45,CD64,CD95,CD115,CD116,CD135),homing markers(CD54,CD68,CD103,CCR2,CCR5,CCR7,CXCR3,MCP-1),activation markers(CD62L,CD83,CD86,CD124,CD135,HLA-DR,IL-7R),transcription factors(Tbet,细胞因子(IL-6、IL-8、IL-10、TGF-β、TNF-α、IFN-γ、GM-CSF)和代谢标记物(CD 27、CD 38、PD-1、PD-1 L、adrp)用于PBMCs的深层免疫分析。 2 ).
我们对CD 45进行了无监督的高维数据分析。 + 单元采用t分布随机线性嵌入(t-SNE)算法(图)。 1E )并根据CD11b、CD3、CD4、CD8、CD 14、CD 19、CD 56等经典细胞系标记物的表达水平,比较细胞亚群的频率,以及CD 86、CCR 7和HLA-DR等功能、归巢和活化标记。 1E,f )。然后比较健康供者、CD患者和AGLCD患者不同亚群体中所有标记物的表达水平。 1g-l )。为了验证我们的大量细胞计量学数据的重复性和控制可能的批量效应,我们比较了16种重叠免疫标记的表达在我们的质量细胞分析抗体面板中的表达,揭示了这两个抗体面板之间的高度相关性,从而证实了我们的发现的可靠性(补充图)。 1 和 2 ).
与CD患者相似,我们观察到CD8a的频率降低。 + CCR 7 + (G1)T细胞和CD11b增加 + CD 86 + (G3)细胞在AGLCD患者与健康对照组相比,突出了炎症条件下单核细胞的预激活,从而反映了CD诱导的免疫细胞组成的变化(图一)。 1E,f ),进一步反映在CD11b上几种分化和功能标记的类似表达模式上。 + CD 86 + 细胞和CD 14 + CD患者和AGLCD患者的单核细胞。 1g,h ).
相反,我们发现CD 14严重下降。 + 单核细胞(G6)和Tbet + CD 56 + CD8 + (G4)和Tbet + CD 56 + CD8 − NK细胞(G5)在AGLCD患者,但在CD患者或健康献血者中不存在。 1E,f ),提示这些改变是脂肪营养不良的特异性改变,至少部分原因是瘦素缺乏,即瘦素受体缺乏。 DB/db 小鼠NK细胞频率也降低。 22
与CD患者和健康献血者相比,我们还检测到活化标记CD 38在CD11b上的高表达。 + CD 86 + 、T细胞和NK细胞在AGLCD患者中的表达。 1g,i-k ),这与接受抗逆转录病毒治疗的HIV患者脂肪营养不良的发展有关。 23 人和小鼠的肠道炎症 24 由于dss引起的结肠炎在 CD 38 −/ − 小鼠 25 ...值得注意的是,CD 38在CD8中显著上调。 + CCR 7 − CD患者T细胞强调CD 38在CD中的潜在疾病传播作用。
此外,AGLCD患者在他的T和B细胞室中CCR 7的表达减少(如图所示)。 1I,j,l ),这意味着由于CCR 7的作用,淋巴细胞向脂肪组织的归巢过程中还存在一种额外的淋巴细胞转运障碍。 26
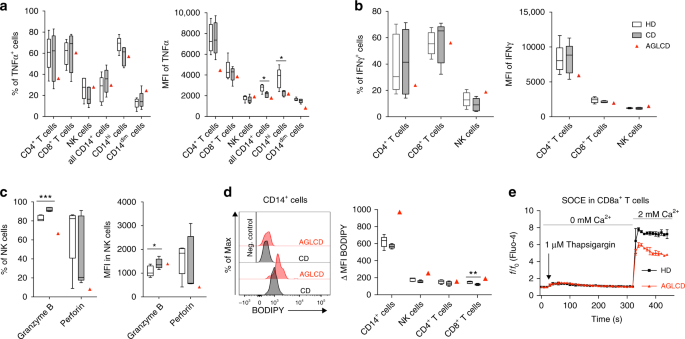
为了对AGLCD患者的淋巴细胞进行功能表征,我们用离子霉素/pma或lps刺激AGLCD患者、CD患者或健康供者的外周血单个核细胞,并通过流式细胞术测定肿瘤坏死因子α和干扰素γ的产生(补充表)。 3 和补充图。 3 )。如图所示。 2A,b ,我们观察到肿瘤坏死因子α和干扰素γ产生CD4的频率和平均荧光强度。 + 和CD8 + T、NK细胞和CD 14 + 从AGLCD患者分离出的单核细胞与CD患者和健康供体细胞相似。同样,FOXP 3表达CD4的频率 + T细胞在AGLCD患者和健康献血者中具有可比性(附图)。 4 ).
图2 AGLCD患者免疫细胞功能和代谢的改变。采用流式细胞术对AGLCD患者、克罗恩病(CD)患者和健康献血者(HD)的PBMC进行比较。 a –b 经PMA/离体霉素或LPS体外刺激后,( a )肿瘤坏死因子α产生和( b )测定干扰素γ产生T细胞、NK细胞和单核细胞,并分别测定细胞因子产生量的平均荧光强度(CD: n =5,HD: n T和NK细胞=6;CD: n =5,HD: n =5代表CD 14 + 细胞,生物独立样本)。 c 对未受刺激的NK细胞进行穿孔素和颗粒酶B表达与MFI表达率的关系分析(CD: n =5,HD: n =5,生物独立样本)。 d 用BODIPY染色法测定免疫细胞内脂滴的积聚情况(CD: n =5,HD: n =5,生物独立样本)。 e 储存Ca 2+ 进入(SOCE)以CD8为单位。 + AGLCD患者与HD患者T细胞的比较 n =1,两者均为技术副本)。方框从第25百分位数延伸到第75百分位数。晶须图显示最小(最小)和最大(最大)值。方框中的线表示中间值。SOCE图上的错误条表示标准差(SD)。* P < 0.05, **P < 0.01, ***P < 0.001, two-tailed unpaired T- 测试,无需校正多个比较。源数据作为源数据文件提供。
AGLCD患者NK和T细胞分化受损 因为我们发现在AGLCD患者中NK细胞的频率降低了(如图所示)。 1E,f )用流式细胞仪进一步对His NK细胞进行了定性和定量分析。与正常人和CD患者相比,AGLCD患者NK细胞表达细胞毒性分子穿孔素和颗粒酶B的频率较低,穿孔素表达也较低。相反,CD患者颗粒酶B的频率明显增高。 + NK细胞( p < 0.001) and an increased expression level of granzyme B (p < 0.05) when compared to healthy donors, whereas perforin expression was similar in both groups (Fig. 2C )。此外,我们还观察到与健康人相比,AGLCD患者NK细胞中CD 56/CD 16的表达模式紊乱(补充图)。4 )。这些数据表明,脂肪组织和脂肪组织衍生脂肪因子的缺乏导致NK细胞表型和功能的改变。
由于脂肪细胞中缺乏脂肪储存能力,导致脂肪营养不良患者出现高甘油三酯血症。 19 研究表明,脂滴在细胞内的积累通过代谢重排和随后颗粒酶B的下调而降低了NK细胞杀伤细胞的能力。 27 我们接下来测定了不同免疫细胞亚群中的脂滴含量。如图所示。 二维空间 ,AGLCD患者在单核细胞、NK细胞和CD8中有较高的脂滴沉积。 + T细胞与CD患者及健康供者比较。有趣的是,Greineisen等人。最近有报道说,脂滴的积累降低了淋巴细胞释放钙的能力。 28 ,这是控制天真CD8的扩张所必需的。 + T细胞通过组织代谢规划和诱导糖酵解 29 ...随着脂滴积聚的增加,我们发现CD8中的钙稳态受损。 + T细胞(图1. 2E 提示AGLCD患者脂质代谢紊乱与所观察到的功能和代谢免疫细胞功能紊乱有关。请注意,由于在AGLCD患者中NK细胞的频率很低,因此无法对NK细胞进行可靠的钙测量或功能杀伤试验。然而,葡萄糖摄取在AGLCD患者的PBMC中没有改变(补充图)。 4 )。观察到的AGLCD患者免疫细胞代谢的变化进一步反映在T和NK细胞中CD 38的表达增加,如CD 38,这是一种多功能酶,具有烟酰胺腺嘌呤二核苷酸(NAD)核苷酶的活性。 30 ,不仅是活化T细胞的标志 31 ,但也被证明是规范NAD的 + 人CD4的代谢、氧化磷酸化和谷氨酰胺解 + T细胞 32
rLeptin诱导的肿瘤坏死因子α的产生及免疫细胞的改变 由于AGLCD患者由于脂肪营养不良和连续的瘦素缺乏症而患上了极度胰岛素抵抗,我们决定重新启动rLeptin替代疗法,这之前曾在莱比锡大学(UniversityofLeipzig)对rLeptin的同情使用项目中启动过,但由于不遵从性,患者在入院前几个月就停止了。
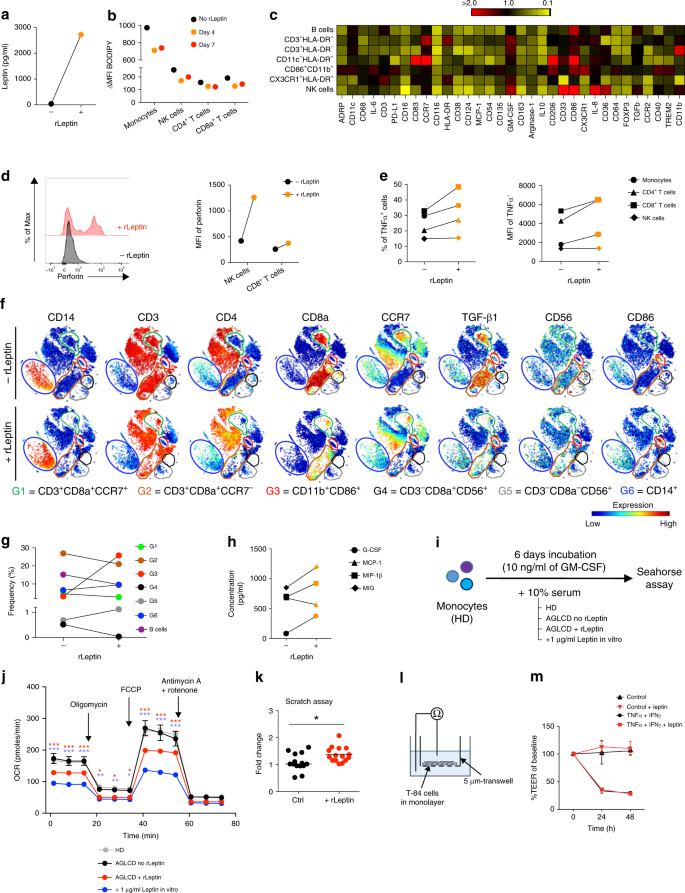
患者每日皮下注射rLeptin 2.5mg。rLeptin给药4天后,AGLCD患者血清瘦素水平明显升高(图1)。 3A )。因此,rLeptin替代降低了患者所需的胰岛素浓度。 ∼ T、NK和单核细胞脂滴数量增加10倍,减少(图1)。 3B ),这也表现为一种脂滴结合蛋白adRP的表达降低(如图所示)。 3C )。随着细胞内脂滴形成的减少,血清甘油三酯和总胆固醇水平在rLeptin治疗下也下降并恢复正常。 5 )。值得注意的是,rLeptin替代导致不同免疫细胞的促炎活性增加,其表现为NK和CD8中穿孔素的表达上调。 + T细胞(图1. 三维空间 肿瘤坏死因子(α)表达细胞在离体刺激下的频率和MFI增加(如图1所示)。 3E )。除了这些功能的改变,我们还检测到活化的CD11b的扩展。 + CD 86 + rLeptin应用后7天细胞(G3),而CD8a数量减少 + CCR 7 − T细胞(G2)、CD 19 + B细胞和CD8a + rLeptin治疗后发现NK细胞(G4)。 3F,g ).
图3 瘦素可诱导AGLCD患者的促炎免疫反应,促进创面的体外愈合。 a 血清瘦素水平的AGLCD患者(−)和(+)4d的rLeptin替代。 B-g 流式细胞术和质量细胞学分析rLeptin治疗4天和7天后对AGLCD患者PBMC的影响。 b BODIPY染色法测定脂滴含量。 c 热图显示不同细胞亚群中不同功能标记物的平均表达(与reptin替代前相比)的相对变化(补充表中的质量流式细胞术抗体组B) 2 )(红色,折叠变化高于2(增加表达);黄色,折叠变化=0.1(减少表达)。 d 穿孔素表达测定为平均荧光强度(MFI)。 e 肿瘤坏死因子α-表达细胞及相应的MFI。 f 大量流式细胞仪数据的t-SNE生成的单细胞数据的二维投影(补充表中的抗体面板A) 2 )显示对( g )不同细胞亚群的频率。针对每个标记(红色、高表达度、蓝色、低表达),对t-SNE地图上所选标记的热颜色进行了缩放。h CBA法测定血清中不同免疫细胞衍生因子的水平 i –j 健康供者外周血单核巨噬细胞耗氧率(OCR)在AGLCD患者血清(“瘦素-无”)和体内外瘦素/rLeptin替代(至少三倍,误差条显示±SEM,双向方差分析后和Holm-Sidak校正)的存在下进行评估。相应的细胞外酸化率(ECAR)在补充图中有报道。 7 . k 用人T84肠上皮细胞在瘦素存在下进行划痕试验,评价体外伤口愈合情况。 l –m 瘦素对TNF、α和IFNγ诱导T84细胞跨膜电阻的影响(错条显示为SD)。* P < 0.05, **P < 0.01, ***P < 0.001, two-tailed unpaired T- 测试(如适用)。源数据作为源数据文件提供。
在我们看来,观察到的NK细胞在rLeptin治疗后的表型和功能变化,包括CD 56表达模式的改变(补充图)。 6 )颗粒酶B和穿孔素的表达以及细胞因子的产生,表明瘦素是NK细胞分化和功能的重要调节因子。因此,瘦素受体缺乏的小鼠显示NK细胞发育和功能受损。 22 而瘦素对人NK细胞YT的增殖、杀伤能力和穿孔素的表达均有促进作用。 33 ...然而,从NK细胞数量来看,即使在rleeptin替代后,NK细胞数量仍然很低,其他脂肪组织衍生因子,如脂肪因子和代谢物,很可能有助于正常NK细胞的发育,并且可能在缺乏脂肪的AGLCD患者中缺失。
流式细胞仪对PBMCs的深层免疫分析显示,在AGLCD患者的不同免疫细胞亚群中,rLeptin相关的促炎表型增加(图1)。 3C 和补充图。 6 )。例如,在CD11b中 + CD 86 + T细胞和NK细胞,我们发现rLeptin治疗后精氨酸酶-1降低,CD 86表达增加。 3C )。精氨酸酶-1已被认为是交替激活的巨噬细胞的标记物。 34 是先天性淋巴样细胞2型氨基酸代谢和糖酵解的重要内在调节因子。 35 ...此外,我们还观察到T、NK和CD11b中CD 38的表达降低。 + CD 86 + rLeptin给药后的细胞,支持NAD的瘦素依赖性调节。 + 这些细胞代谢对谷氨酰胺解和能量代谢的下游作用 30 ,32 ...此外,我们还发现应用rLeptin后,血清中几种促炎单核细胞源性细胞因子(G-CSF、MIG和MIP-1β)的浓度增加(如图1所示)。 3H ),表明rLeptin替代导致髓系细胞活化增加。
结果表明,脂肪细胞和脂肪因子对免疫细胞的代谢重新编程会触发特定的分化程序,从而决定它们的功能。 36 ,37 ...因此,促炎巨噬细胞的能量平衡高度依赖于糖酵解,而脂肪酸氧化则是具有抗炎作用的巨噬细胞的一种特征。 38 ...因此,当我们在接受rLeptin替代后从AGLCD患者获得的血清中分化出健康供者的单核巨噬细胞时,与未接受rLeptin血清的巨噬细胞相比,细胞的线粒体呼吸减少(见图)。 3 I,j),而它们的细胞外酸化率(ECAR)是可比的(补充图)。 7 )。同样,体外扩增CD8 + 与不含rLeptin的AGLCD患者血清相比,T细胞的耗氧量和细胞外酸化率均发生变化。 8 和 9 ),提示瘦素直接影响免疫细胞的生物能量学。
肠上皮细胞表达瘦素受体 39 瘦素对上皮细胞有直接作用。 2 我们希望通过观察人肠上皮细胞的创伤愈合能力和上皮抵抗,探讨瘦素是否影响肠炎症中上皮屏障的动态平衡。如图所示。 3K Leptin在T84细胞划痕试验中改善了伤口的体外封闭,而不改变上皮抵抗(图一)。 3L,m ).
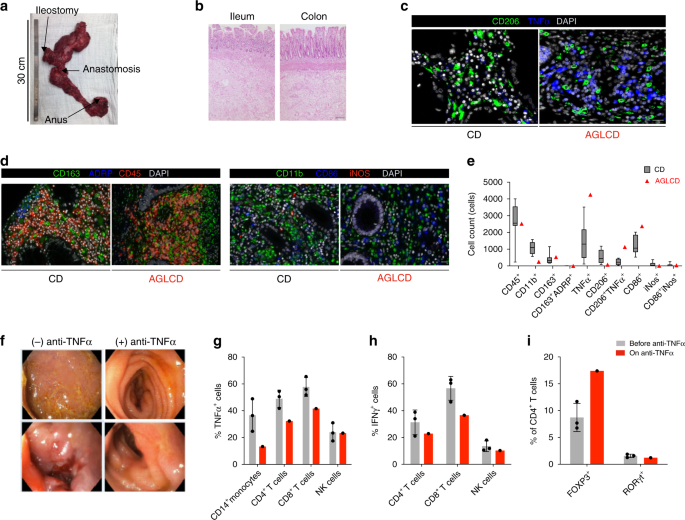
rLeptin替代下的肠道炎症 我们的AGLCD患者在rLeptin替代和以前发生的结构损伤,特别是瘘管的发展中观察到的高疾病活性导致了一个脓肿,最终导致回肠结肠切除和回肠末端造口术(无花果)。 1D 和 4A )。所有切除的肠段均检测到严重的炎症(如图所示)。 4B )。免疫组化结果(补充表) 4 )与CD患者比较,α表达细胞在肠粘膜固有层内大量浸润(图1)。 4C )。根据我们的大量流式细胞仪数据,我们进一步观察到活化的CD 86有较高的浸润。 + AGLCD患者的细胞。 4D,e ),表明AGLCD患者在手术时肠内有肿瘤坏死因子(α)依赖性的炎症活动。考虑到我们关于rLeptin治疗对AGLCD患者PBMCs的影响的数据(如图所示)。 3 )因此,我们假设rLeptin治疗会在肠内引起肿瘤坏死因子α驱动的促炎免疫反应,引起CD的严重恶化。
图4 抗肿瘤坏死因子(α)α治疗可逆转rLeptin治疗过程中肿瘤坏死因子(TNF)引起的肠道炎症. a –e rLeptin替代下的持续炎症和先前的结构损伤(狭窄和瘘管所致脓肿)使直肠结肠切除术和回肠切除必须在rLeptin治疗开始后16天。标本( a )用H&E染色(标尺标出100μm)进行组织学分析。 b ),表现为严重炎症,免疫组织化学染色(IHC); c –e ). c AGLCD患者和克罗恩病(CD)患者肠组织中肿瘤坏死因子(TNF)、肿瘤坏死因子(α)和CD 206染色的显微图像(标度栏显示20m,图像用蔡司的AxioImagerZ1记录)。 d 不同免疫细胞标记的IHC染色的附加图片(用PerkinElmer的Vectra3系统记录,标尺显示20m)和( e )每10个高功率场的细胞染色阳性(CD 45、CD 163和adRP染色-共11个组织样本) n =7例独立的CD对照患者与AGLCD患者( n =1);对于肿瘤坏死因子α和CD 206染色,共9个样本 n =6例独立CD患者,并与AGLCD患者比较( n =1);CD11b、CD 86和iNOS染色共6个样本 n =3例独立的CD患者与AGLCD患者比较( n (1)对同一患者的多个标本进行分析时,从不同的解剖位置提取组织,盲分析)。方框从第25百分位数延伸到第75百分位数。晶须图显示最小(最小)和最大(最大)值。方框中的线表示中间值。 f –i 术后,rLeptin继续治疗,病人在回肠造口术末开始出现新的炎症。临床决定启动抗肿瘤坏死因子α治疗,同时继续替代雷帕汀,从而导致克罗恩病的临床和内镜缓解。 f 开始抗肿瘤坏死因子α治疗前和6个月后内镜检查照片的比较。 g –i 流式细胞术分析抗肿瘤坏死因子α治疗对. g )肿瘤坏死因子(α)和( h )体内外刺激后产生的干扰素γ,以及( I 转录因子FOXP 3和RORγt(“抗肿瘤坏死因子前α”结合三个不同时间点的数据)的表达。列图表上的错误条显示标准偏差(SD)。源数据作为源数据文件提供。
肿瘤坏死因子α−阻断下AGLCD患者的稳定缓解 手术后,病人继续用rLeptin替代以改善胰岛素敏感性,随后在回肠造口术末期再次发展为黏膜炎症,进一步支持了rLeptin驱动的肠道炎症的概念。由于rLeptin替代物增加了肿瘤坏死因子α的产生,我们决定使用阿达利莫单抗进行抗肿瘤坏死因子α治疗,6个月后临床和内镜下得到稳定的缓解(如图所示)。 4F )。此外,肿瘤坏死因子α阻断不仅抑制了CD4中TNFα和IFNγ的产生。 + 和CD8 + T细胞,但也增加了FOXP 3的频率。 + CD4 + 用流式细胞仪检测AGLCD患者的T细胞。 4G-I ).