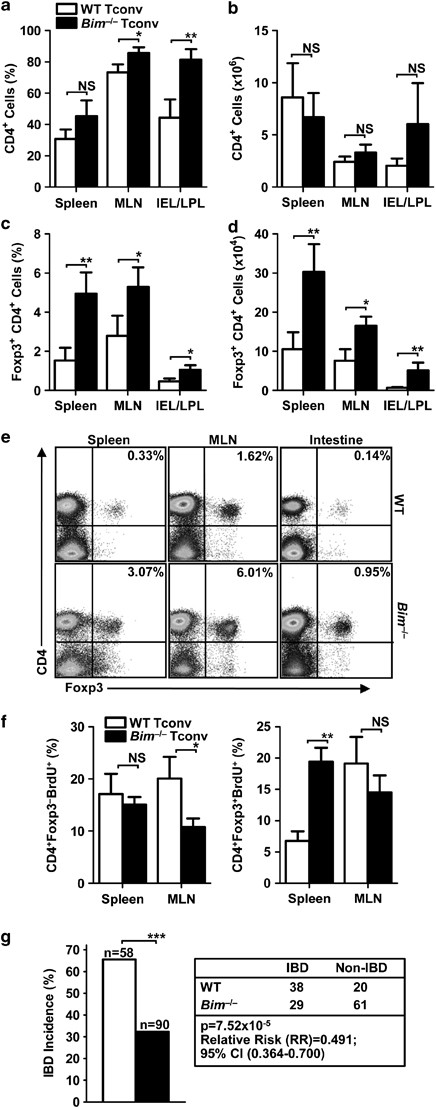
iTregs的优先诱导 体内 在Bim不在的情况下 直接研究Bim耗尽对iTreg稳态的影响 体内 ,通过过继转移CD4诱导小鼠炎症性肠病(IBD)。 + CD 25 − CD45RB 嗨 特康 Rag1 −/− 主人。在该模型中,转移的Tconv可使宿主淋巴组织再填充,导致一定比例的Tconv受体肠道炎症。因为只有Tconv被转移( 补充图S1a ),基本上是所有Foxp 3 + 从受体中恢复的T细胞为 德雷沃 -生成的iTregs。虽然Bim对T细胞凋亡很重要,但我们只观察到 BIM −/− 和WT Tconv受体CD4的百分比和绝对数目 + T细胞从脾脏和肠系膜淋巴结(MLN)中恢复。 图1a和b )。令人惊讶的是,这一比例显著上升( ∼ 2-3倍)和编号( ∼ 3-4倍) + CD4 + 从 BIM −/− Tconv受体与WT受体在脾、肠系膜上皮内淋巴细胞和固有层淋巴细胞(IEL/LPL)联合群中的比较( 图1c和d )。iTregs的增加似乎并不是因为Foxp 3蛋白的表达水平不同,因为iTregs从两者中恢复过来。 BIM −/− 而WT Tconv受体的Foxp 3表达水平相当(脾脏=1022/958(WT/958))。 BIM −/− MIN=1649/1443;肠=1272/1258; 图1e )。这一差异也不是由于能力的提高而造成的。 BIM −/− Tconv扩大,与WT Tconv在转移到淋巴细胞减少宿主后,CD4摄取BrdU的百分比相比较 + Foxp 3 − 细胞在脾脏中相似,而在MLN中WT细胞中则高得令人吃惊( 图1f 和 补充图S1b )。然而,这种差异在CD4的数量上是最小的。 + Foxp 3 − BrdU + 细胞( 补充图S1c )。有趣的是, BIM −/− CD4 + Foxp 3 + BrdU + 脾脏细胞( 图1f 和 补充图S1c )。这可能部分解释了 BIM −/− 脾iTregs和WT iTregs( ∼ 3倍差)与mln( ∼ 2倍差)。
图1 增强型 体内 iTreg诱导和减少IBD的发生率在没有Bim的情况下。Tconv是从C57BL/6(WT)或 BIM −/− 小鼠注射静脉注射。进入.的尾静脉 Rag1 −/− 接受者(0.4×10) 6 (每只老鼠的细胞)。移植后4周,用流式细胞仪分析脾、MLN和IEL/LPL(肠)。CD4的百分比和数量 + (a 和 b )和CD4 + Foxp 3 + (c 和 d )细胞。数据是每组5到7只小鼠的2到3个个体实验的平均±S.E.。a −d ),并使用标准未配对的方法进行统计分析。 t -测试( * P <0.05, ** P <0.01). (e )CD4的代表点图 + Foxp 3 + ITregs。( f )BrdU的百分比 + TCOV(CD4) + Foxp 3 − ,左)和iTregs(CD4) + Foxp 3 + ,右)。数据为每组4只小鼠的两个独立实验的平均±S.E.,并采用标准未配对的方法进行统计分析。 t -测试( * P <0.05, ** P <0.01). (g )TCOV受体IBD的发生率及统计摘要(2×2) χ 2 -分析)
与这些数据一致的是, BIM −/− 特康 ∼ 与WT Tconv接受者相比,IBD的发病率降低50%(以体重下降大于5%的初始体重来衡量)( P =7.52 × 10−5 相对危险度=0.491,95%CI(0.346~0.700); 图1g )。综上所述,这些数据表明Bim的丢失对iTregs的产生和/或存活有有利的影响,而未转换为Foxp 3的转移的Tconv所占的比例更大。 + 种群,对IBD有保护作用。
Bim的丢失给iTregs带来了优先的生存优势。 中观察到的iTregs的增加 BIM −/− TCOV接收者可能是 BIM −/− iTreg转换,有选择的生存优势 BIM −/− iTregs引起的IL-2分泌增加 BIM −/− 由于iTregs固有的生存优势而产生的累积效应 对决 在Bim不在的情况下。为了解决第一种可能性,我们执行了一个 离体 iTreg转化试验。多个因素能够调节iTreg转换的效率。众所周知,TCR信号具有关键作用。具有较高增殖能力的TCR激活促进iTreg的高效分化 离体 (补充数字S2a和b )和 在体内。 17 最近的研究表明 BIM −/− Tconv对TCR刺激反应低, 16 人们可能会预测 BIM −/− 与WT Tconv相比,TCOV可能没有表现出明显的分化优势。与这个概念一致, BIM −/− Tconv的iTreg转换效率较低。 离体 比WT Tconv( 补充图S2C ),这可能是由于TCR激活效率较低所致。有可能 BIM −/− Tconv分泌更多的IL-2,促进了iTregs的转化和存活.然而,这似乎不太可能像WT和 BIM −/− Tconv激活 离体 分泌类似量的白细胞介素-2( 补充图S2D )。此外,CD4的百分比 + CD 25 − IL-2 + 分离细胞 Rag1 −/− 接受WT或WT或 BIM −/− Tconv是等价的( 补充图S2E ).
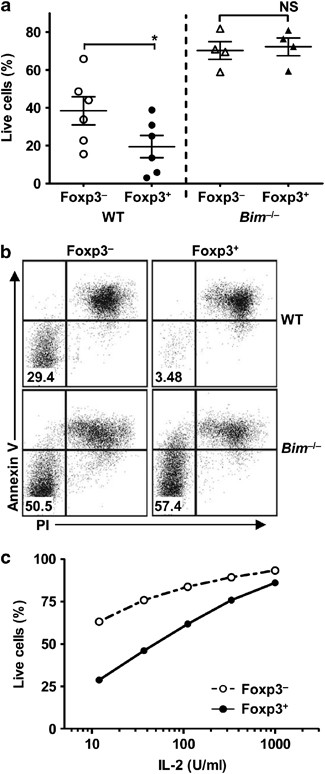
第三种可能性是Bim耗尽对iTregs的存活有不同的影响。 对决 特康夫。IL-2受体(CD 25)的本构表达是nTregs的一个标志,众所周知,NTregs的稳态和存活高度依赖于IL-2。 18 , 19 鉴于Bim是生长因子剥夺介导的细胞凋亡的主要成分,我们比较了WT和WT的生存能力。 BIM −/− iTregs,在没有IL-2的情况下激活Tconv.iTregs是通过激活Foxp 3中纯化的tconv生成的。 绿色荧光蛋白 在转化生长因子存在的情况下报告小鼠- β IL-2持续3天。Foxp 3 + ITregs(全球伙伴关系司) + )和激活Foxp 3 − TCONV(绿色伙伴关系) − )分离培养,在无外源IL-2的条件下培养,并比较其相对存活情况。我们发现Foxp 3 + 与Foxp 3相比,iTregs在不添加外源IL-2的情况下对细胞凋亡的敏感性提高了两倍。 − -激活的TCOV( 图2a和b )。Foxp 3 + iTregs比Foxp 3更容易凋亡。 − -活化的Tconv在有限的外源IL-2(10 U/ml~100 U/ml)范围内; 图2c )。然而,在没有Bim的情况下,iTregs和活化Tconv在这两个细胞群中的生存能力差异被消除了。 图2a和b )。这些数据表明,与活化Tconv相比,iTregs对IL-2剥夺介导的细胞凋亡更为敏感.Bim表达缺失给Foxp 3带来更大的生存优势 + iTregs,使其对生长因子戒断的敏感性降低。
图2 Bim/Bcl-2轴在控制iTreg存活中的优先作用。( a 和 b )Tconv是从WT或 BIM −/− Foxp 3 绿色荧光蛋白 小鼠抗CD3/CD 28微球在转化生长因子存在下激活。 β (5 ng/ml)和IL-2(100 U/ml)连续3d诱导iTreg分化。iTregs(GFP) + )和活化的Tconv(绿色荧光蛋白) − )用流式细胞术(FACS)分类,在无IL-2的情况下培养3天。用碘化丙酸丙啶(PI)和抗Annexin V流式细胞仪测定活iTregs和Tconv的百分率。数据是四个独立实验的平均±S.E.,用标准配对进行统计分析。 t -测试( * P <0.05). (c )iTregs(绿色伙伴关系司) + )和活化的Tconv(绿色荧光蛋白) − )在不同浓度的IL-2存在下培养3天,PI和抗Annexin V法测定活细胞百分率,数据代表两个独立的实验。
iTregs Bim、Bcl-2和Bcl-XL平衡改变对细胞凋亡的内在脆弱性 接下来,我们研究了在有限的IL-2存在下,iTreg与激活的Tconv之间存在差异的机制。活化T细胞仅在TCR介入后瞬间表达IL-2。用抗CD 25抗体阻断IL-2信号对外源性IL-2作用下Tconv的活化存活影响不大。因此,激活的Tconv在限制IL-2条件下对iTregs的存活优势可能是由于细胞的内在机制,而不是自分泌的IL-2途径。
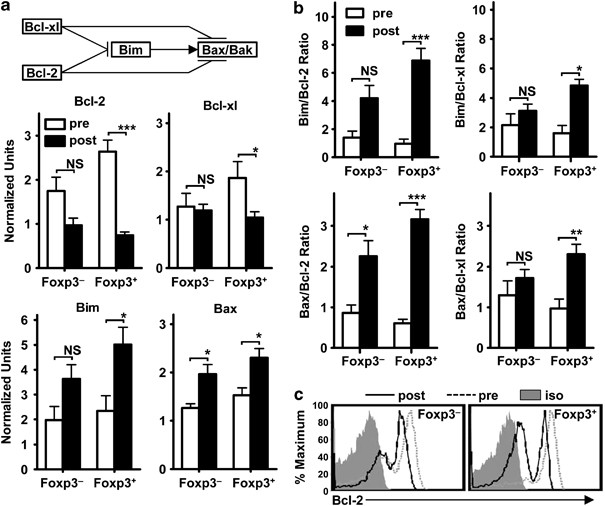
由于亲凋亡分子bim的缺失可以减轻iTregs和活化tconv之间的生存差异,我们比较了在没有外源IL-2的情况下,iTregs和活化tconv中几个亲凋亡和抗凋亡bcl-2家族成员的表达水平。 图3a )。bcl-2家族的促凋亡基因Bim和bax的表达在iTregs和活化的Tconv(IL-2去除前后的表达变化)中有类似程度的增加。Bid表达水平无明显变化。抗凋亡分子bcl-2和bcl-xl在iTregs中的表达略高于IL-2戒断前的活化Tconv。 图3a ;以‘PRE’表示)。然而,与活化的Tconv相比,在没有外源性IL-2的条件下培养48h,iTregs中bcl-2的表达明显降低,而Bim的表达也随之增加。 图3a ;以“POST”表示)。Bcl-XL和Bax的变化相似,但不明显.MCL-1和Noxa在克隆扩增过程中对调节T细胞凋亡具有重要作用。 20 Tconv和iTregs的Mcl-1和Noxa mRNA的相对表达无明显差异(P>0.0 5)。 补充图S3 ).
图3 iTregs中Bim、Bcl-2和Bcl-XL平衡的内在脆弱性.( a 和 b )iTregs和活化的Tconv 图2 ...从新分类的iTregs(Foxp 3)中分离出mRNA。 + )和激活的Tconv(Foxp 3) − ),在没有IL-2(POST)的情况下,在培养前(前)或再培养48小时后。用qPCR方法检测基因的表达水平。数据显示的是5个独立实验的平均±S.E.,用标准配对进行统计分析。 t -测试( * P <0.05, ** P <0.01, *** P <0.005). (c )新分类的iTregs(Foxp 3)细胞内Bcl-2 + )和激活的Tconv(Foxp 3) − )在没有IL-2(POST)的情况下,在培养前(前)或再培养48小时后。数据表示两个独立的实验。
由于细胞存活依赖于亲凋亡分子和抗凋亡分子之间的平衡,而不是它们的绝对表达水平,因此分析相互作用伙伴的相对比率可能是阐明细胞对凋亡敏感性的一个信息参数。新分类的iTregs与活化的Tconv的Bim/Bcl-2、Bim/Bcl-XL、bax/bcl-2和bax/bcl-xl的表达率差异极小。 图3b 表明它们对细胞凋亡的初始敏感性可能是相似的。然而,在没有IL-2的情况下,持续培养导致iTregs中Bim/Bcl-2的表达率显著增加( ∼ 7折前 对决 员额) 对决 活化TCOV( ∼ 3倍)。还有一个 ∼ 在iTregs中Bim/Bcl-XL比值增加了3倍,而活化的Tconv( 图3b )。Bax/Bcl-2或Bax/Bcl-XL比值也有类似的变化.正如预期的那样,补充IL-2可以阻止Bim/Bcl-2比值的增加,这与他们将iTreg存活提高到与活化Tconv相当的水平有关。 补充图S4 )。与mRNA分析相一致,我们观察到与活化的tconv相比,IL-2戒断后细胞内bcl-2蛋白表达丧失的iTregs所占比例要大得多。 图3c )。总的来说,这些数据表明iTregs在维持亲(Bim/bax)和抗凋亡蛋白(bcl-2/bcl-xl)之间的适当平衡,以确保生存的能力降低。
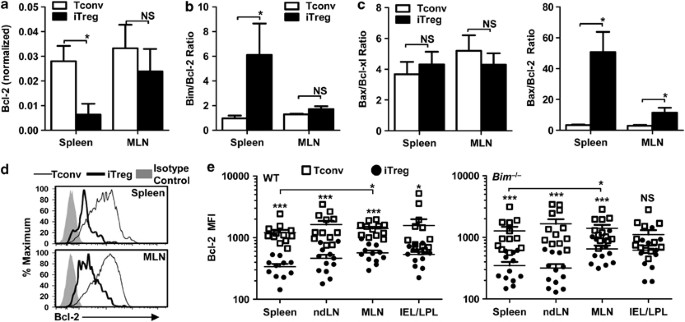
减少bcl-2在iTregs中的表达 体内 扩展我们的发现 体内 ,我们转移了Foxp 3 绿色荧光蛋白 TCOV或CD4 + CD 25 − CD45RB 嗨 Tconv从WT小鼠进入 Rag1 −/− 并分析移植后4周iTregs和Tconv中Bcl-2家族分子的表达水平。虽然iTreg和tconv之间的Bim、bcl-xl和bax的表达水平相当,但iTregs的表达始终比从脾脏中恢复的bcl-2低4~5倍( 图4a )。因此,iTregs的Bim/Bcl-2和bax/bcl-2 mRNA比值显著高于Tconv( 图4b和c )。Bax/Bcl-XL比值无显着性差异(P>0.05)。 图4c )。有趣的是,bcl-2 mRNA在iTregs和tconv中的表达是相似的,这反映了我们观察到在mln中,iTregs的数量增加的幅度要小一些。 对决 脾无Bim( 图1c和d )。由于MLN是IBD模型中免疫应答的主要部位,与脾脏等远端淋巴组织相比,IL-2等生长因子水平可能更丰富。
图4 减少bcl-2在iTregs中的表达 体内 ...Foxp 3 绿色荧光蛋白 TCOV或CD4 + CD 25 − CD45RB 嗨 来自WT或 BIM −/− 小鼠(0.5×10) 6 )转移到 Rag1 −/− 主人。( a –c )调动后4周,iTregs(全球伙伴关系司) + 细胞)和Tconv(绿色荧光蛋白) − 用流式细胞仪(FACS)分离细胞,制备mRNA,qPCR检测基因的表达。所显示的数据代表了三个独立的实验,使用Mann-Whitney检验进行了统计分析( * P <0.01). (d 和 e 术后4周,用流式细胞仪检测细胞内Bcl-2和Foxp 3细胞的iTregs和Tconv、不引流淋巴结(NdLN)、MLN和IEL/LPL。数据为11-12只小鼠的3个个体实验的平均值±S.E.,用标准未配对的方法进行统计分析。t -比较Tconv/iTreg和iTreg在脾脏/mln中的差异( * P <0.05, *** P <0.005)
细胞内bcl-2蛋白染色证实iTregs持续低表达bcl-2( ∼ 3倍)与Foxp 3的比较 − Tconv从脾、无引流淋巴结、MLN和IEL/LPL中分离而来 Rag1 −/− 寄主( 图4d和e )。这也被观察到分离出的细胞。 Rag1 −/− 重新填充的主机 BIM −/− 特康夫( 图4e )。bcl-2在iTregs中的表达也一直较高。总的来说,iTregs似乎缺乏bcl-2的表达,这可能使他们更容易发生凋亡。 体内 .
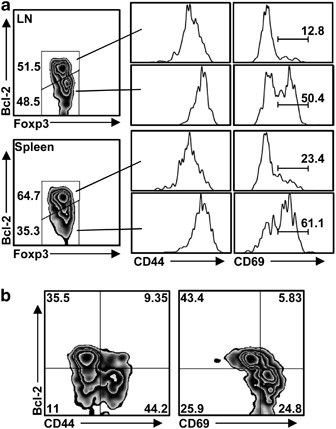
Foxp 3 + BCL 2 罗氏 Treg种群 体内 据报道,nTregs表达的Bcl-2水平高于Tconv。 21 如果bcl-2的低表达是iTregs的特征之一,那么,与nTregs相比,我们询问bcl-2在wtc57bl/6小鼠中是否有可能标记iTregs。 体内 ...与我们的假设一致,有两个明显的tregs种群,可区分为bcl-2。 罗氏 和Bcl-2 嗨 分别在脾脏和周围淋巴结( 图5a )。虽然Bcl-2在Tregs中的表达水平与helios表达无关,但作为iTregs的一个建议标记, 22 , 23 约50%的bcl-2 罗氏 Tregs为CD 69 罗氏 和CD 44 嗨 ,表明这个Treg群体是抗原体验的,但最近没有激活( 图5a和b )。因此,尽管我们不能排除一部分Bcl-2的可能性 罗氏 Tregs来源于nTregs,经过最近的激活,Foxp 3有可能 + bcl-2 罗氏 CD 69 嗨 CD 44 嗨 细胞代表新分化的iTregs,而Foxp 3代表 + bcl-2 罗氏 CD 69 罗氏 CD 44 嗨 单元格表示内存iTreg总体。 24 然而,需要进一步的分析才能确定nTregs和iTregs是否可以通过Bcl-2的表达水平来区分。
图5 Foxp 3的鉴定 + BCL 2 罗氏 调节性T细胞群 在体内。 (a 和 b )用Foxp 3、Bcl-2染色及表面标记。( b )CD4 + Foxp 3 + Bcl-2、CD 44和CD 69染色。五个独立实验的数据表示分析