本研究是第一次在ASD儿童中检测FRA的患病率,并以对照的方式测量FRA阳性儿童对亮氨酸钙的反应。我们还对FRA阳性儿童的临床特点及FRA与CSF、5 MTHF浓度的相关性进行了综述。总之,这项研究显示FRA阳性的ASD儿童FRA患病率高得出乎意料,并且对亮氨酸钙有良好的反应。
ASD患者FRAS的患病率
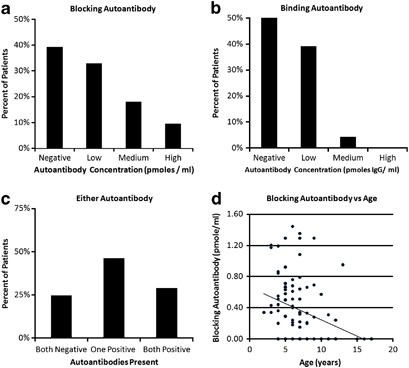
有几项研究报告,在患有ASD的儿童中存在FRAs。2, 3, 4, 5, 6, 7在这些研究中,患有ASD的儿童既有CFD,也有明显的神经异常。在这个病例系列中,在一组没有CFD或明显神经异常的ASD儿童中发现了较高的FRA患病率。阻塞性FRA的患病率(60%)远高于对照组妇女的患病率(估计西班牙为4%-7.2%)。38, 39爱尔兰9%-13%。23据我们所知,阻断FRA在一般美国人口中的流行率还没有公布,但据Quadros博士的实验室估计为10-15%(未公布的数据)。在本病例系列中,结合FRA的患病率为44%,也高于一般美国人口12%的报告。23总的来说,我们的估计表明,ASD儿童的FRA患病率较高;应在ASD中进行更多的研究。
儿童ASD和FRAS的特点
与FRA阴性儿童相比,FRA阳性儿童的临床差异很小。因此,在这一点上,似乎很难区分FRA阳性的ASD儿童和FRA阴性的儿童。FRA阴性儿童自身免疫性疾病家族史高于FRA阳性儿童。这并不支持与FRA相关的疾病,如CFD,是自身免疫性疾病的观点。事实上,FRA阳性的儿童与其他自身免疫标记物或自身抗体之间缺乏任何联系,这说明FRA与传统的自身免疫性疾病有关。考虑到一例幼年类风湿性关节炎与CFD有关,40很明显,经典的自身免疫性疾病可以导致FRA升高,但我们的数据表明这可能并不常见。
阻断FRA浓度随年龄的增加而降低。这一发现的原因尚不清楚。据报道,无奶饮食可以降低阻隔FRA的浓度,5随着年龄的增长,一些孩子可能会自我限制他们的牛奶摄入量。然而,由于本系列中的大多数儿童,不分年龄,都保持无奶饮食,这是不可能的。这一发现也可能与产生FRAs的潜在病理生理学有关。由于ASD的发病时间较早(幼儿年龄左右),部分患儿早期病情有所改善,导致ASD(并有可能引起FRA升高)的病理生理高峰可能在生命早期最活跃,随年龄的增加而降低。
血清FRAs和CSF 5 MTHF浓度
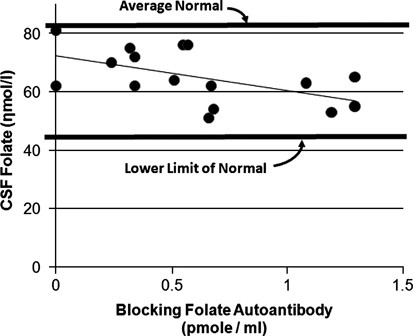
在本研究中,我们发现阻断FRA与CSF 5 MTHF浓度成反比关系,证实了先前的发现。5给出标准平均CFD 5 MTHF浓度为82±31 nmol l。−1(范围:44-181 nmol l−1)5,甚至是本研究中最高的csf 5 mthf浓度(81 Nmol L)。−1在没有阻塞的儿童中,FRA)低于正常儿童的平均水平。
无阻断FRA(72.3nmol l)的CSF5MTHF估计值−1)远低于正常对照组报告的平均浓度。考虑到CSF5MTHF低于正常水平,即使在没有阻断FRAS的儿童中,ASD患儿一般也可能低于正常的CSF5MTHF浓度。这将符合许多研究报告叶酸相关异常的儿童ASD。9, 10, 41, 42, 43更重要的是,无论是否存在fras,患有asd的儿童都可能容易发生跨血脑屏障的叶酸转运异常,因为一项研究报告了rfc基因变异与asd相关。9线粒体紊乱是ASD最常见的代谢紊乱,33还可能导致FRα功能受损。26鉴于ASD儿童已经存在叶酸代谢异常,FRAs可能与其他异常协同作用,以降低CSF 5 MTHF浓度。
白细胞介素治疗
应用亮氨酸钙治疗FRA阳性儿童ASD具有良好的耐受性和良好的认知行为功能,包括言语交流、接受和表达语言、注意和刻板印象行为。大约三分之二的接受治疗的儿童被认为获得了一些好处,大约三分之一的儿童在这些认知行为方面有了适度的或很大的改善(补充表S2)。平均治疗时间4个月。由于一些研究报告说,cfd儿童必须使用亮氨酸钙治疗1-3年,才能获得最大的改善,4, 25更长的治疗期可能会带来额外的好处。
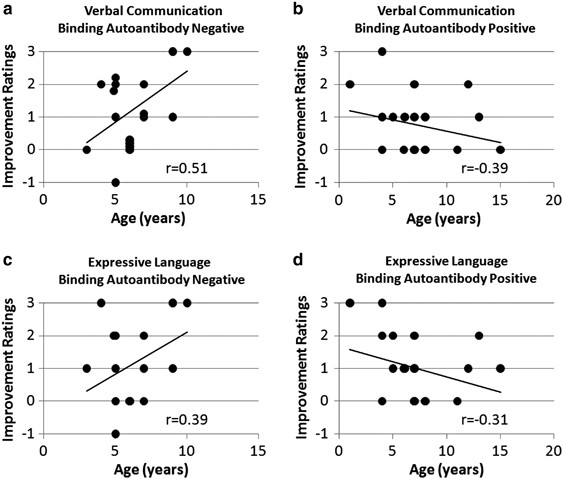
FRA的结合水平和年龄对言语交际和表达语言的改善程度有一定的影响。有人认为,年龄较小的儿童对亮氨酸钙的反应相对较大,2但我们的数据表明,这可能取决于结合的FRA浓度。对于无结合FRA的儿童,年龄较小的儿童改善较少。然而,这些发现应该谨慎地解释,因为很可能后续的时间不够长,不足以为最佳的改善提供必要的时间。
由于FRA浓度在进行和没有进行LP治疗的儿童之间没有显着性差异,而且所有患有LP的儿童的CSF5MTHF浓度都低于正常均值,因此本研究中许多FRA阳性儿童的CSF5MTHF浓度也可能低于平均水平。一些研究人员报告说,在CSF 5 MTHF浓度较低的儿童中,Leucovorin钙治疗有显著的临床改善。44由于即使是低阻断的FRA浓度可能与低CSF 5 MTHF浓度有关,低阻断FRA滴度在一些ASD儿童中可能具有临床意义,这与先前的建议一致。5本研究结果提示,在不进行LP治疗的情况下,应用亮氨酸钙治疗FRA阳性儿童ASD,可能是一种合理、无创的治疗方法。
Leucovorin钙的耐受性一般较好。最常见的AE是恶化的攻击行为,这可能与同时使用利培酮治疗有关。虽然尚不清楚为什么会出现这种副作用,但这些儿童行为变化的迅速发展表明,这可能是由于中枢神经系统中5 MTHF或四氢生物蝶呤增加而引起的CNS多巴胺的增加,从而可能降低了利培酮的多巴胺受体阻断作用。45造成这些行为改变的另一个原因可能是利培酮对线粒体功能的抑制。46, 47线粒体功能障碍的动物模型报告了类似的攻击行为。48,49然而,对于至少一个月内耐受亮氨酸钙的儿童来说,没有迹象表明他们有更多的攻击性。因此,对于未同时接受抗精神病药物且无攻击行为的儿童,经验治疗亮氨酸钙可能是FRA阳性儿童ASD的合理治疗过程。
鉴于RFC提供了一条途径,使由于FRA而导致叶酸转运减少的儿童进入中枢神经系统,我们认为亮氨酸钙的作用是通过增加5 MTHF在CNS中发挥作用的。这得到了一些研究的支持,这些研究表明,在使用亮氨酸后,5 MTHF的CNS浓度会增加。2, 4然而,RFC是肾、肠等其他组织中重要的叶酸载体。由于胃肠道症状与儿童ASD的异常行为有关,50胃肠功能的改善可以改善行为。肾脏功能的改善可以更好地过滤与ASD相关的代谢条件相关的有毒代谢物,从而改善一般生理状况。此外,亮氨酸也被证明可以改善ASD患儿的氧化应激指标。51因此,一些儿童的亮氨酸钙所引起的改善可能是由于亮氨酸钙对非中枢神经系统器官的影响所致。
FRAS和ASD
本研究中FRAs的高患病率与文献中记载的ASD儿童和患有ASD儿童母亲的各种自身抗体的升高是一致的。52, 53尽管有多种自身抗体在儿童ASD中有报道,但其中许多自身抗体的临床意义还没有得到充分的证实,因此存在一些自身抗体可能是免疫功能障碍的偶然现象的可能性。53在本研究中,我们已经证明阻断FRA的血清浓度可以调节CSF 5 MTHF的浓度,而Leucovorin钙治疗可以改善认知行为。因此,fras应该被添加到对asd的认知行为特征有临床意义的自身抗体清单中,例如对gabAergic的自身抗体。54小脑55ASD患儿的神经元和胎儿脑蛋白抗体。56
很可能FRAs不是导致脑脊液5 MTHF水平下降的ASD儿童的唯一罪魁祸首,而是FRAs可能与其他易感因素协同工作,包括降低全身和中央5 MTHF水平的因素。9, 41, 42, 43, 57以及减少叶酸通过血脑屏障的因素。9, 26, 33例如,一些患有自闭症的儿童报告了亚甲基四氢叶酸还原酶基因变异。41可能与5 MTHF的产量下降有关。有趣的是,据报道,某些亚甲基四氢叶酸还原酶基因型与某些自闭症行为有关,包括不寻常的身体活动、多动和自残行为。58此外,二氢叶酸还原酶的一个遗传变异参与了5 MTHF的生产过程。43和RFC中的基因变异9据报道,在一些患有自闭症的儿童中,叶酸转运受损可能是导致中枢神经系统受损的原因之一。最后,线粒体功能障碍,与ASD有关,33可以减少叶酸在血脑屏障上的运输。在一些患有ASD的儿童中报告的胃肠问题可能会使这一问题更加严重。例如,在一些患有ASD的儿童中,报告了某些肠道细菌的异常水平,包括梭菌物种,59, 60能产生肠内短链脂肪酸61这已经被证明是导致动物模型中类似自闭症的行为的原因之一。62这些脂肪酸会消耗肉碱储存,并导致继发性线粒体功能障碍。63因此,如果在儿童时期发生FRAs,那么拥有这些易感因子中一个或多个因素的儿童很可能会有更高的CSF5MTHF浓度降低的风险。当细胞外叶酸浓度较低时,FRα是叶酸转运到中枢神经系统所必需的,20在细胞外叶酸利用率低的情况下,FRA阻断FRα可能特别有害。
此外,FRA的发生时间可能是降低CNS叶酸表型表达的关键因素。因为fra在非asd成人人群中的流行率是非零的。23, 38, 39而且在一些FRA阳性儿童的兄弟姐妹和父母中也发现了ASD,仅仅是FRAs的存在并不一定会导致ASD。事实上,FRAs很可能是在快速发育的时期出现的,而叶酸是大脑生长所必需的。当人FRAs与人、牛和山羊奶中的叶酸受体发生交叉反应时,5很有可能暴露在任何这些乳制品,如发生在第一年的生命,可以触发FRA的生产。随着时间的推移,FRA的慢性升高可能导致中枢神经系统叶酸水平的进行性下降。因此,CNS叶酸减少的症状可能只会在FRA升高和CNS叶酸减少的一段时间内发生。5这将是遗传易感性与环境因素相互作用的真实例子。不幸的是,在这些儿童ASD症状的发展过程中,我们没有机会测量FRA浓度,但是在这段时间内FRA浓度可能更高。显然,一项纵向研究将有助于确定是否存在FRAs对大脑发育最有害的关键窗口。
有趣的是,这些新的发现和高流行的FR自身抗体可能有助于整合一些明显不同的发现描述在一些儿童ASD。例如,叶酸缺乏在中枢神经系统可能导致ASD在一些儿童。4叶酸单碳代谢缺陷已被证明能促进一些ASD儿童的甲基化缺陷和氧化应激。8, 9, 10这反过来可能与ASD大脑中的氧化应激有关。13, 64此外,慢性氧化应激可能导致线粒体功能障碍,15这在一些患有ASD的儿童的大脑中也有报道。16肠道菌群的异常可导致肠内短链脂肪酸的增加,这可能会增加中枢神经叶酸缺乏的不良反应和消耗肉碱水平,这在一些患有ASD的儿童中已经被描述过。65此外,牛奶的饮食暴露可能增加这些自身抗体的产生,并有助于解释为什么一些患有自闭症的儿童改善无奶饮食。66这些发现指出了ASD的代谢、环境和胃肠相关因素,这可能有助于解释ASD的行为和大脑变化,并作为在这些领域进行额外实验和研究的理论基础。
CFD:连续体上的紊乱?
据我们所知,这是第一次报告FRAs在ASD儿童样本中的患病率,这些儿童没有明显的神经异常。本研究结果提示CFD可能存在于一个连续体上,受影响较轻的儿童发展为ASD,而受影响较严重的儿童(即CSF5MTHF水平最低的儿童)具有更严重的神经异常,包括经典的CFD综合征。需要对患有ASD的儿童和使用CFD的儿童进行更多的研究,以探讨这种可能性。
研究局限
此病例系列有几个显著的局限性,包括男女比例高(9:1),而ASD儿童的典型比率为4.5:1。67或CFD的2.5-3:1。2, 4, 5此外,本报告中包括的两个诊所都主要为患有ASD的儿童提供服务,这些儿童有持续的认知行为缺陷。这表明样本可能会受到推荐偏差的影响。今后的研究需要解决一般ASD人群是否也有较高的FRA患病率。即使FRA的存在仅限于ASD人群的一个较小的子集,但一些儿童对亮氨酸钙的显著反应表明,这是在ASD人群中发现的一个重要异常,需要进一步研究。
这项研究不是一项临床试验,医生和父母都没有对治疗视而不见。另外,我们的对照者没有服用安慰剂;因此,安慰剂效应的严重程度没有被考虑在内,我们使用的是主观的父母报告,而不是客观的评估手段。需要双盲、安慰剂对照研究来证实和扩展本病例系列的研究结果.