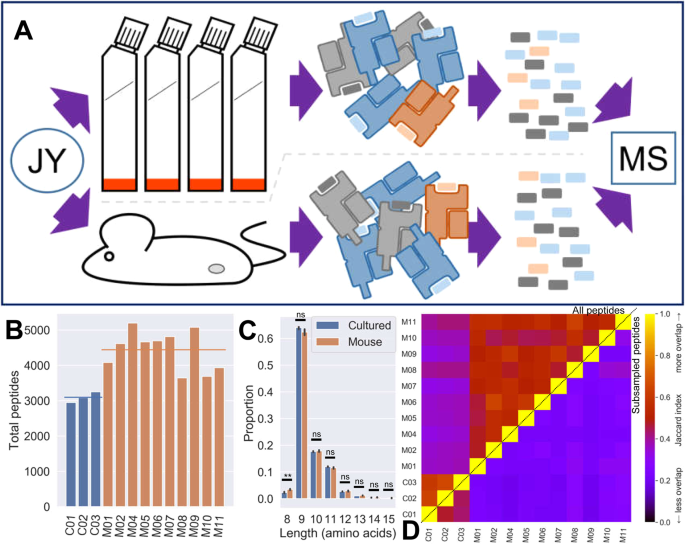
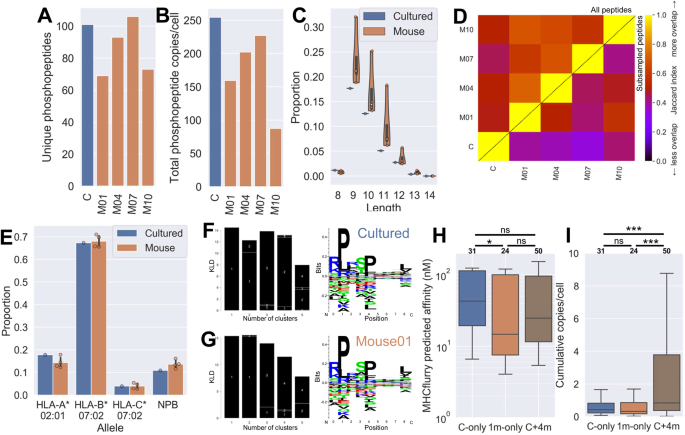
细胞培养
在含10%胎牛血清(FBS,吉布co#26140-079)或新生牛血清(NBS,Gemini Bio-Products#100-504)、2mm/1%GlutaMAX(热费舍尔科学#35050061)和1%青霉素链霉素的RPMI 1640中培养JY细胞。在DMEM/F12中培养MDA-MB-436,以胰蛋白酶法传代。细胞在标准条件下(37℃,腐殖化,5%CO)培养。2),每周分裂三次,将细胞数保持在0.5-1×10之间。6/毫升。
培养细胞直接分离pMHC时,在连续传代培养过程中,通过收获细胞获得细胞。细胞在pbs中洗两次,计数,然后用预称重的锥形离心管球团。球团被冷冻在液氮中,在−80°C储存之前,重新称重以获得球团重量。
Tron细胞系门户34本研究用HLA等位基因获取细胞株的HLA等位基因信息。
动物
根据马萨诸塞州总医院批准的协议,所有动物程序都是按照联邦和机构动物护理和使用委员会的要求进行的。诺德-SCIDIL2RGamma零(NSG)小鼠(杰克逊实验室)按照制造商的指示在Matrigel(Corning)皮下植入细胞。5×106每只小鼠注射细胞。每天监测肿瘤负荷。一旦肿瘤大小达到200毫米3,用CO对小鼠进行安乐死。2,在−80°C保存前,将肿瘤快速采集并冷冻在液氮中。
pMHC分离
Mhc结合肽如前面所述被分离出来。6,14,在这里简单描述。首先,泛人类一级抗体W6/32(#93134,BioLegend)与NHS-sepharose珠(GE,17-0906-01)结合.每1×10制备抗体3mg9细胞或1克组织,以较大者为准。每1mg输入抗体使用100μ1的珠子。在PBS中清洗两次珠子,然后用抗体在一夜之间旋转孵育。第二天,用0.1MTris-HCl颗粒包裹,封闭1h,然后在0.1M醋酸盐/0.5M NaCl和0.1M Tris-HCl交替溶液中洗涤两次。微球再悬浮在20 mm Tris/150 mm NaCl中,残留抗体高达1mg/ml,保存于4°C,直至使用。
第二天,细胞在溶解缓冲液中溶解(对于JY肿瘤,用5 mm edta,pH 8,或用20 mm Tris-HCl,150 mm NaCl,1%chaps,p H 9,每1×10用5毫升)。9细胞或1克组织。裂解缓冲液中添加蛋白酶和磷酸酶抑制剂鸡尾酒,全部来源于Sigma Aldrich:JY肿瘤标本分别用磷酸酶抑制剂鸡尾酒Ⅱ和Ⅲ(#P 5726和#P 0044)、抑肽酶(#A 4529)、亮肽素(#L 2884)和肽抑素A(#77170)溶解,其余样品分别用磷酸磷酸酶抑制剂和完整的微型蛋白酶抑制剂(分别为#4906845001和#11836153001)进行裂解。细胞冷冻后,在4°C缓冲液中旋转1~2h,裂解前用Miltenyi生物技术(Miltenyi Biotech)分离JY肿瘤标本,用氮冷组织粉碎机(Cellcrer)粉碎MDA-MB-436乳腺癌肿瘤标本。裂解细胞在36,800 rpm离心1小时,4℃下,上清液与早期制备的抗体珠结合物混合,在4°C下旋转一夜,使MHC结合。
第二天,球粒用10毫升的溶解缓冲液洗涤,再悬浮在~500μl 20 mm的Tris-HCL中,然后转移到微离心管或聚支柱柱上。在4°C下,用2×20 mm Tris-HCL,150 mm NaCl,2×20 mm Tris-HCl,1 M NaCl,3×1ml 20 mm Tris-HCl洗涤。洗涤后的珠,然后通过一个预湿的阿米孔超离心过滤柱(>=3 kDa,微孔),所有的液体被离心除去。此时,列被并行处理,并存储在−80°C以供以后处理。
停退脱盐(舞台)小贴士
干珠结合HLA:肽复合物包含在Am图标过滤器被发送到阶段尖端清除方法。舞台技巧的制作如前所述。35对4E8~6E8C.eq进行脱盐处理。样本。采用以下洗涤步骤:甲醇1 0 0μl 3 5 0×g 2次1 min洗涤1 min,80%乙腈0.0 1%乙酸5 0μl 1 min洗涤1 0 0×g,2次1 min洗涤1 0 0μl 1%乙酸3 5 0×g,解冻后微球由滤池转移到单独的低蛋白结合管中,以保证完全转移。3 0 0×g离心1 min,将培养上清装在1 5 0μ1×g的台尖上,3500×g装1 min,用3%乙腈/5%乙酸的10 0μl洗涤,1%乙酸的5 0μl洗涤,3 5 0×g的培养上清液分别装于台尖1 min。
将10%醋酸的1 5 0μ1加入到管中,在室温下摇动5 min,洗脱结合在微球上的多肽。以300×g离心1 min,上清液转入低结合管。这一过程被重复,以确保从HLA分子和上清液加入低结合管的多肽完全洗脱。在10%醋酸洗脱上清液中加入两个内磷酸肽标准,每次250 fmol。然后,洗脱上清液在加载到舞台尖端之前,先进行3秒的超声处理。洗脱上清液以3500×g的浓度,以150个μl的浓度加载到舞台尖端,直至整个体积通过。用1%醋酸100μ1的三轮冲洗台尖。以乙腈浓度为20μ/0.1%乙酸,20μl为40%乙腈/0.1%乙酸,20μ1为60%乙腈/0.1%乙酸为洗脱剂。洗脱后的肽组分用Centrivap干燥完成,在0.1%甲酸中重组成1E7细胞等量的μ1,并保存在−80°C中,直至进一步使用。
非富集免疫肽MS
5 E7 C.Eq.将每个样品加载到熔融石英微毛细管分析柱(360μm.d.)。×75μm I.D.)配有皮砂砾,10μm电喷雾尖端,用20厘米的1.9μm C18 Reprosil树脂包装,并与高效液相色谱法连接。用0~30%溶剂B(80%乙腈,0.1%甲酸)在90 min内洗脱,流速为200 nL/min,电喷雾直接离子化进入轨道融合流明质谱。在轨道RAP质量分析仪上获得了全扫描高分辨质谱(MS1),用HCD和ETD裂解法在仪器的线性离子阱中获得了MS/MS谱。采用高速扫描的方法,首先获得一次高分辨率MS1扫描(400 m/z时分辨率为60,000),然后在第二时间(按丰度顺序)选择尽可能多的母体离子进行HCD和ETD的碎裂。数据相关参数包括重复计数3次,重复时间10秒,排除列表持续时间10次。此外,排除了电荷状态为+1的离子。附加参数包括预校准的ETD反应时间、FTMS自动增益控制(AGC)目标2e5电荷、ITMS AGC目标1e4电荷和ETD试剂目标1e4电荷。
mDA-MB-436样品中非富集免疫肽的分析在某些部分存在差异.2E7C.eq载于熔融石英微毛细管预柱(360 mg.d.)。(×75-mI.D.)配备2毫米卡西尔1624型冰箱,10厘米C18反相填料(直径5-20m,孔径120个)。分析柱(360μm o.d)。×50μm I.D.)用普通C18(直径5μm)填料包装,并配备激光牵引,电喷雾发射器尖端(2μm直径)。肽用溶剂B洗脱,乙腈用量为66%,乙酸用量为0.1%,洗脱时间为60~100 nL/min,在热科学™轨道饶舌聚变质谱仪上进行洗脱。MS1扫描采用相同的高速方法和数据相关参数,然后选择尽可能多的母离子,CAD对+2进行裂解,ETD选择+2和+3电荷态。对+3和+2离子的高分辨ETD和CAD分别累积到最大注入时间为120 ms的AGC目标值2E5,并以15K的分辨率在轨道分析仪上检测到。+2离子的补充低分辨率ETD的附加参数与JY相同.
磷肽富集与MS
如上文所述,样品通过固定金属亲和层析进行了费舍尔酯化和磷酸肽富集。36.
采用熔融石英微毛细管柱(360μm.d.)×75μm I.D.)配备2毫米Kasil 1624型冰箱,装有5.5cm的PorosMC 20亚氨基二乙酸酯树脂。iMac柱以20μl/min的流速进行压力清洗,步骤如下:20 min水冲洗,10 min 50 mm EDTA漂洗,10 min水冲洗。用10 0mm FeCl 3进行3轮活化5 min,流速为2 0μl/min,培养3 min,以0.5μ1/min的流速,以0.5μ1/min的流速,以0.5μ1/min的流速,与0.0 1%醋酸的25μl平衡。用1:1:1(甲醇:乙腈:0.01%醋酸,体积/体积)的50μl(甲醇:乙腈:0.01%醋酸,体积/体积)的方法,在活化的iMac柱上,以0.5μ1/min的流速,对干燥的酯化肽样品进行重组。样品加载后,将1:1:1的25μ1加入进样管,以0.5μl/min的流速加载到iMac柱上。在流速为0.5μl/min的条件下,用0.0 1%醋酸进行15μ1的最后冲洗。
熔融石英微毛细管预柱(360μm.d.×75μm I.D.)采用2 mm Kasil 1624冰箱,用8 cm 3μm C18填充树脂,通过Teflon套筒将树脂对接到iMac柱上,用新制备的250 mm L抗坏血酸在水中(PH 2)以0.5μl/min的流速洗脱到预柱上,流速为0.5μl/min,洗脱时间为60~90 min。在分离前柱与iMac柱分离之前,在相同流速下完成0.01%醋酸的最后冲洗。预柱连接到熔融石英微毛细管分析柱(360μm.d.)。×75μm I.D.)配有皮砂砾,10μm电喷雾尖端,用20厘米的1.9μm C18 Reprosil树脂包装,并与高效液相色谱法连接。
Jy磷酸肽用0~60%溶剂B(80%乙腈,0.1%甲酸)在60 min内洗脱,流速为200 nL/min,电喷雾直接离子化,直接进入轨道熔合流明质谱。在轨道RAP质量分析仪上获得全扫描高分辨质谱(MS1),在线性离子阱中用CAD和ETD裂解法获得MS/MS谱。采用高速中性损耗触发方法,首先获得一次高分辨率MS1扫描(400 m/z时分辨率为60,000),然后在3秒钟内选择尽可能多的母离子(按丰度顺序)进行CAD破碎。如果前8种产物离子中存在磷酸(Δ98 Da)损失的中性损耗特性,则对该前驱体进行电子衍射扫描。数据相关参数包括重复计数3次,重复时间10秒,排除列表持续时间10次。此外,排除了电荷状态为+1的离子。附加参数包括预校准的ETD反应时间、FTMS自动增益控制(AGC)目标2e5电荷、ITMS AGC目标1e4电荷和ETD试剂目标1e4电荷。MDA-MB-436磷酸肽的处理方法相似,但溶剂B由66%乙腈在0.1%乙酸中洗脱,在60~100 nL/min洗脱,在轨道饶舌融合中处理。
MS数据分析
数据分析用X杯软件(热电子公司)进行。对于标准免疫肽,使用Byonic(蛋白质计量学)搜索原始数据文件。37针对Swissprot人蛋白数据库,采用以下参数:无酶特异性、氧化修饰(蛋氨酸、色氨酸、半胱氨酸)、半胱氨酸(半胱氨酸)、磷酸化(丝氨酸、苏氨酸、酪氨酸)、±10 ppm前体耐受(MDA-MB-436±6 ppm)、±0.40 Da产物离子耐受和1%FDR。这还输出了每个肽的源蛋白。对MDA-MB-436样品的非富集免疫肽,在Byonic搜索中考虑了±6 ppm前体质量耐受和±20 ppm产物离子质量耐受。磷酸肽搜索还使用了甲基酯(天冬氨酸、谷氨酸、C-末端)参数的固定修饰。这两个搜索的点击率被用来指导分析,磷肽序列是通过精确的质量测量和对ms2光谱的手工解释来确定的。德雷沃测序。原始数据文件也被搜索到一个内部的磷酸肽数据库,其中包含了使用相同参数从以前的样本中识别出的所有磷酸肽。所有磷酸肽序列均经人工验证。
通过与已知数量的内部标准相比较,估算了已识别的磷酸肽的相对丰度,并对其进行了调整,以便在整个过程的各个步骤中恢复内部磷标准。计算每个细胞等效拷贝的假设是:1克组织相当于1e9细胞,1.6股细胞代表每细胞1份拷贝。
下游数据分析
大多数分析都是用Python(2.7.12或2.7.15)进行的,主要软件包如下:cip(1.1.0);numpy(1.15.3);matplotlib(2.2.3);熊猫(0.23.4);海运(0.9.0);matplotlib_venn;upsetplan(0.1);acora(2.2);modlight(4.1.1)。
在此分析中,只考虑了8~15个氨基酸的多肽。在下游加工分析之前,所有的修饰都被剥离和重复序列组合起来。对于标准的(非富磷的)免疫球蛋白丰度值,由于不同尺度的不相容和所有数据集缺乏丰度值而被忽略。
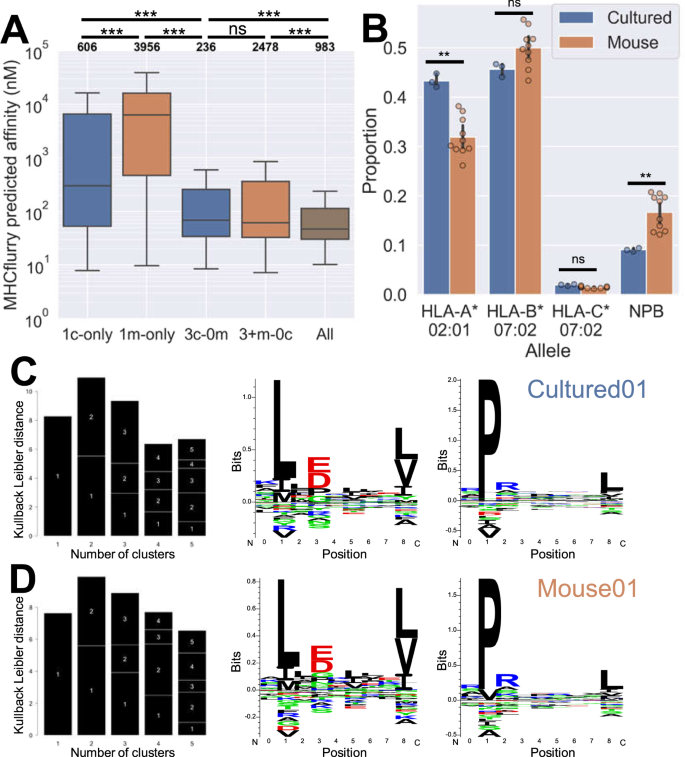
肽-MHC结合预测软件(1.2.2)17用于分配可能的HLA等位基因结合等位基因和预测亲缘关系,在Python中被调用,而不是单独运行,预测亲和力值在1000 nm以下被指定为一个低阈值的潜在结合剂。肽被分配给具有最佳预测亲和力的等位基因,即最低的NM值。使用NetMHC-4.018为了确认MHCflzy的发现,作为一个独立的工具运行相关HLA等位基因的默认参数,等级分数在2以下被指定为潜在的粘合剂。
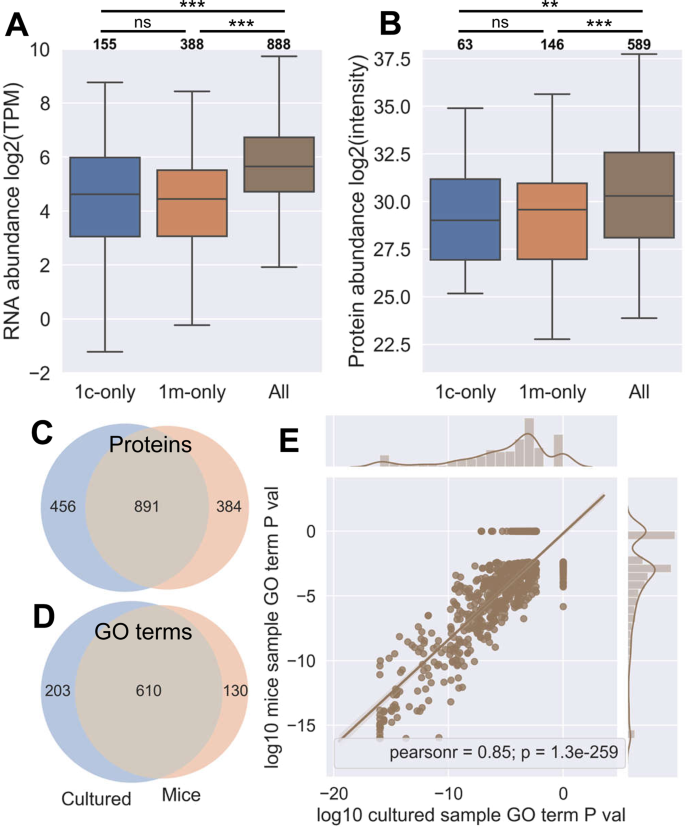
韦格式塔38在Web界面上运行时,使用了以下条件:‘Hapiens’,过度表达富集分析,遗传学,生物过程,以错误发现率(FDR)<0.05收集结果。将含有多肽的蛋白质的基因符号与SwissProt中列出的所有人类蛋白质的基因符号进行比较(2018年11月访问)。
利用Python中的acora软件包,利用aho-corasick字符串匹配算法,快速搜索含有大量潜在子字符串的序列,实现了人类肽与小鼠蛋白质组的重叠。39.
用modlAMP Python软件包计算肽的电物理性质。40...计算了pH值为7.4时的电荷值,包括C端酰胺。
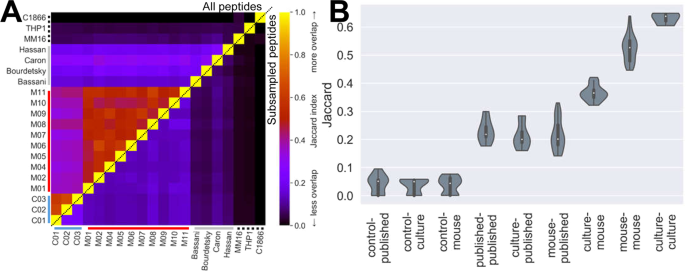
Jaccard索引是两组元素之间规范化重叠的度量,范围从零(意思是没有重叠)到一个(用于比较具有相同列表的集合)。它被定义为相交(共享元素的数目)除以联合(两个集合中唯一元素的总数)。两个肽A和B列表的Jaccard是用下面的方程计算的(其中‘∩’表示两组之间共享的肽,和‘∪‘表示这两组组合中存在的多肽)。请注意,这个方程将每个唯一的肽序列视为独立于其他肽序列,而不管任何两个肽序列是否相似。由于肽因小的变化而不同(例如,单个残基差异,或同一序列的短/长版本)可以相当好地表示,这一指标可以被认为是免疫球蛋白相似性的保守度量。
$J(A,B)=\frac{A\capB}{A\杯B}$$
公共数据源
Jy RNAseq数据是通过SRA登录SRR 364065从NCBI下载的41...转录本用Kallisto进行假读量化。42(0.43.1版)针对GRCH 38参考文献,补充了EBV‘Akata’菌株的转录本43(以防止病毒序列的错位)。Jy蛋白质组数据来自Bassani-Sternberg先前的一项免疫球蛋白组研究。等人.20.
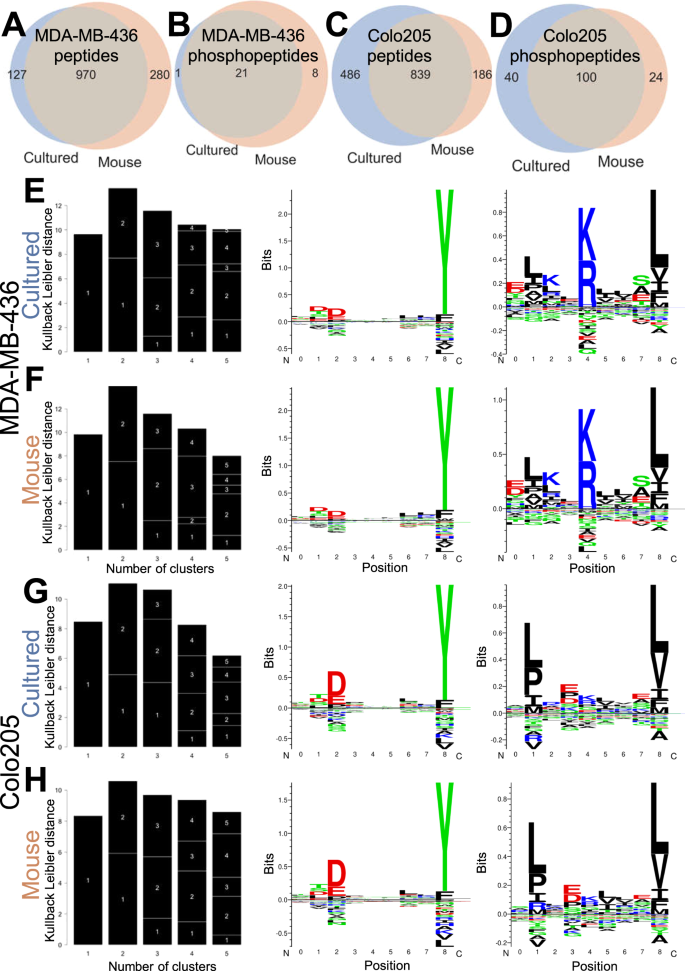
先前发表的JY免疫球蛋白来自Hassan的研究等人.16波德斯基等人.44,Bassani-Sternberg等人.20,和Caron等人.45...其他非JY控制免疫球蛋白来自SysteMHC Atlas项目。21...使用的样本是:MM 16,一种人类黑色素瘤样本。46(SYSMHC 00023);THP 1,一种常用的单核细胞样白血病系,未发表(SYSMHC 002);c 1866,T淋巴细胞系47(SYSMHC 00011)MDA-MB-436和Colo 205也作为JY的替代细胞,产生免疫球蛋白.SysteMHC/Tron中报道的这些品系的HLA等位基因如下:
HLA-A*01:01,HLA-A*24:02,HLA-B*07:02,HLA-B*08:01,HLA-C07:01,HLA-C*07:02
THP 1:HLA-A*02:01,HLA-A*24:02,HLA-B*15:11,HLA-B*35:01,HLA-C*03:03
C 1866:HLA-A*01:01,HLA-B*08:01,HLA-B*44:02,HLA-C*05:01,HLA-C*07:02
MDA-MB-436:HLA-A*01:01,HLA-B*08:01,HLA-C*07:01
Colo 205:HLA-A*01:01,HLA-A*02:01,HLA-B*07:02,HLA-B*08:01,HLA-C*07:01
请注意,MHCfl状版本1.2.2不支持HLA-C*07:01的绑定预测:相反,HLA-C*07:02(具有非常相似的结合主题)用于预测Colo 205和MDA-436的可能的负责任等位基因。
以UP 000005640(人)和UP 000000589(小鼠)为材料,从UniProt中获得完整的蛋白质组。