伦理
这是一项回顾性研究,使用了七个已完成的临床试验的存档血清样本。该研究议定书由H pital Erasme独立道德委员会批准(布鲁克斯大学;第P 2015/173号议定书),这项研究是根据“赫尔辛基宣言”和“良好临床做法”进行的。参与者或法律上可接受的代表提供书面知情同意参加原始临床试验,并同意其样本用于进一步研究。这项研究于2015年4月14日在临床试验中注册(NCT 02415842)。
临床试验、参与者和疫苗
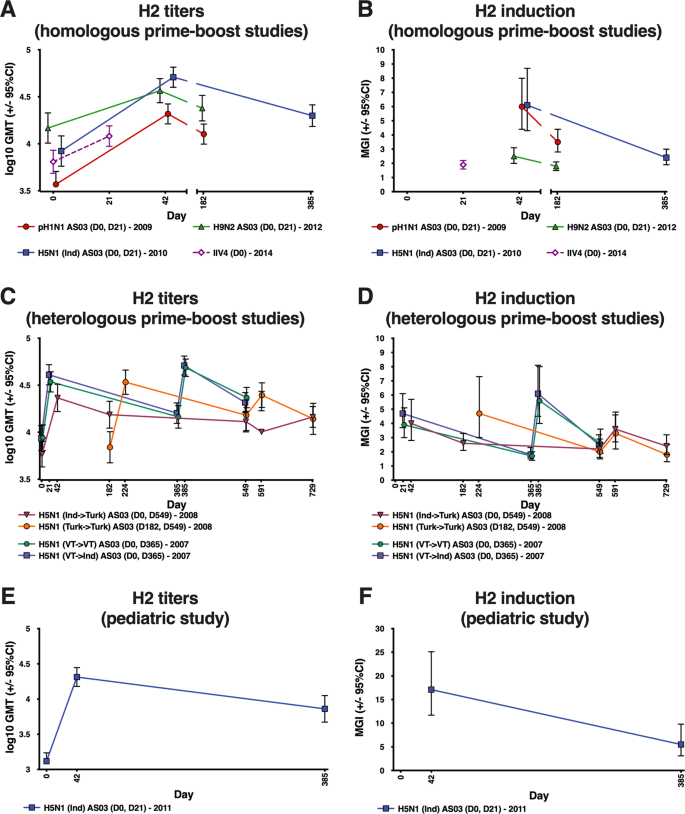
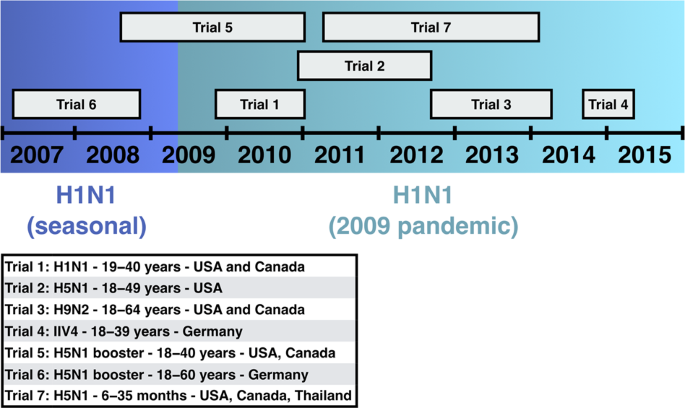
我们包括以下大流行或大流行前流感病毒疫苗(以下简称大流行性流感疫苗)或季节性流感病毒疫苗的试验数据:三个在成人中灭活、分裂-病毒A/H1N1、A/H5N1/H5N1和A/H9N2大流行性流感疫苗(试验1、2和3)的同源主要促进试验(试验1、2和3)、成人单剂量季节性灭活四价流感病毒疫苗(IIV 4)试验(试验4)、成人A/H5N1大流行性流感疫苗两次异源促进试验(试验5和6),和一项与A/H5N1大流行流感疫苗在儿童中的同源的一级推进试验(试验7)(图7)。6表1;补充表6).25,26,27,28,29,30,31,32我们的目标是从每个试验的相关治疗组中选出大约30名参与者。如果参与者已经按照协议完成了临床试验,并且在所有协议指定的样本时间点都有足够的剩余样本量,那么他们就有资格参加本研究。
除试验2中使用的A/H5N1疫苗外,所有疫苗都是在鸡蛋系统中生产的,该疫苗是细胞培养衍生的。对<12个月的儿童在三角肌或大腿注射0.5 mL体积的疫苗。表中描述了疫苗株、疫苗接种计划和用于免疫反应测量的血液取样计划。1...AS 03是一种含ɑ-生育酚(AS 03)的水乳状液辅助体系。A:11.86毫克;AS 03B:5.93毫克。45
研究目标
我们包括试验1−4,以测试具有外来HA头结构域的大流行性流感病毒疫苗的潜力,与季节性流感病毒疫苗相比,该疫苗能在个体中诱导抗HA茎抗体,而季节性流感病毒疫苗被认为主要是由于以前暴露于同型季节性毒株而引起抗HA头部特异性免疫反应。试验5和试验6测试相同病毒亚型(A/H5N1)的异源毒株是否有足够的不同,主要是提高HA茎抗体,而不是HA头部特异性反应。我们包括了儿童队列(试验7),以测试是否可以在已经存在的HA茎抗体水平很低的个体中激发HA茎抗体。
我们选择试验和抗原来评估大流行疫苗引起的抗茎抗体的水平和功能,以及免疫应答的呼吸。此外,我们还从B记忆细胞和浆细胞反应的角度评价了细胞介导的免疫功能,以及实验参与者血清对小鼠体内的保护作用。
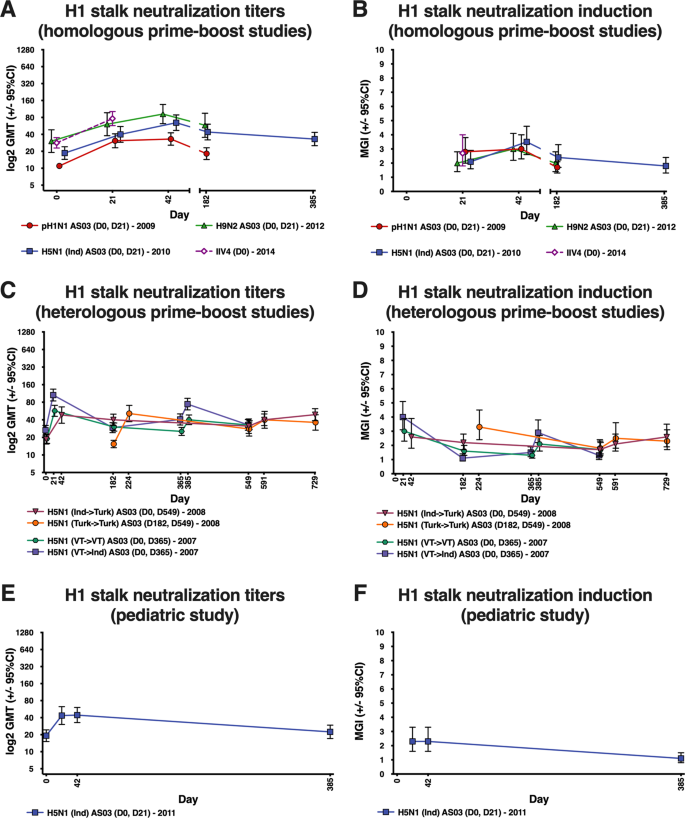
本研究有四个共同的目的:(1)酶联免疫吸附试验(ELISA)检测抗H1茎抗体的应答;(2)接受AS 03佐剂疫苗或IIV 4的参与者的微整化(MN)抗H1茎抗体反应;(3)接受AS03佐剂疫苗或IIV 4的参与者的抗H2全长HA和抗H18全长HA抗体应答;(4)接受AS03佐剂疫苗或IIV 4患者的疫苗异型抗体应答。从几何平均滴度(GMT)和平均几何增量(MGI)两方面综述了抗体的应答情况。
我们以AS 03佐剂对抗茎抗体水平的影响为次要指标(AS 03-佐剂/非佐剂)和≥效价升高4倍者(AS 03-佐剂减非佐剂)的比例差异进行了评价。本研究还以HI法检测大流行疫苗同源病毒的免疫前血清学阳性率,作为第二目标。
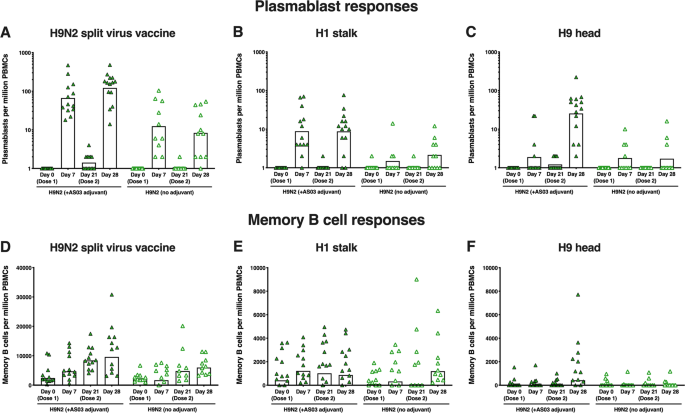
我们在试验3(收集这些细胞的唯一试验)的B记忆细胞和浆细胞反应方面评估了细胞介导的免疫作为第三级终点。此外,血清被动转移/病毒攻击实验评估了试验2中接受AS 03佐剂疫苗的参与者的体内保护作用。
免疫原性试验
ELISA法
我们使用来自A/mallard/瑞典/81/2002(A/H6N1)和来自A/California/04/2009(A/H1N1大流行株)的h6头结构域的重组嵌合hh 6/1 HA抗原(A/h1n1)检测抗H1柄抗体。2)。此外,我们还分别基于A/Japan/305/1957和A/平面BAT/秘鲁/033/2010病毒,用全长重组h2和h18 HA抗原评估了免疫应答的宽度。46,47(表)2)。重组蛋白在毛滴虫利用杆状病毒表达系统衍生的BTI-TN-5b1-4细胞。所有蛋白均含有C端三聚结构域和用于纯化的六氮胞苷标记.我们采用经典的ELISA法,将抗原包被在96孔板上,阻断后加入血清,然后依次稀释。经过培养和洗涤后,检测抗体(小鼠抗人IgG HRP克隆JDC-10[Southern Biotech,CAT])。第9040-05号;1:2000)用于区分附在抗原上的血清抗体。用光密度法测定血清抗体含量。除抗原特异性标准外,还建立了阳性和阴性对照。检测截止量为66 EU/mL(ELISA单位/mL)。
锰测定
我们用反向遗传重组病毒与A/mallard/瑞典/81/2002(A/H6N1)、A/California/04/2009(A/H1N1大流行株)和N5(A/mallard/瑞典/86/2003(A/H12N5)的H6头结构域进行MN分析,评价抗H1茎抗体的功能。2)。由于人类一般对H6头部结构域和N5神经氨酸酶是天真的,这种病毒应该主要测量HA茎抗体介导的中和作用。用A/H5N8(A/GyrFalcon/Washington/41088-6/2014的HA和NA反向遗传学重组病毒)、A/H1N1类禽流感病毒(A/猪/江苏/40/2011)和A/H1 N1pdm09病毒(A/新加坡/GP 1908/2015)的同一方法对疫苗-异型中和进行了评估(表A/新加坡/GP 1908/2015)。2).
样品经受体破坏酶(Denka Seiken)处理,56℃热灭活30 min,标准病毒量(200个菌斑形成单位[PFU]或50%组织培养感染剂量的100倍,视病毒株而定)与含N-甲基苯丙氨酸氯甲基酮的胰蛋白酶处理的胰蛋白酶(Lonza Bioscience)(1:1000稀释)混合,在室温下与病毒结合1 h。将病毒-血清混合物加入Madin-Darby犬肾细胞,在33°C或37°C(视病毒株而定)条件下孵育1h,孵育后取病毒血清混合物,以原浓度稀释血清代替。孵育48−72h(视病毒株而定)后,用细胞上清液测定鸡红细胞(浓度:0.5%)的血凝,观察病毒复制情况,并在血清稀释度最高时计算病毒的中和效价,使病毒完全中和。每例血清标本检测一次。检测截止时间为1:10。
血凝抑制试验
对相应的疫苗株进行了Hi试验。用标准化的、综合验证的微量法对解冻后的血清样品进行了测定,采用每25L适当抗原的两个血凝单位和0.45%的鸡红细胞悬液。48用RDE和热灭活方法去除非特异性血清抑制剂。从初始稀释度为1:10开始,配制了稀释系列(稀释倍数为2),最终稀释倍数为1:10,240。以滴定终点为最高稀释步骤,完全抑制血凝。所有检测一式两份。截止值为1:10。
记忆B细胞和浆细胞检测法
采用酶联免疫吸附法(ELISpot)检测外周血HA茎特异性记忆B细胞的频率(每百万记忆B-细胞)。该方法是根据CroTTY(2004)的方法进行的。49在体外刺激外周血单个核细胞(PBMCs)5天后,将记忆B细胞分化为抗体分泌细胞,然后在涂有感兴趣抗原(用于检测抗原特异性记忆B-细胞)或抗人Ig(用于检测总记忆B-细胞)的硝基板中孵育。采用常规免疫酶法检测抗体/抗原斑点计数记忆B细胞,结果表示为抗原特异性记忆B细胞在总记忆B细胞群体中的频率。同样的方法不需要体外刺激步骤,用同样的方法来测定浆细胞的反应。对下列抗原的反应进行了评估:A/鸡/Hong Kong/G9/1997(A/H9N2)分离病毒、H1茎结构域(上述嵌合cH6/1抗原)和三聚体H9球头结构域(基于A/鸡/Hong Kong/G9/1997的重组蛋白)(见表)。2).
被动转移/病毒挑战
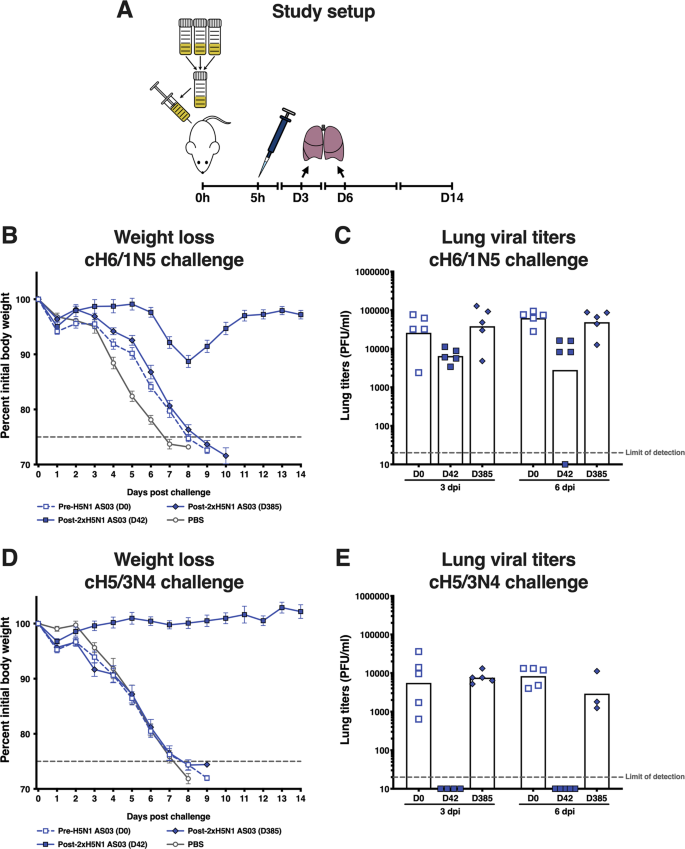
从试验2中接受AS03佐剂疫苗的参与者中收集的血清样本按时点(基线,第一次接种后42天[第42天]和接种后1年[第385天])汇总。我们包括基线数据,以便比较疫苗接种前与接种后血清的保护效果。受体BALB/c小鼠腹腔注射150 L混合血清,然后分别接种CH5/3N4或cH6/1N5病毒(分别测量头和茎反应)(表)2)。评估血清提供的保护水平,包括平均体重减轻(在挑战后14天内从基线上的变化)和肺病毒滴度的变化(Log)。10与基线[PFU/mL]之差翻倍)。50微升病毒制剂稀释在磷酸盐缓冲液生理盐水内。CH5/3N4病毒的剂量为16,000 pfu,用于减肥分析(相当于5xLD)。50在正常人血清存在下)和280 pfu进行肺病毒滴度分析。cH6/1N5病毒的相应剂量为200 pfu(相当于5xLD)。50在正常人血清存在下)和18 PFU。每组10只。病毒攻击后体重下降超过25%的小鼠由于伦理原因而被安乐死,并被视为死亡。
统计方法
GMT计算采用log 10滴度变换平均值的反对数。在GMT计算中,抗体滴度低于试验截止值的任意值为截取值的一半。每组分别获得95%可信区间(CI)。在对数变换值正态分布且方差未知的情况下,首次得到了对数转换滴度均值的95%CI。通过对95%CI的指数变换,得到GMTs 95%CI的对数转换效价均值。所有计算的顺铂均为双面。以Clopper和Pearson的方法为基础,对组内某一比例的95%顺铂进行了测定。50以疫苗组为固定效应,以基线滴度为协变量,采用方差分析模型,计算调整后的GMT比值和95%的顺铂(Cis)值,并与非佐剂组进行比较。