DNA-PKcs促进酒精肝病通过激活Drp1-related线粒体分裂和抑制FUNDC1-required mitophagy
DNA-PKcs促进酒精肝病通过激活Drp1-related线粒体分裂和抑制FUNDC1-required mitophagy
摘要
依赖DNA的蛋白激酶催化亚基(DNA-PKcs)是一种新颖的管家肝线粒体稳态在DNA修复过程。 在这项研究中,DNA-PKcs调节小鼠的肝脏中,被暴露于酒精; DNA-PKcs的表达呈正相关,肝脂肪变性、纤维化、细胞凋亡和线粒体损伤。 功能研究表明,肝脏特异性DNA-PKcs淘汰赛(DNA-PKcsLKO)小鼠免受慢性ethanol-induced肝损伤和线粒体损伤。 机械的调查证实DNA-PKcs促进p53激活,高架dynamin-related蛋白1 (Drp1) -相关线粒体分裂但压抑FUN14包含1 (FUNDC1)需要的mitophagy域。 过度的裂变和缺陷mitophagy触发mtDNA损伤,线粒体呼吸抑制、mro生产过剩,心磷脂氧化,氧化还原平衡,钙超载和肝线粒体凋亡。 相比之下,DNA-PKcs获救的删除这些表型的改变,减轻肝细胞的敏感性饮酒导致的细胞毒性。 此外,我们还显示,孤儿核受体亚科4组一员1 (NR4A1)上游信号DNA-PKcs激活的基因消融NR4A1改善酒精肝病的进展(ARLD); 这些获得的结果类似于DNA-PKcs基因敲除小鼠。 总的来说,我们的研究结果确定了NR4A1 / DNA-PKcs p53轴作为一种新颖的信号通路负责ARLD发病机理,通过激活线粒体分裂和限制FUNDC1-required Drp1-related mitophagy。 新方法的发现潜在影响ARLD疗法。
介绍
酒精肝病(ARLD)的特点包括线粒体的结构和功能的改变。1在过去的几十年里,小心许多实验室的研究表明,细胞死亡后线粒体功能障碍导致ARLD的发病机制。2最近的研究发现,线粒体动态过程,特别是线粒体分裂和mitophagy,在糖尿病患者的肝脏线粒体内稳态,是至关重要的3.non-ARLD,4和缺血再灌注损伤的条件。5然而,角色的线粒体分裂和mitophagy饮酒导致的线粒体功能异常和肝损伤的研究很少。 发现我们的团队表明,过度的裂变和缺陷mitophagy促进脂肪肝疾病的进展。6,7这些分子信号是否参与ARLD病因,如果是这样,监管机制,链接裂变和mitophagy ARLD在很大程度上仍难以捉摸。
线粒体分裂主要是由dynamin-related蛋白1 (Drp1),位于胞质,把在裂变线粒体外膜。8上游转录激活Drp1 p53,已发现绑定到Drp1促进剂,促进Drp1转录。9考虑到建立ARLD p53的有害作用,10我们探讨p53是否涉及Drp1-related ARLD裂变。 已发现三个受体与mitophagy: FUN14域包含1 (FUNDC1)、BCL2相互作用蛋白3 (Bnip3),帕金。11,12许多研究已经描述了Bnip3的关键功能和帕金肝脏保护糖尿病和non-ARLD条件。13,14另外,根据我们以往的研究,不同的受体,调解mitophagy可能影响细胞的命运。15,16,17因此,证实的确切作用FUNDC1-related mitophagy ARLD是必要的。 通过转录后的修改在Ser13 FUNDC1被激活。18,19LC3-interacting地区(LIR)主题FUNDC1被磷酸化酪蛋白激酶2 (CK2)或receptor-interacting蛋白3 (Ripk3),19,20.这与LC3和防止mitophagy激活抑制其交互。 有证据表明p53 CK2激活,21我们旨在确定p53可以灭活FUNDC1 mitophagy CK2。
在正常情况下,细胞使用鼠标两分钟2同族体(MDM2)降解p53阻止p53诱导细胞凋亡。22然而,p53的磷酸化Ser15增加抵抗MDM2-mediated蛋白质降解。 重要的初始信号即p53磷酸化依赖dna的蛋白激酶催化亚基(DNA-PKcs)。23DNA-PKcs和Ku70 / Ku80构成依赖DNA的蛋白激酶(DNA - pk),这是一个核心球员在DNA双链断裂(双边带)修复和基因组的稳定性。24有两种完全不同的后果DNA-PKcs激活。 针对DNA双边带、DNA-PKcs被激活和与Ku80调解DBS修复。25然而,在长期的侮辱的实例,特别是在慢性代谢损害,DNA-PKcs激活p53磷酸化,26促进线粒体损伤诱导的线粒体在肝癌细胞凋亡。27因此,DNA-PKcs / p53通路pro-apoptosis信号。 最后,在喂养和胰岛素信号,DNA-PKcs已被证明转录上调基因在脂肪生成。28此外,DNA-PKcs介导free-fatty-acid-induced在肝细胞脂质积累,这可能导致非酒精性肝病的发病机制。29在目前的研究中,通过DNA-PKcs丧失试验,我们调查的综合作用的病因DNA-PKcs ARLD尤其关注p53激活,Drp1-required裂变,FUNDC1-related mitophagy。
结果
DNA-PKcs被酒精刺激激活,有助于ARLD的发病机制
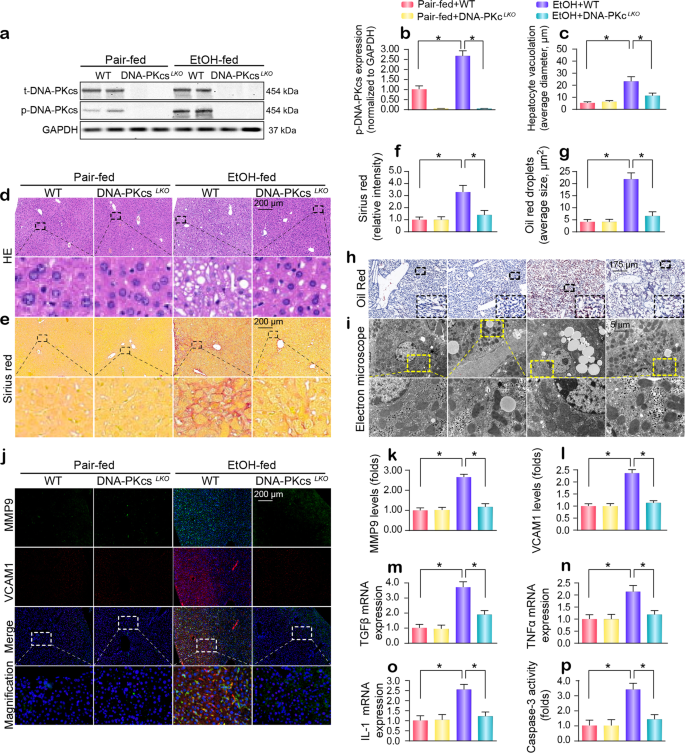
经过16周的酒精摄入量,磷酸化DNA-PKcs (p-DNA-PKcsS2056,一个活跃的形式的DNA-PKcs)显著调节(图。1 a, b)。 体外,隔离和栽培似乎没有影响DNA-PKcs原发性肝细胞的转录和表达野生型小鼠(WT)(补充图。S1a-c),而酒精治疗显著提升DNA-PKcs磷酸化(补充图。S1d e)。 确定是否活跃DNA-PKcs涉及ARLD的进展,肝脏特异性DNA-PKcs淘汰赛(DNA-PKcsLKO)小鼠有或没有酒精。 如补充表所示S1、慢性饮酒显著增加器官(肝脏和心脏)重量和大小(规范化体重)而不影响身体或肾脏重量。 这些变化被DNA-PKcs删除了。 此外,慢性饮酒引起显著升高血清ALT和AST水平和ALT AST的比率,和这些影响已经被废止DNA-PKcs删除(补充表S1).
WT和DNA-PKcsLKO老鼠被允许免费使用乙醇或控制饮食(n= 6)。一个,b从WT和DNA-PKcs肝脏组织LKO小鼠有或没有酒精使用西方墨点法进行了分析。c,d石蜡包埋的肝脏部分被苏木精和伊红染色。e,f肝纤维化是由天狼星红染色检测。g,h冷冻肝脏部分受到油红O染色。我肝细胞超微结构的变化,特别是线粒体,酒精治疗的反应。j- - - - - -l免疫荧光分析MMP9 VCAM1。米- - - - - -oqPCR被用来探索TGFβ变化,TNFα和il - 1的转录。pCaspase-3活动是用来检测肝细胞凋亡。 实验重复三次得到了类似的结果。 的数据代表平均值±标准错误的意思。 *p< 0.05。
从结构上看,观察肝组织无显著变化WT老鼠和DNA-PKcs之间LKO老鼠在正常情况下(图。1 c, d)。 有趣的是,慢性饮酒后,WT老鼠发展严重ARLD,见证了肝细胞空泡形成(图1 c, d)、纤维化(无花果。1 e, f)和脂肪变性(无花果。1 g h)。 超微结构,alcohol-treated老鼠,更多的脂质滴观察,肝细胞胞浆内线粒体短/轮(无花果。1我)。 引人注目的是,这些缺陷在DNA-PKcs完全缺席LKO老鼠。
通过免疫荧光,我们发现MMP-9的水平和VCAM1在alcohol-treated调节小鼠相比WT老鼠(无花果。1 j-l)。 同样,TGFβ的转录,TNFα和摘要意思也增加alcohol-treated老鼠的肝脏(无花果。1 m-o)。 然而,失去DNA-PKcs撤换掉这些表型变化。 在原发性肝细胞,酒精的侮辱,酒精还增加了炎症和纤维化的转录标记如单核细胞趋化蛋白1 (MCP1)、巨噬细胞炎性蛋白- 1α(MIP1α)和白介素8 (IL8) DNA-PKcs-dependent方式(补充图。S1f-h)。 此外,肝细胞生存能力也降低酒精压力,就是明证caspase-3活动增加体内(无花果。1便士)和体外(补充图。S1i)。 然而,失去DNA-PKcs阻止caspase-3激活的酒精压力。
DNA-PKcs缺陷消除饮酒导致的肝细胞死亡
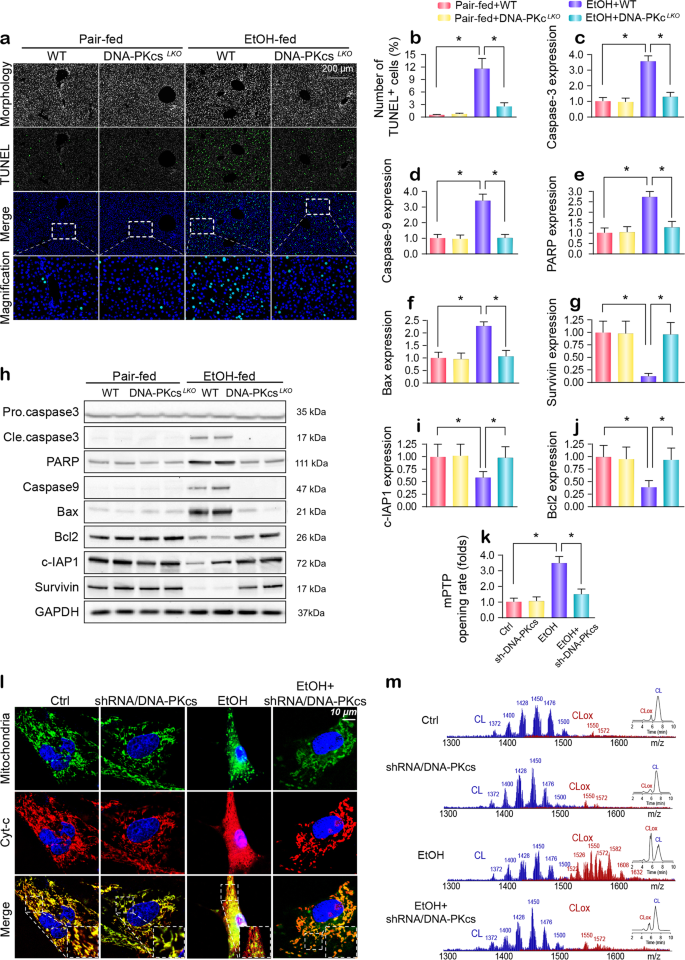
演示的有害影响DNA-PKcs肝损伤,我们专注于细胞死亡,这是一个负责ARLD发展的主要因素。 慢性酒精刺激增强TUNEL-positive比率在肝脏,这改变基因消融获救的DNA-PKcs(无花果。2 a, b)。 接下来,免疫印迹分析表明,线粒体apoptosis-related蛋白质被酒精抑制了压力和激活DNA-PKcs删除(图。2 c-j)。 类似的变化也在原发性肝细胞体外观察(补充图。S2a-e)。 注射Cyt-c释放和mPTP药物开放是线粒体死亡的特征。 原发性肝细胞、酒精注射治疗介导mPTP药物打开(图。2 k从线粒体)和提升cyt-c泄漏到细胞质中,甚至到原子核(无花果。2 l); 这些影响被否定DNA-PKcs删除。 这一发现进一步验证了体内免疫印迹(补充图。S2f-h)。 在健康的肝细胞,cyt-c优先绑定到由协会内线粒体膜和阴离子磷脂双磷脂酰甘油(CL),30.,31和cyt-c可逆解放在CL的过氧化反应。32使用二维高性能薄层色谱法,我们执行一个全球lipidomics CL(图的分析。2米),它演示了~ 185种单个分子的CL在正常肝脏线粒体(补充图。2我),其中只含氧~ 10。 值得注意的是,酒精诱导的氧化大多数多不饱和分子种类的CL和nonoxidized CL物种的数量下降到~ 94,而含氧物种的数量增加到154 ~(补充图。S2i)。 然而,DNA-PKcs沉默降低(图的水平。2米)和数量(补充图。S2i氧化氯的)。
一个,bTUNEL分析是用于检测体内细胞凋亡。c-j肝脏的组织溶解产物WT DNA-PKcsLKO未经处理或alcohol-treated老鼠用免疫印迹分析确定线粒体凋亡蛋白的表达。k注射任意mPTP药物开放时间被确定为初始的时候TMRE荧光强度下降了一半而剩余TMRE荧光强度。lcyt-c免疫荧光是用来检测在肝细胞的细胞定位。 线粒体与Tom20标记。 细胞核被DAPI标记。米评估的分子种类的CL及其氧化产品。 左侧面板显示nonoxidized CL物种(蓝色)和众多的出现氧化氯物种(红色)酒精后攻击。 正确的插入:二维色谱分离nonoxidized和氧化CL (CLox)。 酒精广泛CL氧化引起的。 实验重复三次得到了类似的结果。 的数据代表平均值±标准错误的意思。 *p <0.05。
删除DNA-PKcs保护对酒精肝线粒体损伤
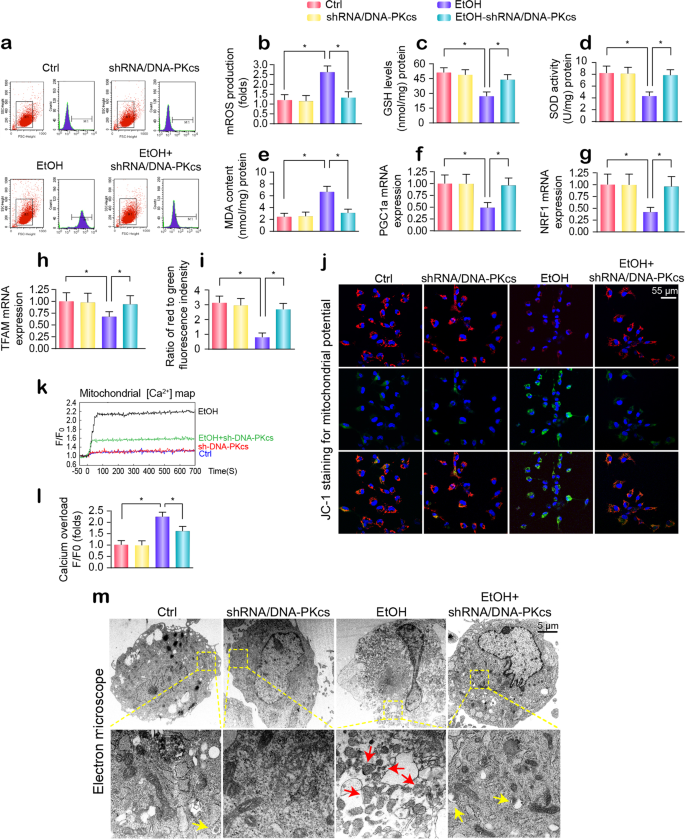
鉴于氯氧化在很大程度上是来源于mro生产过剩,我们测量的mro的变化内容。 流式细胞术显示,酒精高架的mro代原发性肝细胞(图。3 a, b),因此这是紧随其后的是谷胱甘肽的水平下降/ SOD和MDA的产量的增加(图3汉英)。 DNA-PKcs缺乏恢复了氧化还原平衡(图。3 a e)。 除了线粒体氧化应激、线粒体生物起源就是明证PGC1a, NRF1, TFAM转录,明显被酒精压力和逆转DNA-PKcs删除(图基本正常。3 f-h)。 此外,线粒体膜电位(ΔΨm)减少酒精治疗和在肝细胞(图由DNA-PKcs沉默。3 i, j)。 除了失去质子化学梯度,酒精也诱导线粒体钙浓度的海拔([Ca2 +米)(图。3 k, l),这种效应抑制了DNA-PKcs删除。 这一发现表明,alcohol-mediated可以改善线粒体功能障碍DNA-PKcs删除。 结构、酒精导致了无数回合的线粒体大小不一的碎片的形成(图中红色箭头。3米),通过电子显微镜评估。 然而,DNA-PKcs-depleted细胞保留达到reticulotubular线粒体形态。 值得注意的是,DNA-PKcs不足也导致更多的线粒体被溶酶体吞噬,表明mitophagy激活诱导了DNA-PKcs删除(黄色箭头在无花果。3米).
一个,b线粒体活性氧的内容。 图表表明定量流式细胞术的结果。c- - - - - -e谷胱甘肽的变化、SOD和MDA水平,由ELISA。f- - - - - -hmRNA分析PGC-1a、NRF1 TFAM在肝细胞转染shRNA / DNA-PKcs乙醇的存在刺激。我,j分析了膜电位JC1染色。k,l(Ca2 +)m地图,由使用Rhod-2共焦显微镜。 Rhod-2的荧光强度是衡量一个激发波长的发射波长550 nm和570 nm。 数据(F / F0)得到荧光强度除以(F)的荧光强度在休息级别(F0) (t= 0)和对照组规范化。米代表电子显微镜(EM)线粒体形态变化的图像。 红色箭头:分散或圆的线粒体。 黄色箭头:包含在溶酶体,线粒体的mitophagy的说明。 实验重复三次得到了类似的结果。 的数据代表平均值±标准错误的意思。 *p< 0.05。
DNA-PKcs加剧Drp1-required线粒体分裂
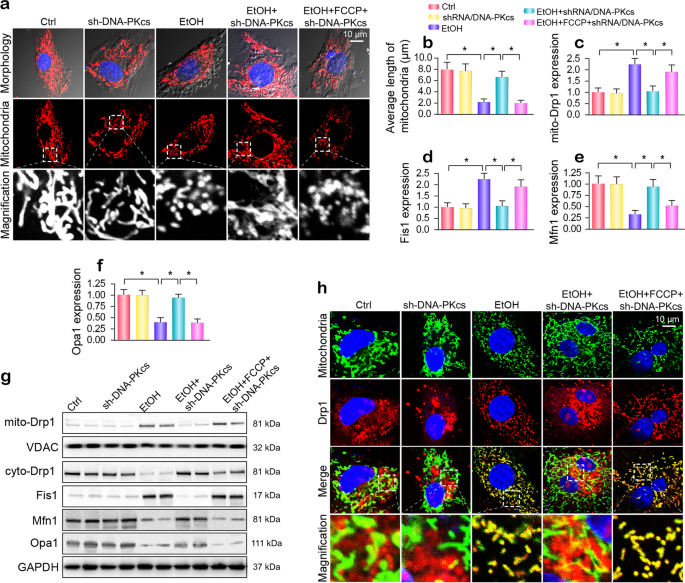
因为更多的线粒体碎片观察酒精治疗下,我们检查是否酒精诱导线粒体分裂。 如无花果所示。4,酒精暴露产生较小、圆润和支离破碎的线粒体,线粒体长度较短的意思(1.92±0.86μm)相比的线粒体在对照组(无花果。4 b)。 然而,失去DNA-PKcs保留线粒体网络形态和线粒体的长度增加到7.89±1.93μm。 这个观察进一步由体外免疫印迹。 如无花果所示。4 c g,酒精增加了线粒体的表达式位于Drp1 (mito-Drp1),这是伴随着细胞质Drp1显著下降。 此外,明显下降,线粒体融合蛋白如Mfn1和Opa1也指出后慢性酒精暴露(无花果。4 c g)。 确定线粒体分裂由DNA-PKcs调制,FCCP,线粒体分裂的一个催化剂,添加到DNA-PKcs-depleted细胞。 如无花果所示。4 g,DNA-PKcs deficiency-mediated裂变后被取消的抑制与FCCP补充。 这一发现表明,线粒体分裂是由酒精压力由于DNA-PKcs激活。激活 类似的结果也观察到体内(补充图。S3a-e).
Coimmunofluorescence用于进一步分析监管DNA-PKcs对Drp1-related线粒体分裂的影响。 线粒体贴上Drp1展出大量的免费碎片alcohol-exposed组比对照组(无花果。4 h)。 然而,在DNA-PKcs-silenced原发性肝细胞,线粒体的Drp1水平明显下降,并维持线粒体正常形态用更少的片段(图。4 h)。 然而,通过FCCP裂变的激活线粒体碎片重新贴上Drp1 DNA-PKcs-deleted细胞。
解释裂变对线粒体功能的后果,我们评估mtDNA稳定和CL氧化。 线粒体基因组的稳定性是反映在mtDNA拷贝数和转录。 酒精压抑mtDNA拷贝数和转录(补充图。S4a-c),这种效应被DNA-PKcs击倒逆转通过抑制线粒体分裂。 此外,通过NAO nonoxidized CL染色,我们发现alcohol-mediated CL氧化抑制了DNA-PKcs删除; 这种效应被否定FCCP治疗(补充图。S4d-e)。 ,上面的数据证实,DNA-PKcs缺乏维持线粒体功能通过抑制线粒体分裂。
基因抑制DNA-PKcs逆转FUNDC1-related mitophagy
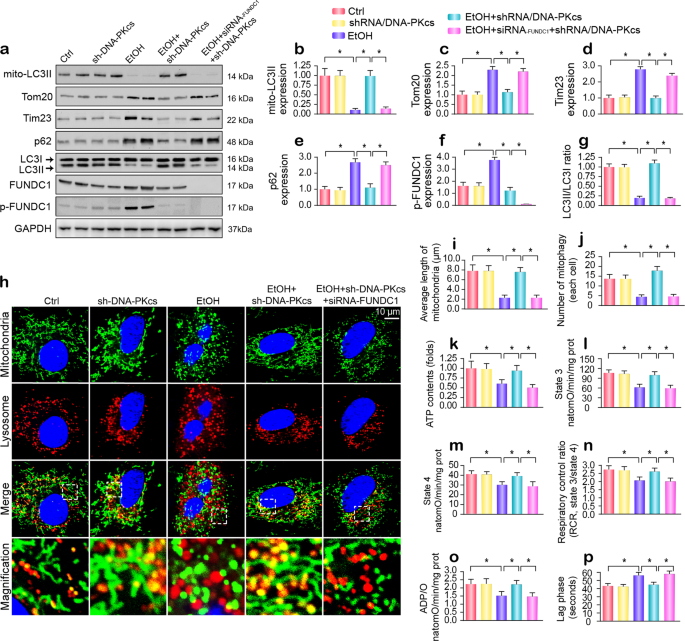
针对线粒体损伤,mitophagy可以删除线粒体功能失调,确保线粒体内稳态。6,33然而,酒精暴露压抑mitophagy活动,通过减少线粒体LC3II (mito-LC3II),减少LC3II / LC3I比率,增加p62(无花果。5 g)。 此外,由于mitophagy抑制线粒体质量,正如由线粒体内膜标记Tim-23和外膜蛋白Tom-20,显著升高。 然而,失去DNA-PKcs逆转mitophagy酒精压力下活动。 我们先前的研究显示,FUNDC1是一种新型受体负责mitophagy激活通过其在Ser13脱磷酸作用。34,35然而,酒精明显增强FUNDC1磷酸化失活(无花果。5 g); 这种变化被DNA-PKcs删除逆转。 类似的结果也观察到体内(补充图。S5a-g)。 此外,其他mitophagy-related分子,如PINK1帕金,也下调了酒精治疗和扭转的基本正常,以应对DNA-PKcs删除(补充图。S5a-g)。 证明是否需要FUNDC1 DNA-PKcs-regulated mitophagy, siRNA反对FUNDC1体外。 如无花果所示。5 g、失去FUNDC1废除DNA-PKcs deficiency-mediated mitophagy激活。
一个- - - - - -g免疫印迹分析mitophagy标记。 FUNDC1 siRNA用于击倒FUNDC1的表达。h- - - - - -jCostaining线粒体和溶酶体。 贴上Tom-20线粒体,溶酶体是通过LAMP1标记。 器官免疫荧光的特征是线粒体和溶酶体之间的相互作用,表明mitophagy。 FUNDC1 siRNA用于击倒FUNDC1的表达。 线粒体的长度是评估来反映线粒体分裂。k在原发性肝细胞ATP生产DNA-PKcs删除或FUNDC1击倒在酒精治疗。l- - - - - -pmitophagy对状态3的影响呼吸,状态4呼吸、呼吸控制比(RCR[3 /状态4]),ADP磷酸化的nmol原子氧消耗(ADP / O)和ADP磷酸化停滞阶段(去极化和复极化周期的时间在ADP磷酸化)。 实验重复三次得到了类似的结果。 的数据代表平均值±标准错误的意思。 *p< 0.05。
监管DNA-PKcs对mitophagy的影响进一步研究通过coimmunofluorescence使用线粒体和溶酶体抗体。 酒精治疗后,大部分分散无法被溶酶体,线粒体的零星colocalization证明了线粒体和溶酶体(无花果。5 h-j)。 然而,DNA-PKcs删除导致线粒体和溶酶体的融合,从而维持线粒体网络机械,如线粒体的长的长度(图所示。5 h-j)。 小干扰rna转染,不幸的是,一旦FUNDC1沉默通过DNA-PKcs deficiency-induced mitophagy是灭活的,结果是伴随着增加线粒体碎片的数量(无花果。5 h-j).
此外,缺陷mitophagy是ATP(图的供给不足密切相关。5 k),它也伴随着减少国家3/4呼吸速率(图。5 l, m),ADP磷酸化(呼吸控制比例)(图5 n)、ATP合成的效率(ADP / O)(无花果。5啊),ADP磷酸化停滞阶段(去极化和复极化周期的时间在ADP磷酸化)(图5便士),这表明所起的保护作用FUNDC1 mitophagy在维持肝细胞线粒体能量代谢。
DNA-PKcs调节Drp1通过p53表达和FUNDC1磷酸化
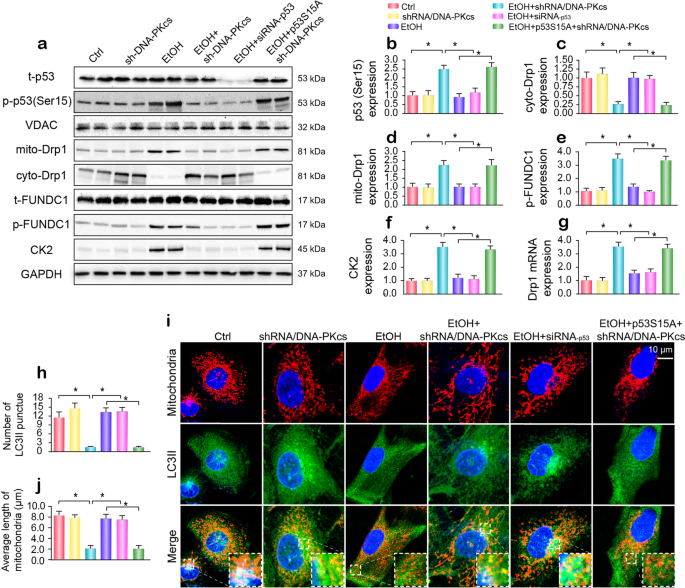
解释如何DNA-PKcs控制裂变和mitophagy,我们首先关注的是p53, Drp1的主要转录启动子。 如无花果所示。6 f,酒精的磷酸化增强Ser15 p53,这影响是否定DNA-PKcs不足和/或小干扰rna转染p53。 确定是否参与磷酸化p53 DNA-PKcs-mediated Drp1-related线粒体裂变,p53功能分析是通过p53突变质粒的转染。 p53的p53突变是一个既定的活动形式(p53S15A) Ser15被替换为天冬氨酸(永久的磷酸化这个网站)。 与p53S15A转染后,磷酸化p53 reupregulated(无花果。6 f),这种效果是伴随着Drp1转录增加(无花果。6克)和线粒体易位(无花果。6 a, d)。 的降价对FUNDC1-related mitophagy p53压抑alcohol-mediated p-FUNDC1 upregulation(无花果。6 f),后观察类似DNA-PKcs的损失。 然而,DNA-PKcs deficiency-inhibited FUNDC1磷酸化被p53S15A转染(图无效。6 a, e)。 我们以前的研究表明,酪蛋白激酶2 (CK2)直接与FUNDC1 Ser13随后引发其磷酸化。19在目前的研究中,CK2被酒精p53-dependent的方式调节(无花果。6 f)。 ,上面的数据显示,DNA-PKcs调节Drp1转录并通过p53 FUNDC1磷酸化。
一个- - - - - -f原发性肝细胞和小干扰rna和p53突变p53S15A转染。 突变p53S15A Ser15网站的替换为天冬氨酸(永久的磷酸化这个网站)。 西方墨点法用于分析Drp1易位和FUNDC1磷酸化。gqPCR被用来评估Drp1的转录响应小干扰rna和p53突变p53S15A。h- - - - - -j对线粒体和LC3II免疫荧光。 小干扰rna或p53突变p53S15A转染到肝细胞在酒精的刺激。 盒装的面积扩大每个显微照片显示重叠LC3II puncta和线粒体。 的数量LC3II puncta和线粒体的长度测量。 实验重复三次得到了类似的结果。 的数据代表平均值±标准错误的意思。 *p< 0.05。
进一步解释是否参与裂变和mitophagy p53,使用Tom-20和LC3II执行免疫荧光抗体。 如无花果所示。6 h-j,酒精引起的线粒体碎片,随后下降LC3II puncta线粒体。 然而,p53击倒和/或DNA-PKcs删除增强colocalization线粒体碎片和LC3II puncta,这是伴随着线粒体长度的增加(图。6 h-j)。 然而,p53S15A转染受损的线粒体和溶酶体之间的通信,导致线粒体碎片DNA-PKcs-depleted细胞的形成。
DNA-PKcs / p53通路由NR4A1监管
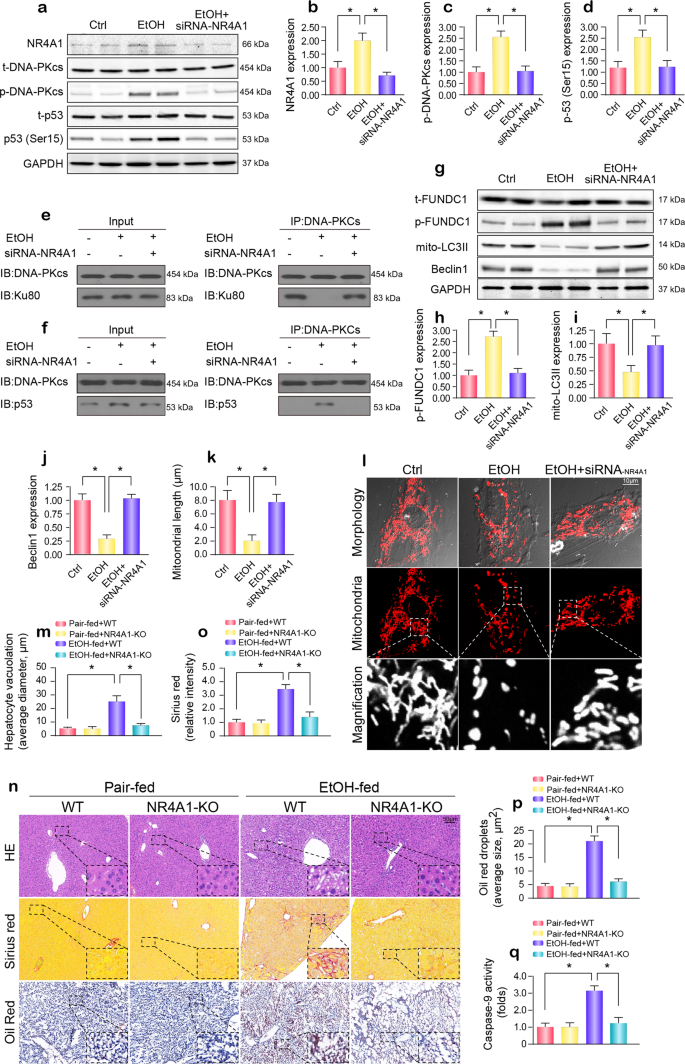
在正常情况下,DNA-PKcs主要与Ku80很大程度上有助于修复DNA损伤因素的招聘。 然而,在长期破坏的实例,DNA-PKcs由孤儿核受体磷酸化亚科4组一员1 (NR4A1),从而导致从Ku80 DNA-PKcs的离解。23,27随后,DNA-PKcs优先结合并激活p53。 在我们的研究中,NR4A1表达增加,以应对酒精治疗(图。7模拟)。 NR4A1镇压p-DNA-PKcs的水平和p-p53 (Ser15)(图。7模拟)。 此外,通过co-IP,我们发现DNA-PKcs主要与Ku80在正常情况下。 然而,在暴露于酒精压力,更多的p53 DNA-PKcs推倒了,而小Ku80 DNA-PKcs互动。 有趣的是,沉默NR4A1逆转DNA-PKcs Ku80和减少之间的联系之间的交联DNA-PKcs和p53的酒精(图。7 e, f)。 这些结果表明,识别的DNA-PKcs p53 NR4A1-dependent。 此外,NR4A1沉默也逆转mitophagy活动在酒精的存在压力,西方墨点法(图就证明了这一点。7 g-j)。 饮酒导致的线粒体分裂也抑制了NR4A1沉默,作为评估免疫荧光(图7 k, l).
一个- - - - - -d从肝细胞蛋白质得到,NR4A1 siRNA被用来抑制NR4A1表达式。 p-DNA-PKcs的表达,p53和NR4A1测量。eCo-IP被用来检测DNA-PKcs和Ku80之间的交互。f蛋白质之间的相互作用DNA-PKcs和p53。g- - - - - -jmitophagy标记的表达磷酸化FUNDC1, mito-LC3II和Beclin1 NR4A1击倒被西方墨点法测量。k,l观察线粒体裂变,线粒体长度测量。米- - - - - -p石蜡包埋的肝脏部分被苏木精和伊红染色。 肝纤维化是由天狼星红染色检测。 冷冻肝脏部分受到油红O染色。问Caspase-9活动应用于研究细胞损伤。 实验重复三次得到了类似的结果。 的数据代表平均值±标准错误的意思。 *p< 0.05。
最后,阐明NR4A1在ARLD, NR4A1淘汰赛(NR4A1-KO)小鼠暴露于酒精摄入16周。 相比alcohol-treated WT老鼠,老鼠的基因消融NR4A1表现出衰减的肝细胞空泡形成(图7 m, n)、纤维化(无花果。7 n, o)、脂肪变性(无花果。7 n, p),caspase-9-related线粒体凋亡(无花果。7问)引起的酒精治疗。
讨论
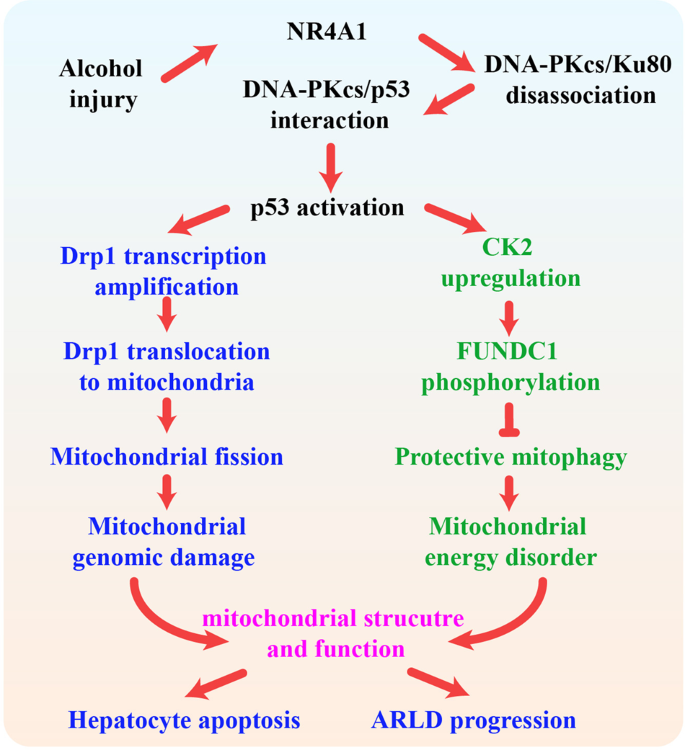
充分的证据表明,DNA-PKcs参与肝细胞癌的发展。36,37然而,很少有人知道DNA-PKcs在ARLD的发展的作用。 在目前的研究中,我们发现,(1)DNA-PKcs显著调节ARLD发展的; (2)DNA-PKcs表达呈正相关,肝损伤和肝细胞凋亡; (3)DNA-PKcs诱导肝线粒体功能障碍通过激活线粒体分裂和抑制mitophagy; (4)p53被DNA-PKcs磷酸化,导致Drp1转录激活,导致过度线粒体分裂; (5)p53也调节CK2表达和诱导FUNDC1磷酸化在Ser13失活,导致mitophagy抑制; (6)NR4A1是DNA-PKcs的上游信号激活p53 upregulation; (7)NR4A1阻塞之间的交互DNA-PKcs p53和Ku80但提升DNA-PKcs绑定; 和(8)的基因消融NR4A1改善的进展和发展ARLD扭转mitophagy和抑制裂变(图。8)。 我们所知,这是第一个研究来描述机制DNA-PKcs肝细胞死亡的作用,线粒体功能障碍,Drp1-required线粒体裂变,FUNDC1-related mitophagy ARLD。
本研究的关键发现是,DNA-PKcs调节线粒体内稳态的能力。 越来越多的数据显示线粒体损伤的有害作用ARLD的发展。38酒精中毒患者的早期观察包括线粒体肿胀的存在肝细胞线粒体DNA断裂,氧化磷酸化崩溃,ROS生产过剩。39,40这些结论与我们的结果。 此外,我们表明线粒体分裂和mitophagy负责线粒体功能障碍。 DNA-PKcs激活线粒体分裂和压抑的保护性mitophagy,从而导致mtDNA损伤,线粒体呼吸抑制、mro生产过剩,心磷脂氧化、膜电位崩溃,pro-apoptotic cyt-c渗漏、和线粒体凋亡激活。 尽管许多研究已经检查的作用线粒体动力学和mitophagy在非酒精性脂肪肝,肝移植再灌注损伤,肝细胞癌,6,41,42角色的裂变和mitophagy饮酒导致的线粒体功能和肝损伤已经很少了。 我们的发现可能有助于填补差距在当前知识分子之间的联系对于裂变,mitophagy,线粒体功能障碍,ARLD。
我们决定,p53是核裂变和mitophagy的监管机构。 DNA-PKcs和磷酸化激活p53,增强Drp1转录,线粒体分裂的一个关键因素。 此外,p53还提拔CK2表达式,它开FUNDC1-phosphorylated失活。 因此,我们确认的监管影响DNA-PKcs / p53通路Drp1-required裂变和FUNDC1-related mitophagy ARLD的设置。 裂变的影响诱导细胞损伤在不同肝脏疾病已经好了。43,44然而,FUNDC1的角色在ARLD mitophagy尚未全面调查。 基于我们的研究结果,激活FUNDC1 mitophagy减毒alcohol-mediated线粒体损伤和肝细胞死亡。 这一发现是类似于我们之前的研究显示,FUNDC1 mitophagy有利于心肌细胞线粒体压力衰减设置生存的心脏缺血再灌注损伤。34,35此外,最近的一项研究表明,激活FUNDC1-dependent mitophagy减轻化学致癌物diethylnitrosamine-induced hepatocarcinogenesis打断inflammasome激活。45此外,FUNDC1 mitophagy也指导骨骼muscle-adipose相声减轻饮食肥胖。46因此,我们的实验提供证据支持FUNDC1 ARLD-induced肝损害的保护作用。 这些发现可能强调的可能性FUNDC1 mitophagy作为内生后卫线粒体完整性和肝细胞的体内平衡常数酒精暴露。
DNA-PKcs起着至关重要的作用在维持基因组的完整性。 在生理条件下,DNA-PKcs优先结合Ku8025和启动dna修复系统来维持基因组内稳态和细胞生存。47,48然而,长期的压力或不可逆转的损害后,DNA-PKcs选择性双和强烈激活p53,从而启动程序性死亡信号在线粒体。 因此,平衡DNA-PKcs / Ku80和DNA-PKcs / p53是细胞命运的主要决定因素。 在目前的研究中,我们的观察表明,增加NR4A1是一个关键因素,推动DNA-PKcs / p53轴而不是DNA-PKcs Ku80通路,这表明NR4A1诱发从DNA修复信号转移到细胞自杀机械ARLD的上下文中。 尽管NR4A1与脂肪肝的发病机制有关7肝炎,49这是第一个发现证据所施加的致病作用NR4A1在ARLD,它可能提供一种新颖的见解ARLD治疗。
我们目前的研究中存在一些局限性。 首先,也许最重要的是,还需要附加的实验用人类样本进一步验证我们的发现。 第二,它仍然未知是否DNA-PKcs调节其他mitophagy ARLD受体,如Bnip3和拒绝。 总的来说,我们的报告的结果确定的致病作用在线粒体功能障碍对ARLD DNA-PKcs。 从力学上看,DNA-PKcs受NR4A1和选择性地激活p53,从而启动Drp1-required线粒体分裂和破坏FUNDC1-related mitophagy,导致肝细胞死亡和ARLD发展。
材料和方法
动物模型和肝细胞隔离
本研究根据指南进行的护理和使用实验动物,由美国国家卫生研究院出版(NIH出版85号- 23,1996年修订)和怀俄明大学的机构的指导方针动物使用和保健委员会(拉勒米,王寅)。 NR4A1淘汰赛(NR4A1-KO)小鼠获得杰克逊实验室。 专门DNA-PKcs在肝脏,DNA-PKcsfl / fl老鼠穿过铝青铜Cre +小鼠获得肝脏特异性DNA-PKcs淘汰赛(DNA-PKcsLKO老鼠)。 DNA-PKcs的生成fl / fl老鼠在我们之前的研究报道。7这些老鼠(三个月大,女)随机分为ethanol-fed pair-fed组然后适应连续16周控制液体的食物,根据我们的先前的研究。15ethanol-fed组被允许自由进入一个ethanol-containing饮食,特别是(卷/卷)等热量的4% ~ 24%酒精饮食总热量来自乙醇。 美联储pair-fed组常规液体饮食没有酒精。
肝细胞隔离都使用了肝细胞隔离系统(美国新泽西州卫氏生化公司,莱克伍德)如前所述。6,7总之,一个松散的1/2)或同等结系在静脉。 腔静脉位于前,打开排水门静脉。 灌注泵包含平原CMF-HBSS打开一个调整到10 - 15毫升/分钟的流量。 油管插入到门静脉向肝。 CMF-HBSS灌注7 - 10分钟后,灌注的解决方案是将酶缓冲溶液。 肝脏灌注了消化混合物,直到它完全膨胀,和肝脏完全消化大约20 - 30分钟。 最后灌注,泵停止,肝脏是轻轻放在一个培养皿,和未消化的组织了。 随后,可行的肝细胞被Percoll梯度离心浓缩。 在细胞的研究中,主要从WT小鼠肝细胞分离乙醇处理48 h 100毫米的浓度根据我们先前的研究。15
线粒体分裂和mitophagy检测
采用免疫荧光观察线粒体分裂和mitophagy使用mitochondria-specific Tom-20抗体,lysosome-specific LAMP1抗体,LC3II抗体在激光扫描共焦显微镜(日本尼康A1R)。 蛋白质免疫印迹分析mitophagy-related也被用来量化mitophagy活动根据我们的先前的研究。34其他材料和方法的细节,包括组织病理学分析、免疫组织化学、免疫荧光,电子显微镜,qPCR,免疫印迹,coimmunoprecipitation,细胞凋亡,氧化损伤,ATP生产、mPTP开口,线粒体膜电位(ΔΨm)和mtDNA复制/转录检测、高性能薄层色谱分析心磷脂,线粒体呼吸功能评估、线粒体钙([Ca2 +米)检测,RNA沉默中描述补充材料。
统计分析
在这项研究中所有数据表示为均值±SEM至少有三个独立的实验。 统计分析的差异是由单向方差分析(方差分析)或学生的t使用SPSS 17.0软件进行测试。 一个P值< 0.05被认为是具有统计学意义。
|
|