摘要
增殖蛋白激酶(MAPK)磷酸酶1 (MKP-1)是一个重要的负调节的MAPKs脱去磷酸MAPKs酪氨酸和苏氨酸残基。 MAPK信号通路的失调与阿尔茨海默病(AD)有关。 然而,MKP-1在AD发病机制中的作用仍然是难以捉摸的。 在这里,我们报告MKP-1水平减少患者的脑组织的广告和广告小鼠模型。 MKP-1基因表达的减少似乎转录抑制的结果通过转录因子特异性蛋白1 (Sp1)独联体代理绑定元素MKP-1基因启动子。 Amyloid-β(Aβ)全身Sp1激活减少MKP-1表达式。 然而,upregulation MKP-1抑制Aβ前体蛋白(APP)的表达和β-site APP-cleaving灭活酶1的细胞外signal-regulated激酶1/2 ERK / MAPK信号通路。 此外,upregulation MKP-1 Aβ生产减少,斑块形成和提高海马(LTP)和长期电位化认知缺陷在APP / PS1转基因小鼠。 我们的研究结果表明,MKP-1障碍促进AD的发病机制,而upregulation MKP-1痴呆混乱起神经保护作用减少情况也增多表型。 因此,这项研究表明,MKP-1广告治疗的新分子。
介绍
阿尔茨海默病(AD)是一种与年龄相关的神经退行性疾病导致痴呆和特点是细胞外老年斑,细胞内的神经原纤维缠结和突触异常。 Amyloid-β(Aβ)肽,老年斑的主要成分,生成Aβ前体蛋白(APP)的顺序由β-γ-secretases蛋白水解分裂。1β-Site APP-cleaving酶1 (BACE1)劈开在Asp应用程序1或Glu2网站生成膜结合c端片段(CTF) 99个氨基酸(C99)或89个氨基酸(C89)。3.,4,5C99γ-secretase进一步裂解生产Aβ胞内域和应用。 值得注意的是,除了知道分泌酶,最近的研究已经发现,应用程序可以在一本小说裂解裂解位点称为η-site产生CTF-η,6,7介导的膜结合基质金属蛋白酶MT5-MMP和被称为η-secretase等活动。 然后,CTF-η由α-裂解,β-secretases释放长时间运行和短Aη肽,分别包括Aη-α和Aη-β。6,8先前的研究显示,Aβ放松从突触前神经递质释放的网站在两个主要模型鼠脑神经元和广告。9,10,11Aβ直接与细胞膜相互作用和膜受体发挥其神经毒性效应,然后启动脊柱密度减少,突触,突触可塑性损伤,2,12,13这可能会导致神经元扰动和在广告记忆衰退。
增殖蛋白激酶(MAPKs),丝氨酸/苏氨酸蛋白激酶,在细胞信号转导中发挥关键作用。 在哺乳动物中,MAPKs组成的细胞外signal-regulated激酶1/2 (ERK), P38激酶(P38)和c-Jun n端激酶(物)。14在AD小鼠模型,物信号通路在脊柱认知衰退之前,应对D-JNKI1及其特定抑制剂能够抑制突触收缩和突触后蛋白质损失。15AD患者的大脑中,P38是高度表达。16Aβ-induced P38τ磷酸化激活增加17并促进amyloidogenic处理应用程序。18在成年人的神经系统,需要ERK激活突触可塑性和记忆形成。19,20.然而,应对ERK与神经原纤维缠结形成和早期AD-related蛋白质沉积,导致海马功能障碍和记忆缺陷在AD患者和小鼠模型。21,22,23,24总的来说,这些研究表明,MAPKs广告可能会加速发展。 预防MAPK overactivation可以减少Aβ沉积,τhyperphosphorylation,25神经元细胞凋亡,26和记忆障碍。27MAPKs可能潜在目标为小说和广告的有效疗法。
MAPK磷酸酶1 (MKP-1)抑制MAPK活性,脱去磷酸酪氨酸MAPK和苏氨酸残基。28,29,30.尽管MKP-1广泛表达于啮齿动物的大脑区域,包括海马体,31皮层,32腹侧被盖区,33纹状体、丘脑34其神经功能了解甚少。 最近的研究表明,MKP-1可以作为突触发生的关键调节器。 MKP-1失调可能扰乱神经发育和认知功能。35最近的一项研究表明,MKP-1施加Aβ-induced凋亡的神经保护作用,通过灭活物神经炎症和氧化应激。36然而,MKP-1的确切作用在AD发病机制基本上仍不清楚。
在这项研究中,我们确定MKP-1水平减少患者脑组织的广告和广告的小鼠模型。 减少与Aβ-induced Sp1激活。 此外,我们发现抑制ERK / MAPK信号通路MKP-1-reduced应用和BACE1表达式生成Aβ,导致斑块形成的抑制,改善海马(LTP)和长期电位化记忆衰退在APP / PS1双重转基因小鼠。 我们的工作表明MKP-1潜在广告治疗的神经保护作用。
结果
减少MKP-1表达式在AD患者的大脑和广告的小鼠模型
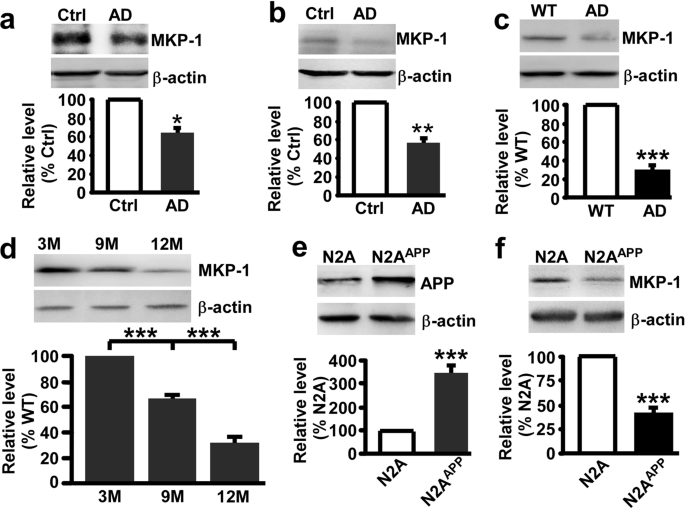
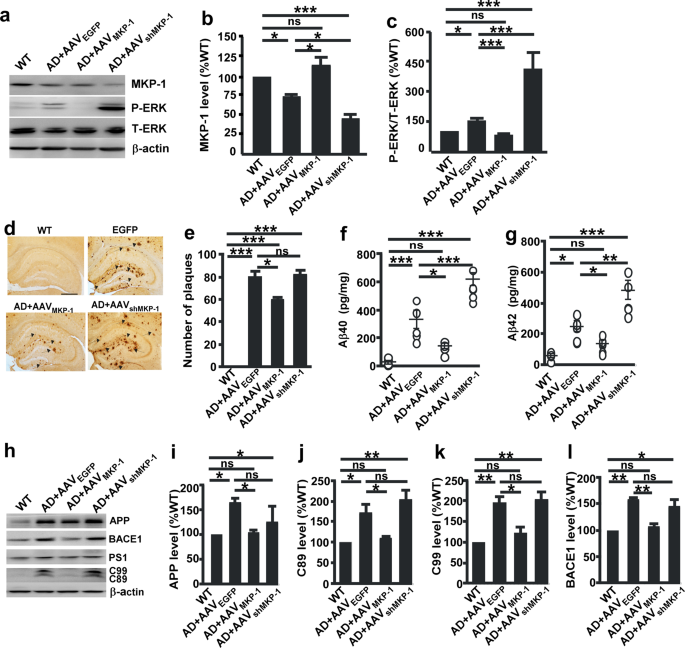
检查是否有MKP-1水平的改变广告,广告和对照组患者的大脑样本进行了分析。 结果表明,MKP-1的表达明显减少在海马体的AD患者(n= 6,64.98±10.77%,p =0.023; 无花果。1)相对于控件(n= 4)。 除了海马体,其他脑区也广告发展中扮演关键的角色。 因此,我们下一个测试MKP-1表达式颞叶皮层的人体组织,发现MKP-1表达也显著降低AD患者(n= 6,55.95±10.94%,p =0.009; 无花果。1 b)相对于控件(n= 4)。 接下来,我们检查MKP-1表达式在APP / PS1广告的双重转基因小鼠模型。 与先前的报道一致,31,32,33,34MKP-1被广泛的形式分布于整个大脑组织的APP / PS1转基因小鼠(补充图。S1)。 类似于广告的发现病人,MKP-1表达显著降低AD小鼠的海马在9个月大(28.46±5.63%,p <0.001; 无花果。1 c与野生型相比同窝出生的。 此外,减少MKP-1广告小鼠发生在年龄相关性的方式(66.79±2.74%至9米和32.31±4.45%在12米相对于3米; 无花果。1 d)。 我们进一步分析了突变体的应用是否会影响的表达MKP-1 N2A细胞中稳定表达人类瑞典突变APP695 (N2A应用程序)。 瑞典突变应用N2A中高度表达应用程序稳定细胞(349.17±34.39%,p< 0.001; 无花果。1 e)与N2A细胞。 符合MKP-1的差别,对这些病人和AD小鼠,MKP-1 N2A表达也显著减少应用程序细胞(40.65±5.98%,p< 0.001; 无花果。1 f)与non-Swedish突变APP-expressing细胞。 这些数据清楚地表明,MKP-1表达减少广告,在AD患者,观察小鼠模型的广告和细胞表达AD-associated基因突变的应用。
MKP-1减少在广告。一个,b的蛋白质水平MKP-1评估免疫印迹在海马体一个和颞叶皮层b控制(Ctrl)和AD患者。 *p <0.05未配对的学生的t测试。n在每组= 4 - 6。c海马体的蛋白质水平的MKP-1野生型(WT)和APP / PS1转基因AD模型小鼠在9个月的年龄。 * * *p <0.001未配对的学生的t测试。n在每组= 6。d的蛋白质水平MKP-1 AD小鼠的海马在不同的年龄。 * * *p <0.001单向方差分析。n在每组= 3。e,f应用的蛋白质含量e和MKP-1f评估免疫印迹N2A和N2A溶解产物应用程序细胞。 * * *p <0.001未配对的学生的t测试。n在每组= 3 - 6。
MKP-1基因表达的差别转录对这些Sp1
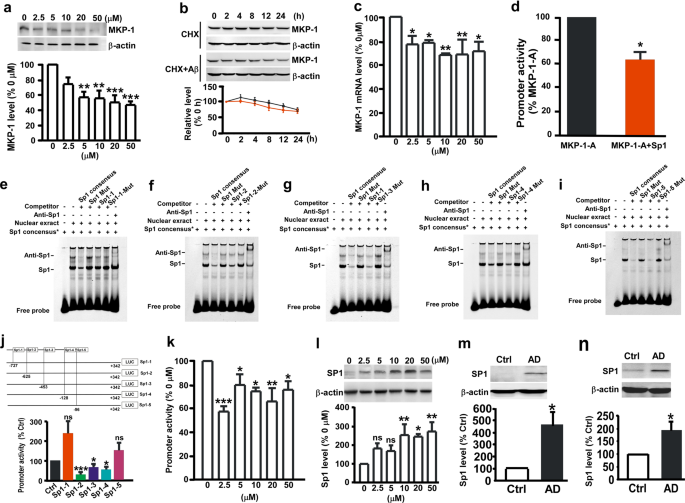
确定MKP-1减少广告是否归因于Aβ,N2A细胞与不同浓度的Aβ治疗。 结果表明,Aβ治疗显著降低MKP-1蛋白质含量以剂量依赖性的方式(74.59±7.72%,报2.5µ米; 在5µ55.87±6.10%米; 在10µ54.95±9.1%米; 在20µ49.21±8.04%米; 并在50µ45.63±5.10%米; 无花果。2)。 确定MKP-1 Aβ-induced减少是由于合成受损或增强的退化,放线菌酮(CHX)进行分析。 CHX被加入到细胞抑制蛋白质合成,和MKP-1蛋白质含量进行了分析。 我们发现10µ米Aβ治疗没有影响MKP-1分解代谢(无花果。2 b)。 然而,Aβ治疗显著降低MKP-1 mRNA水平(图。2摄氏度)。 这些结果表明,Aβ抑制MKP-1基因表达在转录水平但不影响蛋白质的降解。
Sp1抑制MKP-1 N2A表达式应用程序细胞。一个MKP-1的蛋白质水平评估免疫印迹N2A细胞与不同浓度的Aβ治疗后。 * *p< 0.01和* * *p由单向方差分析< 0.001。n在每组= 5。bAβ(10µ的效果米)降解半衰期的MKP-1评估测量N2A细胞治疗100μg /毫升放线菌酮(CHX)。p= 0.352,双向方差分析。n在每组= 5 - 8。cMKP-1的mRNA水平评估qPCR N2A细胞与不同浓度的Aβ治疗后。 *p< 0.05和* *p由单向方差分析< 0.01。n在每组= 6。d启动子荧光素酶测定MKP-1评估活动的N2A细胞与不同浓度的Aβ治疗后。 *p< 0.05,* *p< 0.01和* * *p由单向方差分析< 0.001。n在每组= 5。练习功能性Sp1-binding网站MKP-1基因启动子。 EMSA MKP-1 Sp1探针在核提取HEK 293细胞转染Sp1表达质粒。 巷1只是人类共识Sp1标记探针。 巷2显示了一个转移dna蛋白质标记Sp1和核之间形成复杂的提取物。 竞争分析进行进一步添加不同的寡核苷酸,包括比赛共识野生型Sp1(巷3),突变Sp1(巷4),假定的Sp1-binding站点1 MKP-1和突变Sp1-binding站点1 MKP-1(车道5和6),假定的Sp1-binding站点2 MKP-1和突变Sp1-binding站点2 MKP-1(车道5和6b),假定的Sp1-binding站点3 MKP-1和突变Sp1-binding站点3 MKP-1(车道5和6c),假定的Sp1-binding网站4 MKP-1和突变Sp1-binding网站4 MKP-1(车道5和6d),假定的Sp1-binding站点5 MKP-1和突变Sp1-inding站点5 MKP-1(车道5和6e)。 巷7显示了supershifted乐队anti-Sp1抗体。j,k不同的影响在MKP-1 Sp1-binding网站的推广活动MKP-1所评估的荧光素酶检测。 *p< 0.05,* *p< 0.01和* * *p由单向方差分析< 0.001。n在每组= 4。l不同浓度的效果AβSp1的表达作为评估免疫印迹HEK 293个细胞。 *p< 0.05和* *p由单向方差分析< 0.01。n在每组= 4。米,nSp1的蛋白质水平评估免疫印迹在海马体米和颞叶皮层n控制(Ctrl)和AD患者。 *p <0.05未配对的学生的t测试。n每组= 4到6。
检查MKP-1基因表达的转录调控,人类MKP-1子质粒构建包含不同长度的MKP-1萤火虫荧光素酶报告基因的启动子上游promoter-less向量pGL4.10-basic(补充图。S2a)。 HEK 293细胞与这些质粒转染,进行荧光素酶化验检查启动子活动。37MKP-1-A,包含MKP-1最长的启动子片段−763 bp + 342 bp的转录开始网站+ 1,有健壮的推广活动。 删除534个基点的5’侧翼地区从763−−229导致更高的推广活动,表明有负监管独联体表演元素(s) 763 229−−地区。 120个基点的删除+ 342 + 222的3 '侧翼地区启动子对MKP-1启动子活性几乎没有影响。 没有启动子活动−47 + 342或+ 222地区,但是有很高的启动子活动在该地区从229−−47岁之间,表明该地区229年和−−47包含最小MKP-1启动子的序列(补充图。开通).
使用Genomatix和TFSearch软件分析潜在的监管独联体表演元素MKP-1启动子,几个潜在Sp1-binding网站MKP-1启动子识别。 检查是否Sp1调节转录的激活MKP-1基因启动子,MKP-1启动子质粒MKP-1-A和Sp1表达质粒cotransfected HEK 293个细胞。 与矢量控制转染相比,coexpression Sp1的显著减少MKP-1推广活动(图。二维)。 电泳迁移率改变分析(EMSA)进行,结果表明,有五Sp1-binding网站MKP-1启动子(无花果。2练习)。 检查是否全部或部分结合位点的生理功能调节transactivation MKP-1启动子的突变的网站被废除。 结合位点的突变2、3和4显著降低MKP-1子活动28.49±8.60%,64.17±12.45%,和53.28±13.22%,分别,而结合位点的突变1和5并不影响MKP-1推广活动(图。2 j)。 这些结果说明Sp1负调节MKP-1基因表达的转录激活。
Sp1介导Aβ-induced MKP-1表达的抑制作用
调查是否Aβ-induced减少MKP-1表达式是由其抑制作用的转录激活MKP-1基因,HEK 293细胞转染MKP-1基因启动子质粒MKP-1-A然后Aβ处理。 我们发现Aβ治疗显著降低启动子活性MKP-1 2.5µ(57.40±4.41%米; 在5µ79.89±8.58%米; 在10µ74.32±3.20%米; 在20µ75.97±6.75%米; 并在50µ75.63±3.49%米; 无花果。2 k)。 我们表明,Sp1转录抑制MKP-1基因表达,我们接下来要检查是否Sp1介导的抑制作用AβMKP-1表达式。 结果表明,治疗后与不同浓度的AβSp1 HEK 293个细胞蛋白质含量增加10µ254.93±58.08%米246.35µ±15.20%米和275.11±48.63%,50µ米(无花果。2 l)。 与这个结果一致,Sp1表达显著增加在海马体(457.51±112.89%,p =0.025; 无花果。2米)和颞叶皮层(190.51±33.85%,p =0.033; 无花果。2 n广告的患者(n= 6)相对于控件(n= 4)。 这些数据表明Aβ增加Sp1的表情,会使MKP-1表达式。
MKP-1影响应用处理通过调节应用和BACE1表达式
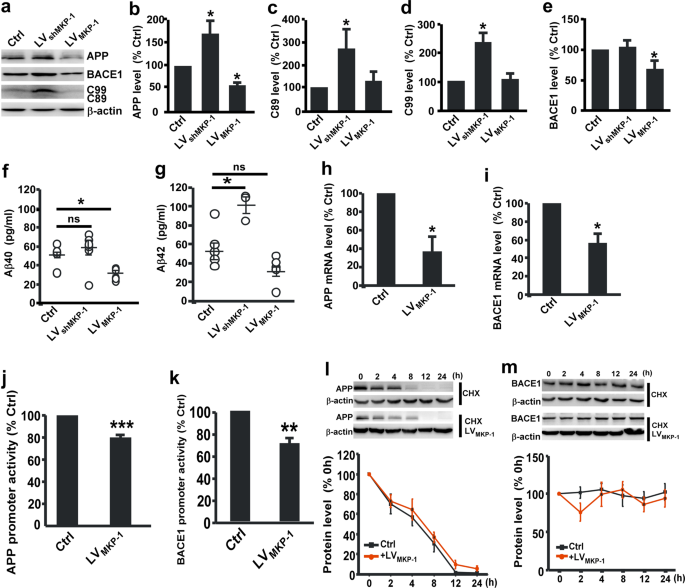
我们的研究表明,MKP-1表达式是减少AD患者的脑组织和老鼠。 进一步探索MKP-1是否会影响应用程序处理和Aβ代N2A应用程序慢病毒感染细胞携带MKP-1基因(LVMKP-1)。 过度的MKP-1大大减少应用57.69±6.47%的水平(p =0.044,无花果。3 a, b68.98±12.34%)和β-secretase BACE1 (p =0.030,无花果。3 a, e)。 Aβ40和Aβ42也大大降低了27.81±2.42 pg / ml(无花果。3 f)和33.18±5.32 pg / ml(无花果。3 g),分别。 MKP-1 MKP-1表达的差别相比之下,对这些成分(LVshMKP-1)显著增加应用的表达171.78±28.19% (p =0.021)及其周大福C89 270.83±83.08% (p =0.023; 无花果。3 a, cC99)和226.48±30.18% (p =0.036; 无花果。3 d)。 Aβ40和Aβ42增加到54.69±7.80 pg / ml(无花果。3 f)和109.7±9.54 pg / ml(无花果。3 g),分别。
MKP-1 N2A减少应用程序处理应用程序细胞。一个- - - - - -e应用的蛋白质含量b,C89cC99,d,BACE1e,评估免疫印迹N2A溶解产物应用程序细胞过度后MKP-1 LVMKP-1或可拆卸的MKP-1 LVshMKP-1。 *p由单向方差分析< 0.05。n每组= 5 - 6。f,gAβ的生成40 f和Aβ42 g以ELISA N2A条件媒体应用程序细胞过度后MKP-1 LVMKP-1或可拆卸的MKP-1 LVshMKP-1。 *p由单向方差分析< 0.05。n每组= 5 - 6。h,我应用程序的mRNA水平h和BACE1我在N2A qPCR评估应用程序细胞在LV之后MKP-1转染。 *p为应用和* = 0.017p= 0.038为BACE1未配对的学生的t测试。n在每组= 3 - 4。j,k应用程序的启动子活动j和BACE1k评估通过荧光素酶测定细胞转染与LVMKP-1。 * * *p< 0.001和* *p= 0.004未配对的学生的t测试。n在每组= 3 - 4。l,米应用程序的退化l和BACE1米评估在LV半衰期测量MKP-1转染N2A应用程序细胞治疗100μg /毫升放线菌酮(CHX)。p为应用程序和= 0.438p =0.483为BACE1双向方差分析。n在每组= 4 - 5。
检查是否MKP-1调节应用和BACE1基因表达,我们首先应用与N2A BACE1 mRNA水平来衡量应用程序细胞。 我们发现,过度的MKP-1 MKP-1慢病毒显著减少应用mRNA(56.68±10.20%的水平p =0.017; 无花果。3 h37.22±15.82%)和BACE1 mRNA (p =0.038; 无花果。3我)。 应用程序的启动子活动和BACE1进一步化验cotransfecting N2A应用程序细胞与人类应用启动子或人类BACE1 promoter-containing质粒和MKP-1慢病毒。 荧光素酶化验表明,MKP-1超表达显著减少应用程序启动子活性pAPP-Luc(79.33±18.45%相对于对照组,p <0.001; 无花果。3 j)和pB1-A-Luc BACE1推广活动(70.95±3.91%相对于对照组,p =0.004; 无花果。3 k)。 检测MKP-1是否会影响应用程序和BACE1蛋白质的降解,CHX试验进行。 我们观察到MKP-1并不影响降解的应用程序(图。3 l)或BACE1(无花果。3米)。 这些结果表明,MKP-1会使应用程序并生成AβBACE1表达和应用程序处理。
MKP-1抑制amyloidogenic过程通过ERK / MAPK信号通路
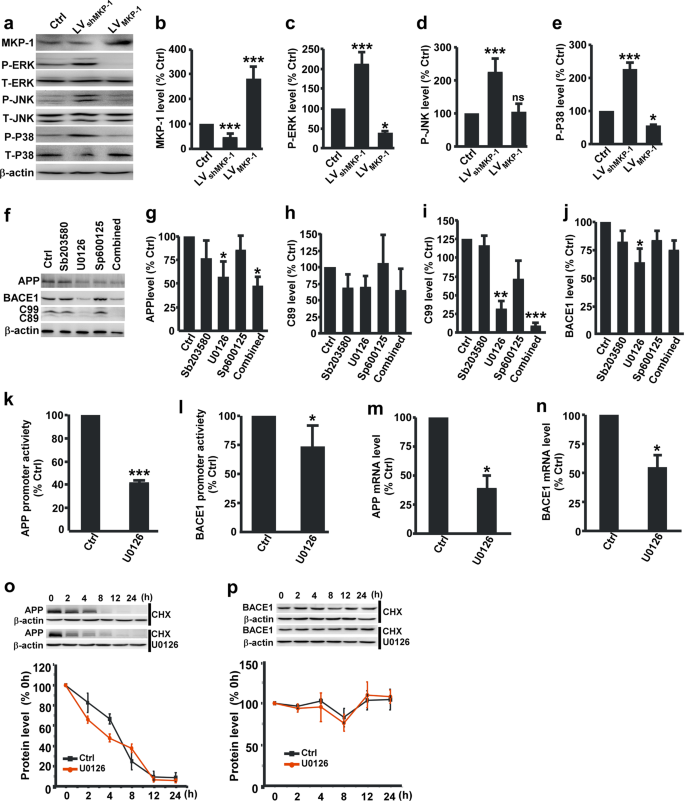
接下来,我们检测到的影响MKP-1 ERK, P38和物。 结果表明,P-ERK, P-P38 P-JNK N2A显著增加应用程序细胞与N2A控制细胞(补充图。S3)。 检查在MAPK MKP-1激活的作用,LVMKP-1或LVshMKP-1转染到N2A应用程序细胞过表达或击倒MKP-1分别。 MKP-1击倒导致P-ERK显著增加(208.82±34.00%相对于对照组,p <0.001),P-JNK (223.46±43.63%,p <0.001)和P-P38(226.65±20.28%相对于对照组,p <(图0.001)。4 a e)。 相反,过度的MKP-1显著降低P-ERK(38.71±3.25%相对于对照组,p =0.035)和P-P38(56.33±3.90%相对于对照组,p =0.024)但不是P-JNK(105.83±25.13%相对于对照组,p =(图0.998)。4 a e)。 此外,治疗一个ERK抑制剂(U0126)但不是物抑制剂(SP600125)或P38抑制剂(SB203580)大大降低应用程序的表达,C89, C99 BACE1(无花果。4 f j)。 此外,U0126的结合应用,SP600125和SB203580一样影响应用程序处理U0126单独治疗(无花果。4 f j),这表明抑制ERK / MAPK信号通路足以抑制amyloidogenic处理应用。此外,U0126明显抑制启动子活动应用到41.28±2.52% (p <0.001; 无花果。4 k67.52±10.83%)和BACE1 (p =0.040; 无花果。4 l)和APP mRNA水平降低到38.06±12.05%相对于控制(p= 0.036; 无花果。4米)和BACE1 mRNA水平降至54.35±10.45% (p =0.032; 无花果。4 n)。 U0126治疗不影响应用程序或BACE1蛋白质降解(无花果。4 o p)。 我们的研究结果清楚地表明,MKP-1抑制应用BACE1基因表达和amyloidogenic处理应用程序通过ERK / MAPK信号通路。
MKP-1抑制应用处理通过ERK / MAPK信号通路的失活。一个- - - - - -e免疫印迹的MKP-1的表达b,P-ERKc,P-JNKd和P-P38e的溶解产物N2A应用程序细胞过度后MKP-1 LVMKP-1或可拆卸的MKP-1 LVshMKP-1。 *p< 0.05和* * *p由单向方差分析< 0.001。n在每组= 4 - 5。f- - - - - -j免疫印迹表达的应用g,C89hC99,我和BACE1j的溶解产物N2A应用程序细胞ERK抑制剂U0126,处理物抑制剂SP600125, P38抑制剂SB203580或三抑制剂(组合)。 *p< 0.05,* *p< 0.01和* * *p由单向方差分析< 0.001。n在每组= 5 - 7。k,l人类应用的mRNA水平k和BACE1l评估qPCR N2A应用程序细胞和N2A应用程序细胞U0126对待。 * * *p< 0.001应用程序和*p= 0.032为BACE1未配对的学生的t测试。n在每组= 3 - 4。米,n应用程序的启动子活动米和BACE1n通过荧光素酶测定N2A评估应用程序细胞和N2A应用程序细胞U0126对待。 *p为应用和* = 0.036p= 0.040为BACE1未配对的学生的t测试。n在每组= 3 - 4。o,p应用程序的退化o和BACE1p评估的半衰期N2A测量应用程序细胞U0126治疗后。p为应用程序和= 0.264p= 0.847为BACE1双向方差分析。n在每组= 4 - 5。
MKP-1减少Aβ生成和斑块形成APP / PS1老鼠
确定MKP-1-mediated ERK / MAPK信号通路的作用在AD发病机制及其治疗的潜力,我们生成一个腺相关病毒携带MKP-1 cDNA (AAVMKP-1)和MKP-1成分(AAVshMKP-1)。 病毒microinjected入侧脑室的APP / PS1老鼠过表达或击倒MKP-1 AD小鼠模型(图。5 a、b)。 在N2A与观测一致应用程序细胞,在AD小鼠P-ERK水平显著增加(155.93±24.54%,p =0.034; 无花果。5 a, c)与WT老鼠。 过度的MKP-1 AAVMKP-1抑制P-ERK广告老鼠(p的差别< 0.001),而对这些由AAV MKP-1表达式shMKP-1P-ERK增加(p <(图0.001)。5 a, c).
MKP-1 Aβ生成和减少老年斑在APP / PS1老鼠。一个- - - - - -c免疫印迹的MKP-1的表达b和P-ERKc野生型(WT)和海马匀浆的APP / PS1转基因AD小鼠超表达的MKP-1 AAV之后MKP-1或MKP-1, AAV击倒shMKP-1。 *p< 0.05,* *p< 0.01和* * *p由单向方差分析< 0.001。n在每组= 4 - 5。d,e老年斑的数量通过免疫组织化学方法检测AD模型小鼠海马的超表达的MKP-1 AAV之后MKP-1或MKP-1, AAV击倒shMKP-1。 *p< 0.05和* * *p由单向方差分析< 0.001。 每组n = 29 - 54。f,g代Aβ40 f和Aβ42 g以ELISA WT和AD模型小鼠的海马匀浆超表达的MKP-1 AAV之后MKP-1或MKP-1, AAV击倒shMKP-1。 *p< 0.05,* *p< 0.01,* * *p由单向方差分析< 0.001。n在每组= 5。h- - - - - -l免疫印迹表达的应用我,C89jC99,k和BACE1lWT和广告后小鼠的海马匀浆超表达的MKP-1 AAVMKP-1或MKP-1, AAV击倒shMKP-1。 *p< 0.05和* *p <0.01单向方差分析。n在每组= 5。
神经炎的斑块的病理标志广告。 我们的结果显示MKP-1应用处理的效果和Aβ代体外和它的底层机制。 体内确认效果,应用处理和Aβ代化验在感染AAV AD转基因小鼠模型MKP-1或AAVshMKP-1。 过度的MKP-1 AAVMKP-1AD小鼠的大脑中减少应用程序(AAV的表达EGFP与AAV: 221.22±57.47%MKP-1:117.09±23.97%,p= 0.037),C89 (AAVEGFP与AAV: 169.42±29.51%MKP-1:106.44±15.11%,p =0.039),C99 (AAVEGFP:195.15±35.38% vs, AAVMKP-1:121.52±33.51%,p= 0.016),BACE1 (AAVEGFP与AAV: 156.70±13.56%MKP-1:105.18±17.36%,p= 0.005)(图5 h l)。 然而,应用的表达,C89, C99 BACE1并没有受到与AAV MKP-1击倒shMKP-1(无花果。5 h l).
过度的MKP-1 AAVMKP-1导致显著减少Aβ的水平40(WT: 21.56±11.44 pg /毫克; 广告+ AAVEGFP:288.67±56.03 pg /毫克; 和广告+ AAVMKP-1:125.30±39.61 pg /毫克)(p =0.025; 无花果。5 f)和Aβ42(WT: 52.70±10.40 pg /毫克; 广告+ AAVEGFP:221.15±34.02 pg /毫克; 和广告+ AAVMKP-1:121.03±22.95 pg /毫克)(p =0.049; 无花果。5克在老鼠的大脑。 相比之下,击倒的MKP-1 AAVshMKP-1增加Aβ的水平40(广告+ AAVshMKP-1:539.84±88.00 pg /毫克)(p <0.001; 无花果。5 f)和Aβ42(广告+ AAVshMKP-1:425.10±53.85 pg /毫克)(p =0.003; 无花果。5克)。 确定MKP-1影响AD-related神经病理学、神经炎的斑块的形成在APP / PS1检查老鼠。 过度的MKP-1 AAVMKP-1显著降低神经炎的斑块的数量(p =0.028; 无花果。5 d, e)。 由AAV MKP-1的差别但是,对这些基因的表达shMKP-1没有影响斑块的形成。 总的来说,这些数据表明,过度的MKP-1抑制Aβ生成和神经炎的斑块形成广告转基因老鼠。
MKP-1减轻突触和认知障碍在APP / PS1老鼠
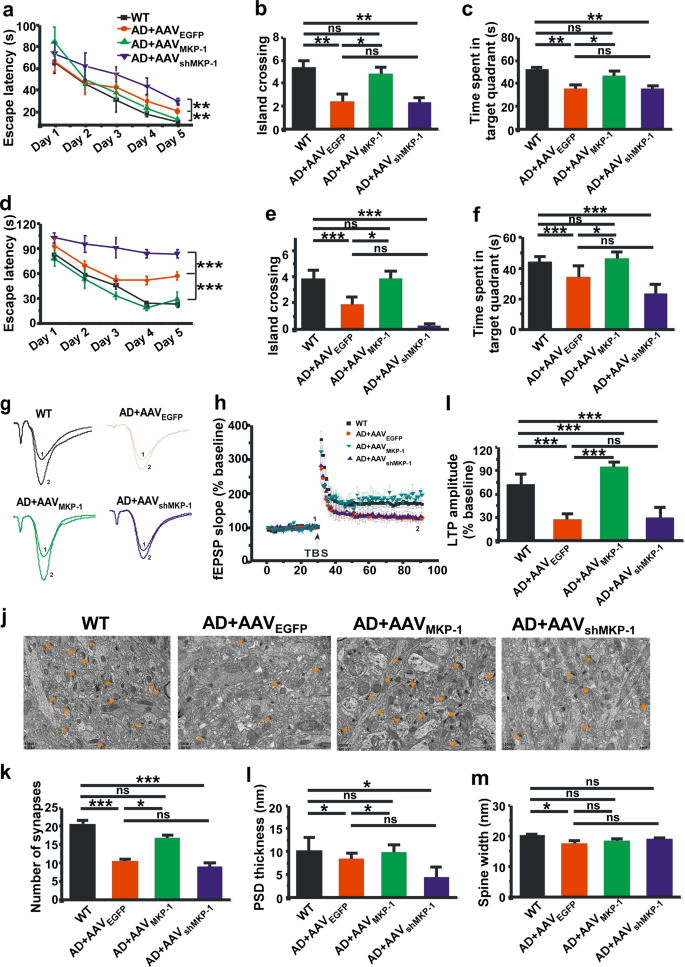
我们的研究表明,超表达广告MKP-1可以改善神经病理学的老鼠。 我们接下来想检测MKP-1能否改善认知障碍。 APP / PS1老鼠对待AAVMKP-1或AAVshMKP-13和6个月的年龄和接受莫里斯水迷宫测试在9个月的年龄。 与WT老鼠相比,转基因小鼠治疗控制AAV显示明显受损的空间学习不再逃避延迟寻找隐藏的平台(p= 0.007; 无花果。6)。 然而,upregulation MKP-1的AAVMKP-1明显缩短了逃避延迟(p= 0.016; 无花果。6MKP-1的差别),而对这些AAVshMKP-1增加了逃避延迟AD小鼠(p= 0.006; 无花果。6)。 探针测试表明upregulation MKP-1增强空间记忆检索,AAVMKP-1治疗小鼠条目的数量增加到平台区(p =0.017; 无花果。6 b)和花更多的时间在目标象限(p= 0.032; 无花果。6摄氏度)。 我们还对另一组老鼠在后期microinjecting广告老鼠AAV在6和9个月大的时候,并在12个月内进行行为测试。 观察到类似的结果。 AAVMKP-1减少逃脱延迟期间隐藏平台培训(p< 0.001; 无花果。6 d)。 对待AAV探针测试显示,老鼠MKP-1有更多的条目到平台区(p =0.037; 无花果。6 e)和花更多的时间在目标象限(p =0.034; 无花果。6 f)。 这些数据清楚地表明,upregulation MKP-1表达改善广告的认知障碍转基因小鼠模型。
MKP-1缓解突触和内存赤字在APP / PS1老鼠。一个- - - - - -c空间学习和记忆的莫里斯水迷宫测试评估野生型(WT)和APP / PS1转基因AD小鼠的超表达的MKP-1 AAV后9个月MKP-1或MKP-1, AAV击倒shMKP-1。 越狱延迟隐藏的平台一个空间学习期间。 * *p< 0.01的双向方差分析。 条目的数量到平台区b在隐藏的位于象限和所花费的时间c在探测试验在老鼠没有隐藏的平台。 *p< 0.05和* *p由单向方差分析< 0.01。n在每组7 - 12 =。d- - - - - -f空间学习和记忆的莫里斯WT和广告小鼠水迷宫测试时过度的MKP-1 AAV后12个月MKP-1或MKP-1, AAV击倒shMKP-1。 越狱延迟隐藏的平台d空间学习期间。 * * *p< 0.001的双向方差分析。 条目的数量到平台区e在隐藏的位于象限和所花费的时间f在探测试验在老鼠没有隐藏的平台。 *p< 0.05和* * *p由单向方差分析< 0.001。n在每组= 10。g- - - - - -我海马CA1 LTP记录从脑片WT和广告模式小鼠时过度的MKP-1 AAV后12个月MKP-1或MKP-1, AAV击倒shMKP-1。 * *p由单向方差分析< 0.01。n= 4到10片每组三只老鼠。j- - - - - -米透射电子显微镜分析了研究突触数量的变化k、PSD厚度l和脊柱宽度米海马的WT老鼠和广告时过度的MKP-1 AAV后12个月MKP-1或MKP-1, AAV击倒shMKP-1。 *p< 0.05和* * *p由单向方差分析< 0.001。n在每组= 4。
海马LTP被认为是学习和记忆的细胞机制。 接下来,我们进一步调查的影响MKP-1小鼠海马CA1区LTP的广告在12个月的年龄。 我们发现LTP显然是在APP / PS1小鼠受损(127.79±1.23%和172.06±2.24%控制基线,p< 0.001; 无花果。6胃肠道)。 Upregulation MKP-1的AAVMKP-1逆转的损害LTP(194.68±9.32%基线,p< 0.001),而AAVshMKP-1AD小鼠的治疗并不影响LTP(无花果。6胃肠道)。 此外,我们测量的影响MKP-1突触结构的改变广告小鼠模型。 突触的总数在AD小鼠显著下降(10.94±0.22和21.05±1.57在控制,p< 0.001; 无花果。6 j, k)。 然而,upregulation MKP-1 AAV表达式MKP-1显著增加突触的总数为18.85±0.25,而击倒MKP-1表达式的AAVshMKP-1进一步降低突触的总数在广告老鼠9.00±2.36 (p <0.001; 无花果。6 j, k)。 此外,也观察到类似的结果与突触后密度(PSD)的厚度。 PSD的厚度是9.78±0.63 nm广告老鼠相比,19.94±1.34 nm nontransgenic老鼠(p =0.045)。 Upregulation MKP-1的AAVMKP-1恢复21.96±4.01纳米的厚度(p= 0.018),而击倒的MKP-1 AAVshMKP-1没有影响厚度为10.05±0.95 nm AD小鼠的海马CA1区(图6 j l)。 值得注意的是,没有明显的区别是在突触间隙的宽度对待AAV在老鼠MKP-1或AAVshMKP-1(无花果。6 j,米)。 在一起,这些发现表明,upregulation MKP-1救援的突触的赤字和改善认知障碍的广告模式体内。
讨论
MKP-1有重要作用在调节神经元的生长和抑制MAPK信号的突触发生中枢神经系统。 这里,我们报道,MKP-1表达显著降低患者的大脑中广告和广告的小鼠模型。 我们还发现MKP-1转录激活是由Sp1。 Aβ治疗减少MKP-1表达上调Sp1。 我们证明MKP-1监管ERK / MAPK-mediated应用和BACE1合成,从而影响应用程序处理和Aβ生产。 这些发现表明,抑制MKP-1信号通路可能促进AD发病机制。 我们的结果进一步表明,MKP-1 upregulation Aβ生产减少,斑块形成,救出了突触异常,在广告的老鼠和改善认知能力下降(补充图。4)。 我们的研究清楚地显示的效果MKP-1 AD发病机制及其治疗AD的治疗潜力。
MAPKs参与Aβ沉积,21,38,39,40τ蛋白磷酸化,21和炎症反应。41MKP-1 MAPKs的抑制剂,28,29,30.在广告中可能发挥重要作用。 目前的研究发现,MKP-1表达明显减少患者的广告和广告的老鼠。 我们发现,减少MKP-1导致overactivation ERK / MAPK信号通路,从而增加Aβ一代。 Aβ是由应用程序通过顺序由β-γ-secretases分裂。1BACE1参与AD发病机制的失调,抑制BACE1减少老年痴呆症的表型。4,37,42我们的数据表明,upregulation MKP-1抑制应用和BACE1表达式,从而减少生成Aβamyloidogenic处理应用程序。 MKP-1 Aβ代增加的差别相比之下,对这些广告的老鼠。 MKP-1的差别不过,有趣的是,对这些并不影响应用程序或BACE1表达式或神经炎的斑块的数量。 一种可能性是,减少MKP-1广告模型能充分提高应用和BACE1表达这样的遗传击倒MKP-1不能在应用和BACE1诱发进一步增加。
越来越多的证据表明需要ERK激活突触可塑性和记忆。19,20.抑制ERK活化的抑制剂SL327造成重大长期记忆障碍。43然而,非特异性ERK的磷酸化或overactivation可能账户,至少在某种程度上,记忆障碍由于改变疾病的信号。 先前的研究已经表明,ERK在广告应对,21,22,23和减少ERK激活前额叶皮层可以逆转早期AD小鼠记忆力下降。24符合这些发现,我们这里报道,AD小鼠显示显著更高水平的激活ERK在12个月的年龄。 MAPK家族的所有成员都牵连到广告。21,38,39,40在这项研究中,我们表明,MKP-1减少导致的overactivation ERK,物和P38。 然而,我们的数据显示,只有ERK / MAPK通路中的关键角色Aβ代通过抑制APP和BACE1基因的转录。 一种可能性是,物和P38对BACE1-mediated应用处理影响甚微,但他们可以通过其他分子机制参与广告发展。 例如,物/ MAPK信号通路可以激活突触前认知障碍的发生。15抑制物活性的cep - 1347封锁了Aβ-induced神经毒性和下游c-Jun caspase-2−3激活,44因此防止突触收缩和突触后蛋白质损失。45Aβ-induced氧化应激可以导致P38 MAPK /激活和τhyperphosphorylation。17此外,Aβ刺激快速P38 MAPK /激活,导致炎症基因表达和小胶质细胞的促炎细胞因子释放。46,47因此,抑制P38 overactivation mw01 - 2 - 069 a - srm显著减毒Aβ-induced促炎细胞因子的增加和减少Aβ-mediated突触和行为赤字在老鼠身上。48
总之,我们确定upregulation MKP-1显著抑制amyloidogenic处理应用程序通过调节ERK / MAPK信号通路,减少老年斑的数量和改善认知功能在一个小鼠模型的广告模式。 这些发现提供了新颖的见解MKP-1在AD的发病机制中的作用及其潜在的作为广告治疗的新目标。
材料和方法
动物
APP / PS1老鼠从北京获得HFK生物科学公司和饲养在一个温度和湿度specific-pathogen-free房间(灯从上午7点到晚上7:00)重庆医科大学儿童医院。 基因型PCR证实了使用尾组织DNA。 所有动物实验按照重庆科委批准的指导方针和动物保健委员会重庆医科大学。
患者样本
十后期人类大脑样本,六是临床诊断为广告,获得来自中国浙江大学人类大脑银行(补充表1)。 这些样本被中国人类大脑银行病理证实。 大脑组织在冰冷的试剂盒均质(豆类,大津,志贺,日本)。 氯仿是添加到独立阶段,然后同等体积的异丙醇与水相混合。 颗粒是用70%乙醇洗净后,发现了RNA分光光度计NanoDrop 2000 (NanoDrop技术,威明顿、德、美国)。 此外,样本均质均匀缓冲区在研钵和研杵和离心机(12000g15分钟,4°C)为西方墨点法测定收集上层的。 人类研究是评价和伦理委员会批准浙江大学(研究项目的伦理批准文件数量:2018 - 009)。
抗体
应用程序和它的清洁技术基金被多克隆抗体检测甜(1:1000)获得教授的实验室未红歌。49Anti-MKP-1 (1∶# sc - 2857)是来自圣克鲁斯生物技术。 Anti-JNK (1:1000 # 9252), anti-P-JNK (1:1000 # 4668), anti-P38 (1:1000 # 8690), anti-P-P38 (1:1000 # 4511), anti-ERK (1:1000 # 4695), anti-P-ERK(1:1000 # 4370)和anti-BACE1(1:1000 # 5606)从中科购买。 Anti-β-actin (1:3000 # A5411)抗体购自σ。
质粒
基因组DNA提取HEK 293个细胞被用来增强启动子区域的人类MKP-1 PCR。 −763 bp + 342 bp的转录开始网站+ 1,6个片段的启动子区域MKP-1被PCR放大,和荧光素酶报告基因被插入到pGL4.10表达载体(MKP-1-A - b, c, d, e, f; 补充图。S2)。 构建不同MKP-1启动子的序列,使用以下引物:−763 fKpnI: 5′-CCGGGTACCAAAAGTCTGGGAAACAGGAAAG,−229 fKpnI: 5′-CCGGGTACCGCTCCGAGGCTGATGACGT,−47 fKpnI: 5′-CCGGGTACCGCTGCGAAGGACATTTGG, + 222 rHindIII: 5′-TACAAGCTTCAGGGTGCCCACTTCCAT, + 342 rHindIII: 5′-TACAAGCTTGAAGCGCACGTTGACAGAG,和−47 rHindIII: 5′-TACAAGCTTGAGCCTGGCCCGGGGAGCGCGTTTA。
以下一系列的替代突变MKP-1 Sp1-binding网站的构建:Sp1-binding站点1 MKP-1 (Sp1-1) TCTCCGCCCCAACTCG是AAAAAAAAAAAAAAAA突变; Sp1-binding站点2 MKP-1 (Sp1-2) CCCCCACCCCA是AAAAAAAAAAA突变; Sp1-binding站点3 MKP-1 (Sp1-3) AGCCCTCCTCCTCCCCG是AAAAAAAAAAAAAAAAA突变; Sp1-binding网站4日在MKP-1 (Sp1-4) CCCCCCCTCCCCC是AAAAAAAAAAAAA突变; 和Sp1-binding网站5 MKP-1 (Sp1-5) GGCCCGCCCCGTCCCCC是突变AAAAAAAAAAAAAAAAA(补充表2).
细胞培养和转染
N2A细胞培养在47%杜尔贝科修改鹰的介质(DMEM)(美国纽约Gibco)和47% Opti-MEM(美国纽约Gibco),补充1%链霉素和5%胎牛血清的边后卫。 N2A应用程序稳定转染细胞与人类从教授获得瑞典突变APP695 Chunjiu钟(复旦大学、上海、中国)和完整的DMEM培养包含G418 100µg /毫升的浓度。 细胞被维持在37°C公司5%2的气氛。 细胞被播种在six-well盘子,直到发展到30 - 40%汇合,然后与LV转染MKP-1或LVshMKP-1生产的最终莫伊20。 大约8 - 12 h后,添加完全培养基,细胞收获之后西方墨点法72 h。 过表达或击倒MKP-1体外,慢病毒overexpressing MKP-1 (LVMKP-1)或MKP-1携带小发夹RNA (LVshMKP-1)是由OBiO科技(上海,中国)。 siRNA对鼠标MKP-1从圣克鲁斯生物技术、获得和MKP-1超表达质粒被OBiO形成的。 特异性神经元发起人P2A是用于驱动MKP-1表达式,H1启动子是用于shRNA-MKP-1。
腺相关病毒和显微镜下注射
过表达或击倒MKP-1体内,表达MKP-1腺相关病毒(AAV)MKP-1)或MKP-1小发夹RNA (AAVshMKP-1)是由OBiO技术。 3×10滴度12你/毫升。 与戊巴比妥钠麻醉后,老鼠被安装在一个立体定位仪器,和1μl AAVMKP-1或AAVshMKP-1microinjected到每个半球侧脑室的钻洞(0.4毫米后,±1毫米侧和腹侧相对于前囱3毫米)。 所有的老鼠收到前两AAV显微镜下注射行为测试。 一些老鼠收到AAV显微镜下注射6岁和9个月,和行为测试进行时12个月。 其他老鼠收到AAV显微镜下注射3和6个月时,和行为测试进行岁9个月。
免疫组织化学染色
与过量的聚氨酯动物被杀后,一半的老鼠大脑立即冻结蛋白质或RNA提取。 大脑的另一半是刚做好的后缀磷酸盐(PBS, 0.1 4%的多聚甲醛米24 h, pH值7.4),然后用30%蔗糖脱水,直到组织沉入底部和连续分为30μm-thick日冕部分。 消除残余过氧化物酶活动,片孵化H为3%2O2了半小时。 然后,片被封锁与10%牛血清白蛋白和孵化鼠单克隆抗体4八国集团一夜之间在4°C。 斑块被ABC和DAB方法检测和统计的显微镜×40放大如前所述。50
定量实时聚合酶链反应
从大脑组织或细胞总RNA提取使用试剂盒试剂(豆类,大津,志贺,日本),用分光光度计和浓度和纯度检测NanoDrop 2000 (NanoDrop技术,威明顿、德、美国)。 一微克的RNA被用来合成第一链互补DNA(互补)'脚本RT试剂盒(豆类,大津,志贺,日本)。 MKP-1互补dna,应用和BACE1分析定量实时PCR利用SYBR预混料交货Taq II(豆类,大津、志贺、日本)的大型管理软件CFX检测系统(Bio-Rad)。 引物序列如下:MKP-1(转发:5′-GTACATAAGTCCATCTGAC,相反:5′-GGTTCTTCTAGGAGTAGACA); 应用程序(向前:5′-ATGCCGTTGACAAGTATCTCG逆转:5′-TCTGCCTCTTCCCATTCTCTC); BACE1(向前:5′-TACCAACCAGTCCTTCCGC逆转:5′-CTCCCATAACAGTGCCCGT); 和GAPDH(转发:5′-AACTGCTTAGCACCCCTGGC,相反:5′-ATGACCTTGCCCACAGCCTT)。 MKP-1的相对表达水平、应用和BACE1互补GAPDH水平正常化。
免疫印迹分析
海马和颞叶皮层细胞溶解在研钵和研杵均匀缓冲区。 匀浆是离心机(4°C, 10000 rpm, 15分钟)收集上层的。 蛋白质样品(30μg)在4×加载缓冲区煮10分钟的95°C。 样本然后tris-tricine tris-glycine sds - page 10%或16% sds - page分离和转移到一个immobilon-PTM聚偏二氟乙烯膜。 阻止非特异性结合,膜被孵化与5%脱脂牛奶Tris-buffered盐水含0.1% Tween-20 37°C 1 h。 目标蛋白质与初级抗体免疫印迹一夜之间在4°C。 孵化后山羊anti-rabbit免疫球蛋白(1:3000; Abcam)在室温下1 h, Bio-Rad成像仪使用ECL的蛋白质检测免疫印迹基质(皮尔斯,沃尔瑟姆,美国)。
AβELISA
小鼠海马匀浆或细胞培养媒体收集。 防止Aβ退化,裂解缓冲是添加蛋白酶抑制剂(罗氏、巴塞尔、瑞士)。 Aβ水平40/ Aβ42决定使用一个Aβ吗40/ Aβ42酶联免疫试剂盒(研发)。 样品测量的标仪(美国Winooski生物Tek协同H1)在450海里。
莫里斯水迷宫
介绍了莫里斯水迷宫测试检测hippocampal-based小鼠空间记忆的年龄在9到12个月,如前所述。50,51迷宫由150厘米直径的圆形不锈钢池满无毒白色油漆,和温度保持在24±1°C。 每个老鼠进行了120年代自由游泳适应迷宫空间学习前24小时。 然后,老鼠训练搜索隐藏的平台(直径13厘米)连续5天每天四个试验。 在未能达成隐藏的平台在120年代,老鼠将会引导他们呆了20年代的平台。 检索测试进行24小时后学习试验。 Any-maze跟踪系统(美国木材戴尔Stoelting有限公司)是用来记录逃脱延迟。
电生理学体外
老鼠(12个月)丧生,海马切片(400 -μm厚)冠方与被削减vibratome (VT1200S徕卡,位于德国)为95%2和5%的公司2然后转移到一个submersion-type孵化室2 h复苏35°C。52场兴奋性突触后电位记录从海马CA1地层radiatum谢弗collateral-commissural通路的刺激。 θ破裂刺激是诱发LTP后获得一个稳定的基线。 执行数据采集与PatchMaster v2.73软件(HEKA电子、Lambrecht /法尔兹,德国)。
透射电子显微镜法
透射电子显微镜(TEM)被用来检测和神经元的超微结构,如前所述。53老鼠过量与灌注聚氨酯然后transcardially 2.5%戊二醛。 每个老鼠大脑快速分离在冰上,1毫米的组织样本的切除海马CA1区。 样品被固定在4%的戊二醛超过24 h和嵌入Epon812环氧树脂。 然后,样本切片1-μm-thick片。 飞利浦EM208S TEM(飞利浦,阿姆斯特丹,荷兰)被用来观察神经元超微结构和双染色后醋酸双氧铀及柠檬酸铅。 的存在至少三个囊泡在突触前小结和PSD的存在是用来识别突触。 随机突触图像获得根据先前使用的方法53,54被用来测量突触的数量和PSD突触间隙宽度和厚度。 所有的措施都在双盲的方式进行。
荧光素酶检测
确定启动子活性,质粒含有人类应用和BACE1基因的启动子区域。3.,55质粒转染到N2A应用程序细胞使用Lipofectamine 2000(美国卡尔斯巴德表达载体),然后MAPK抑制剂进行24 h。 Dual-Luciferase记者分析系统(美国麦迪逊Promega)是用来衡量萤火虫荧光素酶的活动和Renilla顺序荧光素酶。
Aβ低聚物制备
的Aβ42肽是来自GL生物化学有限公司(上海,中国)。 提高低聚物的形成,1米米hexafluoroisopropanol用于Aβ溶解42,然后蒸发,形成干膜。 这部电影被溶解在二甲亚砜5米米,然后与PBS混合培养48 h在4°C。 孵化后,准备离心机(14000×g,10分钟),上层的收集。
环己酰亚胺治疗
MKP-1降解实验(半衰期测量),Aβ42(10μ米)是用于治疗N2A细胞24 h。 应用和BACE1降解实验,N2A应用程序细胞治疗ERK抑制剂和LVMKP-148 h。 N2A和N2A应用程序在不同时间点细胞收获放线菌酮治疗后(100μg /毫升)。
EMSA
EMSA进行如前所述。37总之,核提取物HEK 293细胞由细胞质核隔离设备(美国EdenPrairie发明生物技术)补充蛋白酶抑制剂。 700 -标记IRDye Sp1益生元(5′-ATTCGATCGGGGCGGGGCGAGC)是与核蛋白(2μg)在室温下混合30分钟在黑暗中,用《奥德赛》和凝胶扫描系统(美国林肯LI-COR生物科学)。 无标号野生型和突变体(5′-GGTAACTACTAAGTTATTTTCAAGCTACTTAA) Sp1被用来争夺绑定的竞争分析。