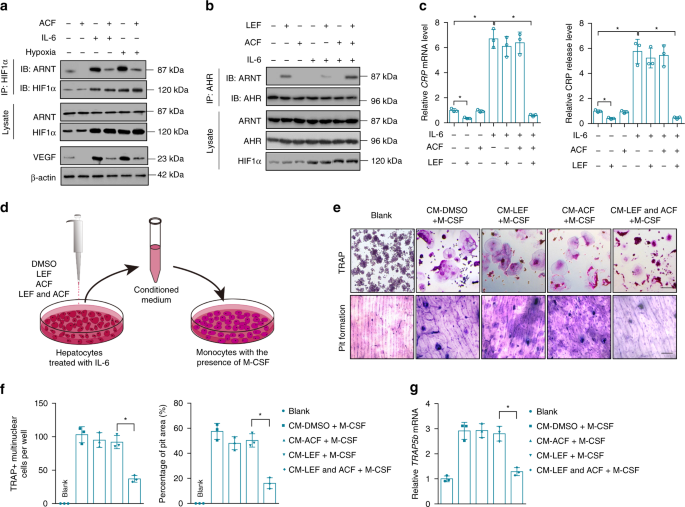
来氟米特治疗RA患者的特点
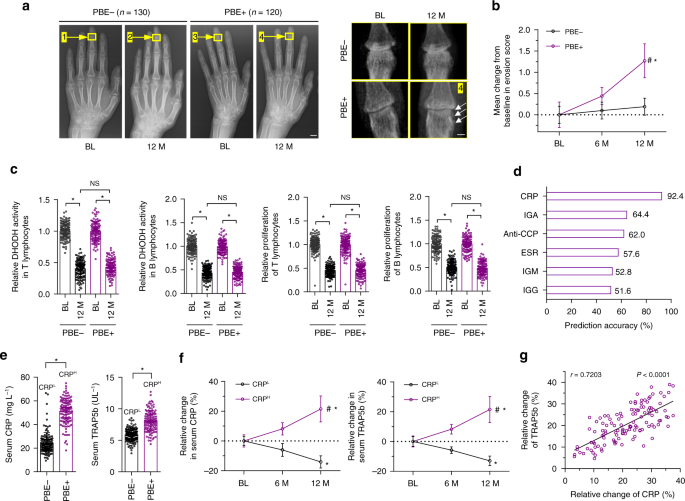
对250例RA患者(女性150例,男性100例)给予来氟米特治疗。患者治疗前的特征见补充表。1..其他疾病或药物的患者,包括钙补充剂和绝经后激素替代疗法,可能影响骨重塑,被排除在研究之外。绝经后少于5年的女性患者也被排除在研究之外。所有患者均获得知情同意。这项研究得到了中国医学科学院临床医学基础研究所伦理委员会的批准。所有RA患者均口服来氟米特治疗12个月。治疗前后收集所有RA患者的血清。治疗前后均行手前后平片检查。
用改进的Sharp法进行放射评价
双手前后平片由两位不同的合格医生进行阅读和评估。X线片的读者对RA患者的X线片顺序和临床细节视而不见。按改良的Sharp评分法进行手关节的侵蚀评分。简单地说,根据6分评分(0-5级)对32只手关节的腐蚀情况进行了评估:如果没有腐蚀,则腐蚀评分为0。侵蚀是1,如果他们是离散的,但清楚地存在,如果他们是较大的2或3,取决于所涉及的关节的表面积。如果侵蚀很大,并延伸到假想的骨中部,则评分为3分。如果关节完全塌陷,或关节的整个表面受到影响,则得分为5分。54.
细胞培养
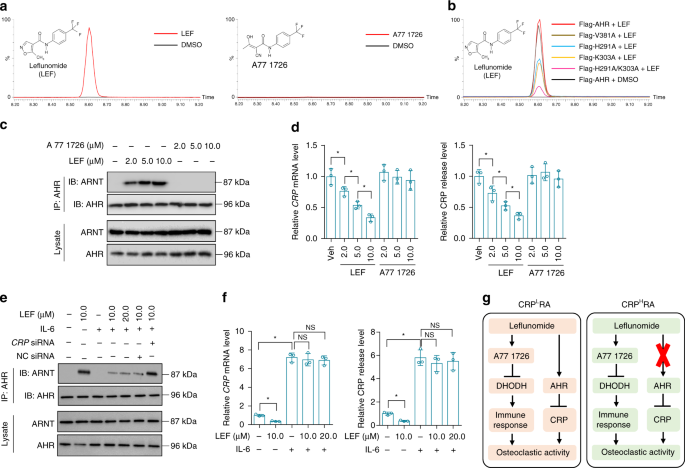
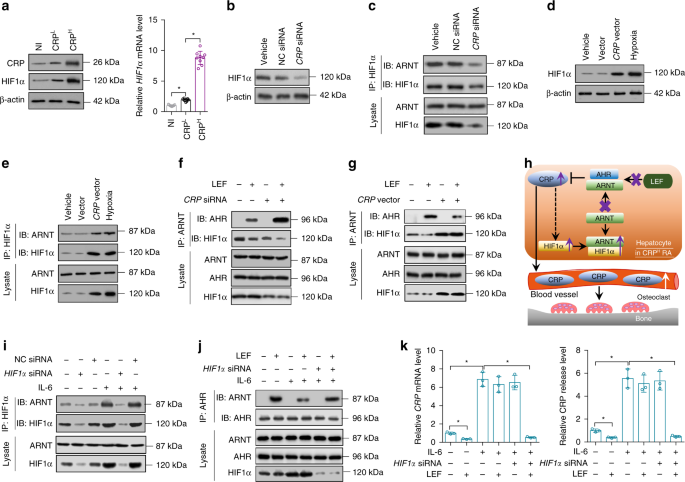
人正常肝细胞株THLE-2(ATCC,CRL-2706)在37℃下,在含5%CO的加湿环境中培养。220%O2在支气管上皮细胞基础培养基和添加剂中(来自美国Lonza/Clonetics公司的BEGM,BEGM子弹试剂盒)。300×酶解离心后,每两天换一次培养基。g持续5分钟。细胞株未检出支原体污染。本研究中未见常见的错误识别细胞株。THLE-2细胞(2×10)5(每孔细胞)在一夜之间孵育。用X-tremeGENE™siRNA转染试剂(RochLifeScience)转染C反应蛋白或AHR。siRNAsAHR和HIF1αNC siRNA来自热Fisher科学。siRNACRPNC siRNA来自圣克鲁斯生物技术公司。对载体诱导的CRP过表达,人CRP用5‘-TGAATTCAGGCCCTTGTATC-3’(正义)和5‘-TCCCATATTATAGAGA-3’(反义)引物进行PCR扩增。全核苷酸序列CRP克隆入哺乳动物表达载体pcDNA3.1(Invitrogen),经DNA测序证实。pcDNA3.1高表达载体转染THLE-2细胞CRP或使用X-tremeGENE的空载体™Hp DNA转染试剂(罗氏生命科学)。转染后,细胞继续培养36h,在细胞内加入一定浓度的小分子24 h,用重组人重组白细胞介素-6(50.0 ng mL)预处理rp的高表达。−1(研发系统)8小时,低氧处理时,细胞暴露于5%的CO中。21%O2来氟米特、A771726、Furafylline和ACF均来自Sigma-Aldrich。
标记蛋白的表达及纯化
AHR(H291A、K303A、V381A和H291A/K303A)的位点突变是由QuikChange定点诱变试剂盒(Agilent Technologies)进行的。将AHR或突变体克隆到标记的哺乳动物表达载体pcDNA3.1(Addgene)中.利用X-tremeGENE转染THLE-2细胞,经直接dna测序证实载体的表达。™Hp DNA转染试剂(罗氏生命科学)。转染后,细胞继续培养36h,用旗标M纯化试剂盒(Sigma-Aldrich)对突变体进行纯化。
免疫沉淀与西方印迹
在HEPES裂解缓冲液(20 mm HEPES pH 7.2,50 mm NaCl,0.5%Triton X-100,1mm NaF,1mm二硫苏糖醇)中加入蛋白酶抑制剂鸡尾酒(Roche Life Science)和磷酸酶抑制剂(10 mm NaF和1mm Na3VO4)制备细胞裂解液。蛋白A/G-琼脂糖(圣克鲁斯生物技术)在4°C进行免疫沉淀,蛋白质样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转移到PVDF膜(Bio-Rad)上。阻断后,用原抗体检测膜,然后与特异性辣根过氧化物酶结合次级抗体(Bio-Rad)孵育。免疫检测采用增强化学发光法(ThermoFisher Science)。采用β-肌动蛋白作为内矫正术的负荷对照.The primary antibodies included an anti-AHR antibody(ab2769,1:500),an anti-ARNT antibody(ab5624,1:500),an anti-HIF1α(ab1,1:200)antibody,an anti-CRP antibody(ab50861,1:2000),an anti-VEGFA antibody(ab46154,1:1000),an anti-JunD antibody(ab28837,1:500),an anti-cyclin A antibody(ab181591,1:2000),an anti-Src antibody(ab47405,1:500),an anti-Src(phospho Y418)antibody(ab4816,1:1000)和抗β-actin(ab8226,1:10000)抗体。抗体已被验证为特定的物种,并在试点研究中的应用。源数据文件中提供了所有相关的未裁剪污迹。
淋巴细胞和巨噬细胞的分离
滑膜液取自RA患者、CIA大鼠和小鼠。用EasySep™T细胞分离试剂盒(干细胞技术公司)分离T淋巴细胞。用EasySep™B细胞分离试剂盒(干细胞技术公司)分离B淋巴细胞。流式细胞仪检测T、B淋巴细胞纯度约为90~95%。用抗CD 14抗体(17000~1-AP,1:100,Proteintech集团公司)流式细胞术分离巨噬细胞.
DHODH活性测定
该方法包括DHODH与DHO底物的酶促反应,然后用4-三氟甲基-苯并酰胺肟(4-TFMBAO)荧光试剂对口蹄酸进行特异性荧光检测。55..3×105淋巴细胞在4°C下超声溶解10 min,裂解液用含500μM DHO,200 mm K的1.0ml水溶液孵育。2协和3-HCl(pH8.0)、0.2%TritonX-100和100μM辅酶Q10在37℃下作用1h。2O,250μL为4.0mm 4-TFMBAO,250μL为8.0mm K3[Fe(CN)]6]和250μL的40毫米K2协和3(PH 11),在80℃下加热4.0 min。在冰水浴中冷却,反应停止,用荧光光谱仪测量反应强度。激发波长和发射波长分别为340 nm和460 nm。在计算产量时,从孵育结束时观察到的总酸量中减去非孵育时间前已存在的葡萄酸水平。欧拉酸、辅酶Q10、4-TFMBAO和DHO均购自Sigma-Aldrich.
人单核细胞的分离与破骨发生
采用Ficoll-Hypaca(Sigma-Aldrich)密度梯度离心法,从健康志愿者肝素化全血中分离出外周血单个核细胞(PBMCs)。用无菌PBS冲洗3次,再悬浮于RPMI 1640(生命技术)中,加入10%FBS、2mm L-谷氨酰胺和1%青霉素-链霉素(完全培养基)。PBMC在37℃完全培养基中孵育45 min。去除不贴壁细胞,用无菌PBS清洗贴壁细胞,用橡胶警察采集。流式细胞仪测定Ficoll-Hyp猕猴分离的单核细胞纯度约为85-90%。细胞在25 ng mL的THLE-2细胞条件培养液中培养3周。−1重组人M-CSF(R&D系统)。媒介每隔一天改变一次。第21天,用白细胞酸性磷酸酶试剂盒(Sigma-Aldrich)鉴定TRAP阳性细胞。10.
肝细胞分离
采用两步灌注法分离大鼠和小鼠原代肝细胞。56..简单地说,肝细胞是通过非循环胶原酶通过门静脉灌注从麻醉成年大鼠中分离出来的。分离的细胞然后通过一个100μm孔径的网状尼龙过滤器过滤。细胞悬液中的细胞数用血细胞计数。用台盼蓝染色法测定细胞活力。用流式细胞仪对分离的肝细胞进行纯化和鉴定。
坑形成试验
人单核细胞接种于骨分析板(Lonza)上,密度为1×10。4每井都有细胞。细胞在25 ng mL的THLE-2细胞条件培养液中培养3周。−1重组人M-CSF(R&D系统)。媒介每隔一天改变一次。第21天,骨片经1mnh超声处理。4去除贴壁细胞,用0.1%甲苯胺蓝染色。电镜下获取骨切片图像。每片骨片随机抽取3个字段进行进一步分析。利用ImagePro Plus 6.2软件(MediaControneticsInc.)对坑区进行了量化。57.
分子对接
针对PDB数据库进行位置特异性迭代BLAST(PSI-BLAST),以识别AHR、PAS-A和PaSB结构域的同源模板.利用建模软件对AHR、PAS-A和PAS-B结构域进行同源建模。选择能量最低的结构作为进一步细化结构的起点。为了找到最优构象,将循环改进应用于AHR PAS-A和PAS-B结构域的预测。58..利用Ramachandran图对蛋白质结构中氨基酸残基的ψ和φ进行检测,评价模型结构的质量。利用AutovokVina对AHR、PAS-A和PAS-B结构域与来氟米特进行了分子对接.AHR的大分子结构被加载后,电荷和氢原子被加入,非极性氢原子被合并。用ChemDRAW 10.0绘制来氟米特分子,用量子化学方法AM1优化结构。利用AutoDock工具将蛋白质和配体结构转换为PDBQT格式。
ELISA法
用热费舍尔科学公司的ELISA试剂盒测定人和大鼠CRP。用定量ELISA试剂盒(R&D系统)测定小鼠CRP。用Cusabio生物技术公司的ELISA试剂盒检测人类风湿因子IGA、IGM和IGG。PeliKine法测定人IL-6和RANKLTM细胞科学人ELISA试剂盒和Boster生物技术ELISA试剂盒。采用ABCAM ELISA试剂盒检测人、大鼠和小鼠白细胞介素-17(IL-17)。人TRAP5b用TECOMedicalAG的ELISA试剂盒检测。用免疫诊断系统ELISA试剂盒检测小鼠和大鼠TRAP5b。用ABCAM ELISA试剂盒检测小鼠和大鼠IL-6。用ABCAM和Biobyt的ELISA试剂盒检测小鼠和大鼠RANKL。用酶联免疫吸附试验(ELISA)检测单抗CRP。59.
血清生化及血液学检测
采用Vitros 250分析仪对大鼠肝功能参数(ALT、AST)和肾功能参数(BUN)进行分析,并与常规临床诊断学、强生公司(Johnson&Johnson Co.,Rochester,NY)进行比较。血液学参数包括TP、血红蛋白、WBC、RBC和PLT用ABXINTERRA60C+分析仪(法国蒙彼利埃HoribaABX)进行分析。
LNPs-siRNA的制备
LNPs传递系统由类脂类98N组成12-5(1),胆固醇,PEG-脂质和siRNA12,24..简单介绍98N的库存解决方案12-5(1),mPEG 2000-脂质和胆固醇(Sigma-Aldrich)在乙醇中混合生成摩尔比为42:48:10。混合脂质加入125 mm醋酸钠缓冲液(pH5.2),得到含有35%乙醇的溶液,从而自发生成类脂纳米粒。用LIPEX挤出机(北脂,不列颠哥伦比亚省,加拿大),通过0.08μm膜(斯特力泰克,肯特,WA)挤出纳米粒子,形成长度为50-60nm的纳米颗粒。CRP在50 mm醋酸钠(pH5.2)和35%乙醇中加入siRNA或NC siRNA,总脂比为7.5:1(wt:WT),37°C孵育30 min。通过对磷酸盐缓冲液进行透析,实现了含siRNA纳米粒子的乙醇去除和缓冲液交换.最后,用0.2μm无菌滤池对该制剂进行过滤。为了确定siRNA的组织分布,用Cy5标记siRNA,用微板阅读器系统(BioSCAN,Washington,DC)测量不同器官样品中的荧光强度。
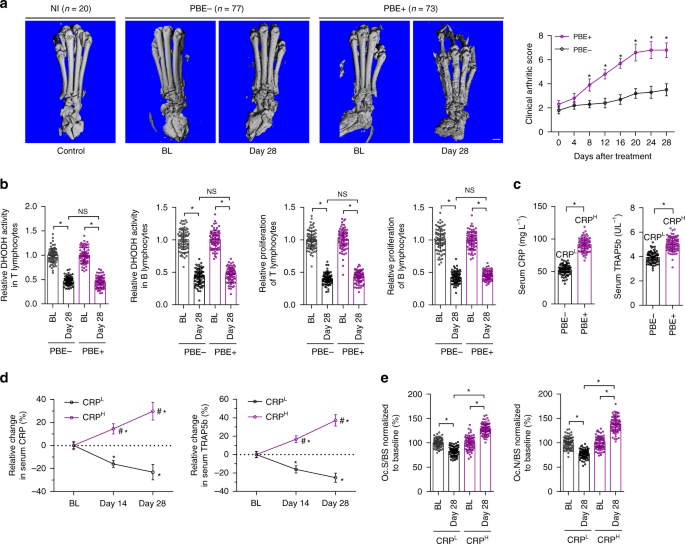
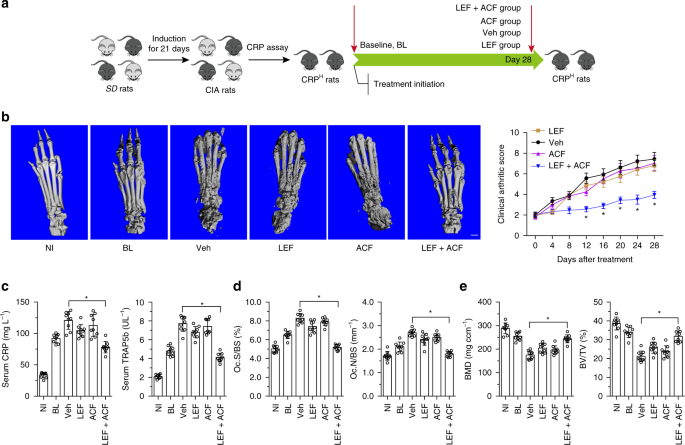
CIA大鼠模型
男SD大鼠(体重170~190克)来自香港中文大学,在标准温度(22°C)和12小时的光/暗循环下,可自由获取食物和水。CIA大鼠模型60..在不完全弗氏佐剂(IFA,Chondrex)中乳化牛Ⅱ型胶原(Chondrex)。用2 0 0μL乳剂(2 0 0μg牛CII)在尾底皮下免疫。第7天给予增强免疫,第1次注射100μL相同的乳剂。关节炎的严重程度通过临床关节炎评分来评估,该评分由两名独立的、失明的观察者进行。评分采用0~4评分,0=无肿胀或红斑,1=轻度肿胀和/或红斑,2=轻度至中度水肿,3=明显水肿,关节使用受限,4=关节僵硬水肿过多。对每只大鼠后肢进行分级,最大可能评分为8分。分数在1或以上的老鼠被认为是关节炎。所有实验程序均获香港浸会大学动物伦理及实验安全委员会批准。我们遵守了所有有关动物试验和研究的道德规范。
肝细胞特异性的产生HIF1α敲除小鼠
HIF1α氧氟沙星/氧氟沙星小鼠(B6.129-)HIF1atm3Rsjo/来自香港中文大学实验动物服务中心。阿尔布-CRE小鼠(B6.Cg-)Speer 6-PS1热重(Alb)−(CRE)21 Mgn/J)来自杰克逊实验室。这两只老鼠C57BL/6背景,被认为对关节炎的诱导具有相对的抵抗力。61..即使C57BL/6用鸡源性Ⅱ型胶原免疫小鼠后可发生关节炎,最大关节炎发生率较低(50%-70%),关节炎易感性变化较大。61..因此,这两只老鼠被回溯了八代,以改变遗传背景。C57BL/6到DBA/1,表明其对关节炎的易感性最大。61,62,63..然后,HIF1α氧氟沙星/氧氟沙星小鼠阿尔布-克雷小鼠产生肝细胞特异性HIF1α击倒HIF1α-香港天文台(HKO)小鼠64.
CIA小鼠模型
男DBA/18至10周龄的老鼠来自香港中文大学,在标准温度(22°C)和12小时的光/暗循环下,可以自由获取食物和水。CIA小鼠模型63..简单地说,牛CII(Chondrex)被乳化在同等体积的完全弗氏佐剂(CFA)中。小鼠尾底单次皮下注射100μL乳剂(100μg牛CⅡ),终浓度为2mg mL。−1的结核分枝杆菌..关节炎的严重程度通过临床关节炎评分来评估,该评分由两名独立的、失明的观察者进行。评分采用0~4分值,0=正常;1=一个关节的红度和/或肿胀;2=多个关节的红肿和/或肿胀;3=整个爪子的红肿和/或肿胀;4=畸形和/或强直。对每只小鼠后肢进行分级,最大可能评分为8分。分数在1或以上的老鼠被认为是关节炎。所有实验程序均获香港浸会大学动物伦理及实验安全委员会批准。我们遵守了所有有关动物试验和研究的道德规范。
药物管理
用0.5%羧甲基纤维素钠(CMC-Na)悬浮于来氟米特和A771726中,给予CIA大鼠或小鼠口服。将ACF溶解于PBS中,腹腔注射给CIA大鼠。向CIA大鼠注射兔IgG对照(ab171870,每只大鼠20g)或抗CRP抗体(b 227507,每只大鼠20g)。
组织学分析
处死后取小鼠和大鼠膝关节,用10%中性福尔马林保存,20%乙二胺四乙酸(EDTA)脱钙4周后脱水,石蜡包埋。组织病理学检查前行苏木精伊红(HE)和抗酒石酸酸性磷酸酶(TRAP)染色。65.
微CT分析
在体内微CT分析中,对大鼠或小鼠进行麻醉,扫描前俯卧于扫描阶段。用VVACT 40(Sanco Medical)扫描20 mm长的右爪和踝骨,电压为70 keV,电流为114μA,进行活体微CT测量,解剖双侧后爪进行显微CT测量。自动重建后,生成21μm各向同性分辨率的二维切片,选择感兴趣区域(ROI)进行三维重建。对跟骨全骨组织进行定量评价,阈值(σ=1.2,支持度=2,阈值=200)。用内置软件计算骨体积分数(bv/tv)和骨密度(BMD)。66.
骨组织形态计量学分析
双侧后爪用70%乙醇固定。双侧后爪骨组织在不同浓度乙醇中脱水,无脱钙作用于改性甲基丙烯酸甲酯中。用Exakt切割/研磨系统(ExaktTechnologyInc.)获得了10μm厚后爪骨的前部部分。德国)。然后在荧光显微镜(Leica图像分析系统,Q5 0 0 MC)下,应用专业图像分析软件(BioQuant Osteo Analysis)对骨切片进行组织形态计量学分析。骨吸收参数,I...根据骨组织形态计量学的标准化命名计算和表达了OC.N/BS和OC.S/BS。67.
飞镖试验
在10 0μL pBS中,用标记的AHR、AHR突变株和阴性对照牛血清白蛋白(BSA),分别在4°C下与载体(DMSO)和来氟米特(μM)在指示浓度(5.0和10.0μM)下孵育18h。在室温下用枯草杆菌素(Sigma-Aldrich)消化20 min。加入SDS负载缓冲液,煮沸5 min,可使反应停止。将样品加载到12%丙烯酰胺SDS-PAGE凝胶上,然后用考马斯亮蓝染色,观察条带的形态。27.
拉拔法与LC-MS/MS
为确定AHR与来氟米特的直接相互作用,分别与来氟米特(10.0μM)、A771726(10.0μM)和车辆(DMSO)在4°C下孵育了100μL pBS中的30.0 g标记AHR和AHR突变体。标记蛋白由标志M纯化试剂盒(Sigma-Aldrich)收集。采用90%甲醇(Sigma-Aldrich)萃取法提取法中的小分子,用Agilent 6400型超高效液相色谱仪(UHP-QQQMS/MS)(Agilent Technologies)进行分析。28,68.
实时PCR
用RNeaseMini试剂盒提取总RNA。用QuantiTect逆转录试剂盒将总RNA反转录成cDNA。最终的实时PCR溶液的10μL体积含有1μL稀释的cDNA产物,5μL2×PowerSYBR绿色PCR主混合物(应用生物系统),0.5μL的正向和反向引物,3μL核酸酶无水。正反向引物如下:CRP5‘-ATGGAAGCTACTCTGGTGC-3’(Sense)和5‘-ACACAGTAAAGGTTTCAGTG-3’(反义);TRAP5b:5‘-GCAACATCCCCTGTATGTG-3’(Sense)和5‘-GCAAACGTAGTAGTAGTAGCTG-3’(反义);HIF1α5‘-TCCATATGAGCTGCTGACCAC-3’(正义)和5‘-CCACCTCAAAGCACCATA-3’(反义);GAPDH5‘-AGGTCGTGTGAGGAGGATTG-3’(Sense)和5‘-TGTACATTAGTAGTAGGGGGGTCA-3’(反义)。发出的荧光信号由ABI PRISM 7900HT序列检测系统采集,信号经SDS 2.1软件(应用生物系统)转换成数值。66,69.
统计分析
应用二元Logistic回归方法,确定PBE+RA患者血液生物医学指标的指征准确性。用Pearson相关法确定变量间的相关性。用Shapiro-WilkW检验所有连续变量的正态性.当比较两个独立组的测量结果时,双面t-测试用于分析连续变量。在对时间序列组重复测量结果进行比较时,采用方差分析(ANOVA)对数据进行分析。对于多个独立群体之间的差异,单向方差分析临时进行了测试。将样本随机分为不同组。调查人员在数据收集和分析过程中对分组分配视而不见。双面P-小于0.05的数值被认为具有统计学意义。所有统计分析均用SPSS软件22.0版进行。为了获得准确可靠的统计数据,进行了生物复制和技术复制两种类型的复制。样本大小由公式计算:n=2[(Uα + Uß) Sδ−1]2. S在公式中提到标准差(S.D.)。δ在公式中表示均值的组间差。在30毫克厘米以上有差异。−3治疗组与对照组在骨密度方面,I.., δ=30毫克厘米−3..S.D.以往研究的骨密度为15毫克厘米。−3,即S=15毫克厘米−3..我们选择了5%的显著水平(α=0.05)在双尾测试和研究的力量在90%(1-ß=0.9)。根据公式:n=2[(Uα + Uß) Sδ−1]2, U0.05=1.960,ß=0.10,U0.1=1.282,我们选择了n=9,足以检测治疗组间的真正差异。身体条件差的动物,如肿瘤或衰老期间的其他疾病,被排除在外。在随机分组作业、实验干预和数据分析之前进行排除。