摘要
肾脏疾病给全世界的卫生系统带来了巨大的健康和经济负担,由于其复杂性和异质性,缺乏有效的预防和治疗方法。肾脏是对线粒体产生的能量有很高需求的器官,据报道,在线粒体中Rrm2b具有重要的功能。我们生产的Rrm2b肾特异性敲除小鼠表现出年龄依赖性的恶化特征,包括线粒体功能障碍和氧化应激增加;此外,导致线粒体相关代谢的严重破坏。Rrm2b不仅为脱氧核糖核酸复制和修复提供脱氧核糖核酸,而且对维持线粒体的结构完整性和代谢稳态至关重要。因此,Rrm2b缺失可能导致小鼠慢性肾脏缺陷。该模型有助于探索肾脏疾病的新机制和靶向治疗,具有重要的转化和临床意义。
介绍
核糖核苷酸还原酶(由两个不同亚基组成的α2β2四聚体)催化重新在细胞核和线粒体的脱氧核糖核苷酸合成和修复过程中,核糖核苷二磷酸还原为脱氧核糖核苷酸三磷酸。核糖核苷酸还原酶M2B (Rrm2b),也称为p53R2,是核糖核苷酸还原酶复合体的亚单位。Rrm2b是一种p53诱导型基因,最初在具有高度调节的p53表达系统的癌症衍生人类细胞中鉴定1,2,3。Rrm2b在脱氧核糖核酸修复、线粒体脱氧核糖核酸(mtDNA)合成、抗氧化应激、细胞周期调控和转移抑制中起着关键作用3,4,5,6,7,8。木村和他的同事产生了Rrm2b缺陷小鼠,这些小鼠在断奶前发育正常,然后表现出生长迟缓和早期死亡9。在Rrm2b缺陷小鼠中发现由p53依赖性凋亡激活引起的严重肾衰竭。因此,Rrm2b似乎对肾脏有重要作用,但其机制尚不清楚。Rrm2b可通过清除活性氧来抵抗氧化应激,并参与线粒体内环境稳定的控制,包括结构完整性和功能能力6,10,11,12,13。在Rrm2b敲除小鼠胚胎成纤维细胞中,dNTP库在氧化应激条件下被严重削弱。Rrm2b缺乏也导致小鼠各种组织中严重的mtDNA缺失4。最近的研究揭示了RRM2B和∏之间的合作1吡咯啉-5-羧酸还原酶1和2可以直接或间接调节人端粒酶逆转录酶永生化正常人包皮成纤维细胞的抗氧化反应14。细胞核和线粒体中受损的脱氧核糖核酸修复会导致严重的脱氧核糖核酸损伤,并影响线粒体体内平衡,从而增加氧化应激和细胞损伤。Rrm2b在线粒体功能的修复和维持中发挥重要作用。在本研究中,我们建立了肾小管上皮细胞中Rrm2b条件敲除的小鼠模型,以研究Rrm2b缺失对线粒体相关和肾功能的影响。我们认为Rrm2b缺失损害线粒体完整性并阻碍线粒体功能,导致线粒体代谢稳态的破坏。
材料和方法
动物
一种包含位于Rrm2b基因外显子3至外显子5两侧的LoxP位点的两个直接重复序列的Rrm2b靶向载体被用作一组同源重组臂,以产生Rrm2b floxed等位基因(Rrm2b Flx/Flx;Rrm2b F/F)。使用设计的探针通过Southern印迹分析筛选靶向胚胎干细胞克隆(C57BL/6菌株背景)。从杰克森实验室购买的Cdh16-Cre转基因小鼠(JAX 012237)15,Cdh-16(也称为Ksp-钙粘蛋白)启动子在肾的管状上皮细胞中被激活16。ksp-钙粘蛋白在肾小管上皮细胞和集合管细胞的基底外侧膜中表达,但在肾小球、血管或肾间质细胞中不表达。在用Rrm2b F/F小鼠进行两代繁殖后,获得肾特异性Rrm2b KO小鼠,并使用常规的聚合酶链反应基因分型进行验证。小鼠在特定的无病原体设施中繁殖和饲养。安乐死是用一氧化碳进行的2吸入。动物实验方案获得了国防医学中心动物护理和使用机构委员会的批准,所有方法均按照相关指南和规定执行。
核糖核酸分析
使用三唑试剂(生命技术)从肾皮质中分离总核糖核酸。我们使用TaqMan探针和TaqMan进行实时定量聚合酶链反应快速通用聚合酶链反应主混合物和实时聚合酶链反应仪器(罗氏生命科学;热费希尔科学公司)。对每个核糖核酸样品和引物组进行三份扩增。
蛋白质和代谢物分析
组织样品在裂解缓冲液中用完整的蛋白酶抑制剂和磷酸酶抑制剂混合液(Roche)匀浆,然后在沸水浴中在SDS样品缓冲液中变性。总提取蛋白质在SDS聚丙烯酰胺凝胶(Bio-Rad)上分离,并转移到混合氮+膜(通用电气医疗保健公司)。用5% (w/v)脱脂奶粉封闭膜,用针对Rrm2b (1:2000,GTX109620,GeneEX)和Hsp70 (1:5000,GTX111088,GeneEX)的初级抗体孵育并洗涤,使用可视化试剂盒(Millipore)检测蛋白质。血清和尿液中的游离甘油使用市售试剂盒(朗道实验室有限公司)进行量热测量。
组织病理学
将组织固定在用磷酸盐缓冲的福尔马林中,并包埋在石蜡中。组织切片(4 m)按照标准程序进行苏木精-伊红(苏木精-伊红)、免疫组织化学(IHC)和特殊染色17。IHC染色是通过将切片与初级抗体(包括靶向Rrm2b (1:200,PAB12860,Abnova)、4-羟基壬烯醛(4-HNE) (1:100,ab46545,abcam)和ki67 (1:50,550609,BD Pharmingen)的抗体)在4℃孵育18-24小时来进行的,检测是使用生物素化的次级抗体和LSAB试剂盒(DakoCytomation)进行的。肾脏切片的特异性染色使用Gomori三色染色试剂盒(Polysciences,Inc .)和Picosirius red染色试剂盒(Atom Scientific)进行。
透射电子显微镜
用戊二醛(1.5%)和多聚甲醛(1.5%)将小鼠组织固定在卡可戴尔酸缓冲液中,后固定在1%的OsO4中,并在卡可戴尔酸缓冲液中冲洗。脱水后,将组织包埋在Epon中,切片用于透射电镜。用透射电子显微镜观察组织超微结构。
线粒体分析
使用海马XFe胞外通量分析仪(海马生物科学)测量来自组织(肾皮质)的分离线粒体的耗氧率(OCR),并根据每个样品的蛋白质含量将结果标准化。如前所述,从组织中分离线粒体18。线粒体基因组与核基因组共纯化,定量实时聚合酶链反应检测mt-Co2(细胞色素c氧化酶亚基2;线粒体编码的)和18S核糖体核糖核酸(18S核糖体核糖核酸;核脱氧核糖核酸编码的)。相对mtDNA拷贝数通过标准化至18S rRNA基因表达来计算(mtDNA/nDNA)19,20。
代谢物的提取
样品制备和代谢物定量根据前述方法进行21,22,23,24。简而言之,将冷冻组织(50 ~ 100毫克)在500升氯仿、甲醇和水的混合物(1∶2∶1,v/v/v)中在冰上匀浆,并在4℃下以13,000转/分钟离心10分钟,随后将150升上清液转移到样品瓶中。剩余的小球在500升甲醇中再均匀化,然后第二次离心。将另一份150升上清液加入同一样品瓶中,然后干燥样品。干燥的提取物然后在30℃用80升甲氧基胺(15毫克/毫升吡啶)衍生90分钟。向衍生样品中加入10升等分保留指数化合物混合物(C10-C40混合物,50g/毫升)。衍生化的第二步是通过加入80 L的N-O-双-(三甲基甲硅烷基)-三氟乙酰胺(1%三甲基氯硅烷)并将样品在70℃孵育120分钟来进行的。衍生化后直接对样品进行气相色谱-飞行时间质谱分析。
气相色谱-飞行时间质谱标准
哺乳动物代谢物标准来自圣克鲁斯生物技术公司西格玛-奥尔德里奇(密苏里州圣路易斯市)。(德克萨斯州达拉斯)或两代情极性脂质(阿拉斯加州雪花石膏)。标准品(约1,000份)在适当的溶液中制备,并通过气相色谱-飞行时间质谱进行分析,以建立内部代谢物数据库。
气相色谱-飞行时间质谱分析
分离分析是使用安捷伦7890N气相色谱仪以无分流模式进行的,该气相色谱仪连接到飞行时间质谱仪(密歇根州圣约瑟夫莱科公司)。使用Rxi-5ms毛细管柱实现分离(交叉5%二苯基/95%二甲基聚硅氧烷;Restek),氦气作为载气,恒定流速为1.0毫升/分钟。气相色谱烘箱温度程序如下:80℃下2分钟,升高10℃/分钟至140℃,升高4℃/分钟至180℃,升高10℃/分钟至240℃,升高25℃/分钟至290℃,然后在290℃下保持4.5分钟。注射、转移界面和离子源的温度分别设置为270、270和220℃。质谱通过全扫描模式(m/z 30–600)下的电子碰撞电离(70 eV)和25光谱/s的采集速率获得。
质谱分析
数据采集使用ChromaTOF软件(密歇根州圣约瑟莱科公司4.22版)进行。使用MATLAB (v7.0,Mathworks,Natick,MA)软件执行数据预处理程序,如基线校正、去噪、平滑、对齐、时间窗分割和多元曲线分辨率25。从数据集中删除了内部标准和任何已知的人工峰,例如由噪音、柱出血和BSTFA衍生化过程引起的峰。代谢物通过与我们内部图书馆的参考标准进行比较进行注释。商用质谱数据库,如2010年NIST文库和LECO/Fiehn代谢组学文库,也用于附加的化合物注释(相似度阈值为70%)。质谱数据经过log2变换,并通过自动缩放进行归一化。
统计分析
所有结果以至少三个独立样本的平均标准差表示。使用学生测试计算两组之间的比较。分析两组间的统计学差异,p %3C 0.05时差异显著。
结果
Rrm2b肾特异性敲除小鼠模型的建立及特征
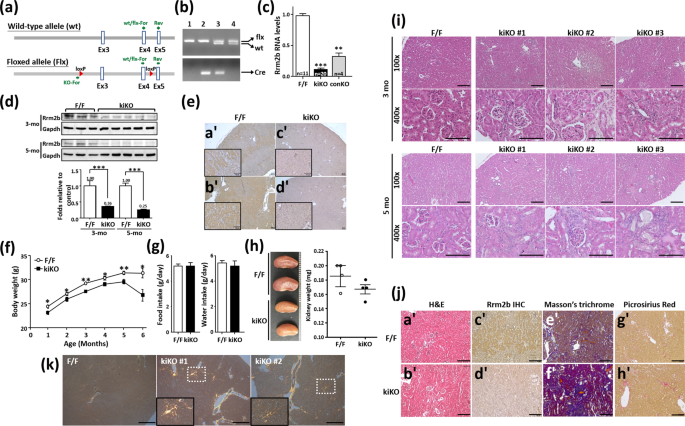
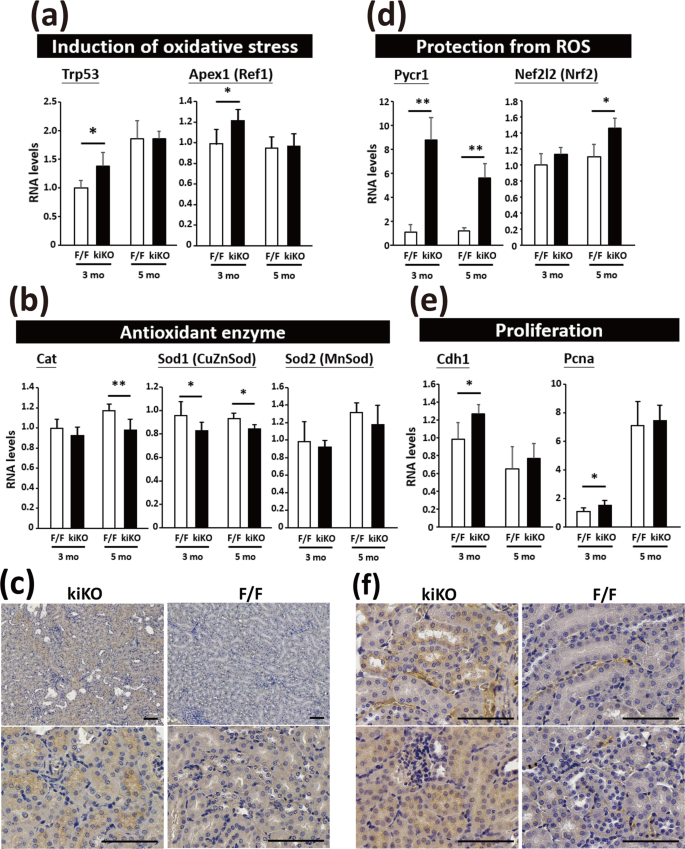
肾皮质的管状细胞富含线粒体,用于产生能量和维持管状功能。为了研究Rrm2b在肾功能中的作用,我们制备了肾小管上皮细胞特异性Rrm2b敲除小鼠(Rrm2bflx/flx;Cdh16-Cre/+,缩写为Rrm2b kiKO)(图1a,b)。蛋白质印迹分析、定量实时聚合酶链反应和IHC染色表明,Rrm2b在正常肾小管细胞中大量表达,在Rrm2b kiKO小鼠中大多不表达(图1)。1c–e)。Rrm2b kiKO雄性小鼠在1至6个月大时表现出明显的生长迟缓(图1f),而食物和水的日摄入量没有减少(图第一代)。对血清生化指标进行了监测,结果显示Rrm2b kiKO小鼠与对照组间无明显差异flx/flx3个月和6个月大的小鼠(补充图S1a–f)。尿液生化数据也没有显示出明显的变化,除了酸碱度的下降相对。Rrm2b F/F,酸碱度= 6.25,p = 0.026),6个月大的kiKO小鼠的酮浓度比Rrm2b F/F小鼠略有增加。(表格1)。然而,禁食后,删除Rrm2b的小鼠显示出略低的血清胰岛素水平,但不显著。此外,删除Rrm2b的模型和对照组小鼠之间的血糖和空腹血糖水平没有显著差异(补充图S1g–I)。在Rrm2b kiKO小鼠中发现苍白和较小的肾脏(图1h)。在Rrm2b kiKO小鼠的肾皮质中观察到小管扩张和退化以及损伤诱导的炎症(图1i,S2a,b)。在Rrm2b缺失的雌性小鼠中也观察到明显的炎症迹象(补充图S2c)。在Rrm2b kiKO小鼠的肾脏中也观察到胶原的边缘积累(图1j)。此外,用偏振对比照明观察天狼星红切片,表明胶原增生在Rrm2b kiKO肾中占主导地位(图。1k)。肾脏中观察到的缺陷很可能是Rrm2b缺乏导致肾功能随年龄而恶化的结果。Rrm2b也被证明参与降低活性氧活性以减少氧化应激。我们的数据显示Rrm2b缺失导致活性氧相关基因的表达增强,例如转化相关蛋白53(Trp53)和无嘌呤/无嘧啶核酸内切酶1(Apex1/Ref1)(图2a),并降低抗氧化剂如过氧化氢酶(猫)和超氧化物歧化酶1(Sod1)(图2b),在Rrm2b kiKO肾脏中相对于对照Rrm2b F/F肾脏。氧化应激标记物4-HNE是脂质过氧化的副产物,被发现在Rrm2b敲除肾组织中具有显著增加的表达水平(图1)。2c)。有趣的是,Pycr1Rrm2b kiKO小鼠的表达显著增加,核因子红细胞衍生2样2(Nef2l2或者Nrf2)也观察到(图2d)。我们还发现诱导表达与细胞增殖相关的基因,如钙粘蛋白1(Cdh1)和增殖细胞核抗原(Pcna)(图2e),并且用ki67的IHC染色证实细胞增殖增加(图2f)。因此,Rrm2b缺乏不仅促进活性氧的积累,而且削弱细胞抗氧化能力。
Rrm2b肾特异性敲除小鼠的物理特征。(a)顺式中两个loxP位点的位置和用于基因分型的引物,以验证Rrm2b杂合、野生型和敲除等位基因。(b)用聚合酶链反应对杂合和野生型等位基因进行基因分型。样品1的基因型为野生型(+/+);样品2基因型为Cdh 16-Cre/+;样品3基因型为Rrm2b KiKo(Rrm2b flx/flx;CHD 16-Cre/+);样品4的基因型为Rrm2b flx/flx(f1/f1)。(c)定量实时聚合酶链反应分析小鼠肾脏中的Rrm2b。conKO,Rrm2b常规敲除小鼠。(d)rm2b kiKO和对照组小鼠肾脏中rm2b蛋白印迹分析。图像J软件定量蛋白质印迹分析。(e)罗氏沼虾和对照组小鼠肾脏中罗氏沼虾的IHC染色。老鼠年龄在(c–e),2个月大。比例尺,100μm。(f)体重检查。这些数据是从1-6个月大的雄性小鼠身上收集的(每组8-30只)。(g)使用代谢笼监测食物和水的摄入。每组共有10只小鼠用于实验。(h)Rrm2b kiKO和F/F(对照)小鼠肾脏的大体视图和定量质量。㈠F/F(对照)和Rrm2b kiKO小鼠肾脏的H&E染色。(j)胶原蛋白的积累与Rrm2b缺失有关:(a’、b’)H & E染色,(c’、d’)Rrm2b IHC染色,(E’、f’)马森三色染色,(g’、H’)胡黄连红色染色。(k)胡黄连红色照片的偏振对比度。放大图显示胶原积聚的位置。小鼠年龄,5-6个月大。比例尺,100 μm。结果显示为平均值标准差。* p % 3C 0.05;* * p % 3C 0.005;***p %3C 0.001。
Rrm2b肾特异性敲除小鼠肾脏活性氧和细胞增殖升高。(a)诱导氧化应激相关基因或相关基因的基因表达水平。Trp53转化相关蛋白53;Apex1(参考文献1),无嘌呤/无嘧啶核酸内切酶1。(b)抗氧化防御相关酶的基因表达水平。猫、过氧化氢酶;Sod1(CuZnSod),超氧化物歧化酶1,可溶性;Sod2(MnSod),超氧化物歧化酶2,线粒体。(c)氧化应激标记物4-HNE的IHC染色表明组织部分有氧化损伤。(d)的基因表达水平Pycr1吡咯啉-5-羧酸还原酶1和Nef2l2(Nrf2),核因子,红细胞衍生2,像2。(e)细胞增殖相关基因的基因表达水平。Cdh1钙粘蛋白1;Pcna增殖细胞核抗原。(f)Rrm2b kiKO和3个月龄对照小鼠ki67的IHC染色。比例尺,100μm。结果显示为平均值标准差。* p % 3C 0.05;**p %3C 0.005。
Rrm2b缺失导致线粒体功能缺陷
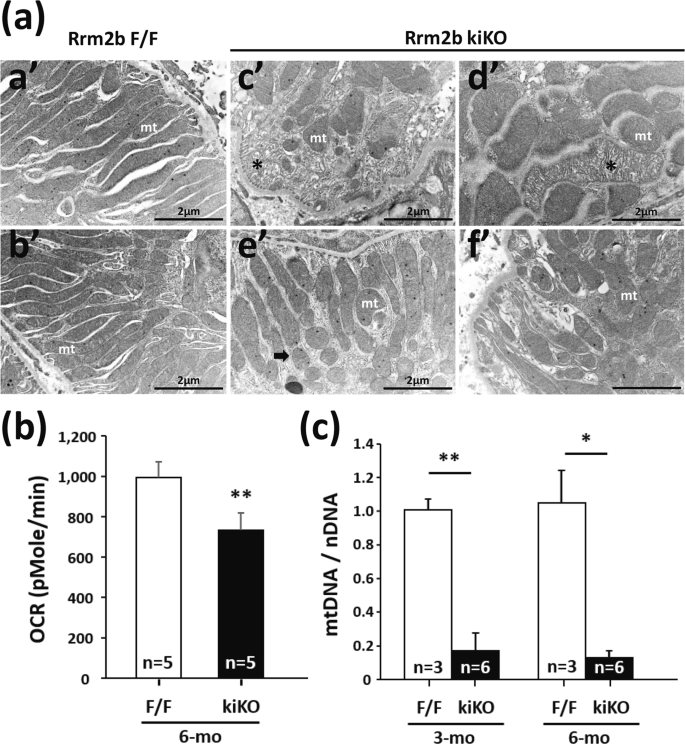
野生型肾脏近端肾小管细胞中的线粒体表现出典型的基底条带特征(图3a)。在Rrm2b kiKO小鼠中,近端肾小管细胞中发现破碎和退化的线粒体(图3a),尽管与线粒体融合和分裂相关的基因在Rrm2b kiKO和F/F小鼠之间没有显示明显的表达水平差异(补充图s3a–c)。这些数据表明,Rrm2b缺失导致线粒体崩溃,这不是由于线粒体融合和分裂的影响。肾功能的维持高度依赖于线粒体能量的产生。我们发现Rrm2b缺失导致耗氧量下降(图3b),这会极大地阻碍线粒体中的能量产生。此外,Rrm2b敲除肾组织中线粒体数量显著减少(图3c)。这些数据提供了支持Rrm2b在线粒体内环境稳定中发挥重要作用的观点的证据。
Rrm2b kiKO小鼠线粒体相关代谢的缺陷
为了系统了解Rrm2b缺失对肾脏的影响,我们对Rrm2b kiKO和F/F小鼠的肾脏进行了代谢谱分析。气相色谱-飞行时间质谱分析共鉴定出126种代谢物;其中,13种代谢物在Rrm2b kiKO小鼠中的浓度较低,14种代谢物在对照小鼠中的浓度较高(表2;补充表格S1)。在Rrm2b kiKO肾中,葡萄糖6-磷酸(糖酵解和戊糖磷酸途径的重要中间体)的水平比对照肾中的水平增加(2.6倍),甘油3-磷酸和甘油浓度也比对照肾中的水平增加(分别为1.27倍和1.88倍),可能通过甘油生成。当检测甲硫氨酸和半胱氨酸代谢物时,发现Rrm2b kiKO小鼠的同型半胱氨酸、高丝氨酸和丝氨酸浓度比对照小鼠低(分别为0.84、0.52和0.77倍),二甲基甘氨酸高(1.27倍)。柠檬酸循环(TCA循环)的两个关键底物,氧戊二酸和琥珀酸,在Rrm2b缺失肾中的浓度也比对照肾低(分别为0.74倍和0.78倍)。最后,在Rrm2b kiKO小鼠中发现咖啡因代谢物7-甲基黄嘌呤的浓度(1.72倍)高于对照组小鼠(补充表S1)。
Rrm2b kiKO小鼠关键代谢基因表达的改变
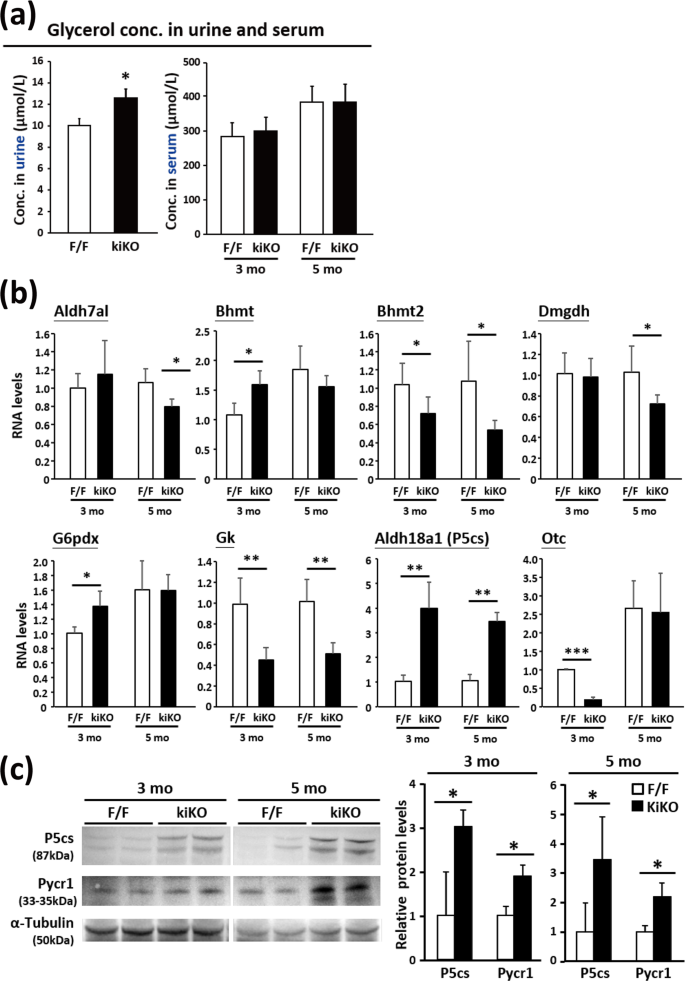
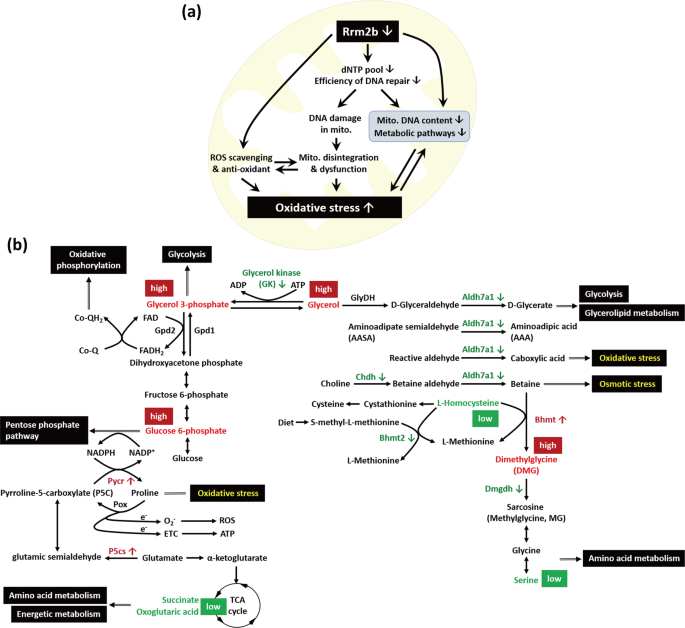
Rrm2b缺乏导致线粒体代谢物浓度的变化;因此,我们想知道参与这些酶活性的基因是否也影响Rrm2b kiKO小鼠。我们搜索了公共数据库MGI-小鼠基因表达数据库(GXD),并鉴定了342个基因,这些基因被注释为在肾皮质中表达,这得到了核糖核酸的证实就地,就地记者(敲入),IHC,蛋白质印迹,逆转录聚合酶链反应和/或northern印迹分析。线粒体保护蛋白、靶向蛋白、线粒体命运蛋白和有丝分裂原蛋白的预测分数被用作线粒体定位的证据。在342个基因中,67个编码候选线粒体蛋白(补充表S2)。我们使用KEGG途径作图工具来说明前15个代谢途径,包括最高数量的候选线粒体蛋白和差异丰富的代谢物(补充表S3)。使用小鼠代谢途径(map mmu01100)作为概述,我们观察到一些途径突出显示了酶和代谢化合物,一些途径在途径图中彼此非常接近(补充图。第四心音)。一些必需代谢物和相关酶显示Rrm2b缺失肾的显著变化。这些代谢物和酶参与重要的生物途径,如甘油脂代谢;甘氨酸、丝氨酸和苏氨酸代谢;糖酵解;氧化磷酸化;戊糖磷酸途径;和其他氨基酸代谢途径。我们进行了酶联免疫吸附试验,并证实与对照组小鼠相比,Rrm2b kiKO小鼠的尿液中甘油浓度升高,但血清中甘油浓度没有升高(图4a)。在图中4b,我们表明醛脱氢酶家族7成员A1(Aldh7a1),甜菜碱-同型半胱氨酸甲基转移酶2(Bhmt2),二甲基甘氨酸脱氢酶前体(Dmgdh)和甘油激酶(Gk)负责糖酵解,甘油脂和氨基酸代谢被抑制。有趣的是Bhmt表达导致高水平的二甲基甘氨酸(DMG)在Rrm2b缺乏条件下观察到的(图4b,补充表S1)。此外,上述途径下游的一些酶,如葡萄糖-6-磷酸脱氢酶的X-连接(G6pdx);醛脱氢酶18家族,成员A1(Aldh18a1,也称为P5cs吡咯啉5羧酸合酶/吡咯啉5羧酸脱氢酶);和鸟氨酸转氨基淀粉酶(Otc),被提升(图4b)。也有酶在Rrm2b kiKO和氟/氟小鼠之间没有明显的表达差异(补充图表面抗原-5)。最后,P5C和Pycr1的蛋白表达水平与基因表达水平相似(图4c)。所有这些结果表明Rrm2b缺失影响肾脏线粒体代谢活动。
Rrm2b缺乏对线粒体相关代谢的影响。(a)使用甘油检测试剂盒测量尿液和血清中的甘油浓度。(b)线粒体相关代谢中关键基因表达水平的量化。(c)3个月和5个月龄Rrm2b kiKO和WT小鼠P5C和Pycr1蛋白印迹分析。α-微管蛋白表达水平作为定量P5C和Pycr1表达的内部控制。Aldh7a1醛脱氢酶家族7,成员A1;Aldh18a1醛脱氢酶18家族成员A1(也称为P5cs吡咯啉5羧酸合酶);Ass1精氨酸琥珀酸合酶;Bhmt甜菜碱-同型半胱氨酸甲基转移酶;Bhmt2甜菜碱-同型半胱氨酸甲基转移酶2;Cbs胱硫醚β合酶;三己糖酰基鞘氨醇胱硫醚γ裂解酶;Dld二氢脂肪酰胺脱氢酶;Dmgdh二甲基甘氨酸脱氢酶前体;G6pdx,葡萄糖-6-磷酸脱氢酶的X-连接;Gk甘油激酶;Gss谷胱甘肽合酶;Idh异柠檬酸脱氢酶;Mdh苹果酸脱氢酶;地铁,5-甲基四氢叶酸-同型半胱氨酸甲基转移酶;Otc鸟氨酸转氨基淀粉酶;肮脏山梨醇脱氢酶。所有结果均以标准差表示。* p % 3C 0.05;* * p % 3C 0.005;***p %3C 0.001。
讨论
Rrm2b在核基因组脱氧核糖核酸修复和线粒体基因组脱氧核糖核酸的复制和修复中起着关键作用26。此外,Rrm2b具有清除活性氧的能力,以防止氧化应激10。Rrm2b缺陷的人和小鼠模型显示脱氧核糖核酸(脱氧核糖核酸)池和脱氧核糖核酸(脱氧核糖核酸)修复效率明显下降,导致核和线粒体脱氧核糖核酸(脱氧核糖核酸)严重受损4,9。此外,Rrm2b的缺失导致活性氧清除和抗氧化能力下降,线粒体结构受损,线粒体功能受损加剧。所有这些效应都会加速生物体的细胞氧化应激(图5a)。
在这项研究中,我们建立了肾小管上皮细胞特异性Rrm2b敲除模型,并显示Rrm2b缺失影响线粒体脱氧核糖核酸的完整性和代谢,导致氧化损伤升高。通过结合代谢组学和实验结果,我们阐明了受Rrm2b缺失影响的途径(图5b)。Gk是一种线粒体结合酶,在肾脏和肝脏中大量表达,并催化三磷酸腺苷和甘油形成甘油3-磷酸酯27。我们的数据表明,线粒体呼吸缺陷导致的能量产生减少导致甘油3-磷酸和葡萄糖6-磷酸水平升高,从而触发能量产生途径,如氧化磷酸化和糖酵解。此外,戊糖磷酸途径也可以被激活以产生更多的核苷酸用于脱氧核糖核酸修复。Aldh7a1(也称为抗quitin)存在于细胞质、细胞核和线粒体中,在肾、肝和脑中高度表达。在生物化学上,醛脱氢酶7a1催化D-甘油醛转化为可以进入糖酵解途径的D-甘油酸。醛脱氢酶7a1也可以将甜菜碱醛代谢为甜菜碱,以抵消高渗胁迫28,29。此外,Aldh7a1可以减弱渗透胁迫诱导的细胞凋亡。然而,Rrm2b缺失导致Aldh7a1表达减少,并诱导极端氧化应激和渗透应激。Bhmt和Dmgdh在肾皮质的近端小管中表达30,31。这两种蛋白在Rrm2b缺乏条件下的异常表达导致DMG积累和左旋同型半胱氨酸(Hcy)和丝氨酸水平下降,从而扰乱氨基酸代谢(图5b)。
Pycr和P5cs表达水平的增加促进脯氨酸的生成,间接增强活性氧的生成,同时降低TCA循环通量32。与对照组(Rrm2b F/F)相比,Pycr1和P5C在Rrm2b kiKO小鼠中的表达分别显著增加了8倍和4倍,而将脯氨酸转化为P5C的脯氨酸氧化酶(Pox)在表达上无明显差异。脯氨酸生物合成基因的上调可触发谷氨酰胺向脯氨酸的转化,并将NAD(P)H氧化为NAD(P) +分子。由Rrm2b缺失引起的Pycr1和p5c的激活可能是细胞用来对抗活性氧生成增加的一种补偿机制。
表型及相关机制
根据我们的研究,肾小管细胞中Rrm2b的缺失导致了小鼠的几种病理缺陷。此外,这些缺陷随着年龄的增长而加剧,如前所述,一些缺陷类似于在人类疾病中观察到的缺陷。
尿液酸碱度的变化
近端小管通过分泌氨和重新吸收过滤后的碳酸氢盐来调节酸碱平衡。尿液生化分析显示,6个月大的Rrm2b kiKO小鼠的酸碱度较低,而年轻小鼠的酸碱度则较低;因此,我们假设Rrm2b缺失可能诱发2型肾小管酸血症,也称为近端肾小管酸血症33,34。患有这种疾病的人类患者肾脏和肠道有碳酸氢盐重吸收缺陷。小鼠Rrm2b缺乏导致代谢缺陷、肾小管功能丧失,并可能损害近端肾小管细胞对尿液中碳酸氢盐的重吸收。
线粒体缺陷介导氧化损伤
肾脏极易受到活性氧诱导的损伤。此外,近端肾小管细胞有丰富的线粒体,主要依靠氧化磷酸化获得能量;因此,它们对活性氧诱导的损伤非常敏感,例如突变、凋亡和线粒体-脱氧核糖核酸相关的功能缺陷35。虽然在汉勒环和收集管中Rrm2b缺乏的影响大部分是未知的,但是线粒体介导的氧化损伤可能导致汉勒环和收集管中的病理变化。过去的研究表明,增强Rrm2b的表达可以降低正常和氧化损伤条件下的氧化应激6,12。我们的数据显示肾小管细胞中Rrm2b的缺失导致氧化应激增加和抗氧化能力下降,从而导致形态和功能性线粒体缺陷。此外,暴露于氧化应激可以触发Pycr1的表达增加36,37的确,我们在Rrm2b kiKO模型中发现了另一种氧化应激诱导基因Pycr1和Nrf2的增强表达。这表明Rrm2b缺失导致肾脏氧化损伤。Pycr1的关键功能之一是在氧化损伤条件下维持线粒体功能和完整性14,37。然而,Pycr1和其他应激诱导基因的补偿作用不足以抵消和保护线粒体在Rrm2b缺失条件下免受氧化损伤。此外,抗氧化机制受损和活性氧清除减少会导致氧化损伤和线粒体崩溃。
线粒体代谢受损
不平衡的新陈代谢通常会导致代谢物超载,伴随着细胞损伤和整体细胞压力的累积。乙醛7a1保护细胞免受渗透胁迫,从而通过代谢有毒醛类产生NAD(P)H来减弱渗透胁迫诱导的氧化胁迫,这有助于恢复细胞氧化还原平衡29。在Rrm2b缺乏的条件下,Aldh7a1表达水平的降低降低了羧酸和甜菜碱的产生,这间接阻断了导致氧化应激和渗透应激的途径。在对严重应激的反应中,Rrm2b缺失肾脏的代偿机制可能被激活。一个这样的机制是脯氨酸的产生和积累,通过P5C和Pycr的上调。据报道,脯氨酸还能防止氧化应激,其在细胞中的积累是对生理应激的反应36。另一种细胞补偿机制是增强Bhmt和降低Dmgdh表达,这两种机制都会导致肾脏中二甲基甘氨酸的积累和同型半胱氨酸的消耗,从而减少高水平同型半胱氨酸引起的氧化损伤。以前的报告表明,高半胱氨酸是一种对高浓度组织有毒的化合物38。因此,细胞中Rrm2b的丢失导致氧化应激升高和代谢活动失调,随后激活某些替代性补偿途径来抵消氧化损伤。
Rrm2b在肾脏中的重要性
线粒体提供三磷酸腺苷,这是全身关键细胞功能所必需的,特别是在高度能量依赖的器官中。肾脏需要大量能量来过滤矿物质和其他物质,进行管状再吸收,并将尿液排出体外。肾近端小管有丰富的线粒体来支持离子转移,如钠离子的转移+-K+腺苷脱氨酶泵。该研究表明,Rrm2b不仅介导线粒体基因复制和修复,而且对线粒体功能完整性和代谢活动的维持也至关重要。使用Rrm2b缺陷(Rrm2b kiKO)小鼠模型,我们认为Rrm2b对肾脏的正常功能至关重要。