摘要
背景
据报道,铜代谢MURR1 (COMM)结构域家族在肿瘤发生中发挥重要作用。作为COMMD家族的原型,COMMD6在人类肿瘤中的表达模式和生物学功能仍然未知。
方法
用实时聚合酶链反应和免疫组织化学方法检测BALB小鼠和人组织中的COMMD6表达。Kaplan–Meier分析用于评估COMMD6在肿瘤中的预后。竞争内源性核糖核酸(ceRNA)和转录调控网络是基于癌症基因组图谱数据库中差异表达的核糖核酸、微小核糖核酸和长非编码核糖核酸构建的。GO和KEGG富集分析用于探索生物信息学的含义。
结果
在BALB小鼠和人组织中广泛观察到COMMD6的表达,其可预测癌症患者的预后。此外,我们通过构建头颈部鳞状细胞癌TEX41-miR-340-COMMD6 ceRNA网络和胆管癌miR-218-CDX1-COMMD6转录网络阐明了COMMD6潜在的肿瘤促进作用和机制。此外,COMMD6可能调节核因子κB亚单位的泛素化和降解,调节肿瘤中核糖核蛋白和剪接体复合物的生物发生。
结论
这项研究可能有助于阐明COMMD6在人类肿瘤中的功能和机制,为肿瘤预防和治疗提供潜在的生物标志物。
背景
癌症的发病率和死亡率在世界范围内迅速增长。全球癌症负担进一步加重,2018年估计有1 810万新癌症病例和960万癌症死亡,是死亡的主要原因。全球75岁前罹患或死于癌症的累积风险分别为21.4%和17.7%。1因此,癌症的预防和治疗已成为当今紧迫的全球性挑战。
恶性肿瘤的发生和发展是一个多步骤、多阶段的复杂过程。2癌症发展的标志包括维持增殖信号、逃避生长抑制剂、抵抗细胞死亡、实现复制永生、诱导血管生成以及激活侵袭和转移。3基因失调,如癌基因的激活和肿瘤抑制基因的失活,是人类癌症的一个共同特征,并参与了这些特征中的每一个。4,5因此,更好地理解肿瘤驱动的关键基因将有助于在分子水平上阐明肿瘤发生的机制,并提高恶性肿瘤的准确预防和治疗。
COMM结构域家族,包含10个家族成员,在其极端羧基末端共享一个高度保守的结构域,6据报道在肿瘤发生中起重要作用。作为COMMD家族中最具特征的成员,COMMD1通过抑制SOD1诱导人肺癌细胞凋亡。7COMMD1核表达的增加抑制了细胞周期蛋白D1的表达,神经母细胞瘤细胞的细胞增殖。8此外,COMMD1的过表达通过直接靶向缺氧诱导因子抑制结直肠癌、胶质母细胞瘤和黑色素瘤细胞的侵袭和转移。9还发现COMMD1的核表达使卵巢癌对顺铂敏感,10下调COMMD1通过调节正反馈回路来促进肿瘤的发展,正反馈回路放大癌细胞的炎症和干细胞相关特性。11此外,COMMD5通过启动子甲基化促进ErbB2/HER2的去磷酸化以及EGFR和ErbB3的表观遗传基因沉默来抑制肾细胞癌。已发现COMMD7通过上调PIAS4来促进细胞迁移和肝细胞癌的侵袭12或CXCL10。13还发现抑制COMMD7通过减少基质金属蛋白酶2分泌来抑制胰腺导管腺癌的侵袭。14COMMD9通过与TFDP1的相互作用促进TFDP1/E2F1的激活和非小细胞肺癌的进展。15此外,我们先前已经显示了COMMD10在人类肿瘤中的表达谱16并且发现COMMD10通过促进NF-kB的泛素化和降解来抑制结直肠癌的侵袭和转移。17
作为COMMD家族的原型,COMMD6主要由COMMD结构域形成,COMMD结构域是COMMD蛋白的一个区域,对多种生物功能至关重要。18文昌鱼的COMMD6与肌酸激酶形成异二聚体,导致肌酸激酶活性和能量转换的抑制。19COMMD6与内体的亚室中的WASH复合体和逆转录酶共定位,并参与受体内体分类中的CCC-WASH轴。20此外,还报道了COMMD6参与抑制HEK-293细胞中的NF-κB途径活性。转录因子κB的激活可以通过转录因子6 COMMD结构域中Trp24和Pro41氨基酸残基的突变而被完全消除。21在许多人类癌症中已经观察到NF-κB信号通路的异常激活,其诱导肿瘤无限生长和发展。22因此,我们假设COMMD6可能与肿瘤发生和恶性进展有关。然而,COMMD6在肿瘤中的组织特异性表达、生物学功能和可能的机制仍然未知。在此,我们提供了COMMD6在各种组织中的表达谱数据和生物预测信息,这有助于阐明其在各种人类肿瘤中的功能和临床价值。
方法
人类标本收集
共收集了100例胃、肾、乳房、结肠、食管、子宫内膜、胎盘、宫颈上皮、肝和肺组织,没有肿瘤细胞。此外,从2016年1月至2017年1月在广州南方医院接受手术切除的25例肝脏、20例结肠、15例乳房、10例肾脏、8例胃、5例膀胱、5例肺和5例食道癌患者中采集人类配对肿瘤和正常组织。这些病人都没有在手术前接受放疗、化疗、生物免疫治疗或多次手术。用于研究目的的组织收集得到南方医院伦理委员会的批准。
小鼠和组织制备
六只雄性BALB/c小鼠(4周龄,每只小鼠18-20克)购自南方大学动物科学中心实验室(中国广州)。实验动物的使用得到了南方医科大学动物护理和使用机构委员会的批准。在实验室的特定无病原体(SPF)级房屋中,用无菌水和饲料喂养BALB/c小鼠。所有小鼠在含有异氟醚的室中麻醉,然后通过颈椎脱位处死。取不同的器官和组织进行随后的实时聚合酶链反应和免疫组织化学检查以检测COMMD6。剩余的组织储存在80℃供以后使用。
实时聚合酶链反应
根据已建立的协议,使用Trizol试剂(Invitrogen,美国)从组织样品中提取总核糖核酸。引物逆转录试剂盒(完美实时,Takara)用于产生检测COMMD6的cDNA。用定量实时聚合酶链反应(qRT-PCR)检测试剂盒(GeneCopeia)分析COMMD6的表达水平。COMMD6的引物序列(智人):前进:5′-GGAAACTTGGGTATGGCTGTGA-3′,后退:5′-tgtgGAATCTCATTTC AAAGCA-3′。COMMD6的引物序列(小家鼠):前进:5′-CAAGTATCTTAGGGAGG-3′,后退:5′-TGGAATTTGTCATCTGG ATGGA-3′。使用比较Ct方法计算相对COMMD6水平(δδCt)。
免疫组织化学(IHC)试验
将组织固定在4%多聚甲醛中,通过分级酒精脱水,包埋在石蜡中,并切成4个微米切片。切片用二甲苯脱蜡,并通过分级醇水合成水。抗原回收通过在10毫摩尔/升柠檬酸盐缓冲液(酸碱度= 6.0)中在100℃沸腾10分钟来进行。然后将切片与COMMD6抗体(AB42937,脓肿,中国)在4℃孵育过夜。然后施用辣根过氧化物酶缀合的抗山羊二级抗体(DakoCytomation,Glostrup,丹麦),并在室温孵育1小时。可视化信号由3,3-二氨基联苯胺四盐酸盐染色产生,用苏木精复染,用中性香脂密封,并在显微镜下观察(奥林巴斯,日本)。COMMD6的表达计算为染色肿瘤细胞的阳性百分比和染色强度的总和。阳性百分比得分为“0”,0%;“1”,1–25%;“2”,26-50%;“3”,51–75%和“4”,3E75%。染色强度分为“0”(无染色)、“1”(弱染色)、“2”(中度染色)和“3”(强染色)。细胞的阳性百分比和染色强度都是以双盲方式确定的。COMMD6的染色评估如下:(1)表示最终染色分数为% 3C3(+)最终染色分数为3;(+++)最终染色分数为4,而(+++)最终染色分数≥5。
系统发育分析
进化史是用邻居连接法推断的。显示了分支长度之和= 8.68230306的最佳树。在自举测试(1000次复制)中相关分类群聚集在一起的复制树的百分比显示在分支旁边。树是按比例绘制的,分支长度与用来推断系统进化树的进化距离单位相同。进化距离使用泊松校正方法计算,单位为每个位点的氨基酸替换数。这项分析涉及17个智人从Uniprot数据库中获得的氨基酸序列。对于每个序列对,所有不明确的位置都被移除(成对删除选项)。最终数据集中共有257个位置。进化分析在MEGA X中进行23
COMMD6的生物信息学挖掘
利用基因卡片数据库(https://www.genecards.org/)。在Uniprot数据库(https://www.uniprot.org/)并用Illustrator绘制生物序列软件(IBS,http://ibs.biocuckoo.org/)。应用DNAMAN软件(LynnonBiosoft,美国)比较人类和其他物种的COMMD6蛋白序列。使用UCSC数据库(https://genome.ucsc.edu/)。使用CCLE数据库(https://portals.broadinstitute.org/ccle)。COMMD6在人类肿瘤细胞系中的突变用宇宙数据库(https://cancer.sanger.ac.uk/cosmic)。基于癌症基因组图谱(TCGA),使用基因工程学会数据库(http://gepia.cancer-pku.cn/index.html)。
使用miRanda、miRDB、miRwalk、DIANAmT和Targetscan数据库预测微RNA。LncRNAs是使用DIANA数据库预测的。使用GCBI数据库(https://www.gcbi.com.cn)。ceRNA网络是使用胞嘧啶软件构建的。差异表达的microRNAs、LncRNAs、TFs和COMMD6共表达基因的热图是使用R 3 . 5 . 3版中的“limma”、“edgeR”、“pheatmap”和“ggplot2”软件包(奥地利维也纳统计计算基金会;http://www.r-project.org/)。此外,生物过程(BP)、细胞成分(CC)、分子功能(MF)和京都基因和基因组百科全书(KEGG)途径的基因本体(GO)富集分析由R软件使用“集群剖析器”(clusterProfiler)、组织生成。Hs.eg.db、“enrichplot”和“ggplot2”包。
统计分析
所有的数据都用软件进行了分析。学生的t-试验用于两组之间的比较,并且单向方差分析(ANOVA)随后的LSD比较试验用于至少三组之间的比较。非参数检验用于分析各种肿瘤中COMMD6的IHC分数。用皮尔逊相关法对COMMD6进行相关分析。这P-值%3C0.05被认为具有统计学意义。
结果
COMMD6的结构和系统发育保守性分析
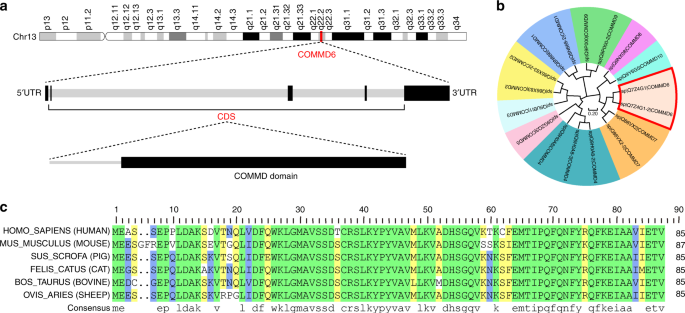
COMMD6基因位于13q22.2,基因结构包括5’UTR外显子、3个CDS外显子、3’UTR外显子和4个内含子。铜代谢基因MURR1结构域(COMMD)的存在是COMMD6蛋白结构的特征(图。1a)。为了探索COMMD6在分子和物种进化中的保守性,我们将COMMD6编码的蛋白质序列与其他COMMD家族蛋白质和哺乳动物物种进行了比较。系统发育分析结果显示智人COMMD家庭成员被分成三组。集群1包括命令2、命令3、命令4和命令5。COMMD6以及COMMD7、COMMD8和COMMD10被分类为集群2。集群3包括命令1和命令9(图1b)。序列比较表明智人COMMD6与共享84、85、88、88和87%的身份小家鼠,Sus scrofa,Felis catus,牛和奥维斯白羊座,表明COMMD6在哺乳动物中高度保守(图1c)。
COMMD6的基因结构和系统发育保守性分析。aCOMMD6的染色体位置(用红线突出显示)显示在顶部面板中。COMMD6的基因结构显示在中板。黑框代表外显子,灰框代表内含子。COMMD6的蛋白质结构如图所示(黑框代表COMMD结构域)。b的进化树智人包括COMMD6在内的COMMD家族蛋白(用红色框突出显示)。树是按比例绘制的,分支长度与用来推断系统进化树的进化距离单位相同。进化距离使用泊松校正方法计算,单位为每个位点的氨基酸替换数。cCOMMD6蛋白序列的比对分析智人(UniProtKB-Q7Z4G1),小家鼠(UNIProkB-Q3V 4 B5)。Sus scrofa(UniProtKB-A0A286ZXE0),Felis catus(UniProtKB-M3WUJ0),牛(UniProtKB-Q2KIY)和Ovis白羊座(UniProtKB-W5Q264)。这些序列中每个氨基酸残基的保守程度表示为绿色(100%保守)、黄色(75%保守)和蓝色(50%保守)
COMMD6在BALB小鼠组织中的生物学分布和表达
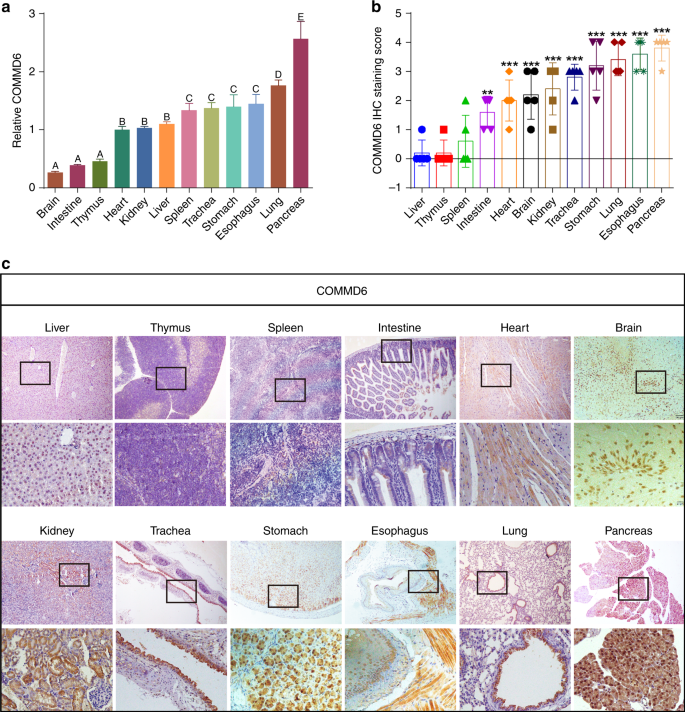
BALB/c小鼠是研究肿瘤发展和进展机制最常用的实验动物。我们首先检测了6只BALB小鼠12种不同组织样品中COMMD6的基因表达。如图所示2a在qPCR分析检测的所有组织中均表达COMMD6基因。不同的字母代表显著的差异(P%3C 0.01),而具有相同字母的组织显示没有差异(P%3E 0.05)。COMMD6基因在胰腺中的相对表达明显高于其他组织。肺组织的COMMD6基因表达水平高于食管、胃、气管和脾组织(P%3C 0.05)。COMMD6基因在脾脏的表达高于肝脏、肾脏和心脏。COMMD6基因在脑、肠和胸腺组织中的表达明显低于其他组织(P%3C 0.05)。
用免疫组织化学(IHC)法进一步检测了COMMD6在BALB/c小鼠组织中的表达水平和分布。如图所示2b,c在不同类型的组织中发现不同的COMMD6表达水平。胰腺腺泡上皮细胞胞浆和细胞核呈强阳性染色。在肺中,支气管上皮在细胞质和细胞核中呈现强阳性染色,而在肺泡上皮细胞中未发现染色。食管鳞状上皮细胞细胞核呈中度至强阳性染色,平滑肌细胞胞浆呈强阳性染色。胃腺细胞的细胞质和细胞核中发现中度至重度染色。肾小管上皮细胞在细胞质中表现出强烈的染色,而肾小球上皮细胞中未检测到染色。气管粘膜在细胞质中呈强染色,透明软骨软骨细胞在细胞质中呈中度阳性染色。脑神经元表现出强染色,而心肌纤维在细胞质中表现出弱染色。肠的腺上皮细胞在细胞质中表现出弱染色。IHC在脾脏、胸腺和肝组织中未检测到明显的COMMD6染色。
COMMD6在人体正常组织中的生物分布和表达
为了探讨COMMD6在人体正常组织中的生物分布和表达,我们用IHC法检测了10种不同类型的人体正常组织中的COMMD6(图1)。3a)。COMMD6在肾小管上皮细胞的细胞质中强烈表达。在肝脏中,COMMD6染色在肝细胞细胞质中呈强阳性,部分在细胞核中表达。在乳腺中,COMMD6在腔上皮细胞的细胞质中强烈表达。人胃粘膜、结肠粘膜、胸腺、子宫内膜、胎盘、宫颈上皮和肺泡组织中未发现COMMD6蛋白染色。
此外,使用UCSC数据库进一步检测了COMMD6在各种人类正常组织中的表达谱(图S1)。COMMD6的表达和分布与上述IHC结果相似。COMMD6基因在人乳腺组织和肾皮质组织中高度表达。矛盾的是,COMMD6基因在肝组织中表达较低,而在IHC检测的肝标本中表达较高。COMMD6基因在结肠、肺和胃组织中表达适度,在IHC检测的相应组织中表达阴性。
人肿瘤中COMMD6的表达、拷贝数变异(CNV)、甲基化和突变
为了探讨COMMD6在人类肿瘤细胞系中的作用,首先使用癌细胞系百科全书(CCLE)数据库评估COMMD6的表达。在急性髓细胞白血病、脑膜瘤、结直肠癌和弥漫性大B细胞淋巴瘤细胞系中,COMMD6的基因表达和CNV均最高(图。S2A)。此外,COMMD6的甲基化状态在淋巴细胞恶性肿瘤中最高,在软组织癌、骨肉瘤、白血病、巨细胞瘤、尤文肉瘤和食管癌细胞系中最低(图。S2C)。宇宙数据库分析显示,COMMD6在皮肤癌、软组织癌和黑色素瘤细胞中高度突变。相反,在宫颈癌、结肠癌和直肠癌细胞中观察到罕见的COMMD6突变(图S3)。使用GEPIA数据库进一步显示了31种人类配对肿瘤和正常组织中COMMD6基因的表达水平。COMMD6基因在20种人类肿瘤中的中位表达高于相应的正常组织,如结肠直肠癌、脑低级胶质瘤和急性髓系白血病。与正常组织相比,11种肿瘤的COMMD6表达较低,尤其是肾上腺皮质癌、嗜铬细胞瘤、副神经节瘤和卵巢癌(图S4A,B)。
我们通过IHC试验进一步检测了八种人类配对肿瘤和正常组织中COMMD6蛋白的表达(图1)。3b)。COMMD6蛋白在肿瘤组织和胃、膀胱、肺和食管的相应正常组织中均呈阴性表达。相反,COMMD6在人乳腺、肝和肾正常组织的细胞质中高表达,而在相应的肿瘤组织中负表达。在结肠中,COMMD6在肿瘤组织的细胞质中高表达,而在正常粘膜中负表达。此外,IHC法检测COMMD6在肝脏和肾脏中的表达模式与GEPIA结果一致。COMMD6表达略高于正常组织,这与IHC染色观察到的结果相反。
COMMD6在人肿瘤中的临床预后意义
为了进一步评估COMMD6的预后价值,我们使用GEPIA数据库分析了COMMD6表达与患者生存的相关性。头颈部鳞状细胞癌(HNSC,P操作系统= 0.0084,小时= 1.7;P= 0.0056,心率= 2.0),胆管癌(CHOL,P操作系统= 0.05,小时= 2.7;P对于= 0.029和HR = 2.8)和肾上腺皮质癌(ACC,P操作系统= 0.0077,小时= 2.9;P= 0.0053,HR = 2.6)(图S2A–F)。相比之下,脑低级别胶质瘤患者高表达COMMD6与长操作系统和DFS相关(LGG,P操作系统= 0.0016,小时= 0.56;P= 0.0096,DFS的心率= 0.66)和葡萄膜黑色素瘤(UVM,P操作系统= 0.0085,小时= 0.30;P= 0.028,HR = 0.35)(图S6A–D)。此外,在睾丸生殖细胞肿瘤患者中,COMMD6的高表达与较长的操作系统有关(TGCT,P= 0.05,心率= 1.7E-09),甲状腺癌患者的DFS较长(THCA,P= 0.017,心率= 0.48)和子宫内膜癌(UCEC,P= 0.029,小时= 0.47)(图S6E–G)。这些数据突出了COMMD6在人类肿瘤中的预后价值。
构建一个涉及人类HNSC的欧洲核子研究中心网络
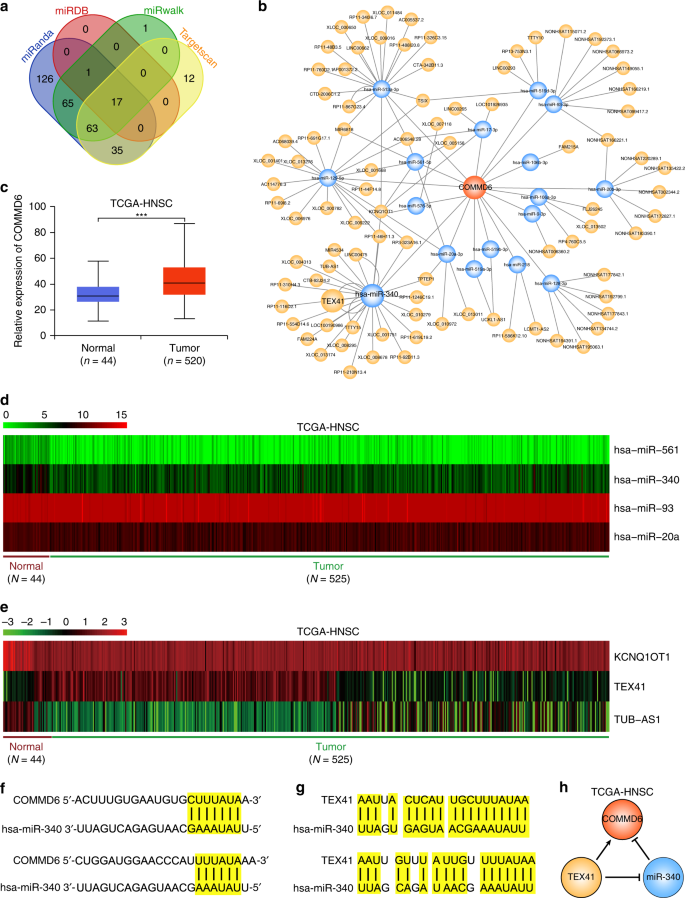
为了探索调节人类癌症中COMMD6表达的上游分子机制,我们构建了一个潜在的竞争性内源性核糖核酸(ceRNA)网络,据报道,这是一个涉及包括癌症在内的许多疾病的新的复杂调节网络。24首先,使用miRanda、miRDB、miRwalk和Targetscan数据库,如has-miR-561和has-miR-340,预测了COMMD6的17个上游微RNA(MirNas)(图。4a)。然后我们基于这些微小核糖核酸的相互作用预测了微小核糖核酸,并构建了微小核糖核酸-微小核糖核酸-通讯6 ceRNA网络(图。4b)。
为了验证预测结果,比较了从TCGA数据库获得的人类HNSC正常样本和肿瘤样本在网络中的COMMD6表达水平以及差异预测的miRNAs和lncRNAs。与正常组织相比,在肿瘤中发现明显更高水平的COMMD6(图4c),表明COMMD6在HNSC具有肿瘤促进作用。此外,与正常组织相比,肿瘤表达较高的hsa-miR-93和hsa-miR-20a,而表达较低的hsa-miR-561和hsa-miR-340(图。4d,P%3C 0.01)。肿瘤中LncRNAs KCNQ1OT1和TUB-AS1低于正常组织,而TEX41高于正常组织(图4e,P%3C 0.001)。
上述结果表明,这些差异表达基因可能在HNSC形成网络。事实上,我们发现了COMMD6和hsa-miR-340的3’非翻译区之间的互补序列(图4f)。此外,在lncRNA TEX41和hsa-miR-340之间检测到互补序列(图4g)。基于差异表达和互补结果,lncRNA TEX41可能通过抑制has-miR-340在HNSC的表达来促进COMMD6的表达(图1)。4h)。
CHOL中COMMD6转录网络的构建
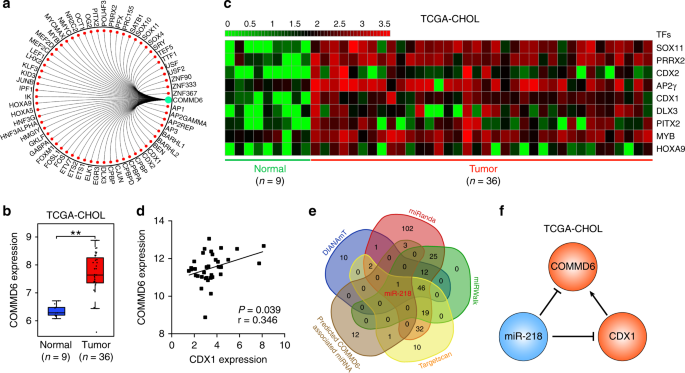
为了进一步探索COMMD6参与肿瘤进展的潜在上游机制,我们提出了一个转录调控网络和62个参与COMMD6表达调控的转录因子(图。5a)。这一监管网络在CHOL中得到了进一步验证。如图所示5b肿瘤组织中的COMMD6明显高于正常组织。与正常组织相比,肿瘤中有9种TFs显著升高(图5c,P%3C 0.01)。此外,皮尔逊分析显示CHOL中CDX1和COMMD6的表达呈正相关。5d,P= 0.039,r = 0.346)。其他八种TFs均与慢性阻塞性肺疾病的COMMD6无显著相关性(图正常人血清中的一种蛋白质成分,P%3E 0.05)。此外,我们使用DIANAmT、miRanda、miRWalk和Targetscan数据库预测CDX1的上游miRNAs,并将其与COMMD6上游的17个miRNAs进行比较。MiR-218是我们预测系统中唯一重叠的miRNA(图5e)。鉴于上述结果,我们提出COMMD6可以直接被miR-218抑制,或者间接被miR-218介导的CHOL中CDX1的抑制所抑制(图。5f)。
COMMD6下游途径的生物富集分析
为了探索COMMD6的下游途径,我们使用字符串数据库研究了COMMD6的相互作用蛋白(图6a)。此外,利用DAVID数据库进一步探讨了COMMD6及其相互作用基因的潜在作用。基因本体分析表明,它们主要是泛素连接酶复合体的成员,与翻译后蛋白修饰相关,参与泛素蛋白连接酶结合的调节(图。S8A–C)。此外,利用KEGG通路数据库预测了与COMMD6及其相互作用基因相关的潜在信号通路。结果表明,它们与泛素介导的蛋白水解信号通路的调节密切相关S8D)。
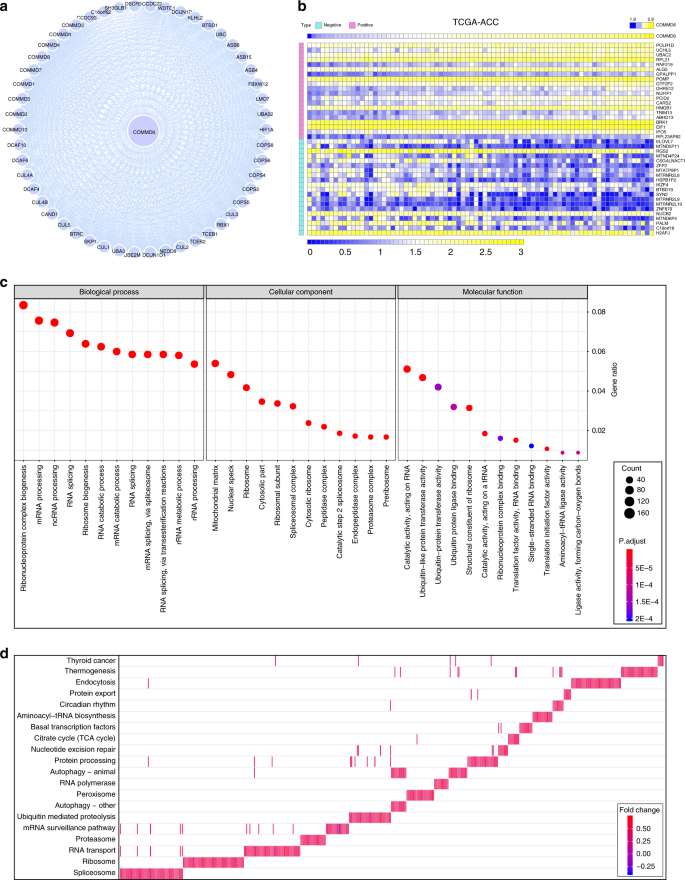
我们进一步探讨了来自TCGA数据库的COMMD6共表达基因在人ACC中的潜在作用。COMMD6的前20个阳性共表达基因和前20个阴性共表达基因如图所示。6b。GO分析表明,这些基因主要位于线粒体基质和核斑中,可能具有催化活性和泛素样蛋白转移酶活性,参与核糖核蛋白复合物的生物发生和基因加工生物过程(图。6c)。KEGG分析表明,这些基因很可能与剪接体和核糖体有关(图6d,S9A,B)。
讨论
癌症是严重威胁人类健康的恶性疾病,其发病率和死亡率在世界范围内迅速上升。1已经在许多人类癌症中观察到NF-κB信号通路的异常激活,22使其成为有希望的肿瘤治疗靶点。据报道,COMMD6通过HEK293细胞COMM结构域中的氨基酸残基Trp24和Pro41的突变完全消除NF-κB通路活性,表明COMMD6也可能在肿瘤发生和恶性进展中发挥重要作用。然而,鲜有证据表明COMMD6在肿瘤中的作用。在此,我们提供了COMMD6在多种组织中的组织特异性表达、生物学功能和可能的机制,旨在阐明其在人类肿瘤中的功能和临床价值。
在这项研究中,COMMD6在哺乳动物中高度保守,表明它在物种进化中的潜在作用。系统发育分析结果表明,COMMD6与COMMD7、COMMD8和COMMD10聚集在一起,而不是与其他COMMD家族成员聚集在一起,这表明这四个COMMD成员在进化过程中可能起着相似的作用。此外,证实COMMD7促进肝细胞癌的迁移和侵袭13我们之前的研究发现COMMD10抑制结直肠癌的转移,17反映了COMMD6在人类癌症中潜在的相似作用。
作为研究人类肿瘤最常用的实验动物,进一步研究了BALB/c小鼠COMMD6的表达和分布。COMMD6的基因和蛋白水平在胰腺、肺、食管、胃和气管组织中持续高表达,而在胸腺中低表达。COMMD6的广泛表达表明其在BALB/c小鼠组织发育中的重要作用。相反,脑组织表达的COMMD6的基因最低,但蛋白水平相对较高。我们推测,基因和蛋白质之间COMMD6表达水平的差异可能是表观遗传造成的21或者翻译后修饰25关于COMMD6,还有待调查。
我们使用GEPIA数据库进一步分析了COMMD6在人类肿瘤中的表达。10个肿瘤表达较高水平,而21个肿瘤与相应的正常对照相比显示较低水平的COMMD6 mRNA,这意味着在人类组织发育中不同的机制参与了COMMD6表达的调节。此外,用IHC检测了8种肿瘤和匹配的正常标本中COMMD6的表达,以验证GEPIA结果。然而,GEPIA数据库和我们的IHC结果在肿瘤和正常组织中COMMD6的表达有一些差异。我们推测来自TCGA数据库的GEPIA数据具有全球种族特征。种族差异可能导致完全不同的生物学特征,导致肿瘤异质性。此外,我们样本的小尺寸也可能导致COMMD6表达的偏差。更重要的是,COMMD6的表达与癌症患者的生存有关。COMMD6的高表达与HNSC、CHOL、ACC患者的生存期较短以及LGG、UVM、TGCT、THCA和UCEC患者的生存期较长相关,表明COMMD6的表达可能有助于理解这些肿瘤的病理机制并为其提供新的诊断和治疗生物标志物。
据报道,CeRNAs (lncRNAs和circRNAs)通过调节重叠的微小核糖核酸间接调节微小核糖核酸,这代表了核糖核酸串扰的一个新层,并参与人类肿瘤的发展和进展。24在我们的研究中,我们首先构建了一个基于miRNAs-COMMD6和miRNAs-LncRNAs相互作用的ceRNA网络来分析COMMD6表达调控的上游机制。此外,基于HNSC的差异表达谱进一步验证了TEX41-miR-340-COMMD6网络。众所周知,miR-340在广泛的人类肿瘤中起着肿瘤抑制剂的作用。在非小细胞肺癌中,低miR-340表达预测预后不良,并通过靶向CDK4促进细胞增殖。26在结直肠癌中,miR-340通过靶向RLIP76抑制癌细胞生长并增加其化学敏感性。27类似地,miR-340通过靶向EphA3抑制宫颈癌的转移。28据报道,MiR-340还通过下调Wnt/β-连环蛋白途径抑制骨肉瘤的发展。29在胶质瘤中,miR-340被定义为肿瘤抑制剂,通过靶向组织纤溶酶原激活剂抑制胶质瘤起始细胞介导的肿瘤发生。30另外,lncRNA TEX41是人乳头状瘤病毒在宫颈癌核糖核酸样品中整合的热点基因,提示TEX41在宫颈癌中具有肿瘤促进作用。31在我们的研究中,miR-340在HNSC的表达低于正常组织。HNSC的TEX41和COMMD6均高于正常组织。这些结果暗示了miR-340潜在的肿瘤抑制作用和TEX41和COMMD6在HNSC的肿瘤促进作用。结合文献综述,miR-340与COMMD6以及TEX41之间的表达和互补序列,我们推断它们可能形成TEX41-miR-340-COMMD6 ceRNA网络,在HNSC发挥重要作用,但仍需要进一步的实验证明。
此外,我们构建了miR-218-CDX1-COMMD6转录网络来分析COMMD6在CHOL中的上游调节机制。发现miR-218通过靶向ROBO1抑制胃癌中的肿瘤血管生成。32在肺癌中,miR-218通过靶向IL6/STAT3减少细胞增殖和侵袭,并与不良预后相关。33更重要的是,miR-218通过抑制结直肠癌中的Bmi1来抑制上皮细胞向间充质细胞的转化并增加奥沙利铂的细胞内积累。34miR-218在肝细胞癌中低表达,MiR-218的过表达通过抑制HOXA10、RET和SERBP1抑制肝细胞癌的生长、EMT和转移。35,36,37CDX1是尾部相关同源盒转录因子基因家族的成员,在胃癌中明显高于正常组织。38相反,CDX1在多种肿瘤中发挥肿瘤抑制作用,如结肠癌、乳腺癌和肝细胞癌。39,40,41迄今为止,CDX1在CHOL中的表达仍然未知。在这里,通过分析从TCGA数据库获得的CHOL数据,我们发现肿瘤中CDX1明显高于正常组织。一直以来,作为CDX1的转录靶标,COMMD6在CHOL中也高于正常组织。此外,生物信息学分析表明COMMD6和CDX1都是miR-218的下游靶标。结合上述表达和相关分析,我们推断miR-218-CDX1-COMMD6网络可能参与了CHOL的调控,这需要进一步的实验来验证。
通过生物信息学分析,我们发现除了与NF-κB的结合活性外,COMMD6的作用主要集中在蛋白泛素化活性上,而且在包含蛋白家族的COMMD结构域中,NF-κB的泛素化是研究最广泛的功能。例如,COMMD1与含有延伸蛋白B和C、Cul2和SOCS1的泛素连接酶结合,加速NF-κB亚单位的泛素化和降解。42此外,COMMD1磷酸化Ser468处的RelA,促进RelA的泛素化和降解,导致核移位的抑制和NF-κB途径的失活。43,44此外,还发现COMMD8与CCDC22相互作用,指导κB蛋白的泛素化和降解。45此外,我们以前发现COMMD10通过促进核因子κB的泛素化和降解来抑制结直肠癌的转移17同样,我们推测COMMD6可能通过调节NF-κB亚单位的泛素化和降解而参与肿瘤。
还发现COMMD6参与了ACC核糖核蛋白复合物的生物发生、核糖核酸加工和剪接过程的调节。核糖体生物发生和蛋白质合成是癌细胞持续生长所必需的关键细胞过程。核糖体基因突变已在各种肿瘤中被检测到,如子宫内膜癌、结肠直肠癌和神经胶质瘤。46,47,48已经发现剪接体是MYC驱动的癌细胞致癌压力的目标。剪接体的抑制损害MYC依赖性乳腺癌的存活、致瘤性和转移。49因此,我们推断COMMD6可能通过核糖核蛋白和剪接体复合生物发生来调节肿瘤的发生和发展。
总之,我们的研究首次阐明了COMMD6在BALB/c小鼠和人正常及肿瘤组织中的表达谱。更重要的是,COMMD6的表达可以预测癌症患者的存活,表明COMMD6在肿瘤发展和进展中的重要作用。此外,我们通过在HNSC构建TEX41-miR-340-COMMD6 ceRNA网络和在CHOL构建miR-218-CDX1-COMMD6转录网络,阐明了COMMD6潜在的肿瘤促进作用和机制。此外,我们发现COMMD6可以调节核因子κB亚基的泛素化和降解,调节肿瘤中核糖核蛋白和剪接体复合物的生物发生。这项研究可能有助于阐明COMMD6在各种人类肿瘤中的功能和机制,为肿瘤预防和治疗提供潜在的生物标志物。