试剂
丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)颜色终点检测试剂盒是从Bio Science(奥斯汀,TX)购买的。从罗氏诊断学公司获得了BM化学发光印迹底物(POD)和10X阻滞剂。(印第安纳波利斯,IN)。赛拉星尔是从中银科学公司(纽约雪莉)购买的。iScript cDNA合成试剂盒和SYBR绿色超级混合物是从Bio-Rad(大力神,CA)购买的.从圣克鲁斯生物技术公司(SantaCruz,CA)获得辣根过氧化物酶(HRP)结合抗山羊抗体。GAPDH特异性抗体(#2118)和辣根过氧化物酶(HRP)结合抗兔抗体是从细胞信号技术(贝弗利,MA)购买的。从R&D系统(明尼阿波利斯,MN)中获得Lipocalin-2/NGAL抗体(AF 1857)、相应的ELISA试剂盒(MLCN 20)和重组小鼠瘦素蛋白(Leptin)。小鼠瘦素和超敏感小鼠胰岛素ELISA试剂盒是从水晶化学公司购买的.(唐纳斯格罗夫,伊利诺伊州)。TRIzol试剂来源于Invitrogen(Carlsbad,CA)。RNeaseMinElute清理套件是从奇根(#74101,巴伦西亚,加利福尼亚州)购买的。
动物与治疗
波士顿儿童医院动物护理和使用委员会批准了本研究中进行的所有动物实验(编号:16-05-3168 R)。所有动物实验均按照机构动物保护和使用委员会(IACUC)的标准操作规程(SOP)进行。
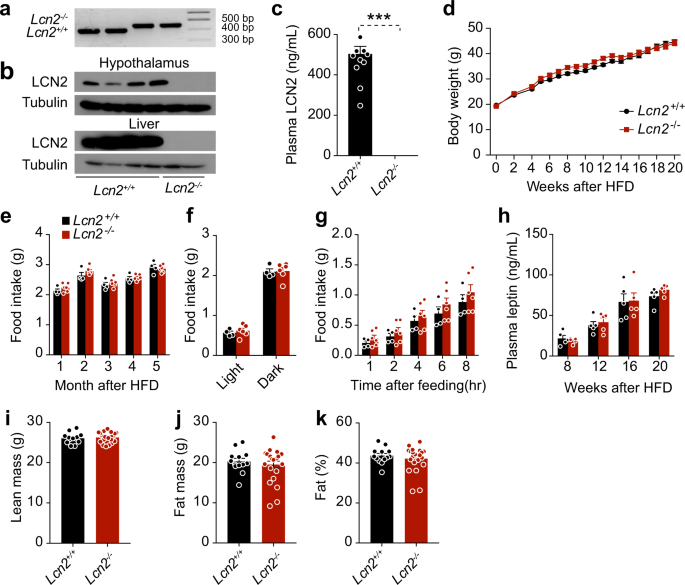
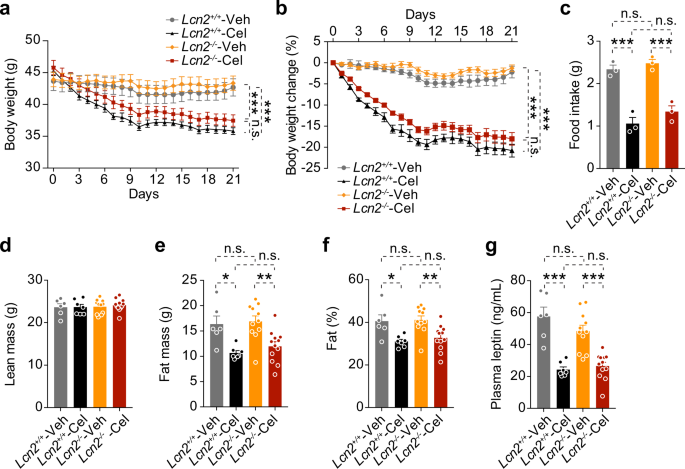
野生型C57BL6/J小鼠(股票编号000664),DB/db小鼠(股票编号000697),以及Lcn 2纯合基因敲除小鼠(股票编号024630)是从杰克逊实验室购买的。小鼠杂合子Lcn 2突变(Lcn 2+/−)是由杂交雄性产生的。Lcn 2纯合敲除Lcn 2−/−)野生型雌性小鼠。野生型(Lcn 2+/+)和纯合的小分子Lcn 2−/−突变是由杂交产生的。Lcn 2+/−老鼠。
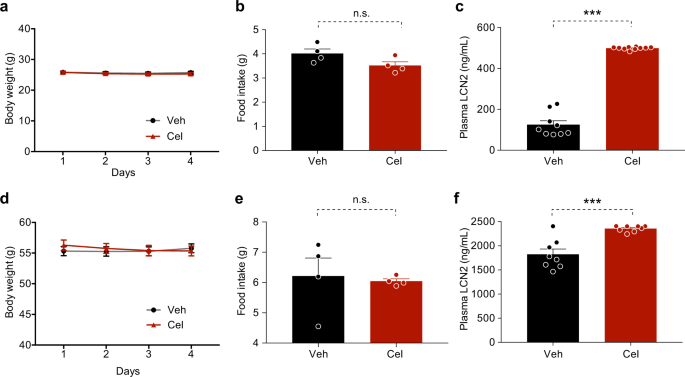
为了获得饮食诱导肥胖(Dio)小鼠,野生型c57bl6/j小鼠和Lcn 2−/−或Lcn 2+/+雄性小鼠给予高脂饮食(HFD,45千卡脂肪;猫。D 12451,研究饮食,新不伦瑞克,新泽西州)4周龄时,保持相同的饮食16-20周.八周大DB/db瘦弱的老鼠被置于正常的饮食中(NCD,来自脂肪的13.5%的卡路里;猫)。0006973,实验室饮食,圣路易斯,密苏里州)。小鼠被安置在一个12小时的暗/光循环中,暗周期从晚上7点持续到早上7点。所有老鼠[医]锂除非另有说明,否则可获得食物和水。天麻醇溶于无菌DMSO(25μg)中,在暗周期前60~90 min腹腔注射(I.P),除非另有规定。相应的车辆组注射I.P,总体积为25 ml无菌DMSO。
采血
用肝素化毛细管从尾静脉采集血液,然后转移到冰凉的Eppendorf管中,在4°C下每分钟3000 rpm离心30 min,血浆部分转移到新的小瓶中,保存在−80°C。
骨髓分离
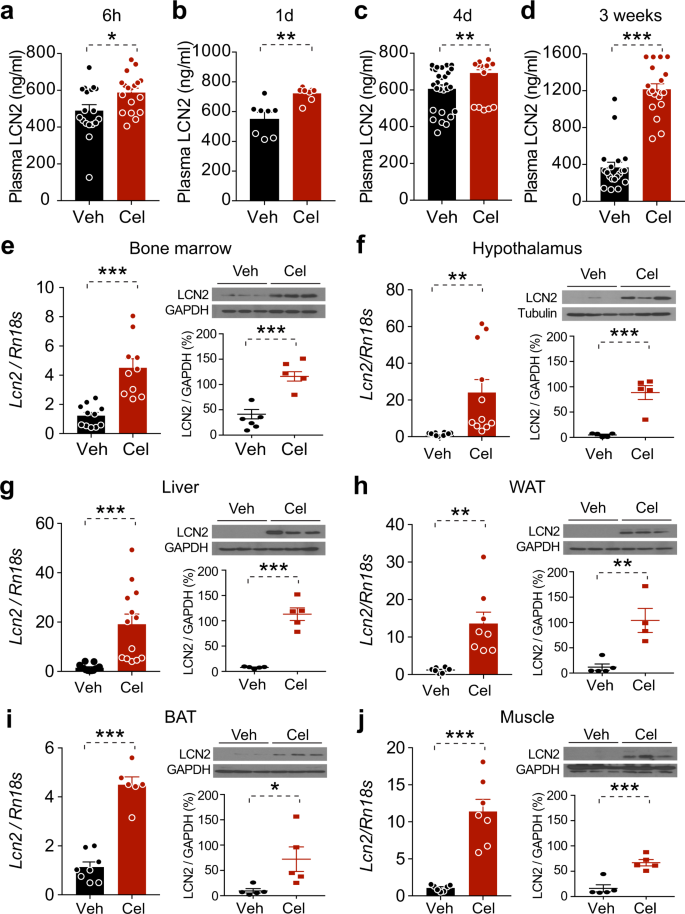
为检测天麻素对小鼠骨髓表达水平的影响,分别用1 0 0μg/kg灌胃给药或1 0 0μg/kg腹腔注射给DIO小鼠。第5天开始光循环后60 min,分别给药2 0 0μg/kg和2 0 0μg/kg的塞拉唑(2 0 0μg/kg)。然后禁食6小时,用25毫米针和5毫升注射器将骨髓从股骨髓腔冲洗成15毫升的冰凉pbs管。细胞经1,000 rpm离心,4°C离心10 min后,上清液被丢弃。骨髓立即冷冻于液氮中,保存于−80°C,待分析。
取小鼠骨髓,分为三个独立组。第一组用15毫升管冲洗骨髓,冷冻2h后离心。这使得我们能够在队列中完成更多的组织收集,但是骨髓的质量受到了影响。因此,我们从这个队列中排除了骨髓分析的结果。在第二组和第三组中,为了保证样品的质量,我们将骨髓冲洗成15毫升的试管,立即离心,并在上清液取出后立即用液氮冷冻样品。
人体成分测量
我们用双能X射线吸收法(DEXA;月球PIXImus2,通用月球公司,麦迪逊,美国)评估了总瘦质量、脂肪质量和体脂百分比。
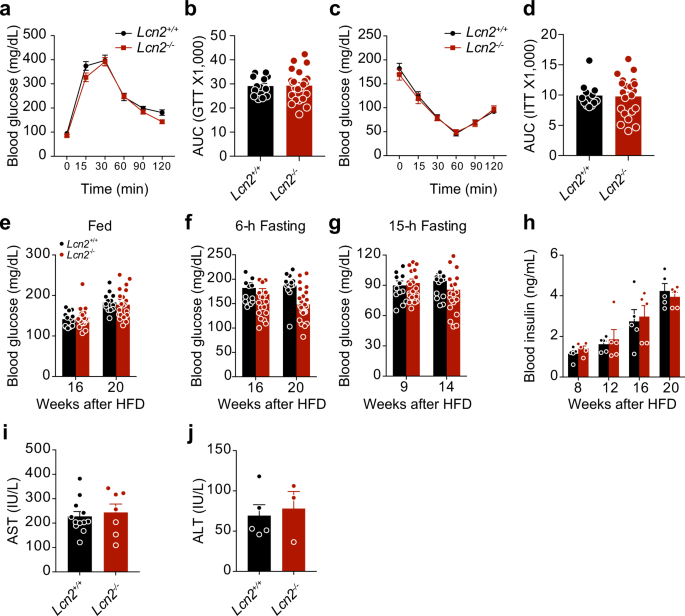
葡萄糖耐量试验(GTT)和胰岛素耐受试验(ITT)
GTT小鼠禁食15h(下午5时至上午8时),给予葡萄糖1g/kg。分别于给糖前、给糖后15、30、60、90、120 min测定血糖水平。
ITT小鼠禁食6h(上午8:00~下午2:00)。重组人胰岛素(1IU/kg)腹腔注射。分别于给药前、给药后15、30、60、90和120 min测定血糖水平。
总蛋白提取与Westernblotting
下丘脑、棕色脂肪组织、腹股沟脂肪组织、肝脏、脂肪、肌肉和骨髓在冰冷组织溶解缓冲液(25 mm Tris-HCl,pH 7.4;100 mm NaF;50 mm Na)中进行匀浆。4P2O710毫米钠3Vo410 mm EGTA;10 mm EDTA;1%NP-40;添加磷酸酶和蛋白酶抑制剂后,在4°C下,以13,400 g离心30 min,用蛋白质分析试剂盒(Bio-Rad)测定蛋白质浓度。蛋白质样品与5xLaemmli缓冲液混合,在95°C下煮5 min,然后装在十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)上。电泳后,在4°C,100 V条件下,将蛋白转移到PVDF膜上2 h,用10%阻滞剂阻断TBS-0.1%吐温-20(TBST)膜。在含10%封闭试剂的TBST中,用原抗体隔膜过夜。原代培养后,用三次TBST冲洗20 min,用10%封闭试剂在TBST中用10%阻滞剂在室温下孵育1 h。在TBST中对膜进行三次清洗后,用化学发光分析系统开发了膜,并用ImageJ(NIH)定量了膜带强度。
总RNA提取及微阵列分析
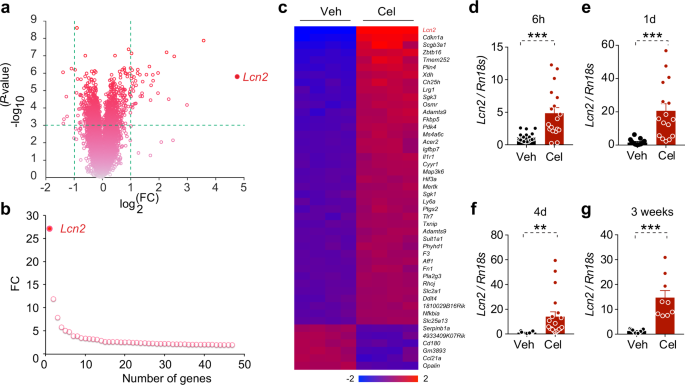
DIO小鼠适应I.P。连续注射车辆(DMSO)4天。在此驯化期后,4只DIO小鼠和4只小鼠在暗周期前4天(100 g/kg)灌胃60~90 min。注射。15h后,小鼠再注射西兰地尔(200μg/kg)。6小时后,我们提取下丘脑并将其冷冻在液氮中。在−80°C保存至RNA提取。为了提取总RNA,我们从−80°C中取出下丘脑,在每个样品中加入5 0 0 1TRIzol。组织匀浆后,按TRIzol裂解试剂的指示提取下丘脑RNA。芯片分析用RNeaseMin清除试剂盒(74104,QIAGEN)清洗提取的总RNA,芯片用1g总RNA。
cDNA的合成及定量实时PCR
DMSO驯化小鼠7天后注射(I.P.)在需要的时间使用DMSO或赛乐星。最后一次注射和禁食后6h取出下丘脑、棕色脂肪组织、腹股沟脂肪组织、肝脏、肌肉和骨髓等组织。用TRIzol裂解试剂按制造商的程序从组织中提取总RNA。利用iScriptcDNA合成试剂盒(Bio-Rad),以1μg总RNA为原料,根据生产厂家的生产工艺,合成了互补DNA。QPCR由SYBERGreen在QuantStudio™6 Flex实时PCR系统(LifeTechnologies)上进行.比较CT法计算感兴趣基因的相对表达。RN18S作为内源对照。用于检测基因的引物如下:
Lcn 2向前:5‘-TGCCCTGAGTGTCATGTG-3’
反向:5‘-CTCTTGTAGCTCATAGGTGC-3’
RN18S:前进:5‘-AGTCCCTCTTTGTACA-3’
反向:5‘-CGATCCGAGGGCCTCACTA-3’
小鼠血浆激素及代谢物测定
Lcn 2、瘦素、胰岛素、谷丙转氨酶(ALT)和谷草转氨酶(AST)的测定采用相应的ELISA或试剂盒。Lcn 2 ELISA稀释DIO小鼠血浆100倍,瘦素ELISA稀释5-10倍。用血浆5μL进行胰岛素ELISA和AST测定,用10μL进行ALT测定。
苏木精和伊红染色
分别用10 0μg/kg的维甲酸或天麻醇治疗DIO小鼠3周后,将其肝脏解剖保存于10%福尔马林磷酸盐缓冲液中。石蜡包埋肝切片H&E染色。
统计分析
所有数据均为均值±S.E.M,统计显着性采用图所示的学生t检验(双尾)或双向方差分析(Bonferroni)的多重比较检验。P低于0.05的数值被认为是显著的。队列数和n图中显示了每个实验的数值。实验结束前死亡或生病的老鼠或统计异常值(根据格鲁布的离群点测试判断)最终被排除在外。没有盲目或随机化。在前人的实验和文献基础上,未采用统计学方法预先确定样品的大小和样本量。在被比较的组中,差异是相似的。