红细胞M3在缺氧缺血性脑损伤后通过IMP2-IGF2信号通路以小生境依赖的方式促进神经发生
红细胞M3在缺氧缺血性脑损伤后通过IMP2-IGF2信号通路
以小生境依赖的方式促进神经发生
摘要
缺氧缺血是所有年龄组的急性脑威胁。治疗性低温可减轻新生儿的损伤,但其副作用会妨碍成人的日常使用。低温上调了一个小的蛋白质子集,包括核糖核酸结合基序蛋白3 (RBM3),它在压力条件下具有神经保护作用。这里我们展示了红细胞M3如何在持续性成人神经发生的两个区域,脑室下区(SVZ)和颗粒下区(SGZ)刺激神经元分化和抑制高胰岛素诱导的凋亡,同时仅在SGZ促进高胰岛素损伤后的神经干/祖细胞(NSPC)增殖。成果管理制3与IGF2mRNA结合蛋白2 (IMP2)提高其表达,从而刺激IGF2在SGZ的释放,但不刺激SVZ神经干细胞。总之,我们通过新的RBM3-IMP2-IGF2信号通路描述了成人HI损伤后神经发生的生态位依赖性调节。
介绍
大脑是最容易受到氧气和能量剥夺影响的器官。缺氧缺血对所有年龄组都造成毁灭性的脑损伤。出生窒息是新生儿脑病和终身神经后遗症的主要原因1。在年龄较大的儿童和成人中,院外心脏骤停是全球HI脑损伤以及随后发病率和死亡率的主要原因2。
亚低温(32–34℃)显著降低出生窒息导致死亡和残疾的风险1,3,但有副作用,使其在成人脑损伤后的使用变得复杂4,5。因此,阐明低温所赋予的神经保护的细胞和分子机制可能有助于靶向治疗的发展。
除了减缓细胞代谢速率,亚低温还诱导哺乳动物的应激反应蛋白子集,包括核糖核酸结合基序蛋白3 (RBM3)6。我们小组和其他人以前的报告显示,红细胞M3通过不同的细胞和分子机制在各种应激条件下具有神经保护作用,例如通过网状蛋白-3 (RTN3)维持突触可塑性,抑制聚腺苷二磷酸核糖聚合酶(PARP)裂解,以及抑制内质网应激诱导的凋亡7,8,9,10。
啮齿动物研究表明,红细胞M3在新生儿和成人的增殖和分化大脑区域中高度表达,如脑室下区(SVZ)、嘴侧迁移流和齿状回的颗粒下区(SGZ)9,11。值得注意的是,RBM3与神经干细胞标记巢蛋白共定位11和神经母细胞标记物doublecortin (Dcx)9,表明其在维持神经干/祖细胞(NSPC)自我更新和神经发生中的作用。
在成年人中,SVZ和SGZ是仅有的两个特征鲜明的神经源生态位,不仅在啮齿动物中如此,在人类中也是如此12,13,14。缺血损伤后在两个小生境中刺激NSPC增殖和神经发生,以帮助缺血后恢复15。然而,由于不同的冷却设置和损伤模型产生了相互矛盾的结论,低温是否促进高脂血症损伤后的神经再生仍不确定16。我们专注于在体外和体内HI损伤后,红细胞M3对SVZ和SGZ小生境中NSPC增殖和神经发生的影响。
结果
RBM3刺激NSPC在SGZ的扩散,但不刺激SVZ的扩散
正如在其他研究中观察到的,RBM3敲除(KO)小鼠在生理条件下不表现出明显的表型17。然而,在神经退行性疾病等病理条件下,红细胞M3作为应激反应蛋白,显著影响神经的存活和功能7。在研究它在成年神经发生中的作用时,我们发现成年RBM3 KO和在正常条件下饲养的野生型小鼠的脑重量没有差异(补充图。1a)。我们也没有检测到大脑的结构异常,或者与野生型小鼠相比,KO的SVZ体积和DG体积有任何差异(补充图1b)。
以前我们和其他人已经在成人神经干细胞和神经母细胞中鉴定出红细胞M39,11。本研究证实了其在体内SVZ和SGZ性别决定区Y-box 2 (Sox2)+ NSPCs和Dcx +神经母细胞中的表达(补充图。1c,d)。我们通过每隔一天给成年小鼠腹腔注射溴脱氧尿苷(BrdU)监测基础NSPC增殖,持续7天,然后处死。在SVZ和SGZ小生境中,KO小鼠的增殖(BrdU+ Sox2+)神经干细胞的总数和密度与野生型小鼠相似(补充图。1e,f)。通过神经球分析的进一步分析显示,从KO小鼠分离的初级和次级神经球的数量和大小与野生型小鼠相似,无论来源如何(补充图1g,h)。因此,我们的数据表明,在生理生长条件下,成年红细胞M3缺乏小鼠的神经源性潜能似乎没有受到损害。
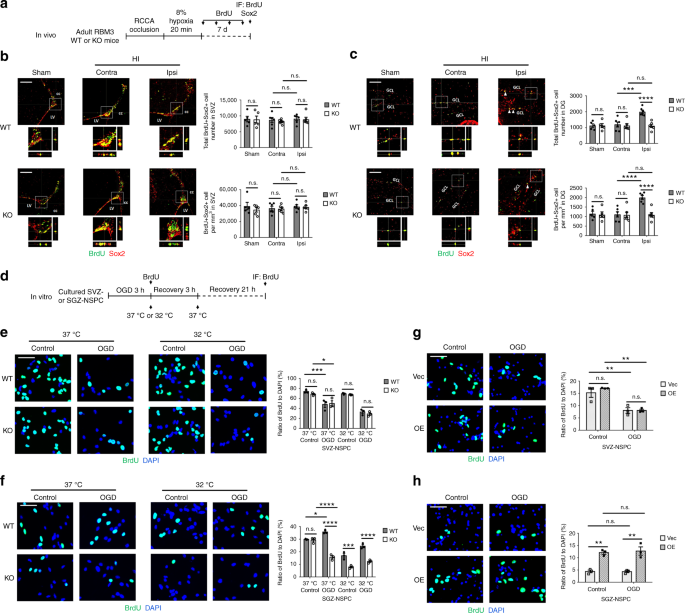
接下来,我们将一个急性脑高指数模型应用于成年红蓝耳鼠和KO小鼠,以确定红蓝耳鼠在病理条件下是否会影响NSPC增殖和神经发生。右侧颈总动脉永久结扎后,动物接受8%低氧20分钟,随后恢复7天,重复BrdU脉冲(图1a)。我们使用方法中的等式(1)来估计梗塞体积。脑梗体积在脑梗科明显大于脑梗科(补充图2a)。不管KO小鼠中更多的神经元损失,WT和KO小鼠中同侧和对侧的SVZ和DG体积没有差异(补充图2b)。方法中的等式(2)用于体视学细胞定量。从高脂血症中恢复7天后,与对侧相比,野生型和KO小鼠的同侧SVZ和DG中的总BrdU+细胞密度均增加,但是在野生型和KO小鼠之间没有观察到差异(补充图2c,d)。同时,在脑损伤后,在SVZ和周围区域,如纹状体和胼胝体,以及邻近缺血核心的同侧海马中,诱导了大量反应性(胶质纤维酸性蛋白[·GFAP]+)星形胶质细胞和(离子化钙结合衔接分子1[·伊巴1]+)小胶质细胞(补充图。3a,b)。我们在野生型小鼠的同侧胼胝体和DG中发现少突胶质细胞转录因子2(少子2)+少突胶质细胞前体细胞刺激的证据,而非KO小鼠(补充图。3c)。我们观察到KO脑同侧皮质和纹状体缺血核心的末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)+凋亡细胞多于WT脑(补充图。3d)。SVZ野生型和KO型小鼠的新生神经干细胞总数和密度几乎不受影响(图。1b)。引人注目的是,与高脂对侧和假动物相比,野生型小鼠高脂同侧SGZ的BrdU+ Sox2+ NSPCs显著增加,而在高脂同窝小鼠中,在SGZ没有诱导BrdU+ Sox2+ NSPCs(图。1c)。尽管我们在KO小鼠的SGZ发现了一些BrdU+细胞,但其中许多是Sox2阴性细胞,这表明RBM3对NSPC增殖影响的神经源性小生境之间存在差异。
红细胞M3是体内和体外HI诱导的SGZ-但不是SVZ-NSPC增殖所必需的。a体内高胰岛素模型图解和NSPC增殖分析。RCCA右颈总动脉,中频免疫荧光。b,cSVZ BRdu和Sox2的代表性免疫荧光染色(b)和DG(c)的红细胞M3重量和KO动物,用HI治疗,每隔一天用BrdU注射液恢复7天。对照组动物接受假手术。正交视图证实了BrdU和Sox2的共定位。估算了SVZ或DG的BrdU+ Sox2+细胞数量和密度。每组计数五只假动物和六只HI动物(假:n= 5,HI:n= 6)。假的,假的团体;HI组对侧(未损伤侧)对侧;HI组同侧(伤侧)。比例尺:左心室侧脑室100米,胼胝体cc,GCL颗粒细胞层。重复测量双向方差分析用于统计分析;注意:不重要。***p% 3C 0.001;****p%3C 0.0001。d体外OGD模型图解及NSPC增殖分析。OGD氧葡萄糖剥夺,免疫荧光。只有WT或KO神经干细胞接受低温治疗(32℃)。质粒转染的神经干细胞总是在37℃培养e–hOGD应激后神经干细胞中BrdU和DAPI的代表性免疫荧光染色。SVZ-国家战略计划委员会(e)和SGZ国家战略中心(f)用OGD处理红细胞M3重量或KO小鼠,并在含BrdU的培养基中在37或32℃下复氧3小时,随后在37℃下再复氧21小时。n= 3)。采用三向方差分析进行统计分析;注意:不重要。*p% 3C 0.05;***p% 3C 0.001;****p%3C 0.0001。SVZ-国家战略计划委员会(g)和SGZ国家战略中心(h)用空载体(Vec)或RBM3过表达(OE)质粒转染,用OGD处理,并在含BrdU培养基中于37℃复氧24小时。n= 3)。比例尺:50 m。统计分析采用双向方差分析;注意:不重要。**p%3C 0.01。所有数据均以平均扫描电镜表示
为了表征红细胞M3在体外NSPC增殖中的作用,我们从红细胞M3重量和KO小鼠的SVZ和SGZ分离和培养巢蛋白+ Sox2+ NSPCs(补充图。4a)。培养的神经干细胞在含BrdU的完全培养基中复氧24小时之前,用缺氧-葡萄糖剥夺(OGD,HI的体外模型)进行攻击(图。1d)。OGD之后,NSPC在SVZ的扩散在野生型文化和KO文化之间几乎是相似的。相比之下,来自SGZ的NSPC增殖在野生型培养物中显著增加,但在KO培养物中减少(图1e,f),与体内发现一致(图1b,c)。此外,我们用模拟应激或低温治疗OGD后的神经干细胞3小时(图1d),从而增强RBM3表达(补充图4b)。总的来说,低温抑制了细胞增殖,但在KO中比在WT SGZ-NSPCs中更是如此(图1f)。我们没有检测到红细胞M3减少的SVZ非淀粉样蛋白细胞的差异(图1e)。此外,当我们在OGD之后在SVZ和SGZ过度表达重组红细胞M3时(补充图4c),只有SGZ神经干细胞增殖速度高于模拟载体组(图1g,h)。
综上所述,我们的数据表明,虽然红细胞M3在正常生长条件下不影响基底NSPC细胞的增殖,但在缺氧缺血性损伤后,它在体内和体外刺激SGZ-非干细胞的增殖,而不刺激SVZ-非干细胞的增殖。
RBM3促进SVZ和SGZ的NSPC神经元分化
接下来,我们检查了红细胞M3是否调节NSPC分化并促进神经发生。
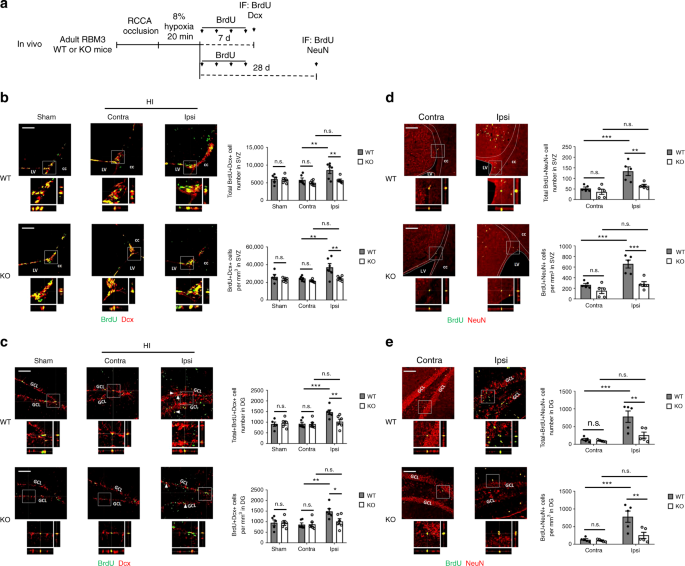
在体内,从HI治疗中恢复7天后(图2a),新生(BrdU+ Dcx+)神经母细胞在野生型小鼠同侧SVZ和SGZ的HI中显示出明显的刺激,与对侧和假组相比(图。2b,c)。另一方面,在缺乏红细胞M3的小鼠中,在同侧的SVZ和SGZ没有新生神经母细胞刺激(图。2b,c)。在长期研究中,研究人员发现大多数新生神经干细胞在成熟前死亡,剩余的细胞分化为成熟神经元,这是对受损脑组织的不充分修复18,19。HI损伤后经过较长的恢复期(28天)(图2a),在SVZ只有少数BrdU+细胞存活,但在DG中有更多的BrdU+细胞存活(补充图2e,f)。与KO小鼠相比,野生型小鼠在SVZ和DG中发现了显著更高数量和密度的总BrdU+细胞(补充图2e,f)。此外,我们发现野生型小鼠同侧SVZ和DG中成熟的BrdU+ NeuN+神经元数量增加(图。2d,e)但KO小鼠的数量减少(图2d,e)。
红细胞M3在体内HI损伤后促进SVZ和SGZ的神经发生。a体内高胰岛素血症模型图解和神经发生分析。RCCA右颈总动脉,中频免疫荧光。b,cSVZ BrdU和Dcx的代表性免疫荧光染色(b)或DG(c)的红细胞M3重量和KO动物,用HI治疗,每隔一天用BrdU注射液恢复7天。对照组动物接受假手术。正交视图证实了BrdU和Dcx的共同定位。估算了SVZ或DG的BrdU+ Dcx+细胞数量和密度。每组计数五只假动物和六只HI动物(假:n= 5,HI:n= 6)。假的,假的团体;HI组对侧(未损伤侧)对侧;HI组同侧(伤侧)。比例尺:左心室侧脑室100米,胼胝体cc,GCL颗粒细胞层。重复测量双向方差分析用于统计分析;注意:不重要。*p% 3C 0.05;**p% 3C 0.01;***p%3C 0.001。d,eSVZ BrdU和NeuN的代表性免疫荧光染色(d)或DG(e)用HI治疗并在恢复的第一周每2天用BrdU注射液恢复28天的RBM3野生型和KO动物。正交视图证实了BrdU和NeuN的共定位。估算了SVZ或DG的BrdU+ NeuN+细胞数量和密度。每组计算五只动物(n= 5)。对侧对侧(未受伤侧);同侧(受伤侧)ipsi。比例尺:左心室侧脑室100米,胼胝体cc,GCL颗粒细胞层。重复测量双向方差分析用于统计分析;注意:不重要。**p% 3C 0.01;***p%3C 0.001。所有数据均以平均扫描电镜表示
在体外,我们通过在无生长因子培养基中培养7天将神经干细胞分化为神经元。与此同时,为了评估OGD对分化的影响,我们用OGD处理神经干细胞,然后再充氧7天:在正常的NSPC培养基中处理前2天,留出足够的时间激活干细胞状态下的下游信号,在剩余的5天在无生长因子的神经元分化培养基中处理(图。3a)。
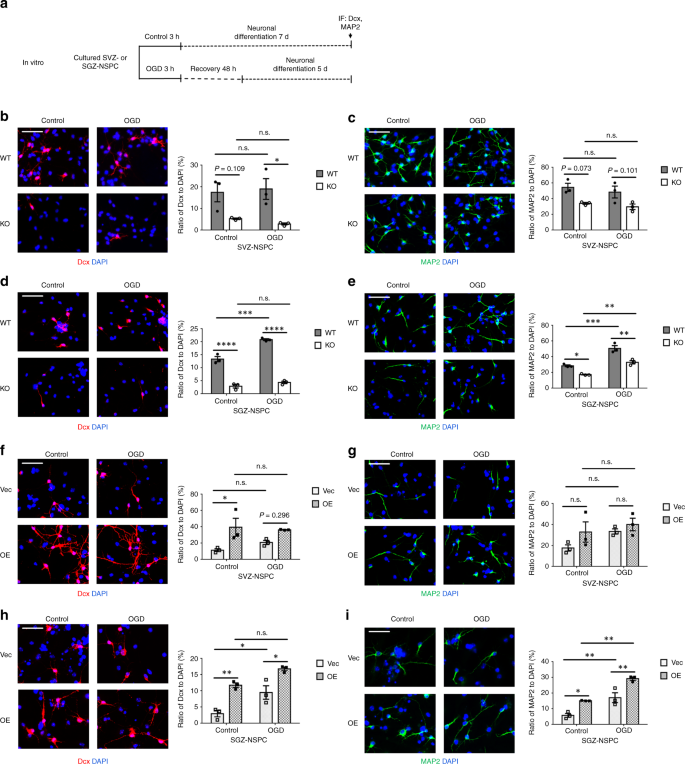
红细胞M3在体外促进OGD后SVZ-NSPC和SGZ-NSPC的神经元分化。a体外神经元分化试验图解。神经干细胞在神经元分化培养基中培养7天(对照),或首先用OGD攻击,然后在前2天在NSPC完全培养基中再充氧,随后切换到神经元分化培养基5天(OGD)。OGD氧葡萄糖剥夺,免疫荧光。b–i来自SVZ的RBM3重量级和KO非淀粉多糖(b,c)或SGZ(d,e)和用空载体或用SVZ过表达载体转染的野生型非淀粉样蛋白细胞(f,g)或SGZ(h,i)起源用于神经元分化分析。神经母细胞标记Dcx(b,d,f,h)和神经元标记MAP2(c,e,g,i)染色并计算免疫反应细胞与DAPI阳性细胞的比率(三个独立实验,n= 3)。呈现代表性图像并获取统计数据。比例尺:50 m。统计分析采用双向方差分析;注意:不重要。*p% 3C 0.05;**p% 3C 0.01;***p% 3C 0.001;****p%3C 0.0001。所有数据均以平均扫描电镜表示
在该神经元分化试验中,OGD治疗诱导SGZ神经干细胞中Dcx+神经母细胞和微管相关蛋白2 (MAP2)+神经元与所有4’,6-二脒基-2-苯基吲哚(DAPI)+细胞的比率显著增加(图。3d,e)但在SVZ没有3b,c)。在缺乏红细胞M3的情况下,SVZ神经干细胞分化成神经母细胞和神经元的百分比几乎保持不变(图。3b,c)而在SGZ国家战略计划中显著下降(图3d,e)。另一方面,当红细胞M3过度表达时,SVZ神经干细胞中神经母细胞和神经元的百分比几乎保持不变(图。3f,g)同时在SGZ国家战略计划中显著增加(图3h,I)。
同样,我们将神经干细胞分化为星形胶质细胞和少突胶质细胞,有或没有OGD治疗(补充图5a)。我们用S100标记神经胶质前体。常用的星形胶质细胞标记物GFAP在所有分化的细胞中表达,也存在于未分化的神经干细胞中(补充图5b)如其他出版物所报道的20,21,因此没有使用。当星形胶质细胞分化试验中红细胞M3表达改变时,我们没有发现差异(补充图5c-f)。
在少突胶质细胞分化试验中,我们使用寡突胶质细胞前体细胞标记寡突胶质细胞,但不使用少突胶质细胞标记麦芽糖结合蛋白(MBP),因为分化7天后只有少数MBP+细胞(%3C1%)(补充图。5g)。与星形胶质细胞分化相反,OGD治疗诱导了SVZ和SGZ神经干细胞的OPC分化(补充图。5h-k)。然而,尽管在没有OGD的情况下,红细胞M3似乎促进了OPC分化,但是当改变红细胞M3表达水平时,我们发现在OGD之后寡2+细胞百分比几乎没有差异(补充图5h-k)。
总之,我们观察到HI损伤后神经发生的诱导。我们的结果支持RBM3在两个神经源性小生境中增强神经元分化潜能的观点。然而,由于红细胞M3对SVZ神经干细胞的神经元分化的影响小于SGZ神经干细胞,我们可以预期对SVZ神经发生的影响较小。红细胞M3的表达对胶质细胞分化没有显著影响。
红细胞M3限制了SVZ和SGZ非干细胞诱导的凋亡
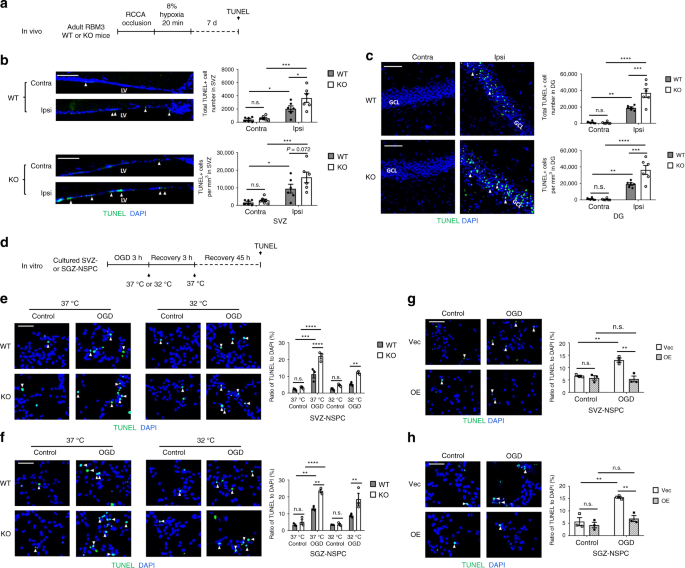
为了排除SVZ和SGZ来源的神经干细胞增殖率差异由不同程度的缺氧诱导凋亡引起的可能性,我们进行了TUNEL染色(图1)。4a)并发现在侧墙的两个干细胞龛中,RBM3 KO小鼠同侧的凋亡细胞明显多于其WT同窝小鼠(图1)。4b)和整个DG(图4c)。在SVZ的侧尾只观察到很少的凋亡细胞(补充图3d)。相比之下,无论是红蓝耳科动物还是野生型高脂血症动物,对侧几乎没有TUNEL+细胞(图4b,c)。
红细胞M3可在体内和体外防止缺氧诱导的细胞凋亡。a体内缺氧缺血模型说明及细胞凋亡分析。RCCA右颈总动脉,TUNEL末端脱氧核苷酸转移酶dUTP缺口末端标记。b,cSVZ有代表性的免疫荧光TUNEL染色(b)或DG(c)的红细胞M3重量和KO动物,用HI处理并恢复7天。估计了SVZ或DG的TUNEL+细胞总数和密度。每组计算六只动物(n= 6)。比例尺:50米对侧(未损伤侧),同侧(损伤侧),左心室侧脑室,GCL颗粒细胞层。重复测量双向方差分析用于统计分析;注意:不重要。*p% 3C 0.05;**p% 3C 0.01;***p% 3C 0.001;****p%3C 0.0001。d体外OGD模型图解及细胞凋亡分析。OGD缺氧缺糖症。只有WT或KO神经干细胞接受低温治疗(32℃)。质粒转染的神经干细胞总是在37℃培养e–hOGD应激后神经干细胞中具有代表性的免疫荧光TUNEL。SVZ-国家战略计划委员会(e)和SGZ国家战略中心(f)用OGD和低温治疗,如图3所示1图例,除了48小时的复氧期,而不是总共24小时。TUNEL+/DAPI+细胞的比率被量化(三个独立实验,n= 3)。采用三向方差分析进行统计分析;注意:不重要。**p% 3C 0.01;***p% 3C 0.001;****p%3C 0.0001。SVZ-国家战略计划委员会(g)和SGZ国家战略中心(h)用空载体(Vec)或RBM3过表达(OE)质粒转染,用OGD处理并在37℃下复氧48小时。n= 3)。比例尺:50 m。统计分析采用双向方差分析;注意:不重要。**p%3C 0.01。所有数据均以平均扫描电镜表示
为了评估红细胞M3的体外抗凋亡作用,我们在OGD后48小时定量TUNEL+细胞(图。4d)。OGD刺激诱导SVZ和SGZ来源的神经干细胞发生显著凋亡(图4e,f)。红细胞M3的缺乏明显加剧了OGD后细胞凋亡(图4e,f)。低温减弱了干细胞的凋亡,但在KO干细胞中仅轻微减弱,提示红细胞M3部分介导了干细胞的低温细胞保护(图。4e,f)。另一方面,强迫红细胞M3表达阻断了OGD诱导的细胞凋亡(图4g,h)。
我们的结果表明,红细胞M3在体内和体外总体上限制了HI诱导的凋亡,因此至少部分介导了冷却的保护作用。然而,这种保护作用同时适用于SVZ-和SGZ-神经干细胞,表明OGD后增殖的差异不是由于凋亡。
RBM3-IMP2-IGF2轴介导生态位依赖性增殖
为了阐明在缺乏红细胞M3的海马NSPC区减少增殖的分子机制,我们进行了核糖核酸测序以鉴定红细胞M3 KO小鼠转录组的变化。我们使用出生后第3天(P3)和出生后2-3个月的成年海马,分别来自无HI损伤的RBM3野生型和KO小鼠。提取的总核糖核酸质量符合核糖核酸序列的要求(补充数据1)。不出所料,即使我们应用了一个不太严格的截止条件,在比较RBM3重量和KO时也能看到罕见的基因表达的整体差异(补充图。6a-c,补充数据2和3),与生理条件下未改变的表型一致(补充图1a、b、e-h)。由于差异表达基因的数量有限,基因集富集分析(GSEA)提供的信息有限(补充图6d)。在P3和成人名单中的少数常见deg中,我们发现了胰岛素样生长因子2(IGF2)作为候选之一,当RBM3不存在时下调(补充图S6a-S6c,补充数据2和3)。同时,我们确定了候选人IGF2我们先前公布的RBM3相互作用因子筛选列表中的基因结合蛋白10,众所周知的调节IGF2mRNA稳定性及其表达促进22。基于这两种独立的筛选方法,我们将重点放在了IGF,因为此外,据报道,它还诱导了成人神经干细胞的小生境依赖性增殖23,24。与以前的出版物一致25,26,我们发现所有三种imp在成年非小细胞肺癌中的表达水平比出生后第0天(P0)小鼠的非小细胞肺癌低得多(补充图。7a)。IMP1表情几乎无法察觉,而IMP3表达比...低得多IMP2在野生型成人神经干细胞中(补充图7a)。给出了IMP2促进胚胎新皮质神经干细胞神经元分化的额外证据27,我们检验了红细胞M3调节NSPC增殖并可能涉及成年非淀粉样蛋白细胞中IMP2-IGF2信号的假设。
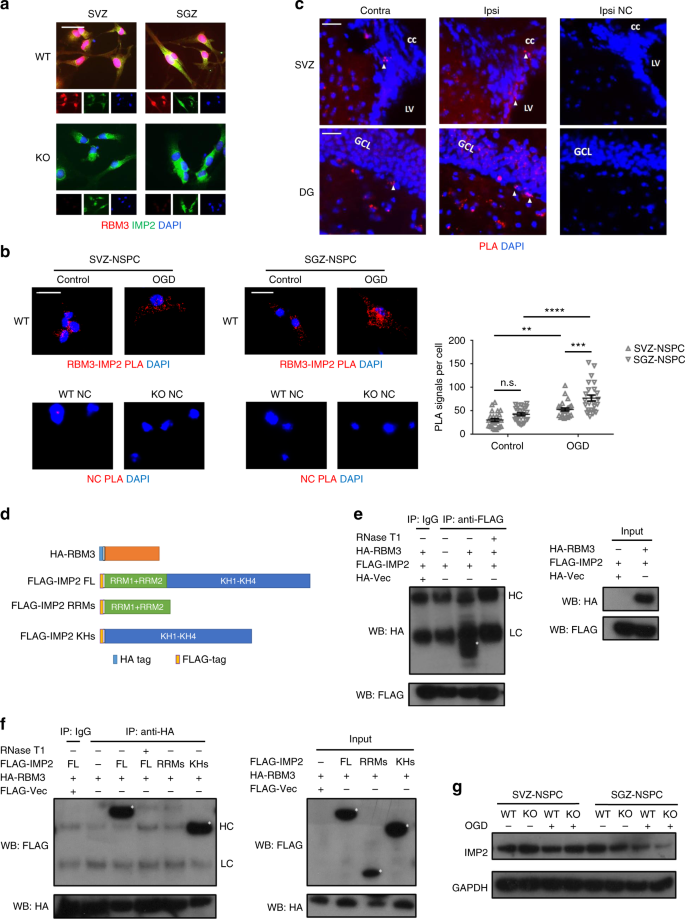
首先,我们研究了核蛋白多糖中红细胞M3-IMP2的相互作用。在培养的神经干细胞中,红细胞M3主要在细胞核中表达,但也在细胞质中表达,而IMP2的表达仅限于细胞质(图5a)。邻近连接试验表明,在SVZ和SGZ-非淀粉样蛋白细胞中,红细胞M3和IMP2都是相邻的,而OGD处理显著增加了每个细胞的阳性信号数,表明红细胞M3-IMP2相互作用对OGD反应更多(图1)。5b)。此外,在OGD之后,SGZ国家干细胞中的红细胞M3-IMP2相互作用比SVZ国家干细胞中的要丰富(图。5b)。在体内SVZ和SGZ地区,RBM3和IMP2共表达(补充图7b)并显示了原位的相邻定位(图5c)。
RBM3与IMP2相互作用。a成年野生型小鼠脑内SVZ-非干细胞和SGZ-非干细胞中红细胞M3和IMP2的代表性免疫荧光染色。RBM3(红色)、IMP2(绿色)和DAPI(蓝色)合并。比例尺:25米。b来自邻近连接试验的代表性免疫荧光图像。用OGD对SVZ-非干细胞和SGZ-非干细胞进行攻击,并复氧3小时。在每个细胞中计数指示单个RBM3-IMP2相互作用的荧光点,并且每组25个细胞用于定量(n= 25)。RBM3-IMP2 PLA信号(红色)和DAPI信号(蓝色)合并。比例尺:25 m。统计分析采用双向方差分析;注意:不重要。**p% 3C 0.01;***p% 3C 0.001;****p%3C 0.0001。所有数据均以平均扫描电镜表示。c用HI和7天恢复治疗的成年小鼠冷冻脑切片中RBM3和IMP2的邻近连接测定的代表性图像。比例尺:50米对侧(未损伤侧)、同侧(损伤侧)、左室侧脑室、胼胝体cc、GCL颗粒细胞层、无初级抗体的阴性对照。dRBM3和IMP2结构示意图。全长红细胞M3与一个氮端透明质酸标签融合。全长IMP2被截短为具有两个核糖核酸识别基序的N端结构域或具有四个钾同源基序的C端结构域;所有的构造都包括一个N端标记。e,fHEK293细胞中全长或截短的RBM3和IMP2的代表性共免疫沉淀图。全长FLAG-IMP2与载体(Vec,阴性对照)或HA-RBM3共过表达,有或没有RNase T1预处理。用FLAG抗体沉淀FLAG-IMP2。输入或输入样品中的FLAG-IMP2和透明质酸-RBM3通过抗FLAG或抗透明质酸抗体使用蛋白质印迹(e)。使用全长透明质酸-红细胞M3进行倒数CoIP,沉淀全长标志-蛋白2、标志-RRMs或标志-千赫(f)。星号表示目标波段。用于免疫沉淀的抗体重链,用于免疫沉淀的抗体轻链。g在存在或不存在RBM3的模拟或OGD治疗后,SVZ-NSPC和SGZ-NSPC IMP 2表达的代表性蛋白印迹
在我们首次鉴定红细胞M3-IMP2相互作用的HEK293细胞中10P0小鼠脑内神经干细胞中,RBM3和IMP2的表达均处于高水平(补充图7c)和它们的相互作用更加丰富(补充图7d),与成人神经干细胞相比(图5b)。内源性红细胞M3-IMP2相互作用通过直接在HEK293细胞和P0神经干细胞中的共免疫沉淀(CoIP)得到证实(补充图。7e)。我们进一步在HEK293细胞中表达重组红细胞M3和IMP2,并用CoIP检测了它们相互作用所需的结构域。已知IMP2含有两个核糖核酸结合基序(RRMs)和四个钾同源性(KH)结构域,它们都可以结合核糖核酸,但是以前的报道只鉴定了KH结构域,而没有鉴定RRM结构域作为直接介导IGF2mRNA结合28。为了检查IMP2的哪些结构域是RBM3-IMP2相互作用所必需的,我们将全长IMP2、截短的IMP2 RRMs(两个RRM结构域)和截短的IMP2 KHs(四个K同源结构域)与全长RBM3(图。5d)。CoIP结果表明,红细胞M3-IMP2相互作用是依赖核糖核酸的,因为它被核糖核酸酶处理所消除(图5e,f)。正如所料,只有KH结构域,而不是RRM结构域,对与RBM3的相互作用至关重要(图5f),这与相互作用由核糖核酸介导的发现相一致。
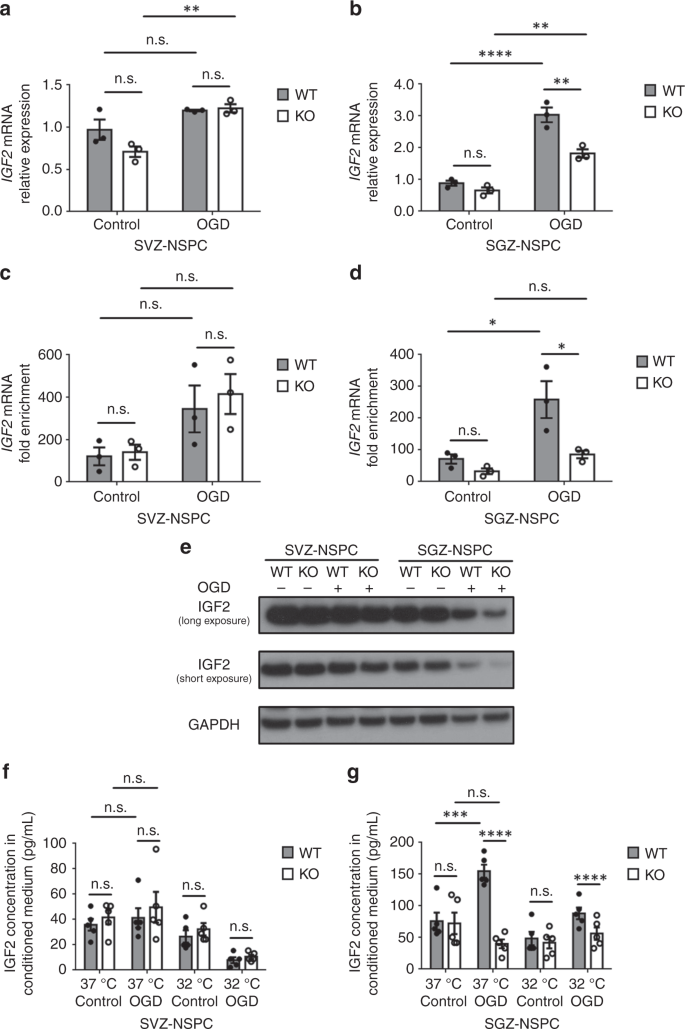
在证实了红细胞M3-IMP2相互作用后,我们希望确定红细胞M3是否调节IMP2及其下游IGF2表达。在整个大脑中,我们检测到RBM3 KO小鼠的IMP2蛋白水平稍低,但IGF2蛋白水平不低(补充7f)。在培养的非淀粉样蛋白细胞中,我们观察到SVZ-非淀粉样蛋白细胞中OGD后IMP2的表达没有差异,而SGZ-非淀粉样蛋白细胞中IMP 2的表达略有下降,并且当红细胞M3不存在时进一步下降(图。5g)。在受损半球,IMP2通常在SVZ和邻近纹状体的GFAP+星形胶质细胞和整个DG中诱导(补充图。7g)。因此,我们打算弄清楚下游效应器IGF2是否以生态位依赖的方式变化。我们发现增加了IGF2OGD体外培养后,在野生型SGZ-非淀粉样蛋白细胞中表达mRNA,但在SVZ-非淀粉样蛋白细胞中表达不明显,在KO SGZ-非淀粉样蛋白细胞中增加较少(图。6a,b)。此外,利用核糖核酸免疫沉淀,我们鉴定了更多IGF2在野生型SGZ-非淀粉样蛋白细胞中,在OGD后与IMP2蛋白结合的基因在野生型SVZ-非淀粉样蛋白细胞中呈上升趋势(图。6c,d)。在没有RBM3的情况下,结合物富集IGF2与野生型相比,SGZ-非干细胞移植后的基因表达明显减少,但SVZ-非干细胞移植后的基因表达没有变化(图。6c,d)。有趣的是,在SGZ神经干细胞移植后,内源性IGF2蛋白水平降低而不是增加,可能是由于分泌增加(图1)。6e)。当红细胞M3耗尽时,OGD后SGZ-非淀粉样蛋白细胞内源性IGF2蛋白减少(图6e)。SVZ国家干细胞中的IGF2蛋白水平没有受到OGD或红细胞M3耗竭的显著影响,与未改变的一致IGF2IMP2蛋白的基因表达数据及趋势(图5g,6c,e)。在测量OGD胁迫后释放到培养基中的IGF2水平时,我们发现SVZ-NSPC条件培养基中的释放水平低于SGZ-NSPC条件培养基中释放水平的50%。6f,g)。OGD显著诱导IGF2分泌到SGZ-NSPC培养基中,但红细胞M3减少(图6g)。相反,RBM3的表达对IGF2释放到SVZ-NSPC培养基中没有影响(图6f)。总的来说,OGD之后,低温抑制了SVZ和SGZ神经干细胞的IGF2分泌,可能是通过降低其表达水平实现的。6f,g)。
红细胞M3在体外调节SGZ非SVZ非干细胞的IGF2表达。a,b定量逆转录聚合酶链反应IGF2基因在SVZ-NSPC的表达(a)和SGZ-NSPC(b)在存在或不存在RBM3的情况下经过3 h OGD和3 h复氧(三个独立实验,n= 3)。IGF2基因水平标准化为GAPDH由2δδCT方法。统计分析采用双向方差分析;注意:不重要。**p% 3C 0.01;****p%3C 0.0001。c,d束缚的丰富IGF2and 3小时和复氧3小时后红细胞膜上IMP2蛋白的基因表达。来自SVZ-NSPC的裂解物(c)或SGZ-NSPC(d)进行核糖核酸免疫沉淀。用抗IMP2抗体沉淀IMP2蛋白,并测定结合量IGF2通过定量逆转录聚合酶链反应(三个独立实验,n= 3)。正常小鼠免疫球蛋白(msIgG)作为免疫沉淀的阴性对照。IGF2mRNA水平标准化为输入2δδCT方法,将折叠富集标准化为msIgG组,该组设为1。统计分析采用双向方差分析;注意:不重要。*p%3C 0.05。e在存在或不存在RBM3的模拟或OGD治疗后,SVZ-NSPC和SGZ-NSPC IGF2表达的代表性蛋白印迹。f,g酶联免疫吸附试验测定培养基中的IGF2水平。SVZ-国家战略计划委员会(f)和SGZ国家战略中心(g)用OGD胁迫,然后在37或32℃复氧3小时,然后在37℃再孵育21小时。立即收集培养基,通过酶联免疫吸附试验(5个独立实验,n= 5)。采用三向方差分析进行统计分析;注意:不重要。***p% 3C 0.001;****p%3C 0.0001。所有数据均以平均扫描电镜表示
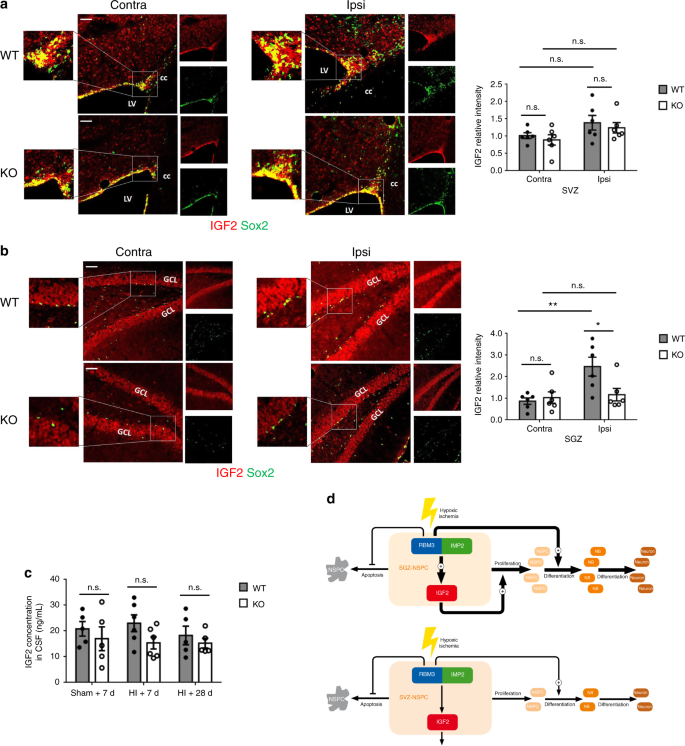
此外,我们注意到在高脂血症损伤后7天,IGF2蛋白表达的强度在同侧SGZ增强,而在WT小鼠中没有增强(图1)。7a,b)。在红细胞M3缺乏的小鼠中,同侧SGZ的IGF2表达强度比WT降低,而同侧SVZ的表达强度保持不变(图7a,b),与体外发现一致。最后,我们用酶联免疫吸附试验(酶联免疫吸附试验)测定了三组脑脊液中的IGF2水平:假手术加7天恢复,高脂血症加7天恢复,高脂血症加28天恢复。在所有三组中,未观察到重量和高度之间脑脊液IGF2水平的显著变化(图7c),表明红细胞M3不改变脉络丛上皮细胞的IGF2分泌,脉络丛被认为是脑脊液的主要来源24。我们进一步发现,脉络丛中不存在红细胞M3表达,而IGF2像以前报道的那样高24(补充图7h)。这一发现支持了我们的观点,即红细胞生成素3不调节脑脊液中的IGF2水平,因此不影响SVZ-NSPC的扩散。
红细胞M3在体内调节SGZ的IGF2表达,但在SVZ不调节。a,bSVZ有代表性的免疫荧光IGF2染色(a)或SGZ(b)的红细胞M3重量和KO动物,用HI处理并恢复7天。所有图像都是用相同的参数拍摄的。Sox2+ NSPCs共染色以鉴定SVZ或SGZ。用图像j量化指示区域中的相对IGF2强度。每组计数6只动物(n= 6)。比例尺:左心室侧脑室50 m,胼胝体cc,GCL颗粒细胞层,对侧(未损伤侧),同侧(损伤侧)。重复测量双向方差分析用于统计分析;注意:不重要。*p% 3C 0.05;**p%3C 0.01。c脑脊液IGF2水平的酶联免疫吸附测定。脑脊液样品是从用假手术、HI+7天恢复或HI+28天恢复(假+7d:n= 5,HI + 7d:n= 6,HI + 28d:n= 5)。统计分析采用双向方差分析;注意:不重要。所有数据均以平均扫描电镜表示。d假设模型。在SGZ-NSPC,红细胞M3与IMP2相互作用,从而增强IGF2的表达和释放,以在HI损伤后以自分泌模式促进SGZ-NSPC增殖。另一方面,RBM3促进神经元分化。在SVZ-NSPC,红细胞M3不促进HI损伤后的增殖,对神经元分化的影响较小。在两种细胞类型中,RBM3抑制凋亡。神经母细胞
综上所述,红细胞M3与非淀粉样蛋白细胞中的IMP2相互作用;然而,只有在SGZ-NSPC,RBM3才促进IMP2介导的稳定IGF2高脂血症损伤后基因表达及促进IGF2表达和分泌。
讨论
当损伤的神经元在缺氧缺血后失去突触连接并经历细胞死亡时,对抗内源性再生过程被激活,导致神经发生和突触形成29。众所周知,治疗性低温可以保护大脑免受缺氧缺血性损伤30,31但是关于低温是否促进或抑制损伤诱导的NSPC增殖和神经元分化,或者抗凋亡是否是关键机制的信息有限且不一致16。我们在此证明,在生理条件下,红细胞M3在脑中表达,但其缺乏对体内脑发育没有明显影响,可能是由于其他未知的补偿机制。然而,在高脂血症等病理条件下,红细胞M3对于神经保护和损伤后神经再生是不可或缺的。红细胞M3不仅保护神经干细胞免受缺氧诱导的凋亡,还刺激NSPC增殖和神经元分化。我们证明红细胞M3通过调节SGZ-非淀粉样蛋白细胞中的IMP2-IGF2途径而不是SVZ-非淀粉样蛋白细胞来促进HI后的NSPC增殖(图。7d)。
冷诱导型核糖核酸结合蛋白(CIRP)是哺乳动物中唯一已知的RBM3同源蛋白6。与红细胞M3一样,已有报道在体外促进神经干细胞的增殖并抑制其凋亡32,33。然而,CIRP已经被鉴定为损伤相关分子模式(DAMP)分子,诱导有害的炎症反应34。缺血性卒中模型中细胞外CIRP水平升高,导致大量神经元损伤35。相比之下,还没有关于红细胞M3的有害影响的报道,因此红细胞m3被认为是比CIRP更安全的损伤后神经发生调节剂。
IMP家族蛋白被广泛表达,并在不同的发育阶段发挥重要作用。成年期,与IMP1和IMP3相反,只有IMP2保持相对高的表达,在细胞存活中起主要作用28,36,NSPC扩散37和神经元分化27。作为IMP2的主要下游因子,IGF2在胚胎和成人脑的增殖区都很丰富22类似于IMP2和RBM3的时空表达模式。近年来,IGF2已被确定为胚胎和新生儿神经干细胞增殖的积极调节者38,39和成人神经干细胞23,24。有趣的是,SVZ-NSPC对外源性IGF2的反应遵循旁分泌模式,而SGZ-神经干细胞分泌IGF2并以自分泌方式调节自我更新23,24。我们的结果支持这样的假设,即红细胞M3上调SGZ-非淀粉样蛋白细胞的IGF2表达和分泌,但不上调SVZ-非淀粉样蛋白细胞,这解释了为什么HI损伤后只有SGZ-NSPC增殖受到红细胞M3表达水平的影响。像红细胞M3一样,微处理器复合亚单位DGCR8,一种参与微小核糖核酸生物发生的关键蛋白,也能调节IGF2表达和促进SGZ-非淀粉样蛋白细胞的增殖,但不能促进SVZ-非淀粉样蛋白细胞的增殖40。正如IGF2已经被证明可以巩固和增强记忆一样,记忆是海马的主要功能41,预期由红细胞M3缺乏引起的IGF2下降会影响HI损伤后的记忆功能,并且也可能有助于在慢性神经退行性疾病模型中通过红细胞M3沉默发现的记忆丧失7。
设计一种小的化合物来稳定红细胞M3蛋白并通过靶向其典型的核糖核酸识别基序保持其高水平的表达是可行的,以促进内源性神经发生,特别是在海马中。这种化合物可以用来治疗急性脑损伤和慢性疾病。虽然CIRP同系物的活性需要进一步测试,但已经开发出一个初步成功的例子42。此外,基于红细胞M3的治疗的安全性需要仔细评估潜在的肿瘤发生。由于IMP家族成员和IGF2在促进细胞增殖方面至关重要,他们在生理条件下保持干细胞的干细胞干,但也被认为有利于不同肿瘤类型中的癌细胞进展及其高表达28,36。幸运的是,临床研究显示,与其CIRP同源物相比,高红细胞M3表达与各种癌症的良好预后相关6。尽管其潜在的机制仍大部分未知,但这表明以红细胞生成素3为靶点的治疗在脑部疾病中是安全的。
方法
老鼠
所有动物实验均经巴塞尔市兽医办公室批准(授权号2064和2652),并符合实验动物指南。日本东京大学教授谷口亲切地提供了RBM3敲除C57BL/6小鼠。由于红细胞M3是与X染色体相连的基因,因此本研究仅使用雄性红细胞M3野生型或KO小鼠。手术前后,所有小鼠在25℃的光照/黑暗的标准条件下保持12/12小时。
缺氧缺血模型
用3%异氟醚麻醉2-3个月大的成年小鼠。暴露右侧颈总动脉(RCCA),通过电烙术永久结扎,随后切割。RCCA只暴露在假动物体内,但没有结扎。手术恢复后,动物在37℃下接受8%低氧20分钟。假动物不接受低氧治疗。缺氧应激后,所有动物腹腔注射50毫克/千克BrdU。随后的BrdU注射每隔一天进行一次,持续7天。在缺氧缺血性损伤后7天或28天处死小鼠进行进一步分析。
免疫荧光染色
小鼠经心灌注4%多聚甲醛。收集大脑并用4%全氟辛烷磺酸后固定24小时,并在4℃下浸入30%蔗糖中另外24小时,然后包埋在室温下(TissueTek)并在异戊烷中冷冻。冷冻保护的大脑在低温恒温器(徕卡)中被切成25米厚的冠状切片。对于培养的神经干细胞,将细胞接种到聚-1-赖氨酸包被的16孔腔载玻片(Nunc LabTek)上,并在室温下用4% PFA固定10分钟。为了染色BrdU,在室温下用2 M盐酸处理脑切片或细胞1小时,并在封闭前用0.1 M硼酸钠(pH 8.5)中和10分钟。磷酸盐缓冲液中的0.5%小麦×100和5%正常山羊血清用于透化和封闭。样品与一级抗体在4℃温育过夜。阿列克谢荧光染料结合的二级抗体以1:500(热费希尔)使用。原子核被DAPI包裹着。补充数据中列出了一级抗体的信息4。
甲酚紫染色
脑冷冻切片安装在Superfrost PLUS载玻片上,室温下用0.2%甲酚紫溶液染色20分钟。染色载玻片随后用蒸馏水洗涤,在70、80、90、95和100%乙醇中脱水,然后在二甲苯中清洗两次。Eukitt安装介质(Fluka)用于安装载玻片。
体视学、成像和细胞定量
立体坐标根据成年小鼠脑图谱确定43。高脂血症损伤后7天的动物用于梗塞体积估计。梗塞体积估计方法是从别处采用卡瓦列里估计器探头改编的44。在低温恒温器中将固定的大脑连续切割成25米厚的冠状切片(距bregma大约在+2.0和4.0毫米之间),如上所述,每十二个切片(间隔300米)进行甲酚紫染色,总共20个切片。使用配有立体研究员(MBF生物科学公司)的Axio成像仪Z1显微镜(蔡司),在实时模式下使用×5物镜进行成像。直接梗塞区域的轮廓(毫米2),同侧半球面积(毫米2)和对侧半球区域(mm2)由立体声调查员的卡瓦列里点计数估计器概述和计算。使用50 m的网格间距。校正后的梗塞面积计算如下:
A修正的是校正后的梗塞面积,A直接的是直接梗塞区,AIPSec是同侧半球区域,并且A对立是对侧半球区域。估计梗塞体积(毫米3)通过将所有20个截面的校正梗塞面积相加,然后乘以300 m的间隔来计算。SVZ(尾部和侧壁)或DG(颗粒细胞层和hilus)体积(毫米3)使用如上所述的卡瓦列里点计数估计器,但是具有20 m的网格间距,以不经校正的直接方式进行估计。每只动物的四个包含SVZ的部分(距短沟大约在+1.2到0.0毫米之间)和八个包含整个DG的部分(距短沟大约在1.2到3.6毫米之间)用于体积估计。
每十二个连续的冠状断面(每个断面厚25米,间隔300米),共四个断面,估计SVZ的细胞定量(距短沟约+1.2至0.0毫米)。SGZ覆盖背侧和腹侧海马(距短脊膜约1.2-3.6毫米)的细胞定量是用每12个连续冠状切片(每个厚25米,间隔300米)估计的,共8个切片。用LSM710共聚焦显微镜(Zeiss)利用z堆叠功能对双阳性细胞成像。在整个切片(25个光学切片)中,每隔1米采集一次堆叠图像,并以正交视图呈现,以确认共定位。SVZ或DG中的细胞计数是根据已发表的方法,用立体研究员(MBF生物科学)的光学分馏器进行的14,45,46,47。所有计数类型均采用30 × 30 m的计数框尺寸。为了计数SVZ和DG中的总BrdU+、BrdU+/Sox2+、BrdU+/Dcx+细胞,或SVZ HI+7d组中的TUNEL +细胞,使用60 × 60 m的采样网格。对于高碘+ 7d组DG中的TUNEL +细胞,采用90 × 90 m采样网格。对于SVZ的全部BrdU +和BrdU +神经元+细胞以及HI + 28d组的DG,使用了30 × 30 m的采样网格。细胞只在高度为10 m的光学分离器中计数,而不在顶部和底部3 m的保护区中计数。总细胞数(N)用以下计算公式估算:
∑Q−是实体中的细胞总数;t是加工后的截面厚度;h光学分离器高度;asf面积采样分数(计数帧大小/采样网格大小);和ssf切片取样分数(1/段间隔)。两个神经源性小生境中阳性细胞的密度分别通过将总阳性细胞数除以SVZ体积或DG体积来确定。SVZ或DG卷(毫米3)用上述方法在相邻截面系列上进行估计。对于非手术动物和假动物,给出了每只动物左右半球细胞数的平均值。
对于IGF2的相对强度量化,所有图像都是用相同的参数捕获的。侧脑室的信号被减去作为背景。用图像J(美国国家卫生研究院)计算SVZ或SGZ所有区域的IGF2信号的平均强度,并对每只动物进行显示。
对于培养的细胞,用AX70荧光显微镜(Olympus)捕获五个具有×20(除了用于邻近连接分析的×40)物镜的随机场的图像,用于每个实验的定量。进行了三个独立的实验。
细胞培养
HEK293细胞在添加10%胎牛血清的DMEM培养基中培养。根据以前的方案,SVZ-神经干细胞和SGZ-神经干细胞分别从2-3个月大成年雄性小鼠侧脑室SVZ或DG中分离48,49。出生后第0天雄性小鼠除小脑和脑膜外的全脑用于NSPC培养。简而言之,来自所需区域的细胞被木瓜蛋白酶(沃星顿)和脱氧核糖核酸酶ⅰ(西格玛)消化分离,并通过40米细胞过滤器(西格玛)除去细胞簇。分离的神经干细胞在完全DMEM-F12培养基(Gibco)中培养,培养基中添加1 × B27补剂(Gibco)、2 mM左旋谷氨酰胺(Gibco)、20纳克/毫升表皮生长因子(PeproTech)和20纳克/毫升FGF2 (PeproTech)。细胞在未包衣培养皿中保持为神经球,或在聚赖氨酸(西格玛)包衣培养皿或16孔腔载玻片(LabTek)中保持为单层。为了通过神经球,使用0.25%的典型蛋白(西格玛)将神经球消化成单细胞。
质粒和构建体
以前的报告中描述了用于在原代非淀粉样蛋白细胞中过量表达红细胞生成素3和控制空的pCEP4载体(热费歇尔)的PCE P4-红细胞生成素3构建体9。商用多囊卵巢综合征3-红细胞M3旨在用于哺乳动物在巨细胞病毒启动子下的全长红细胞M3 cDNA的过量表达,该启动子带有额外的氮末端透明质酸标签(中国生物,HG16437-NY)。商用多囊卵巢综合征3-IMP2质粒被设计用于全长IMP2过表达,带有N末端标记(中国生物,HG11116-NF)。还从嘉汉生物公司购买了带有氮端透明质酸或标志标签的对照空载体(多氯联苯醚-氮-透明质酸-NCV和多氯联苯醚-氮-标志-NCV)。
分别包含两个RRM和四个KH的IMP2的RRM域和KH域被克隆到带有FLAG标记的多克隆抗体3-N-FLAG-NCV中。IMP2-RRMs通过标准聚合酶链反应用IMP2-RRMs荧光/荧光引物对进行亚克隆。通过重叠聚合酶链反应扩增IMP2-KHs,使编码亲和标签的基因与编码截短肽的基因结合。多囊卵巢综合征3个荧光/标志-标记R和IMP 2-千赫荧光/荧光引物对用于重叠聚合酶链反应。重叠的聚合酶链反应产物用KPni/NO1消化,并连接到消化的多氯苯酚-氮-FLAG-NCV载体上。引物序列列在补充数据中4。所有pCMV3构建体在HEK293细胞中瞬时表达。
瞬时转染
为了共免疫沉淀,所有表达全长或截短的RBM3或IMP2的基于多囊卵巢综合征的质粒用富基因高清转染剂(Promega)瞬时转染入HEK293细胞48小时,每个质粒用1-2微克转染1 × 106HEK293细胞。对于培养的非淀粉样蛋白细胞,将10 g pCEP4空载体或pCEP4-RBM3质粒瞬时转染到5 × 106利用小鼠神经干细胞核转染试剂盒(Lonza)和核转染仪ⅰ装置(Lonza)的程序A-33,通过电穿孔法制备NSPCs。转染的细胞在12孔板中保存过夜,然后在室温下以100×g离心5分钟以除去死细胞。剩余的活细胞计数并以1 × 10的密度接种4细胞/毫升进入聚赖氨酸包被的16孔腔载玻片。在开始进一步治疗之前,细胞再孵育48小时。
缺氧缺糖(OGD)
NSPCs在直径为10厘米的聚赖氨酸包被的16孔腔载玻片或培养皿中培养24小时。为了引入OGD,将正常的NSPC培养基改为无葡萄糖的完全培养基(使用无葡萄糖的DMEM-F12,Biowest),载玻片或培养皿在氮气冲洗的低氧腔(Elektrotek)中保持15分钟。然后将该室密封并在37℃下保持3小时。在OGD之后,将无葡萄糖培养基切换回正常的完全培养基,并将细胞在正常条件下用20%的氧气在37℃下(常温组)或32℃下(低温组)孵育指定的时间。对于BrdU掺入,在OGD或模拟处理后立即将20微米BrdU加入培养基中。
定量逆转录聚合酶链反应
从细胞或脑组织中提取的总核糖核酸通过重组核糖核酸微制备系统(Promega)分离。用GoScript逆转录系统(Promega)将一微克总核糖核酸反向转录成互补脱氧核糖核酸。在15 μL反应体积中用GoTaq qPCR主混合物(Promega)进行定量扩增。在CFX Connect实时聚合酶链反应检测系统(Bio-Rad)上,在95℃下进行热循环5分钟,然后进行40次95℃循环15秒和60℃循环1分钟。2−δδCT方法计算基因表达的倍数变化。进行了三个独立的实验。引物序列列在补充数据中4。
蛋白质印迹
收获细胞或脑组织,用冷PBS洗涤,并在裂解缓冲液(1% Triton X-100,50 mM Tris,150 mM氯化钠,1 ×罗氏蛋白酶抑制剂鸡尾酒,pH 8.0)中裂解。脑组织在冰上用Dounce组织研磨机进一步匀浆。在4℃下以15000转/分钟离心10分钟后,收集上清液并用DC蛋白测定法(Bio-Rad)标准化。裂解物被装载到Nupage Novex 4–12%双三蛋白凝胶(Invitrogen)上,并转移到聚偏氟乙烯膜(Amersham/GE保健生命科学)。样品与一级抗体在4℃孵育过夜。辣根过氧化物酶连接的抗兔IgG和辣根过氧化物酶连接的抗小鼠IgG二级抗体购自细胞信号技术公司,以1:5000的比例使用。补充数据中列出了一级抗体的信息4。
神经球分析
神经球试验用于检测培养的神经干细胞的自我更新能力。直接从神经球形式的分离组织中预先培养的神经干细胞被胰蛋白酶消化成单细胞,并以每100升培养基100个细胞的密度在96孔板的每个孔中铺板以形成初级神经球。初级神经球被进一步消化成单细胞,并以相同的密度铺板形成次级神经球。培养48 h后,按直径(%3C20和≥20 m)对两组原代和继发性神经球进行计数。每组包括三个。
分化试验
NSPCs以单层形式以1 × 10的密度接种在16孔室载玻片中5/毫升,并在37℃下保持24小时。培养的细胞进行定向分化或OGD诱导分化。对于定向分化,免疫染色前在下列培养基中孵育NSPCs天:补充1 × B27补充剂和2mM L-谷氨酰胺的神经长基线培养基用于神经元分化;DMEM补充1 × N-2补充剂(Gibco)、2 mM左旋谷氨酰胺和1% FBS用于星形胶质细胞分化;神经生长培养基补充1 × B27补充剂、2 mM左旋谷氨酰胺和30 ng/mL三碘甲腺原氨酸(T3)溶液(Calbiochem)用于少突胶质细胞分化。对于OGD诱导的分化,用3 h OGD刺激细胞,然后在NSPC完全培养基中于37℃复氧2天,接着分别在上述定向分化培养基中复氧5天。下列一级抗体用于鉴定各种分化细胞:神经元MAP2神经母细胞DcxS100代表胶质细胞祖细胞,寡头2代表少突胶质细胞祖细胞(OPCs)。补充数据中列出了一级抗体的信息4。所有的量化都以三份形式进行。
TUNEL染色
TUNEL染色检测晚期细胞凋亡。按照制造商的说明,使用点击TUNEL方法进行检测,用Alexa Fluor 488染料(Invitrogen)进行原位凋亡检测。用蛋白酶K消化脑液进行抗原回收,用DAPI复染。培养的神经干细胞用Triton X-100渗透,用DAPI复染。分别在脑切片或培养的神经干细胞中计数TUNEL+细胞。在培养的神经干细胞中,所有DAPI染色细胞中TUNEL+细胞百分比以三份计算。
共免疫沉淀和核糖核酸免疫沉淀
对于共免疫沉淀(CoIP),在室温下将4微克一级抗体或对照正常IgG与40微克动珠蛋白G (Invitrogen)缀合45分钟。转染全长或截短的RBM3和IMP2过表达pCMV质粒(如上所述)的HEK293细胞在转染后48小时收获。HEK293或P0 NSPC细胞裂解物与抗体偶联的动力珠蛋白G在4℃孵育过夜。对于核糖核酸酶处理组,细胞裂解物在室温下用10 U/μl核糖核酸酶1(发酵罐)预处理15分钟,然后进行珠粒处理。蛋白质从NuPAGE LDS采样器缓冲液(Invitrogen)中的珠子中洗脱,缓冲液含有50毫米DTT,温度为70℃,时间为10分钟。通过蛋白质印迹分析样品。核糖核酸免疫沉淀是以类似于CoIP的天然方式进行的。模拟或OGD处理后,将起始材料调整至5 × 106每个样本的细胞数。所有试剂均含有40U/毫升核糖核酸酶抑制因子核糖核酸酶(Promega),并在无核糖核酸酶的水中制备(Promega),以最大限度地降低环境中核糖核酸酶的活性。免疫回收的核糖核酸在裂解缓冲液中于70℃从上述总核糖核酸分离试剂盒中洗脱10分钟,并通过试剂盒进一步纯化。样品用定量逆转录聚合酶链反应进行分析。
邻近连接试验
使用双链原位红启动试剂盒小鼠/兔(Sigma),用邻近连接试验(PLA)原位揭示RBM3和IMP2之间的蛋白质相互作用。脑切片和培养的神经干细胞用DAPI复染。在培养的NSPCs中,对每个细胞中的PLA +点(每个点代表一个相互作用)进行量化,并对每个样品中的25个细胞进行统计分析。
核糖核酸测序
海马是从出生后第3天(P3)或成年红毛鼠或KO小鼠(n=每组3个),并在冰上用Dounce组织研磨机在Trizol中匀浆。总核糖核酸用氯仿分离,用异丙醇沉淀,然后用核糖核酸清洗浓缩试剂盒(酵母研究)进一步清洗。互补脱氧核糖核酸文库由信使核糖核酸构建,并通过安捷伦2100生物分析仪鉴定。核糖核酸测序在Illumina Hiseq-2500测序系统上进行,单次读取长度为50 bp。用log2A %3E 3.32(百万分之平均计数%3E 10)过滤差异表达基因;|log2光纤通道| % 3E 0.26(|折叠变化| %3E 1.2)和未经调整的P值%3C 0.05。文氏图是通过交互式在线工具(http://www.interactivenn.net)。基因热图是通过热图在线工具(http://heatmapper.ca/expression)。通过在线分析工具(http://www.webgestalt.org)。火山图和测绘图由绘图板棱镜8.0制作。原始数据可在NCBI生物项目(项目编号:PRJNA529585)。
酶联免疫吸附测定
如前所述,在处死动物之前,立即从枕大池收集脑脊液样本50。固定细胞前立即收集NSPC培养基。用灵敏度为% 3C 5 pg/毫升的小鼠IGF2酶联免疫试剂盒(Abnova)测定脑脊液或培养基中的IGF2水平。假组和HI + 28d组包括5个重复,HI + 7d组包括6个重复。来自NSPCs的培养基分为五个重复。
统计分析
所有体外实验至少重复三次。所有体内实验包括每组至少五只小鼠。量化数据以标准误差均值表示。为了比较两组,统计显著性由双尾不成对确定t-有或没有韦尔奇校正(单因素)的测试,双向方差分析(两因素),随后是图基多重比较测试或西达克多重比较测试,三方差分析(三因素),随后是西达克多重比较测试。为了量化涉及同一动物对侧和同侧的数据,进行重复测量双向方差分析,并应用混合效应模型与假组进行进一步比较。p值小于0.05被认为是显著的。注意:不重要。*p% 3C 0.05;**p% 3C 0.01;***p% 3C 0.001;****p%3C 0.0001。使用GraphPad棱镜8.0进行统计分析,所有细节都在源数据文件中报告。
报告摘要
有关研究设计的更多信息,请参见自然研究报告摘要链接到这篇文章。
|
|