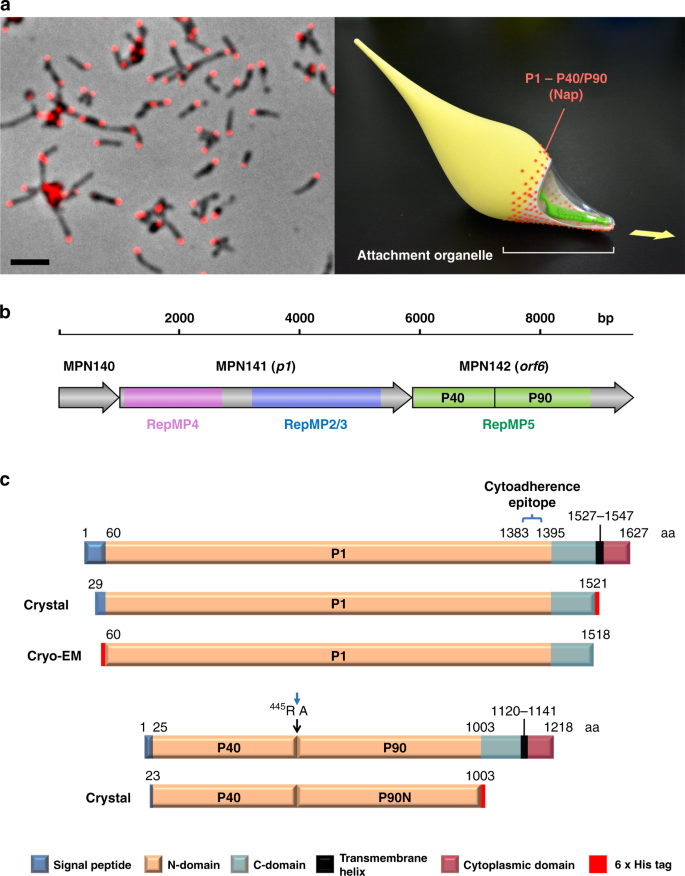
P1和P40/P90结构物的克隆、表达及纯化
与MPN 141和MPN 142基因相对应的区域肺炎支原体从合成克隆中扩增出来(补充表)3和4),分别使用引物P1F和P1R,P40/P90F和P40/P90R(补充表)5)。将PCR片段克隆到表达载体pOPINE中。61(来自美国水镇Addgene,RayOwens质粒#26043),用于生成带有C末端His-标记的结构,其中P1和23-1003以及23-1114的残基分别为29-1521和23-1114,用于P40/P90的短结构和长结构。B834(DE3)细胞(Merck)在22°C下表达后,以0.8mM IPTG(0.6OD)诱导获得重组蛋白。600。细胞在1xPBS、40 mm咪唑中提取并经超声溶解,然后在49,000×离心。g4°C时,将培养上清液装入HisTrap 5ml柱(GE Healthcare),以40 mm咪唑为结合缓冲液,1xPBS为结合缓冲液,1 xPBS与400 mm咪唑作洗脱缓冲液进行预平衡。在Tris 20 mm、pH7.4、NaCl 150 mm的缓冲液中,将可溶性异喹啉加入Superdex 200 GL 10/300柱(GE Healthcare)。为P40/P90纯化制备的缓冲液加入1mM EDTA,以防止蛋白质水解。P40/P90突变体的产生与野生型相同,但使用补充表中所示的相应引物。5。用N端Edman测序法确定了P40/P90的切割位点,并对纯化的P40/P90结构样品的SDS-PAGE谱带进行了序列分析(附图)。5A)。将P1与短的或长的P40/P90结构的混合物按1:1的比例制备了配合物。稳定的P1-P40/P90杂二聚体的存在,经凝胶过滤证实,是在混合物中检测到的唯一的复合物(附图)。5C).
对于cryo-EM数据收集,p1肺炎支原体M 129菌株(MPN 141)的表达和纯化已如前所述。62。这个P1对P1粘附素的氨基酸残基60-1518进行了密码子优化、合成和插入。nde我和XBAPColdI载体中的I位点(Takara Bio,Shiga,日本)。产生的质粒,PP1-1,其中P1融合到一个N端6×His标记和一个因子Xa位点。携带PP1-1的BL 21或BL 21(DE3)pLysS细胞在37℃下培养,直至培养密度达到OD值。600数值为0.3。细胞在15℃冷休克30 min后,加入终浓度为1.0mm的IPTG,于15°C培养一夜,经离心(4000×10×)获得细胞。g,10 min,4°C),用含20 mm Tris-HCl和500 mm NaCl的TN缓冲液冲洗两次。悬浮液在−80°C下冷冻,细胞颗粒解冻,悬浮于含1mM PMSF的结合缓冲液(20 mm Tris-HCl pH8.0,500 mm NaCl,20 mm咪唑)中。细胞随后被超声破坏(日本东京NIHONSEIKI)。未破裂细胞经离心(60,000~140,000×)除去。g,60 min,4°C)。将上清液装入HisTrap HP柱(GE Healthcare,Milwaukee,WI),与结合缓冲液进行平衡。结合蛋白在TN缓冲液中以10-200 mm咪唑为线性梯度洗脱。以TNG缓冲液(20 mm Tris-HCl(pH8.0),150 mm NaCl)为透析液,负载HiLoad 16/60 Superdex 200预柱(GE Healthcare),以1mL/min的流速与TNG缓冲液进行平衡。将收集到的P1粘附蛋白组分组合在20 mm Tris-HCl(pH 8.0)上进行透析,并应用于阴离子交换剂Q Sepharose FastFlow(Q Sepharose FastFlow Flow)与缓冲液进行平衡,并以0~0.4 M的线性梯度洗脱纯化后的蛋白,如有必要,用Am图标Ultra 30k自旋滤池(Millibus,Darmstadt,德国)进行浓缩。
P1和P40/P90N的结晶和X射线数据采集
分别对P1和P40/P90蛋白分别在笛卡尔(笛卡尔(TM)分配系统)和菲尼克斯(ArtRobbins仪器)机器人上进行了96孔板结晶筛选,将储集条件下的150 nL和蛋白质溶液浓度分别为6mg/mL和150 nL混合在一起。将1L的P1在6mg/mL的浓度下与1L 20%PEGMME 2000和PCB(丙酸钠、氰化钠和BIS-Tris丙烷pH=4)以2:1的比例混合,得到了最佳的P1晶体。P40/P90N在6mg/mL条件下与1L 20%PEG 3350、0.3%metoh按1:1的比例混合得到P40/P90N的最佳晶体。为了获得P40/P90N与3SL或6SL的复合物,蛋白质样品在20°C下与10 mm的低聚糖孵育1h,所有的P40/P90结晶实验均未成功。数据采集用晶体以15%甘油为保护剂,在液氮中进行闪蒸冷冻。
X射线数据采集在XALOC光束线(西班牙Alba同步加速器)进行.数据用晓2处理63使用XDS64无目的无意义65来自CCP4系列节目66.
P1晶体结构的测定
来自P1的晶体属于C2空间群,根据堆积考虑,在不对称单元中只包含一个亚基。我们试图用重原子和Semet衍生物来解决P1晶体的问题,但最终通过采用溶剂压扁和用晶体进行平均的密度修正技术,获得了较高的分辨率。生殖器M.同源蛋白P 140,其结构当时也不为人所知17。该方法同时解决了P1和P 140的结构(它们之间的序列同源性为41%)。所使用的含P 140晶体与P 140与P 110(P140-P110N)配合物的晶体相对应,与P 140单独的晶体相对应。确定P1和P 140结构的步骤如下:
(1)
采用p 110结构的N-结构域搜索模型,得到了P140-P110N晶体的部分分子置换解。17。P140-P110N晶体的部分溶液在不对称单元中含有4个P110N亚基。这4个P110N亚基被组织成两对,每对亚基中的两个亚基通过精确的局部(非结晶)双轴关联。在这个部分溶液中,看不到与P 140相对应的密度。
(2)
从这部分溶液的P140-P110N晶体,产生了一个差异(Fo-FC)地图,在约3的分辨率。该差分图中的正密度,预计主要对应于P 140,通过使用局部双对称之一的平均(不使用任何掩模)进行了初步的增强。这种无遮掩的平均化也削弱了晶体中其他亚基的密度,这与局域双对称无关。在这个平均密度中,可以区分强密度和弱密度的连续区域,但还不可能从P 140中识别出任何由分子组成的特征。
(3)
冷冻电子层析成像(CET)整体图生殖器M.小睡17然后用于定义P 140的初始可能掩码。CET地图∼17决议,对应于P 140-p 110配合物的二聚体,其中p 110结构的拟合是明确的。通过叠加相应的P 110结构,将CET图放置在(Fo-FC)平均图上。然后,在与P 140相对应的CET信封内生成一个假定的“P 140初始图”作为(Fo-FC)平均密度。经过一些抛光(避免与相邻亚基重叠或保持连续密度的区域),使用假设的“P 140初始映射”进行分子替换搜索(使用程序相位),得到一个具有4个P110N结构和4个“P 140初始映射”的合理的可能解。试图直接使用CET地图上的密度进行分阶段,而不仅仅是作为一个掩码,在我们的手中没有成功。
(4)
然后用P140-P110N晶体进行密度平均(和溶剂压扁)迭代循环,并与人工调整P 140掩模进行交替。程序会聚给出更清晰和更连续的密度,虽然没有可以与P 140相对应的二级结构可见。很可能,两个非晶双轴的平行取向削弱了这种平均的相位功率。尽管有这些限制,新的密度(在更新的掩膜内)允许获得P1晶体的分子替换溶液。令人惊讶的是,新的密度并没有为单独的P 140晶体提供解决方案。
(5)
在P140-P110N晶体内进行平均密度修正,现在对P1晶体进行平均化处理(使用DMMULTI程序)67)很快地改进了地图。DMMULTI的迭代周期与P1晶体的相位扩展周期交替(使用phenix中的“自动构建”协议,分辨率为1.94)和人工调整平均掩模(更新约40次)。同时对P1和P 140进行了模型建立。通过对约50%的结构进行追踪,可以得到一种单独的P 140晶体的分子替换溶液,该溶液中含有6个亚基,从而促进了P1和P 140结构的完成。
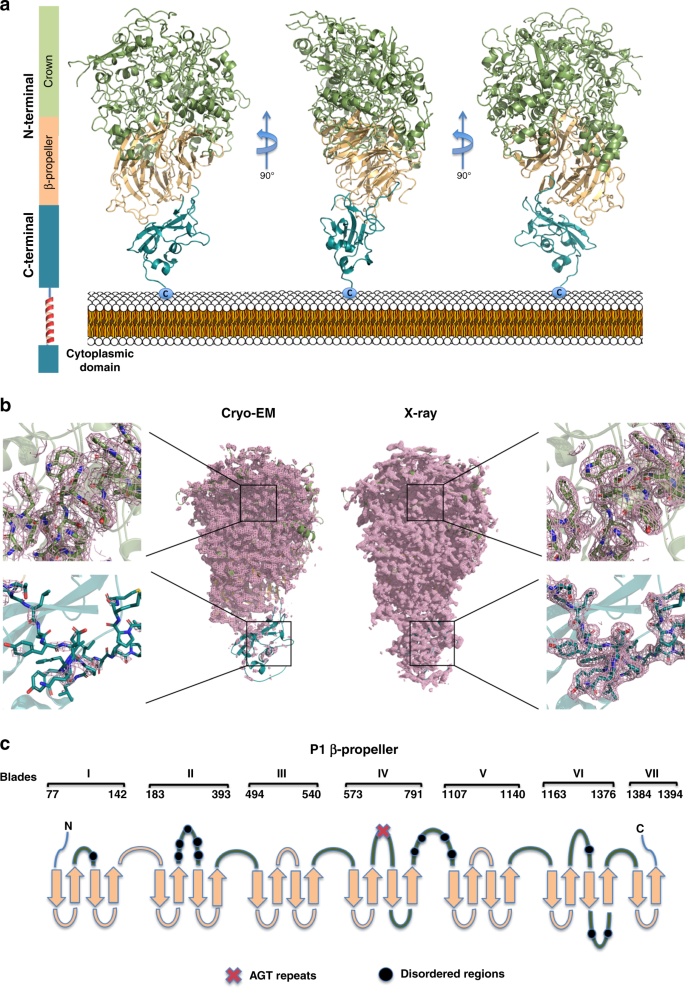
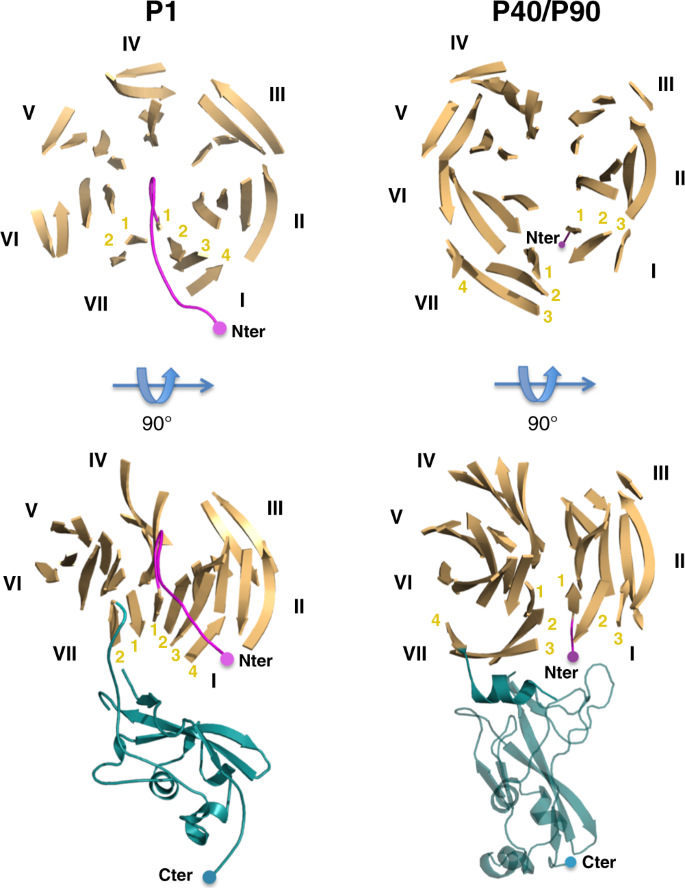
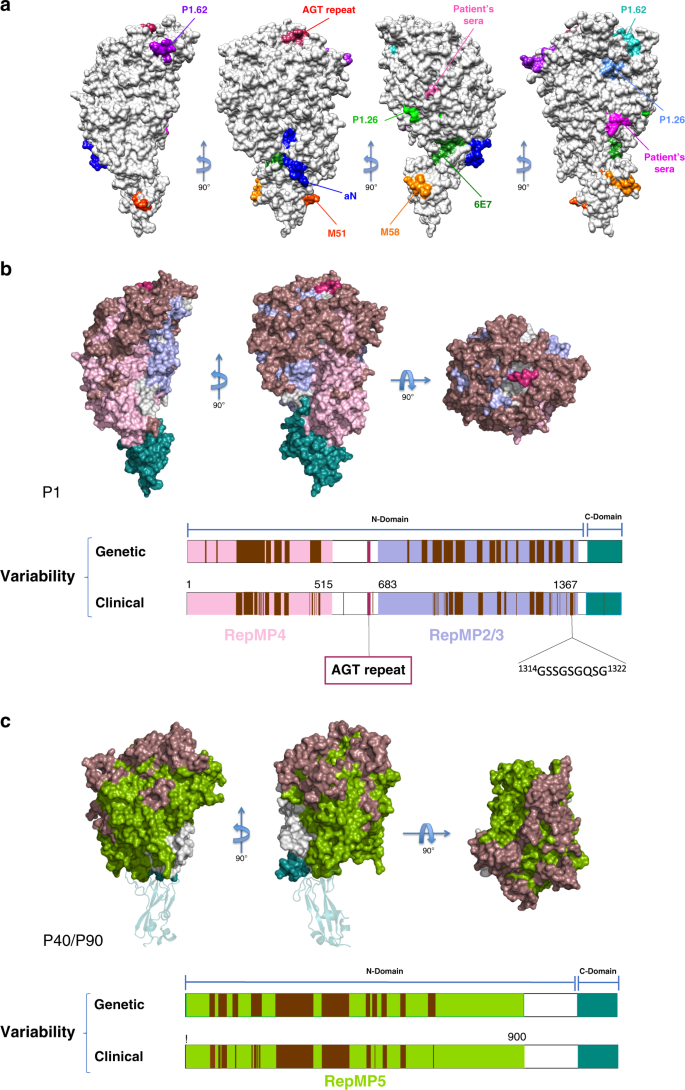
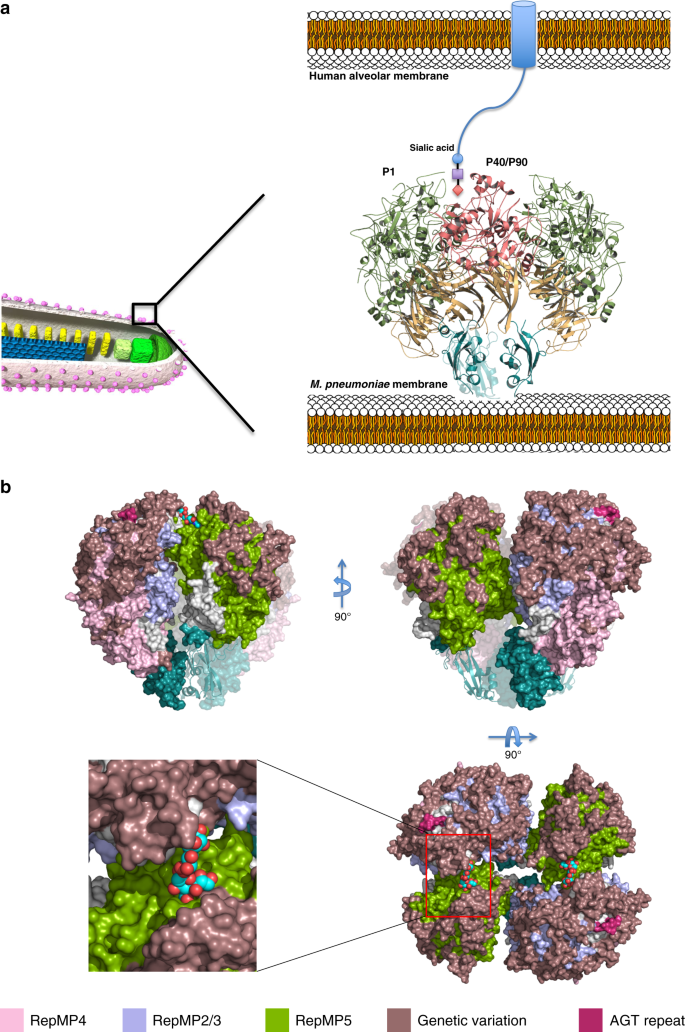
然后对P1进行了改进,给出了协议因素R和R免费分别为18.7%和22.9%(补充表)1)。传统上利用这两个因素之间的差异来评估可用的分子模型对相应的实验衍射数据的解释程度。这两种因素之间的差异与模型在精化过程中引入的偏差有关。尽管最终地图的质量(图)。2BP1结构在N-端(缺失残基29-59)和14个循环(102-105、228-230、259-268、278-282、298-300、337-348、831-847、870-888、923-928、941-944、1226-1232、1308-1324、1341-1349和1482-1495)出现了大量无序残基。最后改进的结构已经用代码6RC 9存放在PDB中。
P40/P90结构的测定
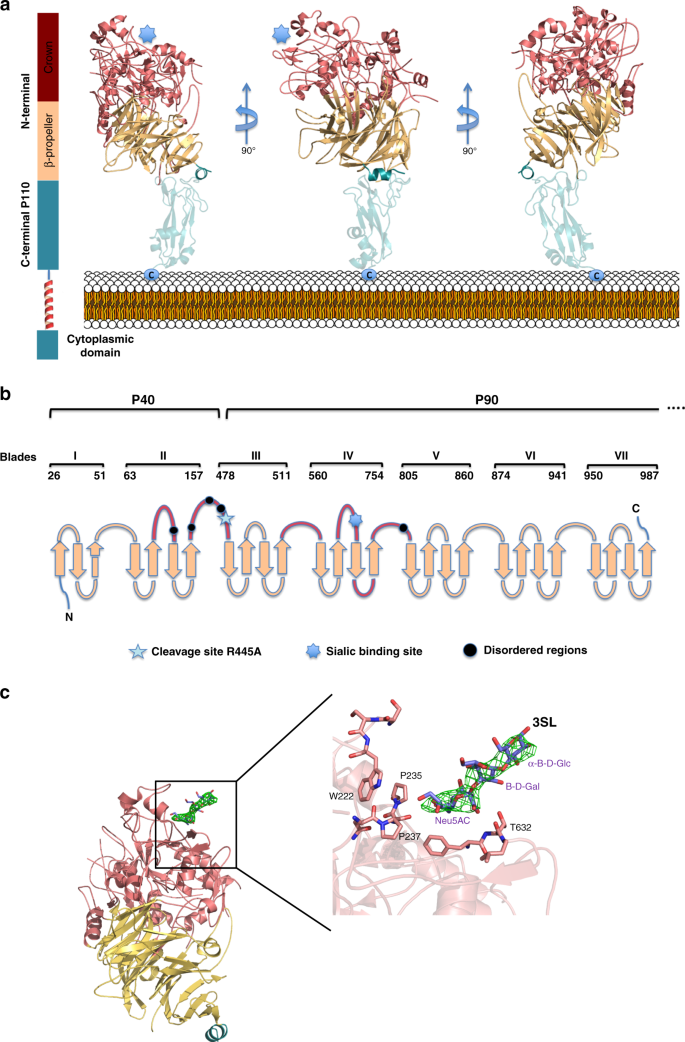
P40/P90晶体属P2空间群12121并在非对称单元中包含两个子单元。用程序Phaser代替分子进行了结构求解。68同源蛋白p 110的结构作为搜索模型生殖器M.(PDB代码6R3T)。对P40/P90的结构在2.65的分辨率下进行了细化,给出了一致因子R和R免费分别为21.4%和23.4%(补充表)1)。P40/P90与3SL和6SL的配合物晶体属C2空间,虽然具有拟正交晶胞尺寸,但在不对称单元中含有一个亚基。3SL晶体具有良好的寡糖结构,在3.2oA处具有较高的占用率。解析度为2.8的6SL晶体具有一定的无序性和整体弱密度,被解释为部分占位。
所有结构的跟踪和精化都是与coot程序交替进行交互和自动循环的。69巴斯特70分别。最终的精细结构已在PDB中沉积,编码为:6RJ1用于P40/P90,6TLZ用于3SL配合物,6TM0用于6SL配合物。
单粒子冷冻-EM
将纯化的P1蛋白应用于定量箔孔碳网(R1.2/1.3,Cu,200目)上,覆盖一层Go薄片(Sigma-Aldrich),在4°C、100%湿度条件下涂抹4.5s,用VitoFisher科学机器人MarkIV(Meo Fisher Science)冷冻在液态乙烷中。在300 kV加速电压下工作的Titan Krios(MEMO Fisher科学)获得了冷电磁成像,并配备了CS校正器(CEO,GmbH)和猎鹰III型直流电探测器(MEMO Fisher Science)。在电子计数模式下,共获得5279部电影,物理像素尺寸为0.69ao/像素,总剂量为60e/ha。2暴露时间为36.33秒。数据由EPU软件自动采集,离焦范围为−0.75~−2.75m,分为78帧。
单粒子冷电镜图像处理
电影帧随后对齐,以纠正光束引起的运动和漂移使用MotionCor2。71,利用gctf估计对比传递函数。72。共有4,574,424个粒子图像是自动使用GAutomatch(Http://www.mrc-lmb.cam.ac.uk/kzhang/)并使用Relion-2.1进行了几轮2D分类和3D分类。73。从优秀的2D类中选取295,195幅粒子图像,用cryoSPARC建立P1的初始模型。74。第一次和第二次三维分类分别以7.5度和3.7度的角度采样间隔计算。最后,对来自最佳3D类的68,014个粒子进行了三维细化,得到了分辨率为2.88av和B-因子为89个的重构。2与金标准的fsc标准(fsc≥0.143)。使用Relion-2.1估计了当地的分辨率。处理策略在附图中描述。2A-d补充表中的模型求精统计2.
SEC-MALS分析
采用Superose 6 10/300 GL(GE保健)柱,在黎明HeleosⅡ多角光散射检测器(MALS)和光学T-REX折射率检测器(Wyatt Technology)的基础上,测定了P40/P90短结构的分子量。使用ATRA 7软件(Wyatt Technology)进行数据处理和结果分析。计算时假定DN/DC值为0.185 ml/g(典型蛋白质)。
抗体产生与验证
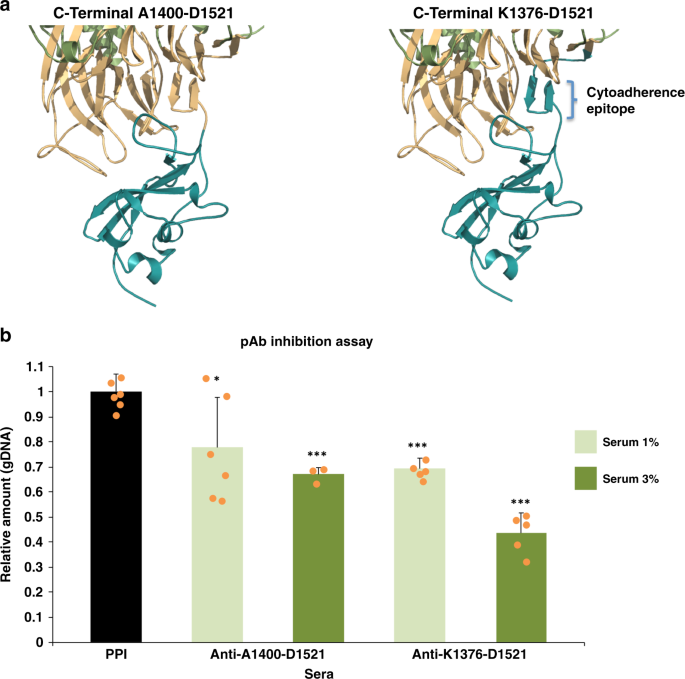
由Eurogentec制备了抗粘附素P1的多克隆抗体。短期内,大鼠注射多肽Lys 1376-Asp1521或Ala140-Asp1521,第28天采血。免疫前出血也作为阴性对照。采用免疫印迹法检测多克隆抗体对支原体细胞重组肽和蛋白提取液的特异性。每种抗体的稀释度为1:500。
多克隆抗体的生产符合动物试验和研究的伦理规定。它符合下列协会的要求:欧洲实验室动物科学协会联合会和英国内政部动物科学程序法。
Eurogentec遵循的条例是:2010/63/EU和01/2005/EU。
定量粘附试验
肺炎支原体(Atcc 29343)在hyflick培养基中的T75瓶中培养24小时,通过刮取收获,再悬浮在hayflick培养基中,直到最后浓度为10。7细胞/ml:在室温下,在旋转轮上孵育1 ml细胞悬液(1、3、6和10%浓度),其中含有抗Lys 1376-Asp1521或Ala140-Asp1521多肽的多克隆抗体,是否含有相应肽的2g。免疫前血清为阴性对照。细胞培养后,将细胞悬液接种于24孔板中,37℃下孵育,使细胞粘附在塑料上。2h后,用MasterPure DNA纯化试剂盒(Epientre#MCD 85201)收集上清液(含不粘附于塑料的细胞的分数)和附加细胞进行gDNA提取。样品一式三份,用SYBR绿色PCR主试剂(Thermo#4367659)qPCR测定细胞的相对数量,采用LightCycler 480型实时PCR仪(Roche)进行定量,条件为:95°C变性10 s,95°C扩增15 s,60°C扩增1 min,95°C扩增15s,60°C扩增15s,95°C扩增1 min,熔融曲线为95°C,15 s,95°C,95°C,15 s,95°C,95°连续。采用以下寡核苷酸:qPCR myco FW 5‘-ACGATGATCAGGCGGTTC-3’和qPCR myco RV 5‘-GTTGTCCTCTTTTGAT-3’。
免疫分析
诊断肺炎支原体是利用联络进行的肺炎支原体IgG,IgM试剂盒(DiaSorin)使用1/100稀释病人血清。采用间接ELISA法对96孔板、Immulon 4、HBX 96井板(热Fisher)进行间接ELISA检测,每种抗原在4°C下孵育1 g。每例患者血清加入1/100稀释液,用HRP结合抗人IgG抗体检测。用100μl的底物(热裂变材料)孵育30 min后,用Triturus ELISA仪(Grifols)在450 nm处加入100μl的硫酸,停止反应,在450 nm处读出吸光度。参比滤光片为620 nm。
伦理认可
这项研究得到了来自Parc Taulí(参考文献2019/664)和Vall d‘Hebron大学医院(PR(AG)24/2020)的药物研究伦理委员会的批准。
电感耦合等离子体质谱
样品用1ml的HNO消化。3加0.5毫升H2O2在90°C封闭聚四氟乙烯反应器中,用ICP-MS在Agilent 7500 Ce仪上对ZN标准溶液(InorganicVentures)稀释法制备的校准线实现了锌的测定。
表面等离子体共振
用Biacore 3000生物传感器平台(GE生物系统)用SPR测定结合动力学,该平台配有研究级链霉亲和素涂层生物传感器芯片SA。用3次1 min注射1M NaCl和50 mm NaOH对芯片进行预处理.随后,在20 mm Tris pH7.4、150 mM NaCl和0.05%Tween 20稀释10 g/ml的条件下,分别加载芯片的第二和第三流细胞,分别加入低聚糖6SL-PAA-生物素和3 SL-PAA-生物素(碳合成酶)。值得一提的是,所使用的配体含有一条长的聚丙烯酰胺链,将生物素化的化学连接标记与低聚糖连接起来,这将避免生物素与所使用的P1和P40/P90样品之间的大部分空间冲突。所获得的固定水平在∼200个响应单元和第一个单元格留空作为参考。在25°C(P40/P90的0.9、1.9、3.7和7.5M,P40/P90的1.0、2.0、4.0、16.0和32.0μm的P40/P90和P1的1.0、2.0、4.0、16.0和32.0μm)的25°C下,以30μl/min的流速注入一系列稀释浓度。在P1、120和240 s,P40/P90分别允许蛋白质结合和解离60和120 s。解离后为30s再生,30℃/min时为0.05%SDS。采用Langmuir 1:1结合模型对数据进行拟合,利用Bia估测3.1软件确定平衡离解常数KD.