学科信息 在本研究中,我们选择了健康对照组(HC)、发热对照组(FC,发烧但未诊断为KD)和KD患者。表 1 结果表明,三组受试者的年龄和性别差异均无显着性。所有KD受试者均符合2004年美国医学会的要求。 25 或JCS 2008诊断标准。
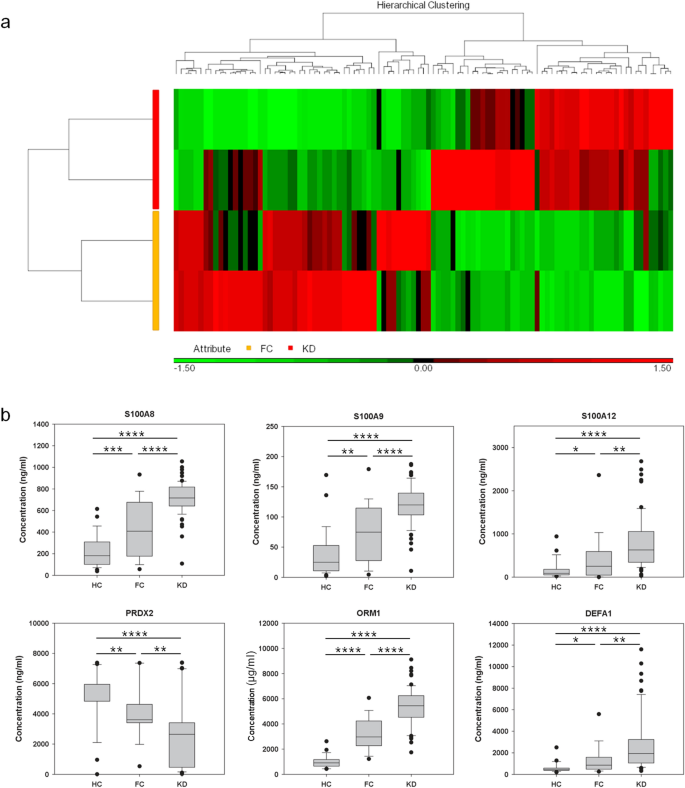
ITRAq无凝胶蛋白质组学全球筛选血清蛋白 我们最初用iTRAQ无凝胶蛋白质组学分析了两份混合FC和两份KD血清样本.结果,我们检测到372种蛋白质(补充表)。 1 )在这些样品中,根据两个具体参数(蛋白质组发现器V2.4的参数):FDR用于蛋白质和肽的鉴定<0.01,蛋白质的数目与唯一的肽相匹配。 ≧ 1.然后将蛋白质丰度表输入Partek软件(版本:7.0, Https://www.partek.com/ ,进行变异分析(KD对FC)。如图所示。 1 A.我们鉴定出101个变异大于1.25倍的蛋白质.图形 1 其中近一半蛋白质在FC样品中丰度较高,其余一半蛋白质在KD样品中含量较高。
图1 血清蛋白谱。( a )我们用iTRAQ无凝胶蛋白质组学测定血清蛋白质的相对强度。在这个热图中,只有101个平均变异大于1.25倍的蛋白质。( b FC和KD患者在明确诊断和治疗前抽血。在这些不同的蛋白质中,S100A8、A9和A12由于其炎症作用而被选为进一步的ELISA验证。 56 。DEFA 1、PRDX 2和ORM 1也包括在内,因为它们与GO函数相连(表) 2 )两种混合FC和两种混合KD血清样品的丰度趋势是可重复的。*、**、*和*分别表示p-值<0.001、0.01、0.001和0.0001。
为了评价蛋白质组学结果的可靠性和推测这些不同蛋白质的可能功能,我们还进行了GO分析。表 2 证明10个最重要的GO项目中有7个是炎症、免疫或应激相关功能,这与KD是一种急性炎症疾病的事实是一致的。此外,KD还具有氧化应激的特点。 26 ,27 。因此,iTRAQ无凝胶蛋白质组学提供了一个值得进一步研究的可靠数据集.
ELISA特异性鉴定KD生物标志物 在蛋白质组学检测的蛋白质中,我们选择了S100A8、S100A9、S100A12、PRDX 2、ORM 1和DEFA 1对HC、FC和KD血清样品进行了ELISA检测。FC和KD患者在明确诊断和治疗前(KD急性期)抽血。蛋白质浓度的统计值列于表中。 3 。图形 1 结果表明,HC和FC之间以及FC与KD之间的蛋白质浓度差异显著。此外,6种蛋白质中有5种表现出明显的浓度梯度,从HC到FC,从FC到KD逐渐增加。然而,PRDX 2的丰度趋势与其他5种蛋白质的丰度趋势相反,从HC到FC和从FC到KD逐渐减少。总之,这六种有效的蛋白质可以作为KD的生物标记物。
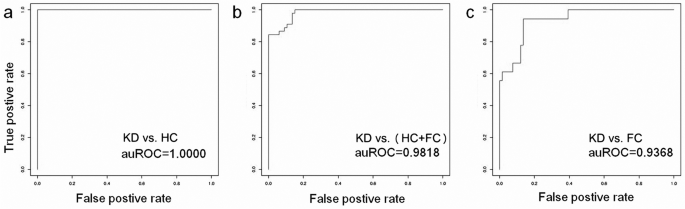
基于蛋白质的KD预测模型的推导 我们进一步利用六种蛋白质生物标记物的浓度,利用一种机器学习算法,支持向量机(SVM,lib-svm Version 3.22),推导出KD预测模型。 21 ,28 。总之,我们首先进行了十倍交叉验证,得出了最佳参数:γ=0.03125和成本=4。然后,通过指定这两个参数,我们使用所有数据点(所有样本中6个蛋白质的浓度)来训练预测模型。如图所示。 2 当KD集与HC、HC+FC和FC集比较时,AuROC值分别达到1.0000、0.9818和0.9368。以KD与FC模型为例,其敏感性为0.93,特异性为0.86。当使用一个独立的队列(15 KD和10 FC样本,随机从初始样本集中分离出来)进行验证时,该预测模型报告了类似的性能,灵敏度为0.93,特异性为0.90。这种模式可能有助于及时识别KD,并使儿科医生和研究人员能够提前做好准备工作。
图2 推导出的KD预测模型的性能。我们使用一种机器学习算法--支持向量机(SVM)来推导预测模型。KD受试者被用来区分( a )HC,( b )HC+FC和( c )FC学科,导致不同的auROC值。
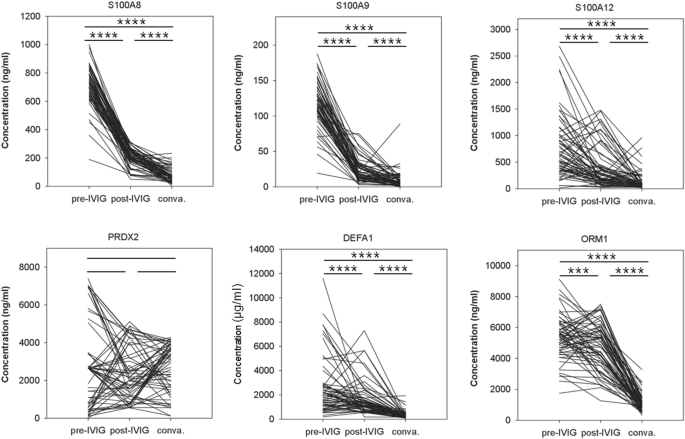
蛋白质浓度随IVIG剂量的变化而变化。 迄今为止,对KD患者而言,这些KD生物标志物的浓度仅在急性时相,即IVIG给药前(IVIG前阶段)测定。我们进一步研究了IVIG治疗后3天(IVIG后)和3周(恢复期)的变化。如图所示。 3 IVIG给药后5种蛋白水平逐渐降低,提示IVIG对全身炎症有较好的治疗作用。虽然总体模式反映了显著下降(例如,S100A12和ORM 1),但在许多样本中,静脉注射IVIG(IVIG后)后,几种蛋白质的浓度都增加了。我们用卡方比较下降是否与CAL形成或IVIG无反应相关。结果表明,两者之间没有显著差异。
图3 IVIG治疗前后6种血清蛋白的变化。大部分KD患者在注射IVIG前的急性期(IVIG前阶段)、IVIG注射后3天(IVIG后阶段)和IVIG用药后3周(恢复期)进行三次酶联免疫吸附试验(ELISA)。每一行在三个阶段给出了一个受试者的三个ELISA值。样本大小为78。*和*根据配对t检验分别表示p值<0.001和0.0001。
对于PRDX 2,IVIG给药前后的浓度变化不明显。三组蛋白质浓度的统计值亦载於表内。 3 。按表 3 S100A8、S100A9和DEFA 1的变异似乎反应过度。在恢复期(注射IVIG后3周),S100A8、S100A9和DEAF 1的浓度下降到比HC组更低的水平,低于健康对照组(附图)。 1 )。由于IVIG的使用,这种下降值得进一步注意。
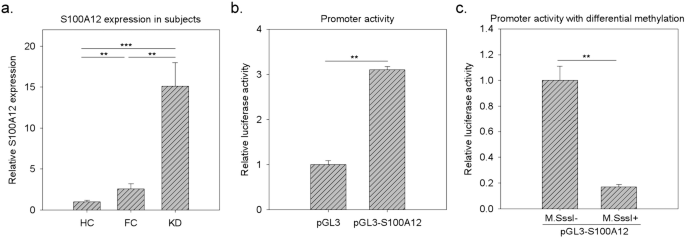
DNA低甲基化激活S100A12的表达 在六种被检测的血清蛋白中,我们对S100A12很感兴趣。
在炎症急性期,S100A12基因通常在中性粒细胞中高表达。 29 。血清s100a12蛋白在许多炎症相关疾病中也有升高的趋势。 30 ,31 。尽管S100A12在KD患者中也有升高的报道 32 ,33 它在KD发病机制中的作用尚不清楚。在我们之前的研究中 22 S100A12 mRNA水平在KD组高于HC组和FC组。此外,体内证据表明,在KD样品中S100A12的启动子区是低甲基化的。在本研究中,我们还检测了S100A12的mRNA水平。如图所示。 4 (A)KD组S100A12 mRNA水平显著高于FC组和HD组。然后,我们进一步进行了启动子甲基化检测。如图所示。 4 B,克隆的S100A12上游DNA片段具有启动子活性。此外,M.Sssi+处理(M.Sssi+)与非M.SssI处理(M.SssI-)相比,导致总DNA甲基化,导致荧光素酶活性下降(图1)。 4 c)。黄等人本研究分别为S100A12的表达受DNA甲基化调控提供了体内和体外证据。
图4 S100A12基因表达变异及启动子甲基化分析。( a )我们用qPCR技术检测了S100A12在WBC中的相对mRNA水平。 22 。WBC中S100A12基因的变化趋势与血清中S100A12蛋白的变化趋势一致。数据显示为2 -ΔΔCT 以18S基因为内对照。( b )与空载体pGL3-S100A12相比,pGL3-S100A12具有启动子活性。( c 携带S100A12启动子和荧光素酶的构建用M.SssI(完全甲基化)或未处理(非甲基化)处理,然后转染和荧光素酶检测。数据以平均±SD表示。**和*按t检验分别表示p-值<0.0 1和0.001.
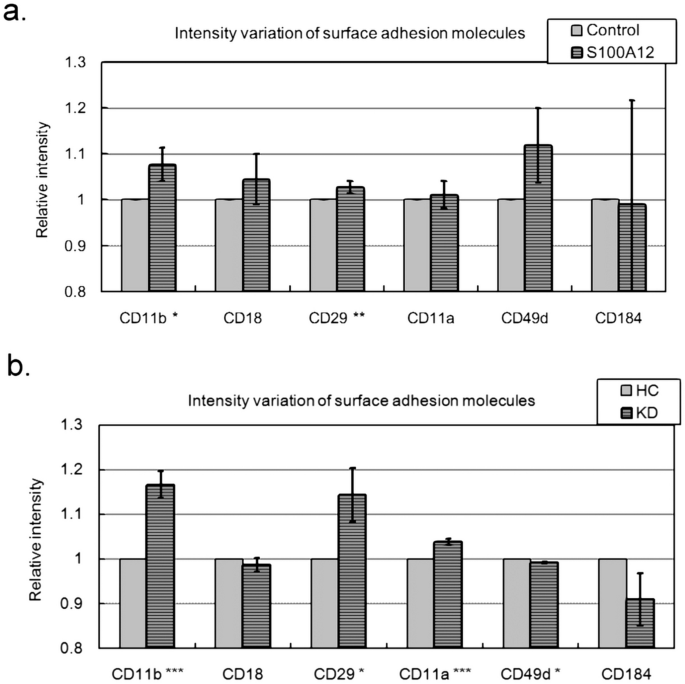
S100A12激活中性粒细胞粘附分子 在我们之前的研究中 22 经S100A12重组蛋白处理的中性粒细胞可促进中性粒细胞通过HCAEC层的浸润。因为白细胞和内皮细胞之间的粘附是白细胞浸润的关键步骤。 34 ,我们检查了s100a12是否激活了锚定在白细胞表面的六个粘附分子。 35 。如图所示。 5 经S100A12处理后,CD11b(ITGAM)和CD 29(ITGB 1)的强度(用流式细胞仪测定)明显增强。CD11b和CD 29的增强差异虽有显着性,但差异很小,均小于10%。因此,我们以血清治疗代替S100A12治疗(20%KD或HC血清样本),重复检测。图形 5 B显示KD血清与HC血清相比,其结果与S100A12相似。此外,川芎嗪治疗可使CD11b和CD 29增强最多17%。因此,在图中观察到的值。 5 A是合理的。
图5 在白细胞表面锚定的表面粘附分子的变化。我们用流式细胞术测定白细胞表面粘附分子的强度。( a 中性粒细胞用S100A12或不加S100A12处理24h后用流式细胞仪检测。( b 中性粒细胞用川芎嗪血清(平均混合血清)或HC血清(均合血清样品)处理24h,然后用流式细胞仪检测。数据以平均±SD表示。*、**和*分别表示p-值<0.001、0.0 1和0.001。
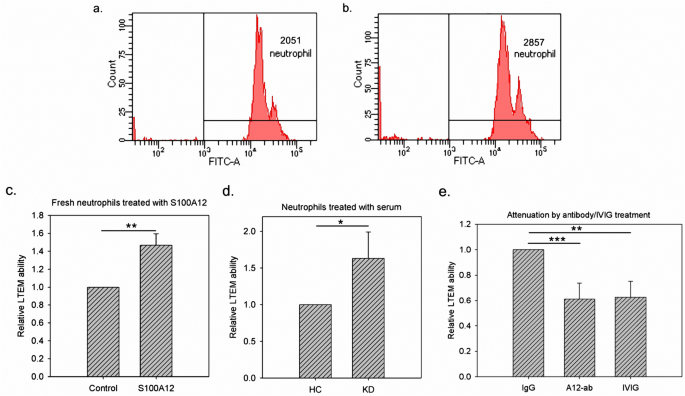
抗体抑制S100A12促进体外中性粒细胞浸润 我们先前研究的结论 22 是通过操纵中性粒细胞样细胞系(HL-60)制成的。我们还对一名健康成年男性志愿者捐献的新分离的中性粒细胞进行了白细胞跨内皮迁移(LTEM)检测。如图所示。 6 A、b、2,051和2,857个新分离的中性粒细胞分别经S100A12处理后进入内皮细胞层。通过三项独立的试验,S100A12处理显著促进新分离的中性粒细胞通过内皮层迁移1.5倍(图1.5)。 6 由健康男性捐献的新鲜中性粒细胞)。
图6 对中性粒细胞进行LTEM检测。( a ,b )临床新鲜分离的中性粒细胞未经S100A12处理或治疗,再经LTEM检测。与对照组相比,S100A12能使更多的中性粒细胞穿透内皮层(2,857对2,051)。( c S100A12处理能显著促进新鲜分离的中性粒细胞(由健康男性捐献)浸润并通过内皮层迁移。( d KD血清能促进中性粒细胞(细胞系)浸润约1.7倍,使我们可以通过血清治疗模拟KD病(n=3)。( e 同时用对照IgG、S100A12抗体或IVIG对KD血清处理的中性粒细胞(细胞系)进行LTEM检测(n=3)。数据以平均±SD表示。*、**、*和*分别表示p-值<0.001、0.01、0.001和0.0001。
接下来,我们研究了S100A12抗体是否能减轻S100A12促进的浸润。我们首先采用KD血清治疗来模拟KD。与S100A12类似,与HC血清相比,KD血清能显著促进中性粒细胞浸润,增加约1.7倍(图1)。 6 d)。当添加抗体中和KD血清中内源性S100A12蛋白时,这种促进作用减弱。 6 e)。此外,IVIG治疗效果与S100A12抗体相似(S100A12与IVIG无明显差异)。总之,抗S100A12抗体可抑制体外中性粒细胞浸润,与IVIG相似。