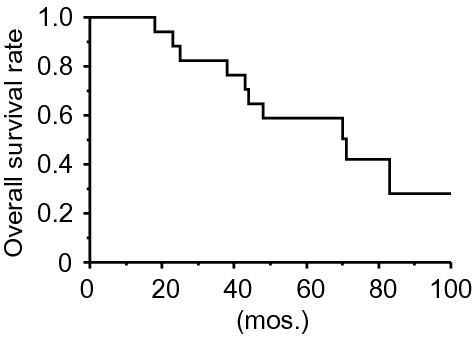
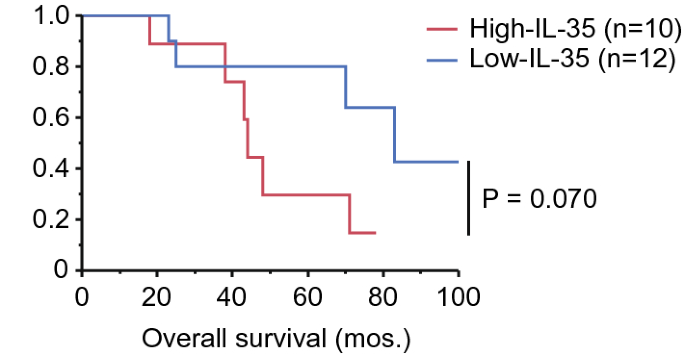
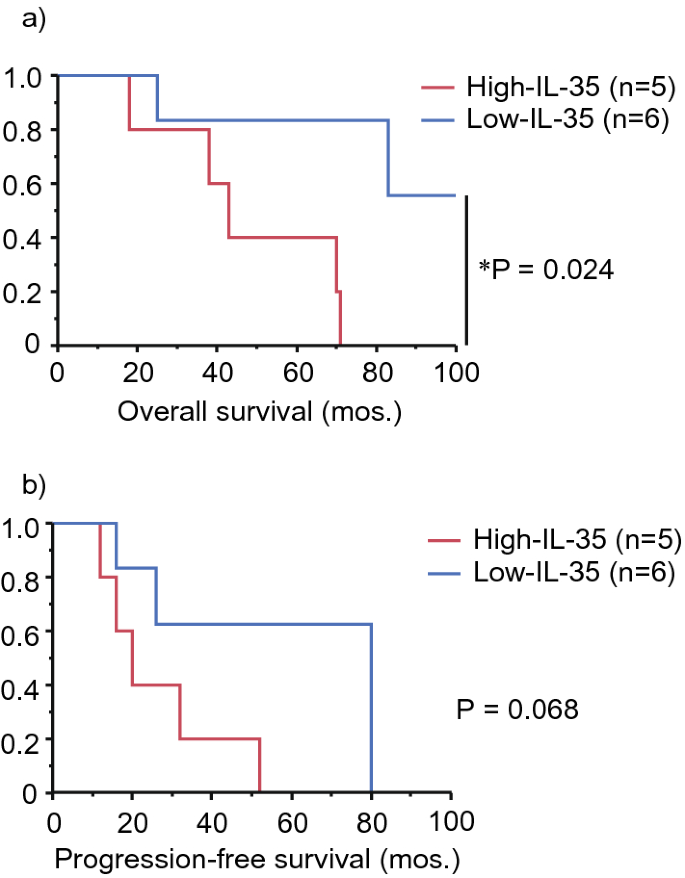
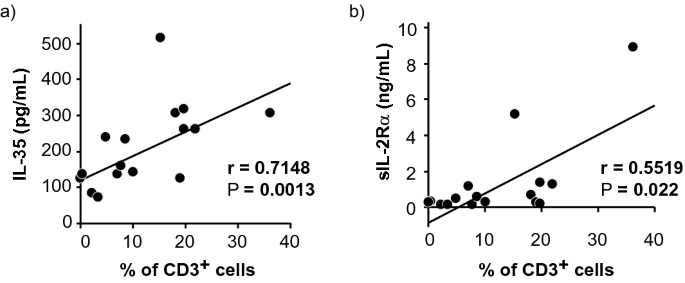
在本研究中,我们确定了B细胞VRL和NIU患者之间调节细胞因子的差异谱。玻璃体体液调节细胞因子谱显示,VRL组IL-10和IL-22水平高于NIU组和对照组,IL-35和sIL-2Rα水平高于对照组,IL-27水平高于对照组。在我们分析调节性细胞因子与临床参数,较高水平的IL-35是一个不良的结果在玻璃体体液在B细胞VRL的最初诊断。此外,IL-35和sIL-2Rα水平与CD3的密度呈正相关。+B细胞VRL玻璃体体液中的细胞。
虽然在本研究中,以HDMTX为基础的全身化疗和/或WBRT对中枢神经系统或中枢神经系统病变的治疗是有效的或导致完全缓解(CR),但治疗的效果是有限的,而不是持久的。最近,一种抗pd-1药物nivolumab被报道用于维持复发/难治性pcnsl患者的CR。28...Pd-1在活化的T细胞(如细胞毒性T淋巴细胞)上表达,与其配体pd-L1和pd-L2相互作用,这些配体通常由肿瘤细胞表达,从而增强了CTL中T细胞受体的抑制信号。29,30。IL-35可直接上调Tregs和骨髓源性抑制细胞(MdSCs)上pd-1受体的表达,通过促进TIL的抑制功能和T细胞耗竭而减弱T细胞介导的抗肿瘤免疫。16。提示针对PD-1或PD-L1的免疫检查点抑制剂对PVRL患者或复发或难治性DLBCL-VRL患者在最初诊断时玻璃体液中IL-35水平较高时预防中枢神经系统是有效的。此外,阻断IL-35是改善复发性或难治性DLBCL-VRL患者预后的重要指标之一。
IL-35不仅由Treg分泌,而且由B细胞、单核细胞、内皮细胞和平滑肌细胞分泌较少。25。IL-35能激活Tregs,将天真的T细胞转化为产生IL-35的诱导Treg细胞(iTr35细胞),这些细胞在TME中积累,并具有较强的抑制活性。31。萨万特等人表明Treg衍生的IL-10和IL-35通过调节CD8中多种抑制性受体的表达和T细胞耗竭而共同限制抗肿瘤免疫反应。+-TIL24。对乳腺癌标本的组织学分析表明,TILs中IL-35的高水平与晚期癌症的分期密切相关,导致pfs和OS水平下降。32。此外,在结直肠癌患者中,IL-35的表达与肿瘤的严重程度、肿瘤的临床分期、外周血Foxp 3的数量有关。+-Tregs33。此外,IL-35的表达被定义为复发的独立预后因子,并与CD 39呈正相关。+Foxp 3+-TIL在肝细胞癌中的浸润34。因此,这些报道和我们自己的结果表明TIL中的Tregs是IL-35的主要来源,IL-35参与了B细胞VRL患者TME的形成和随后的肿瘤进展。此外,据报道,肿瘤来源的IL-35能促进mdSCs在tme中的积聚,促进肿瘤血管生成,并抑制ctl反应以支持肿瘤生长。19。此外,dlbcl的基因表达分析表明,在接受全身化疗的dlbcl患者中,肿瘤细胞中IL-35表达的增加与OS的恶化有关。35。因此,我们的结果表明,DLBCL-VRL细胞和Tregs可诱导较高水平的IL-35在高IL-35组而非低IL-35组中表达,从而抑制抗肿瘤反应。此外,IL-10和IL-35通过诱导抑制性受体(包括pd-1)和T细胞耗竭CD8,增强了抗肿瘤免疫的协同作用。+肿瘤细胞一旦复发,白细胞介素10在B细胞VRL中大量分泌。
据报道,IL-27在几种癌症的抗肿瘤免疫中也发挥了抑制作用。36。IL-27是一种异二聚体细胞因子,它的一个亚基EBI 3与IL-35共有。IL-27在自身免疫性疾病中具有促炎或保护作用。36。然而,IL-27能促进ctl和自然杀伤细胞进入tme,从而增强抗肿瘤免疫。36。Dlbcl的免疫组织学分析显示,IL-27的另一个亚基IL-27p28没有表达,尽管他们都过表达了作为IL-35组成部分的EBI 3和IL-35p35。35。在本研究中,IL-27水平升高,但与B细胞VRL患者的预后无关,提示IL-27可能与抑制B细胞VRL的抗肿瘤免疫无关。
在此之前,我们已经证明sIL-2Rα水平预测了rvl中T细胞浸润到神经视网膜和/或视网膜下引起的组织破坏事件。27。在本研究中,我们发现sIL-2Rα水平与VRL患者的OS和PFS不相关。然而,有几项研究报道,血清sIL-2Rα水平对系统性dlbcl预后不利。37,38,39,40。SIL-2Rα和IL-2复合物促进IL-2依赖性Tregs的发育和功能,抑制CD8。+T细胞支持B细胞淋巴瘤生长41。最近,Yoshida等人。提示血清sIL-2Rα水平依赖于肿瘤相关巨噬细胞(TAM)向tME的浸润;tam-衍生的基质金属蛋白酶-9在结外dlbcl和滤泡淋巴瘤T细胞上的IL-2Rα的切割中起着关键作用。42。TAM在TME内积累,促进肿瘤的发展、侵袭和转移。43。总的来说,我们的数据与这些研究相一致,表明sIL-2Rα水平与TAM和CD3的浸润有关。+在VRL中,T细胞进入神经视网膜和/或视网膜下促进肿瘤侵袭,而不是抑制抗肿瘤免疫的Tregs。
Th22细胞与包括B细胞NHL在内的多种癌症的发生和发展有关。Th22细胞是新定义的T辅助细胞亚群,是IL-22和TNF-α的来源。44。最近发现,IL-22通过IL-22受体A1的异常表达促进多发性骨髓瘤和外套细胞淋巴瘤的肿瘤生长。45,46。此外,虽然Th22细胞的增加与B细胞NHL对化疗的不良反应有关,但Th22细胞的频率与血浆IL-22水平无关,因为IL-22不仅是由Th22细胞产生的,而且还有其他各种类型的细胞,如活化的T细胞和NK细胞。44。我们对IL-10相关细胞因子的评估显示,VRL患者的IL-22水平高于NIU患者和对照组,但与VRL患者的预后无关。因此,这些结果表明IL-22水平的升高与B细胞VRL的形成有关,IL-22的来源并不局限于Th22细胞,导致IL-22水平之间没有关联,导致我们的研究结果更糟。进一步研究Th22细胞在B细胞VRL发病机制中的作用是必要的。
本研究存在一定的局限性。首先,由于这是一个单一的中心回顾性研究,注册信息,病人数量,和变量评估无法事先设计。选择的偏见可能已经发生。其次,由于样本不足,样本规模小。更大样本的多中心研究可能需要澄清IL-35水平是否与VRL的预后有关。
通过对VRL患者玻璃体标本的多重珠分析,发现IL-35可能抑制VRL的抗肿瘤免疫,促进VRL的肿瘤生长,导致VRL患者预后不良。免疫介质的潜在靶向性,如免疫检查点抑制剂和中和IL-35,需要进一步的研究,以制定新的诊断和治疗策略。