人肿瘤基因表达数据的硅分析
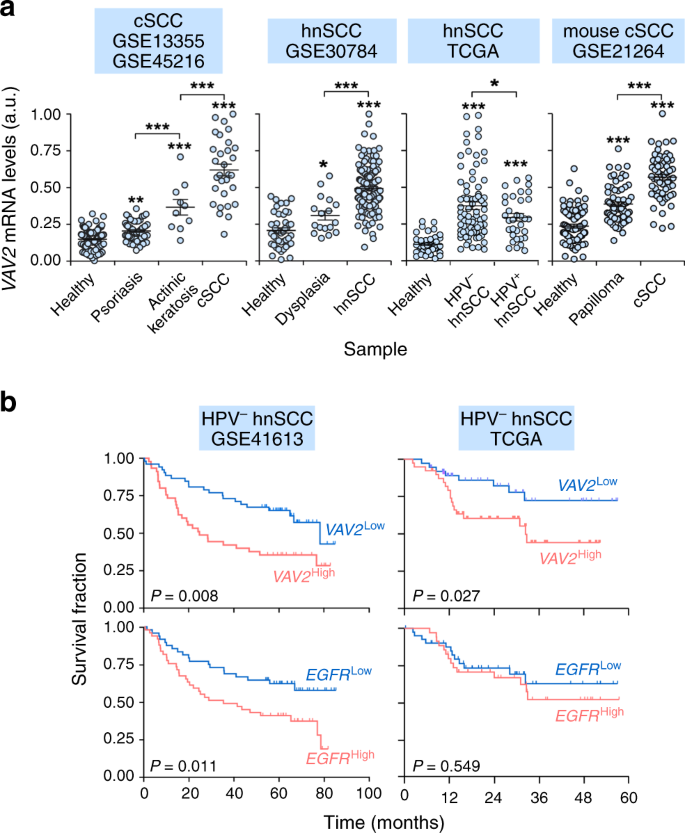
本研究中使用的所有基因表达数据都在补充表中详细列出。1。主要文本描述了选择用于差异表达式分析的表达式数据集的理由。具体而言,GEO数据集GSE 45216和GSE 13355(人类CSCC,n=220个样本)58,59、GSE 30784(人类HNSCC,n=229个样本)21、GSE 21264(鼠标CSCC,n=273个样本)60和TCGA HNSCC数据集(n=573个样本)24被用来审问VAV 2MRNA表达水平(为此目的使用0到1的表达式值规范化)。其他数据集包括TCGA Cesc(n=319)61和LUSC(n=824)62,以及GEO T-所有数据集GSE 26713(n=117;用于图中。10)63。R(Version3.5.1)和Perl程序分别进行统计分析和最终文本处理。通过稳健多芯片平均(RMA),从CEL文件中获取微阵列数据的信号强度值。差异表达的基因被用于微阵列数据的线性模型(Limma)。64。调整后P应用本雅明-霍奇伯格校正法(错误发现率,FDR)计算多重比较值.应用TCGAbiolinks R软件包对头颈部、子宫颈和肺鳞癌TCGA数据集进行分析。65。当数据被分析为多个批次(GSE 45216和GSE 13355)时,使用frma消除批处理效果。66。根据GSE 41613所示转录本的表达水平,用Kaplan-Meier估计法进行总体生存分析。n=97个样本)67、GSE 42743(n=103)67,以及TCGA(见上文)HNSCC数据集。每种转录本的表达分布中位数用于建立低表达组和高表达组,然后应用Mantel-Cox检验统计验证其生存分布之间的差异。
人肿瘤标本HPV状态的测定
HPV检测采用p16免疫组化法、高危hpv DNA原位杂交法和gp5基因分型法。+/GP6+聚合酶链反应68。在第一例中,组织微阵列被切成3μm切片,并在Flex IHC显微镜下进行干燥(DAKOCytomation)。免疫组织化学染色工作站(DAKO自动染色工作站,DAKOCytomation),Envision系统和二氨基联苯胺显色剂为底物。主要抗体为p53(Do-7克隆,DAKO)和p16(克隆E6H4(Roche MTM实验室AG))。在第二例中,我们进行了生物素化原位杂交。人类乳头瘤病毒根据制造商的指示,针对HPV 16、18、31、33、35、39、45、51、52、56、58、59和68(达科细胞瘤)的DNA探针。这两种技术的结果总是由两个独立的病理学家来评估。在后一种情况下,从肿瘤标本中分离出的dna接受gp5。+/6+-用酶免疫分析法检测14种高危型HPV 16、18、31、33、35、39、45、51、52、56、58、59、66和68亚型。随后在Luminex平台上使用基于珠的阵列对感染进行基因分型。当gp 51=61 PCR阳性时,使用位于E7基因68.
免疫沉淀实验
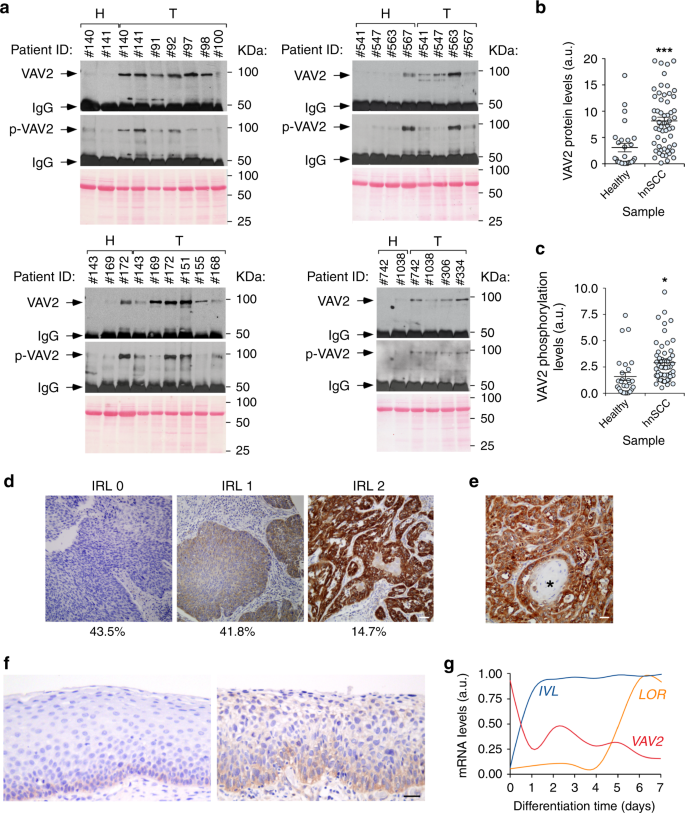
健康的粘膜,当包括在实验中,从相同的HNSCC患者获得(因此,他们被分配相同的识别号码如图所示。2A)。肿瘤和健康组织(补充表)5在RIPA缓冲液(10 mm Tris-HCl[pH8.0],150 mm NaCl,1%Triton X-100(Sigma-Aldrich,Catalog No.)X 100),1毫米钠3Vo4(Sigma-Aldrich,目录编号。S 6508),1毫米NAF(西格玛-奥尔德里奇,目录编号。和蛋白酶抑制剂(C mplete;Roche,Catalog No.11836145001)的混合物,使用温和的MACS解离器(Miltenyi Biotec,Catalog No.130-093-235)和gentleMACS M管(Myltenyi Biotec,Catalog No.130-096-335)。提取液经13,200 rpm离心,4°C离心10 min后,用Bradford反应(Bio-Rad,Catalog No.5000006)测定上清液中蛋白质浓度。4 0 0μg蛋白提取物在5 0 0μ1的RIPA缓冲液中与自制Vav2抗体(实验室编号5 80-2)的1.5μ1在4°C旋转轮中孵育2h。用Gammabind G-Sepharose微球(GE Healthcare,Catalog No.)的35μ1收集免疫复合物.在50%浓度下,在4°C的旋转轮中再放置2h。经4°C裂解缓冲液3次洗涤后,再悬浮于SDS-PAGE缓冲液中,煮沸5 min后,用iBlot干印迹系统(Thermo Fisher Science,Catalog No.)转入硝化棉滤池。IB21001)。5%牛血清白蛋白(Sigma-Aldrich,Catalog No.A 7906)在TBS-T(25 mm Tris-HCl(pH 8.0),150 mm NaCl,0.1%吐温-20(Sigma-Aldrich,目录编号)中.(P 7949))至少1小时,然后在4°C下用Vav2抗体(1:1000稀释度,见上文)在夜间孵育。剥离后,使用相同的过滤器进行第二次westernblot分析,使用抗磷酪氨酸残基的抗体(1:1000稀释度;Santa Cruz生物技术,目录编号)。(SC-7020)。经TBS-T三次冲洗去除原抗体后,在室温下与合适的二次抗体(1:5000稀释度,GE Healthcare)孵育30 min。免疫反应带是用标准化学发光法开发的(热费舍尔科学,目录编号32106)。用ImageJ软件(NIH,Www.imagej.nih.gov).
除蛋白质定量外,在SDS-PAGE凝胶免疫沉淀实验中对各组织裂解液中的总蛋白含量进行了测定,并将其转移到硝化纤维素滤膜上,用Ponceau S溶液(Sigma-Aldrich,Catalog No.)进行染色。(P 7170)。
在角质形成细胞培养中,成倍生长的细胞用磷酸盐缓冲液冲洗,用1ml的RIPA缓冲液加C mplete溶解。将细胞提取物保存在冰上5 min,然后在4°C下以13,200 rpm离心10 min,以消除细胞碎片。蛋白定量后,将裂解液与自制抗Vav2抗体的1.5μ1孵育,按上述方法处理。
细胞总提取物的Westernblotting分析
在组织提取物的情况下,样品被转移到RIPA缓冲液和机械均化使用温和MACS解离器。在培养的角质形成细胞中,用冷冻磷酸盐缓冲液冲洗细胞,然后在4°C的RIPA缓冲液中直接溶解,提取液在4℃下离心13,200 rpm离心10 min,在SDS-PAGE样品缓冲液中煮沸变性,电泳分离,用iBlot干斑点系统转移到硝化棉滤池中。按上述方法阻断膜,然后在4℃下用适当的Vav2(1:1000稀释度,自制)、GFP(1:5,000稀释度;Covance,目录编号)的抗体孵育一夜。MMS-118 p,血凝素(HA)表位(1:1,000稀释;细胞信号传递,目录编号3724),RAC 1(1:1,000稀释;BD生物科学,目录编号610651),RhoA(1:1,000稀释;细胞信号传递,目录编号2117),Cdc 42(1:1,000稀释;Santa Cruz生物技术,目录编号:No.SC-87,c-Myc(1:1,000稀释;Merck,目录编号06-340)和微管蛋白α(1:2,000稀释;CalBiochem,目录编号:.(CP 06)。用TBS-T三次冲洗去除原抗体后,可见上述免疫反应带。
免疫组织化学在患者标本中的应用
回顾性收集1990年至2010年在中央大学医院接受肿瘤切除的HNSCC患者的外科组织标本。将福尔马林固定的石蜡包埋组织切成3m切片,在Flex IHC显微镜片(Agilent,Catalog No.)上进行干燥。(K 8020)。切片用标准二甲苯分离,经分级醇水化而成。抗原提取采用Envision Flex靶标检索液,高pH值(达科欧姆尼斯,目录编号)。(GV 804)。在室温下,在自动染色工作站上进行染色(达科·欧姆尼斯,目录编号)。用兔抗VAV 2单克隆抗体(ABCAM,Catalog No.Ab52640;1:50稀释)。用苏木精进行染色。随机分为阴性(0)、弱至中(1)或强(2)。在这些分析中使用的所有肿瘤样本中有96.55%是人乳头瘤病毒。−.
小鼠实验
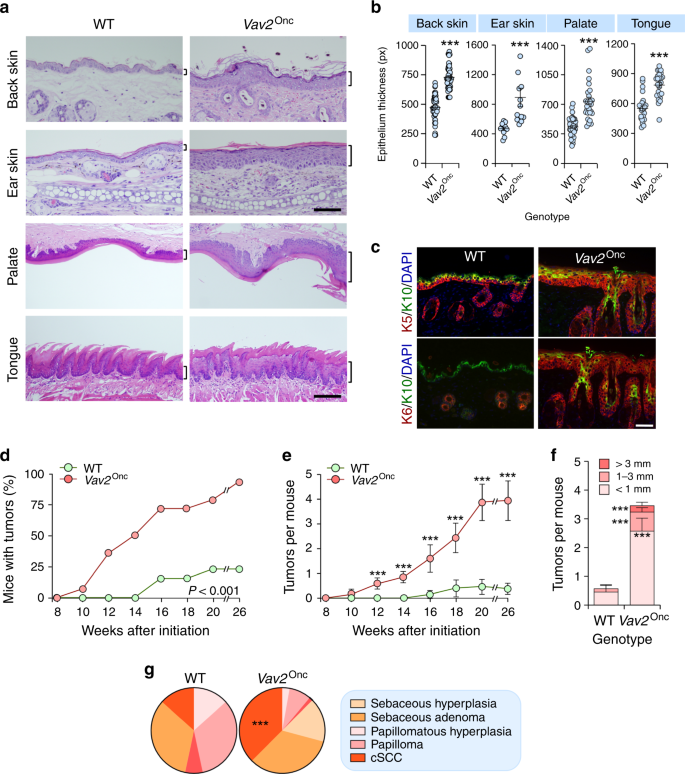
Vav2ONC/ONC和Vav1–/–;Vav2–/–;Vav3–/–老鼠已经在其他地方被描述过了。17,29。在无菌环境中,在温度控制(23℃)、湿度(50%)、光照(12 h光/12 h暗周期)条件下,将动物饲养在通风室中。在新生小鼠的致癌实验中,3日龄小鼠单次应用5g DMBA(Sigma-Aldrich,Catalog No.(D 3254)在200升丙酮中。每周监测肿瘤的数量、大小和发生率。WT和Wt上皮在体反应的时程研究Vav2ONC/ONC用上皮增生法和BrdU掺入法检测小鼠对TPA的影响。17。安乐死后,采集肿瘤和组织标本进行组织学和免疫组化分析。
在原位异种移植实验中,用Accuase(CellnTec,Catalog No.)分离指数生长的HNSCC患者细胞。Cnt-酰基酶-100),300×离心g5分钟,再悬浮于1.7×10的培养基中6细胞每毫升5×104然后在6周龄至8周龄的舌部使用一根8毫米针(bd,目录编号320927),原位导入scc细胞。Vav1–/–;Vav2–/–;Vav3–/–小鼠先前通过腹腔注射10毫克/毫升氯胺酮(MerialCatalog No.Imalgene 1000)和2mg/ml西拉津(拜耳,目录编号)。在磷酸盐缓冲溶液中。然后在体内成像系统中使用IVIS Lumina定期显示肿瘤的生长情况(PerkinElmer,Catalog No.CLS 136334)在给D-荧光素酶(Goldbio,Catalog No.)5毫克/毫升溶液50毫升.祝老鼠好运。这一过程是与上述麻醉动物进行的。小鼠经腹腔注射1 mg/ml阿替帕唑200μg/ml(厄瓜多尔噬菌体,目录编号)后恢复活力。在磷酸盐缓冲盐水中的溶液。安乐死后,取肿瘤进行病理和免疫组化分析。
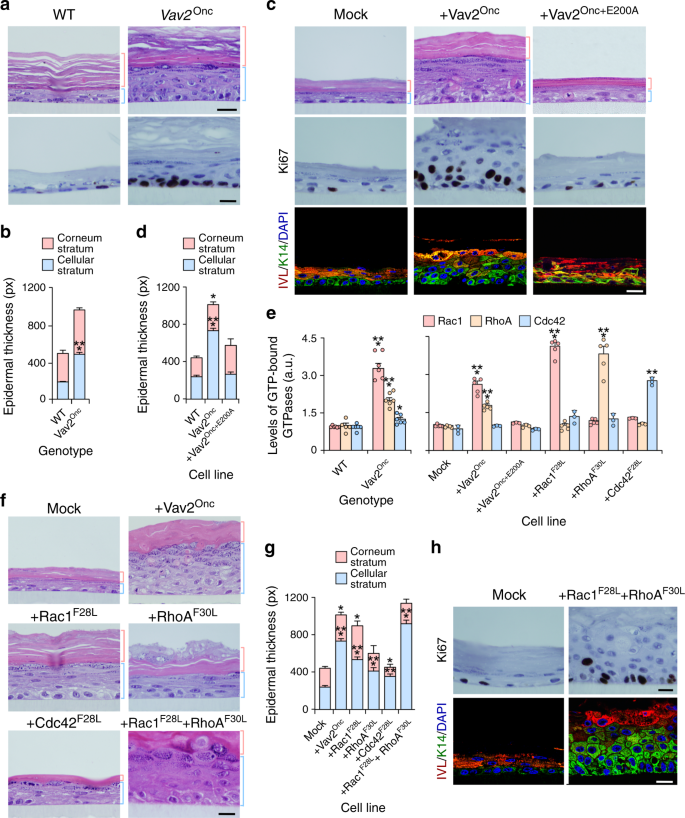
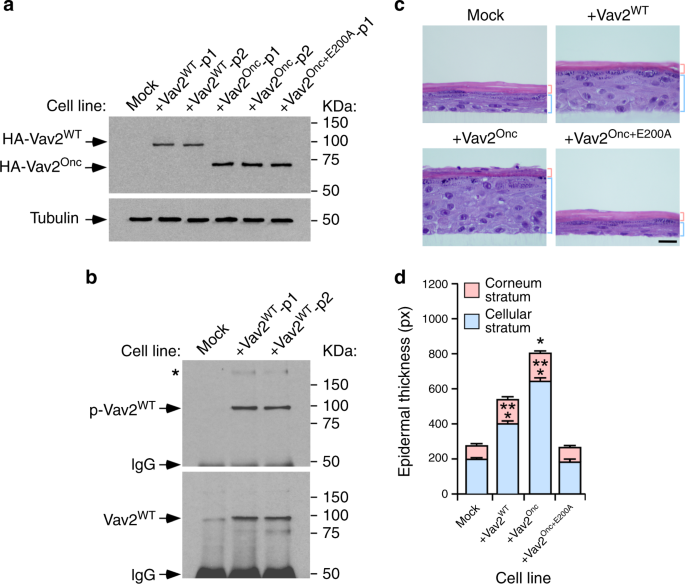
必要时取组织,用4%多聚甲醛固定,石蜡包埋,切2~3m厚切片,用苏木精-伊红染色。用ImageJ软件在垂直横截面上测量表皮层厚度和/或皮肤总厚度。在肿瘤切片中,由病理学家对其进行盲目分析,根据肿瘤的恶性程度和分化程度对其进行分类。
小鼠免疫组织化学研究
免疫组织化学染色用文塔纳发现超仪器(罗氏,目录编号05987750001)。石蜡包埋切片经柠檬酸缓冲液[pH6.0]或Tris EDTA(pH8.0)热诱导抗原提取,用适当的c-Fos(1:50稀释,Santa Cruz生物技术,目录编号)一抗孵育40 min。SC-166940),c-Myc(1:50稀释,ABCAM,目录编号.YAP(1:200稀释度,Novus生物制剂,目录编号:NB 110-58358),Cyclin D1(1:200稀释,罗氏,目录编号790-4508),角蛋白14(1:300稀释,Biolegend,目录编号905301),或雪莲素(1:100稀释,Sigma-Aldrich,Catalog No.I 9018)。标准染色采用DiscoveryOmniMap抗RbHRP检测系统(Roche,Catalog No.760-4311)进行检测,苏木精用于对抗染色。用ImageJ软件对免疫组化信号进行定量,将信号阈值调整到染色强度,并测量产生的颗粒面积。
细胞
原代角质形成细胞如别处所述被分离出来。17。第二天(4°C),用2 5 0U/ml的放散酶(罗氏04942078001号)处理新生小鼠皮肤,分离表皮,在37°C下用针刺酶处理30 min,提取角质形成细胞。在CnT 07培养基上保存培养物(CellnTec,目录编号)。(cnt-07)I型胶原预涂板(BD生物科学,目录编号356400)。
永生化的,初级新生儿角质形成细胞(KerCT细胞)是从美国型培养集(目录编号)购买的。CRL-4048),在KGM-Gold培养基(Lonza,目录编号00192060)中培养。这些细胞通过体外表达人TERT和CDK 4而永生化。从S.A.B.中获得SCC-25细胞,在KSFM培养基(热费雪科学,目录编号17005-042)中添加25 g/ml牛垂体提取物(Thermo Fisher Science,Catalog No.17005-042)和0.5 ng/ml人表皮生长因子(Thermo Fisher Science,Catalog No.17005-042)。
Hnscc(舌位)患者来源的细胞在其他地方也有描述。35。VdH 15细胞在KSFM培养基中加入25μg/ml牛垂体提取物和0.5ng/ml人表皮生长因子(Thermo Fisher Science,Catalog No.17005~042)。流式细胞术培养VdH 01细胞+培养基由DMEM的三部分组成(吉布科,目录编号21969)和火腿F12培养基的一部分(Thermo Fisher Science,目录编号11765054),外加10%的胎牛血清(吉布科,目录编号10270106),1.8×10–4M腺嘌呤(Sigma-Aldrich,目录编号.)A 2786-5G),0.5克/毫升氢化可的松(Sigma-Aldrich,目录编号。H4001-1G),5μg/ml胰岛素(热费舍尔科学,目录编号12585014),10 ng/ml表皮生长因子(PreproTech,Catalog No.(AF-100-15),10–10M霍乱毒素(Sigma-Aldrich,目录编号。C 8052-5mg)和2毫米L-谷氨酰胺(吉布科,目录编号25030024)。
三维有机培养
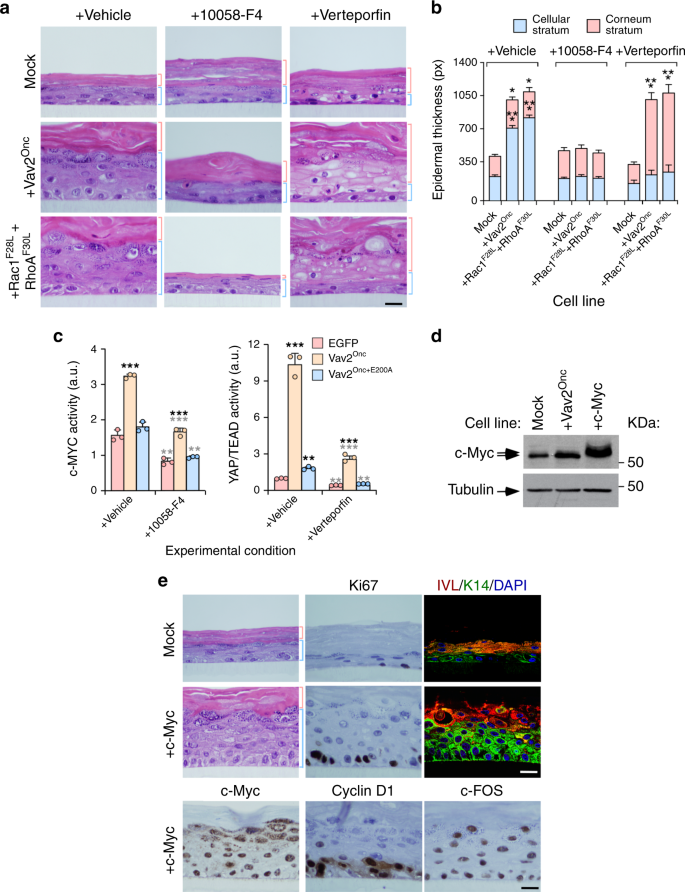
在CNT-Prime培养基中保持指数生长的角质形成细胞,用酰化酶分离,离心于300×。g室温下5 min,计数。2×105将细胞接种在聚碳酸酯插入物(ThermoFisher Science,Catalog No.140620)上,在CNT-主培养基中培养2天。汇合后,介质改为3D-势垒(CellnTec,Catalog No.CNT-PR-3D)和气举是按照制造商的指示进行的.3D培养12天,每周3次,最后进行组织学研究。当指示时,抑制剂和相应的车辆在进行空运后的第六天使用,并随着上述介质的变化而刷新。使用的抑制剂包括FRAX 597(5 NM;Selleckchem,目录编号)。S 7271),Y-27632 2 HCl(1 M;Selleckchem,目录编号。S 1049),1A116(500海里)39,10058-F4(500 NM;Selleckchem,目录编号:No.S 7153)和脊椎动物鳍(200 NM;Selleckchem,目录编号:No.(S 1786)。抑制剂浓度的选择是基于对控制细胞所形成的有机结构的小作用的诱导作用。
慢病毒介导的角质形成细胞蛋白表达
为获得稳定的细胞克隆,在DMEM(添加10%胎牛血清和2mm L-谷氨酰胺)中培养的HEK293T细胞中产生慢病毒颗粒,然后用LentiX浓缩试剂盒(Clontech,Catalog No.631232)浓缩。在KGM-Gold培养基中,在8g/ml聚苯存在下,用对照蛋白和编码慢病毒颗粒的蛋白感染角质形成细胞(Sigma-Aldrich,Catalog No.)。H 9268),流式细胞仪检测耐药性或EGFP的表达。在后一种情况下,我们使用FACSAria III流式细胞仪(BD生物科学)进行细胞纯化。如其他文献所述,转移的细胞是普罗霉素。17。Westernblot检测蛋白的表达情况。
Rho GTPase活化试验
按上述方法获得细胞总裂解物,快速冷冻,解冻,定量测定总蛋白浓度,并根据制造商的说明(细胞骨架,目录编号)使用Rac 1、RhoA和Cdc42G-Lisa分析试剂盒进行分析。(BK 135)。
微阵列实验
8周龄小鼠背部表皮总RNAn=3个基因型),用RNAeaseMini试剂盒(齐根,目录编号74104)进行分离,并按我们先前的描述,用基因芯片小鼠基因1.0ST阵列平台进行分析。17,55,69.
小鼠表达微阵列数据的硅分析
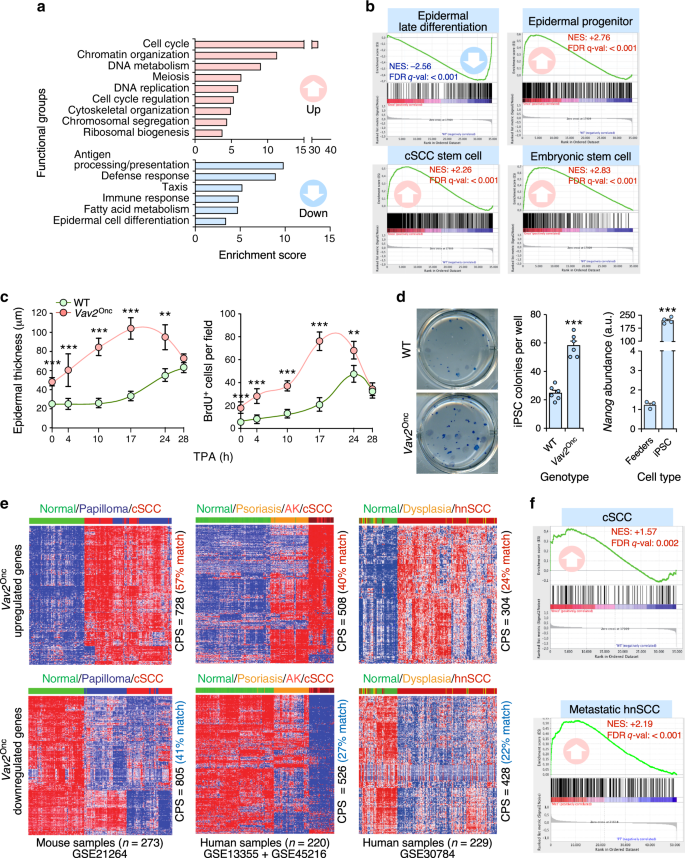
对人类数据进行了初步数据处理(见上文)。利用David和ToppFun进行基因本体和KEGG途径富集分析。GSEA使用基因组排列(n=1000)用于评估基因排序的显着性和信噪比指标。使用的基因集包括与表皮分化相关的标记(GSE 52954)。70;CSCC干细胞(GSE 29328)71;胚胎干细胞(GSE 10423)72;CSCC细胞(GSE 5576)73转移性HNSCC细胞(GSE 72939)35。我们还使用了ap1的转录目标列表。74,c-MYC75、E2F(广义研究所分子签名数据库签名#M40)、NFY(签名#C3:TFAC:0178来自宽研究所分子签名数据库)、YAP/TAZ/TEAD(GSE 66083)5,和FOXO(签名#C3:TFAC:0256来自宽研究所分子签名数据库)。评估Vav2激活的转录程序之间的相似性ONC并以GSE 45216和GSE 13355(人CSCC)、GSE 30784(人HNSCC)和GSE 21264(小鼠CSCC)为研究对象。评估Vav2的保护ONC通过肿瘤的转录信号,使用1.5倍的变化阈值。使用heatmap 3包生成热图。评价Vav2的富集程度ONC基因标记在SCC肿瘤中使用ssGSEA。
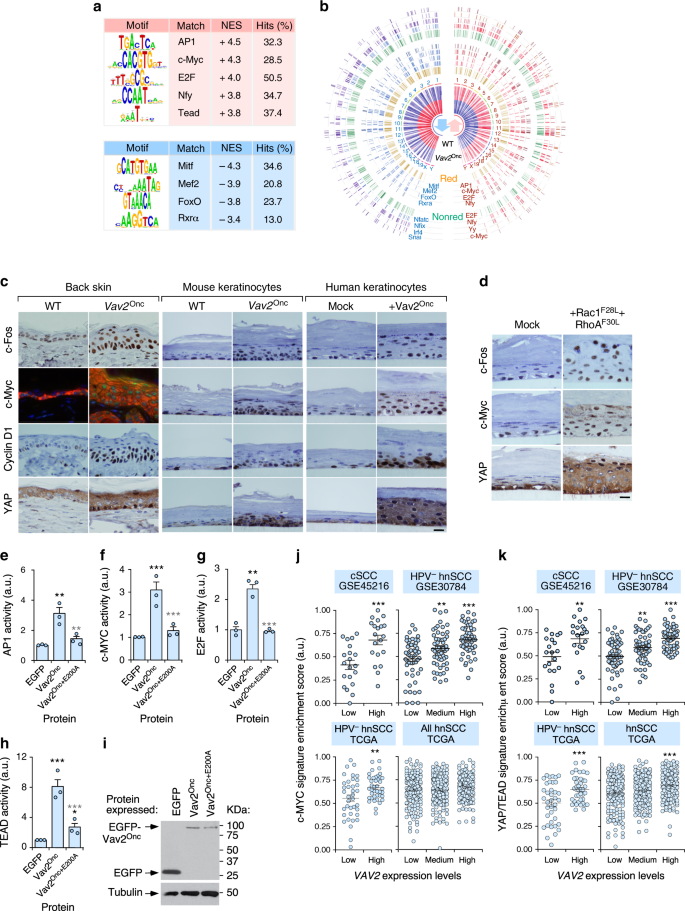
为了在共调控基因的启动子中发现转录因子结合基序,我们使用了iRegulon软件。47。收集了9713个位置权重矩阵(PWMS),分析了围绕转录起始点的10 kb长的DNA序列。以最大错误发现率(Fdr)为准则,对模体相似度低于0.001的情况进行了模体检测、跟踪发现、模因子映射和目标检测.Circos图是使用用UCSC基因组浏览器中的小鼠基因组数据实现的OmicCircos软件包生成的(Https://genome.ucsc.edu),基因本体联盟的基因本体注释(Http://www.geneontology.org),以及来自iRegulon工具的转录因子注释。
评价c-myc或yap基因信号与VAV 2在肿瘤中的mRNA水平,我们根据VAV 2表达水平(低、中、高,由分位数确定)并计算上述签名的ssGSEA富集分数。
诱导多能干细胞的产生
用编码Yamanaka因子的逆转录病毒粒子感染新生小鼠的原代角质形成细胞(8g/ml),2天后转移到由dmem-GlutaMAX(Thermo Fisher Science,Catalog No.31966-021)、15%敲除血清替换(Thermo Fisher Science,Catalog No.10828-028)、1x非必需氨基酸(Thermo Science,Catalog No.11140-035)、100 M2-巯基乙醇(Thermo Fisher Science,Catalog No.31350-010)和1×10组成的培养基中。3U/ml LIF(微孔,目录编号)(ESG 1107)。三天后,用针刺酶收集细胞,并在其他地方所述的饲养层上播种。76。允许iPS细胞集落生长2周,每日培养基变化,最后用碱性磷酸酶检测试剂盒(Sigma-Aldrich,Catalog No.)染色。根据制造商的指示。经qrt-PCR分析,进一步证实了真伪ips细胞的生成。奈诺表情。
MRNA丰度分析
用NZYol(NZYtech,Catalog No.)提取总RNA。MB18501)和定量RT-PCR,使用PowerSYBR绿色RNA到CT 1步试剂盒(应用生物系统,目录编号4389986)和StepOnePlus实时PCR系统(应用生物系统,目录编号4376600)进行。使用StepOne软件(应用生物系统)对原始数据进行分析。我们利用了内源的丰富度GAPDHMRNA作为内正常对照。用于转录定量的引物包括:5‘-GAC GGG GAA CTG AAA GTC CG-3’(正向,VAV 2),5‘-TTT TCC CGT Gagg ACT TCT TGAC-3’(反向,VAV 2),5‘-ATG GCC TTC CGT GTC CCC ACT G-3’(前进,GAPDH),5‘-TGA GTG TGG CAG GGA CCC A-3’(反向,GAPDH),5‘-AAG TAC CTC AGC CTC CAG CA-3’(前进,奈诺),5‘-GTG CTG AGC CCT TCT GAA TC-3’(反向,奈诺),5‘-TGC ACC ACC AAC TGC TTA GC-3’(前进,GAPDH),5‘-TCT TCT GGG TGG CAG TGA TG-3’(反向,GAPDH).
启动子激活试验
我们利用荧光素酶报告质粒评估本研究中询问的转录因子的激活状态。为此,以指数级增长的人角质形成细胞瞬时转染了40 ng的prl-sv 40载体,该载体编码雷尼拉在AP1-(pAP1-Luc)、c-Myc-(PBV-Myc-Del1-Luc)、E2F-(pGL2-Chk1-WT-Luc)和tead-(p8xGTIIC-Luc)的调控下,适宜的萤火虫报告质粒含有萤火虫荧光素酶基因2g。24h后,用被动裂解缓冲液(Promega,Cat No.用双荧光素酶分析系统(Promega,Cat No.)测定荧光素酶活性。(E 1960)。在所有情况下,每个实验点获得的萤火虫荧光素酶活性值都是标准化的,同时考虑到了萤火虫的活性。雷尼拉在同一样品中获得荧光素酶。此外,我们还用westernblot分析了同一种溶菌物的异形结构,以评估每一种情况下外胚层表达蛋白的适当表达情况。数值在图中表示为实验样本相对于控制细胞所显示的活性的n倍变化(在每种情况下给出的任意值为1)。在需要的时候,这些实验包括使用化学抑制剂,其浓度与3D有机培养中使用的浓度相同。
HNSCC患者来源细胞的基因组特征
用150 bp的配对末端阅读法,在韩国首尔的Macrogen(韩国首尔)对来自患者细胞的DNA样本进行测序。使用BWA-MEM(v0.7.17)将已测序的读序列映射到人类基因组总成GRCH 37。77使用Biobambam标记重复读取(v2.0.87)78。对于变量调用,GATK工具(v4.1.4.1)79用于检测替换和吲哚。每个样本都使用GVCF模式的单形调用器和使用CombineGVCFs、GenotypeGVCFs和VariantFil滤工具生成的连接调用队列进行调用。使用Delly的胚系实现调用了结构变体(v0.8.1)80。复制号状态是使用画布推断的(v1.40.0)81。对于变量注释,我们使用了Ensembl变量效应预测器(v100.2)。82。当符合以下标准时,替换和indels被定义为具有潜在临床意义的变异体:(1)在1 KGP、ESP或GNOMAAD人群中观察到的最高等位基因频率小于0.01或未描述。(2)根据SIFT和PolyPhen评分,预测变异体对蛋白质功能有很大的影响或有害。还选择了克林瓦尔报道的致病性变异体。(Iii)癌症基因普查中的变异体83。利用癌症热点数据库确定已知的癌症热点84。拷贝数的改变被认为是临床上相关的,如果它们涉及致癌增益或肿瘤抑制缺失。对于结构变异,包括在断点水平上影响癌症基因普查基因的变异。
ShRNA介导的转录敲除
目标是VAV 2我们用编码空号的慢病毒感染HNSCC患者和SSC-25细胞(TR1.5pLKO-1-puro;Sigma-Aldrich,Catalog No.(SHC 001)或一些独立的VAV 2ShRNA(数字中称为shRNA#1;TRCN0000436728,图中称为shRNA#2;TRCN000000048227,图中称为shRNA#3;TRCN0000418821,图中称为shRNA#4和TRCN0000419630,在数字中称为shRNA#5)。编码这些shRNAs的慢病毒载体来自Sigma-Aldrich.扁豆病毒颗粒的产生和感染就像上面提到的那样。如其他文献所述,转移的细胞是普罗霉素。17。用qRT-PCR方法检测基因敲除情况.
诊断特征的发展
开发Vav2所用的标准ONC-SIG已在结果一节中作了说明。为了评估其肿瘤特异性,我们利用图中所示的数据集进行了主成分分析。用于开发Vav2中的MVGSONC-Sig,我们利用生存R软件包建立了Cox比例风险回归模型(Https://cran.r-project.org/web/views/Survival.html)。采用GEO(GSE 41613)和TCGA(HNSCC收集)的数据进行生存分析。
统计
生物复制的数量(n)、统计测试的类型,以及每个实验的统计意义,无论是在图图中还是在主文本中。分别用Shapiro-Wilk检验和Bartlett检验分析方差的正态性和均匀度.用学生模型分析参数分布t-测试(在比较两个实验组时)或方差分析(ANOVA),然后是Dunnett试验(当比较两个以上的实验组与一个单独的对照组)或Tukey的HSD测试(当将两个以上的实验组与其他每一组进行比较时)。非参数分布采用Mann-Whitney(两个实验组的比较)或Kruskal-Wallis后的Dunn‘s(三个或三个以上的实验组)检验进行分析。采用X-平方检验,确定期望频率与观察频率之间差异的显着性。在所有情况下,当P≤0.05。所得数据为平均值±扫描电镜。