肠道上皮端粒功能障碍引发炎症 为了研究肠道端粒生物学,我们产生了一种由lgr5启动子(lgr5-gfp-ires-creer)驱动的三苯氧胺(tamoxifen,TAM)诱导的cre等位基因的小鼠。 T2 )指导GFP和Creer的 T2 在Lgr5+上皮中的表达及(II)an MTert 该等位基因可被CRE介导的由LSL-mTert位点(LSL-mTert)侧侧的转录停止盒缺失激活的等位基因激活。纯合子lsl-mTert小鼠代际杂交导致第3代(G3)和第4代(G4)出现DNA损伤信号,导致组织干细胞耗竭、器官萎缩和过早衰老。 13
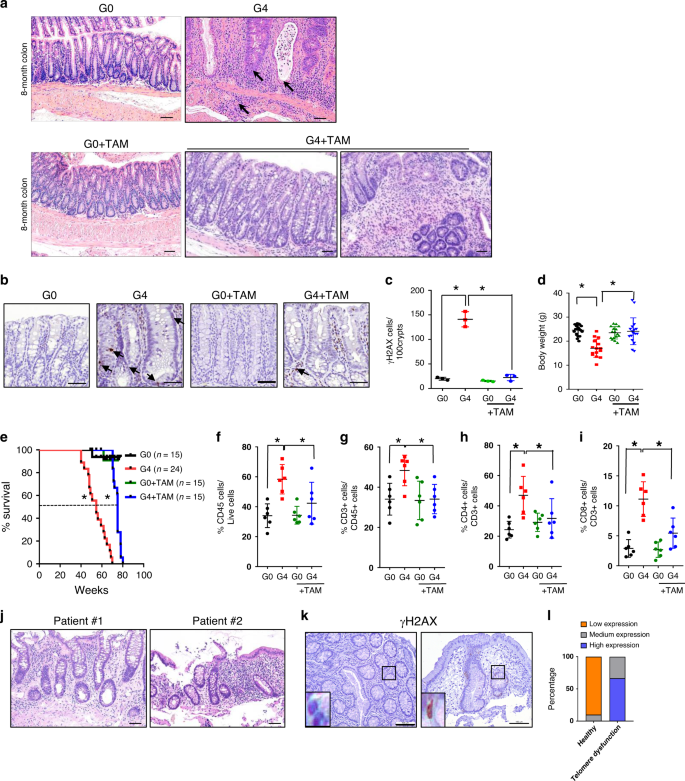
对G4小鼠和端粒酶活性对照组(G0)进行肠组织学系列分析。在3个月大的时候(称为幼仔),大约40%的G4小鼠出现轻度结肠变性(附图)。 1A,c ;补充表 1 组织学评分定义见“方法”),显示隐窝和隐窝脓肿、轻微炎症和DNA损伤(补充表)。 1 ;补充图。 1A 和 2G G4末端回肠表现为轻度隐窝病变较轻(附图)。 1D )。在8个月大的时候,G0肠子继续表现出微小的病理改变,而所有的G4结肠都有多种糜烂和溃疡,同时伴有明显的隐窝炎和隐窝脓肿,并伴有慢性炎症(图一)。 1A ;补充表 1 ;补充图。 1F ),增加了肠上皮细胞DNA的损伤(如图所示)。 1B,c ,补充图。 2D,e )和显着的体重下降(如图所示。 1D )。G4末端回肠呈中度病理改变,十二指肠和空肠均正常(附图)。 1E )。8月龄G4肠子的免疫谱显示有丰富的CD4。 + 和CD8 + T细胞,B细胞,巨噬细胞和树突状细胞。 1F-I ;补充图。 2H-k )。这种相当大的T细胞浸润在以前的研究中具有重要意义,认为T细胞是炎症病理的关键驱动因子。 14 ,15 。健康完整肠的年轻G4小鼠的病理分析(低组织学评分)已经显示CD4增多。 + 和CD8 + T细胞在固有层,尽管整体较低的淋巴细胞计数(CD 45+细胞)相对于年龄匹配的G0小鼠的正常免疫谱(补充图。 2L-o )。因此,我们假设,从G4上皮发出的固有DNA损伤信号可能会分泌因子,吸收T细胞来引发组织炎症。
图1:肠道上皮端粒功能障碍导致炎症。 a 8月龄G0和G4小鼠结肠组织苏木精和伊红染色 n 标度为100米。箭头表示隐窝炎、隐窝脓肿和粘膜下炎症。 b γH2AX(箭头)在8月龄G0和G4小鼠结肠组织中的免疫组织化学染色 n =3),标尺50米。 c 他莫昔芬对G0和G4小鼠结肠隐窝γH2AX染色细胞的定量研究 n =3)。 P 值是用双面计算的。 t G0与G4之间的测试( p < 0.0002), between G4 and G4 + TAM (p < 0.0003). d 端粒熟练的G0和端粒缺失的G4小鼠死亡时体重(G)的变化 n =18,G4, n =15,G0=TAM, n =16,G4+TAM, n =17)。 P 数值计算采用G0和G4之间的双边t检验( p =<0.0001),介于G4和G4+TAM之间( p < 0.0003). e 三苯氧胺和他莫昔芬对不同基因型小鼠生存曲线的影响。虚线显示G4小鼠(54.6周)和G4+TAM小鼠(75周)(G0小鼠)的存活率为50%。 n =15;G4, n =24;G0+TAM, n =15;G4+TAM, n =15)。 P 数值计算采用Mantel-Cox检验,在G0和G4之间( p < 0.0001) and between G4 and G4 + TAM (p < 0.0001). f –i 三苯氧胺或他莫昔芬对小鼠结肠固有层和肠上皮免疫细胞的影响 n =6)。 P 值是用双面计算的。 t G0和G4,G4和G4+TAM之间的测试。 f CD 45, p G0和G4之间的值, p =0.0008,在G4至G4之间=TAM, p =0.0451。 g CD3, p G0和G4之间的值, p =0.0097,介于G4与G4+TAM之间, p =0.0079。 h CD4, p G0和G4之间的值, p =0.0022,介于G4与G4+TAM之间, p =0.0551。 i CD8, p G0和G4之间的值, p < 0.0001, between G4 and G4 + TAM, p =0.0045。 j TIN 2中TERT或蛋白质突变患者结肠活检的苏木精和伊红染色 n =3)。两例患者的结肠活检显示隐窝炎,凋亡增加,固有层慢性炎症增加,隐窝轻度扭曲。 k 健康儿童/(对照组)和端粒病患者结肠上皮免疫组化γH2AX(对照组, n 10;端粒功能失调患者, n =3)。 l 直方图显示正常人(对照组)和端粒功能失调患者结肠上皮中γH2AX染色强度的定量。γH2AX, p =0.0001。 P 计算值采用Fisher‘s精确检验。*具有统计学意义, p < 0.05 by unpaired Student’s t 测试,两尾。 n 研究中使用的小鼠或病人活检的数量。数据用平均±扫描电镜表示。实验至少进行了两次独立的实验。也请参阅附图。 1 ,补充图。 2 ,以及附图。 3 和补充表 1 和 2 .
考虑到端粒功能障碍对所有器官系统的影响,我们试图确定端粒功能障碍,特别是肠上皮细胞的端粒功能障碍,是否在维持炎症病理过程中起着直接作用。为此, TERT 基因表达仅在Lgr5中重新激活。 + TAM作用于1月龄和6月龄G4小鼠(G4+TAM).端粒功能正常的G0+TAM小鼠作为TAM治疗对照组。经TAM治疗后,cre介导的lsl切除激活。 TERT γH2AX在肠上皮中的表达和抑制,与端粒酶的重新激活和端粒的恢复一致。 1B,c 老老鼠;补充图。 2B,f,g 幼鼠)。年龄较大的G4+TAM小鼠病理呈梯度挽救,50%的小鼠经他莫昔芬治疗后30d后见隐窝炎、隐窝脓肿和炎症的部分挽救(附图)。 1g,我 ),并对G4+TAM老年小鼠60天后的严重病理进行了明显的抢救,其中只有33%的小鼠表现为上皮增生、隐窝炎、隐窝脓肿和中到重度炎症(图一)。 1A ;补充图。 1g-i ;补充表 1 )。此时,对端粒酶重新激活的小鼠肠道的分析显示,Lgr5-EGFP+隐窝有明显的克隆性扩展(补充图)。 2A-C )肠道再生的指示。对隐窝DNA损伤的分析表明,γH2AX阳性Lgr5-EGFP+细胞数量明显减少,提示干细胞室损伤有所改善(补充图)。 2D,e )。与疾病解决办法一致(补充表格) 1 年龄较大的G4+TAM小鼠与G4对照组相比,体重恢复正常,总体存活率提高(G4+TAM小鼠中位生存期增加20.4周)(图二)。 1D,e )。流式细胞术分析“老”和“年轻”G4+TAM肠显示T细胞显著减少(图1)。 1F-I ;补充图。 2L-o )以及B细胞、巨噬细胞和树突状细胞的减少(附图)。 2i-k )。我们的结论是,肠上皮端粒功能障碍引发并维持了一种炎症状态,这种炎症状态可以通过恢复端粒功能来逆转。
为了证实端粒-炎症在人类中的联系,我们分析了一组来自德克萨斯州儿童医院的21名患者,他们在儿童时期出现端粒功能障碍(中位年龄12岁,最后随访或死亡),其中8名有胃肠道症状的患者可进行肠活检。这些观察结果与霍普金端粒登记处胃肠症状增加的报告一致。 7 。8例患者中有5例出现肠道炎症征象(图5)。 1J ;补充表 2 ),包括伴有嗜酸性粒细胞的急性肠炎/结肠炎和固有层慢性炎症的证据、增加的隐窝凋亡、隐窝炎、局灶性腺体损伤、轻度淋巴浆细胞性炎症、轻度再生性隐窝和明显的上皮内T细胞浸润(见图)。 1J )。与年龄匹配的正常对照组相比,在这些患者样本中检测到了DNA损伤信号增强(γH2AX)。 1K,l )。这些数据与端粒功能障碍在炎症中的驱动作用是一致的。
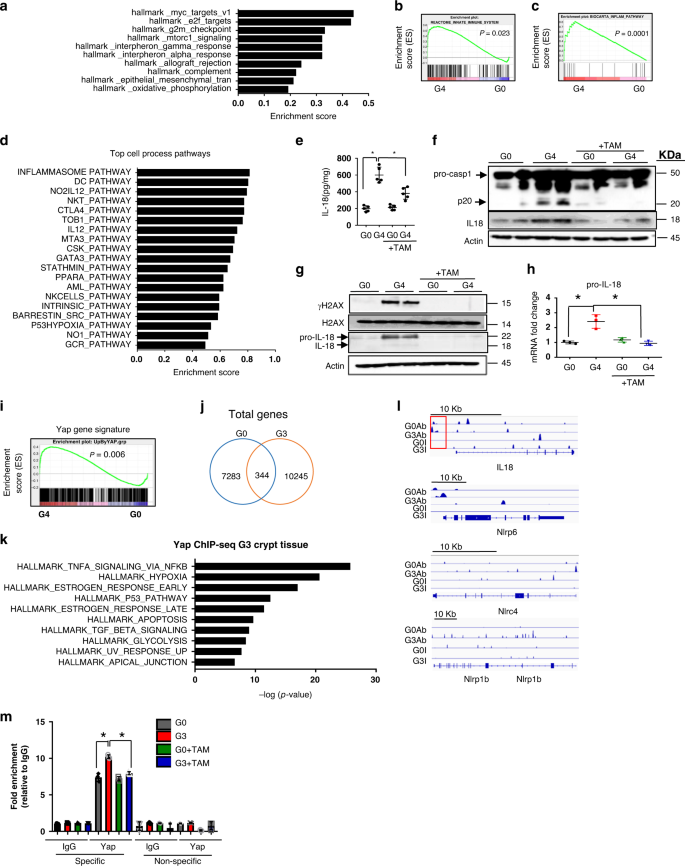
YAP 1作为免疫途径的关键调节因子的鉴定 伊-18 对3月龄(幼龄)G0、G4和G4+TAM小鼠分离的结肠上皮细胞进行无偏RNA-seq转录分析,以鉴定可能导致炎症的纯化上皮中的基因网络。基因集富集分析(GSEA)显示端粒功能障碍与先天免疫途径(如干扰素、α、γ通路和补体通路)的过度表达有关。 2A,b ; p 富集分数=0.62)。干扰素γ反应通路在该基因组中也显著上调(补充图)。 三维空间 )。(1)幼龄G0与G4隐窝差异表达基因的交集;(2)幼龄G4与G0和G4+TAM隐窝差异表达基因的交叉,提示先天免疫通路基因通过消除端粒功能障碍而发生急性逆转,G0水平趋于正常(附图)。 3A )。同样,检测基因表达的变化,特别是在分离的Lgr5 GFP中。 + 来源于幼龄G0和G4小鼠结肠的干细胞/祖细胞(附图)。 3B ),确定炎症通路为顶级类别(补充图)。 3C ),以炎症小体通路为最高差异调节通路(图1)。 2C,d ).
图2:鉴定YAP 1是包括IL-18在内的免疫途径的关键调节因子. a G0和G4小鼠结肠隐窝的RNA-seq分析和路径分析确定了几种与炎症有关的途径( n =2)。 b 基因组rna-seq分析的基因集富集分析曲线( a )描述了先天免疫系统的重要途径。 p 值0.02。( n =2)。 c 基因集富集分析曲线描述了gfp的rna-seq确定为最顶端的炎症小体通路。 + G0和G4小鼠结肠上皮细胞分类 n =3)。 d 谷胱甘肽分析从绿色荧光蛋白中鉴定的顶层细胞过程途径 + G0和G4小鼠结肠分选细胞。( n =2)。 e 用所述基因型小鼠的结肠裂解液进行IL-18的ELISA检测( n =5)。 P 值是用双面计算的。 t G0和G4,G4和G4+TAM之间的测试。 P G0和G4之间的值, p < 0.0001, between G4 and G4 + TAM, p =0.0031。 f 他莫昔芬对G0和G4小鼠结肠上皮裂解物caspase-1和IL 18抗体的免疫印迹 n =2)。 g 三苯氧胺对G0和G4小鼠肠道溶解物免疫印迹的研究( n =2)。 h G0和G4小鼠经他莫昔芬、亲IL-18治疗后肠道炎症通路基因的qRT-PCR分析(英文) n =3)。 P 在G0与G4、G4和G4+TAM之间进行双边t检验。 P G0和G4之间的值, p =0.0067,介于G4与G4+TAM之间, p =0.0063。 i GSEA图显示 YAP 1 G4上皮与G0上皮的基因标记 p =0.006)。 j 用YAP 1抗体鉴定的G0和G3隐窝上皮基因重叠。 k YAP 1对G3上皮中差异结合基因的富集分析 n =4)。 l 芯片-seq数据显示,与G0端粒熟练上皮相比,G3端粒功能失调上皮中的YAP 1在启动子和炎症体通路基因中的占用率增加。 m 用他莫昔芬或不加他莫昔芬治疗G0和G3肠类中YAP 1或IgG的染色质免疫共沉淀。用针对红色包被的特异位点和YAP 1结合位点以外的非特异性位点1Kb的引物,对所指示的基因进行qRT-PCR检测。( n =3)。 P 在G0与G4、G4和G4+TAM之间进行双边t检验。 P G0和G4之间的值, p =0.0013,介于G4与G4+TAM之间, p =0.0003。*具有统计学意义, p < 0.05 by unpaired Student’s t 测试,双尾和费舍尔的精确测试。 n ,研究中使用的小鼠数量。数据用平均±扫描电镜表示。实验至少进行了两次独立的实验。也请参阅附图。 2 .
鉴于炎症小体通路在本模型中的突出地位及其在肠道炎症性疾病发病机制中的作用。 16 ,17 ,我们评估了该通路在上皮细胞中激活的下游后果,即caspase-1裂解、IL-1β和IL-18的成熟和分泌。 18 ,19 ,20 ,21 ,22 ,23 。结肠上皮细胞裂解物的细胞因子阵列和肠类RNA的定量检测表明,幼龄G4细胞中IL-1α、IL-1Ra、TNF-α和IFN-γ表达增加(补充图)。 3E-g )。由于细胞因子阵列不包括IL-18,进行了ELISA和确认性免疫组织化学检查,证明G4结肠裂解液和组织切片中IL-18水平升高;反之,G4+TAM结肠裂解液和组织切片端粒酶重新激活后,IL-18水平下降(见图)。 2E ;补充图。 3H )。由于caspase-1将亲IL-18切割成其成熟的分泌形式,我们对端粒功能失调小鼠上皮中活化的caspase-1(裂解p20)和成熟形式的IL-18进行了鉴定和记录,其表达在端粒酶重新激活后降低,与炎症小体途径激活相一致(见图)。 2F ).
进一步证实肠上皮细胞是IL-18的主要来源,IL-18是溃疡性结肠炎等炎症性疾病中已知的T细胞聚集因子。 24 ,25 ,26 我们检测了幼龄G4小鼠纯肠上皮样细胞培养中IL-18的水平(附图)。 3I 证实γH2AX信号消失后,端粒功能障碍的肠类上皮细胞中亲IL-18蛋白表达增高,端粒酶活性降低(如图1所示)。 2G,h ;补充图。 3J )没有任何变化。 亲IL-1β( 补充图 3K ) ...我们观察到亲IL 18对成熟IL 18的体外切割是可以忽略的。 2G ).
为了鉴定促IL-18的转录因子以及Nlrp1b、NLRC4和NLRP 6等炎症受体,我们对TRANSFAC启动子进行了分析,并鉴定了几个进化上保守的一致结合基序,包括 NFATc 1、HNF4a、NKKX2.3、IRF 4/9和TEF 。这个 TEF 有约束力的元素成为我们进一步调查的首要任务,因为它的合作伙伴, YAP 1 ,是已知的转录共激活剂,在y 357被经典的dna损伤信号分子atm和c-abl磷酸化。 27 ,28 ,导致YAP 1的稳定和核定位。而急性DNA损伤诱导的YAP 1激活则可诱导细胞死亡。 27 YAP 1在端粒功能障碍引起的慢性DNA损伤信号下的激活,尤其是在衰老和炎症性疾病的背景下,其作用尚未得到探讨。为了探讨yap 1是否驱动了端粒功能失调小鼠的表型,我们比较了rna-seq在比较g0和g4上皮时发现的上调基因集。 YAP 1 基因标记 29 ,显示激活 YAP 1 G4上皮的特征(标准化富集评分,NES=1.36和 p =0.006)(图1。 2I ).
为了进一步研究YAP 1在调节免疫通路方面的作用,我们对G0(端粒完整)和G3(端粒功能失调)结肠隐窝组织进行了无偏的芯片-seq分析。通过对YAP 1结合基因的分析,发现G3上皮共有10,589个基因,而G0上皮中则有7627个。其中只有344个基因重叠,而在G0和G3隐窝上皮中分别有7283和10245个基因与YAP 1唯一结合。 2J )。这与端粒功能失调上皮中基因启动子的YAP 1占用率较高相一致,与端粒功能障碍时YAP 1的高表达和稳定性呈正相关。谷胱甘肽的通路分析显示,肿瘤坏死因子-α通过NF-κB信号通路是G3上皮中最顶端的通路,而其他与p53和凋亡有关的途径也存在于前10条通路中(图1)。 2K )。相比之下,与增殖相关的几条途径在G0中排在前10位(补充图1)。 3L )。值得注意的是,我们确认在 NLRP1B,NLRP 6,NLRC4 ,以及 伊-18 基因启动子在G3和G0上皮中的表达 2L )。最后,抗YAP 1芯片验证了YAP 1与亲IL-18启动子区的结合,与G0对照相比,G3肠系膜上的结合增高,而G3+TAM则相反,YAP 1与G3+TAM的结合减少(图二)。 2M )。这些不偏不倚的分析支持了YAP 1在端粒功能障碍背景下引起炎症的显著作用。
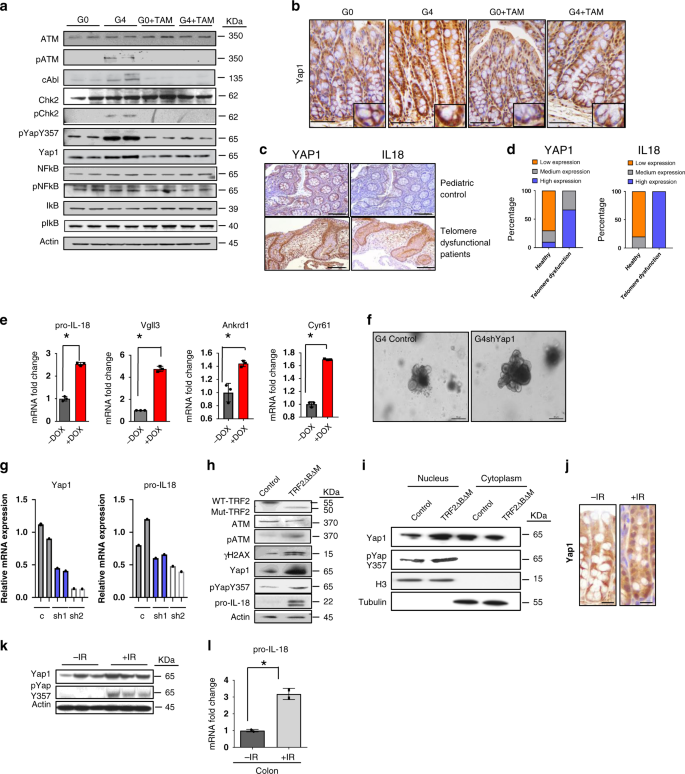
端粒功能障碍激活YAP 1 在我们的模型系统中,在端粒功能失调的肠类中检测到更高水平的磷酸化ATM、Chk 2和YAP 1(Y 357),这些信号在端粒酶重新激活时被降低。 3A )。虽然NF-κB是许多炎症基因的主要转录调控因子,但我们记录到在这些样本中,关键的NF-κB通路成分(pNF-κB,IκB和PIκB)的磷酸化没有改变(图1)。 3A )。在G4肠道,在结肠隐窝(干细胞和祖细胞)中检测到较高水平的YAP 1核定位。 3B )类似于IL-18的分泌模式(补充图)。 第三代 而YAP 1的核信号在端粒酶重新激活后减弱(如图所示)。 3B )。重要的是,德克萨斯州儿童端粒登记处的患者活检显示YAP 1的稳定和结肠上皮中IL-18水平的上调(图一)。 3C,d ;补充图。 4A ),进一步支持端粒功能障碍激活这一途径来驱动炎症的模型。
图3:端粒功能障碍激活YAP 1。 a 用他莫昔芬或不加他莫昔芬治疗G0和G4小鼠肠道肠溶物的免疫印迹 n =2)。 b 三苯氧胺和他莫昔芬对G0和G4小鼠结肠隐窝YAP 1免疫组织化学的影响 n =3)。标度棒,50m.inets表明YAP 1在G4小鼠中的核定位高于其他小鼠。 c 健康儿童(对照组)和端粒病患者结肠上皮免疫组织化学检测YAP 1和IL-18。(控制, n 10;端粒功能失调患者, n =3) d 直方图描述健康(对照组)和端粒功能失调患者结肠上皮YAP 1和IL-18染色强度的定量。YAP 1, p =0.0035 IL-18, p =0.0001。(控制, n 10;端粒功能失调患者, n =3)。 e 从YAP 1(S127A)转基因小鼠中分离出的肠道指示基因经多西环素处理或不加多西环素处理后,qRT-PCR可抑制降解,提高稳定性和核定位。 n =3)。 P 用双侧t检验计算未处理的DOX和DOX处理的有机物的值。以下是 p -亲18岁的价值观, p < .0001, Vgll3, p =0.0067,Cyr 61, p < 0.0001. f 传送或控制载体上肠系膜的显微图像 YAP 1 ShRNAs介导的肠类物质( n =2)。标尺,30米。 g Qrt-pcr对g4肠系膜上的指示基因进行qrt-pcr检测。 YAP 1 ShRNAs( n =2)。每个样本的柱状图用单个条形图显示。h 用普罗霉素在CRL-1831细胞中表达TRF 2、ΔB、ΔM质粒或对照载体1d后进行Westernblot分析。 i 用高表达TRF 2、ΔB、ΔM质粒的CRL-1831细胞或对照载体进行分离。 j YAP 1在照射后或对照G0结肠隐窝中的免疫组化染色显示,照射后YAP 1呈较高的核阳性染色。标尺,50μm。 k 辐照或对照G0结肠隐窝中YAP 1和pYAPY 357磷酸化蛋白的westernblot显示,照射后磷酸化水平较高( n =3)。 l 用qRT-PCR技术检测正常人和照射后结肠G0细胞前IL-18细胞RNA的定量PCR(QRT-PCR)(英文) n =3)。 P 值是用双面计算的。 t 测试, p =0.0122。*具有统计学意义, p < 0.05 by unpaired Student’s t 测试,双尾和费舍尔的精确测试。 n 表示研究中使用的老鼠数量。“Ab”表示抗体,“I”表示输入样本。每个实验至少进行两次。数据用平均±扫描电镜表示。也请参阅附图。 3 .
从多西环素诱导的r26-yap 1转基因小鼠中提取的肠类物质证实了yap 1的作用。 30 表明高水平的转基因表达 YAP 1 (补充图。 4B )与未诱导的肠类动物相比,pIL-18和Vgll 3、Ankrd 1和Cyr 61(直接YAP 1靶标)的表达水平较高(如图1所示)。 3E )。相反,shRNA介导的YAP 1缺失在端粒功能失调的肠类中表达减少。 亲IL-18 与矢量控制相比(图1)。 3F,g ;补充图。 4D-f ;补充表 4 ).
炎症小体激活是诱导caspase-1与caspase-1发生断裂的关键协同因子,而caspase-1又能切割亲IL-18到成熟的IL-18。 31 。此外, 雅普 芯片-seq数据来自我们的研究以及Gregorieff等人。学习 29 还证明了 伊-18 , NLRC4,Nlrp1b 和 NLRP 6 与其他几个炎症基因一起是YAP 1的靶点,其中许多基因在我们的rna-seq数据集中也有差异表达。因此,我们研究了能够组装炎症体的关键微生物受体的表达。在我们的模型中,我们观察到关键的炎症体蛋白(Nlrp1b,Nlrp 3,NLRC4和NLRP 6)在端粒功能失调的肠类中的表达增加,端粒酶活性下降(补充图1)。 4G-j )。此外,微生物受体在 YAP 1 ShRNA治疗G4肠类物质(附图)。 4F )和增加微生物受体和炎症途径基因的表达 Nlrp1b , NLRP 3 , NLRC 4 和 NLRP 6 也观察到YAP 1激活的肠类物质(补充图)。 4C ).
为了获得端粒功能障碍驱动的YAP 1激活的额外遗传学证据,强制表达显性阴性TRF 2(ΔBΔM)的CRL 1831结肠细胞株CRL 1831伴随着pγH2AX、pATM、pYAP 1(Y 357)和亲IL-18水平的升高(图五)。 3H )。细胞分馏研究进一步证实了pYAP 1(Y 357)核定位的增加。 3I )。此外,中等电离辐射(2Gy/d×5d)显示,YAP 1在结肠隐窝上皮中的定位增强,与以前的报道一致。 3J ),YAP 1在Y 357时磷酸化增强(图1)。 3K )。在这些暴露在红外辐射下的地穴中,我们记录了高举。 亲IL-18 MRNA水平(图1. 3L )和更高的水平 Nlrp1b、Nlrp 3、NLRC4和NLRP 6 MRNA(附图) 4K-n )。我们认为来自端粒的DNA损伤信号可以稳定和激活YAP 1,而YAP 1又直接促进关键炎症基因和亲IL-18的转录。
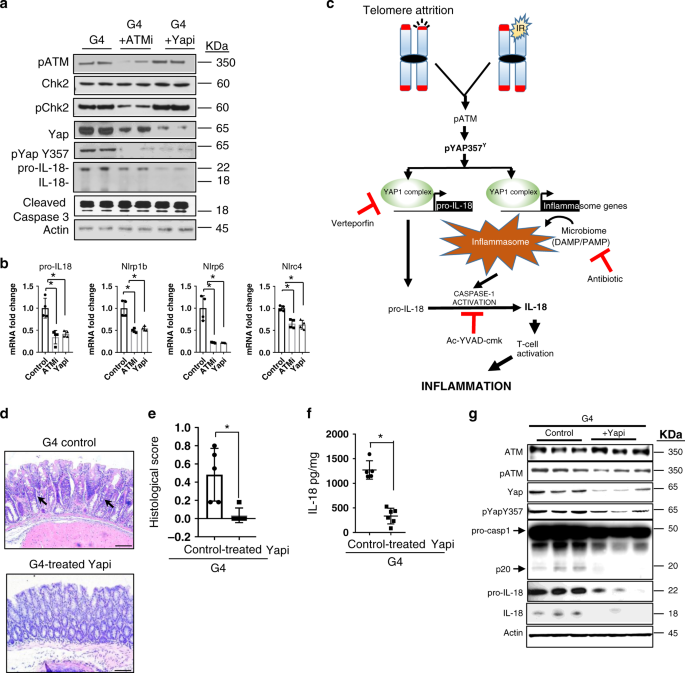
抑制ATM和YAP 1减少IL-18分泌,减轻炎症反应 为了验证ATM-YAP 1信号在调节亲IL-18表达中的功能和翻译相关性,我们用Am(0.1μM×24 h)或YAP 1抑制剂(4μM×24 h)治疗G4肠类动物,并评估其亲IL-18水平。虽然这种短暂的治疗并没有损害细胞的活力(由切割的caspase-3决定),但在pYAP 1(Y 357)水平和亲IL-18水平上观察到明显的下降,表明ATM和YAP 1在G4肠类细胞中具有端粒功能障碍,并能驱动亲IL-18的转录(如图所示)。 4A,b ).
图4:抑制ATM和YAP 1可减少IL-18的分泌,减轻炎症反应. a 用或不加ATM或YAP 1抑制剂治疗G4肠类肠溶物的免疫印迹抗体( n =2)。 b QRT-PCR检测单用DMSO或ATM或YAP 1抑制剂处理的肠道RNA所指示的基因( n =4)。 P 值是用双面计算的。 t 测试一下。以下是 p -价值观,亲IL18, p =0.0030,Nlrp1b, p =0.0018,Nlrp 6, p =0.0015,Nlrc 4, p =0.0010。 c 代表端粒功能障碍介导的炎症小体通路的模型,以及YAP 1、caspase-1或抗生素抑制剂抑制该途径导致caspase-1分泌减少和结肠上皮分泌IL-18减少的节点。 d G4小鼠结肠组织苏木精和伊红染色。(控制, n =5;经处理的抑制剂, n =6)。标尺,50μm。 e G4小鼠肠道表型的病理组织学评分(对照组、对照组):用或不加椎卟啉(YAPI)治疗的G4小鼠肠道表型评分。 n =5;经处理的抑制剂, n =6)。 P 数值计算采用双边t检验, p =0.0048。 f 免疫酶联免疫吸附法检测G4小鼠结肠上皮中成熟IL-18的表达 n =5;经处理的抑制剂, n =6)。 P 值是用双面计算的。 t 测试, p < 0.0001. g G4小鼠结肠上皮中溶菌物的Westernblot分析 n =3)。*具有统计学意义, p < 0.05 by unpaired Student’s t 测试,双尾。 n 表示研究中使用的老鼠数量。数据用平均±扫描电镜表示。实验至少进行了两次独立的实验。
由于IL-18在结肠上皮中的分泌增强被认为是一种损伤性和可能的炎症诱导剂,我们认为通过抑制其上游诱导剂降低IL-18的可能性可以作为一种潜在的治疗策略(图一)。 4C )。因此,除了上述基因验证外,我们还从药理学上抑制了yap 1与vpf或caspase-1抑制剂ac-yvad-cmk的关系。 32 在三个月大的G4小鼠中,与年龄匹配的对照组相比,炎症减少(如图所示)。 4D,e ;补充图。 5C,d ),减少上皮细胞IL-18的表达(如图所示)。 4F,g ;补充图。 5E,f )和低表达的干扰素-γ(补充图)。 5A,g )。治疗后小鼠YAP 1和pYAP 1(Y 357)水平降低,亲IL-18和成熟IL-18水平降低(图二)。 4G ;补充图。 5F )。值得注意的是,在治疗组中也观察到Proaspase-1切割减少,这加强了YAP 1通过转录调控参与炎症体组装和proaspase-1切割的关键微生物受体而促进炎症体激活的作用(如图1所示)。 4G )。因此,维甲酸治疗导致参与炎症小体组装的几个炎症通路基因的表达减少(补充图)。 5B ).
肠道微生物体通过与上皮和免疫细胞的相互作用和诱导caspase-1的断裂而在肠道炎症的诱导中发挥重要作用。此外,G4结肠相对于小肠的疾病严重程度与小肠相对于结肠的微生物负荷减少是一致的(补充图1)。 6A )33 ,34 G0和G4小鼠的微生物组分略有差异(附图)。 6B )。为了探讨肠道微生物群在IBD诱导中与端粒功能障碍的潜在协同作用,我们在饮水中用广谱抗生素(甲氧苄啶-磺胺甲恶唑)治疗小鼠,以减少肠道微生物负荷(附图)。 6C )。经结肠镜检查,G4小鼠出现上皮性溃疡,用抗生素治疗1个月。与未治疗的对照组相比,治疗组在疾病病理学方面表现出明显的减少(补充图)。 6d,e ),亲IL-18和成熟IL-18水平(补充图.) 6f,g ),caspase-1切割(附图)。 6g )和干扰素-γ分泌(补充图。 六小时 )。这些数据共同支持一个模型,端粒功能障碍介导的YAP 1磷酸化和转录激活,以及肠道微生物介导的caspase-1切割聚合在成熟的IL-18的高产量,导致招募干扰素-γ分泌T细胞启动和维持炎症。