Epsin介导的IP3R1降解助长动脉粥样硬化
Epsin介导的IP3R1降解助长动脉粥样硬化
内吞衔接蛋白的epsin家族广泛表达,并与蛋白质和脂质相互作用以调节多种细胞功能。然而,人们对爱普生在动脉粥样硬化中的作用了解甚少。在这里,我们显示使用该疾病的细胞培养和小鼠模型,内皮素蛋白的缺失可减少炎症并减轻动脉粥样硬化。在经动脉粥样硬化胆固醇治疗的小鼠主动脉内皮细胞中,epsins与泛素化内质网蛋白肌醇1,4,5-三磷酸受体1型(IP3R1)相互作用,从而触发该钙释放通道的蛋白酶体降解。Epsins通过这种相互作用增强其降解。内皮IP3R1的遗传减少会加速动脉粥样硬化,而内皮蛋白的缺失会稳定IP3R1并减轻炎症。在epsin缺陷型小鼠中降低IP3R1可恢复动脉粥样硬化的进展。两者合计,epsin介导的IP3R1降解代表了epsin蛋白以前未被发现的生物学作用,并可能为动脉粥样硬化和其他疾病的治疗提供新的治疗靶点。
介绍
在美国和其他发达国家,动脉粥样硬化是发病率和死亡率的主要原因1。粥样硬化斑块,动脉粥样化或,吸留的血流量,原因血管硬化,并且导致心脏发作或中风的渐进累积1,2。动脉瘤形成于动脉壁的内层,主要由矿物质沉积,纤维结缔组织和称为泡沫细胞3的富含脂质的巨噬细胞组成。。了解导致动脉粥样硬化的形成,生长和失稳的分子机制,对于开发更有效,更有针对性的疗法以预防心血管疾病患者的缺血性损伤,残疾或死亡至关重要。
慢性炎症激活各种信号级联,这反过来,招该渗透内动脉壁,并过渡到载脂和胆固醇载货泡沫细胞的促炎性巨噬细胞4,5。泡沫细胞的积累和延长的炎症信号最终结果以形成去稳定动脉粥样坏死核心的和大大增加血栓形成事件的风险5,6。损伤或新陈代谢异常导致的动脉内皮功能障碍是辅助性促炎事件,有助于慢性炎症和巨噬细胞募集。然而,驱动内皮功能障碍和促进在动脉壁促炎症信号传导的潜在分子相互作用仍不清楚7,8,9,10。鉴于内皮功能障碍是动脉粥样硬化发病机理中的早期事件之一,因此确定潜在的细胞机制可能为开发用于治疗该疾病的创新疗法提供分子靶标。
Epsins是家族高度保守的,膜结合的,泛素-结合的内吞衔接蛋白的11,12,13,14,15,16。Epsins 1和2普遍存在并且在功能上大为多余,而epsin 3的表达主要限于角质形成细胞和胃17。所有三个epsins的缺乏通过阻碍网格蛋白涂层的凹坑16的肌动蛋白依赖性内陷来损害受体介导的内吞作用。另一方面,epsin 1和epsin 2的丧失不会损害管家膜的运输,包括运铁蛋白受体的内吞作用和内皮生长因子受体(EGFR)的内在化18,19岁。使用细胞类型和组织特异性底物蛋白敲除小鼠模型中,我们揭示了关键的调控作用,这些蛋白在多种疾病,包括癌症和动脉粥样硬化的发展中起着20,21,22。考虑到慢性炎症在癌症和动脉粥样硬化进程中的作用,我们假设抑制epsin功能可能为对抗动脉粥样硬化提供潜在的治疗靶点。为了支持这一观点,我们最近报道了在小鼠模型中,巨噬细胞(MΦ)epsin的缺失可通过减少噬斑沉积约50%来保护其免受动脉粥样硬化的侵害22。从机制上讲,发现巨噬细胞爱普生控制低密度脂蛋白受体相关蛋白1(LRP-1)的内吞和降解,低密度脂蛋白受体相关蛋白1(LRP-1)是一种膜蛋白,与介导巨噬细胞的胞吞作用有关。Epsin介导的LRP-1降解促进了动脉粥样硬化的发展。然而,epsins是否通过其他蛋白质相互作用促进内皮功能障碍,从而促进动脉粥样硬化的发展尚不清楚。
因此,我们探讨了内皮素在加剧与动脉粥样硬化有关的内皮功能障碍中的作用。使用新型的内皮特异性epsin缺陷型ApoE -/-动脉粥样硬化小鼠模型中,我们发现epsin蛋白的内皮特异性耗竭可防止内皮细胞功能障碍并阻止动脉粥样硬化。我们建立了epsin 1的泛素相互作用基序(UIM)与内质网(ER)钙释放通道N-末端区域的泛素化抑制域(SD)肌醇1,4,5-三磷酸( IP3)接收器1(IP3R1)。动脉粥样化下的条件下,我们发现底物蛋白1个加速时IP3R1的泛素依赖的降解,这导致异常钙稳态,炎症和动脉粥样硬化进展23,24。因此,与这些衔接子相互作用的epsin和蛋白质可能代表了治疗动脉粥样硬化的潜在治疗靶标。
结果
Epsin与经动脉粥样硬化刺激处理的内皮细胞中的IP3R1相互作用
由于epsin 1和2是表达和功能重叠的旁系同源物,因此我们主要关注epsin 1的体外研究。然而,为了阐明内皮蛋白在动脉粥样硬化中的作用,我们产生了ApoE -/-小鼠,该蛋白在全局epsin 2剔除背景下(EC-iDKO / ApoE -/-)具有内皮细胞特异性缺失epsin 1的作用。2个epsins(补充图的冗余功能 1A,b )18,19,25。通过冷冻保存的主动脉根的免疫荧光染色证实了主动脉ECs epsin 2 -/-背景上的epsin 1条件性缺失(补充图 1c))。然后使用ApoE -/-的主动脉组织和内皮细胞(对照,请参见“方法”部分以获取详细说明)和EC-iDKO / ApoE -/-(iDKO)小鼠,以研究内皮素的表达和功能。以及动脉粥样硬化起始和进展中的相互作用蛋白。
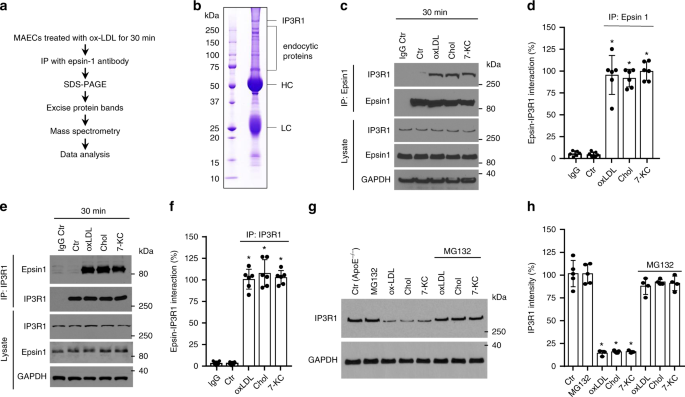
为了检测在致动脉粥样化条件下epsin 1衔接蛋白与其他蛋白的相互作用,我们使用epsin 1抗体免疫氧化的低密度脂蛋白(oxLDL)处理了30分钟的鼠主动脉内皮细胞(MAEC)的结合伴侣,进行了免疫沉淀光谱仪(图 1a,b和补充数据文件 1)。对MAECs进行表征并与鼠脑内皮细胞(MBEC)进行比较,以确定主动脉内皮细胞能够形成管状网络(补充图 2a,b),并且与脑内皮细胞不同,在缺乏α平滑肌肌动蛋白的情况下,血管内皮生长因子2(VEGF2)的表达水平较低,此外血管内皮生长因子2(vWF),CD31和VE-钙粘蛋白的表达水平也较高(通过免疫染色和FACS分析(α-SMA)(补充图 2c-h;补充图 3)。与从野生型(ApoE -/-)小鼠分离的细胞相比,来自iDKO小鼠的MAEC所含的epsin蛋白量可忽略不计,这证实了双重(epsin 1和2)敲除策略的效率(补充图 2h)。 。随后将经动脉粥样硬化的胆固醇处理过的MAEC用于鉴定结合epsin 1的蛋白质。
识别epsin 1结合蛋白的策略。b来自MAEC的epsin 1 IP免疫复合物的考马斯染色凝胶。通过质谱表征谱带。HC重链,LC轻链。c,d从WT小鼠分离的MAEC用100μg/ mL oxLDL或500μg/ mL胆固醇晶体(Chol)或50μM7-KC处理30分钟,并使用epsin 1抗体进行免疫沉淀(IP)。免疫复合物上清液通过Western blot分析用抗IP3R1或epsin 1的抗体进行探测(c),然后进行定量(d)(n = 6个独立实验, 与对照组相比,星号P <0.05)。Ë,f在c和d中所述的相同样品中使用IP3R1抗体进行互惠IP 。 显示了IP 的代表性蛋白质印迹(e)和定量(f)(n = 6个独立实验,与对照组相比,星号P <0.05)。g,h从对照小鼠主动脉(即ApoE -/-小鼠)分离的MAECs用5μMMG132 预处理4 h,然后用100μg/ mL oxLDL或500μg/ mL Chol或50μM7-在存在车辆(DMSO)或MG132的情况下,将KC放置36小时。IP3R1通过Western blot(g)进行定量(h)(n = 5个独立重复, 与对照组相比,星号P <0.001)。所有数据均使用学生t检验进行评估,并以平均值±SEM表示。
有趣的是,除了预测的内吞蛋白(例如网格蛋白,epsin 2)外,epsin 1还与肌醇1,4,5-三磷酸(IP3)受体1(IP3R1)免疫沉淀(图 1b)。IP3R1是位于内质网(ER)膜上的主要钙释放通道,对维持钙稳态起重要作用。作为异常钙信号传导和ER应激可以基本上内皮功能障碍和动脉粥样硬化贡献,我们研究了在胆固醇处理过的内皮细胞底物蛋白1和IP3R1之间的连接26,27。用氧化的低密度脂蛋白(oxLDL),晶体胆固醇(Chol)或7-酮胆固醇(7-KC)处理的MAEC显示与EPSin 1相互作用的IP3R1数量增加,无论是否使用epsin 1或IP3R1抗体细胞裂解物产生免疫沉淀(图 1c–f)。由于肌醇三磷酸受体迅速响应细胞应激而泛素化并降解,因此蛋白酶体抑制剂MG132被应用于MAEC,以阻止泛素缀合蛋白的降解。用动脉粥样硬化胆固醇长期治疗细胞(36小时)会使IP3R1不稳定,在慢性动脉粥样硬化中通常会降低IP3R1;然而,MG132处理逆转了这种下降趋势,表明该受体是动脉粥样硬化降解的靶标(图 1g,h)28,29。虽然通过泛素依赖的内质网相关降解(ERAD)IP3R1退化是有据可查的 30,31,我们也想确定其他蛋白水解系统是否参与了氧化低密度脂蛋白介导的降解IP3R1。我们的结果表明,溶酶体蛋白水解,未折叠蛋白反应(UPR)和自噬的生化或遗传抑制作用对IP3R1降解几乎没有影响(补充图 4a,b)。同时,我们不能排除其他形式的蛋白质降解,因为化学抑制剂并不是专门的。因此,有必要使用基因工程模型对IP3R1降解途径进行进一步研究。
人动脉粥样硬化患者主动脉中IP3R1的免疫荧光染色证实了在疾病过程中受体表达的降低(补充图 5a,b)。此外,与饲喂普通食物或iDKO的对照动物(EC-iDKO / ApoE -/-)饲喂的对照动物相比,饲喂WD 的对照(ApoE -/-)小鼠的免疫染色显示主动脉内皮和中层的IP3R1更少WD(补充图 5c,d)。这些结果证实了IP3R1水平与动脉粥样硬化之间呈负相关。
IP3R1 SD和epsin 1 UIM域在致动脉粥样硬化条件下相互作用
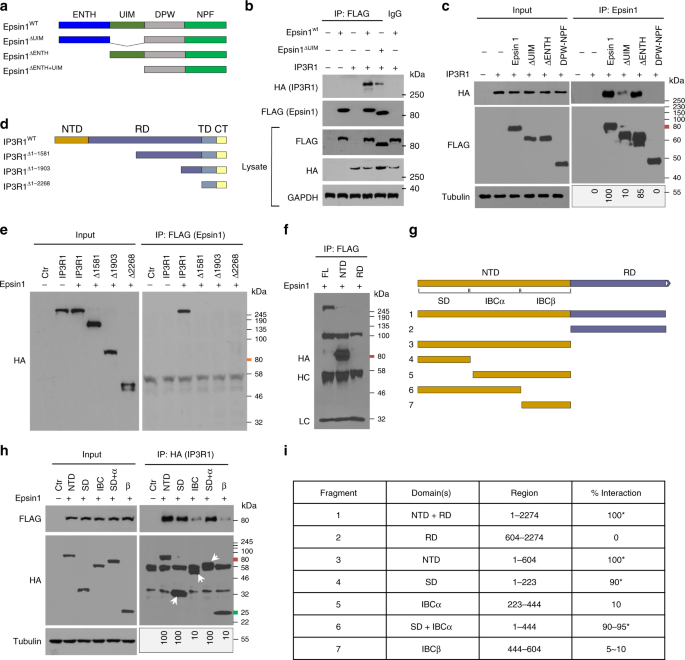
为了更好地了解IP3R1和epsin 1之间的分子相互作用,我们通过用各种pcDNA3表达构建体转染HEK 293T细胞来绘制蛋白结合域。含有N末端同源性(ENTH)结构域和/或泛素相互作用基序(UIM)精确缺失的血凝素(HA)标记的IP3R1构建体和FLAG表位标记的epsin 1构建体在HEK 293T细胞中表达24小时,用于针对每个表位标签以及特定蛋白的抗体的免疫沉淀和蛋白质印迹分析(图 2a–c和补充图 6a,b)。我们的结果表明,与UIM的删除相比,ENTH域的删除对epsin 1-IP3R1相互作用的影响较小,而网格蛋白结合的DPW图案和天冬酰胺-脯氨酸-苯丙氨酸(NPF)的图案几乎没有贡献epsin 1-IP3R1交互。这些发现暗示epsin 1 UIM是与IP3R1相互作用的强制性位点。
一到ç在pcDNA3载体FLAG-底物蛋白1的全长和域缺失构建体进行转染到HEK 293T(293tsA1609neo)细胞24小时,随后通过IP和使用针对HA(IP3R1)或FLAG抗体(免疫印迹分析底物蛋白1)标签以及特定的蛋白质(n = 5)。d – f将HA-IP3R1的全长和缺失构建体转染到HEK 293T细胞中24 h,然后使用针对HA或FLAG标签和特定蛋白质的抗体进行IP和Western blot分析(n = 5)。克到我精细映射IP3R1的N端以确定与epsin 1相互作用的区域。相互作用结果显示为0-100比例尺映射域,在293T细胞中共表达后结合epsin 1(n = 6, 与删除了SD的片段相比,星号P <0.001)。将转染的HEK 293T细胞全部用100μg/ mL oxLDL处理30分钟。NTD N末端结构域,RD调节结构域,TMD跨膜结构域,CTT C末端胞质尾,SD抑制结构域,由α和β结构域组成的IBC IP3结合核心。
或者,将epsin 1结合位点映射到HEK 293T细胞中表达的,截短的IP3R1构建体上,发现IP3R1的N末端结构域(NTD)对于epsin 1-IP3R1相互作用至关重要(图 2d-f)。使用在IP3R1的NTD中包含精确缺失的表达构建体进行的其他精细定位实验表明,抑制域(SD)降低了与肌醇三磷酸(IP3)结合核心(IBCα和IBCβ)的亲和力,对epsin 1的结合至关重要(图。 2克-i的和补充图 6C)。结果,我们详细的作图实验表明,epsin中的UIM和IP3R1中的SD负责这些蛋白质的分子相互作用。
Epsin 1通过与泛素化的IP3R1结合来调节受体降解
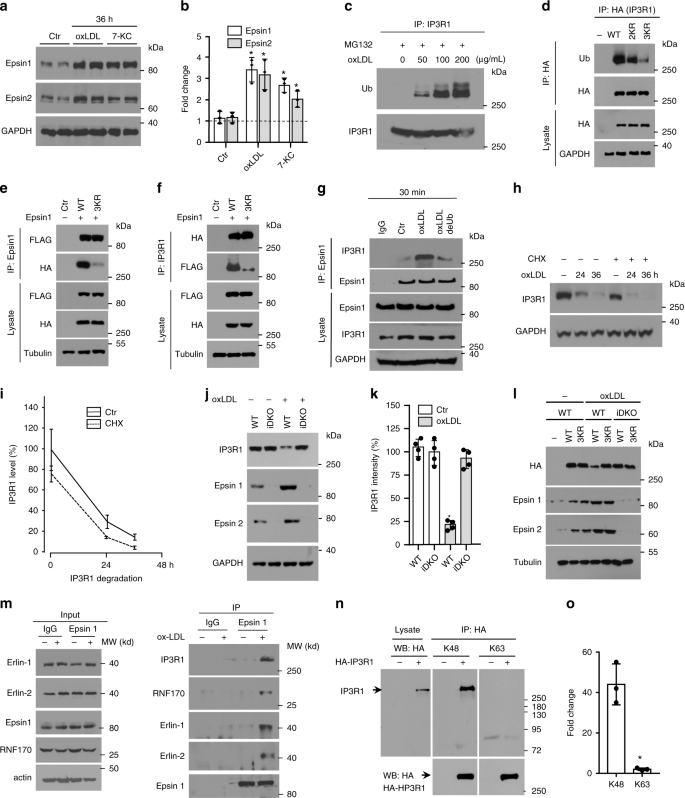
为了确定epsin 1和IP3R1之间相互作用的结果,我们从对照(ApoE -/-)和突变小鼠(EC-iDKO / ApoE -/-)中分离了MAEC,并用致动脉粥样硬化胆固醇处理了这些细胞,以确定其对特异性抗体的作用。基因表达以及IP3R1的泛素化和蛋白酶体降解。与用100 µg / mL oxLDL或50 µM 7-KC进行的急性(30分钟)处理不同(图 1c–f),经过36 h刺激的对照小鼠内皮细胞的总细胞裂解物显示,epsin 1和2均显着增加蛋白质水平(图 3a,b)。来自EC-iDKO / ApoE的MAEC -/-(iDKO)胆固醇治疗36小时的小鼠的IP3R1 mRNA水平没有变化,这暗示IP3R1在蛋白水平上受到epsins的调节,这与相应的GO分析一致(补充图 6d和补充数据)文件 2)。为了支持这种解释,在存在MG132的情况下,急性oxLDL处理(0、50、100和200 µg / mL)可增加IP3R1的泛素化,从而抑制泛素缀合蛋白的降解并使其定量(图 3c和补充资料)。图 6f)。响应于长期致动脉粥样硬化的胆固醇,IP3R1泛素化的增加导致蛋白酶体降解和该钙从ER膜释放通道的损失(图。 1g,h)。
a,b用100μg/ mL oxLDL或50μM7-KC处理的MAEC中的Epsin表达(36 h)。蛋白质印迹分析(a)和定量(b)(n = 3,星号P <0.001)。c在 5μMMG132存在下用oxLDL处理的MAEC(30分钟),然后进行IP和Western印迹检测泛素和IP3R1(n = 5)。d将转染到293T细胞中的含有K126R / K129R(2KR)和K126R / K129R / K143R(3KR)突变的HA标记IP3R1用100μg/ mL oxLDL(30分钟)处理,然后用于IP和Western印迹分析HA(IP3R1),泛素和蛋白质(n = 4)。e,f带有3KR突变的HA标记IP3R1和转染到293T细胞中的FLAG-epsin 1(24 h),用100μg/ mL oxLDL处理(30分钟),并用于HA,FLAG和蛋白质的IP和蛋白质印迹分析(n = 4)。用100μg/ mL oxLDL处理30 g MAEC(30分钟),然后进行IP和蛋白印迹分析以分析epsin1。用10μM去泛素化酶(deUb)USP2处理裂解液(n = 4,星号P <0.05,对oxLDL)。h,i MAEC用100μg/ mL oxLDL处理0、24和36 h±10μg/ mL环己酰胺(CHX)。Western分析IP3R1(h)和定量(i)(n = 5)。Ĵ,通过Western印迹分析IP3R1(j)并定量(k)从用100μg/ mL oxLDL处理的ApoE -/-(WT)或EC-iDKO / ApoE -/-(iDKO)小鼠中分离出的k MAEC (j)并定量(k) (n = 4,P <0.001)。l用100μg/ mL oxLDL处理带有HA标记的野生型(WT)或3KR IP3R1转染的对照(WT)或iDKO MAEC(30 h)。通过蛋白质印迹分析裂解液中的HA(IP3R1),epsins和微管蛋白(n = 5)。m个 MAEC在10 µM MG132存在下处理±100μg/ mL oxLDL(4小时),然后进行epsin 1 IP和免疫印迹(n = 3)。ñHA标记的IP3R1转染的293T细胞在10μMMG132存在下用100μg/ mL oxLDL处理(4 h)。分析HA免疫沉淀的裂解液中的K48或K63(n = 3,星号P <0.0001)。使用学生t检验评估数据,并以平均值±SEM表示。o定量转染的IP3R1的K48或K63泛素化(n = 3.星号P <0.001)。
因此,我们进行了生物信息学分析以预测IP3R1 SD中的泛素化位点,因为该区域对于epsin 1的结合至关重要(补充图 7a)。使用HEK 293T细胞在推定位点中用赖氨酸(K)取代精氨酸(R)来表达IP3R1,然后用针对HA标签的抗体对裂解物进行免疫沉淀,证明了双K126R / K129R(2KR)和三联K126R / K129R / K143R( SD中的3KR)突变会阻止IP3R1的泛素化(图 3d和补充图 7b))。此外,我们确定了epsin 1通过泛素-蛋白酶体途径调节IP3R1降解的分子机制。首先,我们在用oxLDL处理的HEK 293T细胞中,用带有HA标签的3KR IP3R1构建体转染了带有FLAG标签的epsin 1,然后对细胞裂解液进行了双向免疫沉淀。全细胞裂解物和免疫沉淀物的蛋白质印迹分析证实IP3R1在氨基酸126、129和143位具有K到R突变,减弱了epsin 1的相互作用(图 3e,f;补充图 7c,d)。其次,我们用100 µg / mL oxLDL处理野生型MAEC 30分钟,并在存在或不存在10 µM USP2(一种重组脱泛素酶(deUb))的情况下,从裂解物中免疫沉淀出与epsin 1相互作用的蛋白质。Western印迹显示在USP2存在的情况下IP3R1的泛素化减少,同时伴随着epsin 1结合的减少,这表明epsin 1-IP3R1相互作用需要泛素化(图 3g和补充图 7e))。第三,在用100 µg / mL oxLDL处理0、24和36 h的MAEC培养物中,存在10 µg / mL环己酰胺(CHX),显示IP3R1降解与在没有翻译抑制的情况下培养的刺激内皮细胞中发现的降解平行,表明蛋白酶体分解代谢既有现有受体又有新合成的受体,而oxLDL对IP3R1蛋白质合成的影响最小(图 3h,i)。第四,epsin 1和2的缺乏阻止了oxLDL诱导的从EC-iDKO / ApoE -/-(iDKO)小鼠分离的MAEC中IP3R1蛋白的慢性减少,反映oxLDL诱导的IP3R1降解是epsin依赖性的(图 3j,k)。最后,对用IP3R1或经oxLDL处理的3KR突变体转染了IP3R1的野生型或突变MAEC衍生的蛋白裂解物进行蛋白印迹分析30个小时后发现,受体降解需要epsin与泛素化IP3R1的相互作用(图 3l和补充图) 。 1408米)。结合起来,这些数据表明IP3R1抑制域的泛素化对于oxLDL诱导的epsin 1结合和该受体的最终降解是必不可少的。
因为已经报道IP3R1可以被E3泛素蛋白连接酶无名指蛋白170(RNF170)30泛素化,所以我们试图确定epsins是否与此酶相关。我们在MG132存在下用oxLDL处理MAEC,并使用epsin 1抗体进行了免疫沉淀实验。我们的结果表明,epsin 1与由RNF170,erlin 1和erlin 2组成的RNF170复合体相关。这些结果表明,在oxLDL处理后,epsin可能参与IP3R1与RNF170的相互作用(图 3m)。)。然后,我们在MG132和oxLDL存在的情况下在HEK 293T细胞中过表达IP3R1(带有HA标签),并使用HA抗体免疫沉淀IP3R1。通过随后用K48和K63抗体进行免疫印迹,我们发现只有K48抗体会产生一条对应于IP3R1的条带,而K63抗体则没有显示该条带(图 3n,o)。这些结果表明,IP3R1被K48连接的链多泛素化,并在致动脉粥样硬化刺激后经历了ER相关的蛋白酶体降解。
Epsin缺乏症在动脉粥样硬化条件下维持钙稳态,并抑制内皮细胞的炎症
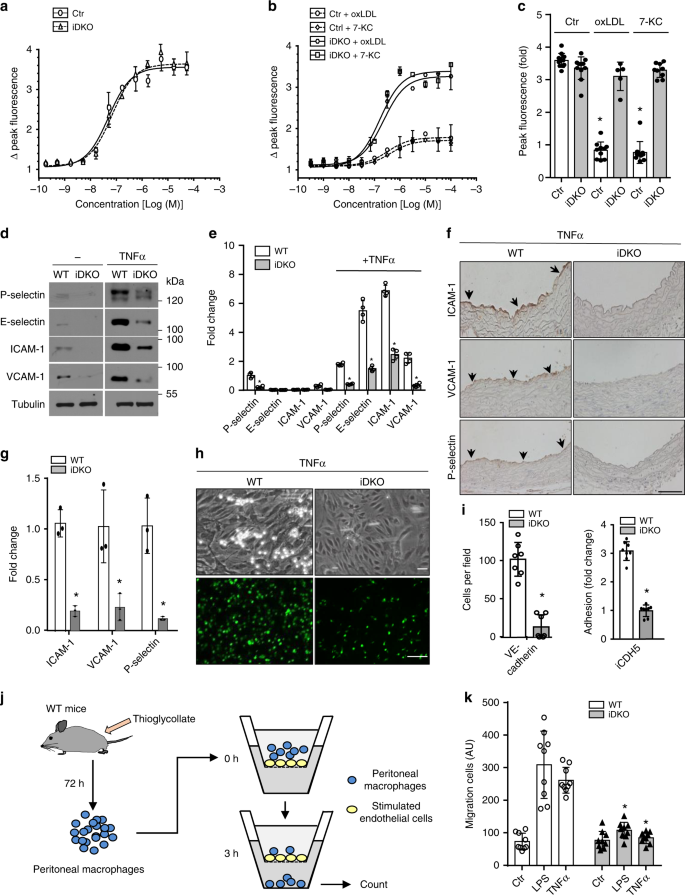
为了确定epsin介导的IP3R1降解的病理生理学意义,我们检查了用胆固醇处理的主动脉内皮细胞除炎症标志物的表达外,还发现了钙稳态调节受损的迹象。作为IP3R1介导释放从ER细胞内钙的,我们刺激对照和iDKO MAECs随使用基于荧光的方法的ATP浓度和记录细胞内钙信号23,32,33。尽管在基础或静止状态下,与对照(ApoE -/-)内皮细胞相比,epsin 1和2(iDKO)的丢失并不影响细胞内钙浓度(图 4a)),用oxLDL或7-KC处理可显着降低对照组中胞质钙的释放,但在缺乏epsin的细胞中则不会(图 4b,c)。这些数据进一步支持以下观点:epsin蛋白的缺失可稳定IP3R1,IP3R1可在动脉粥样硬化条件下保持细胞内钙稳态。
在不存在(a)或存在(b)100 µg / mL oxLDL或50 µM 7-KC 的情况下,用ATP刺激对照组和iDKO小鼠的a – c MAEC 36 h,并测量和定量细胞内钙(c)(n = 5个独立重复,星号P <0.001)。d,e WT或iDKO MAECs用50 ng / mlTNFα处理3小时以检测P选择或E选择素16小时以检测粘附分子ICAM-1和VCAM-1以及微管蛋白通过Western印迹法(d)之前的量化(ë)(ñ = 5 IND ë侧重复,星号P <0.05)。f,g WT和iDKO小鼠注射0.5 µgTNFα,并在3小时(对于P-选择素)或16小时(对于粘附分子)后处死。用ICAM-1,VCAM-1和P-选择素的抗体对心脏切片进行染色。箭头指示内皮染色(f),其被量化(g)( 每组n= 5只小鼠,星号P <0.001)。比例尺100 µm。h,i在流动(上图)和静态条件下(下图)中性粒细胞对从WT和iDKO小鼠分离的TNF处理的MAEC的粘附力(h)和定量(i)(n = 3个独立的重复序列,星号P <0.001)。MAECs从Epsin 1分离fl / fl / Epsin 2 -/-:VE-钙粘着蛋白-Cre(上图)或Epsin 1 fl / fl / Epsin 2 -/-:iCDH5-Cre小鼠(下图)。标尺为10 µm(明场)或200 µm(荧光)。j,k在不存在或存在epsin 1和2的情况下,使用Transwell平板通过融合MAEC进行腹膜巨噬细胞迁移。将LPS(200 ng / mL)或TNFα(50 ng / mL)添加到上部Transwell腔室中,以刺激内皮细胞3 h,然后添加WT腹膜巨噬细胞(j)。3小时后,对迁移至Transwell小室底部的巨噬细胞进行计数和定量分析(LPS和TNFαWT与iDKO,n = 3个独立实验,每个处理选择3个字段进行统计分析,星号P <0.0001)(k)。所有数据均使用学生t检验进行评估,并以平均值±SEM表示。
为了评估缺乏epsin 1和2的受刺激的主动脉内皮细胞的炎症反应,用50 ng / mLTNFα处理野生型或缺乏epsin的原代MAEC多次,以研究P-选择素,E-选择素,ICAM-1和VCAM -1表达因为这些蛋白质介导白细胞外渗34,35。如所预期的,TNFα在3小时(P-选择素和E-选择素)或16小时(VCAM-1和ICAM-1)刺激对照细胞中的所有四种蛋白质(图 4d-g)。相反,epsin的缺失显着抑制了这些粘附分子的诱导(图 4d-g)。选择素和粘附分子表达减少的功能作用是嗜中性粒细胞对TNFα处理的内皮细胞的粘附力显着下降(图2)。 4小时,我)。我们观察到小鼠巨噬细胞粘附的类似减少。为了补充这些发现,我们对从野生型和EC-iDKO小鼠中分离的MAEC进行了体外巨噬细胞迁移测定。在LPS或TNFα刺激3小时后,我们的数据表明,epsin 1和epsin 2的丧失显着降低了巨噬细胞通过融合内皮细胞层的迁移(图 4j,k;补充图 8)。由于受干扰的钙动态平衡促进炎症,我们的结果强调了爱普生在促进对动脉粥样硬化刺激的内皮功能障碍和炎症中的重要性,部分原因是它们在加速IP3R1降解从而损害钙动态平衡方面的作用36。
删除内皮蛋白1和2抑制动脉粥样硬化
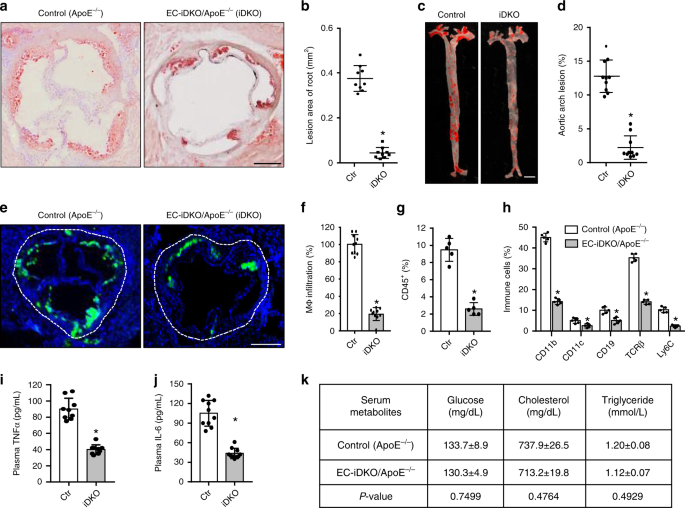
为了了解epsin在通过内皮细胞功能障碍促进动脉粥样硬化中的体内作用,我们采用了ApoE -/-动脉粥样硬化小鼠,在全球epsin 2基因敲除背景下(EC-iDKO / ApoE - / - 。)(补充图 1A-C )18,19,25。为了加速动脉粥样硬化的形成,给十周大的小鼠喂食了西方饮食(WD)8至16周。动脉粥样硬化通过冷冻保存的心脏切片或面部制剂,通过WD喂养的ApoE -/-和EC-iDKO / ApoE -/-小鼠的主动脉根部和足弓中的中性甘油三酸酯的油红O(ORO)染色来监测37。喂入WD时,ApoE -/-小鼠在主动脉根部和弓形中逐渐进行脂质沉积,而内皮蛋白的损失则减弱了脂质沉积(图 5a-d和补充图 9a-d)。随着时间的流逝,雄性和雌性小鼠中由epsin缺乏引起的动脉粥样硬化的减少是相当的(未显示)。与epsin 1和epsin 2的冗余功能相一致,喂食WD的epsin 2 -/- / ApoE -/-小鼠与ApoE -/-小鼠(未显示)相比,主动脉脂质沉积水平没有差异22。
a – d主动脉根(a)和对照(c)的动脉粥样硬化病变(ApoE -/-)和EC-iDKO / ApoE -/-(iDKO)的动脉粥样硬化小鼠的动脉粥样硬化病变的油红O(ORO)染色12-14周。主动脉根和弓病变的统计分析分别在(b)和(d)中显示( 主动脉根为n = 9只 小鼠,主动脉弓为n = 10只小鼠,星号P <0.001)。比例尺为500μm(a)和5 mm(c)。Ë,˚F马Ç用Moma-2抗体对对照和iDKO小鼠饲喂WD(e)并定量(f)进行免疫荧光染色,对主动脉根部的巨噬细胞(MΦ)进行浸润( 每组n = 10,星号P <0.001)。比例尺500μm。g使用FACS分析CD45 +细胞,测量主动脉弓的免疫细胞和炎性细胞。数据表示为所分析总细胞的百分比( 每组n = 5,星号P <0.05)。h对照和iDKO小鼠通过FACS测量的主动脉弓免疫细胞亚型的百分比(每组n = 5只小鼠,星号P <0.001)。i,j对照和iDKO小鼠的血清TNFα和IL-6水平( 每组n = 10,星号P <0.001)。k血清中的代谢参数( 每组n = 10)。使用Student's t检验进行统计分析,并表示为平均值±SEM。
分别通过免疫荧光染色和流式细胞术测定,内皮素蛋白1和2的缺失会损害巨噬细胞(图 5f,g)募集至主动脉。从ApoE -/-和EC-iDKO / ApoE -/-小鼠的主动脉收集的白细胞常见抗原(CD45 +)群体中鉴定出的免疫细胞亚型包括CD11b,CD11c,CD19,T细胞受体β(TCRβ)和LyC-6阳性细胞(图 5h)。这些细胞由于epsin缺乏而减少。EC-iDKO / ApoE -/-小鼠的循环促炎细胞因子(TNFα和IL-6)也降低了(图 5i,j)。重要的是,内皮epsins的丢失并没有改变全身的葡萄糖,脂质分布或循环白细胞(图 5k)。为了证实这些发现,我们评估了喂食正常食物或WD的ApoE -/-小鼠,并证实在主动脉内皮中epsin 1增加(补充图 10a)。同时,我们对从人类动脉粥样硬化患者获得的主动脉弓进行了染色,并再次发现epsin 1增加了(补充图 10b)。在一起,这些结果表明,在动脉粥样硬化的内皮细胞中内皮蛋白表达上调,并且这些衔接蛋白的缺失抑制了动脉粥样硬化。
IP3R1在小鼠内皮和主动脉中的分布和丰度
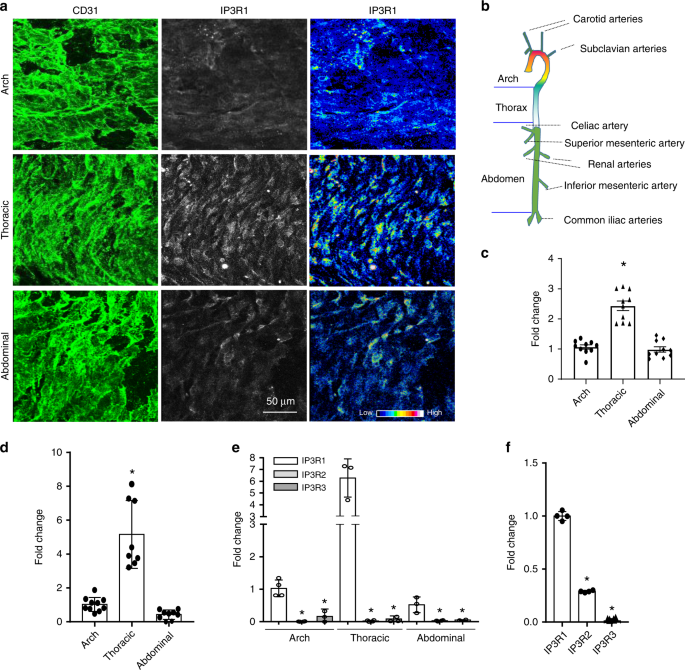
由于不同的主动脉区域受到不同的切应力,我们认为IP3R1的水平可能会沿着这些血管的长度变化。整个主动脉染色和共聚焦成像显示,相对于主动脉弓和腹主动脉,胸主动脉内皮中存在更多的IP3R1蛋白(图 6a–c)。为了证实这些发现,将这些主动脉区中的七个用于RNA提取(见图 6b)。定量RT-PCR分析显示,与主动脉弓和腹主动脉相比,胸主动脉中IP3R1表达水平显着提高(图 6d)。这些数据表明,与动脉粥样硬化区域相比,IP3R1在主要受到脉动剪切应力作用的抗动脉粥样硬化区域中有所增加,而动脉粥样硬化区域的主要特征是扰动的血液动力,例如振荡剪切应力。这些数据表明IP3R1具有抗动脉粥样硬化作用。为了研究IP3受体的其他同工型(即IP3R2和IP3R3)是否显示相似的响应,我们通过RT-PCR分析了主动脉节段中的所有三种同工型。我们的结果表明,IP3R1是主要表达的主动脉亚型(图 6e)。这一发现在小鼠主动脉内皮细胞(MAEC)中得到了证实(图 6f),这证实了先前的报道38。
一个整装恩面对免疫荧光染色,然后聚焦成像。拍摄了0.5μm内皮的光学切片。CD31染色显示内皮细胞表面,并且显示了相同光学部分的IP3R1染色(左侧和中央面板)。还描绘了来自主动脉弓,胸主动脉和腹主动脉的切片的IP3R1染色的荧光强度(右图)。b主动脉示意图,突出显示了分析区域。c量化主动脉中IP3R1免疫荧光染色的分布(胸主动脉与主动脉弓和腹主动脉, 每段捕获n = 10个显微视野,星号P <0.01)。dRT-PCR分析主动脉弓,胸主动脉和腹主动脉中IP3R1的丰度(胸主动脉与主动脉弓或腹主动脉,提取7只小鼠的主动脉RNA进行qPCR分析,每个反应重复4次,星号P <0.0001 )。e,f主动脉弓,胸主动脉和腹主动脉中IP3R1,IP3R2和IP3R3 mRNA的丰度。从七只小鼠的主动脉中提取RNA进行qPCR分析,并在每个反应或MAEC中重复4次(e)(f)。(IP3R1与IP3R2和IP3R3,n = 3个独立实验,星号P <0.0001)。所有数据均使用学生t检验进行评估,并以平均值±SEM表示。
内皮细胞IP3R1缺乏会加速动脉粥样硬化
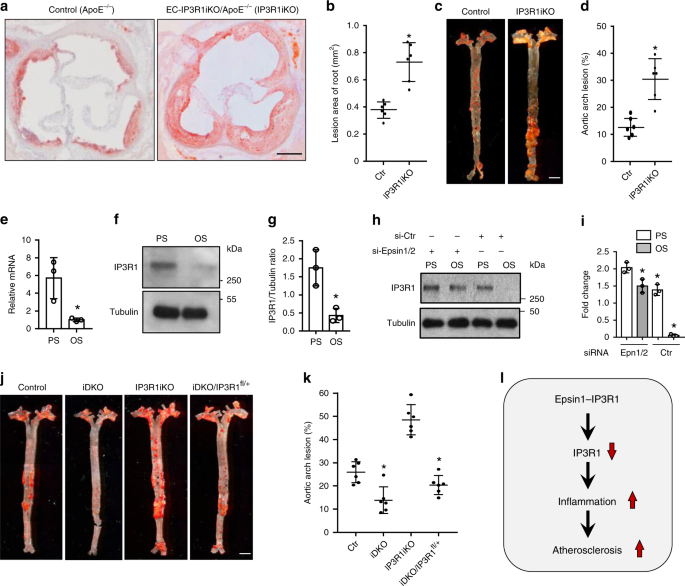
为了研究内皮IP3R1在调节动脉粥样硬化中的体内作用,我们建立了条件内皮特异性IP3R1耗竭小鼠,方法是将IP3R1 fl / fl小鼠与ApoE -/-小鼠杂交,然后用iCDH5-Cre转基因小鼠繁殖后代(补充图)。 。 图11A-C )39。在分离的MAECs中通过western印迹分析和体内免疫荧光染色证实了他莫昔芬注射到内皮中的IP3R1特异性缺失(补充图 11d,e)。当对EC-IP3R1-iKO / ApoE -/-小鼠进行WD喂养12-14周时,主动脉根部沿血管壁形成了严重的动脉粥样硬化和脂质条纹(图 7a,b)。WD喂养的EC-IP3R1-iKO / ApoE -/-的主动脉弓中的动脉粥样硬化病变也明显大于WD喂养的ApoE -/-小鼠(图 7c,d)。此外,这些小鼠的动脉粥样硬化病变在WD喂养25周后出现了大的坏死核心,这表明内皮IP3R1的丧失会对动脉粥样硬化的稳定性产生不利影响(补充图 12a,b)。为了证实这些发现,我们在暴露于已知具有抗动脉粥样硬化作用或动脉粥样硬化作用的血液动力的人类主动脉内皮细胞(HAEC)中探索了IP3R1表达。与动脉粥样硬化的振荡剪切应力(OS,1±4 dynes / cm 2),动脉粥样硬化性搏动剪切应力(PS,12±4 dynes / cm 2)相比)显着诱导并增加IP3R1 mRNA和蛋白水平(图 7e–g)。在没有epsins 1和2的情况下,IP3R1在PS和OS条件下都相对丰富(图 7h,i),同样,在epsins 1和2的存在下OS降低IP3R1的速度更快,这进一步表明这些适配器蛋白质加速IP3R1降解(图 7h,i)。这些数据表明,脉动剪切应力上调了内皮IP3R1,这与IP3R1在体内的抗动脉粥样硬化作用相一致。
一到d ORO在主动脉根粥样硬化病变(的染色一)和拱(Ç控制(ApoE基因的)- / - )和EC-IP3R1iKO /的ApoE - / -(IP3R1iKO)动脉粥样硬化的小鼠喂食WD为12-14周。(b,n = 6个主动脉根)和(d,n = 6个主动脉弓)分别显示了主动脉根和弓根病变的统计分析(星号P <0.001)。比例尺为500μm(a)和5 mm(c)。e – g人主动脉内皮细胞(HAEC)经受12±4达因/厘米2脉动切应力(PS)或1±4达因/ cm 2振荡切应力(OS)持续16 h。IP3R1的mRNA(ë)和PROT È在(˚F)水平通过qRT-PCR和Western印迹分析分别确定。定量蛋白质印迹结果(g)(e – g,n = 3个独立重复,星号P <0.001)。ħ,我 HAECs进行PS或OS为在不存在底物蛋白1和2的存在16小时,随后通过Western印迹(ħ)和统计分析(我)(底物蛋白1对底物蛋白2,Ñ = 3个独立重复,星号P <0.05;epsin 1 vs. Ctr,n = 3个独立重复,星号P <0.003;epsin 2 vs. Ctr。,n = 3个独立的重复,星号P <0.005;)。j,k喂食WD 26-28周的对照,iDKO,IP3R1iKO和iDKO / IP3R1 fl / +小鼠主动脉弓的ORO染色(j)。比例尺500 µm。ORO染色的定量显示,与iDKO小鼠相比,iDKO / IP3R11 /中的动脉粥样硬化进展得到了缓解(k)( 每组n = 6个主动脉弓,星号P <0.001)。升内皮素蛋白介导的IP3R1降解以及炎症和动脉粥样硬化加速的示意图。所有数据均使用学生t检验进行评估,并以平均值±SEM表示。
EC-iDKO中内皮细胞IP3R1的减少可恢复动脉粥样硬化
为了检查epsins是否通过控制体内内皮细胞中的IP3R1降解来调节动脉粥样硬化的进展,我们将EC-iDKO / ApoE -/-小鼠与EC-IP3R1 fl / + / ApoE -/-小鼠杂交,以遗传方式消除一个IP3R1等位基因,并确定是否由于减少了epsin EC-iDKO小鼠中IP3R1的降解,我们可以逆转epsin缺乏对病变进展的动脉粥样硬化保护作用。由于长时间饲喂WD的小鼠的主动脉弓病变更为稳定,因此我们选择为小鼠饲喂WD 26-28周。我们发现EC-iDKO / EC-IP3R1 fl / + / ApoE -/-小鼠表现出的表型具有比EC-iDKO / ApoE -/-大的主动脉粥样斑块小鼠,约占ApoE -/-小鼠斑块大小的60–70%,表明内皮IP3R1杂合性可恢复epsin缺陷小鼠的动脉粥样硬化,而epsin缺失的动脉粥样硬化保护作用主要是由于IP3R1的稳定通过预防蛋白酶体降解而产生的(图 7h,i)。因此,我们的发现揭示了内皮中epsin的缺失通过IP3R1的稳定作用抑制了炎症并减轻了动脉粥样硬化(图 7j)。
讨论区
我们表明,底物蛋白1间与ER钙释放通道IP3R1相互作用在内皮细胞中动脉粥样硬化刺激期间,指示与质膜和内质网(图相关蛋白之间的动态的相互作用 1)40,41。IP3R1具有长N端结构域和一个短的C末端结构域,这两个面胞质溶胶23,42。最近的发现表明,ER膜和质膜动态交互并彼此紧密准40,41,这表明爱普生素通常被认为是与质膜相关的衔接蛋白,具有与IP3R1相互作用的潜力。epsin 1的泛素相互作用基序(UIM)和IP3R1 N端的泛素化抑制域(SD)促进了这些蛋白质的结合(图 2)。这种相互作用导致IP3R1的蛋白酶体降解(图 3),这导致细胞质游离钙浓度的体内平衡失衡,通过炎症加剧内皮功能障碍,导致动脉粥样硬化的发展(图 7)。使用无ApoE的动脉粥样硬化小鼠(ApoE -/-)饲喂高胆固醇高脂肪的西方饮食(WD)并诱导了内皮素特异性蛋白1和2的缺失(EC-iDKO / ApoE -/-),我们证明了内皮素的缺失阻止了主动脉粥样斑病变的生长,提示爱普生是动脉粥样硬化的重要调节剂(图 5)。相反,在喂WD的ApoE -/-小鼠中IP3R1的丢失导致脆弱的动脉粥样硬化斑块形成增加(图 7)。更重要的是,在动脉粥样硬化小鼠中也缺乏epsins的遗传去除了一个IP3R1等位基因(iDKO / IP3R1 fl / +)恢复动脉粥样硬化的形成,反映出epsins和IP3R1的体内相互作用。总的来说,我们的数据揭示了epsins在通过控制泛素化IP3R1成交额促进内皮功能障碍和动脉粥样硬化作用ER相关降解43,44,45。这些发现可能为开发治疗动脉粥样硬化的疗法提供基础。
1,4,5-三磷酸肌醇受体是位于内质网释放钙通道,从而导致钙释放从ER家族23,46。尽管尚未完全解决,但最近的证据表明,成人内皮细胞中IP3R1的缺失不会影响血管舒张或血压。[46]然而,从内皮细胞中删除IP3受体1、2和3的组合会降低血浆一氧化氮的产生并增加血压,提示这些钙通道中存在功能冗余46。有趣的是,相同的IP3受体通过增加细胞质钙浓度来调节血管平滑肌收缩力47。因此,在慢性输注血管紧张素II后,血管平滑肌细胞中所有三个受体的缺失均显着减弱了收缩压的升高,但未能影响基础血压47。IP3受体也被牵连在动脉粥样硬化发挥了重要作用28,29。例如,人内皮细胞中的IP3R3表达可通过KLF4 48下游的动脉粥样硬化性脉动剪切应力(PS)来增加。为了支持这一发现,我们发现在12达因/厘米2的脉动剪切应力下,与1达因/ cm 2的振荡剪切应力相比,IP3R1 mRNA和蛋白水平明显更高使用人的主动脉内皮细胞(图 7)。我们还发现IP3R1的分布和丰度沿主动脉长度不同。该受体在胸主动脉中最大程度地表达,与主动脉弓或腹主动脉相比,它对动脉粥样硬化的抵抗力更大(图 6)。这表明不同的剪切应力会影响IP3R1的表达,这与我们的体外实验一致,该实验显示,抗动脉粥样硬化的脉动层流可上调IP3R1,而动脉粥样硬化振荡液可下调该蛋白(图 7)。总之,这些结果表明增加的IP3R1水平可能会抑制动脉粥样硬化病变的形成和进展。
其他团体已报道了IP3R1蛋白水平和随之而来的钙瞬变可以在血管平滑肌细胞慢性oxLDL的曝光被降低,以及在这两个兔和小鼠动脉粥样硬化模型28,29。与这些报告相一致,我们发现在动脉粥样硬化患者和以西方饮食喂养的无ApoE的小鼠中,整个主动脉壁(即内皮和平滑肌层)的IP3R1降低(补充图 5)。有趣的是,氧化应激还会通过培养的平滑肌细胞中的蛋白酶体降解而导致IP3R1降低,从而导致钙流出减少49。尽管这些结果表明IP3R1可能通过干扰细胞钙稳态而参与了动脉粥样硬化的发展,但我们的研究将内皮细胞epsin介导的泛素化IP3R1的降解与细胞培养和小鼠模型系统中的动脉粥样硬化的发展联系起来(图 3)。
使用突变小鼠模型,我们显示了内皮中IP3R1表达的条件性缺失促进了动脉粥样硬化的发病机理(图 7)。在主动脉弓中,内皮IP3R1的丧失极大地增加了脂质的积累,尤其是在主动脉弓的上升和腹部区域。我们的结果表明,通过防止蛋白酶体降解,epsin缺失的抗动脉粥样硬化作用是IP3R1稳定化的结果。内皮蛋白1和2缺失的组合以及IP3R1的遗传还原(EC-iDKO / EC-IP3R1 fl / +)在ApoE无效的背景下确定了epsin-IP3R1相互作用在促进动脉粥样硬化进展中的重要性。如前所述,我们确定epsin和IP3R1通过epsins的泛素相互作用基序和IP3R1的泛素化SD结构域相互作用(图 2)。后者的域对于epsin介导的IP3R1降解和使用定点诱变抑制epsin 1的结合抑制IP3R1泛素化至关重要(图 3)。值得注意的是,IP3R1泛素化残基主要位于调节域中。50而我们发现IP3R1泛素化发生在SD位点或N端,这可能是由于细胞类型和刺激差异造成的。在人的动脉粥样硬化样本中,我们还发现IP3R1被下调,这暗示IP3R1可能与治疗相关。这些实验表明IP3R1在病理条件下会降解,并可能为开发治疗动脉粥样硬化的疗法提供基础。
我们以前报道在调节VEGFR2的内吞作用和降解的epsins 1和2的特定角色18,19,51。所述底物蛋白- VEGFR2相互作用也依赖于该域名废除在从毛细血管,静脉和小动脉分离内皮细胞VEGFR2底物蛋白结合的底物蛋白UIM和删除18,52。据认为,内皮异质性导致许多中央调节器的差异功能。与此主张相符,我们发现与从小血管分离的内皮细胞相比,从主动脉分离的内皮细胞表达的VEGFR2少得多(补充图 2)。),提示与大血管(MAEC)相比,小血管(MBEC)中涉及血管生成和血管发芽的分子事件更为频繁。我们推测,在这些主动脉内皮细胞中该受体的表达要低得多的情况下,在动脉粥样硬化的主动脉内皮中靶向epsin会导致对EPSin依赖性VEGFR2稳定性的调节作用最小。
从机理的角度,我们发现在慢性动脉粥样硬化期间,epsins通过与epsin泛素相互作用的基序与泛素化的IP3R1抑制子域的直接相互作用来加速IP3R1蛋白酶体降解,从而调节ER钙释放,从而促进动脉粥样硬化。正如我们最近报道的,巨噬细胞epsins的缺失通过预防LRP-1(一种参与受体介导的内吞作用和蛋白质降解的抗炎蛋白)来减少动脉粥样硬化的进展22。内皮蛋白是否也与LRP-1相互作用并靶向该蛋白进行降解的问题是一个有趣的问题,值得进一步研究。
总体而言,我们的发现提高了我们对epsin在炎症,细胞内钙稳态和动脉粥样硬化中的作用的理解。此外,我们的结果阐明了质膜蛋白和ER膜蛋白之间的动态相互作用。因此,扩展了我们对epsin作为质膜受体衔接蛋白和细胞内细胞器膜受体结合伴侣的作用的认识。基于我们的动物和人的数据,IP3R1似乎是在促进除了其在其它疾病中的作用动脉粥样硬化进展的必要如神经变性疾病53,54,乳腺癌55,和高血压56。
总而言之,这项研究以及我们先前的发现,支持了内皮和巨噬细胞爱普生都促进动脉粥样硬化,内皮和巨噬细胞爱普生都丧失了预防动脉粥样硬化的观念22。同时针对巨噬细胞和内皮蛋白的方法可提供前所未有的益处,同时预防内皮功能障碍和泡沫细胞形成,从而有效地阻止动脉粥样硬化57。
方法
人体样本
人的主动脉弓样品购自缅因州医学中心生物库(MMC BB)。动脉粥样硬化患者样本的医学信息在补充数据文件 3中提供。患者样本最初是由MMC BB收集的,MMC BB在机构审查委员会(IRB)批准的规程下运作,该规程由缅因州医学中心研究院(MMCRI)研究合规办公室监督。MMC BB IRB确保按照45 CFR 46.116和21 CFR 50.20的要求并在其范围内,征求每个潜在受试者或受试者合法授权代表的知情同意。MMC BB IRB还涵盖了样品的临床分析。人主动脉内皮细胞(HAEC)购自Cell Applications。
动物
这项研究中的小鼠方案已得到波士顿儿童医院和俄克拉荷马州医学研究基金会的机构动物护理和使用委员会(IACUC)的批准。使用雄性和雌性小鼠并以12 / 12-h的光/暗周期饲养。动脉粥样硬化的ApoE无效小鼠(ApoE -/-)从Jackson研究实验室购买。WD含有1.3%的胆固醇和0.5%的胆酸(Atherogenic Rodent Diet TD.02028,Envigo Teklad)。
因为epsin 1和2双基因敲除小鼠(DKO)显示出胚胎致死性,所以我们生成了epsin 1 fl / fl。epsin 2 -/-小鼠,随后将其与特定的Cre删除子小鼠品系组合以创建组织和细胞类型特异性的可诱导DKO(iDKO)小鼠品系。底物蛋白的小鼠品系的内皮细胞(EC)特异性缺失通过已建立的loxP的重组酶Cre底物蛋白,其中通过LoxP位点在底物蛋白2空背景侧翼1 18,19。通过用EC特异性Cre转基因小鼠(iCDH5-Cre ERT2或VE-cad-Cre ERT2)育种这些小鼠以创建EC-iDKO小鼠来创建条件删除。将EC-iDKO小鼠饲养到ApoE -/-从58岁起的8周开始,每隔一天以C57 / BL6为背景并回交7代并用4-羟基他莫昔芬(5-10 mg / kg,体重)治疗5至7次的小鼠。随后在全文和附图中指示的时间给小鼠喂WD。对于对照小鼠,除了ApoE -/-小鼠以外,通过利用epsin 1和2的冗余功能(即,单个epsin KO小鼠缺乏总表型),我们还使用了同窝对照Epsin 1 fl / fl。没有他莫昔芬可诱导的Cre的Epsin 2 -/- / ApoE -/-小鼠,并用4-羟基他莫昔芬治疗这些小鼠。另外,我们使用Epsin 1 fl / fl;Epsin 2 -/- / ApoE-/-具有他莫昔芬诱导性Cre但未进行4-羟基他莫昔芬治疗的小鼠作为其他对照。为了简单起见,我们将这些对照小鼠统称为ApoE -/-小鼠。重要的是,我们没有观察到这些对照小鼠在动脉粥样硬化斑块形成方面有任何显着差异。
为了生成IP3R1 LoxP-Cre小鼠,将IP3R1与LoxP位点侧接,将EC特异的Cre小鼠与IP3R1 fl / fl小鼠(iCDH5-Cre ERT2)繁殖。IP3R1的可诱导EC特异性缺失;iCDH5-Cre ERT2表示为IP3R1iKO,而EC特异性IP3R1杂合小鼠(EC-IP3R1 fl / + ; iCDH5-Cre ERT2)表示为IP3R1 fl / +。然后将IP3R1突变体与ApoE无效的小鼠在C57 / BL6背景上进行繁殖,进行回交并如上所述用4-羟基他莫昔芬处理。检查Epsin 1 fl / fl中的动脉粥样硬化抢救; Epsin 2 -/- / ApoE -/- / iCDH5-Cre小鼠,引入IP3R1 fl / +,Epsin 1 fl / fl。Epsin 2 -/-通过繁殖获得/ IP3R1 fl / + / ApoE -/- / iCDH5-Cre小鼠。为简单起见,我们将EC-iDKO / IP3R1 fl / + / ApoE -/-小鼠称为iDKO / IP3R1 fl / +。
细胞培养
为了分离鼠主动脉内皮细胞(MAEC),收集主动脉并在4°C下用PBS洗涤两次,然后小心剥离脂肪和结缔组织。将主动脉切成3mm长的部分,并将片段放在具有EC培养基的基质胶包被的(BD Biosciences)板上。4天后,在光学显微镜下可见血管网络,并切除组织段。用5 mg / mL的Dispase II(Roche)分离EC 15-30分钟。离心细胞并在含有FibrOut 11(CHI Scientific)的新鲜EC培养基中培养以去除成纤维细胞。使用EC标记CD31,vWF和VEGFR2抗体通过免疫荧光染色确认了分离的EC的身份,并将抗α-SMA抗体用作阴性对照。试剂的完整列表,包括抗体,肽, 4)。用5 µM他莫昔芬处理培养的MAEC 3天,以诱导EC-iDKO / ApoE -/-或EC-IP3R1 fl / fl的epsin或IP3R1基因缺失:iCDH5-Cre小鼠,从ApoE -/-小鼠分离的MAEC 作为对照,也同时用5 µM他莫昔芬处理。如图所示,在不同的时间用100 µg / mL oxLDL,500 µg / mL胆固醇晶体或50 µM 7-KC处理细胞。还从野生型小鼠中分离出MAEC,并在存在或不存在100μg/ mL oxLDL的情况下,用100 µM亮肽素,10 µM salubrinal和2.5 µM MG132处理36小时。此外,我们从ULK中分离了这些细胞-/-小鼠测试自噬是否可以阻止oxLDL介导的IP3R1降解。这些试剂的制备描述如下。鼠脑内皮细胞(MBECs)进行分离和如先前所描述培养13,18。根据供应商的指导(ATCC)培养HEK 293T细胞。从小鼠分离的原代内皮细胞在两次传代中使用。
质谱
如前所述和以上59分离了MAEC 。对于epsin 1质谱分析,使用十个主动脉在两次传代中使用MAEC产生了约一亿个细胞。将MAEC用100 µg / mL oxLDL处理30分钟,然后用epsin-1抗体在rec蛋白-G-Sepharose 4B珠中进行免疫沉淀(Life Technologies)。将小珠用IP缓冲液彻底清洗5次。根据制造商的规程,使用SDS-PAGE(Perfect NT Gel W,10–20%丙烯酰胺,28孔; DRC Co.)分析样品。凝胶用考马斯亮蓝R250(Sigma-Aldrich)染色。切下蛋白带,用含50 mM NH 4 HCO 3的 50%乙腈脱色,然后用去离子水洗涤。将凝胶在100%乙腈中脱水15分钟,然后在微量离心真空浓缩器(Thermo Fisher Scientific)中干燥60分钟。将其在4°C下浸入10至30 mL的含0.1 ng / mL胰蛋白酶(Promega)的50 mM Tris(pH 9.0)中45分钟。丢弃过量的胰蛋白酶,将凝胶碎片在最小体积(10至20 mL)的50 mM Tris(pH 9.0)缓冲液中于37°C保存24小时。来自凝胶碎片的消化的肽片段在24小时内扩散到周围的溶液中。然后将溶液缓慢转移至1.5 mL硅化塑料管中,并保存在4°C下。为了进一步回收残留在凝胶片中的肽片段,在室温下使用最小体积的含50%ACN的5%甲酸进行20分钟孵育。将含有肽的溶液合并在硅化管中。用0.1%的甲酸将胰蛋白酶的样品稀释5倍,然后使用MonoSpin C18(GL Sciences)脱盐,然后冻干。将冻干的样品溶解在Invitrosol(Thermo Fisher Scientific)中,以增强疏水肽的回收率60。
肽消化物用LTQ Orbitrap Discovery系统(Thermo Fisher Scientific)与Nanospace SI-2 HPLC(Osaka-Soda)结合进行分析,并在CAPCELL PAK C 18 MG III-H S3反相柱(Shiseido)上分离。流动相的流速为200 µL / min。将流动相的溶剂组成编程为在24分钟后以溶剂A(水-甲酸= 100:0.005,v / v)与溶剂B(水-ACN-甲酸= 10:90)的可变混合比变化:0.005,v / v / v):0%B(0–2.8分钟),0–10%B(2.8–3.0分钟),10–25%B(3.0–9.0分钟),25–40%B( 9.0–19.0分钟),40–60%B(19.0–21.0分钟),60–95%B(21.0–21.1分钟)和95%B(21.1–24分钟)。施加5000V的喷雾电压。
Mascot版本2.2.6搜索引擎(Matrix Science)用于从肽的质谱和串联质谱中鉴定蛋白质。通过使用MASCOT引擎搜索UniProtKB人类数据库来匹配多肽数据。数据库搜索参数为:肽质量公差,3 ppm;片段公差为0.8 Da; 将酶设置为胰蛋白酶,最多可进行一次错位切割;修复修饰,氨基甲酰甲基(半胱氨酸);可变修饰,氧化(蛋氨酸)。使用支架版本3.6.1(Proteome Software Inc.)来验证基于MS / MS的肽和蛋白质鉴定。如果可以按照肽先知算法61规定的概率大于95.0%建立肽鉴定,则可以接受肽鉴定。如果可以以大于99.0%的概率建立蛋白质鉴定并且包含至少一种可鉴定的肽,则可以接受蛋白质鉴定。蛋白质概率由蛋白质先知算法62分配。蛋白质丰度的定量分析通过光谱计数法63确定。
中性粒细胞/巨噬细胞粘附测定
嗜中性粒细胞如上所述分离64,65。简要地,给小鼠腹膜内注射1mL的4%巯基乙酸盐培养基。4小时(诱导巨噬细胞分离用3天的巯基乙酸盐诱导3天)后,使用异氟烷处死小鼠,并在无菌条件下,使用带有20 G针头的10 mL注射器收集腹膜液。离心分离细胞并通过流式细胞仪分析纯度(基于分散和Ly6G的表达)。
如先前所述进行分离的野生型嗜中性粒细胞(或巨噬细胞)至MAECs的下流动的表面的密合性64,65。将中性粒细胞(HBSS中含Ca 2 +,Mg 2+和0.5%HSA的1×10 6 / mL )在TNFα刺激的MAEC单层(50 ng / mL,持续3 h)上灌注在平行安装的35 mm皿上板流室(Glycotech)在1达因/ cm 2的剪切应力下。10分钟后,使用视频显微镜系统收集图像5分钟,并使用Element软件(Nikon)分析贴壁细胞。在每个实验中至少从五个不同的领域对贴壁细胞进行计数,每个实验重复超过三遍。
作为具有一些修改的描述进行静态粘附试验66个隔离MAECs分别以8×10的密度接种4每孔使用12孔板含有盖玻片。达到汇合后,用50 ng / mLTNFα刺激细胞3小时以诱导粘附分子的表达。将来自GFP标记的转基因小鼠供体的新鲜分离的小鼠嗜中性白细胞以每孔8×10 5的量添加到MAEC中,使其粘附15分钟,然后用汉克平衡盐溶液(HBSS)洗涤3次,以去除不粘附的嗜中性白细胞,并用DAPI(Thermo Fisher Scientific)染色。通过荧光显微镜对结合的嗜中性粒细胞的数目进行成像,并且粘附细胞与总细胞的比率表示为倍数变化。
巨噬细胞迁移测定
如先前所述进行巨噬细胞迁移测定67。简而言之,将来自WT和EC-iDKO小鼠的MAEC过夜添加至Transwell插入物(Corning)的上腔膜。第二天,用TNFα(50 ng / mL)或LPS(200 ng / mL)处理融合的MAEC 3小时。然后在腹膜内注射4%巯基乙酸盐(TG; 1 mL /动物)后3天,使用6 mL无菌PBS冲洗腹膜腔,收获腹膜巨噬细胞。将这些巨噬细胞添加到Transwell插入物中的内皮细胞顶部。3小时后,通过对Transwell板的下部腔室进行成像,通过明视野显微镜检测到巨噬细胞通过Transwell膜的迁移。
血清葡萄糖和脂质分析
使用血糖仪(OneTouch)测量血清葡萄糖。用试剂盒(BioVision和Thermo Fisher Scientific)测定甘油三酸酯的含量,然后用分光光度法定量。使用试剂盒(Abcam)测量总胆固醇,HDL和LDL / VLDL。
动脉粥样硬化病变的染色
油红O(ORO)染色的主动脉根部和主动脉弓的如先前描述的方法进行37,68。简而言之,在指定的星期数内喂饱WD后,将小鼠禁食14小时,放血并用PBS灌注。心脏和主动脉组织在4%多聚甲醛中固定16小时。为了分析病变,将心脏从主动脉切开,包埋在组织冷冻培养基中并切成薄片(厚度为10μm)。从每只小鼠收集距离200μm的四个连续切片,并用ORO染色并用苏木精复染。为了分析主动脉弓内的病变,内膜表面通过从左弓形动脉到左锁骨下动脉远端5 mm的纵向切开而暴露,以使主动脉弓的内腔平放。将主动脉分别在80%和100%丙二醇中漂洗5分钟,在65°C下用ORO染色8-10分钟,然后在80%丙二醇中脱色5分钟,然后用蒸馏水冲洗。用体视显微镜(Olympus)捕获主动脉的数字图像,并使用NIH Image J量化从主动脉弓到左锁骨下动脉远端5 mm的病变区域。
面共聚焦显微镜
如上所述,用PBS和4%PFA灌注主动脉并分离(即,从心脏到肾主动脉),然后在4%PFA 22中孵育20分钟。基于先前的研究69进行了整装免疫荧光染色。使用100 mM甘氨酸-PBS(pH 7.4)淬灭后,将组织渗透,洗涤并用含有5%驴血清,1%BSA,75 mM NaCl,18 mM Na 3 C 6 H 5 O 7的 PBS封闭以及0.01%Triton X-100在室温下放置2小时。然后将主动脉与抗IP3R1(1:100),α-SMA-Cy3(1:500)和PECAM1(1:100)的一抗孵育过夜。与驴抗大鼠或抗兔Alexa Fluor偶联的二抗孵育2小时后,将组织固定并使用共聚焦显微镜(LSM 880,Zeiss)在488、550和680 nm处成像。区域的感兴趣(ROI)(即,主动脉弓,胸主动脉和腹主动脉)使用0.5μm的成像ž轴增量。内皮细胞被鉴定为PECAM阳性和α-SMA阴性。在对整个主动脉进行低倍瓷砖扫描后,对特定区域进行高倍成像。每个ROI中的内皮细胞均表现出与局部切应力条件一致的形态。使用禅黑色软件(Zeiss)对和图像J进行图像重建和分析70,71。
体外剪切应力实验
在添加有15%胎牛血清(Hyclone),1 ng / mL重组人内皮生长因子(Sigma-Aldrich),90μg/ mL肝素钠(Sigma-Aldrich)的M199培养基中培养人主动脉内皮细胞(HAEC), 100 U / mL链霉素/青霉素(Hyclone)和100 U / mL丙酮酸钠(Hyclone)。如72所述,使用循环流系统向载玻片上接种的HAEC的汇合单层施加切应力。连接到循环系统的往复式注射泵将正弦(1 Hz)分量施加到剪切应力上。动脉粥样硬化的保护性搏动剪切流(PS)或动脉粥样硬化振荡剪切流(OS)产生的剪切应力为12±4或1±4达因/厘米2, 分别。将流动系统封闭在保持在37°C的室内,并用95%的加湿空气加5%的CO 2通风。
流式细胞仪
基本上如先前所述进行流式细胞术73。简而言之,将MAEC(1×10 5)在100μLPBS 加1%牛血清白蛋白(BSA)和PE偶联的抗小鼠VE-钙粘蛋白抗体中于4°C孵育30分钟,洗涤3次,并通过流式细胞仪(Becton Dickinson)进行分析。PE缀合的小鼠IgG1(R&D Systems)用作同种型对照。使用FlowJo版本10软件(Tree Star)分析数据。
对于主动脉驻留的免疫细胞的分析,如先前描述的细胞从主动脉分离6,74。简而言之,将小鼠麻醉并用PBS灌注,并去除血管周围脂肪组织。将主动脉切成小块,并在含有20 mM HEPES的PBS中用含有125 U / mL XI型胶原酶,60 U / mL透明质酸酶,60 U / mL DNase I和450 U / mL I型胶原酶的酶溶液消化。 37°C加热3小时。通过70 µm过滤器过滤后,将细胞重新悬浮在FACS缓冲液中,并在冰上与Fc封闭抗体(eBioscience)孵育15分钟,然后用特异性抗体染色。使用的抗体如下:FITC-CD45,PE / Cy7-CD11b,APC / Cy7-CD11c,PE-CD19,Alex Flour-700-TCR-b和Pacific blue-Ly6-C(均从BioLegend获得并使用以1:100稀释)。细胞同时用碘化丙啶染色。洗完之后
克隆和转染
如先前所述构建底物蛋白1的质粒18,20。IP3R1质粒IP3R1HAWT,IP3R1HAΔ1-1581,IP3R1HAΔ1-1903和IP3R1HAΔ1-2268是Richard JH Wojcikiewicz博士的礼物75。通过PCR扩增并插入到N末端域(NTD)和调节域(RD),抑制域(SD),IP3结合核心α和β(IBC),SD加上IBCα和IBCβ域的截短表达构建体pcDNA3.1载体(引物信息可在补充数据文件 4中找到)。使用QuikChange II定点诱变试剂盒(Agilent)根据制造商的指导制备了双突变(K126R / K129R)和三突变(K126R / K129R / K143R)IP3R1构建体,并通过DNA测序证实。使用Lipofectamine 2000 Transfection Reagent(Thermo Fisher Scientific)将质粒转染到HEK 293T细胞中24 h,并将细胞裂解液用于免疫沉淀或Western blot分析。使用Amaxa Nucleofector™II Device(Lonza)将构建体转染到MAEC中。简而言之,将1×10 6 MAEC与5 µg质粒和100 µL Amaxa Basic Nucleofector Kit初级内皮细胞溶液(Lonza)混合,然后使用程序A-034立即脉冲。培养细胞长达3天以进行基因表达分析。
其他实验程序
免疫沉淀法,western印迹,H&E染色,免疫荧光染色,共聚焦显微镜,和细胞培养的维护是根据公布的标准方法进行的18,20,37,52,68,76。Western印迹重复至少3次,重复的确切次数显示在图例中。使用带有平场复消色差60x物镜(Olympus)的Ix81旋转圆盘共聚焦显微镜(Olympus)和Orca-R 2单色数码相机(滨松)捕获共聚焦和荧光显微镜图像。
氧化的LDL(oxLDL)如先前所述68制备。最终制剂用PBS缓冲液充分透析。根据先前文献77制备胆固醇晶体。将胆固醇(Sigma-Aldrich)溶于95%乙醇(12.5g / l)中并加热至60℃,在仍温热的同时通过滤纸(Whatman)过滤,并在室温下静置以进行结晶。通过过滤收集晶体,高压灭菌,使用无菌研钵和研棒研磨,并在-20°C下储存直至使用。使用LAL试剂盒(Pierce)监测内毒素(EU / mg)。
由U-Pharm Laboratories LLC(Parsippany,NJ)32在MAEC中进行钙动员测定。细胞板滗析和将所述培养基用20μLHBSS Hank平衡盐溶液(HBSS)(138毫的NaCl,5mM的KCl,1.3mM的氯化钙代替2,0.5毫摩尔MgCl 2,0.4mM的硫酸镁4,0.3mM的KH 2 PO 4,0.3mM的钠2 HPO 4,葡萄糖5.6 mM)。以每孔20 µL的浓度添加Fluo-8钙染料(U-Pharm实验室),以达到2 µM的最终浓度,然后在37°C下孵育60分钟,然后在室温下再孵育30分钟。使用带有光学滤光片的FDSS6000系统(滨松)测量基线荧光,激发波长为490 nm,发射波长为525 nm。在相同的测量过程中,在室温下用ATP(0、0.0003、0.003、0.1、0.3、1.0、3.3、30.3和100 µmol / L)刺激细胞,并在1.5 s的间隔内以1.5 s的间隔记录荧光信号。 3分钟 Ca 2+动员结果表示为峰值荧光变化或相对于背景的比率。
基因本体分析
对于基因本体(GO)分析,将从质谱法鉴定的蛋白质列表导入到http://go.princeton.edu/上的通用GO术语查找器中,并根据小鼠(M. musculus)数据库搜索GO术语。分析了包括过程,功能和组件在内的本体论方面。计算蛋白质列表中单个GO项与整个小鼠基因组中单个GO项的百分比之比,并将其定义为富集倍数变化。绘制富集的GO项的倍数变化及其通过GO算法计算的P值。
统计分析
数据表示为平均值±SEM。数据通过两尾学生t检验或ANOVA进行分析,并根据需要进行适当的事后检验。一个P小于0.05 -值被认为是统计显著。所有动物实验在每组中由五只或更多只小鼠组成,代表至少三个重复。重复所有体外实验至少五次。可以在Source Data文件夹中找到用于统计分析和未经裁剪的Western印迹的数据。
|
|