皮层发育过程中兴奋性和抑制性神经元的不平衡状态是精神病的基础
皮层发育过程中兴奋性和抑制性神经元的不平衡状态是精神病的基础
尽管进行了广泛的遗传和神经影像学研究,但对精神分裂症和躁郁症的详细细胞机制仍知之甚少。单细胞RNA测序(scRNA-seq)技术的最新进展使得能够鉴定细胞类型特异性的病理生理学。但是,由于在分析人的大脑时存在方法上的困难以及由于一生的疾病造成的混淆,将其应用于精神疾病具有挑战性。源自患者多能干细胞(iPSC)的脑类器官是研究病理生理过程的强大途径。在这里,我们从与精神病不一致的单卵双胞胎中产生了iPSC衍生的脑器官。对类器官的scRNA-seq分析显示,患者Wnt信号减弱后,GABA能级指标增强,细胞增殖减少,这在iPSC衍生的前脑神经元细胞中得到了证实。精神分裂症不一致的另外两个单卵双胞胎对也证实了患者神经祖细胞的过量GABA能指标。具有良好控制的遗传背景,我们的数据表明皮层发育过程中兴奋性和抑制性神经元的不平衡状态是精神病的基础。
介绍
精神分裂症(SZ)和双相情感障碍(BD)是大脑健康中最难治的疾病。两种疾病都具有复杂的遗传/环境病因,分子神经病理学,神经发育起源以及包括精神病在内的症状的子集。遗传和神经影像研究显示出线索,可以了解这些精神疾病的生物学基础。然而,由于对脑细胞复杂性的方法学局限性,尚未完全阐明负责病因的细胞类型及其功能障碍的后果。
单细胞RNA测序(scRNA-seq)技术的最新发展和进步使得能够鉴定特定于细胞类型的病理过程。虽然scRNA-SEQ已经应用到人类的大脑死后[ 1,2,3 ],混杂因素和方法困难这一技术的应用阻碍到与患者的死后脑精神病学障碍底层细胞改变的识别。
脑类器官已成为研究的结构和功能性人脑发育和神经发育障碍[复杂性的重要的实验工具4,5,6,7 ]。考虑到神经发育起源,源自患者多能干细胞(iPSC)的脑器官是识别SZ和BD细胞类型特定病理生理的最佳工具。
使用来自患者的iPSC进行的越来越多的研究提出了在这些精神疾病中改变的几种细胞途径,包括突触功能和Wnt信号传导[ 8 ]。然而,大多数这些研究将iPSC分化为预定的特定细胞类型。因此,在这些疾病中导致大脑发育改变的发育轨迹仍然未知。此外,先前研究中使用的零星病例对照设计具有较大的异质基因型差异。由于存在很大的异质性,神经精神疾病和导致大脑结构改变的发育轨迹的这些途径的特异性及其之间的关系仍不清楚。因此,在遗传背景受控的情况下模拟大脑发育[ 9]对于该领域的进步也至关重要。
在这里,我们将Quartz-Seq2 [ 10 ] 应用于iPSC衍生的精神病模型,通过对标[ 11 ] 在scRNA-seq方法中表现出出色的性能。为了检测最小化个体间遗传变异的疾病特异性变化,我们分析了一对与精神病不一致的单卵双胞胎的类器官,并验证了另外两个与SZ不一致的单卵双胞胎的发现。
材料和方法
参加者
一个日本家庭,包括一对患有分裂情感障碍的男性单卵双胞胎,双极型(DT1_A,DT1_U,C1和C2)(图 1a和S1A)和两对SZ不协调的单卵双胞胎(DT2_A和DT2_U [ 12 ] 这项研究包括DT3_A和DT3_A和DT3_U [ 13 ](图 S1A),基于阵列的比较基因组杂交(阵列CGH)分析证实了DT1的单合性(图 S1B)。采血日前3年,两个健康的男性对照个体(C3和C4)(图 S1A)也参加了。通过Mini International Neuropsychiatric Interview [ 14 ],由受过训练的精神科医生对所有参与者的精神障碍进行筛查。关于参与者特征的详细信息在图 S1A中示出。获得了所有参与者的书面知情同意,并且所有涉及人类iPSC的实验均获得了理研的Wako第一研究伦理委员会的批准(Wako 1:15-4(41))。
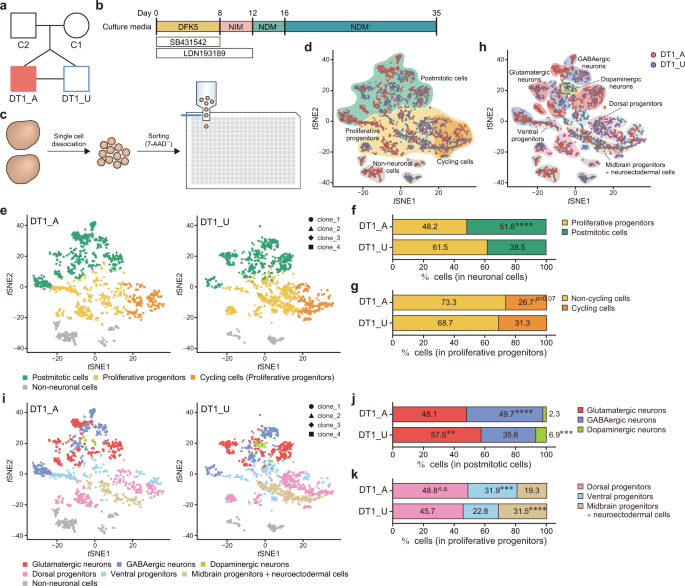
一个谱系,包括一对单卵双生子不和谐的对SA-B的图。DT1_A,受影响的双胞胎;DT1_U,不受影响的双胞胎;C1,妈妈;C2爸爸 b用于生成脑类器官的示意图方案。c scRNA-seq的样品制备概述。的7-AAD -活的单细胞从每个克隆的iPSC两个类器官离解分选到包含细胞裂解缓冲液与条形编码的引物384孔板中。基于标记基因表达模式的细胞成熟度的d t分布随机邻居嵌入(t SNE)图。Ë ŤSNE根据细胞成熟度进行绘制。分别显示了来自DT1_A和DT1_U的数据。增殖祖细胞和有丝分裂后细胞在神经元群体(f)中的比例,非循环细胞和循环细胞在增殖祖细胞中的比例(g)。ħ 吨 SNE根据基于标志物基因的表达模式的神经元亚型的情节。我 牛逼基于神经元亚型SNE地块。分别显示了DT1_A和DT1_U的数据。核分裂后细胞(j)和增殖祖细胞(k)的分类。费舍尔精确检验:** p <0.01;*** p <0.001;**** p <0.0001; ns不重要(f,g,j和k)。参见图。 S2 – 4。
人iPSC的派生,培养和表征
对于DT1_A,DT1_U,C1,C2,C3和C4,从外周血单核细胞(PBMC)建立了iPSC。根据制造商的说明,使用Ficoll-Paque PREMIUM(GE Healthcare,IL,美国),通过密度梯度离心法纯化PBMC。我们生成使用附加型载体的iPSC,如前所述[ 15,16 ]。简而言之,使用Nucleofector II(Lonza,Basel,Switzerland;程序V-024)将质粒pCXLE-hOCT3 / 4-shp53-F,pCXLE-hSK,pCXLE-hUL和pCXWB-EBNA1(Addgene,MA,USA)转染到PBMC中。 )浓度为每3×10 6每100μl溶液3μg细胞和Amaxa Human T细胞Nucleofector试剂盒(Lonza)。然后将转染的细胞接种在补充有16.7μl/ 10 6的 KBM502(Kohjin Bio,Saitama,Japan)中,用丝裂霉素C处理的SNL76 / 7饲养细胞(ATCC,VA,美国)覆盖的100 mm培养皿上Dynabeads人T激活剂CD3 / CD28的细胞(Thermo Fisher Scientific,MA,美国)。转染两天后,等体积的iPSC培养基由DMEM / F12 + GlutaMAX,20%敲除血清替代品(KSR),1×MEM NEAA,100μM2-巯基乙醇,0.5×青霉素/链霉素(Thermo Fisher Scientific)组成,加入4ng / ml的人碱性FGF(bFGF)(和光,大阪,日本)。然后每隔一天用iPSC培养基替换培养基,直到出现iPSC菌落。对于DT2_A,DT2_U,DT3_A和DT3_U,从淋巴母细胞样细胞系(LCL)生成iPSC。LCL维持在LCL培养基中,该培养基由RPMI 1640培养基(Thermo Fisher Scientific)补充10%FBS和0.5×青霉素/链霉素组成。按照先前描述的方法[ 17],通过使用Neon转染系统(赛默飞世尔科技)将2×10 6个细胞分别用1μgpCXLE-hOCT3 / 4-shp53-F,pCXLE-hSK和pCXLE-hUL 电穿孔来对细胞进行重新编程。转染参数如下:1100 V,30 ms,两个脉冲。将转染的细胞在LCL培养基中培养24小时,然后将一半的培养基替换为iPSC培养基,并进一步孵育24小时。电穿孔后48小时,将细胞接种到SNL饲养细胞上,并保持在iPSC培养基中。三到五周后,人工挑选iPSC菌落进行进一步扩增和鉴定。将iPSC保持在iPSC培养基中的饲养细胞上,并每4-6天用CTK溶液传代一次,该溶液由0.25%胰蛋白酶,0.1 mg / ml IV型胶原酶,1 mM CaCl组成2和20%的KSR,如先前所述[ 18 ]。
为了评估已建立的iPSC的神经分化潜能,我们通过快速重聚集(SFEBq)方法通过胚状体样聚集体的无血清漂浮培养,将它们(分别来自DT1_A和DT1_U的八个克隆)分化为神经祖细胞(NPC),如先前所述[ 19 ](图 S1C)。简而言之,使用Accumax(Innovative Cell Technologies,CA,USA)将用10μMY-27632(Wako)处理过夜的iPSC分离成单个细胞,并以9000个细胞的密度转移到PrimeSurface 96U平板(住友电木,东京,日本)。 /好。将细胞在由DMEM / F12 + GlutaMAX,5%KSR,1×MEM NEAA,100μM2-ME和0.5×青霉素/链霉素组成的DFK5培养基中培养14天。在前4天中,向培养基中添加30μMY-27632、10μMSB431542(美国密苏里州西格玛)和100 nM LDN-193189(Miltenyi Biotec,德国贝吉施格拉德巴赫)。使用Accutase(Innovative Cell Technologies)将第14天的神经聚集体分离成单个细胞,并用抗PSA-NCAM-PE(Miltenyi Biotec)和抗TRA-1-60-FITC(BD Biosciences,NJ,USA)抗体染色,按照制造商的协议。然后将细胞用7-AAD(BD Biosciences)染色以排除死细胞,并使用FACS Aria II(BD Biosciences)进行分析。未染色的细胞用作阴性对照。使用FlowJo软件(BD Biosciences)分析数据。通过定量RT-PCR(RT-qPCR)和RT-PCR用表中所列引物检查多能干细胞标志物的表达 S1和抗OCT4,TRA-1-60和TRA-1-81抗体的免疫荧光染色(请参见表S2中的详细信息 )。已建立的iPSC品系的多能性通过体外自发分化测定法进行了验证。将用CTK溶液收获的iPSC细胞团转移到没有bFGF的iPSC培养基中的100 mm超低附着培养皿(Corning,NY,美国)中。每隔一天更换一次介质。收获二十日龄的胚状体(EB),并提取总RNA。使用表S1中列出的引物,通过RT-PCR分析了三种胚层标记物的表达 。为了确认不存在用于重编程的附加型载体的基因组整合,我们使用了OriP盒的引物进行了基因组PCR(表 S1)与Ex Taq HS(日本滋贺县宝良生物)。iPSC的核型分析是通过G带(日本鸟取,Chromocenter Inc.)进行的。
细胞培养
将SNL76 / 7饲养细胞保存在DMEM(Thermo Fisher Scientific)中,在添加有10%FBS和0.5×青霉素/链霉素的0.1%明胶包被的板上。为了抑制增殖,我们用12.4μg/ ml丝裂霉素C(Sigma)处理SNL76 / 7细胞2.25小时。人iPSC品系409B2由RIKEN BRC(日本茨城市)通过再生医学实现项目和日本MEXT的国家生物资源项目提供[ 15 ]。将人类皮肤成纤维细胞(HDF)(RIKEN BRC)保留在补充有10%FBS的MEMα(Thermo Fisher Scientific)中。为了量化重编程因子的外源表达,使用氖载体的游离载体将高密度脂蛋白转染,每3×10 5的浓度为3μg细胞。转染参数如下:1650 V,10 ms,三个脉冲。电穿孔四天后,收获细胞并进行进一步分析。对于RT-PCR,PBMC在KBM502中在涂有抗人类CD3抗体(BD Biosciences)的100 mm皿上扩增,以激活T细胞的增殖。
基因组DNA提取
使用基因组DNA提取试剂盒(Genomix,的里雅斯特,意大利)从外周血样品中提取基因组DNA。使用DNeasy血液与组织试剂盒(Qiagen,Hilden,德国)提取培养细胞的基因组DNA。使用Qubit 2.0荧光计和Qubit dsDNA HS分析试剂盒(Thermo Fisher Scientific)测量提取的dsDNA的浓度。
RNA提取和(q)PCR
根据制造商的说明,使用TRIzol试剂(Thermo Fisher Scientific)和Direct-zol RNA MiniPrep试剂盒(Zymo Research,CA,USA)从iPSC或神经元细胞中提取总细胞RNA。使用RverTraAce-α-kit(Toyobo,大阪,日本),用oligo dT20引物进行逆转录。RT-PCR用Ex Taq HS在Veriti 96孔热循环仪(Thermo Fisher Scientific)上进行。使用SYBR Premix Ex Taq II(Takara Bio)在QuantStudio 12 K Flex实时PCR系统(Thermo Fisher Scientific)上进行RT-qPCR。引物序列示于表 S1中。
基于阵列的比较基因组杂交(阵列CGH)分析
阵列CGH使用SurePrint G3人CGH微阵列试剂盒(1×1 M)(美国加利福尼亚州安捷伦科技公司)进行。使用SureTag Complete DNA标记试剂盒(Agilent Technologies)进行标记。使用安捷伦微阵列扫描仪扫描微阵列载玻片,并使用功能提取软件将扫描的图像数字化。然后使用GeneSpring GX(Agilent Technologies)分析数据。
脑类器官的产生与培养
如前所述,经过修改后生成了脑类器官[ 20]。简而言之,在用CTK溶液从iPSC培养物中去除SNL饲养细胞后,使用Accumax将iPSC解离为单个细胞,并以9000个细胞/孔的密度转移到PrimeSurface 96U板上。将细胞在补充有10μMSB431542和100nM LDN-193189的DFK5培养基中培养8天。在最初的4天中,还向培养基中添加了30μMY-27632。在第8天,将EB转移至神经诱导培养基(NIM)中的超低附着力24孔板(Corning)中,该培养基由DMEM / F12 + GlutaMAX,1×N2补充剂(Thermo Fisher Scientific),1×MEM NEAA,1μg组成/ ml肝素(Sigma),0.5×青霉素/链霉素和100 nM LDN-193189。将它们转移到24孔板后48小时,加入等体积的NIM。在第12天,−)由DMEM / F12和Neurobasal培养基(Thermo Fisher Scientific)的1:1混合物组成,补充有0.5×N2补充剂,0.5×B27补充剂减去维生素A(Thermo Fisher Scientific),0.5×MEM NEAA,1×GlutaMAX, 100μM2-ME和2.65μg/ ml胰岛素,无需搅拌。在第14天更换培养基。在静态培养4天后,将培养基更改为神经分化培养基加(NDM +),其中B27补品减去维生素A被B27补品(含维生素A)代替。然后在定轨振荡器(IKA,Staufen,德国)上以80 rpm的速度搅拌培养物。每3-4天更换一次培养基。对于急救实验,将EBs /类生物体用1 mM LiCl(Sigma)或100 ng / ml Wnt3a(R&D systems,MN,USA)处理8天(第4-12天)。在第30天和第35天,将类器官固定并用适当的抗体免疫染色,并分别进行scRNA-seq分析。SOX2 +心室区(VZ)样层的大小是使用ImageJ软件测量的[ 21 ]。定量以非盲目方式进行。SOX2之间的暧昧边界+和SOX2 -基于DCX的表达确定细胞,DCX的表达在连续切片上与SOX2共染色。用ImageJ软件测量GABA在脑类器官切片上的荧光强度。阈值是通过日元的方法确定的。总荧光强度除以面积。
Quartz-Seq2单细胞RNA-seq分析
在第35天,将来自DT1_A和DT1_U的大脑类器官(每个iPSC克隆两个类器官)在细胞回收溶液(Corning)中在冰上孵育45分钟。用PBS洗涤两次后,将类器官在37℃的Accutase中孵育20分钟,然后通过上下移液将其分解为单个细胞。用FACS缓冲液冲洗细胞,该缓冲液由HBSS(Thermo Fisher Scientific)和0.5%BSA组成(MP Biomedicals,CA,美国),并通过35 µm尼龙网(BD Biosciences)过滤。离心后,将细胞重悬于FACS缓冲液中,并在室温下用7-AAD染色15分钟。然后使用FACS Aria II将每个活的单细胞在384孔PCR板(Eppendorf,汉堡,德国)中于4°C下分选到裂解缓冲液中。序列文库DNA是根据我们先前的研究[10 ]。使用具有NextSeq 500测序仪(Illumina,CA,美国)的NextSeq 500/550 High Output v2试剂盒(75个循环)分析文库。Quartz-Seq2的序列规范如下:Read1,22个周期;index1,6个周期;和Read2,64个周期。使用bcl2fastq2(v2.17.1.14)(Illumina)将Bcl文件转换为fastq文件。然后,像以前的研究一样,我们将fastq文件处理成数字表达矩阵[ 10 ]。在此过程中,我们使用FASTX-Toolkit(版本0.0.14)将read2长度缩短为63个核苷酸(https://github.com/agordon/fastx_toolkit/blob/master/reconf)。该过程的数据库版本如下:人类基因组,GRCh38.primary assembly.genome.fa;基因组注释gencode.v27.primary_assembly.annotation.gtf; 和Drop-seq工具,v1.11 [ 22 ]。每口井的fastq平均读取数约为95,000。我们平均每口井检测到约4800个基因计数和20,000个唯一的分子标识符计数。在Quartz-Seq2的检测概率为50%时,ERCC刺入RNA的拷贝数为〜2.18(表 S3)。
使用DESeq2 1.16.1 [ 23 ]和statmod 1.4.30 R包[ 24 ] 选择跨细胞群体的高度可变的基因进行二级分析。首先,我们选择CV2值高于0.3的基因,然后计算第95个百分位。然后,我们删除了中位数值低于95%的基因,并使用glmgam.fit函数拟合了每个基因和经对数转换的CV2的平均表达。最后,我们使用卡方检验评估了每个基因与拟合曲线的偏差的统计显着性,设置了p-value参数为0.001(最终设置:7469个基因)。使用stats R软件包中的kmeans函数排除了线粒体基因表达比例高于12%或少于10-3000个表达基因的异常细胞簇(https://stat.ethz.ch/R-manual/R-devel /library/stats/html/00Index.html),将k参数设置为7(最终设置:2782个单元格)。将数字基因表达矩阵加到1并进行对数转化。使用Rtsne 0.13函数[ 25 ]将源自所有类器官的细胞进行尺寸缩减,将困惑度设置为40。使用kmeans基于细胞类型特异性标记物的表达谱(表S4)[ 26,26]进行细胞分型 。27,28,29 ]。使用edgeR 3.18.1 R包中的glmLR函数计算了每种细胞类型中受影响和未受影响样品之间的DEG [ 30 ]。使用IPA软件(Qiagen)进行DEG的途径富集分析。为了显示基因表达数据,使用了ggplot2 2.2.1 [ 31 ],pHeatmap 1.0.10(https://cran.r-project.org/web/packages/pheatmap/index.html)和Rtsne 0.13。
iPSC分化为前脑特异性神经干/祖细胞(NSPC)和皮层神经元
根据以前的报告,我们将iPSC分为前脑特定的NSPC [ 32],并稍加修改。在大脑类器官分化的第8天,将EBs以48 EBs /孔的密度转移到涂有Matrigel GFR的6孔培养板(Corning)上,该培养基由DMEM / F12 + GlutaMAX,1×N2补充剂,1× MEM NEAA,100μM2-ME,0.5×青霉素/链霉素和100 nM LDN-193189。每2天更换一次培养基。在第24天,使用Accutase将细胞解离为单个细胞,并以150-250个细胞/孔的速度接种在生长在10毫米玻璃盖玻片或13.5毫米Celldesk LF1上的新生鼠皮质星形胶质细胞床上的24孔培养板中(住友NB27培养基中的胶木),该培养基由Neurobasal培养基,1×GlutaMAX-I,不含维生素A的B27补充剂和0.5×青霉素/链霉素组成。从第24天到第28天,向培养基中添加10μMY-27632。在连续培养过程中,每4天更换一半培养基。为了进行拯救实验,从第4天到第24天用1 mM LiCl或100 ng / ml人Wnt3a处理细胞。在第8天通过流式细胞术检查细胞活力。使用7-AAD标记的Accutase将细胞解离为单个细胞。 ,然后使用FACS Aria II进行分析。未染色的细胞用作阴性对照。使用FlowJo软件分析数据。
EdU掺入法
为了测量NSPC的增殖活性,在8天龄的EB和30天龄的NSPC中进行了EdU掺入试验。对于EB样品,将细胞与10μMEdU孵育3或24 h。此后,根据制造商的说明,使用Accutase将细胞解离为单细胞,并用抗CD15-APC抗体(BD Biosciences)染色。然后,按照制造商的规程,准备使用Click-iT Plus EdU流式细胞分析试剂盒(赛默飞世尔科技)检测细胞。DNA用1μg/ ml DAPI(BD Biosciences)染色。使用FACS Aria II分析细胞。未染色的细胞用作阴性对照。使用FlowJo软件分析数据。对于30天的NSPC,将细胞用10μMEdU标记3小时,然后根据制造商的协议使用Click-iT EdU成像套件(Thermo Fisher Scientific)进行信号检测。检测EdU后,将细胞用抗Nestin抗体(MBL,爱知,日本)进一步免疫染色。教育份额使用ImageJ Cell Counter插件测量+ / Nestin +细胞。
电生理分析
使用Multiclamp放大器(Molecular Devices,CA,美国)从放置在Axio Examiner直立显微镜(Carl Zeiss,Oberkochen,德国)的载物台上的iPSC来源的皮质神经元获得全细胞膜片钳记录。录音室中连续用含有130mM的氯化钠,2.5mM的氯化钾,2.2mM的氯化钙的胞外溶液灌注2,1.5毫摩尔MgCl 2,10 mM D-葡萄糖和10 mM HEPES(pH 7.35,渗透压调节至290 mOsm)。对于微型IPSC,将1μMTTX(Tocris Bioscience,英国布里斯托尔)添加到记录溶液中。对于微型EPSC,将1μMTTX和50μM微毒素(Sigma)添加到记录溶液中。微量移液器由硼硅酸盐玻璃毛细管制成,电阻范围为3–6MΩ。细胞内溶液含有100mM葡萄糖酸钾,17mM的氯化钾,5mM的NaCl的,5毫摩尔MgCl 2,10mM的HEPES,0.5mM的EGTA,4mM的ATPK2,和0.5mM GTPNa(pH为7.3,渗透压调整为280毫渗透摩尔浓度)。所有记录均在室温(21–24°C)下进行。事件以10 kHz记录并离线分析。所有分析均使用Clampfit软件(Molecular Devices)进行。
iPSC衍生神经元的形态学分析
为了评估iPSC来源的皮质神经元的形态,使用Lipofectamine 2000(赛默飞世尔科技),用编码EGFP的质粒(pEGFP-N1)(Clontech,CA,美国)转染细胞。转染后四十八小时,可见稳定的EGFP表达,并将细胞在PBS中的4%多聚甲醛(PFA)/蔗糖中固定15分钟。透化后,将细胞与抗GFP抗体(Millipore,MA,美国)在0.3%Triton X-100和0.3%山羊血清白蛋白存在下于4°C孵育过夜。在室温下将稀释在孵育缓冲液中的二抗应用2小时。使用×20或×63物镜在Zeiss 780 Axio检查器(卡尔·蔡司)上对细胞成像。为了进行树突突起密度分析,以0.3μm的切片深度捕获Z堆,折叠成最大强度的投影,
大量RNA序列分析
将第8天和第24天的NSPC用于基因表达分析。根据制造商的说明,使用TRIzol试剂和PureLink RNA Micro试剂盒(Thermo Fisher Scientific)或Direct-zol RNA MiniPrep试剂盒分离总RNA。使用Agilent 2100生物分析仪(Agilent Technologies)进行RNA质量的确认。使用TruSeq RNA样品制备试剂盒v2(Illumina)从纯化的RNA中制备RNA-seq库。文库的长度为316–429 bp,包括衔接子序列。在HiSeq 2500系统(Illumina)上以2×101 bp的配对末端对样品进行测序。对于数据处理,我们使用HISAT2(v2.1.0)将读码与GRCh38人类基因组(GENCODE版本26,GRCh38.p10)对齐[ 33 ]。我们使用SubRead实用程序featureCounts(v1.5.3)[[34 ]用于使用读取级别过滤器的成对末端反向链阅读计数,包括:(1)Hisat2 BAM文件的映射质量对应于60的映射质量的唯一映射的阅读,(2)按适当的对对齐的阅读,(3)排除的嵌合读,以及(4)主要对齐方式[= featureCounts -p -s 2 -Q 60 -B -C --primary -a $ GTF -G $ FASTA -o $ OUTPUT $ BAM =]。使用通过使用picard工具实用程序= CollectInsertSizeMetrics =确定的有效读取长度,将基因计数转换为TPM,以计算所有样本的平均插入片段大小。使用IPA软件对DEG进行通路分析。
免疫细胞化学
在室温下,将细胞用PBS中的4%PFA固定10分钟,然后在室温下用0.2%Triton X-100的PBS透化15分钟。然后在室温下用含0.01%Tween-20的PBS中的10%正常驴血清封闭细胞30分钟,或在4°C过夜。封闭后,将细胞与在封闭溶液中稀释的一抗在4°C孵育过夜,然后将其与二抗在室温孵育2 h。最后将细胞与1μg/ ml Hoechst 33342(Thermo Fisher Scientific)在室温下孵育10分钟。使用带有ApoTome.2的Zeiss AxioObserver.Z1显微镜(Carl Zeiss)检测荧光信号,并使用ZEN软件(Carl Zeiss)和Photoshop CS6软件(Adobe,CA,USA)处理图像。手动计数兴奋性和抑制性突触点的数量。使用ImageJ Analyze粒子插件分析了Gephyrin点子的大小。使用ImageJ Cell Counter插件测量GABA能神经元的比例。
为了对脑类器官进行免疫染色,将第30天在4°C下用PBS中的4%PFA固定过夜,然后用PBS洗涤后,将类器官置于PBS缓冲蔗糖的连续稀释液中(10%,20%和30%,按顺序)在4°C。每天更换每种溶液。将脱水的类有机物保持在4%的30%蔗糖溶液中,直到嵌入OCT化合物(Sakura Finetek,东京,日本)。冷冻切片前一天,将类器官置于30%蔗糖溶液和OCT化合物的1:2混合物中,并在4°C下放置过夜。然后,将类器官动物包埋在30%蔗糖溶液和OCT化合物的1:2混合物中,并立即在干冰/丙酮中冷冻。将冷冻切片(10μm)在室温下用4%PFA的PBS溶液进一步固定3分钟,随后在室温下将它们用含0.3%Triton X-100的PBS中的10%正常驴血清渗透并封闭30分钟。用含0.01%Tween-20的PBS中的5%血清洗涤后,将切片与一抗和二抗一起孵育。表中提供了有关抗体的详细信息 S2。
死后脑基因表达数据分析
我们下载了BrainSeq联盟,背外侧前额叶皮层FASTQ文件[ 35 ]。如先前[描述的读取进行比35,36 ]的方法稍加修改。简而言之,我们通过使用Kallisto(v0.43.1)[ 37 ]和参考转录组将读段与GRCh38人类基因组(GENCODE版本26,GRCh38.p10)进行比对来生成TPM估计值。在患有SZ或分裂情感障碍(“ Schizo”)的患者和非精神病控制患者之间比较了编码146个基因的转录物的表达水平,这些基因用GABA能突触和/或GABA受体信号转导。在每个基因的多个转录本中,我们提取了一个在对照样品中表达最高的蛋白质编码转录本。
统计分析
使用GraphPad Prism 7软件(GraphPad Software,CA,美国)和SPSS软件(IBM,NY,USA)进行统计分析。两组之间的比较使用两尾或一尾学生或Welch t检验,而三组之间的比较则采用单向方差分析和Tukey多重比较检验。为了评估的氯化锂的效果(氯化锂)治疗,我们进行了双因素ANOVA与事后学生或韦尔奇吨测试。为了评估克隆变异和LiCl处理的效果,我们进行了三向方差分析。我们还使用Fisher精确测试来比较scRNA-seq分析中双胞胎之间的大脑类器官中的细胞比例,以及散装RNA海和死后大脑中GABA能突触基因的表达模式。没有使用统计方法来确定样本量。样本量和试验次数列于表 S5中。详细的统计信息可在图例中找到,并在表 S6中显示。样本量和试验次数列于表 S7。使用R studio [ 38 ]中的ggplot2库[ 31 ] 绘制每个图。
结果
受影响的双生脑类器官显示出加速的神经元分化和增强的GABA能级
我们首先从一对患有精神分裂性情感障碍,双相型(SA-B)的男性单卵双生双胎(DT1)中建立了iPSC,其与SZ和BD都具有包括精神病的临床特征(图 1a和S1A,B)。首先,我们从双胞胎中筛选了iPSC的神经元分化潜能(图 S1C – F),并验证了每个个体(受影响的双胞胎:DT1_A1、2、3、4和未受影响的双胞胎:DT1_U1、2)的多个选定克隆的质量。 ,3、4)进行进一步的功能分析(图 S1G – M)。为了研究精神病背后的神经发育变化,我们将iPSCs分为脑类器官(图 1b)。)[ 6,20 ]。在第35天,我们使用Quartz-Seq2方法进行了scRNA-seq分析(图 1c)[ 10 ]。我们首先根据标记基因表达的模式将每个细胞分为神经元和非神经元群体(图 1d,S2和S3A–D以及表 S4)。神经元群体由表达诸如MAPT或STMN2的标志物的有丝分裂后细胞组成,并且增殖祖细胞对诸如SOX2或NES的标志物呈阳性(图 1d和表 S4))。非神经元人群包括星形胶质细胞,少突胶质细胞,间充质细胞和脉络丛的祖细胞(表 S4)。与健康的双胎(DT1_U)派生的类器官相比,来自精神病双胞胎(DT1_A)的大脑类器官的增殖祖细胞明显减少,有丝分裂后细胞明显增多(图 1e,f和S3E,F),这意味着对神经元的承诺加快了。在受影响的双胞胎中分化。此外,DT1_A类器官倾向于有更少的循环细胞,表达诸如HMGB2或MKI67的标记(图 1d和表 S4),而不是增殖祖细胞中的DT1_U类器官(图 1e,g和S3E, G)。然后,我们根据基因表达模式进一步解构神经元细胞组成(图 1h,S2和S4A–E和表 S4)。有丝分裂后神经元群体包含谷氨酸能,GABA能和多巴胺能神经元(图 1h和S4A–C)。在祖细胞群中,细胞被分为三个簇,分别由背祖细胞,腹祖细胞和中脑祖细胞+神经外胚层细胞组成(图 1h和S4D,E)。DT1_A中有丝分裂后细胞中谷氨酸能或多巴胺能神经元的比例明显低于DT1_U。相反,DT1_A类器官比DT1_U类器官包含更多的GABA能神经元(图 1i,j和S4F,G)。尽管背祖细胞比例没有显着差异,但DT1_A类器官比DT1_U类器官包含更多的腹祖细胞。或者,在DT1_A类器官中发现的中脑祖细胞+神经外胚层细胞比在DT1_U类器官中发现的少得多(图 1i,k和S4F,H)。
接下来,我们分析了双胞胎之间的差异表达基因(DEG)(表 S8)。与DT1_U类器官中的基因表达相比,DT1_A类器官中的350个基因被下调,而219个基因被上调。这些DEG的IPA显示出DT1_A中细胞周期控制途径和Wnt信号通路的显着下调。相反,“ GABA受体信号传导”明显富集于受影响双胞胎的上调基因之中。此外,在DT1_A类器官中调节轴突指导的基因显着上调(表 S9)。
Wnt信号通路的激活可恢复受影响的双生脑类器官中的细胞增殖缺陷和过量的GABA能指标
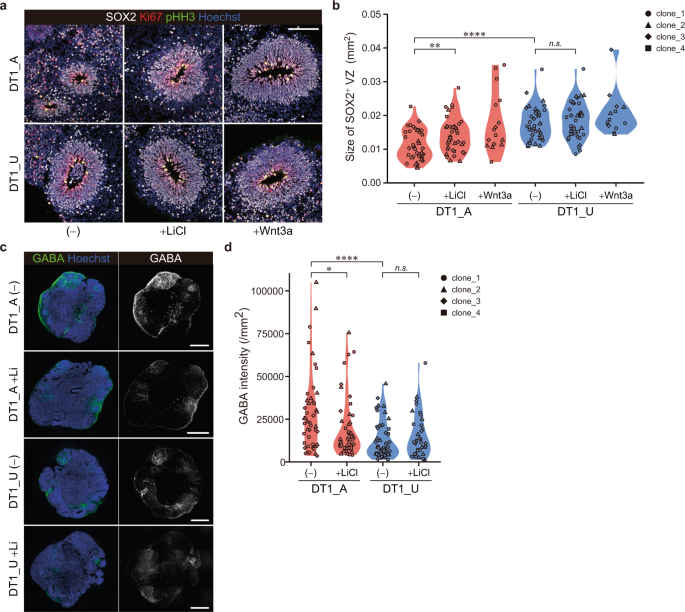
为了确认双胞胎之间在皮质发生过程中细胞组成的差异,我们对类器官进行了免疫细胞化学分析。在第30天,脑类器官显示出分层结构,该结构由代表增殖性神经NPC 的SOX2 + VZ样层和DCX +神经元层组成(图 S5A,B)。与在scRNA-seq分析中确定的增殖祖细胞减少相一致,DT1_A类器官比SOD2 +结构显着小于DT1_U类器官(图 2a,b和S5C–E)。)。此外,我们证实与DT1_U类器官相比,DT1_A类器官中的GABA能种群增加(图 2c,d和S6A,B)。为了探索减弱的Wnt信号通路对这些事件的贡献,我们通过用LiCl,GSK3β抑制剂或Wnt3a处理细胞来激活该通路。有趣的是,在神经发育早期,Wnt /β-catenin信号的激活明显恢复了SOX2 +层的大小和GABA能神经元的比例,特别是在DT1_A类器官中(图 2a–d,S5D,E和S6A,B),表明Wnt /β-catenin信号传导活性降低会影响精神病患者发育中的大脑细胞增殖和命运规范。我们证实,每个iPSC克隆之间的变异性对这些发现的影响小于疾病状态或LiCl治疗的影响(图 S5E和S6B以及表 S6)。
Wnt信号减弱先于受影响的双胞胎在神经发育早期的NPC增殖减少和细胞命运规格改变。
接下来,我们通过单层神经元细胞的时间点分析,确定了在受影响的双胞胎类器官中观察到的细胞和分子改变的顺序。双胞胎的iPSC通过SFEBq方法结合双重SMAD抑制作用分化为前脑神经干/祖细胞(NSPC)(图 3a)[ 32 ]。我们首先从两个不同的发育阶段对iPSC衍生的NSPC进行了大体积RNA测序。在第8天,DT1_A和DT1_U之间有150个基因以我们的标准差异表达(|倍数变化|> 1.5和错误发现率<0.05),并且通路分析显示“ Wnt /β-CateninSignaling”中的这些DEG显着富集。 (表 S10)。在该途径的DEG中,信号传导途径的抑制剂[39,40,41 ]被上调,和Wnt受体及其下游基因表达下调在DT1_A衍生NSPCs(图 S7A),在精神病患者的早期神经发育过程中暗示减少Wnt信号活性。我们在这个时间点研究了NSPC的增殖和生存能力,发现双胞胎之间没有差异(图 S7B,C)。在第24天,我们发现双胞胎之间没有符合标准的DEG。但是,当我们研究调节GABA能神经元规格的基因的表达模式时,关键的转录因子DLX1和DLX2 [ 42RT-qPCR证实,与DT1_U来源的细胞相比,在DT1_A来源的NPCs中,]]显着上调(图 S7D,E)。相比之下,双胞胎之间的PAX6和NEUROG2(调节皮层兴奋性神经元生成的基因)的表达没有差异[ 43 ](图 S7 F,G)。既不表达DLX1也不DLX2第8天的双胞胎之间有所不同(数据未显示)。此外,在类器官的scRNA-seq分析中,“ GABA受体信号传导”途径中包含的大多数基因已在DT1_A的24天龄NPC中显示出明显的上调(图 S7H)。此外,在早期神经发育过程中通过用LiCl或Wnt3a处理激活Wnt /β-catenin信号转导会特别抑制DT1_A衍生的NSPCs中GABA能级规范相关基因的表达(图 S7D,E和H)。因此,在受影响的双胞胎中,Wnt信号传导活性在非常早期的发育阶段就减弱了,并导致了皮质发育中GABA能神经元的不平衡分化。
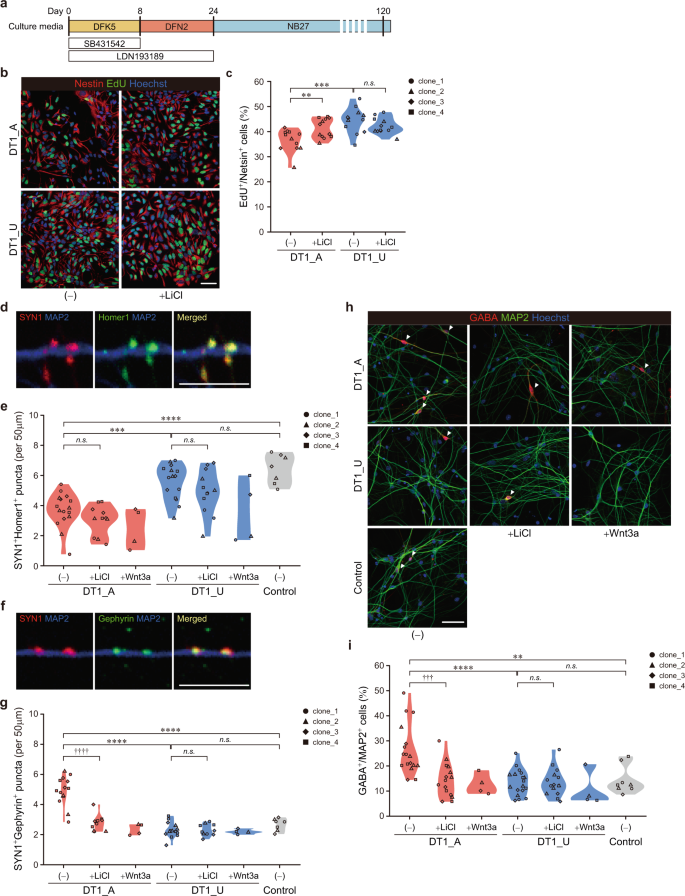
将 iPSC分化为前脑特异性神经元细胞的示意图方案。b 30天大的NPC中EdU和Nestin染色的代表性图像。比例尺,50μm。c EdU阳性增殖NPC的定量分析。事后t检验的双向ANOVA :** p <0.01;*** p <0.001;ns不重要。d在120天大的神经元的MAP2 +树突上表达SYN1和Homer1的兴奋性突触的代表性图像。比例尺,10μm。e SYN1 + Homer1 +兴奋性突触的定量。F在120天大的神经元的MAP2 +树突上表达SYN1和Gephyrin的抑制性突触的代表性图像。比例尺,10μm。g定量SYN1 + Gephyrin +抑制性突触。h来自120天大的神经元的GABA和MAP2免疫染色的样本图像。比例尺,50μm。箭头指示GABA能神经元。i GABA + MAP2 +细胞的比例。具有Tukey多重比较测试的单向方差分析:** p <0.01;*** p <0.001;**** p <0.0001; ns不重要;两因素方差分析与事后Ť-检验:††† p <0.001;†††† p <0.0001; ns不重要;由于样本量有限,未对Wnt3a处理的样本进行统计分析。也参见图 S8。
然后,我们在第30天评估了前脑NPC的增殖。尽管在第8天双胞胎之间没有差异(图 S7C),这与脑类器官的发现(图1e,f和2a,b),DT1_A-在此后期阶段,衍生自NPC的增殖明显少于衍生自DT1_U的NPC。LiCl对DT1_U NPC没有明显作用,但是它显着改善了DT1_A NPC中的细胞增殖(图 3b,c和S7I,J),证实DT1_A皮质发育过程中Wnt信号传导活性降低会影响神经元细胞的增殖。我们证实,iPSC对NPC增殖的克隆变异效应小于疾病状态或LiCl处理的效应(图 S7J和表 S6)。
受影响的双胞胎神经网络在后期神经发育阶段表现出兴奋/抑制平衡改变
为了检查在发育早期在DT1_A来源的NPC中观察到的调节GABA能神经元分化的基因上调的后果,我们进一步将细胞分化为表现出自发放电的成熟皮质神经元(图 S8A)。尽管来自双胞胎的120日龄神经元的体细胞大小和神经元树突状乔化没有差异(数据未显示),但DT1_A神经元比DT1_U神经元显示出更多的树突状突起(图 S8B),提示患者神经元的加速成熟。然后,我们在第120天通过电生理学和免疫细胞化学分析研究了iPSC衍生的皮层网络之间神经元亚型的平衡。双胞胎的神经元在兴奋性或抑制性突触电流的频率或振幅方面未显示任何显着差异(图 S8C– H)。但是,用突触前标记突触蛋白-1(SYN1)和突触后标记Homer1(对于兴奋性突触)或Gephyrin(对于抑制性突触)进行免疫标记神经元时,双胞胎之间的兴奋性和抑制性突触密度不平衡。DT1_A神经元的SYN1 + Homer1 +兴奋性突触的密度显着降低(图 3d,e和S8I, J)。相反,与源自DT1_U的神经元相比,DT1_A 中的SYN1 + Gephyrin +抑制性泪点显着增加(图 3f,g和S8K,L)。此外,DT1_A中的GABA能神经元比例显着高于DT1_U(图 3h,i和S8M, N)。在早期(第4-24天)通过LiCl处理激活Wnt信号传导对任一双胞胎的兴奋性突触密度没有明显影响(图 3e和S8I))。然而,特别是在DT1_A神经元中,LiCl显着降低了抑制性突触和GABA能种群的密度(图 3g–i和S8K, M)。重要的是,来自健康对照个体的iPSC的皮质神经元(图 S1A和S8O)与DT1_U神经元的行为没有明显区别,而它们在DT1_A神经元的突触密度和GABA能比上均表现出显着差异(图 3e,g,i和S8 I) ,K,M)。这一发现表明,GABA能规范表型的增加确实与精神病有关。因此,在神经发育的早期阶段,Wnt /β-catenin信号的减弱导致神经发育向抑制作用增强,后者在后期由DT1_A衍生的皮层神经元形成的体外网络的兴奋和抑制(E / I)平衡受到抑制。我们确认每个iPSC克隆之间的变异对这些表型的影响要小于疾病状况或LiCl处理的影响(图 S8J,L,N和表 S6)。
来自三个患有精神病的单卵双胞胎的iPSC衍生的NPC与健康双胞胎相比显示GABA能突触相关基因的上调
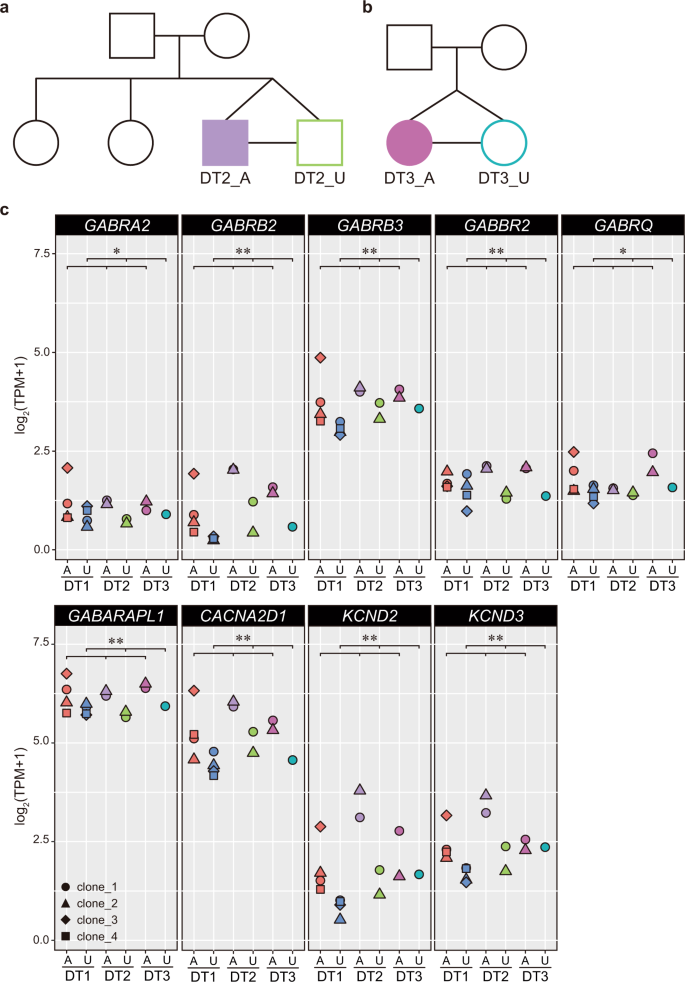
综上所述,这些发现表明在皮质发育期间异常增强的GABA能规范是精神病的细胞内表型之一。为了进一步评估该表型与疾病的相关性,我们分析了另外两对与SZ不符的单卵双胞胎(图 4a,b和S1A)。从每个人的LCL建立iPSC(图 S9A, B),并将其分化为前脑NPC(图 3a)。)。然后,我们进行了批量RNA测序,并比较了在KEGG途径(hsa04727)或基因本体论(GO:0098982)和IPA中的“ GABA受体信号”中至少用术语“ GABA能突触”之一注释的基因的表达模式。在第24天患有精神病的患者及其健康双胞胎(DT1,DT2和DT3)。在分析的146个基因中,受影响的双胞胎和未受影响的双胞胎之间有37个基因显着差异表达(表 S11)。与未受影响的双胞胎的NPC相比,所有三只受精神病影响的双胞胎的NPC均显示35个基因的上调,包括编码突触前和突触后GABA受体亚基和离子通道的基因(图 4c),以及仅下调两个基因(图 S9C和表 S11)。因此,在受精神病影响的双胞胎及其双胞胎之间的早期神经发育过程中,与GABA能突触相关的基因显着上调(p <1.0244e-08,Fisher精确检验)。
a,b系谱图,包括一对与SZ不和谐的单卵双胞胎。DT2_A和DT3_A,受影响的双胞胎;DT2_U和DT3_U,不受影响的双胞胎。c从大量RNA序列分析得出的GABA能突触相关基因的基因表达水平。显示了编码GABA受体亚基和离子通道的代表性基因。受影响的双胞胎,不受影响的双胞胎。韦尔奇t检验:* p <0.05;** p <0.01。还参见图 S9。
讨论区
尽管数十年的研究表明了SZ和BD的几种神经发育机制,但个体之间大量的遗传异质性已阻碍了特定疾病相关细胞表型的鉴定及其在这些疾病发病机理中的时间顺序,特别是在占绝大多数的散发病例中的病人。因此,需要通过模拟具有良好控制的遗传背景的大脑发育来分析患者神经元。
在这项研究中,从单卵双胞胎的iPSC衍生的脑器官和前脑NPC与精神病不一致,我们提出了疾病相关的神经元发育阶段性失调,其中Wnt信号通路的缺陷先于增殖减少和明显的背腹命运向神经网络的E / I平衡趋于GABA能神经元分化。以前的研究已经报道了神经元命运说明书中,改变朝向增加ventralization / GABA能分化在源自iPSC的神经元细胞从患者BD [ 44,45 ]。Chen等。[ 44证明了在患者来源的细胞早期神经发育过程中腹侧化增强,而健康个体的神经元更倾向于背侧命运。他们还表明,LiCl可以促进患者神经元的背侧化。这个发现得到了Kim等人的证实。[ 45 ]患者来源的神经元表现出较高的GAD1表达与健康个体相比,GABA能指标更高。即使这些研究(包括我们的研究)利用了不同的神经元分化方案并分析了完全独立的患者队列,但每项研究都观察到BD患者的iPSC衍生神经元中GABA能级指标的表型相似,这意味着神经元命运指标的改变是其中之一。疾病的潜在机制。根据我们的功能研究表明,在DT1_A衍生的24天大的NPC中,对GABA能神经元的分化重要的基因队列被上调(图 S7D,E, H),表明在神经网络中GABA能神经元的数量增加和神经网络中的抑制性突触。体外(图 2d和3g,我)。在早期神经发育过程中,Shh和Wnts在神经管的背腹模式中起拮抗作用[ 46 ]。有趣的是,我们的鉴定了源自iPSC的NSPCs的RNA-SEQ分析SHH倾向于在DT1_A被上调在第8天(log2FC = -0.77339,Padj = 0.07),除了降低Wnt信号传导(图 S7A)。这些改变表明,失调的Wnt /β-catenin信号传导通过Shh信号传导增强了受影响的双胞胎神经元细胞的腹侧化。
在本研究中,虽然与DT1_U神经元相比,源自DT1_A的神经元的抑制性突触突点显着增加,而兴奋性突点明显减少(图 3e,g),但除了明显减少外,它们没有表现出任何明显的电生理异常。 LiCl对DT1_A衍生神经元的mIPSC振幅的影响(图 S8D,E,G,H)。引起这种矛盾的一种可能机制是iPSC衍生神经元的功能成熟。由于蛋白质和基因的表达可能要提前数天甚至数周才能达到电生理特性,因此我们的研究中iPSC衍生的神经元即使在表达突触标记物的情况下也可能未完全成熟。确实,DT1_A神经元比DT1_U具有更多的Gephyrin点(图 S10A),表明DT1_A衍生的神经元网络中树突上的GABA能释放增加[ 47 ],这支持了我们发现DT1_A神经元中GABA能群体的增加。另一方面,与我们在mIPSC振幅上的发现一致,双生子间的Gephyrin puncta大小没有差异(图 S10B),表明在iPSC衍生的神经元上突触的功能/电生理成熟度上,双胞胎之间没有明显差异。LiCl会显着降低点状卟啉的密度和大小,尤其是在DT1_A神经元中(图 S10A和B)。LiCl处理的DT1_A神经元中mIPSC幅度的显着衰减可能反映了LiCl抑制性突触的减少和未成熟。
以前的研究分析从患者SZ源自iPSC的神经元都建议在突触功能的改变,如神经元连接[衰减48 ],减少的神经元的活性[ 49,50,51 ],赤字在突触密度[ 48,49,51,52,53 ],和神经递质的释放[ 49,52,54]。但是,这些发现依赖于自发性突触事件和形态的分析。尽管自发事件不足以预测突触成熟和功能,但很少有报道用经典的(即不是基于转录因子的)神经元与人PSC进行神经元诱发的突触传递,这表明研究成熟的神经元特性(如突触传递)的局限性,以及那些PSC衍生的神经元。本研究中分析的经典分化的PSC衍生神经元具有成熟状态的异质性[ 55],这可能会导致研究突触传递的困难。在另一方面,基于转录因子诱导的神经元细胞(INS)据报道表现出较高程度的突触成熟比经典的PSC源性神经元的和诱发EPSC和IPSC [ 56,57 ]。迄今为止,通过分析诱发的突触事件,数项研究表明,携带疾病相关基因突变(如STXBP1)的 PSC的iN中神经递质释放失败,该基因突变导致婴儿早期癫痫性脑病[ 58 ]以及自闭症和SZ相关的NRXN1 [ 59]。]。此外,最近的研究开发了一种autaptic培养系统用于诱发突触传递和短期可塑性[分析人iPSC衍生的神经元60,61 ]。因此,对具有这些替代系统的双胞胎iPSC衍生神经元诱发的突触事件的进一步研究可能支持或加强我们对DT1_A神经元体外网络E / I平衡改变的发现。
来自SZ,分裂情感障碍和/或BD患者的死后大脑的几项研究表明,大脑皮层和海马中的中间神经元数量优先减少,表明这些疾病与GABA能网络的破坏有关[ 62 ]。我们对患有精神病患者和非精神病学控制患者的死后脑组织的分析(图 S11A)[ 35 ]也证明了患者大脑中GABA能突触相关基因的显着下调。在研究的146个基因中,有107个基因的表达降低,而在精神病性大脑中只有11个基因被上调(p <6.4038e-21,Fisher精确检验)(图 S11B)和表 S11)。在患有精神病患者的iPSC来源的神经元细胞中观察到增强的GABA能规范(图 4c和S9C)似乎与那些发现不一致。但是,死后大脑数据是该疾病的终极阶段,反映了终身疾病和药理干预的后果。因此,尚不清楚在早期大脑发育过程中特定的扰动是成人中GABA能神经元减少的基础。人iPSC衍生的神经元细胞的胎儿大脑[的综述细胞27,63]; 因此,基于iPSC的神经元疾病模型为我们提供了在疾病发作之前研究分子和细胞变化的机会。而且,在早期发育阶段和成年期之间,病理过程可能有所不同。例如,在自闭症中,早期发育已报道了大脑过度生长,但是随后过早地阻止了生长,导致成年人的大脑体积变小[ 64]。因此,在疾病发作后,成年人早期的GABA能神经元数量过大,其后的GABA能神经元数量会明显减少。此外,在非常早的神经发育阶段,Wnt信号传导活性减弱可能会影响DT1_A在发作前的脑容量。对SZ高危人群的研究一致表明,与对照组相比,该人群的大脑皮层灰质体积较小[ 65 ],这表明在疾病发作时脑体积已经很小,并且灰质体积进一步降低。发作。然而,深圳的前驱研究还表明,脑萎缩主要发生在发病后的前1.5年[ 66]。]。因此,细胞表型与患者大脑形态变化之间的相关性仍存在争议。
已使用源自iPSC的神经元细胞从患者SZ或BD的研究报告中的Wnt信号传导途径[变化45,48,67,68 ]改变神经命运规范[ 44,45 ],线粒体异常[ 69 ],失调的神经元活性[ 49,50,51 ]和兴奋性[ 69,70 ],和突触机能障碍[ 48,49,51,52,53,54]。最近使用脑类器官的研究也显示了BD患者来源的神经元的兴奋性改变[ 71 ]。但是,还没有很好地研究变更之间的关系及其顺序。我们对脑类器官的scRNA-seq分析和其他功能基因组分析,以及对iPSC衍生的神经元细胞进行时间点分析,可以得出结论,在iPSC衍生的Wnt /β-catenin信号传导途径中,病原性的细胞增殖减少和GABA能水平提高是暂时的SA-B患者的神经元细胞。皮质发育过程中祖细胞增殖减少和过度的网络抑制导致对神经元分化的过早承诺可能会导致后期成人神经元网络功能的E / I失衡。
在当前的研究中,双胞胎之间细胞表型不一致的根本原因尚不清楚。为了确定DT1_A和DT1_U之间的基因组差异,我们对外周血样本进行了全基因组测序分析,未发现任何明显的基因组差异,例如单核苷酸变异,插入和缺失以及长散布的element-1(LINE-1)插入。另一方面,基于DNA甲基化分析,我们鉴定了一个CpG位点,该位点在整个血液中差异甲基化为双胞胎之间的iPSC衍生NPC。这可能表明表观遗传学差异对整个DT_1对中细胞表型的不一致在整个重新编程过程中均保持不变。
基于通过分析与疾病不一致的单卵双胞胎对来最小化遗传变异的策略,当前研究提出,在早期皮质发育过程中,神经元和突触患病率的平衡向GABA能规范的转变是精神病的内表型之一。进一步研究以阐明细胞表型与患者症状之间的相关性是了解疾病发病机理和发现新治疗靶点必须解决的重要问题。此外,利用本研究中使用的方法学进行的未来研究将着重于重建精神病患者的整个疾病级联,而其他患者的iPSC系列数据的并行积累可能会导致人们理解复杂的基本原理,
|
|