表达PKCβII的新型转基因小鼠品系显示出B1和边缘区B细胞群体的扩张
摘要
在哺乳动物细胞中以两个剪接变体PKCβI和PKCβII形式表达的蛋白激酶Cβ(PKCβ)在B细胞受体(BCR)信号传导途径中起作用,并有助于B细胞发育。我们通过产生转基因小鼠来研究PKCβII在B细胞中的相对作用,其中转基因的表达使用Eµ启动子(Eµ-PKCβIItg)定向到这些细胞。我们的发现表明,纯合的Eµ-PKCβIItg小鼠在脾脏,腹膜和外周血中显示出从IgD + IgM dim向IgD dim IgM + B细胞迁移的趋势。对这些组织的仔细检查显示,边缘区(MZ)样B细胞(IgD + IgM + CD43 negCD21 + CD24 +),增加的B-1细胞数量(B220 + IgD 昏暗 IgM + CD43 + CD24 + CD5 +)和更多的未成熟B细胞(IgD 昏暗 IgM 昏暗 CD21 neg),但以成熟的B细胞为代价(IgD + IgM +CD21 +)。因此,PKCβII的过度表达是慢性淋巴细胞性白血病细胞的表型特征,它可能会使小鼠的B细胞发育发生偏差,这很可能是由于对BCR信号传导的调节作用所致。
介绍
B细胞受体(BCR)信号传导在B细胞发育的关键阶段中起重要作用1,2。在骨髓中,来自该受体的自发的和环境的配体诱导的滋补信号帮助发育中的B细胞从一个分化阶段过渡到另一个分化阶段,直到它们进入外周循环。在外围,成熟的B细胞在次要淋巴器官之间移动,在该器官中,BCR对特定抗原的识别会导致它们的活化和分化,最终产生可产生特异性抗体产生和免疫记忆的细胞。已发现关键信号分子与BCR信号的阶段特异性反应错综复杂地联系在一起。虽然对于这种关系已经明确定义的B细胞分化的早期阶段尤其如此,但是与周围B细胞命运决定有关的信号传导分子的作用并没有得到很好的表征和理解。2。
一种这样的信号分子是蛋白激酶Cβ(PKCβ),它在B细胞发育和激活的适当调节(包括BCR信号传导3)中起着核心作用。已经证明敲除小鼠中的PKCβ基因prkcb会导致免疫缺陷,使人联想到X连锁免疫缺陷,并对应于体液免疫反应和B细胞功能受损4。PKCβ在B细胞发育和活化,包括BCR信号传导中起重要作用3,4。
BCR参与过程中PKCβ的关键靶标是Bruton酪氨酸激酶(Btk)。PKCβ磷酸化Btk,通过阻断其激活磷脂酶Cγ2(PLCγ2)并刺激Ca 2+从细胞内存储中释放5的能力,从而提供对BCR信号的反馈抑制。遗传研究已经证实PKCβ与Btk的之间的函数关系,这表明存在来自编码这些蛋白质的基因的靶向破坏所得B细胞相关表型的很大的相似性4,6,7,8。转录时编码PKCβ,PRKCB的基因被剪接,产生PKCβI和PKCβII,它们的C末端50个氨基酸互不相同9,10。但是,尚不清楚这些同工型在B细胞发育和激活中是否具有冗余功能或特定功能。
我们先前对B淋巴增生性疾病的恶性细胞中PKCβII的研究表明,这种PKC亚型的过度表达是慢性淋巴细胞性白血病(CLL)细胞的表型特征11。此外,CLL的Tcl1转基因小鼠模型表明PKCβ在CLL的发病机理中起关键作用,因为PKCβ缺陷型小鼠不会发展CLL样疾病12。这种情况的一个可能的解释是在边缘区B细胞(MZ B细胞)和B-1的B细胞的数量的严重减少在PKCβ敲除小鼠4,因为这些是从CLL被认为产生的细胞13,14。有趣的是,在CLL的几乎所有的小鼠模型中,恶性细胞从一个扩增的B-1 B细胞区室开发15,16,17,18,19,并且这类似于其通过被称为单克隆乙淋巴细胞增多的病症之前人类疾病20。基于这些综合的发现,我们希望研究PKCβII在B细胞区室中过度表达的作用。考虑到PKCβ在调节BCR信号和B细胞发育,特别是B-1和MZ B细胞发育中的作用,我们假设PKCβII在小鼠B细胞内的转基因表达可能导致这些B细胞群体的扩增类型。
材料和方法
Eµ-PKCβII tg小鼠的产生
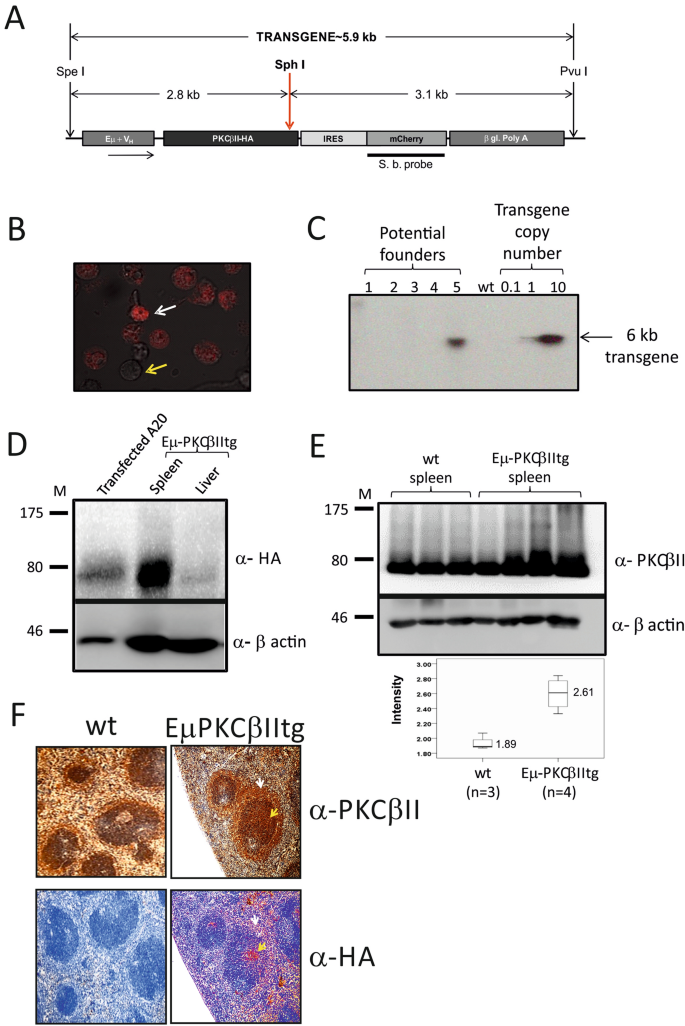
为了产生Eµ-PKCβIItg小鼠,使用了pBSVE6BK质粒(由哈佛医学院的Raif Geha博士提供),该质粒利用VH启动子和IgH增强子特异性地指导靶基因在B细胞中的表达(pEµ载体21)。使用正向5'-GAGAATCGATCAAGATG-GCTGACCCGGCTGCGGGGCC-3'和反向5'-GAGAGTCGACTCAAAGAGCGTAATCTGGAACATCGTATGGGTAGCTCTTGACTTCGGGTTTTAAA引物,全长PKCβII编码序列(2021-bp)在其3'末端通过人流感HA标记。 Eurofins MWG Operon,英国伦敦),然后克隆到pEµ载体的ClaI(本研究中使用的所有限制性酶均来自New Hitachi Biolabs,Hitchin UK)和SalI位点。将核糖体内进入位点(IRES)亚克隆到mCherry的多克隆位点(MCS)的BamHI和SalI位点,然后使用Not-I将IRES-mCherry编码序列亚克隆到pEµ-PKCβIIHA和Apa-I将其置于Eµ载体中PKCβIIHA和β-多球蛋白编码序列之间的5'→3'单向取向(图 1一个)。在小鼠B淋巴瘤细胞系A20 22中测试了该构建体,其中使用溶液V转染试剂盒和程序U-013根据制造商的规程(Lonza)用2 µg pEµ-PKCβIIHA-IRES-mCherry核仁了2×10 6个细胞,英国图克斯伯里(Tewkesbury,UK)观察到的荧光与mCherry的表达有关(图 1B)。然后用Pvu-I和Spe-I消化含有pEμ-PKCβIIHA-IRES-mCherry的构建体,纯化DNA片段,并注入从C57B1 / CBA F1杂种小鼠分离的合子的原核中。通过对从尾巴分离并用SphI消化的基因组DNA进行Southern印迹分析,筛选从该方法产生的小鼠中转基因的存在。基本上与先前所述23一样,将印迹与标记有32 P-dCTP(Amersham Megaprime DNA标记系统)的mCherry特异性DNA探针杂交。通过更高的表达和/或转基因单一整合位点的证据来确定创始人(图 1)。C),并选择在其基因组中显示转基因整合的动物进行进一步育种,以产生本研究中分析的杂合的和最终纯合的Eµ-PKCβIItg转基因动物。为了建立第一代Eμ-PKCβII杂合小鼠,将创建者的小鼠与C57BL / 6野生型小鼠回交以产生F1后代。然后选择来自该杂交的杂合小鼠并进行杂交以产生F2后代。这些F2小鼠中有些是纯合的,至此,我们重新考虑了建立的品系,并将这些小鼠用于表型鉴定和繁殖以扩大品系。Eμ-PKCβIItg,同窝幼仔和非同窝幼仔都保持在相同的条件下。在利物浦大学和格拉斯哥大学的生物服务部门内部产生并繁殖了小鼠。在获得英国内政部适当批准和许可的情况下进行了动物实验。所有涉及动物的实验程序均按照利物浦大学和格拉斯哥大学动物福利和道德审查机构批准的指南进行,并根据当地和家庭办公室规定的标准动物饲养条件进行。
Eµ-PKCβII转基因小鼠的产生。(A)用于产生转基因小鼠的质粒构建体(pEμ-PKCβII-IRES-mCherry)的示意图。(B)使用核转染法用pEμ-PKCβII-IRES-mCherry质粒转染的A20细胞系。白色箭头表示已成功转染并表达mCherry的荧光A20细胞。黄色箭头表示未吸收质粒的细胞。(C)从转基因子代的尾插分离的基因组DNA的Southern印迹分析,以鉴定潜在的Eμ-PKCβIIItg创建者小鼠。通过附带的质粒DNA标准曲线估计插入基因的拷贝数。(D)从纯合Eµ-PKCβIItg小鼠脾脏和肝脏组织中提取的蛋白质的免疫印迹分析。使用针对HA(上图)或β-肌动蛋白(下图)的抗体进行蛋白质印迹。作为阳性对照,从已经用pEµ-PKCβII-IRES-mCherry瞬时转染的A20细胞制备的蛋白裂解物。(E)上面板和中面板。wt(n = 3)和Eµ-PKCβIItg(n = 4)小鼠脾脏组织中PKCβII和β-肌动蛋白表达的蛋白质印迹分析。下面板。wt和Eµ-PKCβIItg小鼠中PKCβII表达的比较。相对于β-肌动蛋白定量PKCβII的表达。(F)用抗HA(用鲜红色染色)和抗PKCβII抗体(用DAB染成褐色)对Eµ-PKCβIItg和wt小鼠的脾脏切片进行免疫组织化学染色。对于Eμ-PKCβIItg小鼠,脾脏部分是连续的,可以使用指向MZ的白色箭头和指向卵泡的黄色箭头叠加上下图像。(C - E)部分中的图像已裁剪以有效显示相关细节,未裁剪的图像可在此手稿随附的补充信息中查看。该图的所有元素已在AAA 43的博士学位论文中发表。
蛋白质印迹分析
如前所述23从组织样品中提取蛋白质。简而言之,使用杵和臼在液氮下将速冻组织样本进行均质化。将匀浆的组织重悬于含有20 mM HEPES,25%甘油,0.42 M NaCl,1.5 mM MgCl 2的缓冲液中,0.2 mM EDTA,1 mM DTT,1 mM PMSF和以下蛋白酶抑制剂:抑肽酶(2 µg / ml),亮肽素(0.5 µg / ml),胃蛋白酶抑制剂A(1 µg / ml)和大豆胰蛋白酶抑制剂(100 µg /进行3次冷冻/解冻循环,然后离心后,收集上清液,并使用改良的Bradford(BioRad,Hemel Hampstead UK)测定蛋白质浓度。通过SDS-PAGE分离等量的蛋白质,转移到Immobilon™膜上(Millipore,Fisher Scientific UK Ltd,英国拉夫堡,英国),并使用Ponceau-S染色来验证等效的蛋白质负载量。根据确定的方案11用以下抗体探测膜:稀释度为1的PKCβII(C-18,圣克鲁斯,Insight生物技术有限公司,英国温布利)或HA [克隆C29F4,(Cell Signaling Technologies,英国Hitchin)或克隆16B12(Covance,Cambridge Bioscience,英国剑桥)] :1,000。与偶联HRP的二抗孵育后,根据制造商的规程(GE Healthcare Life Sciences,Little Chalfont UK),使用增强的化学发光(ECL)可视化蛋白条带。
组织病理学和免疫组化
将脾脏组织固定在10%中性福尔马林缓冲液中,然后包埋在石蜡中。为了去除石蜡和再水化脾脏切片,根据制造商的说明,使用PT Link装置(DAKO,Stockport UK)。免疫组织化学染色使用DAKO Auto-stainer自动玻片处理系统和EnVision™FLEX / HRP试剂盒(DAKO,K8012)进行。使用的主要抗体是PKCβII(C-18)和HA(C29F4)。根据标准方案对脾切片进行苏木精和曙红(H&E)染色。
细胞准备
通过将5-10 ml冰冷的改良PBS(1%BSA + 0.1%叠氮化钠,pH 7.2)注入腹膜腔中,去除腹膜细胞,然后撤出腹膜渗出液。去除脾脏并机械破坏以制备单细胞悬液。在洗涤细胞悬液之前,通过用0.165M氯化铵处理来裂解外周血,腹膜和脾样品中的红细胞。
流式细胞仪
如图所示,通过比较Eµ-PKCβII tg小鼠和wt小鼠,采用流式细胞术表征脾脏,腹膜和外周血中成熟的B细胞亚群。将细胞(2–5×10 6)悬浮在200μl修饰的PBS中,然后加入抗体混合物,并将细胞悬浮液在黑暗中于冰上孵育30分钟。此后,将细胞用300 µl修饰的PBS洗涤,然后在2,000 rpm下于4°C离心2分钟。倒出上清液,并将沉淀重悬于300μl修饰的PBS中。使用LSR-Fortessa流式细胞仪(BD Biosciences)获取标记的细胞,并使用FACSDIVA™和FlowJo™(BD Biosciences,UK)软件包进行分析。荧光标记的抗体是从Biolegend公司(英国伦敦)除非另有说明购买:生活色彩®DsRed mCherry(PT3647-2,Clontech),CD45R / B220-PE(RA3-6B2),CD5-PE / Cy5(53–7.3),IgD-APC(11-26c.2a),CD43-FITC(S11), IgM-APC / Cy7(RMM-1),CD21 / CD35-PE / Cy7(7E9),CD24-PerCP / Cy5.5(M1 / 69),FITC-RatIgG2bκ同种型Ctrl(RTK4530)和CD45R / B220-Alexa福陆公司® 488(RA3-6B2)。B细胞子集的百分比,包括FO(IgD + IgM dim),MZ(IgD dim IgM + CD43 neg CD21 + CD24 +)和B-1(B220 + IgD dim IgM + CD43 + CD24 +)野生同窝和非同窝野生动物之间的B细胞群体非常相似(数据未显示),因此非同窝和同窝野生小鼠被认为是同一组野生小鼠。
钙通量
如先前所述24进行分离细胞中的钙通量分析。简言之,将来自脾细胞Eμ-PKCβIITG坎/ HET小鼠标记用1μM的Fura-2 AM(Invitrogen公司制)在缓冲液(145毫摩尔的NaCl,5mM的KCl,1mM的硫酸镁4,1mM的氯化钙2,10mM的HEPES,0·18%葡萄糖和0·2%BSA(调节至pH 7.4)在37°C下黑暗中放置30分钟。洗涤细胞,将其与10μg/ ml生物素化的抗IgM在4°C下再孵育30分钟,洗涤并以1×10 6 / ml的浓度重新悬浮在缓冲液中。单元格(1.5×10 6)转移到荧光计比色杯中,在数据采集之前,先将其加热至37°C 3分钟。记录基础荧光后,添加50 µl抗生物素蛋白使BCR交联(终浓度8.3 µg / ml),并继续记录3分钟。使用日立F-7000荧光分光光度计(日立高新技术公司,美国伊利诺伊州绍姆堡)在340和380 nm处测量荧光。
免疫球蛋白浓度分析
从小鼠中提取血液,并通过将RBC以12,000 g沉淀10分钟来制备血清。将血清等分并保存在– 20°C直至需要。按照制造商的说明,使用LEGENDplex™试剂盒(英国BioLegend)进行血清中IgM浓度的测定。使用LEGENDplex™数据分析软件加密狗计算IgM浓度。
统计分析
使用GraphPad Prism进行本研究中所有的统计分析® 8软件。
结果
Eµ-PKCβII转基因小鼠的表征
基于所述的Southern印迹分析,集成在创始人小鼠基因组的单中心pEμ-PKCβIIHA-IRES-mCherry的转基因拷贝的数量估计为大于一,但小于10个拷贝(图 1个 C)。PKCβIIHA表达然后通过Western印迹分析进行分析并且在脾脏检测到,但不是在6个月龄小鼠纯合子PKCβIIHA转基因(以下称Eμ-PKCβIItg小鼠)(图的肝 1 d),这表明转基因表达是组织特异性的。比较脾脏组织中蛋白质提取物中总PKCβII的表达,结果表明,与wt对应物相比,Eµ-PKCβIItg小鼠中PKCβII的表达水平明显更高(图 1)。E)。此外,对脾脏内HA表达的分析表明,表达集中在小动脉周围淋巴鞘(PALS)和MZ的滤泡区域内,两者均为B细胞富集区域(图 1 F)。尽管转基因小鼠和wt小鼠脾脏中的总PKCβII表达表现出相似的染色模式,但转基因小鼠组织中的染色强度始终较高,并且与HA相关。我们无法在Eµ-PKCβIItg小鼠中检测到mCherry的表达(数据未显示)。这可能是因为来自IRES序列的二级基因的表达可能是可变的,并且在转基因小鼠中并不总是有效的,因此可能低于检测水平25。
Eµ-PKCβIItg小鼠年龄正常,到14个月大时也没有任何疾病迹象。Eμ-PKCβIItg小鼠的WBC计数在正常范围内,与wt小鼠的WBC计数没有差异(表1)。此外,在Eµ-PKCβIItg小鼠和wt小鼠之间,脾脏重量没有明显变化,尽管与wt小鼠相比,EµPKCβIItg脾脏中的B细胞与合并的T / B淋巴细胞的比例出现了小幅但显着的增加,但是这一比例这些动物的外周血和腹膜中仍然保持相似。
来自Eµ-PKCβIItg小鼠的脾脏组织显示出MZ B细胞数量的增加和随之而来的FO B细胞数量的减少
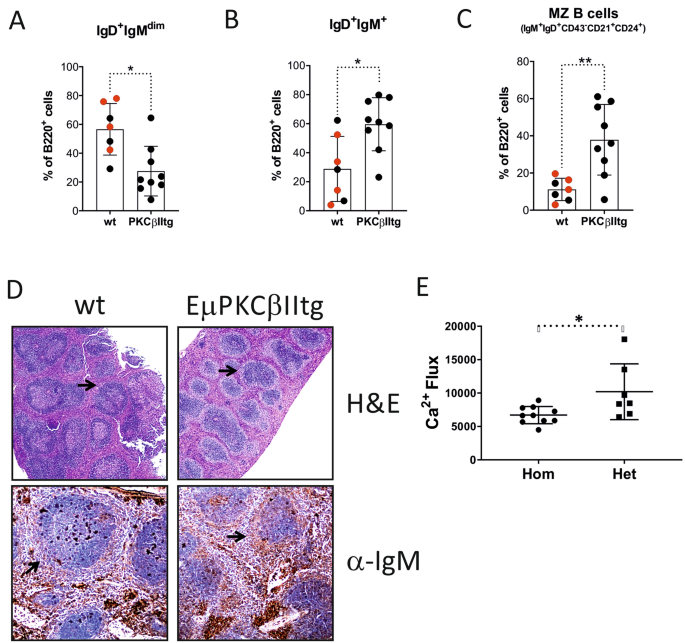
尽管EµPKCβIItg和wt小鼠的总B细胞计数相似,但在离散种群之间观察到差异。我们应用了补充图2所示的门控策略来分析wt和Eµ-PKCβIItg小鼠脾脏组织中的B细胞。因此,首先分析B220 +细胞的表面IgD和IgM表达。与wt对照小鼠相比,Eµ-PKCβIItg小鼠的IgD + IgM + B细胞百分比升高,而IgD +IgM的dim B细胞百分比降低(图 2 A,B)。IgD + IgM 昏暗的分析B细胞由于其CD21和CD24的表达而将它们识别为主要的FO B细胞。wt和Eµ-PKCβIItg小鼠之间这些细胞的表型似乎是一致的(补充图2),尽管后者的数量较少。进一步门控IgD + IgM + B细胞的CD43表达,并进一步分析该抗原阴性的细胞的CD21和CD24表达。主要群体中鉴定,IGD + IgM的+ CD43 阴性CD21 + CD24 +,属于“MZ样”表型和类似于描述前体MZ细胞群体称为边缘区的前体B细胞26,27。与wt小鼠相比,该“ MZ样” B细胞群体在Eµ-PKCβIItg的脾脏组织中表现出明显更高的代表性,表明前者对该表型有强烈的偏见(图 2 C)。朝向偏压此MZ样表型,进一步通过H&E污渍表示Eμ-PKCβIItg扩展MZ证实与野生型小鼠(图相比 2 d,上图),通过抗IgM染色(图识别 2 d,下面板)。有趣的是,这个区域似乎在转基因小鼠脾脏组织中对PKCβII和HA强烈染色(图 1 F)。值得注意的是,IgD + IgM +CD24 + CD43 negCD21阴性的细胞存在于Eµ-PKCβIItg的脾脏组织中,而不存在于wt小鼠中。该种群可能代表未成熟的B细胞,但在本研究中未作进一步分析。转基因动物脾脏B细胞的功能分析表明,从Eµ-PKCβIItg小鼠分离的细胞中,BCR诱导的Ca 2+通量被显着抑制(图2 E),这一观察结果与PKCβ在调节小鼠 脾脏B细胞中的作用一致。 Btk和PLCγ2诱导的钙释放的功能5。因此,这些数据表明,针对B细胞的PKCβII的过表达在功能上限制了抗原受体信号传导,从而导致了Eμ-PKCβIItg小鼠脾MZ B细胞的扩增。
靶向B细胞的PKCβII表达对Eµ-PKCβIItg和wt小鼠脾脏组织中B细胞种群的影响。将由从Eμ-PKCβIItg和wt小鼠分离的脾脏制备的单细胞悬液用含有B220,IgM,IgD,CD43,CD21和CD24标记的抗体混合物染色,然后通过流式细胞术进行分析。然后对以下门中的B220 +细胞百分比进行定量比较(A)IgD + IgM dim,(B)IgD + IgM +和(C)IgD + IgM + CD43 - CD21 + CD24 +按补充图2中所示策略定义的wt和Eµ-PKCβIItg小鼠(MZ样B细胞)。这些图中的黑点表示来自杂合的Eμ-PKCβIItg交配小鼠的wt和纯合的Eμ-PKCβIItg后代。红点是指具有相似遗传背景(C57BL / 6)的wt小鼠,它们的年龄与转基因小鼠的年龄相似。(D)上图来自wt和Eμ-PKCβIItg小鼠的脾组织的H&E染色。下面板wt和Eµ-PKCβIItg小鼠脾脏切片的抗IgM染色。这些图像代表使用来自不同小鼠的脾脏组织进行的n = 2实验,这些小鼠的年龄已经超过12个月。插图箭头指示MZ。这些直方图图像已发表在AAA 43的博士学位论文中。(E)BCR诱导的杂合和纯合的Eµ-PKCβIItg小鼠脾脏B细胞中的Ca 2+流量。当以任意单位报告曲线下面积时,计算总通量。使用Mann– 对零件(A)(* P = 0.012),(B)(* P = 0.016),(C)(** P = 0.0052)和(E)(* P = 0.024)进行统计分析。惠特尼U检验。
Eµ-PKCβII转基因小鼠的腹膜含有升高的B-1细胞群
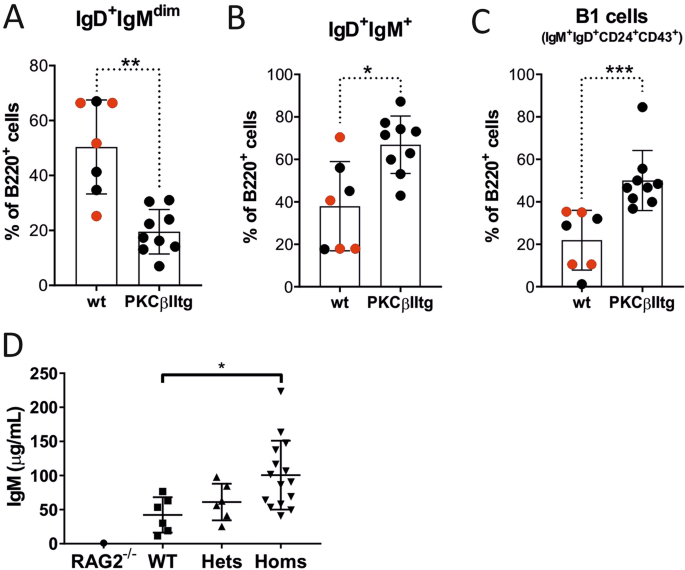
与wt小鼠相比,Eµ-PKCβIItg小鼠的腹膜B220 + B细胞的IgD + IgM 暗细胞百分比显着降低,并且IgD 暗 IgM +细胞百分比显着增加(图 3 A,B,补充图3)。进一步的分析显示,由CD24和CD43表达定义的IgD + IgM 暗细胞的种群在wt和Eµ-PKCβIItg小鼠之间非常相似(补充图3)。但是,对IgD 昏暗的 IgM +细胞进行的类似分析表明,CD24 +与wt小鼠相比,Eµ-PKCβIItg小鼠中的CD43 +细胞显着增加(图 3 C)。这些细胞具有B-1 B细胞表型(B220 + IgM + IgD dim / -CD43 + CD24 hi),并可能是B-1a细胞,因为它们中的大多数也对CD5呈阳性(补充图3)。综上所述,这些结果表明靶向于B细胞的PKCβII的过度表达导致E-1-PKCβIItg小鼠腹膜中的B-1a B细胞蓄积。
靶向B细胞的PKCβII表达对Eµ-PKCβIItg和wt小鼠腹膜中B细胞群体的影响。用针对B220,IgM,IgD,CD43,CD24和CD5的抗体对从Eµ-PKCβIItg和wt小鼠的腹腔冲洗物中制备的单细胞悬液进行染色,并通过流式细胞术进行分析。然后对以下门中的B220 +细胞百分比进行定量比较(A)IgD + IgM dim,(B)IgD dimIgM +和(C)IgD dim IgM + CD43 + CD24 +按补充图3中所示策略定义的wt和Eµ-PKCβIItg小鼠的(B-1细胞)。这些图中的黑点表示来自杂合的Eμ-PKCβIItg交配小鼠的wt和纯合的Eμ-PKCβIItg后代。红点是指具有相似遗传背景(C57BL / 6)的wt小鼠,它们的年龄与转基因小鼠的年龄相似。(D)比较来自Rag2缺陷型,wt型和杂合和纯合的Eμ-PKCβIItg小鼠的血清中IgM水平。对于零件(A)(A)(** P = 0.0040),(B)(* P = 0.042)和(C)(*** P = 0.0010)进行统计分析。d)分析是采用单向方差分析和Tukey的多重比较检验(P = 0.040)进行的。
Eµ-PKCβIItg小鼠的血清IgM水平升高
在脾和腹膜观察MZ的比例增加和B-1A细胞一致,Eμ-PKCβIItg小鼠相比重量的动物(图也显示出血清的IgM水平升高 3 d)。作为阴性对照,我们分析了来自一只Rag1 -/-小鼠的血清,以显示所用测定的检测背景。
Eµ-PKCβIItg小鼠的外周血含有大量未成熟B细胞
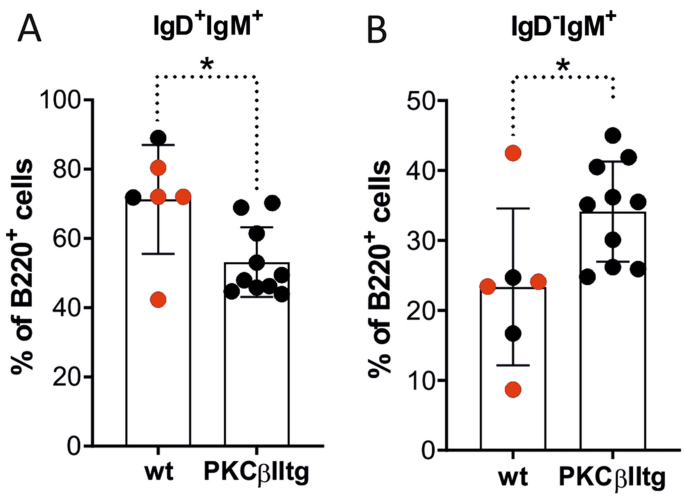
当分析外周血中的B220 + B细胞的IgD和IgM表达时(补充图4),与wt小鼠相比,在Eµ-PKCβIItg小鼠中IgD 昏暗的 IgM +/- B细胞的扩增明显,因为IgD的减少+ IgM +/- B细胞(图 4)。对来自Eµ-PKCβIItg和wt小鼠的IgD 昏暗 IgM +/- B细胞和IgD + IgM +/- B细胞上CD21表达的分析表明,前者是CD21 neg,而后者是CD21 +(补充图4))。由于CD21是B细胞成熟的标志物28,来自Eµ-PKCβIItg小鼠的IgD 昏暗 IgM +/- B细胞上CD21表达的缺乏表明这些细胞很可能是未成熟的B细胞。考虑到Eµ-PKCβIItg和wt小鼠之间外周血的WBC和B:B / T比率无显着差异(表1),这些结果表明PKCβII的B细胞定向表达导致其向BMC的扩展转移。外周血中B细胞未成熟。
靶向B细胞的PKCβII表达对Eµ-PKCβIItg和wt小鼠外周血B细胞群体的影响。用抗B220,IgM,IgD和CD21的抗体对由Eµ-PKCβIItg和野生型小鼠的外周血和骨髓制备的单细胞悬液进行染色,并通过流式细胞仪进行分析。然后定量比较以下门中的B220 +细胞百分率(A)IgD + IgM +/-和(B)IgD dim IgM +/- wt和Eµ-PKCβIItg小鼠,如补充说明中所述的策略所定义图4。这些图中的黑点表示来自杂合的Eμ-PKCβIItg交配小鼠的wt和纯合的Eμ-PKCβIItg后代。红点是指具有相似遗传背景(C57BL / 6)的wt小鼠,它们的年龄与转基因小鼠的年龄相似。使用Mann–Whitney U检验对零件(A)(* P = 0.030)和(B)(* P = 0.023)进行统计分析。
讨论区
在B淋巴组织增生性疾病的恶性细胞中经常观察到PKCβII的表达上调29,尤其是在CLL中,PKCβII的过表达是表型特征11。因此,我们旨在通过产生转基因小鼠品系来分析PKCβII过表达对B细胞区隔的影响,其中PKCβII的表达由Eµ启动子驱动。与我们最初的假设一致,B细胞定向的PKCβII过表达的结果是Eµ-PKCβIItg小鼠的脾脏,腹膜和外周血中FO,MZ样,B-1和未成熟B细胞群体的比例发生了比例变化。对Eµ-PKCβIItg小鼠的进一步检查显示,脾B细胞中BCR信号传导受到抑制,血清IgM水平升高。尽管B-1细胞室的膨胀是CLL的几个小鼠模型的特征15,16,17,18,19,我们没有在Eµ-PKCβIItg小鼠中观察到疾病,尽管这些动物衰老了15个月,但它们在B / T组合B / T细胞(总淋巴细胞)中所占的比例仍然与wt小鼠相似。我们得出结论,PKCβII在B细胞发育中起重要作用,过表达导致MZ样和B-1 B细胞发育偏向,但在Eµ-PKCβIItg小鼠的CLL样或其他B淋巴增生性疾病的发病机理中不起作用。
这项研究的局限性在于我们的发现基于对动物的分析数据,这些动物是从单个创建者那里获得的,该动物最少回交到了亲本品系中。因此,我们描述的表型可能是位置效应的结果,或者是与产生Eµ-PKCβIItg小鼠有关的未知因素。然而,在同窝和非同窝(即C57BL / 6背景)wt动物之间,我们分析的wt小鼠的脾脏,腹膜和外周血中B细胞表型的比较相似。这些发现表明,用于产生Eμ-PKCβIItg小鼠的菌株的遗传背景对我们的观察结果几乎没有影响。此外,我们观察到的现象与Eµ-PKCβIItg小鼠B细胞中PKCβII的高表达可能通过抑制Btk激活来限制BCR信号传导的机制一致。PKCβ在B细胞中的良好作用是S的磷酸化180残余物在的Btk导致下调其功能的4,5,30。我们自己的工作显示,在原代CLL细胞中过表达的限制BCRPKCβII在PS的存在信令180 11,31。我们在此描述的新型小鼠模型概括了这些发现,并表明来自Eµ-PKCβIItg小鼠的B细胞中的BCR信号传导受到抑制。相比之下,一项描述PKCβ基因敲除小鼠表型的研究表明,这些动物的B细胞中BCR介导的信号传导增强4,这一现象类似于在PKCβ抑制BCR信号传导研究32中观察到的现象。。这项相同的研究还显示,在PKCβ基因敲除小鼠中,MZ和B1 B细胞群体以及血清IgM水平显着降低4。总之,这些观察结果为我们的解释提供了支持,即在Eµ-PKCβIItg小鼠中,由于靶向PKCβII过表达而导致的BCR信号被抑制,导致总B细胞群中MZ样和B1 B细胞扩增,并增加了血清IgM水平。在我们的观察中可以发现进一步的补充支持,即在Eµ-PKCβIItg小鼠中脾脏B细胞的数量略有增加,而Leitges等人(2006年)则发现。4观察到在PKCβ基因敲除小鼠中这些种群的数量略有下降。综上所述,这些观察结果表明,我们观察到的表型最有可能是由于PKCβII的转基因过度表达,而不是混杂因素。
在当前的研究中,我们专注于PKCβII,尚未考虑其剪接变体PKCβI。由于我们尚未在系统中沉默编码PKCβ的基因的表达,因此我们不能排除PKCβI对我们产生的表型的贡献。将来将Eµ-PKCβIItg小鼠与PKCβ空小鼠杂交的研究将使我们能够更准确地确定PKCβII在B细胞中的作用。
有趣的是,尽管在Eµ-PKCβIItg小鼠的B细胞群体中观察到明显的谱系偏倚,但老年动物并未出现疾病终点。其可能的原因可能是仅PKCβII的过表达不足以驱动B淋巴疾病的发病机理。但是,Eµ-PKCβIItg小鼠可能更容易罹患这些疾病,因为已经证明,例如在结肠癌中,PKCβII的过表达通过增加结肠上皮细胞对致癌刺激的敏感性来促进疾病的发展33,34。事实上,这可能是因为这种疾病显示从B-1的细胞的淋巴细胞培养在小鼠和人类中CLL是特别相关的14,15,16,17。如果这个假设是正确的,则由于E-1-PKCβIItg小鼠与另一种CLL小鼠模型(例如Tcl-1模型)杂交,由于B-1细胞数量的增加,其疾病会加速发展。缺乏疾病发展的另一个原因可能是在我们的小鼠模型中获得的PKCβII的表达水平不足以促进肿瘤转化。我们以前在CLL中的工作表明,在这种疾病中,恶性细胞表达的这种PKC同工酶的量是正常B细胞的17倍。在当前的研究中,与wt小鼠相比,我们只能在Eµ-PKCβIItg中实现PKCβII大约两倍的增长。
我们提出,在Eµ-PKCβIItg小鼠中观察到的PKCβII蛋白质水平的适度增加会改变BCR信号传导,导致周边B细胞群亚群的偏斜表达,并伴随MZ样细胞,B-1 B细胞和未成熟B细胞的扩增。我们在这项研究中描述。B细胞中的PKCβII具有两个关键靶点:CARMA1(CARD11),其磷酸化的时候,用MALT1和Bcl10的结合,形成一个复合物募集TAK1刺激NFκB和JNK信号途径的活化和促进细胞存活35,36,37,和Btk的其中S 180磷酸化下调其功能如上所述5。因此,PKCβII的过表达将保留B细胞的存活,同时限制其对BCR参与的反应能力。这种局限性可能会影响B细胞的分化,而我们的观察结果可以由Cariappa等人提出的“信号强度”模型来解释。38,39,其中过渡B细胞中经由BCR与承诺递送到FO B细胞分化强或“触发”信号周边响应,而较弱的或“发痒” BCR信号导致对MZ分化和B-1 B细胞。BCR信号的缺失会导致由于忽视而导致细胞死亡。这可能是我们鉴定出的MZ样B细胞表型的解释。这些细胞与MZ前体B细胞具有相似性26,如证明Aiolos-和CD22缺陷小鼠,其的存在直接相关的BCR信号强度27,38,40。由于我们在Eµ-PKCβIItg小鼠中观察到的外周血中未成熟B细胞数量增加,PKRβII过表达导致BCR信号减弱也很可能是原因。消除自我反应性B细胞克隆发生在骨髓内的前B细胞阶段,并且可以通过受体编辑来实现,从而阻止B细胞发育,同时进行进一步的基因重排以减轻自我反应性41,或者通过BCR强信号诱导细胞凋亡42。由于这两个过程都是由Btk 8驱动的,Eµ-PKCβIItg小鼠的前B细胞内PKCβII的过表达可能会通过抑制Btk激活来限制强大的自身抗原驱动的BCR信号传导,从而导致未成熟B细胞数量增加。我们提出,在Eµ-PKCβIItg小鼠中适度增加的PKCβII水平会改变BCR信号传导,从而使B细胞亚群在外周偏斜。的MZ样细胞,B-1 B细胞和未成熟的B细胞的所有扩展群5,8,26,27,35,36,37,38,39,40,41,42。
总之,我们已经产生了在B谱系细胞中靶向性PKCβII过表达的转基因小鼠品系。Eµ-PKCβIItg。我们表明,与Eµ-PKCβIItg小鼠相关的表型使脾脏和外周血中的FO B细胞以及腹膜中的B-1 B细胞偏向MZ样和未成熟B细胞发展,从而提供了支持的体内数据我们的假设是,PKCβII的过度表达可能导致B1和MZ B细胞群体的扩大。考虑PKCβ基因敲除小鼠的表型3,我们推测Eµ-PKCβIItg小鼠中MZ样和B-1a细胞数量的增加将产生IgM抗体普遍存在的表型,的确如此。因此,我们证明了PKCβII在小鼠B细胞发育中起着重要作用。这种新型小鼠品系可能在涉及BCR信号,尤其是CLL的疾病研究中有用。
|
|