CRISPR / Cas9介导的VvMLO3诱变可增强葡萄对白粉病的抗性(Vitis vinifera)
CRISPR / Cas9介导的VvMLO3诱变可增强葡萄对白粉病的抗性(Vitis vinifera)
葡萄(Vitis vinifera)是世界上经济上最重要的水果作物之一,其白粉病是由Erysiphe necator引起的主要真菌病,白粉病使产量大大降低。除抑制宿主免疫力外,植物病原体还调节称为易感性(S)因子的宿主蛋白,以促进其在植物中的增殖。在这项研究中,使用CRISPR / Cas9(聚簇的规则间隔的短回文重复序列/ CRISPR相关的9)技术来实现MLO(防霉位点O)家族基因的定向诱变,该基因被认为是白粉病真菌的S因子。 。在两个葡萄MLO的一个或两个等位基因中诱导了小的缺失或插入白粉病易感品种汤普森无核的转基因植株中的基因VvMLO3和VvMLO4。使用不同的CRISPR / Cas9构建体实现的编辑效率从0到38.5%不等。在获得的20个VvMLO3 / 4编辑的品系中,一个品系为单个突变纯合,三个为双等位基因突变,七个为杂合突变,九个为嵌合体,这表明每个品系中存在两个以上的突变等位基因。在20个VvMLO3 / 4编辑的葡萄系中,有6个表现出正常的生长,而其余的系表现出衰老样的萎黄和坏死。重要的是,四个VvMLO3编辑的品系显示出增强的抗白粉病能力,这与宿主细胞死亡,细胞壁并置(CWA)和H 2 O 2积累有关。综上所述,我们的结果表明,CRISPR / Cas9基因组编辑技术可以成功地用于诱导目标基因的定向突变,从而改善具有经济重要性的性状,例如葡萄的抗病性。
介绍
葡萄是世界上种植最广泛且最具经济价值的园艺作物之一,仅葡萄酒出口市场就生产760万公顷,年产值约36亿美元(Organisation Internationale de la Vigne et du Vin,2017)。不幸的是,葡萄的生产受到多种疾病的限制,包括由真菌Erysiphe necator引起的白粉病。可以通过杀真菌剂在一定程度上控制白粉病,但这会增加生产成本,并对环境和人类健康产生负面影响。此外,滥用农药会增加碳排放量1。
减少疾病造成的损失的一种更具成本效益和环境友好的策略是通过传统育种和/或借助生物技术进行精确育种来开发抗病品种。赋予抗性的基因和遗传途径的鉴定和表征可以极大地促进后一种方法。功能基因组学的进步正在改变首选的实验策略,从使用传统的正向遗传学(即从表型转变为基因型)到同时采用正向遗传学和反向遗传学(即根据目标基因突变引起的表型推断基因功能)2。通过靶向基因组编辑引入功能突变是了解基因功能的强大反向遗传学方法。CRISPR-Cas9技术是一种相对简单而有效的技术,可用于基因突变,基因表达的抑制/激活,基因功能的细微修饰和表观基因组编辑3。在2013年,三个研究小组同时报道了在靶向基因组修饰使用CRISPR-Cas9系统的拟南芥(拟南芥),烟草,水稻和小麦的第一次4,5,6。该系统也已成功应用于玉米7,棉花8,以及其他植物。葡萄是多年生木本植物,具有高度杂合的基因组,只能通过冗长而困难的过程才能进行遗传转化。迄今为止,已经有仅在使用CRISPR-Cas9的在葡萄基因组编辑少数报告5,9,10,11。
在过去的25年中,对植物免疫系统进行了广泛的研究,而基础发现已使人们对植物抗病性的分子基础有了更好的了解。虽然抗病作物品种的开发通常依赖于通过经典育种将优势抗性(R)基因引入优良品种,但宿主易感性(S)基因的隐性突变也已被用于赋予抗性。R基因诱导的防御反应通常会导致局部细胞死亡或超敏反应(HR)12;相比之下,S的损失-成功入侵特定病原体所需的基因可能不会显示出强大的防御激活作用。例如,的破坏小号 -genes如PMR5 13,DMR6 14,15,LOB1 16,和SWEET14 17,18可以以几种经济上重要的植物物种赋予与没有或最小激活防御广谱抗病性。S基因介导的抗药性通常比基于R基因的抗药性更持久,因为病原体必须克服对宿主S因子15的依赖性。MLO的破坏大麦中的基因赋予持久的白粉病抗性,这一事实证明,几十年来在该领域未发现能够克服mlo介导的抗性的白粉病菌株19。
研究表明,适应白粉病物种的致病性依赖于一个功能主机上的MLO基因20,21。MLO蛋白质构成高度保守的22种植物特异性七膜结构域蛋白家族,其结构类似于具有钙调蛋白结合结构域23的 G蛋白偶联受体(GPCR)。MLO蛋白作为白粉病敏感性因子的机制尚不清楚,并且宿主中MLO蛋白的生化功能在很大程度上尚待探索24。在大麦中,发现了一个mlo突变赋予了对Blumeria graminis大麦白粉病菌株的广谱和持久抗性F。sp。hordei 25,但是宿主发生了一系列受发育控制的多效性作用,例如在没有任何病原体的情况下形成了含ose的细胞壁并列(乳头状)和叶片衰老的过早发作。这些影响降低了mlo突变体的籽粒产量。因此,功能失调的MLO蛋白确实可能在自然种群中导致竞争劣势26。在面包小麦中,TALEN诱导的所有三个TaMLO同源物中的突变赋予了对白粉病的可遗传的广谱抗性27。在苹果中,抑制MdMLO11和MdMLO19通过RNA干扰(RNAi)可降低对白粉病(Podosphaera leucotricha)的敏感性28。在拟南芥中,Atmlo2 Atmlo6 Atmlo12(Atmlo2 / 6 / 12)三重突变体是白粉病完全抗性21。葡萄基因VvMLO3,VvMLO4和VvMLO17分别与AtMLO2,AtMLO6和AtMLO12基因直系同源29据报道,在感染白粉病后,它们具有快速诱导作用,表明这些VvMLO蛋白可能在调节葡萄中的抗真菌防御反应中起作用。先前的一项研究使用RNAi抑制特定的VvMLO基因,发现同时敲低葡萄中VvMLO6和VvMLO7可以降低对白粉病的敏感性30。
葡萄品种Thompson Seedless是研究葡萄中白粉病抗性的理想材料,因为它易于转化并易于感染白粉病。汤普森无核中有17个VvMLO。在这项研究中,我们使用CRISPR / Cas9技术靶向两个葡萄MLO基因VvMLO3和VvMLO4,并获得了由VvMLO3编辑的葡萄系,对白粉病的抵抗力增强。我们的工作表明,针对CRISPR / Cas9的诱变是产生抗病葡萄的有价值的工具。
结果
MLO和向量构造内的目标选择
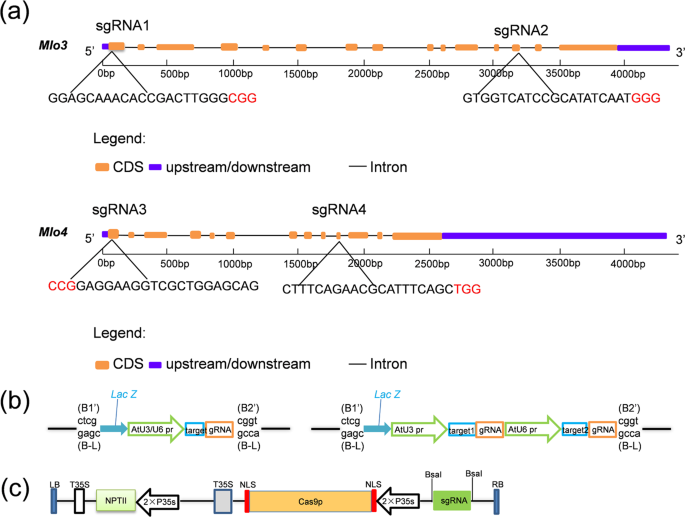
对于每个VvMLO基因,选择了两个靶基因座(图1a)。用于农杆菌介导的葡萄胚发生性愈伤组织转化的两个小向导(sg)RNA的靶位点及其基因表达盒的示意图如图1a,b所示。sgRNA中间载体基于先前描述的pUC18骨架31。用于植物转化的二元载体包含植物密码子优化的Cas9基因。总共有四个DNA构建体,命名为CM3G1(C as9 / sgRNA 1 - M LO3 - G rapevine),CM3G2和CM4G3(C产生了as9 / sgRNA 3 - M LO4 - G rapevine)和CM4G4,并将其用于转化(图1b,c)。
再生转基因葡萄中的定向诱变
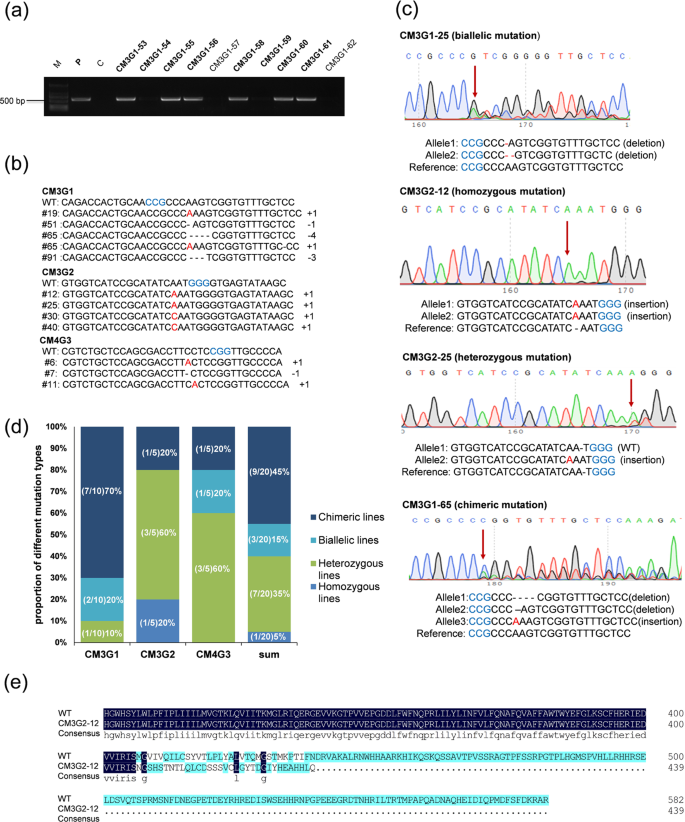
通过与农杆菌细胞共温育的葡萄花药丝诱导的胚性愈伤组织总共再生了210株小植株(图2)。为了验证CRISPR-Cas9序列的存在,通过PCR分析了每个再生小植株的基因组DNA。如图3a所示,从Cas9阳性小植株扩增了〜508bp的片段,而Cas9阴性和非转基因的对照小植株未显示扩增。对于两个VvMLO的四个目标中的任何一个,共鉴定出125株Cas9阳性基因,然后进一步分析这些小植株是否存在预期的序列变异。通过Sanger测序分析了总共68个VvMLO3 - sgRNA1,独立的PCR阳性小植株,39个VvMLO3- sgRNA2、13个VvMLO4- sgRNA3和5个VvMLO4- sgRNA4(表1)。sgRNA1,sgRNA2或sgRNA3的相应DNA靶位点包含突变(表1),表明四个CRISPR / Cas9-DNA构建体中的三个(即CM3G1,CM3G2,CM4G3)能够在再生的葡萄植株中成功进行基因编辑。不同的目标位点以不同的编辑效率变异,范围从0到38.5%(表1))。在这些编辑品系中鉴定出各种长度的单核苷酸插入和核苷酸缺失(图3b)。sgRNA1系中检测到的突变主要是小缺失和插入,而sgRNA2系中的突变主要是小插入,而sgRNA3系的突变主要是小插入(图3b和表S1)。sgRNA1和sgRNA2品系中的大多数插入片段仅由1 bp组成,大部分缺失很短。双链断裂(DSB)通常发生在PAM序列32上游三个碱基对的位置。在20条VvMLO编辑的品系中,有16个品系显示的突变位点恰好位于PAM位点的第4个碱基处(图S1)。和表S1)。
一个从使用基因特异性引物再生植株的基因组DNA的507-bp的DNA片段的PCR扩增。M:标记物,P:质粒,C:对照,CM3G1-53至CM3G1-62:表达VvMLO3 -sgRNA1的不同再生系。b右边的数字表示突变的类型和涉及的核苷酸数,“-”和“ +”分别表示缺失和插入。插入物以红色字母突出显示,并且与原始间隔物相邻的主题(PAM)用蓝色字母指示。C四种不同类型的突变测序色谱图:双等位基因突变,纯合子突变,杂合子突变和嵌合突变。第一个替换或插入缺失位点用红色箭头指示。原间隔物基序(PAM)序列以蓝色突出显示,插入缺失或取代碱基以红色突出显示,'-'表示缺失。d在编辑的行中找到不同突变类型的频率。e一个代表性突变体与VvMLO3靶区域的野生型之间的氨基酸序列比对。
图3c显示了四种不同类型的突变序列色谱图。在获得并分析的125株转基因植株中检测到了这20条编辑品系(表1);因此,整体基因编辑效率为16.5%。有趣的是,在包含CM4G4构建体的五个转基因品系中,未检测到任何编辑品系。在20个编辑品系中,一个(5%)为1 bp插入纯合子,三个(15%)为双等位基因用于小缺失和插入(Indels),七个(35%)为杂合子(即仅包含一个等位基因)一个突变),并且有9个(45%)是嵌合的(即,在一条线中检测到两个以上的突变等位基因)(图3d)。在图3e中提供了有关在一个编辑行CM3G2-12中找到的突变的详细信息;该株系中VvMLO3的两个等位基因在目标位点均包含一个单核苷酸(A)插入,导致形成了一个过早的终止密码子,这反过来又会产生具有C端截短的VvMLO3突变体。
基因组编辑品系的表型表征
在这项研究中,农杆菌感染后获得的绝大多数(93%)再生体显示出异常的生长和发育(未显示)。当在缺氧条件下生长时,在20个3个月大的VvMLO3-或VvMLO4编辑的小植株中,有14个(例如CM3G1-65和CM3G2-25;图4a)显示出相似的表型,其特征在于衰老样萎黄和坏死。在这14株小植株中,插入1 bp的纯合子CM3G2-12在两个月大时死于培养基中。但是,未经编辑的植物在同一时期显示出正常的生长发育。
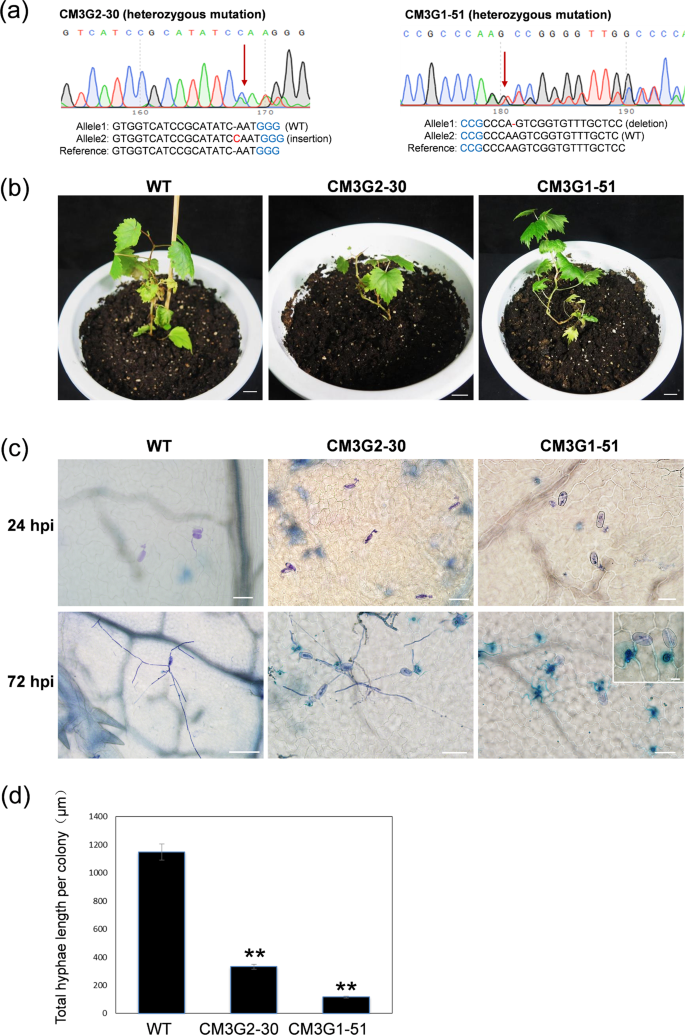
我们发现,当将VvMLO编辑的小植株继代培养以诱导增殖时,即使在浓度高达1.0 mg·L -1的IBA存在下,它们的生根潜力也非常低。只有少数几行(即CM3G2-30和CM3G1-51)显示出正常的生根(图4b)。与非转基因对照相比,VvMLO编辑的幼苗生长较差,并且幼苗下部显示出加速的脱叶。
白粉病触发的叶肉细胞死亡,细胞壁并置和H 2 O 2的产生与mlo介导的抗性有关
为了评估两个VvMLO基因中靶向突变对白粉病抗性的影响,将两个VvMLO3编辑品系CM3G2-30和CM3G1-51(测序色谱图见图5a),并将一种非转基因对照植物移植到将盆栽(图5b)和这些植物的离体叶片接种白粉病分离株En。移植后第 15天的NAFU1 33。叶接种了En。在24和72hpi收集NAFU1,并用锥虫蓝染色以通过显微镜观察真菌结构。在24 hpi时,两个VvMLO3编辑和非转基因品系产生的压感没有明显差异。但是,在72 hpi时,与对照相比,编辑后的线显示出的真菌生长要少得多(图5c),在CM3G2-30上仅观察到每个菌落的菌丝总长度的约1/4,而在CM3G2-30上观察到的菌丝的长度只有〜1/10 CM3G1-51与对照组相比(P <0.01)(图5d)。另外,与非转基因对照(未显示)相比,在两个VvMLO3编辑的品系上有较少的次级菌丝,表明两个编辑的品系均显示出对白粉病的增强的抗性。不幸的是,所有五个VvMLO4编辑的行产生变形的叶子并死亡。因此,仍有待确定VvMLO4是否在白粉病发病机理中起作用。将盆栽的VvMLO3编辑的植物转移到温室中进一步生长和评估(图6a)。在具有VvMLO3杂合突变的编辑品系中,观察到明显的白粉病诱导的细胞死亡(图6b)。仔细检查锥虫蓝染的叶切片后发现,在许多情况下,被感染的表皮细胞下面的叶肉细胞被染成蓝色(图6c),这表明来自发霉的表皮细胞的信号触发了邻近的叶肉细胞的崩溃。突变的结果这些杂合系中的VvMLO3。
突变线CM3G2-30和CM3G1-51 的序列色谱图。第一个替换或插入缺失位点用红色箭头指示。原间隔子基序(PAM)序列以蓝色突出显示,插入缺失或取代碱基以红色突出显示。“-”表示删除。b从亚培养基移植后15天,比较野生型(WT)和不同类型的VvMLO3编辑的品系。c代表性显微照片显示在野生型和VvMLO3编辑的系中,在24和72 hpi时白粉病的生长。条形图= 100μm,除了插图中的(20μm)以外。d VvMLO3叶片上每个白粉病菌落的总菌丝长度编辑的品系和野生型在72 hpi 接种En NAFU1。数据是根据三个重复实验计算得出的平均值±SE。星号表示所编辑的行与汤普森无核WT对照之间的显着差异(P <0.01;n = 3,Student's t检验)。
在以前的报告中,在mlo突变植物21试图穿透的部位下方观察到细胞壁并置(CWA)或乳头形成的增加。在将白粉病接种到VvMLO3编辑的系的离体叶片上后,我们使用苯胺蓝染色来检查CWA中是否存在call质。在7 dpi时,在杂合突变体CM3G2-40中观察到了清晰的CWA,但在非转基因对照植物中未观察到(图6d)。另外,H 2 O 23,3'-二氨基联苯胺(DAB)染色后显示为褐色沉淀的产物的产生和积累在7 dpi的杂合突变株CM3G1-91和CM3G2-40的霉菌感染的细胞中更为明显(图6b和图S3a) 。使用ZEN 2012软件对H 2 O 2积累进行定量显示,两种VvMLO编辑的植物中约22%和〜42%的被感染叶片表皮细胞表现出H 2 O 2积累,是后者的三到六倍。 (6.5%)感染了野生型植物的叶片表皮细胞(图S2a,b)。综上所述,我们的数据表明Vvmlo3-介导的对白粉病的抗性与白粉病感染的表皮细胞中的愈伤组织沉积和H 2 O 2积累有关,并且可能与下面的叶肉细胞死亡有关。
为了评估VvMLO3基因突变对全株抗白粉病的影响,进行了两个独立的实验。盆栽转基因或非转基因对照植物白粉病的新鲜分生孢子接种恩。NAFU1。该菌株能够感染WT对照和杂合突变株CM3G1-91和CM3G2-40(图7a)。但是,注意到编辑线的叶子而不是对照线的叶子在15 dpi时被丰富的白茸真菌覆盖,这似乎与编辑线中被感染的叶子组织中坏死性病变的存在有关。线但在15 dpi时不在控制线中(图7b)。在20 dpi下,对每毫克新鲜感染叶组织的孢子数量进行定量分析表明,与WT品系相比,编辑品系CM3G1-91的真菌孢子形成减少了约2倍,尽管很小,但是仍然在另一个编辑行CM3G2-40中检测到统计学上显着的降低(图7c)。
讨论区
自从在2016年的CRISPR / Cas9技术的应用葡萄基因编辑的第一份报告34,两个最近的研究已经探索了利用原生质体小道消息使用这种新的基因组编辑技术的11或胚性愈伤组织细胞9。使用CRISPR / Cas9系统在葡萄中成功进行定向诱变的另外两个例子是WRKY52基因10和VvCCD8基因35的功能表征研究的结果。在这项研究中,两个葡萄MLO基因VvMLO3和VvMLO4,通过使用CRISPR / Cas9技术进行编辑,并且通过突变一个等位基因来降低VvMLO3表达,显着提高了易感葡萄品种对白粉病分离株En的抗性。NAFU1。
Charrier等。使用CRISPR-Cas9系统在苹果和梨中进行了定向诱变,他们将获得的突变体分为纯合,杂合,双等位基因和嵌合体36。根据它们的分类,在“纯合”系中,靶基因的两个等位基因都包含相同的突变;在“杂合”系中,仅一个等位基因被突变;在“双等位基因”系中,两个等位基因都发生了突变,但突变并不完全相同。最后,在“嵌合”系中,检测到两个以上的等位基因,这表明在体细胞胚发生过程中存在来自不同编辑细胞的细胞谱系。在这项研究中,检测到上述所有四种葡萄突变体,“嵌合”型占获得的突变体的45%,这表明CRISPR / Cas9在胚胎发生的早期由单个转化的体细胞引发的具有酶促活性。
作为多年生木本水果,葡萄树对基因转化具有顽强的抵抗力。为了增加成功的机会,我们为两个MLO靶基因中的每一个设计了两个sgRNA ,一个靶向于起始密码子附近的一个位点,另一个针对每个基因的编码序列中间的一个位点(图9)。1a)。发现该策略对VvMLO3有效,因为在两个靶位点鉴定出突变。对于VvMLO4,sgRNA3(CM4G3)达到了约23%的编辑效率,但sgRNA4(CM4G4)无法产生单个突变株(表1))。后一种情况可能仅仅是由于产生的转基因品系数量不足(八个)或由于存在不常见的局部染色质结构,而CRISPR-Cas9 37难以获得这种结构。CRISPR / Cas9在植物中诱导的DNA突变主要由短插入缺失和通过非同源末端连接(NHEJ)38在DSB修复过程中发生的替换组成。预计在NHEJ介导的DNA修复过程中会发生这种多样的突变。在这项研究中也观察到了这种突变模式,因为在VvMLO3中诱导的大多数突变都是插入缺失。在获得的20个编辑品系中,只有一个是纯1 bp插入的纯合子,而所有其他品系显示了不同类型突变的组合(图3c))。
MLO同系物已经经受定向诱变在许多植物抗白粉病的工程20,21,27,39,40。的损失AtMLO2,但不AtMLO6或AtMLO12,在拟南芥增强了突变植物白粉病的抵抗力,而所有三个基因的结果完全阻力损失21。这些发现表明,尽管AtMLO2是白粉病感染所需的主要宿主S蛋白,但AtMLO6和AtMLO12具有与AtMLO2重叠的功能。在这项研究中,VvMLO3和VvMLO4,从对应于进化枝AtMLO2,6,和12中的进化系统树29(图S3),被选择用于CRISPR / Cas9介导的诱变。不幸的是,仅敲除VvMLO3的Vvmlo3纯合突变体小苗死于组织培养基中的大量叶片坏死(数据未显示)。这意味着,由于T-DNA插入导致VvMLO3丢失或基因突变,可能已触发了该Vvmlo3突变体中的致死细胞死亡。尽管如此,尽管有多个VvMLO3编辑的品系是杂合品系,qRT-PCR显示,与WT品系相比,CM3G1-91和CM3G2-40品系中VvMLO3表达水平降低了约4-8倍(图S4),这表明VvMLO3表达水平确实受到这种编辑的负面影响。与2到7 dpi的WT植物相比,在多个VvMLO3杂合品系中观察到了显着增强的抗霉性(图5和6),这表明VvMLO3是葡萄AtMLO2的功能同源物之一。综上所述,我们的结果表明VvMLO3是白粉病感染所需的重要(尽管不是唯一)宿主易感基因。应该注意的是,在同一时间发表的Feechan 29和Winterhagen 41的两项先前研究中,葡萄MLO基因的命名法有所不同。在本研究中,根据Feechan命名法29命名VvMLO3和VvMLO4,而根据Winterhagen 41,这些基因分别命名为VvMLO11(W)和VvMLO13(W)(为清楚起见,当我们使用Winterhagen描述MLO基因时,命名,我们使用VvMLO6(W)和VvMLO7(W))(图S3)。显示以前的研究VvMLO6(W)和VvMLO7(W),而不是VvMLO11(W)或VvMLO13(W)(即,VvMLO3和VvMLO4根据Feechan命名法),可以负调节抗病性29,42,和消音的VvMLO6(W)和VvMLO7(W)基因导致对白粉病的抵抗力增强30。因此,很可能VvMLO6 / 7(W)也可以是功能同系物AtMLO2。同时靶向诱变所有三个葡萄因此,将来可能需要MLO基因来发展葡萄的完全抗霉性。
除了抗白粉病,MLO突变植物显示过早叶萎黄和大麦降低的产量19,叶片在无病原体的植物和更慢的生长和发育的细胞壁增加的胼胝质沉积拟南芥21,43,44,减少胡椒中的植物大小45。毫不奇怪,在我们的VvMLO3杂合突变葡萄树幼苗中观察到类似的生长表型,例如早期叶片衰老(图4a)。有趣的是,在VvMLO3杂合突变株中观察到了霉菌诱导的叶肉细胞死亡(图6)。),以及H 2 O 2积累和accumulation质在受霉菌感染的表皮细胞中的沉积,似乎与这些突变株对白粉病的抗性增强有关(图6)。在这方面,值得指出的是,当RNAi 30敲低VvMLO6、7、11或13(W)时,未观察到明显的多效性表型。这意味着VvMLO6、7和13(W)在功能上可能与VvMLO3不同,并且/或者这四个基因在功能上是多余的或未充分沉默。
结论
启用CRISPR / Cas9的定向诱变表明VvMLO3是葡萄白粉病感染所需的S基因,葡萄品种中VvMLO3的定向突变导致对白粉病的抗性增强。这证明了以CRISPR / Cas9为靶点的诱变可用于开发抗病品种,并促进葡萄中目标基因的功能表征。
材料和方法
植物原料
V. vinifera cv。Thompson Seedless被用于基因克隆和转化,并作为白粉病感染的基因功能分析和表型观察的对照。植物是在中国陕西省杨凌市的西北农林科技大学的植物加速器中生长的。在14 h / 10 h(昼/夜)光周期下,温度控制在22至26°C之间。汤普森无核的花药细丝诱导了胚性愈伤组织。汤普森无核发育中子叶发育中期的胚发生质量(PEMs)和体细胞胚用于转化。在补充了60 g·L -1蔗糖,3 g·L -1 Phytagel和1 g·L -1的 MS基础培养基上维持PEM培养物活性炭,pH值为5.8–6.0。PEM培养物通过将切碎的鱼雷形阶段或中间子叶阶段的胚胎KBN介质上(MS,蔗糖,1g的·L reinduced -1肌醇,0.3克·L -1 KNO 3,1.126毫克·L -1 6-BA,0.552 mg·L -1 2,4-D和0.505 mg·L -1 NOA)。通常在3-7个月内观察到PEM的二次再生。所有培养物均在25°C的黑暗环境中保存,每月转移到新鲜培养基中46。
葡萄MLO基因的克隆
根据制造商的说明,使用EZNA植物RNA试剂盒(欧米茄,广州,中国)从汤普森无核叶中提取总RNA。使用PrimeScript RTase(Takara Bio Inc.,大连,中国)从1.5μg总RNA中产生第一链cDNA。将合成的cDNA产物稀释10倍,用作克隆MLO基因的模板。二VvMLO基因,VvMLO3和VvMLO4,在先前的研究中发现29使用源自寡核苷酸引物选择性扩增VvMLO在国家生物技术信息中心(NCBI)数据库(可用基因序列//blast.ncbi.nlm.nih:HTTPS。 gov / Blast.cgi)。PrimeSTAR HS DNA聚合酶用于扩增。将PCR产物克隆到pMD18-T载体(Takara Bio Inc.,中国大连)中,并在北京AuGCT生物技术公司杨凌测序部进行测序。将测序的DNA与葡萄(Vitis vinifera) PN40024 的基因组比对。
CRISPR-Cas9二进制构建体设计
在两个VvMLO外显子中选择靶序列,并在两个编码区内设计了四个sgRNA,分别命名为sgRNA1至sgRNA4(表S3)。为了提高每个基因的编辑成功率,我们在每个MLO基因中选择了两个目标基因座,以寻找具有中等GC含量的基因座。我们使用在线软件Grape-CRISPR(http://biodb.sdau.edu.cn/gc/)和CRISPR-P(http://crispr.hzau.edu)筛选了靶序列,以最大程度地减少脱靶的潜在比对。 cn / CRISPR2 /)47。对于每个基因,我们将一个靶位点定位在起始密码子附近,并将另一个靶位点定位在与功能域相对应的区域中。接下来,我们根据国家生物技术信息中心(NCBI)数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对靶序列(包括PAM)进行了BLAST-P搜索葡萄基因组序列,以确保目标序列尽可能特异。我们避免了包含四个以上连续T的序列,以防止RNA Pol III将此类位点用作转录终止信号。(选择的靶序列在图1a中显示。)使用Ao ke ding sheng(http://www.augct.com/?ClassID=2)为每个靶基因座合成靶衔接子寡核苷酸)在杨凌部门(表S2)。
使用二元pYLCRIPSR / Cas9-N 48载体和两个由AtU3b和AtU6-1启动子驱动的sgRNA盒来生成表达CRISPR / Cas9- MLO的载体。对于每个sgRNA,由北京AuGCT生物技术公司合成了一对DNA寡核苷酸并退火以生成二聚体,随后将其整合到质粒载体中sgRNA支架的上游。进行了两轮连续的重叠PCR,以在双Bsa I限制酶位点之间插入双链gRNA间隔区DNA序列,以生成具有一个或两个靶位点的中间载体。通过重叠PCR产生具有靶序列的中间sgRNA表达盒(图S5和S6)。我们使用了一个包含CRISPR / Cas9的二元载体pYLCRISPR / Cas9P35S-N,其中包含CaMV 35S启动子和NPTII基因作为选择标记。Cas9载体构建在pCAMBIA1300的骨架中。将最终纯化的PCR产物通过金门连接49组装成包含NPT II基因和2×35 s启动子的二元pYLCRIPSR / Cas9载体。具有一个或两个sgRNA表达盒的连接产物直接用于转化DH5α 大肠杆菌感受态细胞。
农杆菌介导的葡萄转化
经由农杆菌介导的转化系统进行转化,如先前所描述的50,进行了微小的修改。使用根癌农杆菌菌株GV 3101进行转化。为了避免失败,分批进行了转换。将细菌溶液(OD600,0.6–0.8)倒入无菌烧瓶中,将葡萄组织在烧瓶中轻轻摇晃浸泡15–20分钟。然后将组织放在两层无菌滤纸上,以去除多余的细菌培养物,并转移至2 ml液体MS培养基(含20 mg·L -1AS和3%蔗糖)共培养。在黑暗中于25°C进行2天共培养后,将物料在没有任何抗生素的情况下进一步保存1个月,然后进行筛选以使转化的物料得以恢复。然后,将组织在无菌水洗涤三次,并转移到KBN延迟筛选培养基(30克·L -1蔗糖,MS,0.3克·L -1 KNO 3,1.126毫克·L -1 6-BA,1g的·L -1肌醇,0.505 mg·L -1 NOA,Phytagel,200 mg·L -1 Cef)3周,然后在X3延迟筛选培养基(30 g·L -1蔗糖)中孵育1周,MS,1 g·L -1活性炭,Phytagel,200 mg·L-1 Cef)。延迟筛选后,将转化的PEM培养物转移至含有Cef和Kan的抗性筛选培养基(30 g·L -1蔗糖,MS,1 g·L -1活性炭,Phytagel,200 mg·L -1 Cef,75 mg·L -1 Kan)。继续筛选直至萌发的胚发育。然后将抗发芽的胚转移至发芽培养基(15 g·L -1蔗糖,MS,Phytagel)中,置于光照下进行进一步发育。出现真叶后,将培养的幼苗转移至30 mL生根培养基(30 g·L -1蔗糖,MS,1 g·L -1活性炭,Phytagel,1 mg·L -1IBA)进行进一步开发。将生根的小植株移植到装有盆栽混合物(珍珠岩,ver石和泥煤)的盆(直径:14 cm,高度:10 cm)中,并用透明塑料杯覆盖,然后放入光子发生器中。
基因分型和突变体验证
转基因品系的基因分型基本上如先前所述31进行。使用基于CTAB的方法51从0.5至1.0 g的再生苗组织中分离出每个品系的基因组DNA 。为了验证工程序列的存在,使用了特定的寡核苷酸引物(SP-L-35S和SP-R)来扩增CRISPR / Cas9序列(表S2)。使用内部特异性引物直接对PCR产物(约400–600 bp)进行测序,其理想的结合位置是靶位点上游〜150–250 bp(北京AuGCT生物技术杨凌测序部门)。靶基因编辑的检测需要对源自同一基因组DNA样品的PCR扩增子的多个克隆进行测序。将PCR扩增子克隆到pMD18-T质粒载体中,并使用5至10个随机选择的大肠杆菌菌落进行质粒制备和插入测序。SnapGene Viewer软件用于突变分析。序列结果示于表S1中。
病原菌接种和白粉病抗性评估
评估了四个MLO编辑的品系CM3G1-51和-91以及CM3G2-30和-40对白粉病的抗性。如前所述,用白粉病分离株En NAFU1 接种转基因突变和非转基因对照品系33。对于分离的叶片接种,在从传代培养基移植后的第15天使用CM3G2-30,CM3G1-51和野生型(WT)植物。选择从芽尖起第三位置的完全展开的叶子进行接种。分别在24和72 hpi观察到代表性的显微照片和菌丝发育。对于植物叶接种,将CM3G2-40,CM3G1-91和野生型(WT)植物在光电子加速器条件下生长6个月,以便繁殖,然后进行接种。以5或7 dpi观察到WT,CM3G2-40和CM3G1-91植物的DAB和台盼蓝染色的表皮细胞。评估VvMLO3的影响对白粉病全株抗性基因突变,转基因株系CM3G2-40和CM3G1-91或者非转基因对照植物已在花盆中生长六个月的植株用新鲜分生孢子接种恩。NAFU1白粉病,在15 dpi下通过台盼蓝染色在CM3G2-40或CM3G1-91植物的叶片中进行细胞死亡检测。评估每个CM3G2-40和CM3G1-91系的三个个体。在可见光下使用Olympus BX51显微镜对接种后的白粉病感染症状进行评估。如前所述进行DAB染色,台盼蓝染色和苯胺蓝染色,以检测H 2 O 2的积累,真菌结构,细胞死亡和CWA 52。
统计分析
使用ZEN 2012和SigmaPlot 10.0软件分析疾病严重程度数据。使用配对的学生t检验(http://www.physics.csbsju.edu/stats/)分析所有数据。基于至少三个重复的结果计算平均值±平均值的标准偏差(SD),与对照相比的显着差异由* p <0.05和** p <0.01表示。
|
|