结合到EF-G1的人线粒体核糖体的结构揭示了线粒体翻译延伸的独特特征
结合到EF-G1的人线粒体核糖体的结构揭示了线粒体翻译延伸的独特特征
哺乳动物的线粒体核糖体(线粒体)及其相关的翻译因子已经进化为适应蛋白质更多地参与线粒体翻译的过程。在这里,我们介绍了人类55S线粒体的2.68–3.96Å冷冻EM结构与人类线粒体延伸因子G1(EF-G1 mt)的复合状态,包括三种不同的构象状态,包括中间状态和易位状态。这些结构揭示了线粒体tRNA(tRNA mt)易位的几种线粒体特异性(mito特异性)线粒体蛋白(MRPs)和EF-G1 mt的线粒体特异性节段。特别是EF-G1 mt中特定于Mito的C末端延伸直接与A位点tRNA mt的受体臂易位有关。除了小的线粒体亚基表现出棘轮状和独立的头部旋转动作,我们还发现了大型线粒体亚基内新生多肽出口部位MRP mL45的显着构象变化,这可能是延长延伸的线粒体的关键到线粒体内膜上
介绍
线粒体被认为起源于α-原细菌和原始真核宿主细胞1之间的早期共生共生事件。然而,线粒体核蛋白体(mitoribosome)的结构,功能和组成的组织是从其胞质和细菌同行显着不同的2,3,4,5,6,7。与真核生物中的核糖体(〜2:1)相比,哺乳动物的线粒体中的核糖体RNA(rRNA)与核糖体蛋白的比例是相反的(〜1:2)。哺乳动物线粒体的首次冷冻-EM研究确定了几个独特的结构特征5在其两个亚基中:大的39S亚基(LSU)和较小的28S亚基(SSU)。随后高分辨率结构2,4,8,9提供的先前确定的特征分子描述5,如重屏蔽rRNA的芯由mitoribosomal蛋白(读护照),mRNA的信道和新生多肽射出的显著改性入口的存在隧道(NPET)和P站点手指。此外,高分辨率结构揭示了线粒体的tRNA(tRNA的一个公吨),用于细菌5S rRNA基因,成为哺乳动物mitoribosomal LSU的结构部件的作用部分地替代品2,4。
类似于细菌翻译,哺乳动物线粒体翻译的机制大致分为四个阶段:起始,延伸,终止,和核糖体回收10,11。这些步骤中的每一个是由同源其细菌同行但携带线粒体特异性(线粒体特异性)段的平移因子促进10,11。生化12,13,14,15和结构8,9,16,17研究表明,翻译因子中的线粒体特异性片段在线粒体翻译中起着重要的作用。因此,在每个线粒体翻译步骤中,线粒体及其结合的翻译因子均具有独特的结构特征,这表明了独特的分子相互作用和机制。真核生物中的延伸因子-G(EF-G)和真核细胞质中的同源EF-2促进了核糖体上tRNA和mRNA易位的关键步骤。在哺乳动物线粒体,有EF-G的两种同种型MT:EF-G1 MT和EF-G2 MT 18,19。EF-G1 mt催化线粒体上的tRNA mt易位,而EF-G2 mt专门参与线粒体回收19。在人类EF-G1的突变MT导致致命的肝性脑病,表明该亚型对人类线粒体蛋白质的生物合成必需的20,21。此外,在线粒体蛋白质合成缺陷与许多人类疾病直接涉及在机读护照突变酶和tRNA相关MT 22,23,24。
细菌EF-G由五个结构域,即G(或域I)和结构域II - V 25,26。对细菌核糖体EF-G-催化易位的结构和功能方面进行了广泛研究以各种功能状态,同时使用冷冻电镜27,28,29,30,31,32,33和X射线晶体34,35,36,37,38。像其他行李箱一样,哺乳动物的EF-G1 mt(分子量约80 kDa)是一种单一多肽,与其细菌同源物39相比,在其两个末端均具有线粒体特异性延伸,并具有47个氨基酸(aa),包括信号序列。人EF-G1 mt长751 aa,其中N端的前36个残基构成线粒体靶向信号39,该信号以功能形式被切割。功能性人类EF-G1 mt与细菌对应序列具有约45%的序列同一性,主要区别是在其C末端存在11个氨基酸的mito特异性延伸。我们已经确定了人类EF-G1 mt复合体中人类55S 线粒体的近原子分辨率冷冻EM结构。研究EF-G1 mt的线粒体特异性MRP和C末端延伸在哺乳动物线粒体tRNA mt转运中的作用。我们的研究揭示了几个独特的特征,包括在人类丝裂体上EF-G1 mt介导的tRNA mt易位期间的线粒体特异性分子相互作用。此外,我们确定与在线粒体中NPET出口处的翻译伸长相关的构象变化,这对于促进新生多肽链通过NPET的释放以及将线粒体锚定在内部线粒体膜上可能是必需的。
结果和讨论
55S·EF-G1 mt复合体的整体结构
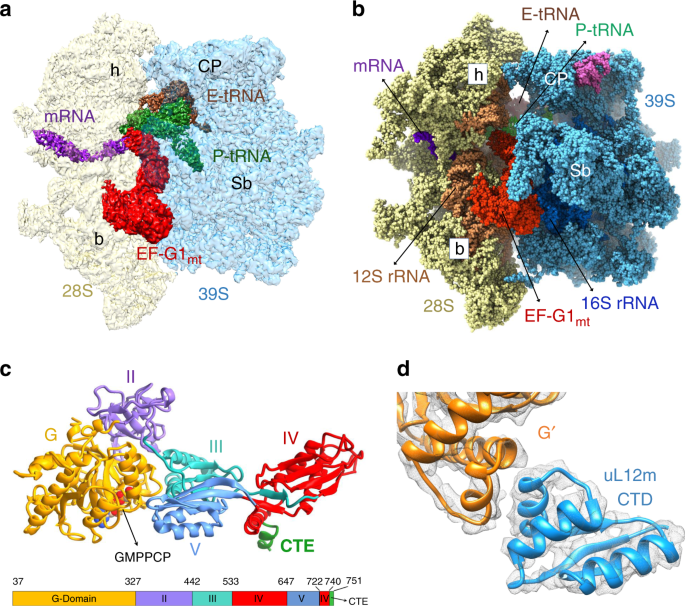
为了获得55S·EF-G1 mt复合物,使用了GTP的不可水解类似物GMPPCP将EF-G1 mt锁定在线粒体上(请参见方法)。获得了55S·EF-G1 mt ·GMPPCP配合物的冷冻EM结构,其总分辨率为2.7Å(补充图 1和2)(请参见方法)。所有选定的55S线粒体图像的3D分类产生两个主要类别,分别细化为2.96Å和2.97Å分辨率,一个次要类别细化为3.96Å分辨率(补充图 1和2;补充表 1)。所有三个55S线粒体图均显示EF-G1 mt的明确定义的密度,但显示28S亚基相对于39S亚基的相对方向存在显着差异。冷冻电镜结构在其完全转动状态的28S亚基8被称为I类,在其未旋转典型状态的28S亚单位的结构2,4称为III类(图 1A,B),在I类和III类构象之间处于中间状态的具有28S亚基的结构称为II类。这些结构中的每一个在线粒体肽基(P)和出口(E)位点都显示出tRNA mt的可变密度(图 1a,b和补充说明)。
在所有三个图中,EF-G1 mt在55S 线粒体上的总体构象类似于细胞质核糖体复合物中的EF-G结构,在该结构中,该因子已通过抗生素夫西地酸(FA)捕获了27,31,32,35,或通过使用一个不可水解的GTP类似物29,33,34,36,37。除了确定完整的EF-G1 mt及其715个氨基酸残基折叠成五个球状结构域的结构(图 1c)之外,我们的cryo-EM图还具有高分辨率特征(补充图 3)。)使我们能够对目前可用的人类线粒体结构2中不存在的75个rRNA残基和1,082个氨基酸残基进行建模。此外,我们确定哺乳动物MRP之间的物种特异性结构差异。EF-G1 mt结合稳定了uL10-L12茎29的柔性C端结构域(CTD),并能够建模与EF-G1 mt的G'子域相互作用的uL12m CTD的一个副本(图 1d)。 。EF-G1 mt诱导的运动还使uL11m的N末端结构域(NTD)距离uL12m-CTD更近5Å(补充图 4c),从而使后者能够同时与uL11m和G'的子域相互作用形成的圆弧状的结构27,29。uL12m CTD和EF-G1之间的直接互动MT表明uL12m在招聘因素作用40,41线粒体翻译过程中。
EF-G1 mt与线粒体的GTPase激活中心的相互作用
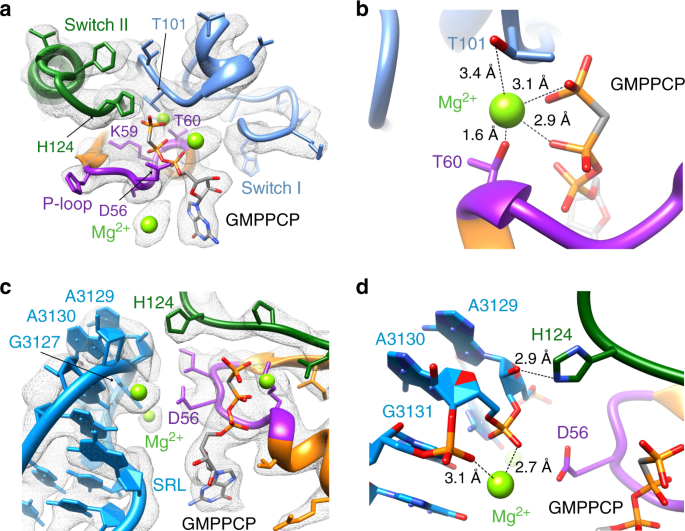
tRNA和mRNA的易位是核糖体的固有性质而EF-G的结合·GTP和EF-G GTP的随后的水解通过几个数量级提高易位速率42,43。使用我们的高分辨率图(复杂III),可以构建核苷酸结合口袋的完整从头模型,以及开关I与EF-G1 mt其他域和相邻核糖体组分的相互作用。结合的GMPPCP通过氢键和范德华相互作用的大型网络与几个高度保守的EF-G1 mt残基保持位置,其中主要是P环的D56和K59,开关I区的T101和H124的H124。开关II区域(图 2a)。靠近GMPPCP的γ磷酸根的关键Mg 2+离子由P环的T60和开关I区的T101协调(图 2b)。H124是已知用于催化GTP的水解,如在细菌这个关键残基的突变必需EF-Tu的严重抑制其核糖体刺激的GTP水解44,45。在我们的地图中,催化H124是面向结合GMPPCP分子(图的γ磷酸 2C),表示活动核苷酸结合口袋34,36而将其模拟指向在相反方向上在GDP-状态细菌后-易位复合体(补充图 5)35。H124的定位是通过从39S LSU,其在激活所述平移GTP酶中心作用的16S rRNA段的普遍保守的八叠球菌-蓖麻环(SRL)稳定34,35,36。与SRL相邻的G结构域的结合关闭了EF-G1 mt的核苷酸结合口袋,而来自SRL的碱基A3129通过氢键相互作用来稳定当前激活的H124构象(图 2c,d)。发现来自SRL的碱基A3130和G3131与独特放置的Mg 2+离子配位,而后者又能使P环D56稳定在活性构象中(图 2c,d)。如细菌中观察到的34,36中,EF-G1结合公吨到55S mitoribosome在必要以催化水解反应的活性构象通过订购开关I区和D56和H124的朝向活性位点为GTP水解定位稳定因子。
通过与G结构域功能必需元件的保守氨基酸残基(如Switch I(蓝色),Switch II(绿色)和P环(紫色))进行多次相互作用,在核苷酸结合口袋中的 GMPPCP位置。结合的镁离子显示为绿色球体。b来自P环的T60和来自开关I区的T101协调了GMPPCP附近的关键Mg 2+离子。c H124(绿色)和D56(紫色)与α-sarcin-ricin环(SRL)的功能重要碱基的相互作用:A3129,A3130和G3131。dH124通过与SRL A3129高度保守残基的糖部分相互作用而稳定在其活性构象中。SRL的A3130和A G3131残基的磷酸盐骨架与Mg 2+离子配位,从而使D56稳定在其活性构象中。面板a – d中G域成分的颜色匹配。
EF-G1 mt结构域IV 在28S亚单位的A位点处于三种构象状态的相互作用
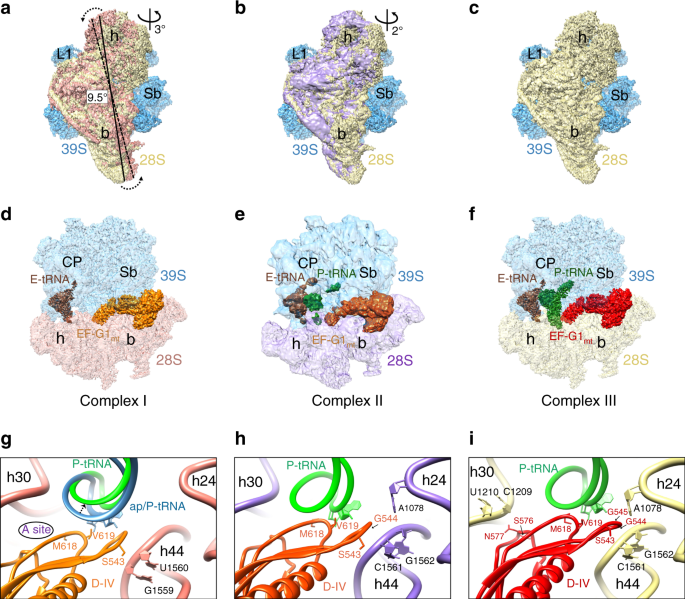
在所有三个55S·EF-G1 mt复合物中,EF-G1 mt通过与大型和小型线粒体亚基的几个组分相互作用而被固定在位,但EF-G1 mt的结构域IV和线粒体组分在这些复合物中的相互作用不同。在I类55S·EF-G1 mt复合物中,28S亚基相对于39S亚基逆时针旋转了约9.5°(图 3a),类似于先前描述的细菌的棘轮状亚基重组。核糖体30,46。除了这种棘轮状运动,显著头旋转32,47在I类复合物中也观察到了这种现象,其中28S亚基头部区域在与棘轮状运动大致正交的方向上相对于身体旋转了约3°(图 3a)。II类复合物呈现出一个以前未知的,与EF-G结合的构象中间体,其中28S亚基的头部区域已像棘轮的I类复合物一样旋转(图 3b),而28S体区的构象类似于在未旋转的III类复合物中(图 3c)。的存在下,I类复合体样与构象状态和棘轮头旋转SSU在先前的EF-G1 公吨 -unbound映射2,但不存在于我们的控制图(补充图这样的构象。 6)表明,I类复合物时EF-G1的结合或者形成公吨到mitoribosomes的亚群携带仅在E-位点的单一的tRNA 2,48(图 3D),或一个人口携带松散结合全部易位到E位点的P位tRNA。总的来说,与我们对照组的分布相比,我们发现EF-G1 mt结合使更多的线粒体进入非棘突状态(补充图 6)。II类复合物代表了三个种群中最小的一个,并且显示出E位点tRNA的强密度,但P位点的tRNA密度却有些碎裂(图 3e)),而III类复合物显示了P位和E位tRNA的密度(图 1a,3f)。
a – c亚基间旋转和28S头部旋转。一个所述的叠加冷冻电镜映射I类和III类复合体中逆时针方向相对于39S亚基(蓝)的方向在I类复合物显示了一个整体9.5°旋转28S亚基(鲑鱼),具有28S头域在与子单元间旋转方向大致正交的方向上额外旋转了约3°。bII类和III类复合物之间的类似比较显示,II类复合物(浅紫色)中的28S头部旋转了约2°,而亚单位间的整体旋转没有可测量的。在所有三个面板中,从28S溶剂侧显示了55S线粒体。来自复合物I和II的28S亚基以鲑鱼和紫色显示,而来自III类复合物的28S亚基以黄色显示。除L1茎(L1)外,面板a – f中两个线粒体亚基的地标与图1中介绍的相同 。d – f分别对应于P-(绿色)和E-(深棕色)位点tRNA mt和EF-G1 mt的分段密度显示了复合物I–III中的(橙色,带红色的橙色和红色),以及28S(底部)和39S(顶部)亚基的半透明密度。g – i EF-G1 mt结构域IV与28S亚基和P位点tRNA的相互作用。g在I类复合物中,域IV(橙色)的位置距12S SSU rRNA螺旋(鲑鱼)h30和h24约10Å。为了与EF-G1 mt域IV(橙色)建立联系,需要将P-tRNA的反密码子末端(绿色)移至ap / P杂合位置(蓝色)6–7Å。指示了A站点的位置。h中间头仅旋转状态显示域IV(红橙色)与12S rRNA螺旋(浅紫色)h24和h44的相互作用有限。i III类复合物中IV域(红色)与12S rRNA(黄色)和P位tRNA(绿色)的多重相互作用。
细菌EF-G的结构域IV已知在tRNA和mRNA的转运中发挥关键作用27,49。在所有三个类别中,将EF-G1 mt的 IV域插入28S亚基解码中心,以使其与A位tRNA的反密码子臂在空间上重叠(图 3g–i),如类似的细菌复合体27。与IV区的最小线粒体相互作用发生在I类复合物中,中等数量的相互作用发生在II类复合物中,最大相互作用发生在III类复合物中(图 3g–i)。在III类复合物中,结构域IV与28S亚基的多个12S rRNA组件(例如,螺旋24(h24),h30,h44和以P / P状态结合的tRNA的反密码子臂)接触(图 3i)。 。[我们一直采用细菌编号来指代rRNA螺旋,因为它们在SSU中的前缀是线粒体12S rRNA的'h',在LSU中的16S rRNA则带有'H'。rRNA核苷酸编号根据Amunts和其同事2进行。]在28S P位点区域,来自域IV的loop1区域的氨基酸残基S543,G544和G545与h44碱基C1561和G1562的主链磷酸酯相互作用,而碱基A1078从h24开始将其放置在距结构域IV的G544和G545形成氢键的范围内(图 3i)。II类和III类显示密度映射为P位的tRNA(图 3E,F在古典P / P状态结合的)4,5。然而,P-位点密度是相对较弱,因为它代表了内源性结合多尺寸的tRNA的平均密度公吨,其中一些是已知的相比,他们的细菌同行具有小得多的T-回路50,51。然而,保守的片段,如tRNA的反密码子和CCA臂可以对接成相应的密度。因此,来自P位点tRNA反密码子的核苷酸33和34位于残基M618和V619的3Å之内(图 3i)。)从域IV的loop3区域中删除。在III类复合物的28S头部区域中,12S rRNA碱基U1209和U1210的骨架磷酸酯与域IV的loop2区的氨基酸残基S576和N577相互作用(图 3i)。tRNA mt的大小变异性也会影响与E位点tRNA mt的反密码子区域相对应的密度(补充说明和补充图 7)。
结构域IV与复合物III中28S亚基的头部和肩部区域以及tRNA的反密码子区域的同时相互作用将稳定P位点的tRNA,并防止易位的P位点tRNA的反密码子末端滑回。 A位点,如也被结构研究细菌移位建议31,32,35,52。细菌70S核糖体的小亚基也以不旋转的构象存在,在70S·EF-G·GDP·FA易位复合物35的晶体结构中具有相似的相互作用,这表明我们的III类55S·EF-G1 mt复合体代表人的线粒体的真实的转位后状态。已知能与真细菌A-和P位的tRNA相互作用的线粒体和细菌核糖体的12S核心SSU rRNA的区域通常是保守的5,53,和结合的A-和P位的tRNA的相对定向也是相似(补充图 8),尽管在下一个标题下详述,但在线粒体的LSU中的tRNA结合位点周围存在显着改变且富含MRP的环境。
I类复合物中的EF-G1 mt结构域IV 的尖端距12S rRNA螺旋h24和h30约10Å,比其在III类复合物中的位置更靠近28S肩部或A位点(图 3g,另请参见补充图 9)。域IV不与I类复合物中的28S头部区域相互作用,并且仍然与域IV相互作用的唯一28S亚基元素是12S rRNA h44(图 3g)。这并不奇怪,因为域IV与头部和平台组件的同时相互作用会阻碍头部旋转,并且亚基棘轮和头部旋转的组合有助于分别将A和P位tRNA分别转移到P和E位点31,32,47。与III类复合物不同,I类图谱没有足够的密度来模拟P位点tRNA,但将III类P位点tRNA密度叠加到I类位点上表明结构域IV与P-反密码子的相互作用在P / P状态的tRNA位点不会在I类复合物中建立(图 3g)。有趣的是,如果P位点tRNA的反密码子末端向28S亚基的A位点移动6-7Å(图3g),则可以恢复这些接触 ,这表明I类55S·EF-G1 mt复合体代表关键的早期易位中间产物,其中在A位点tRNA进入中间嵌合ap / P状态后,结构域IV仅部分移入了A位点在第II类状态(图 3h)之前的第 31类 ,随后是第III类状态(图 3i)的第31类 。EF-G1的结构域IV公吨同步核糖体的棘轮运动与tRNA的移动一起,因为它似乎紧跟A位的tRNA的反密码子臂其易位期间到P位点 31,32,35,52。
P位手指和其他与tRNA mt和EF-G1 mt直接相互作用的MRP的作用
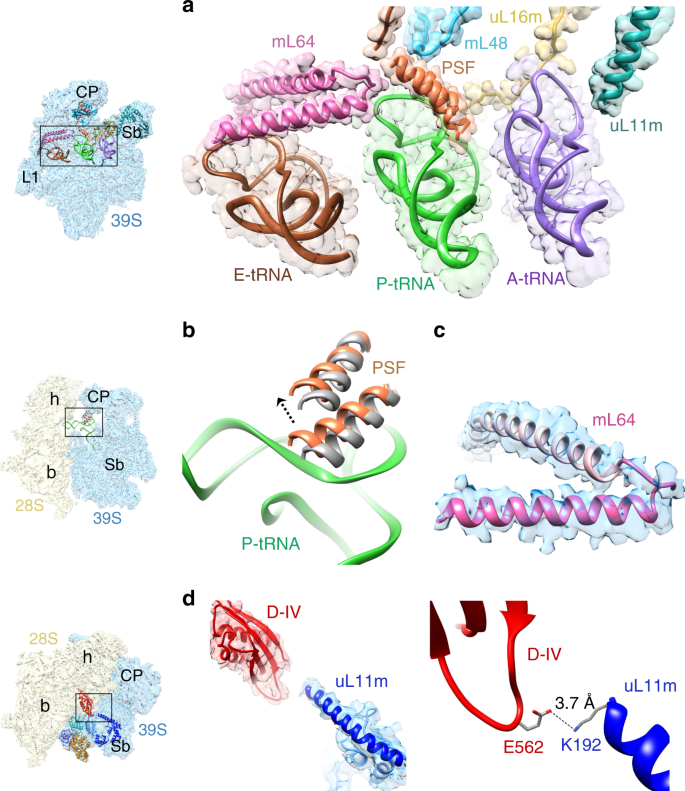
一项所述的细菌和线粒体核糖体之间的主要结构差异是几个rRNA基因片段的线粒体中损失的一部分被采集的新读护照和扩展同源读护照补偿5,54,55,56。这也改变了核糖体亚单位间空间的组成景观,为翻译延伸过程中哺乳动物的线粒体上的mRNA和tRNA运动提供了通道。在哺乳动物线粒体,蛋白质BL5从P位点丢失,而BL25和A位的手指(23S rRNA的螺旋38)从A位点丢失2,4,5。与结合的tRNA分子相互作用是通过补偿这些结构元件的损失的唯一的指状称为P位指(PSF)的结构元件,与A-和P-位点相互作用结合的tRNA 4,5。在III类复合物中,发现PSF与P位tRNA的T环和D环相互作用(图 4a)。PSF的作用似乎是正确定位A位和P位tRNA,并防止在P位结合的tRNA从A移位到P位的过程中和之后,其肘区域恢复到A位。相比于空55S mitoribosomes 2,4,PSF发生了显着的构象变化,并在我们所有的EF-G1 mt结合复合物(图 4b)以及哺乳动物的线粒体起始复合物中9向P位结合的tRNA靠近。与PSF的紧密相互作用可能是经常与P位点结合的tRNA mt 5共纯化线粒体的原因之一。
a(紫色),P(绿色)和E(棕色)tRNA 与线粒体特异性蛋白,PSF(橙色),mL48(蓝色),mL64(粉红色)和线粒体特异性插入/延伸的相互作用同源蛋白uL11m(深青色)和uL16m(黄色)。处于A / A状态的A位点tRNA mt位置来自55S牛(Bos taurus)图谱(参见补充图 8)。b PSF的动力学,它已向55- S ·EF-G mt ·GMPPCP复合物中的D-和T环区域P-位tRNA(P / P状态)相互作用,同时向P-位tRNA移动了约4Å。它在空的人线粒体中的位置(灰色)2。C来自III类图谱(蓝色)的mL64的C端区域(A160-E192,深粉红色)的结构。d uL11m的线粒体特异性节段(深蓝色)与EF-G1 mt(红色)的结构域IV 之间的相互作用,涉及uL11m的C末端残基K192和来自结构域IV的E562之间的氢键。面板a,b和d左侧的缩略图描述了39S和55S线粒体的总体方向。缩略图上的地标:CP中央突起,39S LSU的L1 uL1m茎,Sb uL11m茎基,28S SSU的h头,b体。
在我们的地图中,我们发现了以前未分配的肾小管密度,该密度位于线粒体特异性蛋白mL64的C末端和PSF 8之间。这种额外的密度很容易归因于mL64 C端的α-螺旋形成32个氨基酸残基(图4c),该残基 在P位和E位tRNA之间的39S亚基中延伸,同时与T-相互作用两个tRNA的环状区域(图 4a)。与线粒体特异性蛋白mL48和MRP的线粒体特异性节段uL11m和uL16m一起,PSF和mL64的C端跨越了39S亚基上的所有三个tRNA结合位点(图 4a)。),在结构上补偿不存在某些已知的r蛋白和rRNA组分的细菌同源物,这些同源物与细菌核糖体中的tRNA定位,稳定和易位有关。
与空的55S相比,在所有三个EF-G1 mt结合复合物中,线粒体LSU内的uL11m茎基区域向EF-G1 mt的域V移动了5Å (补充图4a,b)。 mitoribosomes 2,4,在启动9和在mitoribosome回收络合物8。据报道,细菌70S·EF-G复合物的uL11m区域也有类似运动29。但是,在哺乳动物的线粒体中,构象变化与EF-G1 mt的 IV结构域与uL11m的线粒体特异性节段直接接触有关(图 4d)。uL11m的线粒体特异性C末端α-螺旋的K192通过氢键相互作用与EF-G1 mt IV域的E562 相互作用(图 4d)。有趣的是,在EF-G2 mt中不存在唯一放置的E562 (补充图 10)。E562的存在下和在EF-G1的特定线粒体-CTE MT和它们的不存在在EF-G2 公吨内对应EF-G2的结构域II和III,具有四个小的插入片段的存在沿公吨(补充图 10),似乎分别是赋予这两个因素特异性的关键差异,因为这两个因素分别在延伸和循环步骤中发挥了作用。
C端扩展在EF-G1 mt中的作用
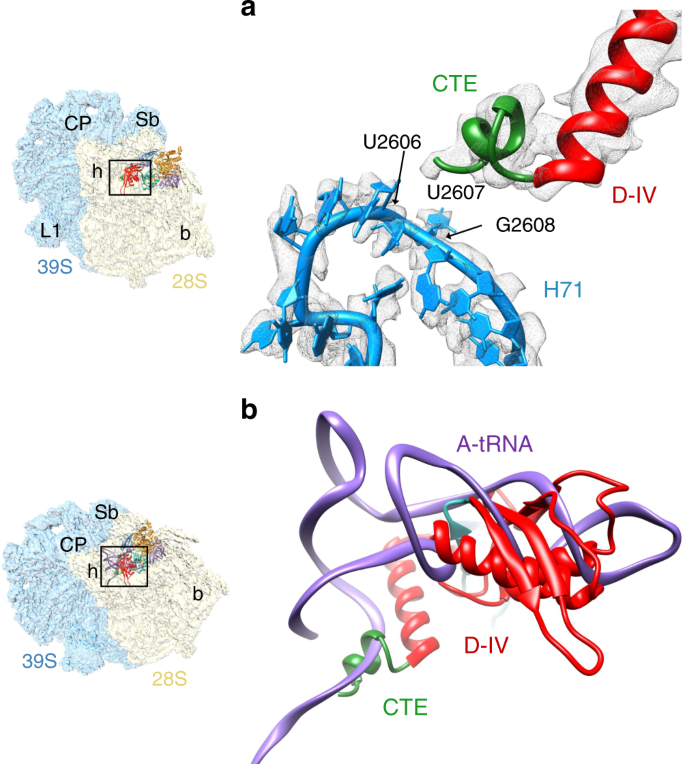
I类和III类复合物都显示出与EF-G1 mt域IV 保守C末端相邻的额外密度,可以很容易地容纳其线粒体特异性C末端延伸(CTE)(图 5a),在II类复合物中无法解决。富含赖氨酸的CTE折叠成α-螺旋并延伸到39S亚基,使EF-G1 mt与细菌EF-G无法接近的rRNA和tRNA mt片段相互作用。CTE的位置靠近16S LSU rRNA螺旋71(H71)的核苷酸U2606-G2608片段(图 5a)。按照目前的方向,CTE将与主要涉及tRNA 的A位tRNA mt肘的内弯重叠mt的CCA臂(图 5b),表明CTE在A位点结合的tRNA mt的CCA臂的运动中起着直接作用。富含赖氨酸的CTE与H71的相互作用也将阻止P位tRNA向A位的反向转运。EF-G1 mt在大肠杆菌核糖体上仍具有活性,而大肠杆菌 EF-G 在线粒体上仍无活性这一事实57,表明观察到的EF-G1 mt的CTE与线粒体和A位点的相互作用我们结构中的tRNA mt也可能与EF-G1 mt相关对核糖体的GTPase活性。上一节中描述的线粒体亚单位间空间的格局发生了重大变化,EF-G1 mt的CTE在线粒体上的位置表明MRP和翻译因子已与其独特的tRNA共同进化\({} _ {{\ mathrm {mt}}} \)在结构上和功能上补偿丢失的细菌RNA片段。
a域IV(红色)的C端延伸(CTE,绿色)与16S LSU rRNA螺旋71(H71,蓝色)相互作用。b将A位点结合的tRNA mt(紫色)叠加到EF-G1 mt结合的人55S结构上,发现虽然EF-G1 mt的 IV域大部分与反密码子-茎环区域重叠,但CTE部分重叠带有A站点tRNA mt的CCA臂。左侧缩略图上的地标,如图4所示,其中描述了55S线粒体的总体方向 。
新生多肽出口位点的构象变化
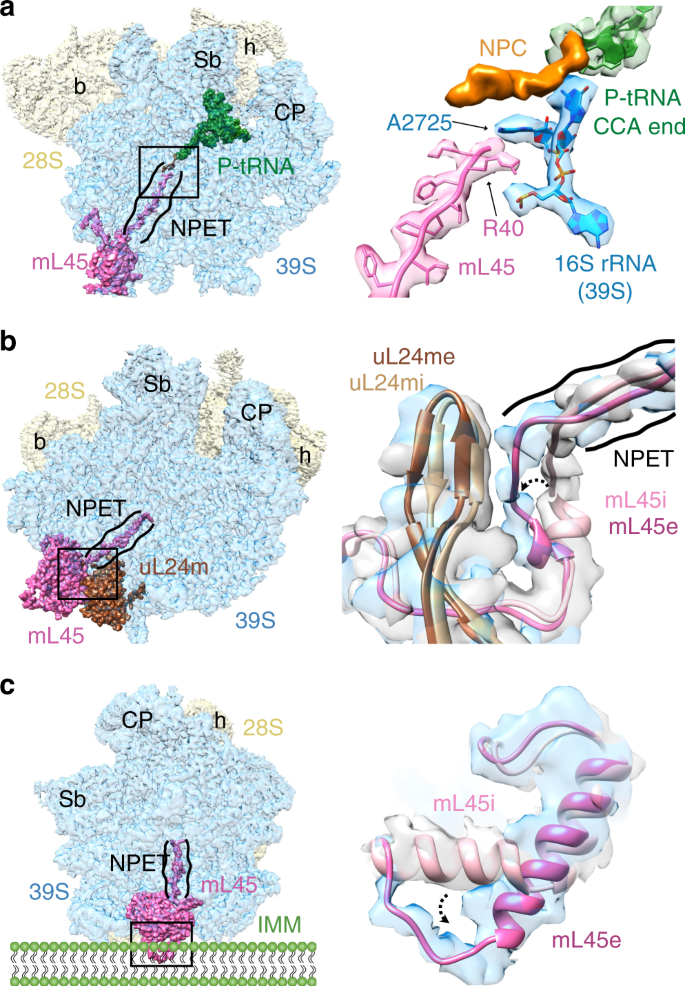
新合成的蛋白质链离开穿过大亚基的隧道状特征核糖体5,58,59被称为新生多肽退出隧道(NPET)。NPET起源于肽基转移酶中心(PTC),并在溶剂界面的另一侧终止,这被称为多肽出口位点(PES)。该隧道的结构组成是细菌和哺乳动物线粒体核蛋白体之间显着不同的2,4,5。域I和23S rRNA基因的III该行NPET在细菌的底部在类似的线粒体16S都大大降低LSU rRNA的5,53。围绕这些隧道重要的结构成分的损失是通过采集与扩展N和C末端较大细菌r-蛋白同系物的补偿5,54,56。甲三刀特异性蛋白mL45也存在靠近PES 2,4。在启动阶段,整个NPET被mL45的N末端(NT)残基38–64插入NPET 9所阻断。mL45的N末端区域还与PES附近的MRP uL23m和uL24m相互作用。突变研究表明,删除mL45 NT会严重抑制线粒体翻译9。
尽管受阻的NPET可能不会对起始的线粒体造成任何问题,但在翻译延伸阶段需要一条空的通道来容纳不断增长的新生多肽链。在我们所有的复合物中,我们发现了一个未分配的密度,该密度连接到P位tRNA的CCA末端,并接近NPET内部核糖体蛋白mL45的NT(图 6a)。可以容纳多达5个氨基酸残基的密度很容易归因于新生的肽链(NPC)。在我们的结构中,来自16S LSU rRNA螺旋H73和H74之间的环区域的保守腺嘌呤残基(A2725)插在NPC的NT和来自mL45的NT的Aa R40之间(图 6a))。通过同时与NPC和mL45的NT相互作用,A2725可能在触发大型线粒体亚基的构象变化中起关键作用,最终导致从NPET撤回mL45的NT,从而为生长的NPC腾出空间。实际上,我们观察到涉及aa残基R61至D73的显着构象变化(图 6b)。与它们在起始复合物9中的位置相比,这些残基已从隧道移向uL24m约9Å,这也随着mL45的移动而移动。EF-G1 山当mL45准备从NPET中检索其NT以允许从NPET的PTC侧插入传入的新生多肽时,在我们的结构中捕获的大亚基中诱导的构象变化可能代表了功能状态。
a与P位tRNA的CCA末端相关的 A密度(绿色)被确定为接近核糖体蛋白mL45的N末端(NT)的NPC(橙色)(粉红色)。来自16S LSU rRNA的A2725(蓝色)位于mL45的NT和新生多肽链(NPC)之间。b N末端区域在延伸复合mL45的(R61-D73)(mL45e,深粉色)已基本上移向uL24m,相比于在起始复合物(mL45i,浅粉色)其位置9。mL45的变化伴随着uL24m在起始状态(uL24i,浅棕色)和伸长状态(uL24e,深棕色)之间的微小移动。c mL45核心区的构象变化。面板b和c中的弯曲箭头指向观察到的从起始到伸长复合物的运动。面板a,b和c中的缩略图描绘了55S线粒体的整体方向,其中28S SSU(半透明黄色)位于39S LSU(半透明蓝色)后面,并突出了相关的MRP。缩略图上的地标如图4所示 。面板c中线粒体内部膜(IMM)的描述为观察到的构象变化的位置提供了背景信息。
此外,位于mL45核心区域的残基T101-Y128在起始9之间经历了较大的构象变化(图6c)。 和我们的伸长复合物。在起始复合物中,这些残基形成两个单独的α螺旋,它们之间的夹角约为120°。其中,来自N末端螺旋的残基T109-T115旋转〜60°,成为延伸复合物中单个长α-螺旋的一部分,使残基S101-R108处于开放构象。涉及二级结构重排的这种大构象变化对于将哺乳动物的线粒体锚定到内部线粒体膜(IMM)可能是必需的。mL45恰好是Mba1的同源物,Mba1是将新生多肽共翻译插入酵母60中 IMM所必需的IMM相关受体。有趣的是,mL45的这个带正电荷的区段(aa残基101-114残基)通过介导基于电荷的相互作用61介导了55S线粒体与IMM的带负电荷的脂质含量的关联,这可能伴随观察到的构象变化在这个研究中。此外,与mL45 NT相互作用的uL23m的C端区域发生了巨大的构象变化,其中涉及aa残基A123-R137的α螺旋向mL45 NTE移动了约20。看来,这种α螺旋运动对于清除mL45的NTE从出口通道的位移路径是必需的(补充图 11a)。然而,人与其他哺乳动物中uL23m序列的比较(补充图。 11b)表明这种主要的构象差异可能是物种特异性的。
总之,我们的研究为人类55S 线粒体提供了最完整的结构,并表明EF-G1 mt结合的线粒体可以采用至少三种不同的构型,而与GTP的水解状态无关。主要变化发生在整个28S亚基的相对方向上,或仅发生在其头部区域,这表明28S亚基在移位过程中具有异常的适应性(图 3)。直接的结构证据表明,线粒体和EF-G1 mt中的线粒体特异性成分都参与了tRNA mt的转运。我们的研究还显示了线粒体的tRNA mt相互作用位点中的线粒体特异性核糖体蛋白(例如PSF和mL64)如何(图 4),以及在EF-G1 mt的C末端仅添加11个氨基酸残基(图 5),使得线粒体翻译系统与其细菌对应物相比,能够适应线粒体RNA组分的大量减少。例如,不存在23S rRNA螺旋38(也称为A位手指),它在真细菌中tRNA易位期间与A位和P位tRNA都动态相互作用,在哺乳动物中被PSF蛋白在结构和功能上进行了补偿线粒体。同样,缺失的真细菌E位点tRNA与rRNA相互作用53被蛋白质mL64取代。最后,在NPET出口位点涉及线粒体特异性蛋白mL45的起始状态和延伸状态之间的构象变化很大(图 6),似乎与将线粒体锚定在IMM上有关。
方法
从HEK细胞中分离线粒体
线粒体是从缺乏N-乙酰-氨基葡萄糖氨基转移酶I(HEK293S GnTI)8的人类胚胎肾细胞中分离出来的,然后使用装有5%胎牛血清(Gibco,Life Technologies)的FreeStyle TM 293培养基(Gibco,Life Technologies)在滚瓶中培养。。以1000× g离心 7分钟后,将HEK293S GnTI细胞颗粒转移至玻璃匀浆器中,并重悬于含有50 mM HEPES-KOH pH 7.5、10 mM KCl,1.5 mM MgOAc,70 mM蔗糖,210 mM甘露醇的缓冲液中,1 mM EDTA,1 mM EGTA,1 mM DTT和1 mM PMSF。均质后,通过以950× g旋转15分钟将上清液与细胞碎片分离 。然后将上清液以11,000×旋转 克 15分钟,和包含粗线粒体所得沉淀重新悬浮于缓冲液SEM(250mM蔗糖,20mM的HEPES-KOH pH为7.5,1mM的EDTA,和1mM EGTA)。将DNase I(3单位/毫升)添加到粗线粒体中,并在4°C下孵育1小时。通过在含有10 mM HEPES-KOH pH 7.5和1的缓冲液中分层放置2.5ml 60%,4ml 32%,1ml 23%和1ml 15%蔗糖溶液,在Beckman聚异体管中制备不连续的梯度。毫米EDTA。将DNase处理的样品上样到不连续的梯度上,并在Beckman超速离心机中使用Ti70转子在135,000× g下离心1 h 。小心地分离出包含纯线粒体的棕橙色层,并将其重新悬浮在SEM缓冲液中。
从线粒体中分离线粒体
Mitoribosomes分离8通过添加四卷裂解缓冲液(25mM HEPES-KOH pH为7.5,100mM的氯化钾,25mM的MgOAc,1.7%的Triton X-100,2mM的DTT和1mM PMSF)与线粒体沉淀,然后在4°C下孵育15分钟。将样品以30,000× g离心 20分钟,并将上清液加载到缓冲液(20 mM HEPES-KOH pH 7.5、100 mM KCl,20 mM MgOAc,1%Triton X-100和2 mM DTT)。在90,000× g下离心17小时后 使用Beckman超速离心机中的Ti70转子,加入足以溶解沉淀物的最小体积的Mitobuffer(20 mM HEPES-KOH pH 7.5、100 mM KCl,20 mM MgOAc和2 mM DTT)。使用梯度制备仪(CBS Scientific Co.)在Mitobuffer中制备10–30%的连续蔗糖密度梯度。使用贝克曼超速离心机中的Sw32转子,以60,000× g对重悬的沉淀物进行10–30%的连续蔗糖密度梯度离心 处理17 h。在ISCO梯度分析仪(Teledyne ISCO,Inc)上对梯度进行分级,并收集并汇集对应于线粒体的级分。最后,将合并的线粒体以130,000× g的转速进行浓缩。 使用Ti70转子离心6小时,然后将沉淀重悬于Polymix缓冲液(5 mM HEPES-KOH pH 7.5、100 mM KCl,20 mM MgOAc,5 mM NH 4 Cl,0.5 mM CaCl 2,1 mM DTT,1 mM亚精胺中和8 mM腐胺)62。
人EF-G1 mt的克隆与表达
从GeneCopoeia(No. GC-W1058)获得编码人EF-G1 mt的表达序列标签。使用PCR,通过使用正向5'-GGAATTCCATATGTCTTCATCAGGGGTGTGATTCC-3'和反向5'-AACCGCTCGAGTTCTTGGCTTTTCCTTTTTTAAC-3'引物39来扩增与EF-G1 mt(氨基酸36-751)的成熟形式相对应的序列。将PCR产物克隆到pET 21c(+)(Novagen)中,该载体提供在C端编码六个His残基(His-tag)的序列。将得到的构建体转化到大肠杆菌 ER2267中,然后转化到大肠杆菌 BL21(DE3)(RIL)中以进行过表达。
人类EF-G1 mt的纯化
培养物生长至对数中期,并用50μM诱导异丙基-1-硫代D -galactopyranoside(IPTG)。在4°C下以5,000 rpm离心15分钟后,收获细胞,冷冻并保存在-80°C下。通过以两倍于A-5型氧化铝的细胞重量(Sigma)研磨20分钟来破碎冷冻细胞。将该糊状物重悬于缓冲液B(50 mM Tris–HCl,pH 7.6,40 mM KCl,7 mM MgCl 2,7 mMβ-巯基乙醇,0.1 mM苯基甲基磺酰氟和10%甘油),并通过在4°C下以10,000 rpm离心10分钟除去碎屑。随后进行DNase I(5μg/ mL)处理,并在4°C下以15,000 rpm离心20分钟。将得到的上清液与0.6 mL 50%的Ni–NTA树脂在缓冲液B中平衡的浆液混合,并使用亲和色谱39获得相对纯的EF-G1 mt。为了获得高纯度,采用了离子交换色谱技术,其中在阳离子交换TSKgel SP-5PW色谱柱(TosoHaas,日本)上处理了由Ni–NTA纯化得到的部分纯化的EF-G1mt。
人线粒体 • EF-G1 mt •GMPPCP复合物的制备
为了获得55S·EF-G1 mt复合物,GTP的不可水解类似物GMPPCP被用于将EF-G1 mt锁定在线粒体上。通过在HEPES混合缓冲液中于37°C下将150 nM 55S 线粒体与5μMEF -G1 mt和1 mM GMPPCP(Sigma-Aldrich,USA)孵育5分钟来形成复合物。
低温电子显微镜和图像处理
总共将4μl55S ·EF-G1 mt •GMPPCP复合物应用于Quantifoil多孔铜1.2 / 1.3网格,该网格预先涂有一层薄的(约50Å厚)自制的连续碳膜并发光。 -在等离子灭菌器上放电30 s。将栅格在4°C和100%湿度下孵育15 s后,将其吸干4 s,然后在Vitrobot(FEI公司)的帮助下快速冷冻成液态乙烷。在配备有Gatan K2顶峰直接电子检测相机的Titan Krios电子显微镜(FEI公司)上以300 kV收集数据。我们使用的散焦范围为-1.0到-3.0 µm,校准放大倍数为105,000,像素尺寸为1.0961Å。的每每像素7个电子的剂量率和10秒的曝光时间导致69.2 E的总剂量/ A 2。所有下游数据处理均使用CryoSPARC 63完成。将全帧运动校正应用于对应于每张6,671张显微照片的所有50个电影帧。在使用CTFFIND4 64确定其对比度传递函数(CTF)之后,取消选择不良图像。从剩余的6649张显微照片中,使用自动拾取功能拾取了1,611,0847个颗粒,经过局部运动校正后,剩下1,262,274个颗粒。此步骤之后是无参考2D分类,最后基于2D平均值保留了851,131个良好的粒子。最初的3D重建和完善产生了2.74Å分辨率的55S图(补充图 1)。),其39S亚基的总体分辨率为2.68Å(补充图 2),并且发现39S亚基核心区域的局部分辨率在2.5-2.6Å范围内(补充图 2)。)。但是,28S亚基的解析相对较差。基于参考的3D分类可将55S线粒体(289,982个颗粒)与39S亚基(408,686个颗粒)和28S亚基(152,463个颗粒)分开。进一步将对应于55S线粒体的颗粒进行多轮3D分类,从而产生三个稳定的类别,即I类(99,804个颗粒),II类(25,755个颗粒)和III类(150,347个颗粒),并允许我们去除少量种群14,076个坏粒子。经过3D细化后,I类,II类和III类的最终分辨率分别为2.97Å,3.96Å和2.96Å,并且这三个类别均显示出很强的密度,可以很容易地归因于EF-G1 mt。经过掩盖的局部改进后,来自I类复合物的28S和39S亚基分别改进为3.15Å和2.91Å;II类复合物的28S和39S亚基分别精制为4.82Å和3.77Å;将来自III类复合物的28S和39S亚基分别精制为3.04Å和2.87Å(补充图 2)。使用0.143 FSC临界值65的金标准来报告所有分辨率。
模型建立与优化
对应于已公开的人类线粒体(PDB ID:3J9M)2的大小亚基的坐标用作初始模板。我们的地图的较高的分辨率(补充图 3)使我们能够建立多个蛋白质和不存在于先前的人类mitoribosome结构rRNA的区段2,8,66。高度解析的二级结构元件(SSE)和氨基酸侧链特征指导使用UCSF Chimera 1.14 67和COOT 68手动构建大多数蛋白质模型。为了建模相对较低的区域,例如L7 / L12茎蛋白和大亚基的L12的C末端结构域(CTD),以及小亚基的mS39的蛋白,将猪线粒体9的同源结构用作模板。从头建模了以前的人类线粒体结构中不存在的其他片段(75个rRNA nt和1082个氨基酸残基)。这些新的rRNA片段在ModeRNA服务器69中构建,使用相应的片段(只要可从猪线粒体9获得)作为模板。为了构建P和E位点tRNA,使用酵母tRNA Phe(PDB ID:1EhZ)70的高分辨率结构作为模板来生成tRNA mt苯丙氨酸。手动将tRNA mt Phe停靠,并使用Chimera 1.14 67将刚体装入相应的cryo-EM密度。由于内源结合的tRNA mt内的次优占用和固有异质性,对应于tRNA mt密度的分辨率相对较低,以允许对P位和E位tRNA mt进行任何序列特异性建模。I-TASSER 71中生成的EF-G1 mt的同源性模型用作初始模板。在同源性模型的区域不完全适应到相应的EF-G1 MT密度从头为蓝本,使用奇美拉1.14 67和COOT 68。我们的冷冻-EM图中较低的分辨率对应于EF-G1 mt C末端延伸(CTE)的密度,从而限制了该区域在侧链水平上的建模,但允许构建由可识别的SSE引导的碳骨架。为了将模型最终优化为cryo-EM密度,我们使用了PHENIX 72中的“实空间优化”功能。使用Molprobity服务器73对模型进行了验证,补充表格1中列出了EM重建和分子建模的总体统计数据 。
报告摘要
与本文链接的《自然研究报告摘要》中提供了有关研究设计的更多信息 。
资料可用性
根据合理的要求,可以从相应的作者处获得支持该研究的数据。低温EM谱图和原子坐标已保存在电子显微镜和PDB数据库(wwPDB.org)中,登录号为EMD-21233 [ https://www.ebi.ac.uk/pdbe/entry/emdb/EMD -21233 ]和PDB 6VLZ [ https://doi.org/10.2210/pdb6VLZ/pdb ]用于EF-G1 mt结合的55S 线粒体(复合体I),以及EMD-21242 [ https://www.ebi.ac .uk / pdbe / entry / emdb / EMD-21242 ]和EF-G1 mt结合55S 线粒体(复合物III)的PDB 6VMI [ https://doi.org/10.2210/pdb6VMI/pdb ] 。复合物II和牛55S线粒体的低温电磁图已保藏,登录号为EMD-22212 [https://www.ebi.ac.uk/pdbe/entry/emdb/EMD-22212 ]和EMD-22209 [ https://www.ebi.ac.uk/pdbe/entry/emdb/EMD-22209 ],分别。3D重建中使用的所有原始显微照片和粒子图像都可以通过电子显微镜公共图像档案库empiar(https://www.ebi.ac.uk/pdbe/emdb/empiar/)获得。
|
|