指导RNA表达后,蚊子中病毒序列的Cas13b依赖性和Cas13b依赖性RNA敲低
指导RNA表达后,蚊子中病毒序列的Cas13b依赖性和Cas13b依赖性RNA敲低
埃及伊蚊和白纹伊蚊是目前尚无特异性治疗方法的基孔肯雅热和登革热RNA病毒的载体。产生抗病毒蚊子的新方法的发展将是有益的。Cas13b是一种酶,它使用RNA向导来靶向和切割RNA分子,并且据报道可以抑制哺乳动物和植物细胞中的RNA病毒。我们调查了Prevotella sp的潜在用途。P5-125Cas13b系统使用病毒衍生的报告基因和CHIKV分裂复制系统在蚊子细胞中提供病毒抵抗性。Cas13b与合适的指导RNA结合可以强烈抑制昆虫细胞中病毒衍生的报告RNA。出人意料的是,单独的RNA向导(没有Cas13b)也产生了明显的抑制作用。我们的研究为在蚊子中潜在使用Cas13b提供了支持,但在解释CRISPR / Cas数据时也要谨慎,因为我们证明了指导RNA可能具有Cas独立的作用。
介绍
埃及伊蚊和阂。白带病是由具有登革热,基孔肯雅热(CHIKV)和寨卡病毒等正链RNA基因组的病毒引起的多种高影响力疾病的载体,这些病毒是许多热带和亚热带地区的主要健康负担,目前尚无有效的许可疫苗1,2,3,4,5。CHIKV引起严重的关节痛,这是对医疗保健系统的负担,和大规模城市流行病已被记录为最近的2019 6,7,8,9,10。因此,开发减少这种蚊子传播虫媒病毒能力的新方法将非常有价值。
原核簇状规则间隔的短回文重复序列(CRISPR)和CRISPR相关(Cas)蛋白构成针对异源核酸(如噬菌体)的细菌适应性免疫系统。感染后,将处理外来核酸,并将短片段整合到CRISPR阵列中,随后将其转录以产生引导RNA。然后,不同的Cas蛋白使用CRISPR-RNA向导识别特定的DNA或RNA靶标并切割互补序列11。从革兰氏阴性菌Cas13酶RNA引导的核糖核酸酶从类2 CRISPR-CAS系统亚型VI-B 12,13,14。从一系列不同细菌的酶Cas13b已显示能够从较长的RNA处理其导向,然后使用它们来靶和切割RNA 12,13。
该Cas13b系统已被提出作为抗病毒途径靶向在植物中的病毒RNA 15,16,17和哺乳动物18。因此,我们想探讨Cas13b是否可以作为靶向蚊子中病毒RNA的有用工具。
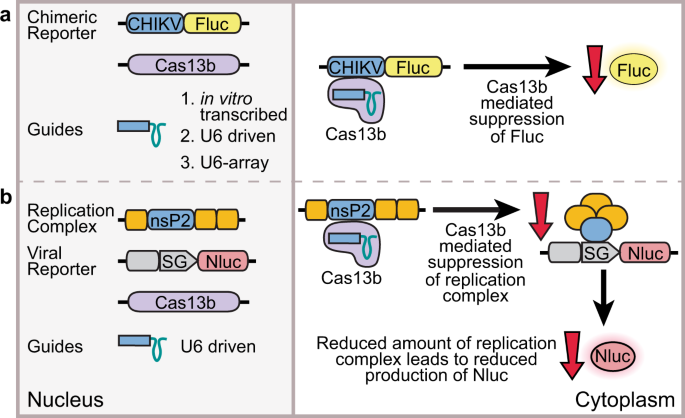
在这里,我们报告充分表征Cas13b从效果普雷沃菌。P5-125 12当用于靶向含有Ae中 CHIKV序列的RNA时。埃及和埃及。白带蚊细胞。针对CHIKV的非结构蛋白2(nsP2)区设计了两个RNA向导,并在四种不同的蚊子细胞系中针对(i)包含对应于nsP2的CHIKV序列的嵌合萤火虫荧光素酶报告质粒和(ii)CHIKV分裂进行了测试复制系统19,20(图 1)。我们证明Cas13b能够识别蚊子细胞中的病毒RNA序列,并可能介导此类序列的特异性降解。令人惊讶地,在不存在Cas13b蛋白的情况下,指导RNA也能够诱导降解。
结果
与Cas13b无关的作用与体外转录指南
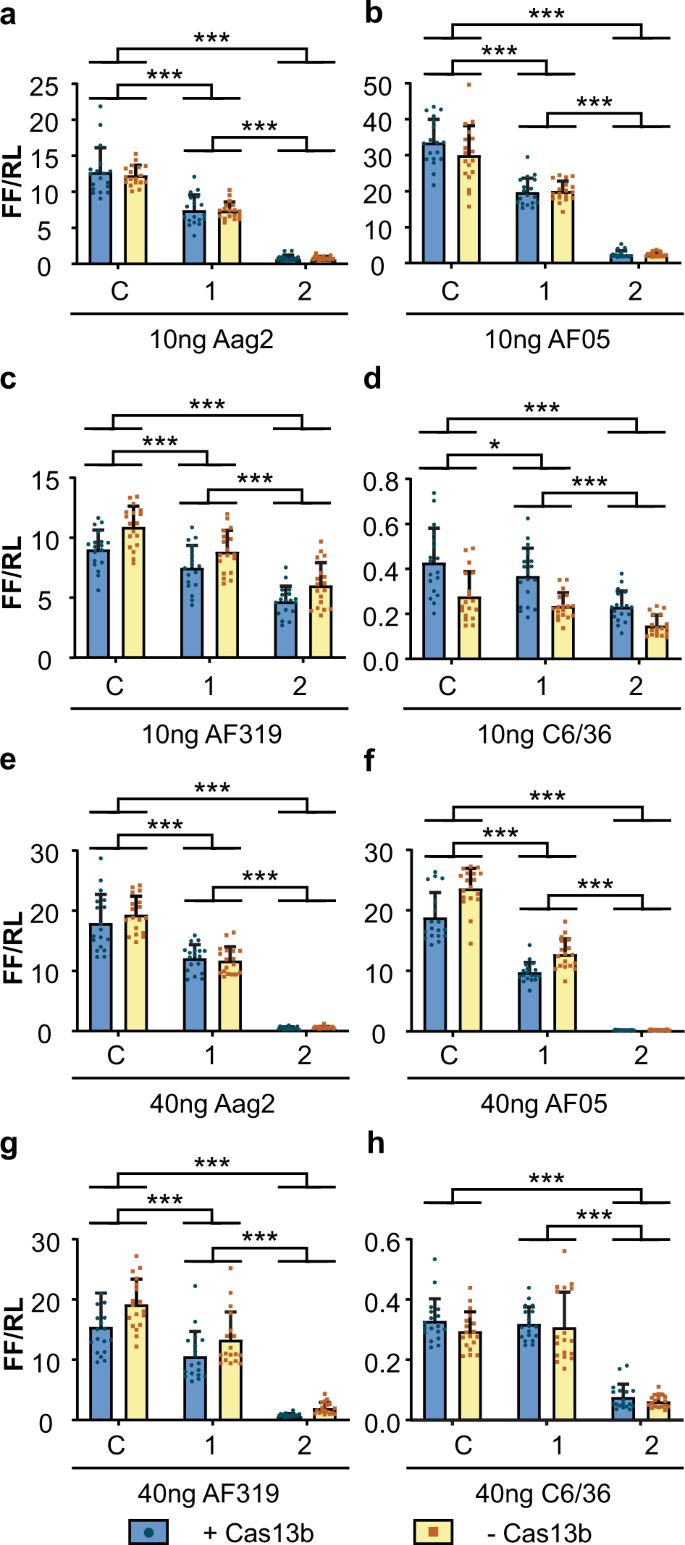
我们首先旨在使用转染的指导RNA确定Cas13b在不同的蚊子细胞系中是否起作用。设计了两个指导RNA,以靶向CHIKV nsP2编码区内具有不同预测RNA结构的RNA序列(补充图 1,补充表 1和2)。指导是通过体外转录产生的。将表达包含CHIKV靶序列和萤火虫荧光素酶编码序列的报告RNA的质粒(pCHIKVLuc,补充图 2)共转染到Ae中。aegypti衍生的Aag2,AF05和AF319细胞以及Ae。白化病衍生的C6 / 36细胞与指导RNA和表达Cas13b的第二质粒(pCas13b,补充图 2和3,补充表 3)。AF05和AF319是Aag2细胞的克隆衍生物,其中AF319具有基因编辑的Dicer-2(Dcr2)21的敲除;C6 / 36也是DCR2缺陷22,23,24。每个转染均以两种不同的量(10和40 ng,补充表3)测试了每种指导RNA(指导1和指导2 )。
在Cas13b存在的情况下,相对于海肾荧光素酶对照,在所有Ae中,两个10 g和40 ng的向导(1和2)均降低了CHIKV-荧光素酶报告基因的表达。伊蚊细胞系(图 2A-C,E-G ,补充表 4 - 6)。在大江 除40 ng的指导1以外,没有观察到与对照的差异(图2d,h,补充表7), 白纹 C6 / 36细胞也有类似的作用 。在所有细胞类型中表达的减少更大的带导向2比引导件1(图 2,补充表格 4 - 7)。出乎意料的是,依赖指导的敲除与编码Cas13b的质粒的存在无关,因为当使用表达ZsGreen的质粒(pZsG,补充图2)代替Cas13b质粒(图2,补充)时,观察到类似的敲 除。 表 4 - 7)。
将Aag2(a,e),AF05(b,f),Dcr2基因敲除AF319(c,g)和C6 / 36(d,h)细胞与表达Cas13b(+ Cas13b)或ZsGreen(-Cas13b)的质粒共转染以及每孔10 ng(a–d)或40 ng(e – h)的体外转录指南。每个条形图表示萤火虫荧光素酶活性的平均值,将其标准化为海肾荧光素酶活性(FF / RL),该晶须是来自三个独立转染的标准差,每个转染有六个重复,每个点代表一个重复。线性混合模型,除h双向方差分析外,因为无法拟合模型。*** P <0.001,*P <0.05(补充表 4 - 7)。C:非目标控制指南(AmC3),1:指南1,2:指南2。
U6驱动的指南,部分依赖Cas13b的效果
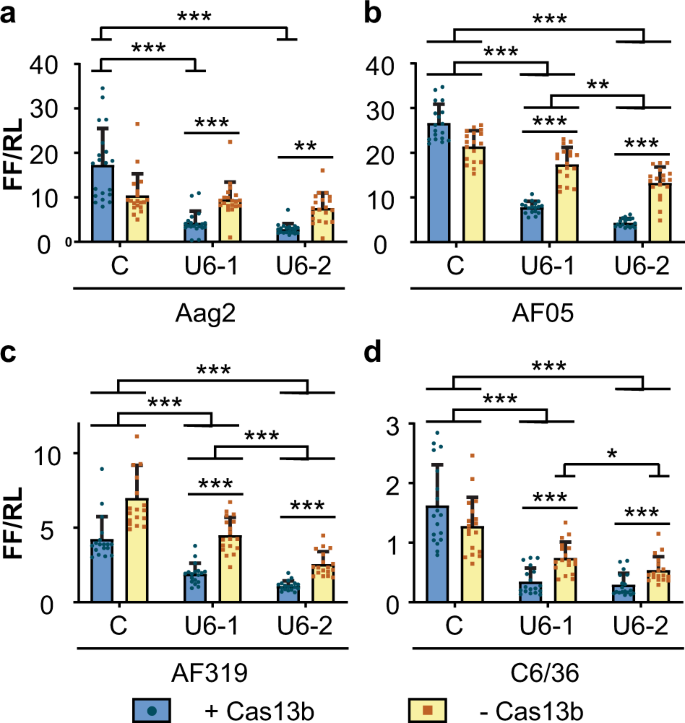
我们推测基因表达的Cas13b独立敲低可能是使用体外转录的指导RNA转染到细胞中的结果。为了测试RNA的来源是否影响对Cas13b的需求,我们在Ae的控制下表达了相同的指导RNA 。埃及埃及人 U6 RNA启动子(补充图 4,补充表 3)。在Aag2细胞中,U6启动子驱动的向导能够指导目标基因表达的Cas13b依赖性敲低。从两个指南中观察到了相似量的Cas13b依赖敲低(图 3a,补充表 8)。在拦截基因表达的其它蚊细胞系仅部分Cas13b依赖性的,由击倒的Cas13b存在而增强(图 3B-d ,补充表 9 - 11)。在这些细胞系Cas13b无关的报道基因表达敲低是与导向件2和在AF319和C6 / 36细胞中特别引人注目(图 3C-d ,补充表格 10 - 11)。根据各组的平均比率,报告子表达分别为36.7(SD ± 10.9)%和47.7(SD ± 与用非靶向对照指导RNA(AmC3,补充表2)转染的细胞相比,在Cas13b阴性AF319和C6 / 36细胞中,在指导2下分别观察到16.2)% 。
体外抑制CHIKV分裂复制系统
已经确定Cas13b可以通过报告系统下调RNA,我们有兴趣测试它是否能够影响病毒RNA的复制。由于在英国CHIKV直接工作需要大容量设备,我们采用了分体式复制系统19,20,其中,用于病毒RNA的复制所需的复制酶聚在供给反式。表达,其中所述结构蛋白是由一个nanoluciferase(Nluc)报告基因(pCHIKVRep1,补充图替换经修饰的病毒基因组中的质粒 2)中的共转染表达病毒复制酶蛋白(pCHIKVRep2,补充图质粒。 2),Cas13b(pCas13b)或ZsGreen(pZsG),萤火虫萤光素酶参考质粒(pHr5Fluc,补充图 2)和表达U6启动子驱动的指导RNA的质粒(补充图 5,补充表 3)。
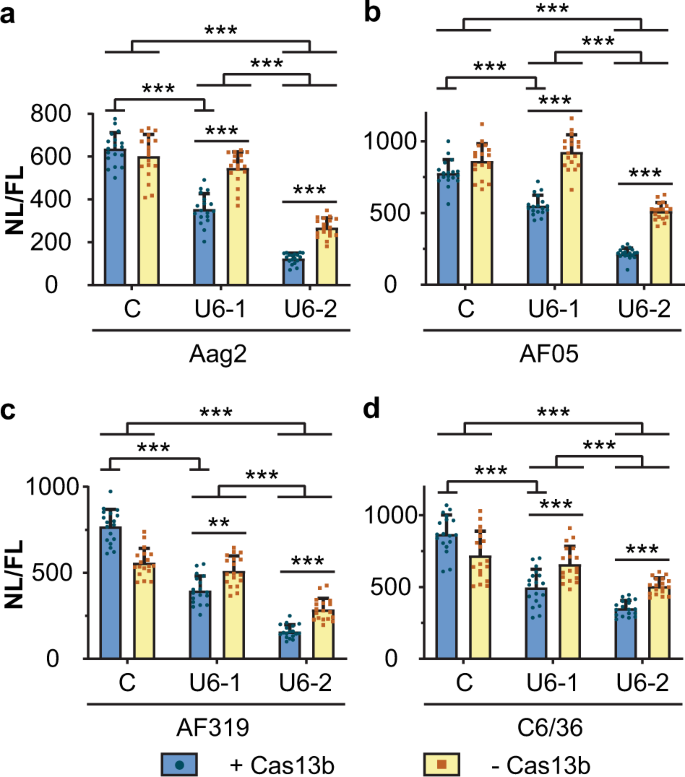
与使用U6启动子驱动的向导进行的非复制记者实验一致(图 3),Cas13b和任一向导的存在均显着降低了所有细胞类型中病毒复制系统中Nluc的表达(图 4,补充表 12 – 15)。对于指南1,敲除完全由Cas13b依赖性病毒RNA降解负责。所述Cas13b转染的细胞显示出在Nluc表达显著降(P < 0.001,图 4,补充表格 12 - 15)相比,非特异性导向的RNA控制,但没有Cas13b(ZsGreen的)对照没有(P > 0.05,图 4,补充表格 12 - 15)。
将 aAag2,b AF05,c Dcr2基因敲除AF319和d C6 / 36细胞与表达Cas13b(+ Cas13b)或ZsGreen(-Cas13b)和U6启动子驱动的RNA向导的质粒共转染,并使用纳米荧光素酶拆分复制系统在CHIKV亚基因组启动子的控制下,表达萤火虫荧光素酶的质粒作为转染效率的对照。每个条形图代表相对于萤火虫荧光素酶活性(NL / FL)标准化的纳米荧光素酶活性的平均值,晶须是来自三个独立转染的标准偏差,每个转染有六个重复,每个点代表一个重复。a,b,d线性混合效应模型c无法使用双向ANOVA作为模型。*** P <0.001,** P <0.01(补充表 12 – 15)。C:非目标控制指南(U6-AmC3),U6-1:指南1,U6-2:指南2。
同样与先前的实验一致,指南2导致病毒复制系统RNA水平的降低。指南2仅单独降低了Nluc表达(P < 0.001,图 4,补充表 12 – 15),并且通过添加Cas13b增强了这种效果(P < 0.001,图 4,补充表 12 – 15)。在所有细胞类型中。
使用多向导阵列抑制CHIKV报告基因
使用病毒RNA的序列特异性敲除技术的局限性在于,通过引导RNA靶位点的微小序列变化,病毒可能会逃脱。对于使用相对短的靶向RNA的系统,例如shRNA,miRNA和基于CRISPR / Cas的系统,这尤其成问题。该问题的潜在解决方案是在同一细胞内表达多个指导RNA,从而同时靶向靶RNA内的多个序列。在其天然原核上下文,Cas13b处理更长的RNA以产生导轨和已被证明能够在哺乳动物细胞中这样做的12,13 ; 因此,我们研究了我们的指导RNA是否在一系列指导中发挥作用。
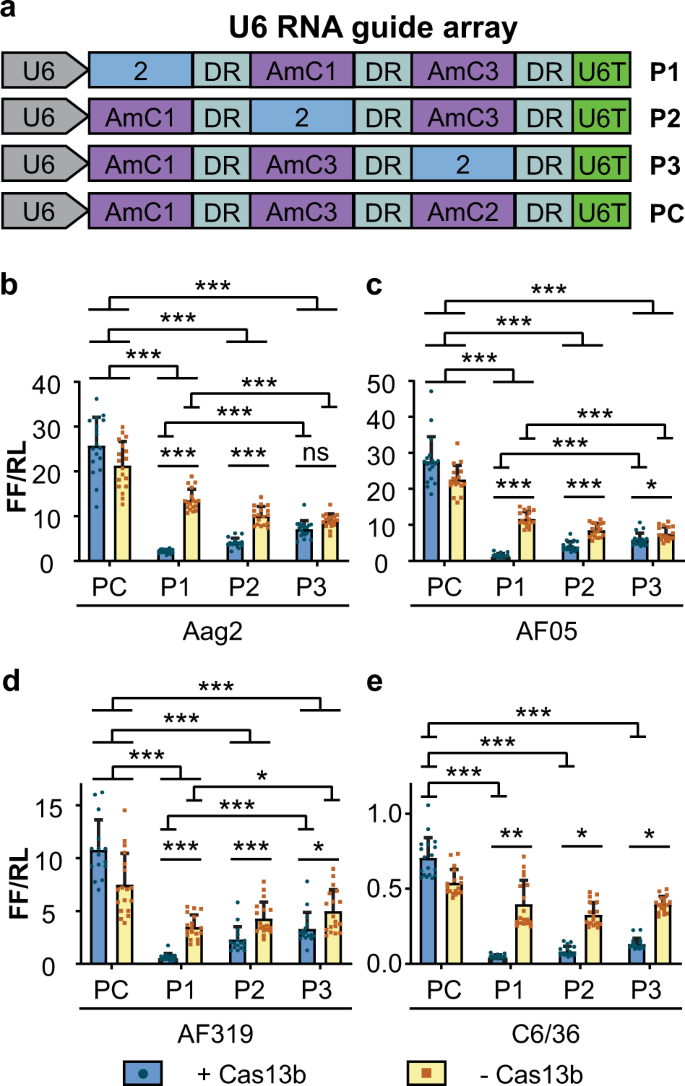
我们设计了具有三个引导位置的U6启动子驱动的引导阵列(图 5a)。每个阵列中的一个位置包含CHIKV靶向指南(指南2),而其他两个位置具有不包含报道分子的指南靶向序列(AmC1,AmC3,图 5a,补充表 2)。将表达每个阵列的质粒与表达Cas13b(pCas13b)或ZsGreen(pZsG)的质粒,CHIKV-荧光素酶报道质粒(pCHIKVLuc)和表达海肾荧光素酶的参考质粒共转染到蚊子细胞中(补充图 2)。,补充表 3)。
一个 pol III启动子用于测试的引导位置上的敲低效果(U6)驱动的RNA导向器阵列。构造P1,P2和P3分别在三位置阵列的位置1、2和3上具有主动导向(导向2),在其余位置具有针对缺少目标(AmCyan)的导向。使用所有位置都填充有非定向向导(AmC1,AmC2,AmC3)的模拟数组(PC)作为控件。b – e CHIKV荧光素酶报告基因对Aag2(b),AF05(c),Dcr2基因敲除AF319(d)和C6 / 36(e)细胞中U6启动子驱动的RNA阵列的干扰。每个柱形代表标准化为海肾的萤火虫荧光素酶活性的平均值荧光素酶活性(FF / RL);晶须是三个独立转染的标准偏差,每个独立转染有四到六个重复,每个点代表一个重复。b–d线性混合效应模型,e双向方差分析。*** P <0.001,** P <0.01,* P <0.05,NS:不显著(补充表 16 - 19)。DR:不变的RNA指导骨架,U6T:U6启动子终止子,P1:位置1,P2:位置2,P3:位置3。
(图中的所有细胞类型中检测到CHIKV萤光素酶报道的抑制Cas13b依赖性增强 5B-E ,补充表格 16 - 19)。与转染了表达ZsGreen的质粒的对照细胞相比,用Cas13b转染的Aag2细胞显示出更大的荧光素酶表达降低,其中向导2在阵列中的位置1或位置2,但在位置3时没有差异(图 5b,补充)表 16)。在所有其他细胞系(AF05,AF319,C6 / 36)引导2是在所有的三个阵列位置(图介导CHIKV萤光素酶报道的Cas13b依赖性敲低效果。 5C-E ,补充表格 17 -19)。在Aag2,AF05和AF319细胞中,敲低效果相比位置3(图中位置1更高 的5b-d ,补充表格 16 - 18),但在C6 / 36有一个在减少的尺寸没有显著差异和阵列中导向器2的位置(图 5e,补充表 19)。
与U6驱动单个引导实验与导向件2(图一致 3),我们也观察到Cas13b无关的敲低在Aag2,AF05和AF319细胞(图 5B-d ,补充表格 16 - 18)。当特定向导位于Aag2和AF05细胞中的位置3时,该位置比位置3的效果更好(图 5b–c,补充表 16 – 17),而检测到相反的位置(位置1低于位置3)在AF319细胞中(图 5d,补充表 18)。在C6 / 36细胞中未观察到Cas13b独立干扰(图 5e,补充表 19))。
讨论区
在这项研究中,我们已经证明,Cas13b RNA向导能够通过Cas13b介导的抑制增强作用以及意外地通过Cas13b独立的,序列特异性的RNA抑制作用来诱导蚊子中靶基因的敲低。这与在描述使用在哺乳动物和植物细胞Cas13b导的工作,其中RNA敲低完全依赖于Cas13b的存在12,17。我们假设该现象取决于向导和目标RNA之间的碱基对互补性,从而导致细胞RNA干扰(RNAi)系统识别和处理目标RNA。为了对此进行进一步研究,我们使用了两种Dcr2缺陷细胞系C6 / 36和AF319。在这些细胞系中观察到的仅指导性抑制与在Aag2和AF05细胞中观察到的相似。因此,我们得出的结论是,仅引导抑制基本上不依赖于Dcr2。
我们使用嵌合的CHIKV-荧光素酶报告基因评估Cas13b是否在蚊子细胞中起作用(图 1)。在这些实验中,相对于海肾荧光素酶对照,在Cas13b加抗CHIKV向导RNA或单独的向导的存在下,CHIKV荧光素酶报道基因的表达显着降低(图 3,补充图 4)。在双荧光素酶测定中萤火虫荧光素酶的这种敲低表明存在的萤火虫荧光素酶mRNA的量减少,如其他RNAi 25所示,这与Cas13b或导向RNA直接靶向CHIKV荧光素酶mRNA一致。
由于使用ZsGreen模拟控制质粒(pZsG),检测到Cas13b非依赖性作用。在植物和哺乳动物细胞以前的工作不能只靠导游报告的干扰12,17。在植物中,不使用Cas13b 17即可使用靶向向导,而在哺乳动物中,作者使用的是催化不活泼的dCas13b 12。我们推测与我们的结果的差异可能是由于所使用的细胞类型造成的,并且dCas13b可能结合并隔离了这些向导,因此这些向导对于内源性RNAi途径的可用性较小。dCas13酶结合向导和识别靶标的能力已在活细胞中可编程RNA编辑和RNA追踪中得到证实26,27,28。
Cas13b依赖性抑制的程度在不同的指南和给药方法之间有所不同。例如,转染体外转录的向导时,抑制作用似乎完全不依赖于Cas13b(图 2),而使用U6向导时,添加Cas13b通常会增强抑制作用。在一些实验中,与向导2相比,在没有Cas13b的情况下,单独的向导1并未显示出明显的抑制作用(图 4)。
指南之间观察到的差异可能是由于多种原因。基于RNAup 29的预测,该预测可以基于RNA结构开放能预测RNA的可及性,目标位点2比目标位点1更易访问(补充表 1)。Cas13活性还取决于周围目标部位30的碱基组成; Cas13b从普雷沃菌。据报道,喜欢开A丰富的基序裂解18,31。
在每种情况下都可能发生不依赖Cas13b的抑制作用,但在我们的较弱指导基因1的实验中并不总是能检测到一定程度。更令人惊讶的是,添加Cas13b并不能增加体外转录的指导基因的抑制作用。尽管在这些实验中向导1的抑制作用不是特别强,但可能与Cas13b无关的作用已达到饱和(图 2)。这强调了设计多个指南的重要性,也许可以通过生物信息学分析(例如RNA结构可及性)为依据,并在存在和不存在Cas13b的情况下测试每个指南的功效。
在我们的实验中观察到的与Cas13b无关的RNA抑制作用的可能解释是,引导RNA中的双链RNA区域被细胞RNAi系统识别。由于昆虫是本系统作为针对病毒的初级适应性反应与RNA基因组上严重依赖32,33,它是可能的昆虫细胞。将小高度结构化的RNA触发器与哺乳动物细胞更敏感。这与以下观察结果一致:将体外转录的引导物引入细胞质比刺激从核中RNA聚合酶III启动子转录引导物更能刺激Cas13b非依赖性敲低(图2和图 3)。),尽管在这些实验中制作的指南水平可能不相等。
预期在不表达Cas13b的细胞中观察到的序列特异性沉默,并且机制尚不清楚。Dcr2可能识别指导RNA骨架的茎环结构,并将其引导至Dcr2小干扰RNA途径。然而,由于Dcr2敲除的AF319细胞也显示出有限的Cas13b独立沉默,因此应考虑其他替代方法,例如将单链RNA向导直接加载到Ago1和Ago2上,这是RNA诱导沉默复合物(RISC)的催化成分34,35,36,37。即使在昆虫细胞中不存在Dcr2的情况下,被Cas13b识别的短而高度结构化的RNA也可能有效地加载到RISC复合体上。确实,据报道重组哺乳动物Ago2可以结合长达73 nt长的单链RNA 34。另一种解释可能是DCR2介导的小干扰RNA,DCR1介导的微RNA和不太已知的Piwi相互作用RNA通路,其中,这些途径之间的相互作用已经描述之间的可能的冗余21,38,39,40,41和组件后者的两种途径已经显示参与抗病毒反应,以及21,42,43,44,45。
尽管以前曾在人类和植物细胞中使用过U6驱动的向导26,但我们不确定从U6启动子表达Cas13b向导在昆虫细胞中是否有效。通常,U6 RNA保留在细胞核中,而Cas13b在细胞质中翻译,并可能在那里对抗病毒RNA。尽管这一理论的关注,我们与U6驱动导向的数据表明,Cas13b无关,Cas13b依赖性抑制可能与U6驱动的导向来实现(图 3 - 5)。这些数据还表明,pol III转录的U6 RNA 46典型的γ-单甲基帽没有阻止这些活性。
给定常设的遗传变异和突变,单个指导RNA不可能为大量人群的所有成员提供足够的敲低。这适用于蚊子基因,但更适用于RNA病毒,RNA病毒具有高突变率,并且具有逃逸突变体快速进化的潜力。因此,将指导RNA用于针对此类病毒的工程化难治性可能需要使用多个指导。Cas13b的吸引人的特征之一是,它可以使用嵌合的CHIKV-荧光素酶报道基因(图5)从更长的RNA 13(其已证实)加工其向导。 )。我们还评估了阵列中位置的影响。我们发现在三向导阵列中的第一,第二或第三位置使用定位向导会产生强烈的压制效果。但是,当我们将导板移至3'位置时,抑制效果有所降低。由于最高的5'位置将产生一个封闭的引导,而其他位置则不会,因此这进一步证明该封闭至少不会不利于抑制。对于在更多的3'位中的适度降低效力的一种可能的解释是,编码指导RNA骨架的序列包括四个连续的T核苷酸(补充表 1)。U6序列的Pol III转录终止于T的均聚物运行;已显示T 4可在哺乳动物细胞中提供部分终止作用47。因此,似乎有理由认为,从更多3'位置降低的有效性仅反映了在这些位置上引导件的合成减少。可能是可以对该序列进行突变以克服这一问题,这与使用Cas9指导RNA 48或使用的其他Cas13或指导组合相似。另一种可能性是Cas13b被认为从3其导向器阵列处理'至5' 13,49,50,这可能影响每个导向的相对利用率。
甲CHIKV分裂复制系统19,20是用来评估如果病毒复制的抑制可以实现(图 1)。在该系统中,病毒复制酶导致亚基因组启动子上的报告子在病毒来源的RNA上表达,复制酶的编码序列已从该RNA缺失。病毒复制酶的减少,例如通过靶向nsP2 mRNA编码序列,导致报告子活性的降低(图 4,补充图 5)。与嵌合CHIKV-荧光素酶(图3)相比,分裂复制系统(图4)观察到的靶标干扰程度要小一些 。 ),可能是由于在Cas13b干扰之前产生的功能齐全的复制复合物导致了报告基因的基础扩增。
拆分复制系统是CHIKV的模型;我们认为它复制了与Cas13b相关的元素,但细微的差异可能意味着对CHIKV本身的影响或影响的程度可能会大不相同。例如,复制酶RNA是由Pol II聚合酶在细胞核中产生的,而病毒RNA是由病毒编码的细胞质中的复制酶产生的。因此,特定于细胞核的作用可能显示出不同的活性。另一方面,用这种分裂复制系统鉴定的突变已被证明在引入复制病毒19时具有相似的作用。此外,Cas13b介导的RNA病毒的抑制已被证明在人类和植物细胞17,18。
我们在这里展示的是Cas13b可以用来抑制CHIKV分裂复制系统19,20。这和在其他物种中观察到的病毒抑制17,18表明Cas13b提供在蚊子的电势的方法来工程病毒耐火度。其它变体Cas13也是已知的,具有大致相若性能,但可能对于特定应用更有效的14,17。指导RNA本身具有抑制作用是有趣的,但不太可能降低其在工程耐火材料中的效用。Cas13提供了一种替代的方法来靶向病毒序列而不是基于RNAi的方法,先前已经显示对CHIKV,寨卡和登革病毒可能有效51,52,53,54。基于序列的方法具有特异性的优势,但是在靶向多种病毒,甚至是给定病毒的所有序列变体方面存在相应的困难,并且相应地,由于序列变体的出现,可能易于产生抗性。抗性进化的类似问题可能适用于使用单克隆抗体作为病毒抗性的基础55。解决此类问题的一种方法是通过多路复用-同时针对相同或不同病毒中的多个序列。Cas13b在相对容易的多重化方面具有一些优势,特别是在单个主转录本上处理来自紧密阵列的指导RNA的能力。我们通过在三元素阵列中的三个位置的每个位置放置一个主动向导来测试了这种潜力,并发现它在所有位置都有效(图 5),尽管在可能与之相关的更多3'位置中其有效性有所降低提前终止转录。综上所述,这些数据对于基于RNA定向Cas系统的蚊子中抗病毒效应子的未来发展非常令人鼓舞。
方法
质粒构建
通过修饰pGL3载体(Promega)以插入Hr5-ie1启动子来制备在杆状病毒Hr5-ie1启动子控制下表达萤火虫荧光素酶(Fluc)的AGG1186:pHr5Fluc(Genbank登录号MT119956,补充图2)。 图56是来自果蝇果醇脱氢酶(adh)基因57和Fluc编码区上游的Kozak共有序列58的内含子。总之,通过泛素融合将200 bp的CHIKV LR2006-OPY1菌株nsP2序列(ECSA基因型)添加到Fluc的5'端59以构建表达CHIKV- 荧光素酶报道基因的AGG1221:pCHIKVLuc(Genbank登录号MT119958;补充图 2)。
为了构建Cas13b表达质粒(AGG1328:pCas13b,Genbank登录号MT119959;补充图。 2),的PspCas13b序列普雷沃氏菌属。P5-125 12已针对Ae优化了密码子。aegypti,合成为两个片段(Twist Bioscience),并使用Q5高保真DNA聚合酶(New England BioLabs)通过组装PCR进行组装。将Cas13b克隆到含有氨苄青霉素抗性基因的载体中,以使Cas13b处于组成型Hr5-ie1启动子的控制之下。将T2A核糖体结巴插入Cas13b的3'端,以连接ZsYellow标记蛋白进行可视化。
合成在Hr5-ie1启动子的控制下表达ZsGreen荧光团的质粒(AGG1201:pZsG,Genbank登录号MT119955,补充图 2),作为pCas13b的模拟对照。
AGG1080:pRL-Opie2 海肾荧光素酶质粒(补充图 2)由M. Anderson 60提供,并用作参考质粒以标准化转染效率数据。
用引物2704和2705(Sigma-Aldrich;补充表 20)从AeU6-702(AGG1120)60扩增埃及伊蚊 U6-3 Pol III启动子。PspCas13b(Cas13b)12的CRISPR-RNA的非可变茎环主链,在每个末端均具有BsaI限制位点以允许插入不同的RNA引导序列,是通过使用引物2706和2707的组装PCR合成的(补充表 20) 。通过HiFi组件(New England BioLabs)将这两个PCR产物插入pJet1.2载体(Thermo Scientific)中,以构建质粒AGG1399,U6-向导载体(Genbank登录号MT119950;补充图 2)。)。将可变RNA指导序列的寡核苷酸(指南1的引物2712和2713,指南2的引物2714和2715;补充表 20)退火,然后插入BsaI线性化AGG1399中以构建不同的U6单指导质粒(AGG1879: U6-1,Genbank登录号MT119960,以及AGG1880:U6-2,Genbank登录号MT119961)。将AmCyan靶向指南(AmC3;补充表 2)设计为阴性对照,并克隆到相同的载体(引物2720和2721,AGG1881:U6-AmC3,Genbank登录号MT119962;补充表 20)中。
对于U6驱动的导向阵列,还设计了两个针对AmCyan的导向(AmC1和AmC2;补充表 2)。AmC1和AmC3用于CHIKV靶向指南2所没有占据的位置(图 5a)。带有指导AmC1,AmC2和AmC3的模拟数组(图 5a)作为对照(AGG1875:U6-PC; Genbank登录号MT119951)构建。将阵列与三个可变的RNA引导序列组装在一起,每个序列均跟随有不变的骨架,并组装到AGG1399载体中,从而使阵列的表达受U6-3启动子控制。将指南2插入AGG1876:U6-P1(Genbank登录号MT119954),AGG1877:U6-P2(Genbank登录号MT119953)和AGG1878:U6-P3(Genbank登录号MT119952)的位置1、2或3中。分别测试每个职位的活动。
对于CHIKV分裂复制系统,质粒育碧-P1234-CHIKV(pCHIKVRep2;补充图 2)和乌美-Fluc的-GLUC质粒先前已被描述19,20。通过分别用荧光团EGFP和Nluc代替Fluc和Gluc,从Ubi-Fluc-Gluc得到AGG1521:pCHIKVRep1(Genbank登录号MT119957;补充图 2)。
体外转录的RNA向导和阵列
CHIKV的nsP2区域是针对性的;它编码负责将病毒多蛋白加工成其功能成分的病毒蛋白酶。Mfold 61和RNAup 30预测了目标结构和可及性。尚未针对PspCas13b 12报道过用于靶标选择的核苷酸限制,原间隔子侧翼位点基序。Ae的RNA转录物中没有同源靶标。aegypti(AaegL3和AaegL5)和Ae。纹伊蚊(AaloF1)被发现62,63对每个设计RNA引导件。
通过使用Phusion高保真DNA聚合酶(New England BioLabs)(一种向导特异性的71-72 nt正向引物(10 nM; Sigma),通过PCR合成了PspCas13b的单个RNA向导的DNA模板(指导1,指南2和AmC3对照)。 -Aldrich)包含T7启动子,可变向导序列和不变的茎-环向导主链的前18 nt,如先前发布的12(分别用于向导1,向导2和AmC3对照的引物2430、2433和2946;补充表 20)和编码引导主链的36 nt反向互补引物(10 nM,Sigma-Aldrich)(引物2323,补充表 20))。分别使用MEGAscript T7转录试剂盒(Invitrogen)和MEGAclear转录清除试剂盒(Invitrogen)进行向导RNA的体外转录和后续纯化。
细胞培养
Aag2细胞(。阂伊蚊衍生,RRID:CVCL_Z617)和C6 / 36细胞(白纹伊蚊。衍生,RRID:CVCL_Z230),其具有一个截断DCR2不是功能性22,24,64被用于转染。e 伊蚊 DCR2 CRISPR敲除AF319细胞和K. Maringer,萨里大学,英国获得其单细胞来源的亲本细胞系AF05 21,44,65。通过COI扩增和测序鉴定所有细胞系。
所有细胞系均在28%的Leibovitz-15培养基(Gibco)中生长,该培养基中添加了10%的胎牛血清(Labtech),100 IU / ml的青霉素和100 µg / ml的链霉素(Gibco)和10%的胰胰葡萄糖酸肉汤(Gibco)。 C,无CO 2或湿度控制。
细胞转染
将细胞以5×10 5个细胞/ 孔的细胞密度接种到96孔微孔板(Nunc)中。当细胞达到70-80%汇合时,根据制造商的说明使用TransIT PRO试剂(Mirus Bio)进行转染。对于每个实验,进行了3次独立的转染,重复6-8次。在适用的情况下,将pRL-Opie2或pHr5FLuc(补充图 2)用作转染对照。优化用于转染的质粒和RNA混合物的量,以使总质量不超过250 ng。靶向靶向AmCyan的指导基因(不存在于报告RNA中的基因)被用作对照,以测试该效应的特异性,并使用表达荧光报告基因ZsGreen(pZsG;补充图2的质粒) )代替表达质粒的Cas13b(pCas13b,补充图 2),用)来确定观察到的敲除是否是Cas13b依赖性的,而不改变转染的DNA的总摩尔质量。转染混合物的具体细节在补充表3中列出 。转染前,将培养基替换为不补充的培养基。转染后将细胞在28°C下孵育3-5小时,然后将培养基替换为补充培养基。2天后收获细胞用于双荧光素酶测定。
萤光素酶测定
如先前所描述的60,在GloMax multi +板读数器(Promega)上用Dual-Luciferase Reporter Assay(Promega)进行萤光素酶测定。简而言之,在用无离子磷酸盐缓冲盐水(1x PBS)洗涤两次后,分别用30 µl 1x被动裂解缓冲液(Promega)裂解细胞,并在-80°C下进行一个冻融循环。根据制造商的说明制备萤光素酶测定试剂II(Promega)和Stop&glo试剂(Promega),并测量萤光素酶活性。
统计和可重复性
在使用pCHIKVLuc的实验中(补充图 2,补充表 3),萤火虫荧光素酶活性针对海肾荧光素酶活性进行了标准化,以校正每个孔中的转染效率(FF / RL)。在使用CHIKV拆分复制系统进行的实验中(补充图 2,补充表 3),将Nluc活性针对萤火虫荧光素酶活性(NL / FF)进行了标准化。使用R(版本3.6.1)分析FF / RL或NL / FF比,不包括未转染的孔。对于每个实验,进行三个独立的感染,重复六次。通过限制最大可能性拟合的线性混合效应模型优先用于研究Cas13b及其相关指导对所报道基因表达水平的影响。使用lme4程序包66中的lmer函数,并使用lmerTest程序包67计算t-使用Sattherthwaite逼近自由度进行测试。在每个实验中,对数据进行适当的转换以适应正态分布,并在适用的情况下针对每种细胞系和指导浓度分别运行模型。将Cas13b的存在和使用的指南设置为分类固定因素,将实验设置为随机因素。使用逐步删除非显着 变量(P > 0.05)来构建最终模型,其中所有变量均为显着(P <0.05)。检查残差的诊断图,以确保残差之间存在恒定方差,并且满足模型假设。在无法拟合模型的地方使用了双向ANOVA。Tukey的诚实重大差异测试(multcomp程序包68)用于事后分析。使用GraphPad Prism 8和Illustrator CS6(Adobe)绘制图形并进行排列。
报告摘要
与本文链接的《自然研究报告摘要》中提供了有关研究设计的更多信息 。
资料可用性
可以在Figshare的https://doi.org/10.6084/m9.figshare.c.4867740 69上获得支持该研究结果的数据。本研究中使用的质粒的序列数据已保存在Genbank中,登录号为MT119950至MT119962。
|
|