Toll样受体双作用激动剂是PBMC产生的细胞因子的有效诱导剂,可抑制人原代肝细胞中乙型肝炎病毒的产生
摘要
重组干扰素-α(IFN-α)治疗在功能上可治愈某些个体的慢性乙型肝炎病毒(HBV)感染并抑制病毒在体外感染的肝细胞中的复制。我们研究了由Toll样受体(TLR)2、7、8和9激动剂刺激的外周血单核细胞(PBMC)的条件培养基(CM)的抗病毒作用。我们发现PBMC的CM由双作用TLR7刺激/ 8(R848)和TLR2 / 7(CL413)激动剂比单作用TLR7(CL264)或TLR9刺激的PBMC中的CM更能有效抑制HBV感染的原代人肝细胞(PHH)的HBe和HBs抗原分泌(CpG-B)激动剂。PHH对HBV的抑制作用与PBMC产生的IFN-α的数量无关,但它是多种分泌细胞因子的复杂功能。更重要的是,我们发现,通过各种细胞因子库和机制有效抑制新鲜分离的PHH中HBV产生的CM并没有降低共价闭合环(ccc)DNA的水平。我们用基于HepG2-NTCP细胞和浆细胞样树突状细胞系GEN2.2的细胞培养模型证实了我们的数据。总的来说,我们的数据显示了双重作用的TLR激动剂诱导广泛的细胞因子库的重要性。多特异性TLR激动剂的开发为功能性HBV治愈提供了新的机会。我们的数据显示了双重作用的TLR激动剂诱导广泛的细胞因子库的重要性。多特异性TLR激动剂的开发为功能性HBV治愈提供了新的机会。我们的数据显示了双重作用的TLR激动剂诱导广泛的细胞因子库的重要性。多特异性TLR激动剂的开发为功能性HBV治愈提供了新的机会。
介绍
乙型肝炎病毒(HBV)的慢性感染是一个重大的公共卫生问题,全世界大约有2.5亿人受到影响。尽管弱先天免疫响应于HBV成人的约90%的透明HBV,据推测通过一种有效的CD8 + T细胞应答的诱导1,2,3。用核苷酸类似物治疗慢性乙型肝炎可抑制新的感染性病毒颗粒的形成,但不能消除肝细胞中稳定的共价闭合环状DNA(cccDNA)。聚乙二醇干扰素α(IFN-α)治疗可以被视为轻度至中度慢性乙型肝炎患者的替代疗法4。然而,除了在人慢性乙型肝炎小于8%导致不希望的副作用,IFN-α单一疗法导致功能治愈4,5,6,7。
细胞培养实验的结果表明,I型干扰素(IFN-I,IFN-α,β,ε,ω)和III型干扰素(IFN-III,IFN-λ1、2、3)直接影响HBV cccDNA通过表观遗传转录沉默8或通过降低其稳定性9,10,11。在HBV感染的肝细胞中,IFN-I诱导数百种IFN刺激基因(ISG),这些基因将HBV感染限制在不同水平12。IFN-α诱导抑制HBV进入细胞的可溶性因子13,蛋白激酶R(抑制HBV蛋白翻译14)和tetherin(阻止受感染的肝细胞释放HBV)15。大量体外细胞因子的并排比较显示,促炎细胞因子,例如肿瘤坏死因子α(TNF-α),白介素(IL)-1β和IL-6,在抑制作用方面与IFN一样有效HBV复制16,17,18。因此,无论是干扰素和促炎细胞因子控制HBV复制和促进HBV治疗不同型号17,19。
缺乏疗效的抗乙肝病毒治疗的亮点不同的免疫调节剂的激动剂的潜在重要性和20,21,22,23,24。中识别在原代肝脏细胞表达的受体图案的激动剂25,即激动剂,因为它们的效力的吸引Toll样受体(TLR)的兴趣,以诱导在肝细胞和非实质细胞干扰素和促炎细胞因子和趋化因子23,24。此外,结果表明,GS-9620(vesatolimod),内体TLR7,其在浆细胞样树突细胞(pDC的)中优先表达的激动剂26,27,28,29,30而不是在原代肝细胞(PHH) 23,31,32,显著降低病毒血症和cccDNA的表达,并导致功能治愈的动物模型 20,21,22。最近的研究表明,TLR1 / 2和TLR3配体抑制了PHH中的HBV复制,并且相同的配体还诱导了外周血单核细胞(PBMC) 23中抗病毒细胞因子的产生。另一项研究表明,PHH中HBV复制的抑制作用可能是由受GS-9620刺激的PBMC的条件培养基(CM)介导的[ 24]。。由TLR7激动剂刺激的PBMC分泌的IFN-I被确定为抑制HBV产生而不降低cccDNA水平的主要物质24。
一些研究表明,不同的TLR激动剂或与其它免疫调节剂的单个TLR激动剂的组合强化免疫治疗效果33,34。然而,尚未阐明多特异性TLR激动剂(如最近开发的TLR2 / 7双作用激动剂CL413(Adilipolin),一种可共同激活细胞表面受体TLR2和内体受体TLR7 35的嵌合分子)对HBV感染的影响。 。在这里,我们比较了由双作用激动剂刺激的PBMC中CM的抗病毒作用与对单TLR激动剂刺激的PBMC中CM的抗病毒作用。我们发现,从CM刺激PBMC与TLR7 / 8(R848)和TLR2 / 7(CL413)的双重作用的激动剂是抑制肝炎的更有效的驱动ë与HBMC感染的PHH产生的S和s抗原(HBeAg和HBsAg)相比,由仅对TLR7(GS-9620,CL264)或TLR9(CpG-A,CpG-B)具有特异性的激动剂刺激的PBMC中的CM产生的抗原(HBeAg和HBsAg)。PHH对HBV的抑制与PBMC产生的IFN-α的水平无关,但它是多种分泌细胞因子的复杂功能。我们解决了一个问题,即通过不同的细胞因子库有效抑制PHH中HBV产生的CM是否也会降低cccDNA水平。
结果
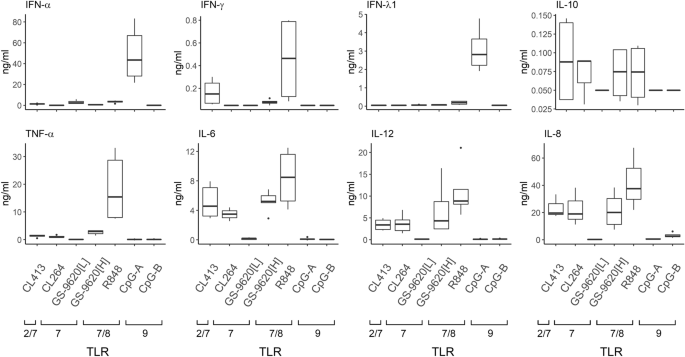
TLR激动剂在诱导PBMC分泌的细胞因子中的差异效力。首先,我们确定了由TLR7的不同激动剂(CL264-CM,GS-9620 [L] -CM(50 nM)),TLR7 //刺激的PBMC上清液(条件培养基,CM)中分泌的所选细胞因子的水平。 8(R848-CM,GS-9620 [H] -CM(10 µM)),TLR9(CpG-A-CM,CpG-B-CM)和TLR2 / 7双激动剂(CL413-CM)(图 1),线性图,补充图S1,对数图)。使用了两种浓度的GS-9620:在低浓度(GS-9620 [L],50 nM)下,其对TLR7的激活对TLR8的选择性较高36,而更高的浓度(GS-9620 [H],10 µM)则引发TLR7和TLR8联合刺激。在CM中存在的细胞因子中,我们量化了先前显示的调节HBV复制的细胞因子,包括I型,II型和III型IFN(IFN-α,γ,λ)。促炎细胞因子TNF-α,IL-6和IL-12;趋化因子IL-8;和调节性细胞因子IL-10 8,9,10,11,13,14,15。CpG-A主要诱导IFN-α和IFN-λ1,而R848主要诱导促炎细胞因子IFN-γ,TNF-α,IL-6,IL-8和IL-12。CL264-CM,GS-9620 [H] -CM和CL413-CM也可显着刺激IL-6,IL-8和IL-12。后者的激动剂也刺激了抗炎细胞因子IL-10的产生。然后,我们通过动态磷酸流式细胞术测定了暴露于不同TLR激动剂1小时的PBMC中NF-ĸBp65亚基的磷酸化(补充图S2)37。在此时间间隔内刺激不足以产生细胞因子,导致暴露于双作用激动剂R848(20.3%),CL413(20.8%)和GS-9620 [H](6.3%)的PBMC中p65NF-ĸB的磷酸化)。相反,单作用激动剂GS-9620 [L](0.6%)和CpG-A(0.6%)不会诱导NF-ĸBp65磷酸化。总之,受不同的TLR2 / 7,TLR7,TLR7 / 8和TLR9激动剂刺激的PBMC产生了I型,II型和III型IFN和促炎性细胞因子的广泛而可变的库。
由不同TLR2 / 7,TLR7,TLR7 / 8和TLR9激动剂刺激的PBMC分泌的细胞因子。用TLR2 / 7双激动剂CL413(5 µg / ml),TLR7激动剂CL264(5 µg / ml)和GS-9620 [L](50 nM),TLR7 / 8刺激PBMC(N> 3)激动剂GS-9620 [H](10 µM)和R848(4 µg / ml),以及TLR9激动剂CpG-A(4 µg / ml)或CpG-B(4 µg / ml)持续16 h,以及细胞因子通过ELISA确定水平。数据显示为中位数和四分位间距。对数图见补充图S1。
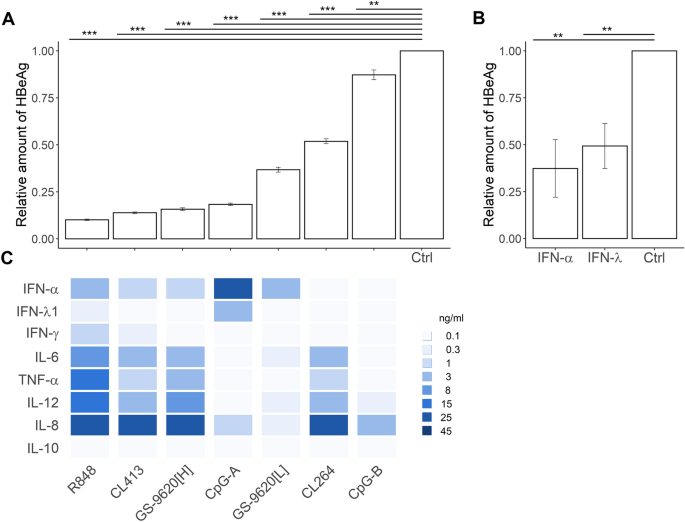
通过用TLR2 / 7,TLR7,TLR7 / 8和TLR9激动剂刺激的PBMC暴露于CM,可抑制感染的PHH中的HBV产生。我们检查了CM的从PBMC中与TLR2 / 7,TLR7,TLR7 / 8和TLR9的不同激动剂刺激对HBeAg的作用(图 2 A)和HBsAg(补充图。S3)的生产从PHH感染HBV的3至9感染后(DPI)天。PBMC CM均不影响PHH生存力(补充表S1)。CM显着抑制了R848刺激的PBMC中HBeAg的产生(降低了89%,p = 5.70e-09),CL413(降低了85%,p = 5.70e-09),CpG-A(降低了80%,p = 5.70e−09),GS-9620 [H](降低83%,p = 5.70e−09),GS9620 [L](降低59%,p = 5.70e−09),CL264(降低42%,p = 5.70e−09),CpG-B(降低9%,p = 2.24e -03)(图 2 A,对于重要性的补充表S2)和重组IFN-α-2a和IFN-λ3(图 2 B)。与GS-9620 [L] -CM相比,R848-CM,CL413-CM和GS-9620 [H] -CM对HBeAg的抑制作用明显更高(图 2)。C)。值得注意的是,与GS相比,GS-9620 [H] -CM对HBeAg的抑制作用明显更高,其中所含的IFN-α量较少,但促炎细胞因子IL-6,TNF-α和IL-12的水平较高-9620 [L] -CM。在IFN和促炎细胞因子的可变库中,IFN-α和IFN-λ1的水平以及所测试的促炎细胞因子和趋化因子的水平-IFN-γ,TNF-α,IL-6,IL-8和IL-12 —评估的所有激动剂之间的相关性(R≥0.7)(补充表S3)。更重要的是,HBeAg水平与IFN-γ,TNF-α,IL-6,IL-8和IL-12的含量呈负相关(R≥0.7)。两者合计,对HBeAg产生的分析表明,当PBMC产生其他抗病毒细胞因子如IL-6,TNF-α和IFN-γ时,抑制水平与分泌的IFN-α数量无关。我们的数据支持一种模型,其中不是单个细胞因子而是多种PBMC分泌的细胞因子的复杂功能与PHH中CM介导的HBV抑制有关。
用PBMC CM处理的HBV感染的PHH对HBeAg的抑制作用。(A)总共65,000 PHH被每个细胞500个病毒基因组当量(VGE)的HBV感染,并培养3天,然后加入条件培养基(CM,1:10稀释)。CM衍生自TLR2 / 7(CL413),TLR7(CL264,GS-9620 [L]),TLR7 / 8,(R848,GS-9620 [H])激动剂刺激的每毫升3×10 6个 PBMC。 TLR9(CpG-A,CpG-B)进行16小时。感染后6天(DPI)再次添加CM。通过ELISA 9 DPI测定HBeAg的产生,并在不存在CM的情况下,通过HBV感染的PHH将其标准化。HBeAg数据显示为来自三个供体(N = 3)的五个PHH独立实验的平均值±SEM。** p <0.01,*** p <0.001成对的Wilcoxon检验。Kruskal–Wallis p <2.2×e -16。(B)用1,000 IU / ml重组IFN-α-2a或IFN-λ3处理的HBV感染的PHH。数据显示为来自两个供体(N = 2)的PHH的三个独立实验的平均值±SEM。** p <0.01,Mann–Whitney–Wilcoxon成对检验,通过Benjamini–Hochberg(BH)方法调整p值。(C)将刺激的PBMC中CM中的细胞因子数量绘制为代表图1中值的热图 。
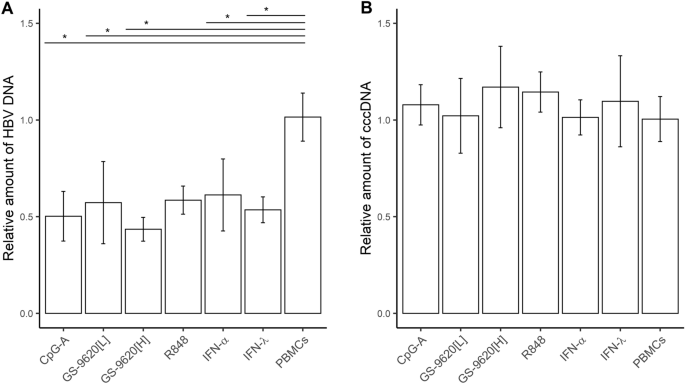
从TLR2 / 7,TLR7,TLR7 / 8和TLR9激动剂刺激的PBMC中,CM减少了被HBV感染的PHH中的总HBV DNA,而不是cccDNA。用CpG-A-CM,GS-9620 [L] -CM,GS-9620 [H] -CM或R848-CM治疗新鲜分离的HBV感染的PHH,或用1,000 IU重组IFN-α或IFN-λ治疗导致细胞内HBV DNA水平降低约50%(图 3 A)。使用特异性cccDNA引物通过qPCR在来自三个PHH供体的相同DNA样品中未检测到cccDNA降低(Kruskal–Wallis p = 0.443)(图 3)B)。此外,我们使用qPCR评估了TLR双重激动剂诱导的R848-CM和GS-9620 [H] -CM对来自一位供体的PHH中HBV cccDNA的影响。但是,由这些双重TLR激动剂刺激的PBMC中的CM也没有降低cccDNA水平。此外,我们使用了液滴数字(dd)PCR验证了GS-9620 [H] -CM或R848-CM和CL413-CM等TLR双激动剂对cccDNA的作用,并评估了cccDNA样品的制备质量(补充表S4)。ddPCR获得的数据证实了T5核酸外切酶处理和cccDNA特异性引物选择的重要性。总体而言,我们的结果表明,在我们的体外PHH培养系统中,没有选择的TLR激动剂能降低cccDNA。
由TLR激动剂刺激的PBMC通过CM减少HBV感染的PHH中的总HBV DNA(A),而不减少cccDNA(B)。PHH被HBV感染并培养3天,然后添加CpG-A-CM,GS-9620 [L] -CM,GS-9620 [H] -CM或R848-CM(按1:10稀释)或1,000 IU IFN-α或IFN-λ。CM再次添加了6 DPI。细胞再培养3天,并通过qPCR确定总HBV DNA和cccDNA的量。数据显示为CpG-A-CM,GS-9620 [L] -CM的来自三个供体(N = 3)的PHH和GS-9620 [H的来自一个供体(N = 1)的PHH的平均值±SEM ] -CM,R848-CM(两个生物学重复)* p <0.05 ,邓恩氏检验,p值通过本杰米尼-霍奇伯格(BH)方法进行调整。
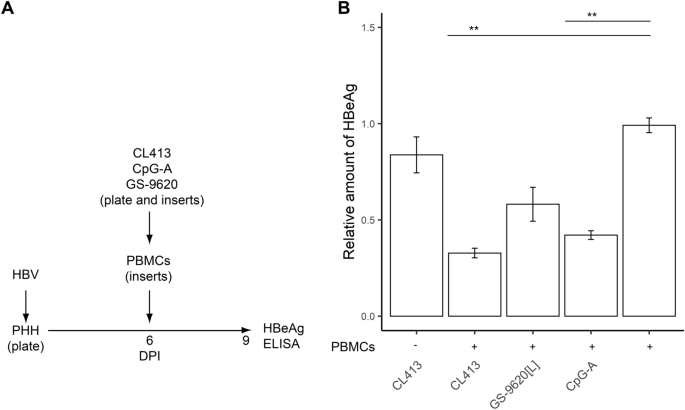
与受刺激的PBMC共培养可抑制PHH产生HBV。为了测试从TLR2 / 7,TLR7或TLR9激动剂刺激的PBMC连续产生细胞因子是否比从感染细胞中两次添加CM更强烈地抑制HBV感染的PHH产生的HBeAg,我们共培养了TLR激动剂刺激的PBMC在6–9 DPI的Transwell系统中感染HBV感染的PHH(图 4 A)。我们发现,与TLR2 / 7(CL413),TLR7(GS-9620 [L])或TLR9(CpG-A)激动剂刺激的PBMC共培养对HBV感染的PHH中的HBeAg的抑制作用与经过两次乘以CM(图 4B)。在任何情况下,抑制均不超过70%,并且CL413是抗病毒应答比CpG-A或GS-9620 [L]更有效的诱导剂。先前的研究发现,几种TLR激动剂既可以直接通过PHR中的TLR激活,也可以通过暴露于受刺激的先天免疫细胞CM间接抑制HBV复制23。因此,我们测试了TLR2 / 7双激动剂CL413是否可以抑制HBV复制而没有PBMC分泌的细胞因子的间接作用(图 4)。B)。但是,在缺乏PBMC的情况下,CL413虽然显示出促炎细胞因子IL-6(275 pg / ml),TNF-α(84 pg / ml)和趋化因子IL-8(987 pg)的产生,但未显示任何抗病毒活性。 / ml)感染HBV的PHH。与在HBV感染的细胞中添加CM的情况一样,在Transwell系统中将TLR激动剂刺激的PBMC与HBV感染的PHH共培养不会导致cccDNA降解(数据未显示)。
通过与TLR2 / 7,TLR7或TLR9激动剂刺激的PBMC共培养,抑制从HBV感染的PHH产生HBeAg。(一)实验流程图。PHH被HBV感染并培养6天,然后在Transwell插入片段中插入含有TLR2 / 7激动剂CL413(5 µg / ml),TLR9激动剂CpG-A(4 µg / ml)或TLR7激动剂GS-刺激的PBMC。加入9620 [L](50nM)。(B)将HBeAg的产生标准化为与未刺激的PBMC共培养的HBV感染的PHH细胞的产生。同时,在没有PBMC的情况下,将感染HBV的PHH培养物暴露于CL413。数据显示为来自两个供体(N = 2)的三个PHH生物学重复实验的平均值±SEM。** p <0.01,Mann–Whitney–Wilcoxon成对检验,p 通过BH方法调整的值。
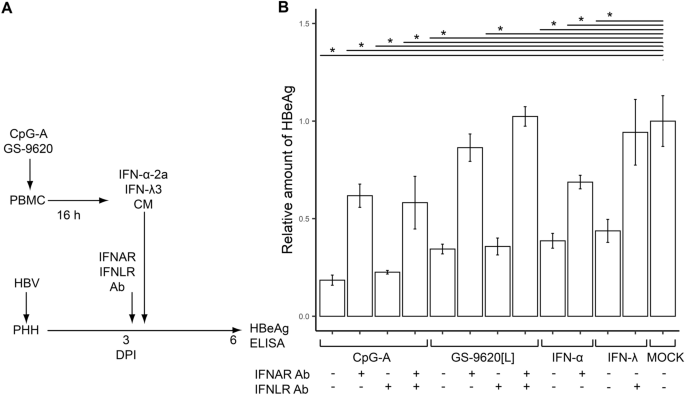
抗IFN-1受体单克隆抗体(IFNAR mAb)废除了CpG-A-CM或GS-9620 [L] -CM诱导的HBV感染PHH对HBeAg产生的抑制作用。随后,我们研究了pDC诱导的HBV感染PHH抑制HBeAg产生的机制。由于在HBV感染的PHH中HBeAg产生对IFN-α和IFN-λ的敏感性,我们检查了由I型和III型IFN受体,IFNAR和IFNLR介导的抑制作用的比例(图 5A)。为此,我们用针对IFNAR和IFNLR的mAb对HBV感染的PHH进行了预处理,并确定了将HBV感染的PHH暴露于CpG-A-CM或GS-9620 [L] -CM时产生的HBeAg水平(图 5)B)。尽管IFNAR mAb完全废除了GS-9620-CM的抑制作用,但仅废除了CpG-A-CM的抑制作用的40%。同时阻断IFNAR和IFNLR并不能显着提高对HBeAg产生的抑制作用。1,000 IU重组IFN-α2a(61.3%,p = 0.04)和IFN-λ3(56.2%,p = 0.04)也显着抑制了HBeAg的产生。
IFNAR mAb消除了CpG-A-CM或GS-9620 [L] -CM对HBV感染的PHH产生HBeAg的抑制作用。(一)实验流程图。将感染HBV的PHH以3 DPI的浓度暴露于5 µg / ml的IFNAR mAb,IFNLR mAb或对照同种型mAb。重组IFN-α-2a或IFN-λ3(1,000 IU / ml)用作对照。通过ELISA 6 DPI测定HBeAg的产生。(B)将HBeAg的产生归一化为由CM处理的HBV感染的PHH的产生,所述PHH是由ELISA 6 DPI测定的未刺激的PBMCs产生的。数据显示为来自一个供体(N = 1)的PHH的三个独立实验的平均值±SEM。* p <0.05,Mann–Whitney–Wilcoxon成对检验,p值通过BH方法调整。
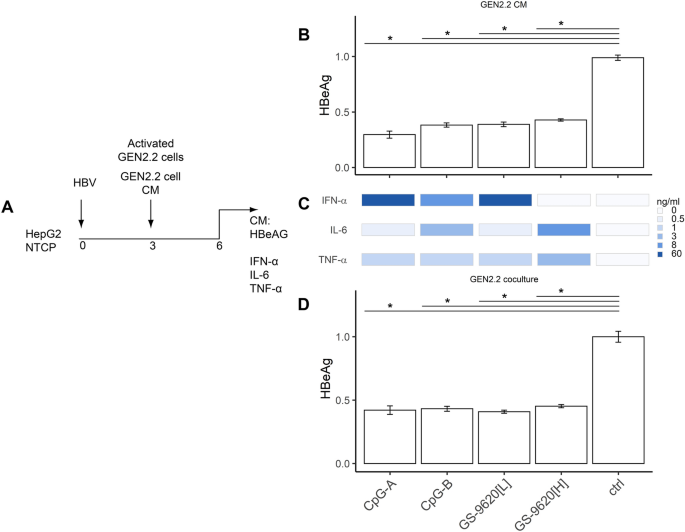
刺激的GEN2.2 pDC对HBV感染的HepG2-NTCP细胞显示抗病毒活性。我们接下来比较了抗病毒的CM从对病毒生产刺激的PBMC在PHH作用(图 2与在模型包括GEN2.2的pDC和HBV-感染的HepG2-NTCP肝细胞)26,38,39(图 6 A) 。为了方便4天持久共培养,这仍然是困难的罕见和体外短期居住的人原代pDC的执行,我们在人pDC系GEN2.2,进行我们的研究,其中的许多功能与人类主要的pDCs 26,39,40。通过用CpG-A(67%),CpG-B(59%),GS9620 [L](55)刺激的GEN2.2细胞暴露于CM,显着抑制了HBV感染的HepG2-NTCP肝细胞产生HBeAg。 %)和GS-9620 [H](降低53%)(图 6 B)。将刺激的GEN2.2细胞产生的CM的抗病毒作用与GEN2.2和HepG2-NTCP细胞的直接共培养进行比较时,未观察到HBeAg产生的抑制作用有显着差异(图 6 C)。尽管CpG-A(50 ng / mlIFN-α),CpG-B(4 ng / mlIFN-α),GS-9620 [L](50 ng / mlIFN-α)诱导的库和细胞因子水平不同),即GS-9620 [H](<50 pg / mlIFN-α)(图 6D),所有这三种激动剂均相似地抑制HBeAg(约65%)(图 6 B,C)。
刺激的GEN2.2 pDC对HBV感染的HepG2-NTCP细胞的抗病毒活性。(一)实验流程图。总共60,000 HepG2-NTCP细胞被每细胞HBV 2000 VGE感染,并培养3天,然后用CpG-A(4 µg / ml),CpG-B(4 µg / ml)刺激的GEN2.2细胞产生CM。 ,或添加GS-9620 [L或H](50 nM或10 µM)(B)。通过ELISA 6 DPI测定CM中的IFN-α,IL-6和TNF-α(D)水平。将感染HBV的HepG2-NTCP细胞与100,000个刺激的GEN2.2细胞共培养(C)。在不存在pDC的情况下,将HBeAg的产生归因于HBV感染的HepG2-NTCP细胞的产生。数据显示为来自三个独立实验的平均值±SEM。* p <0.05,Mann–Whitney–Wilcoxon成对检验,通过BH方法调整p值。
讨论区
在这项研究中,我们调查了PBMCs的CM的抗病毒作用,该PBMCs用一组内体定位的TLRs激动剂刺激。我们的结果表明,能够激活多个TLR的合成TLR激动剂比单个TLR靶向激动剂能诱导更广泛的促炎细胞因子谱,并且是更有效的HBV抑制驱动因子。双作用TLR激动剂R848 41,CL413 35和GS-9620 [H] 36是HBV抑制作用得分最高的诱导剂。在这些实验中,统计学意义是一个主要问题,这些实验是在3个供体的新鲜PHH中进行的,每个供体均进行了5次生物学重复测试。所选的TLR配体均未降低HBV感染细胞中cccDNA的水平。先前的发现表明,尽管在较高的R848浓度下TLR8比TLR7更有效地被诱导,但人类TLR7和TLR8都可以独立识别R848 41。低浓度的GS-9620 [L]与TLR8相比,对TLR7的激活具有约30倍的选择性,而对其他人类TLR则没有可检测的活性36。然而,GS-9620在较高浓度下会引发TLR7和TLR8的联合刺激36。如在PBMC亚群TLR7表达主要局限于pDC的26,27,28,29,30,42和TLR8在骨髓DC和单核细胞中表达43,44,我们推测,低浓度的GS-9620 [L](50 nM)优先介导pDC分泌IFN-α,而高浓度的GS-9620 [H](10 µM)优先刺激经典髓样DC和CD14 +单核细胞分泌炎性细胞因子。
另一种双重作用的激动剂CL413也诱导IFN-1和促炎细胞因子。我们测试了CL413的活性,以分析对PHH中TLR2刺激的直接作用和对PBMC中TLR7刺激的间接作用。CL413并未在表达TLR2的PHH中引起对HBV复制的直接抑制作用。因此,其抗病毒作用可能是通过触发PBMC中的TLR2和TLR7间接赋予的。CD14 +单核细胞中细胞质TLR2和内体定位的TLR7的表达允许在单细胞水平上触发两种信号通路44。相反,在未表达TLR2的pDC中,CL413仅可以激活TLR7信号。最近,双功能激动剂Riboxxol通过IFN或NF-κB途径触发TLR2 / 3介导的信号传导,被证明可以有效,直接地抑制HBV感染的PHH 23中的 HBV复制。与双作用激动剂相反,PBMC中诱导的TLR7(CL264)或TLR9(CpG-B)单作用配体只有中等水平的促炎细胞因子,而没有检测到IFN-I,CL264-CM和CpG-B-CM与不良的HBeAg抑制作用有关。双作用激动剂在PBMC中诱导的促炎性细胞因子的强劲产生与p65NF-κB磷酸化水平升高有关。
为了诱导大量可变范围的细胞因子,我们刺激的PBMC与激动剂比在以前的研究中使用的较大的频谱23,24。我们的结果表明,在HBV感染的PHH中抑制HBeAg和HBsAg的产生与PBMC分泌的IFN-α的数量无关,而是多种分泌细胞因子的复杂功能。我们发现了CpG-A-激活的PBMC产生更多的IFN-I和IFN-III比那些具有GS-9620 [L],其已经在广泛的测试刺激以前HBV抑制有关的研究20,21,22,23,24。与先前的发现一致,即IFN-I是负责抑制PHH中HBV产生的PBMC CM的主要成分,与GS-9620相比,CpG-A-CM更有效地抑制了HBeAg和HBsAg的分泌[L]。然而,与GS-9620 [L]相比,更高浓度的GS-9620 [H](10 µM)在PBMC中诱导了更广谱的促炎细胞因子,但IFN-I的含量却较低。抑制HBeAg和HBsAg。R848还诱导了非常广泛的促炎细胞因子,其抗病毒作用与GS-9620相似[H]。重组IFN-α-2a和IFN-λ3的抑制活性相对较低(50%至60%),进一步突出了细胞因子复杂性在抑制HBV产生中的重要性。基于单抗对IFNAR的阻断作用,Lucifora等人(2002年)提出。23结论认为,PHH中TLR1 / 2和TLR3激活的抗病毒作用不是由于I型IFN和IL-6产生。相关分析表明,除IFN-α外,促炎细胞因子IL-6,TNF-α和IL-12以及趋化因子IL-8和IFN-γ是抗HBV抑制活性的主要贡献者。一个统计模型可能需要破译抑制感染的肝细胞产生HBV所必需的特定细胞因子组合,因此需要对CM的影响或重组细胞因子的人工排列进行额外的测量。
虽然R848-CM,CL-413-CM,了CpG-A-CM和GS-9620 [H] -CM实现两到四倍的HBeAg的更大的抑制比在以前的研究中使用GS-9620 [L] -CM观察到23,24,没有导致新鲜分离的PHH中cccDNA水平降低。这与最近的发现相吻合,后者表明GS-9620 [L] -CM在不诱导APOBEC3A或Smc5 / 6复合物的情况下,并且在不降低cccDNA水平的情况下,强烈诱导各种IFN刺激的基因并抑制HBV感染的PHH中病毒的产生24。cccDNA及其降解对于HBV治愈的重要性,使该分子成为HBV研究的中心。2012年的一项研究报道,IFN-α通过cccDNA结合的组蛋白的低乙酰化抑制cccDNA的转录,并降低STAT1和STAT2转录因子与HBV基因组中IFN刺激的反应元件的结合8。最近的研究表明,血清cccDNA可以在HBV感染的肝细胞的细胞病变的时尚IFN-α治疗期间下降9,10。
与由HBV感染的PHH产生相比,由HBV感染的肝癌细胞系HepG2-NTCP产生的HBeAg对IFN-α的敏感性低三到五倍。在CM或重组IFN-1的存在下,HepG2-NTCP细胞中HBeAg的残留产生没有被抑制低于35%。通过将感染了HBV的HepG2-NTCP细胞直接暴露于活化的GEN2.2细胞或其CM,在抑制HBV产生方面的微不足道的变化表明,在共培养过程中,可溶性因子而不是细胞与细胞之间的接触起着主要作用乙肝病毒生产的监管。
我们还研究了CpG-A-CM中存在的IFN-I和IFN-III是否在HBV抑制中协同作用,这可以解释CpG-A-CM与GS-9620 [L] -CM相比具有更大的抑制作用。出人意料的是,靶向IFNLR对HBeAg的分泌没有影响,只有IFNAR mAb可以部分废除CpG-A-CM的抑制作用。通过同时靶向IFNAR和IFNLR不能完全恢复这种抑制作用,这可能是由于对IFNAR的无效抑制所致。因此,我们不能得出结论,IFN-I是否是CpG-A-CM的主要抑制性驱动因子,或者其他细胞因子是否也起作用。阐明IFN-I信号在PHH中是否比IFN-III信号更重要。
具体并且在由内体TLR7,8黑猩猩和土拨鼠模型慢性乙型肝炎的延长抑制和9激动剂导致辨别由这些TLR配体引导学生抗病毒应答的机制的兴趣20,21,22。然而,GS-9620,这表明在动物模型中最好的抗病毒作用,临床研究没有揭示的HBsAg在可容忍的剂量治疗慢性乙型肝炎临床显著下降(两个一周剂量4毫克)45,46。此剂量相当于血浆中4.6 ng / ml的浓度,而我们的实验中使用了50 ng / ml的GS-9620 [L] 47。临床试验中常用的CpG ODN剂量为1.5–15μg/ kg,ODN的给药计划为每周至每月。在临床前研究中,每天向小鼠施用更高剂量的CpG ODN(2.5 mg / kg),而在我们的实验中使用4μg/ ml CpG-A或CpG-B 48。同样,CL413激动剂的剂量(5μg/ ml)在临床前研究中给予小鼠的剂量范围内(3μg/ g)49。为了阐明其功能,有必要进一步研究多特异性TLR激动剂的独特抗病毒潜力,这可能为开发新策略以实现持续的病毒清除和为乙型肝炎提供明确的治疗方法提供新的机会。
方法
肝细胞培养
HepG2-NTCP(人肝癌细胞系HepG2,已被人HBV输入受体-牛磺胆酸钠共转运多肽[hNTCP]稳定转染)获自德国海德堡海德堡大学医院的Stephan Urban博士。HepG2.2.15(HepG2细胞系,带有两个HBV基因组的头对尾二聚体[血清型ayw,基因型D; GenBank登录号:U95551.1])是从里昂癌症研究中心的David Durantel博士获得的,法国里昂。这些细胞系分别在补充了10%胎牛血清(FBS)和嘌呤霉素(0.05 mg / ml)或G418(0.4 mg / ml)的Dulbecco改良Eagle培养基中生长50。HepAD38细胞保存在Dulbecco改良的Eagle's培养基中,该培养基中添加了10%FBS和四环素(0.3 µg / ml)。如David等人所述,从肝脏切除物中分离出原代人肝细胞(PHH)。51。简而言之,首先用缺乏Ca 2+的汉克斯平衡盐溶液(HBSS)灌注肝活检,并补充0.5 mM EGTA(Merck)。然后,用补充有Ca 2+的 HBSS灌注肝组织碎片和0.05%胶原酶(Merck)。肝细胞悬液通过100 µm细胞过滤器(Corning)过滤,在4°C下以50×g离心3分钟,并用L-15培养基(Thermo Fischer Scientific)洗涤3次。通过锥虫蓝排除法估计细胞活力,并将细胞接种在胶原包被的板上。PHHs在补充有原代肝细胞维持补充剂试剂盒(Gibco)的Williams E Medium(Thermo Fisher Scientific)中维持。
PBMC和GEN2.2细胞系
分离PBMC并如前所述进行培养37,52。将GEN2.2细胞系与小鼠MS5细胞系一起在补充有10%FBS 40的 RPMI 1,640中培养。
抑制剂,抗体和试剂
CpG-A(ODN 2,216),CpG-B(ODN 2006),CL413(Adilipolin),CL267和R848获自InvivoGen(美国圣地亚哥),用于体外PBMC刺激测定,GS-9620是礼物来自Gilead Sciences。所有这些都以制造商推荐的浓度用于最佳体外刺激。从PBL获得重组IFN-α-2a和IFN-λ3。抗人干扰素λ受体1(IFNLR),克隆MMHLR-1,中和(MAb)来自PBL;抗IFN-α/β受体链2抗体,克隆MMHAR-2,MAB1155来自EMD Millipore。
乙肝病毒的制备
使用两种HepG2来源的细胞系生产和纯化HBV:2.2.15细胞系和AD38细胞系。感染性颗粒(Dane颗粒)通过6%PEG沉淀纯化并从收集的无细胞上清液中离心分离。
HepG2-NTCP细胞和PHH的HBV感染
在存在4%PEG8000和2.5%DMSO的情况下,将HepG2-NTCP细胞用HepG2.2.15衍生的HBV(每细胞2000病毒基因组当量)感染过夜。然后,将HepG2-NTCP细胞用PBS洗涤3次,并保存在补充有10%FBS和2.5%DMSO的Dulbecco's改良Eagle培养基中。在4%PEG8000存在的情况下,将PHHs感染HepAD38衍生的HBV(每个细胞500个病毒基因组当量)过夜。然后,将PHH用Williams E培养基(Thermo Fisher Scientific)洗涤3次,并维持在补充有原代肝细胞维持补充剂试剂盒(Gibco)和2%DMSO的Williams E培养基中。
ELISA检测HBsAg和HBeAg分泌
收集感染了HBV的HepG2-NTCP细胞或PHH的无细胞上清液,并以300× g离心 5分钟以除去细胞碎片,转移到干净的试管中,并在-80°C下保存直至进行抗原测量。HBsAg和HBeAg的效价使用商购的ELISA试剂盒(Bioneovan,北京,中国)根据制造商的说明进行测量。
体外GEN2.2和PBMC刺激
为了确定细胞因子的产生,用CpG-A(4 µg / ml),CpG-B(4 µg / ml)刺激PBMC(3×10 6细胞/ ml)或GEN2.2(1×10 6细胞/ ml)。 ,CL413(4 µg / ml),CL267(4 µg / ml),R848(4 µg / ml)和GS-9620(50 nM或10 µM)过夜。
HBV DNA和cccDNA的总定量
使用NucleoSpin组织试剂盒(Macherey–Nagel)从感染HBV的PHH中分离出总细胞DNA。通过定量PCR(qPCR),使用对HBV DNA特异的引物测定HBV总DNA水平:HBV-F,5'-AGAGGACTCTTGGACTCTCTGC-3'; HBV-R,5'-CTCCCAGTCTTTAAACAAACAGTC-3'; 和探针pHBV,5'-[FAM] TCAACGACCGACCTT [BHQ1] -3'。用gb Elite PCR Master Mix(Generi Biotech)和TaqMan探针进行qPCR。HBV DNA水平标准化为白蛋白(Alb-F,5'-GCTGTCATCTCTTGTGGGCTGT-3'; Alb-R,5'-AAACTCATGGGAGCTGCTGGTT-3';和Alb-probe,5'-[FAM] GGAGAGATTTGTGTGGGGGCATGACAGG [BHQ1]- 3′)。cccDNA定量方法如前所述50。简而言之,用10个单位的T5核酸外切酶处理1 µg DNA 2小时。然后,使用DNA Clean and Concentrator试剂盒(Zymo Research)纯化DNA。用gb Elite PCR Master Mix(Generi Biotech)和特异性cccDNA引物和探针进行qPCR。将cccDNA的水平标准化为未经T5核酸外切酶消化的样品中线粒体编码的细胞色素C氧化酶亚基II(MT-CO2)的表达。如先前所述使用cccDNA特异性引物和MC-CO2特异性引物24。使用QX200数字PCR发生器和QX200 Droplet Reader(均为Biorad)以及cccDNA特异性引物和探针进行ddPCR。通过比较T5处理的样品和未处理的样品,以及将cccDNA特异性引物与总HBV DNA引物(非特异性cccDNA引物)进行比较,可以确定T5处理和cccDNA引物的特异性。
IFNAR和IFNLAR的封锁
IFNAR被抗-IFN-α/β受体链2抗体(克隆MMHAR-2,MAB1155 EMD(Millipore))以5 µg / ml的浓度阻断。IFN-λ受体1被抗人类干扰素Lambda受体1阻断,克隆MMHLR-1(PBL)的浓度为5 µg / ml。来自鼠骨髓瘤克隆MOPC 21的小鼠IgG1对照和来自鼠骨髓瘤克隆UPC-10的小鼠IgG2a同种型对照用作同种型对照。
分泌细胞因子和趋化因子的测定
PBMC或GEN2.2产生的IFN-α,IFN-γ,IFN-λ1,TNF-α,IL-6,IL-12,IL-8和IL-10的总量在无细胞上清液中测量后使用人ELISA试剂盒(Mabtech)培养16至20小时。
统计分析
定量变量表示为平均值±平均值的标准误差(SEM)。由于数据的性质,进行了非参数测试。首先,应用Kruskal–Wallis,然后进行非参数事后成对多重比较Mann–Whitney–Wilcoxon检验,并通过Benjamini Hochberg方法(BH)调整p值。在图中描绘数据的情况下 3 ,用还进行唐恩的测试p由霍赫贝格的Benjamini方法(BH)值的调整。所有测试和图片均在R软件包中计算并绘制,图形在Adobe Photoshop CS中完成。一个p值≤0.05被认为是显著。
|
|